KEEFEKTIFAN PADI TRANSGENIK YANG MENGANDUNG
GEN cry UNTUK PENGELOLAAN HAMA PENGGEREK
BATANG PADI KUNING Scirpophaga incertulas (WALKER)
(LEPIDOPTERA: PYRALIDAE) PADA TAHAP IN VITRO
Abstrak
Penggerek batang padi merupakan salah satu hama utama pada pertanaman padi di Indonesia. Tanaman padi transgenik adalah salah satu cara alternatif untuk mengendalikan hama ini. Untuk mempelajari tingkat keefektifan
padi Rojolele transgenik terhadap hama penggerek batang padi kuning S.
incertulas penelitian tahap in vitro dilakukan di Laboratorium Biologi Molekuler Tanaman, Pusat Penelitian Bioteknologi-LIPI, Cibinong-Bogor pada bulan April 2008-Juli 2009. Penelitian dilakukan dengan menggunakan rancangan acak lengkap (RAL) dengan 10 perlakuan dan 20 ulangan. Perlakuan meliputi padi Rojolele transgenik: galur 4.2.3-28-15-2-7 dan 4.2.4-21-8-16-4 yang mengandung
fusi dua gen cry (cryIB-cryIAa), galur 3R9-8-28-26-2 dan 3R7-8-15-2-7 yang
mengandung gen mpi::cryIB, galur T9-6.11-420 yang mengandung gen cryIAb
melalui teknik penembakan, galur DTcry (Azygous) yaitu segregan yang
mengalami proses kultur jaringan dan tidak mengandung gen cry (null), dan galur
DTcry-13 yang mengandung gen cryIAb melalui Agrobacterium, serta tanaman
padi bukan transgenik yang meliputi varietas Rojolele, Cilosari, dan Ciherang. Hasil penelitian menunjukkan bahwa semua protoxin dalam galur padi Rojolele
transgenik mempunyai keefektifan yang tinggi dalam mematikan larva S.
incertulas dibandingkan dengan varietas padi bukan transgenik. Ada perbedaan keefektifan antar protoxin dalam galur padi Rojolele transgenik. Protoxin dalam
padi Rojolele transgenik galur T9-6.11-420 (cryIAb melalui teknik penembakan)
mempunyai keefektifan tertinggi (94%) dalam mematikan larva S. incertulas,
diikuti galur 4.2.4-21-8-16-4 (fusi) (89%) dan galur 3R7-8-15-2-7 (mpi) (78%).
Protoxin dalam padi Rojolele transgenik galur 4.2.3-28-15-2-7 (fusi) (74.5%) dan
galur 3R9-8-28-26-2 (mpi) (73.5%) mempunyai keefektifan sedang, sementara
protoxin dalam padi Rojolele transgenik galur DTcry-13 (cryIAb melalui
Agrobacterium) mempunyai keefektifan terendah (69.5%) dalam mematikan larva S. incertulas. Galur DTcry (Azygous) keefektifannya sama dengan varietas padi bukan transgenik (45%). Protoxin dalam padi Rojolele transgenik galur
T9-6.11-420 (cryIAb melalui teknik penembakan) dan galur 4.2.4-21-8-16-4 (fusi)
mempunyai kisaran keefektifan lebih panjang yaitu efektif mematikan larva S.
incertulas dari mulai instar-1 sampai instar-4. Semua protoxin dalam galur padi
Rojolele transgenik efektif dalam mematikan larva S. incertulas, namun
keefektifannya semakin menurun dengan bertambah lanjutnya perkembangan larva.
Abstract
Rice stemborer is one of the major pests on rice plant in Indonesia. Transgenic rice plant is an alternative to control this pest. To study the effectiveness of transgenic Rojolele rice to the rice yellow stemborer S. incertulas, in vitro test was conducted at laboratory of Molecular Biology, Research Centre for Biotechnology-Indonesian Institute of Science, Cibinong-Bogor from April 2008–July 2009. Completely randomize design with 10 treatments and 20 replications were used. The treatments were transgenic Rojolele rice: 4.2.3-28-15-2-7 and 4.2.4-21-8-16-4 lines containing fusion two cry genes (cryIB-cryIAa), 3R9-8-28-26-2 and 3R7-8-15-2-7 lines containing mpi::cryIB gene, T9-6.11-420 line containing cryIAb gene by particle bombardment, DTcry (Azygous) line is a segregate and does not contain cry gene (null), DTcry-13 line containing cryIAb gene by Agrobacterium, and non transgenic rice varieties i.e., Rojolele, Cilosari, and Ciherang. The result showed that protoxin in transgenic Rojolele rice lines were highly effective in increasing the mortality of S. incertulas larvae compared to non transgenic rice varieties. There were differences of effectiveness and activity among protoxin in transgenic Rojolele rice lines. Based on the effectiveness and activity, protoxin in T9-6.11-420 line was the highest (94%) followed by 4.2.4-21-8-16-4 line (89%) and 3R7-8-15-2-7 line (78%). Protoxin in transgenic Rojolele rice 4.2.3-28-15-2-7 line (74.5%) and 3R9-8-28-26-2 line (73.5%) were categorized as moderat and DTcry-13 line was the lowest (69.5%). DTcry (Azygous) line was as effective as non transgenic rice varieties (45%). Protoxin in transgenic Rojolele rice T9-6.11-420 line and 4.2.4-21-8-16-4 line had longest effectiveness range that were effective in increasing the mortality of first to fourth instar S. incertulas larvae. Protoxin in transgenic Rojolele rice lines were effective in increasing the mortality of S. incertulas larvae, but its effectiveness declined gradually along the development of larvae growth.
Key words: effectiveness, transgenic rice, S. incertulas Pendahuluan
Penggerek batang padi merupakan salah satu hama utama pada pertanaman padi di Indonesia. Berdasarkan luas serangan pada tahun 2006, hama penggerek batang padi menempati peringkat pertama yaitu seluas 112 950 ha. Peringkat ke-2 adalah hama tikus seluas 103 786 ha dan peringkat ke-3 adalah hama wereng coklat seluas 28 421 ha (DIRJENTAN PANGAN 2007).
Penggerek batang padi dapat menyerang semua stadium pertumbuhan
tanaman padi (Alam et al. 1998). Pada stadium vegetatif serangan menyebabkan
kematian anakan (tiller) muda yang disebut sundep (deadhearts), dan pada
stadium generatif serangan menyebabkan malai tampak putih dan hampa yang
Perakitan varietas padi tahan hama selama ini masih bertumpu pada metode konvensional yang mengandalkan persilangan antar tetua terseleksi. Dengan metode tersebut telah berhasil dirakit cukup banyak varietas tahan wereng
coklat (Satoto et al. 2003). Namun untuk penggerek batang padi belum ada
varietas padi yang memberikan tingkat ketahanan terhadap hama yang cukup (Wu et al. 1997; Bandong & Litsinger 2005).
Transformasi genetika tanaman merupakan alternatif yang diharapkan
dapat membantu memecahkan masalah yang sulit diatasi oleh teknik pemuliaan konvensional. Teknik transformasi genetika ini mempunyai keuntungan antara lain mampu mentransfer karakter baru dari plasma nutfah yang lebih luas, gen baru langsung ke kultivar target tanpa melalui banyak generasi persilangan, dan gen tertentu dapat ditransfer tanpa menyertakan banyak gen lain yang tidak dikehendaki (Conner 1997).
Transformasi genetika tanaman padi untuk ketahanan terhadap penggerek
batang padi telah dilakukan dengan menggunakan gen cry (Ghareyazie et al.
1997; Datta et al. 1998; Breitler et al. 2000), gen potato proteinase inhibitor II
(Duan et al. 1996), dan gen CpTi (cowpea trypsin inhibitor)(Xu et al. 1996).
Tanaman padi transgenik yang ditransformasi dengan gen cry terbukti
terlindungi dari serangan hama padi dari ordo lepidoptera. Ghareyazie et al.
(1997) melaporkan padi aromatik Tarom Molaii yang ditransformasi dengan gen
cryIAb sintetik menunjukkan tahan terhadap penggerek batang padi. Datta et al.
(1998) melaporkan 81 tanaman transgenik (kultivar CBII, IR64, dan padi tipe baru
IRRI) yang ditransformasi dengan gen cryIAb mampu mematikan larva penggerek
batang padi kuning S. incertulas sebesar 100%. Breitler et al. (2000) melaporkan
gen cryIB sintetik mampu melindungi padi Mediterranean (cvs. Senia dan Ariete)
dari serangan penggerek batang padi bergaris instar 2 sampai instar 4.
Introduksi gen potato proteinase inhibitor II dan gen CpTi (cowpea trypsin
inhibitor) pada tanaman padi juga mampu meningkatkan ketahanan terhadap
hama padi. Pada bioassay untuk ketahanan serangga dengan menggunakan
tanaman padi transgenik generasi ke-5 dengan gen potato proteinase inhibitor II
menunjukkan tanaman padi transgenik meningkatkan ketahanan terhadap hama
tanaman transgenik yang mengekspresikan trypsin inhibitor terlindungi dari
serangan hama penggerek batang padi bergaris C. suppressalis.
Di Indonesia, transformasi genetika untuk ketahanan terhadap penggerek
batang padi telah dilakukan dengan menggunakan gen cry pada padi varietas
Rojolele dengan teknik penembakan (Slamet-Loedin et al. 1998) dan melalui
Agrobacterium (cryIAb) (Rachmat 2006). Selain itu, untuk mendapatkan padi tahan penggerek batang padi yang mempunyai ketahanan panjang (tidak mudah
patah), telah dilakukan transformasi dua gen cry (cryIB-cryIAa) yang berbeda
binding site dalam sistem pencernaan larva serangga dan transformasi gen cryIB
dibawah kendali promoter terinduksi pelukaan yaitu promoter dari gen maize
proteinase inhibitor (mpi) (Rahmawati 2004).
Keberhasilan perakitan varietas tahan hama melalui transformasi genetika, pada tahap akhir ditentukan oleh keefektifannya terhadap hama sasaran. Penelitian ini bertujuan untuk mempelajari tingkat keefektifan padi Rojolele transgenik terhadap hama sasaran yaitu hama penggerek batang padi kuning S. incertulas pada tahap in vitro.
Bahan dan Metode Waktu dan Tempat
Penelitian dilakukan di Laboratorium Biologi Molekuler Tanaman, Pusat Penelitian Bioteknologi-LIPI, Cibinong-Bogor pada bulan April 2008-Juli 2009. Bahan dan Alat
Serangga uji yang digunakan dalam penelitian ini adalah penggerek batang
padi kuning S. incertulas. Imago S. incertulas diambil dari pertanaman padi di
Kecamatan Ciasem, Kabupaten Subang, Jawa Barat. Selanjutnya imago S.
incertulas dipelihara pada tanaman padi varietas Ciherang di rumah kaca Balai Besar Penelitian Tanaman Padi Sukamandi-Subang sampai bertelur. Kelompok telur yang dihasilkan selanjutnya diambil dan dimasukkan ke dalam tabung gelas untuk dipelihara sampai menetas menjadi larva instar-1. Larva instar-1 ini kemudian dipelihara pada tanaman padi varietas Ciherang sampai mencapai instar-2, instar-3, instar-4, dan instar-5. Untuk mendapatkan larva dengan berbagai
stadia tersebut, infestasi larva instar-1 pada tanaman padi varietas Ciherang dilakukan setiap minggu.
Materi penelitian yang digunakan terdiri atas 6 galur padi Rojolele transgenik, yaitu galur 4.2.3-28-15-2-7 dan 4.2.4-21-8-16-4 yang mengandung
fusi dua gen cry (cryIB-cryIAa), galur 3R9-8-28-26-2 dan 3R7-8-15-2-7 yang
mengandung gen mpi::cryIB, galur T9-6.11-420 yang mengandung gen cryIAb
melalui teknik penembakan, galur DTcry (Azygous) yaitu segregan yang
mengalami proses kultur jaringan dan tidak mengandung gen cry (null), dan galur
DTcry-13 yang mengandung gen cryIAb melalui Agrobacterium, serta tanaman
padi bukan transgenik yang meliputi varietas Rojolele, Cilosari, dan Ciherang. Untuk mendeteksi keberadaan gen pada tanaman padi Rojolele transgenik yang diuji, dilakukan uji PCR. Isolasi DNA dilakukan dengan menggunakan
metode seperti yang dikemukakan oleh Van Heusden et al. (2000). Total DNA
diekstraksi dari daun tanaman kontrol (tidak ditransformasi) [varietas Rojolele], daun tanaman padi Rojolele transgenik generasi ke-5 [galur 4.2.3-28-15-2-7
(fusi), galur 4.2.4-21-8-16-4 (fusi), galur 3R9-8-28-26-2 (mpi), dan galur
3R7-8-15-2-7 (mpi)], daun tanaman padi Rojolele transgenik generasi ke-9 [galur
T9-6.11-420 (cryIAb melalui teknik penembakan)], serta daun tanaman padi Rojolele
transgenik generasi ke-2 [galur DTcry-13 (cryIAb melalui Agrobacterium)].
Sekitar 10 cm daun muda dimasukkan ke dalam tube 1.5 ml dibekukan dengan nitrogen cair, digerus hingga menjadi halus, dan ditambah dengan 750 µl buffer isolasi yang mengandung buffer lisis [0.2 M Tris-HCl pH 7.5, 0.05 M EDTA, 2 M NaCl, 2% (b/v) CTAB], buffer ekstraksi [0.35 M sorbitol, 0.1 M Tris-HCl pH 7.5, 5 mM EDTA], dan 5% (b/v) sarkosil dengan perbandingan 2.5 : 2.5 : 1.
Kemudian diinkubasi 1 jam pada suhu 65 oC sambil dikocok perlahan.
Selanjutnya ditambah 750 µl kloroform : isoamil alkohol (24:1) dan dikocok. Kemudian sampel disentrifus (12 000 rpm, selama 5 menit pada suhu ruang). Lapisan atas diambil dan dipindah ke tube 1.5 ml yang baru dan ditambah 500 µl isopropanol dan dikocok. Sampel disentrifus (12 000 rpm, selama 6 menit pada suhu ruang). Supernatan dibuang, pellet dicuci dengan 500 µl 70% etanol dan disentrifus (12 000 rpm selama 3 menit). Supernatan dibuang dan pellet dikering
anginkan. DNA dilarutkan dalam 50 µl TE (10 mM Tris-HCl pH 8.0, dan 1 mM
EDTA). Sampel DNA disimpan di -20 oC.
Amplifikasi PCR dilakukan dengan total reaksi 20 µl [1x buffer PCR: 2.5
mM MgCl2, 0.05 mM dNTPs, masing-masing 2.5 ng/µl primer, 0.05 µ/µl taq
polymerase, 1 µl sampel DNA, dan H2O]. Primer yang didesain untuk
memperbanyak fragmen DNA (785 bp) dari fusi dua gen cryIB-cryIAa
mempunyai urutan sebagai berikut: forward 5’ gcc caa gaa gct gtc aac gc 3’ dan reverse 5’ cga tgt cga gaa ctg tga gg 3’. Primer yang didesain untuk
memperbanyak bagian (1.9 kb) dari gen cryIB mempunyai urutan sebagai berikut:
forward 5’ gct gtg tcc aac cac tcc gc 3’ dan reverse 5’ gta ccg aat tgg gct gca gg
3’. Kondisi PCR untuk amplifikasi gen cryIB-cryIAa adalah 95 oC (3 menit); 95
oC (1 menit), 60 oC (1 menit), 72 oC (1 menit) 35 siklus; 72 oC (10 menit).
Kondisi PCR untuk gen cryIB adalah 95 oC (3 menit), 95 oC (1 menit), 62 oC (1
menit), 72 oC (1 menit) 40 siklus; 72 oC (10 menit). DNA hasil amplifikasi dengan
PCR dianalisis melalui elektroforesis pada gel agarosa 0.8% dan diwarnai dengan ethidium bromida. Elektroforesis dilakukan selama 1 jam dengan tekanan 100 volt dalam buffer 0.5x Tris Boric Acid EDTA (TBE). Larutan buffer berasal dari stok 5xTBE dengan susunan bahan: 54 g Tris base, 27.5 g Boric acid dan 20 ml 0.5 M EDTA pH 8.0 untuk setiap satu liter. Hasil elektroforesis diamati dan difoto dengan menggunakan Bio Rad Gel Doc UV 1000.
Amplifikasi PCR untuk gen cryIAb dilakukan dengan total reaksi 20 µl
[1x buffer PCR: 2.5 mM MgCl2, 0.05 mM dNTPs, 0.05 µ/µl taq polymerase, 2.5
ng/µl primer forward cry, 2.5 ng/µl primer reverse cry, 2.5 ng/µl primer goss
forward, 2.5 ng/µl primer goss reverse, 1 µl sample DNA, dan H2O]. Primer
untuk mendeteksi gen cryIAb mempunyai urutan basa sebagai berikut: forward 5’
cat tgt gtc tct ctt ccc 3’ dan reverse 5’ ccg tta gag aag ttg aaa gg 3’. Kondisi PCR
untuk amplifikasi gen cryIAb adalah 95 oC (3 menit) 1 siklus, 95 oC (1 menit), 55
oC (1 menit), 72 oC (1 menit) 40 siklus; 72 oC (10 menit) 1 siklus. DNA hasil
amplifikasi dengan PCR dianalisis melalui elektroforesis pada gel agarosa 0.8% dan diwarnai dengan ethidium bromida. Elektroforesis dilakukan selama 1 jam dengan tekanan 100 volt dalam buffer 0.5x Tris Boric Acid EDTA (TBE). Larutan buffer berasal dari stok 5xTBE dengan susunan bahan: 54 g Tris base,
27.5 g Boric acid dan 20 ml 0.5 M EDTA pH 8.0 untuk setiap satu liter. Hasil elektroforesis diamati dan difoto dengan menggunakan Bio Rad Gel Doc UV 1000.
Tanaman-tanaman yang berdasarkan uji PCR memberikan hasil positif selanjutnya digunakan untuk pengujian, sementara tanaman-tanaman yang berdasarkan uji PCR hasilnya negatif dibuang.
Metode Penelitian
Penelitian dilakukan dengan menggunakan rancangan acak lengkap (RAL) dengan 10 perlakuan dan 20 ulangan. Perlakuan meliputi: A = Rjl trans galur 4.2.3-28-15-2-7 (fusi), B = Rjl trans galur 4.2.4-21-8-16-4 (fusi), C = Rjl trans
galur 3R9-8-28-26-2 (mpi), D = Rjl trans galur 3R7-8-15-2-7 (mpi), E = Rjl trans
galur T9-6.11-420 (cryIAb melalui teknik penembakan), F = galur DTcry
(Azygous), G = Rjl trans galur DTcry-13 (cryIAb melalui Agrobacterium), H =
varietas Rojolele, I = varietas Cilosari, dan J = varietas Ciherang.
Penelitian ini dilakukan dengan menggunakan metode seperti yang
dikemukakan oleh Nayak et al. (1997). Tahap-tahap pengujian adalah sebagai
berikut: batang padi yang masih muda dengan daerah ruas dipotong sepanjang 7
cm. Selanjutnya potongan batang padi tersebut ditempatkan pada cawan petri atau cup plastik, ujung batang padi tersebut dibalut dengan kapas basah untuk
menjaga kelembaban. Sepuluh ekor larva S. incertulas masing-masing instar
ke-1, 2, 3, 4, dan 5 ditempatkan pada setiap cawan petri atau cup plastik. Selanjutnya
cawan petri atau cup plastik diinkubasi pada tempat gelap pada suhu 28 oC dan
kelembaban relatif 70%. Pengamatan dilakukan dengan membelah batang padi pada 3, 6, 12, 24, 48, dan 72 jam setelah infestasi (JSI) untuk melihat tingkat
mortalitas larva (Tamayo et al. 2000).
Data yang diperoleh dianalisis dengan analisis ragam (ANOVA), perbedaan antar perlakuan dievaluasi dengan uji wilayah berganda Duncan pada taraf nyata 5% dengan menggunakan program SAS (1990).
Hasil
Keefektifan padi Rojolele transgenik terhadap hama penggerek batang
padi kuning S. incertulas dapat terlihat dari tingkat mortalitasnya. Mortalitas larva
S. incertulas yang makan pada tanaman padi Rojolele transgenik maupun pada tanaman padi bukan transgenik sudah terlihat pada pengamatan 3 jam setelah infestasi, dan mortalitasnya meningkat seiring dengan lamanya pemaparan (Gambar 3.1, 3.2, 3.3, 3.4, 3.5).
Mortalitas larva instar-1 S. incertulas pada tanaman padi Rojolele
transgenik terlihat sangat tinggi. Pada 72 jam setelah infestasi, mortalitas tertinggi
terlihat pada padi Rojolele transgenik galur T9-6.11-420 (cryIAb melalui teknik
penembakan) dengan tingkat mortalitas sebesar 94%. Namun demikian, tingkat
mortalitas pada galur T9-6.11-420 (cryIAb melalui teknik penembakan) tersebut
tidak berbeda dengan galur 4.2.4-21-8-16-4 (fusi) yang menyebabkan mortalitas sebesar 89% (Gambar 3.1). 0.00 10.00 20.00 30.00 40.00 50.00 60.00 70.00 80.00 90.00 100.00
3 jam 6 jam 12 jam 24 jam 48 jam 72 jam
Waktu pengamatan (jam)
M ort al ita s (% ) Rjl trans 4.2.3-28-15-2-7 (Fusi) Rjl trans 4.2.4-21-8-16-4 (Fusi) Rjl trans 3R9-8-28-26-2 (mpi) Rjl trans 3R7-8-15-2-7 (mpi) Rjl trans T 9-6.11-420 (cryIAb) DT cry (Azygous)
Rjl trans Dtcry-13 (cryIAb) Rojolele
Cilosari Ciherang
Gambar 3.1 Persentase mortalitas larva instar-1 S. incertulas pada berbagai
perlakuan dan waktu pengamatan
Hal ini menunjukkan bahwa galur T9-6.11-420 (cryIAb melalui teknik
penembakan) sama efektifnya dengan galur 4.2.4-21-8-16-4 (fusi) terhadap larva
instar-1 S. incertulas. Padi Rojolele transgenik galur 3R7-8-15-2-7 (mpi)
4.2.3-28-15-2-7 (fusi) (74.5%), galur 3R9-8-28-26-2 (mpi) (73.5%), dan galur DTcry-13
(cryIAb melalui Agrobacterium) (69.5%). Pada varietas padi bukan transgenik
dan DTcry (Azygous) tidak terlihat adanya perbedaan mortalitas, tingkat
mortalitasnya adalah 42-45% (Gambar 3.1).
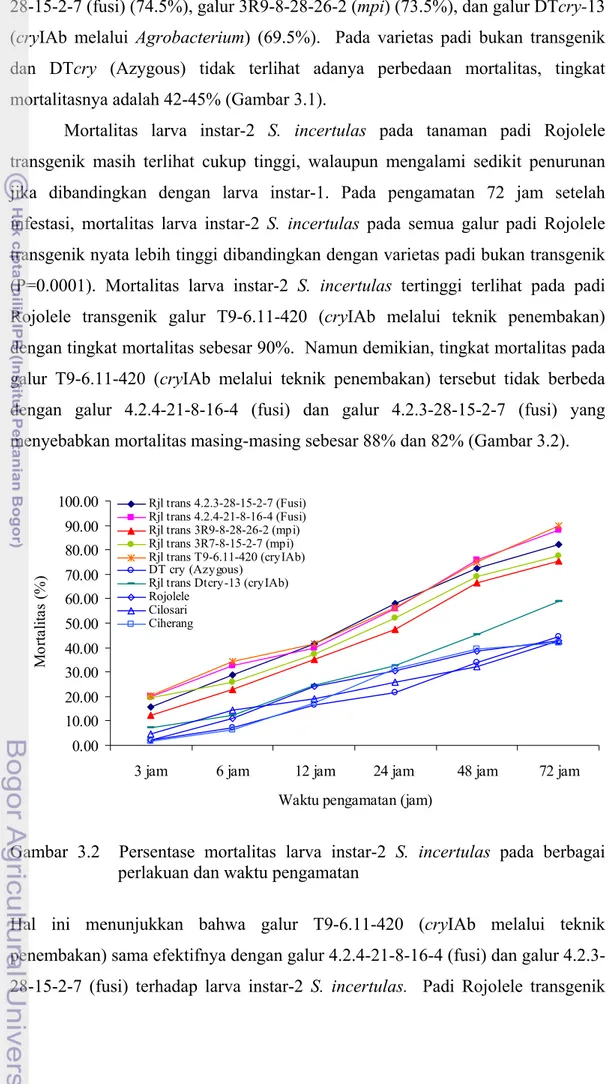
Mortalitas larva instar-2 S. incertulas pada tanaman padi Rojolele
transgenik masih terlihat cukup tinggi, walaupun mengalami sedikit penurunan jika dibandingkan dengan larva instar-1. Pada pengamatan 72 jam setelah
infestasi, mortalitas larva instar-2 S. incertulas pada semua galur padi Rojolele
transgenik nyata lebih tinggi dibandingkan dengan varietas padi bukan transgenik
(P=0.0001). Mortalitas larva instar-2 S. incertulas tertinggi terlihat pada padi
Rojolele transgenik galur T9-6.11-420 (cryIAb melalui teknik penembakan)
dengan tingkat mortalitas sebesar 90%. Namun demikian, tingkat mortalitas pada
galur T9-6.11-420 (cryIAb melalui teknik penembakan) tersebut tidak berbeda
dengan galur 4.2.4-21-8-16-4 (fusi) dan galur 4.2.3-28-15-2-7 (fusi) yang menyebabkan mortalitas masing-masing sebesar 88% dan 82% (Gambar 3.2).
0.00 10.00 20.00 30.00 40.00 50.00 60.00 70.00 80.00 90.00 100.00
3 jam 6 jam 12 jam 24 jam 48 jam 72 jam
Waktu pengamatan (jam)
M or ta lita s ( % ) Rjl trans 4.2.3-28-15-2-7 (Fusi) Rjl trans 4.2.4-21-8-16-4 (Fusi) Rjl trans 3R9-8-28-26-2 (mpi) Rjl trans 3R7-8-15-2-7 (mpi) Rjl trans T9-6.11-420 (cryIAb) DT cry (Azygous)
Rjl trans Dtcry-13 (cryIAb) Rojolele
Cilosari Ciherang
Gambar 3.2 Persentase mortalitas larva instar-2 S. incertulas pada berbagai
perlakuan dan waktu pengamatan
Hal ini menunjukkan bahwa galur T9-6.11-420 (cryIAb melalui teknik
penembakan) sama efektifnya dengan galur 4.2.4-21-8-16-4 (fusi) dan galur
galur 3R7-8-15-2-7 (mpi) menyebabkan mortalitas sebesar 77.5%, tidak berbeda
dengan galur 3R9-8-28-26-2 (mpi) (75.5%). Mortalitas larva instar-2 S. incertulas
terendah terlihat pada padi Rojolele transgenik galur DTcry-13 (cryIAb melalui
Agrobacterium) yang menyebabkan mortalitas sebesar 59%. Pada varietas padi
bukan transgenik dan DTcry (Azygous) tidak terlihat adanya perbedaan
mortalitas, tingkat mortalitasnya adalah 42-44.5% (Gambar 3.2).
Keefektifan padi Rojolele transgenik terlihat mulai menurun terhadap
larva instar-3 S. incertulas. Pada pengamatan 72 jam setelah infestasi, mortalitas
larva instar-3 S. incertulas pada semua galur padi Rojolele transgenik nyata lebih
tinggi dibandingkan dengan varietas padi bukan transgenik (P=0.0001). Namun antar galur padi Rojolele transgenik dan antar varietas padi bukan transgenik tidak terlihat adanya perbedaan mortalitas. Tingkat mortalitas pada galur padi Rojolele transgenik berkisar 52.5-68.5%, sementara tingkat mortalitas pada varietas padi bukan transgenik berkisar 40.5-43.5% (Gambar 3.3).
0.00 10.00 20.00 30.00 40.00 50.00 60.00 70.00 80.00 90.00 100.00
3 jam 6 jam 12 jam 24 jam 48 jam 72 jam
Waktu pengamatan (jam)
M or ta lita s ( % ) Rjl trans 4.2.3-28-15-2-7 (Fusi) Rjl trans 4.2.4-21-8-16-4 (Fusi) Rjl trans 3R9-8-28-26-2 (mpi) Rjl trans 3R7-8-15-2-7 (mpi) Rjl trans T9-6.11-420 (cryIAb) DT cry (Azygous)
Rjl trans Dtcry-13 (cryIAb) Rojolele
Cilosari Ciherang
Gambar 3.3 Persentase mortalitas larva instar-3 S. incertulas pada berbagai
perlakuan dan waktu pengamatan
Keefektifan padi Rojolele transgenik terlihat sangat menurun terhadap
larva instar-4 S. incertulas. Hal ini dapat terlihat pada semua waktu pengamatan,
kecuali pada 72 jam setelah infestasi, mortalitas larva instar-4 S. incertulas pada
padi bukan transgenik (P=0.0211; P=0.7867; P=0.9316; P=0.8397; P=0.4025) (Gambar 3.4).
Pada pengamatan 72 jam setelah infestasi, mortalitas larva instar-4 S. incertulas yang nyata lebih tinggi jika dibandingkan dengan varietas padi bukan transgenik hanya terlihat pada padi Rojolele transgenik galur 4.2.4-21-8-16-4
(fusi) dan galur T9-6.11-420 (cryIAb melalui teknik penembakan) (P=0.0001).
Tingkat mortalitas pada padi Rojolele transgenik galur 4.2.4-21-8-16-4 (fusi) sebesar 61.5% dan tingkat mortalitas pada padi Rojolele transgenik galur
T9-6.11-420 (cryIAb melalui teknik penembakan) sebesar 61%. Hal ini menunjukkan
bahwa galur 4.2.4-21-8-16-4 (fusi) dan galur T9-6.11-420 (cryIAb melalui teknik
penembakan) sama efektifnya terhadap larva instar-4 S. incertulas. Mortalitas
larva instar-4 S. incertulas pada padi Rojolele transgenik galur 4.2.3-28-15-2-7
(fusi), galur 3R9-8-28-26-2 (mpi), galur 3R7-8-15-2-7 (mpi), dan galur DTcry-13
(cryIAb melalui Agrobacterium) terlihat tidak berbeda jika dibandingkan dengan
varietas padi bukan transgenik. Pada varietas padi bukan transgenik dan DTcry
(Azygous) tidak terlihat adanya perbedaan mortalitas, tingkat mortalitasnya adalah 34.5-38.5% (Gambar 3.4). 0.00 10.00 20.00 30.00 40.00 50.00 60.00 70.00 80.00 90.00 100.00
3 jam 6 jam 12 jam 24 jam 48 jam 72 jam
Waktu pengamatan (jam)
M ort al ita s (% ) Rjl trans 4.2.3-28-15-2-7 (Fusi) Rjl trans 4.2.4-21-8-16-4 (Fusi) Rjl trans 3R9-8-28-26-2 (mpi) Rjl trans 3R7-8-15-2-7 (mpi) Rjl trans T9-6.11-420 (cryIAb) DT cry (Azygous)
Rjl trans Dtcry-13 (cryIAb) Rojolele
Cilosari Ciherang
Gambar 3.4 Persentase mortalitas larva instar-4 S. incertulas pada berbagai
Semua padi Rojolele transgenik terlihat tidak efektif terhadap larva instar-5 S. incertulas. Hal ini dapat terlihat pada semua waktu pengamatan, mortalitas
larva instar-5 S. incertulas pada semua galur padi Rojolele transgenik tidak
berbeda dibandingkan dengan varietas padi bukan transgenik (P=0.5276; P=0.0010; P=0.1976; P=0.2058; P=0.5774; P=0.1418) (Gambar 3.5). 0.00 10.00 20.00 30.00 40.00 50.00 60.00 70.00 80.00 90.00 100.00
3 jam 6 jam 12 jam 24 jam 48 jam 72 jam
Waktu pengamatan (jam)
M or ta lita s ( % ) Rjl trans 4.2.3-28-15-2-7 (Fusi) Rjl trans 4.2.4-21-8-16-4 (Fusi) Rjl trans 3R9-8-28-26-2 (mpi) Rjl trans 3R7-8-15-2-7 (mpi) Rjl trans T9-6.11-420 (cryIAb) DT cry (Azygous)
Rjl trans Dtcry-13 (cryIAb) Rojolele
Cilosari Ciherang
Gambar 3.5 Persentase mortalitas larva instar-5 S. incertulas pada berbagai
perlakuan dan waktu pengamatan Pembahasan
Berdasarkan hasil pengujian pada tahap in vitro ini terlihat bahwa terdapat
perbedaan keefektifan padi Rojolele transgenik dan padi bukan transgenik
terhadap hama S. incertulas. Hasil penelitian menunjukkan bahwa semua galur
padi Rojolele transgenik yang diuji mempunyai keefektifan yang lebih tinggi
dalam mematikan larva S. incertulas dibandingkan dengan varietas padi bukan
transgenik. Hal ini disebabkan oleh sumber ketahanan intrinsik yang berbeda antara padi Rojolele transgenik dan padi bukan transgenik. Sumber ketahanan intrinsik pada padi Rojolele transgenik adalah protoxin yang berasal dari gen
cryIAb, fusi dua gen cry (cryIB-cryIAa), dan gen mpi::cryIB. Gen cry adalah
penyandi δ-Endotoksin dari B. thuringiensis yang menghasilkan suatu kristal
protein yang bersifat racun jika terhidrolisis dalam sistem pencernaan serangga
(Dekeyser et al. 1990). Kristal ini di alam merupakan protoxin yang jika larut
polipeptida yang lebih pendek (27-149 kilo Dalton) serta mempunyai sifat
insektisida. Toxin aktif ini berinteraksi dengan sel-sel epitel midgut serangga.
Toxin Bt mengakibatkan terbentuknya lubang-lubang kecil pada membran sel
epidermis sistem pencernaan serangga, sehingga mengganggu keseimbangan osmotik sel tersebut. Sel yang terganggu tekanan osmosisnya menjadi bengkak dan pecah, sehingga serangga mati (Hofte & Whiteley 1989; Bahagiawati 2005;
Manyangarirwa et al. 2006). Dengan demikian dapat dikatakan bahwa mekanisme
ketahanan tanaman transgenik ini termasuk mekanisme ketahanan antibiosis. Menurut Panda dan Khush (1995) pengaruh antibiosis mengakibatkan berkurangnya ukuran atau berat serangga, mengurangi proses metabolisme, meningkatkan kegelisahan, dan kematian larva serta pradewasa.
Sumber ketahanan intrinsik pada padi bukan transgenik umumnya berasal dari karakteristik biokimia dan karakteristik biofisik tanaman yang mempengaruhi perilaku atau metabolisme serangga (Kogan 1982). Karakteristik biokimia dapat berupa senyawa kimia primer yang tidak terdapat secara seimbang, senyawa yang bekerja sebagai hormon serangga, dan metabolit sekunder (senyawa sekunder) (Reese 1979) seperti phenol, steroid, dan terpenoid yang pada kadar tertentu tahan terhadap serangan serangga tertentu. Senyawa sekunder dapat bersifat racun baik secara langsung atau setelah dihidrolisis di dalam sistem pencernaan serangga
(Speight et al. 1999). Karakteristik biofisik tanaman dapat berupa sifat-sifat
morfologi tanaman yang dapat menghalangi terjadinya proses makan, peletakan telur, dan pergerakan serangga secara normal (Kogan 1982), misalnya adanya rambut-rambut pada permukaan daun yang disebut trichome dan glandular
trichome, duri, daun yang licin atau mengkilat, dan adanya lapisan lilin (Speight et
al. 1999).
Pada pengujian tahap in vitro ini terlihat pula adanya perbedaan
keefektifan antar protoxin dalam padi Rojolele transgenik. Keefektifan tertinggi
terlihat pada protoxin dalam padi Rojolele transgenik galur T9-6.11-420 (cryIAb
melalui teknik penembakan) diikuti galur 4.2.4-21-8-16-4 (fusi) dan galur
3R7-8-15-2-7 (mpi). Protoxin dalam padi Rojolele transgenik galur 4.2.3-28-15-2-7 (fusi)
dan galur 3R9-8-28-26-2 (mpi) mempunyai keefektifan sedang, dan protoxin
mempunyai keefektifan terendah. Galur DTcry (Azygous) mempunyai keefektifan yang sama dengan padi bukan transgenik. Selain itu, protoxin dalam padi
Rojolele transgenik galur T9-6.11-420 (cryIAb melalui teknik penembakan) dan
galur 4.2.4-21-8-16-4 (fusi) mempunyai kisaran keefektifan lebih panjang karena
kedua galur tersebut efektif mematikan larva S. incertulas dari mulai instar-1
sampai instar-4.
Selain perbedaan keefektifan antar protoxin dalam padi Rojolele
transgenik, pada pengujian tahap in vitro ini terlihat pula adanya perbedaan daya
kerja masing-masing protoxin dalam galur padi Rojolele transgenik yang diuji. Hal ini dapat terlihat dari kemampuan protoxin dalam galur padi Rojolele transgenik tersebut menyebabkan mortalitas 50% pada setiap stadium larva.
Mortalitas 50% larva instar-1 S. incertulas pada padi Rojolele transgenik galur
T9-6.11-420 (cryIAb melalui teknik penembakan) dan galur 3R7-8-15-2-7 (mpi)
tercapai pada 12 jam setelah infestasi. Pada padi Rojolele transgenik galur
4.2.3-28-15-2-7 (fusi), galur 4.2.4-21-8-16-4 (fusi), dan galur 3R9-8-28-26-2 (mpi)
tercapai pada 24 jam setelah infestasi. Mortalitas 50% pada padi Rojolele
transgenik galur DTcry-13 (cryIAb melalui Agrobacterium) lebih lambat yaitu
tercapai pada 48 jam setelah infestasi (Gambar 3.1).
Pada larva instar-2 dan instar-3 S. incertulas, mortalitas 50% pada semua
galur padi Rojolele transgenik yang diuji lebih lambat jika dibandingkan dengan
larva instar-1 S. incertulas (Gambar 3.2 dan 3.3). Pada larva instar-4 S. incertulas,
mortalitas 50% hanya tercapai pada padi Rojolele transgenik galur T9-6.11-420
(cryIAb melalui teknik penembakan) dan galur 4.2.4-21-8-16-4 (fusi) pada 72 jam
setelah infestasi (Gambar 3.4). Pada larva instar-5 S. incertulas, mortalitas 50%
tidak tercapai pada semua galur padi Rojolele transgenik (Gambar 3.5).
Berdasarkan analisis daya kerja ini dapat dikatakan bahwa protoxin dalam
padi Rojolele transgenik galur T9-6.11-420 (cryIAb melalui teknik penembakan)
mempunyai daya kerja yang paling cepat dalam mematikan larva S. incertulas,
diikuti galur 4.2.4-21-8-16-4 (fusi) dan galur 3R7-8-15-2-7 (mpi). Protoxin dalam
padi Rojolele transgenik galur 4.2.3-28-15-2-7 (fusi) dan galur 3R9-8-28-26-2
transgenik galur DTcry-13 (cryIAb melalui Agrobacterium) mempunyai daya
kerja yang paling lambat dalam mematikan larva S. incertulas.
Perbedaan keefektifan dan daya kerja ini disebabkan oleh adanya perbedaan kontrol ekspresi gen dan tingkat toksisitas dari aktivitas insektisida pada gen yang digunakan. Padi Rojolele transgenik galur T9-6.11-420
mengandung gen cryIAb dan jumlah gen yang diintroduksikan adalah tunggal.
Promoter yang digunakan adalah promoter ubiquitin yang bersifat constitutive. Tanaman transgenik dengan kontrol ekspresi gen seperti ini, gennya akan terekspresi terus menerus diseluruh jaringan tanaman dan sepanjang umur
tanaman (Datta et al. 1998; Fontes et al. 2002). Dengan demikian larva S.
incertulas akan terpapar terus menerus oleh tanaman transgenik sepanjang umur
serangga tersebut. Selain itu gen cryIAb mempunyai aktivitas insektisida sangat
tinggi. Menurut Wu et al. (1997) dan Datta et al. (1998) gen cryIAb mempunyai
aktivitas insektisida yang tinggi dan mampu menekan perkembangan larva S.
incertulas instar-1 dengan tingkat mortalitas mencapai 100% pada 4 hari setelah infestasi.
Padi Rojolele transgenik galur 4.2.4-21-8-16-4 (fusi) mempunyai
keefektifan dan daya kerja yang hampir sama dengan galur T9-6.11-420 (cryIAb
melalui teknik penembakan). Galur 4.2.4-21-8-16-4 (fusi) mengandung dua gen
cry yaitu cryIB-cryIAa yang mempunyai binding site berbeda. Promoter yang
digunakan adalah promoter ubiquitin yang bersifat constitutive. Tanaman
transgenik dengan kontrol ekspresi gen seperti ini, gennya akan terekspresi terus
menerus diseluruh jaringan tanaman dan sepanjang umur tanaman (Datta et al.
1998; Fontes et al. 2002).
Padi Rojolele transgenik galur 3R7-8-15-2-7 (mpi) mempunyai keefektifan
yang tinggi dan daya kerja yang cepat setelah galur T9-6.11-420 (cryIAb melalui
teknik penembakan) dan galur 4.2.4-21-8-16-4 (fusi). Galur 3R7-8-15-2-7 (mpi)
mengandung gen mpi::cryIB dan jumlah gen yang diintroduksikannya adalah
tunggal yaitu gen cryIB. Promoter yang digunakan adalah promoter maize
proteinase inhibitor yang bersifat inducible. Tanaman transgenik dengan kontrol ekspresi gen seperti ini, gennya hanya akan terekspresi apabila ada gigitan
Menurut Breitler et al. (2000) cryIB mempunyai aktivitas insektisida yang tinggi
dan mampu menekan perkembangan larva penggerek batang padi bergaris C.
suppressalis instar-2 dengan tingkat mortalitas mencapai 90-100% pada 7 hari setelah infestasi.
Untuk padi Rojolele transgenik galur 4.2.3-28-15-2-7 (fusi), galur
3R9-8-28-26-2 (mpi), dan galur DTcry-13 (cryIAb melalui Agrobacterium) yang
mempunyai keefektifan dan daya kerja lebih rendah dibandingkan dengan galur
T9-6.11-420 (cryIAb melalui teknik penembakan), galur 4.2.4-21-8-16-4 (fusi),
dan galur 3R7-8-15-2-7 (mpi) kemungkinan disebabkan gennya kurang
terekspresi (Satoto 2003). Untuk galur DTcry (Azygous) yang mempunyai
keefektifan sama dengan varietas padi bukan transgenik disebabkan galur ini adalah segregan yang mengalami proses kultur jaringan dan tidak mengandung gen cry (null).
Pada pengujian tahap in vitro ini ada fenomena bahwa semua galur padi
Rojolele transgenik yang diuji efektif dalam mematikan larva S. incertulas, namun
keefektifannya semakin menurun dengan bertambah lanjutnya perkembangan larva (Gambar 3.6). Hal ini disebabkan adanya perbedaan kuantitas makanan yang dikonsumsi dan efisiensi penggunaan makanan antara larva instar awal dan larva instar lanjut. Larva instar awal dapat mengkonsumsi jaringan tanaman sampai 6 kali berat badannya per hari, selain itu lebih efisien dalam penggunaan makanannya. Fenomena ini terkait pula dengan tingkat enzim detoksifikasi yang diduga masih rendah. Larva instar lanjut per hari hanya makan sekitar berat badannya sendiri dan kurang efisien dalam penggunaan makanannya. Hal ini terkait dengan adanya tingkat enzim detoksifikasi yang lebih tinggi (Schoonhoven et al. 1998). Dengan kondisi demikian maka pada larva instar awal lebih banyak protoxin yang masuk ke dalam tubuhnya melalui banyaknya makanan yang dimakan. Selain itu toxin yang sudah masuk dalam tubuh larva instar awal tidak bisa dikeluarkan dari tubuhnya karena enzim detoksifikasinya diduga masih rendah. Sebagai akibatnya larva instar awal adalah yang paling terpengaruh oleh toxin tersebut. Sebaliknya pada larva instar lanjut karena makannya sedikit, maka protoxin yang masuk ke dalam tubuhnya pun sedikit.
0.00 10.00 20.00 30.00 40.00 50.00 60.00 70.00 80.00 90.00 100.00
Instar-1 Instar-2 Instar-3 Instar-4 Instar-5
Stadia perkembangan M or tal itas ( % ) Rjl trans 4.2.3-28-15-2-7 (Fusi) Rjl trans 4.2.4-21-8-16-4 (Fusi) Rjl trans 3R9-8-28-26-2 (mpi) Rjl trans 3R7-8-15-2-7 (mpi) Rjl trans T9-6.11-420 (cryIAb) DT cry (Azygous) Rjl trans Dtcry-13 (cryIAb) Rojolele Cilosari Ciherang 0.00 10.00 20.00 30.00 40.00 50.00 60.00 70.00 80.00 90.00 100.00
Instar-1 Instar-2 Instar-3 Instar-4 Instar-5
Stadia perkembangan M or ta lita s ( % ) Rjl trans 4.2.3-28-15-2-7 (Fusi) Rjl trans 4.2.4-21-8-16-4 (Fusi) Rjl trans 3R9-8-28-26-2 (mpi) Rjl trans 3R7-8-15-2-7 (mpi) Rjl trans T9-6.11-420 (cryIAb) DT cry (Azygous) Rjl trans Dtcry-13 (cryIAb) Rojolele Cilosari Ciherang (a) (b) 0.00 10.00 20.00 30.00 40.00 50.00 60.00 70.00 80.00 90.00 100.00
Instar-1 Instar-2 Instar-3 Instar-4 Instar-5
Stadia perkembangan M ort al ita s (% ) Rjl trans 4.2.3-28-15-2-7 (Fusi) Rjl trans 4.2.4-21-8-16-4 (Fusi) Rjl trans 3R9-8-28-26-2 (mpi) Rjl trans 3R7-8-15-2-7 (mpi) Rjl trans T9-6.11-420 (cryIAb) DT cry (Azygous) Rjl trans Dtcry-13 (cryIAb) Rojolele Cilosari Ciherang 0.00 10.00 20.00 30.00 40.00 50.00 60.00 70.00 80.00 90.00 100.00
Instar-1 Instar-2 Instar-3 Instar-4 Instar-5
Stadia perkembangan M or tal itas ( % ) Rjl trans 4.2.3-28-15-2-7 (Fusi) Rjl trans 4.2.4-21-8-16-4 (Fusi) Rjl trans 3R9-8-28-26-2 (mpi) Rjl trans 3R7-8-15-2-7 (mpi) Rjl trans T9-6.11-420 (cryIAb) DT cry (Azygous) Rjl trans Dtcry-13 (cryIAb) Rojolele Cilosari Ciherang (c) (d) 0.00 10.00 20.00 30.00 40.00 50.00 60.00 70.00 80.00 90.00 100.00
Instar-1 Instar-2 Instar-3 Instar-4 Instar-5
Stadia perkembangan M or ta lita s ( % ) Rjl trans 4.2.3-28-15-2-7 (Fusi) Rjl trans 4.2.4-21-8-16-4 (Fusi) Rjl trans 3R9-8-28-26-2 (mpi) Rjl trans 3R7-8-15-2-7 (mpi) Rjl trans T9-6.11-420 (cryIAb) DT cry (Azygous) Rjl trans Dtcry-13 (cryIAb) Rojolele Cilosari Ciherang 0.00 10.00 20.00 30.00 40.00 50.00 60.00 70.00 80.00 90.00 100.00
Instar-1 Instar-2 Instar-3 Instar-4 Instar-5
Stadia perkembangan M or ta lita s ( % ) Rjl trans 4.2.3-28-15-2-7 (Fusi) Rjl trans 4.2.4-21-8-16-4 (Fusi) Rjl trans 3R9-8-28-26-2 (mpi) Rjl trans 3R7-8-15-2-7 (mpi) Rjl trans T9-6.11-420 (cryIAb) DT cry (Azygous) Rjl trans Dtcry-13 (cryIAb) Rojolele Cilosari Ciherang
(e) (f)
Gambar 3.6 Persentase mortalitas larva instar 1-5 S. incertulas pada berbagai
perlakuan dan waktu pengamatan: (a) 3 jam, (b) 6 jam, (c) 12 jam, (d) 24 jam, (e) 48 jam, (f) 72 jam
Selain itu larva instar lanjut mampu mengeluarkan toxin dari tubuhnya karena tingkat enzim detoksifikasinya tinggi. Menurut Matsumura (1975) proses detoksifikasi senyawa aktif berlangsung dalam 2 tahap yaitu primer dan sekunder. Tahap primer melalui reaksi oksidasi, reduksi, dan hidrolisis serta proses-proses enzimatik yang menghasilkan produk-produk yang bersifat polar. Tahap sekunder melalui konjugasi yang menghasilkan konjugat-konjugat yang dapat diekskresikan keluar tubuh. Dengan demikian larva instar lanjut kurang terpengaruh oleh toxin.
(a)
6 mm 8 mm
(b)
Gambar 3.7 Gejala larva S. incertulas yang makan pada: (a) tanaman padi
transgenik, (b) tanaman padi bukan transgenik Kesimpulan
1. Semua protoxin dalam galur padi Rojolele transgenik mempunyai keefektifan
yang tinggi dalam mematikan larva S. incertulas dibandingkan dengan
varietas padi bukan transgenik.
2. Ada perbedaan keefektifan antar protoxin dalam galur padi Rojolele
transgenik. Protoxin dalam padi Rojolele transgenik galur T9-6.11-420
(cryIAb melalui teknik penembakan) mempunyai keefektifan tertinggi (94%)
dalam mematikan larva S. incertulas, diikuti galur 4.2.4-21-8-16-4 (fusi)
transgenik galur 4.2.3-28-15-2-7 (fusi) (74.5%) dan galur 3R9-8-28-26-2
(mpi) (73.5%) mempunyai keefektifan sedang, sementara protoxin dalam padi
Rojolele transgenik galur DTcry-13 (cryIAb melalui Agrobacterium)
mempunyai keefektifan terendah (69.5%) dalam mematikan larva S.
incertulas. Galur DTcry (Azygous) keefektifannya sama dengan varietas padi bukan transgenik (45%).
3. Protoxin dalam padi Rojolele transgenik galur T9-6.11-420 (cryIAb melalui
teknik penembakan) dan galur 4.2.4-21-8-16-4 (fusi) mempunyai kisaran
keefektifan lebih panjang yaitu efektif mematikan larva S. incertulas dari
mulai instar-1 sampai instar-4.
4. Semua protoxin dalam galur padi Rojolele transgenik efektif dalam
mematikan larva S. incertulas, namun keefektifannya semakin menurun
dengan bertambah lanjutnya perkembangan larva. Daftar Pustaka
Alam MF et al. 1998. Production of transgenic deepwater rice plants expressing a
synthetic Bacillus thuringiensis cryIAb gene with enhanced resistance to
yellow stem borer. Plant Science 135:25-30.
Bahagiawati. 2005. Ulasan: dampak tanaman transgenik Bt terhadap populasi
serangga pengendali hayati. J AgroBiogen 1(2):76-84.
Bandong JP, JA Litsinger. 2005. Rice crop stage susceptibility to the rice yellow
stemborer, Scirpophaga incertulas (Walker) (Lepidoptera: Pyralidae).
Inter Jour Pest Manag 51(1):37-43.
Breitler JC et al. 2000. Expression of a Bacillus thuringiensis cry1B synthetic
gene protects Mediterranean rice against the striped stem borer. Plant Cell
Reports 19:1195-1202.
Conner AJ. 1997. Genetically engineered crops: environmental and food safety
issues. The Royal Society of New Zealand. Miscellaneous Series 39.
Datta K et al. 1998. Constitutive and tissue-specific differential expression of the
cryIA(b) gene in transgenic rice plants conferring resistance to rice insect
pest. Theor Appl Genet 97:20-30.
Dekeyser, Inze RP, Van Montagu M. 1990. Transgenic Plants. In. Gustafson JP
(ed). Gene Manipulation in Plant Improvement II. New York: Plenum Press. pp 237-250.
[DIRJENTAN PANGAN] Direktorat Jenderal Tanaman Pangan.2007. Informasi Perkembangan Serangan OPT Padi Tahun 2006, Tahun 2005 dan Rerata
5 Tahun (2000-2004). Jakarta: Direktorat Jenderal Tanaman Pangan,
Direktorat Perlindungan Tanaman.
Duan X et al. 1996. Transgenic rice plants harboring an introduced potato
proteinase inhibitor II gene are insect resistant. Nature Biotechnology 14:494-498.
Fontes EMG et al. 2002. The environmental effects of genetically modified crops
resistant to insect. Neotropical Entomology 31(4):497-513.
Ghareyazie et al. 1997. Enhanced resistance to two stem borer in an aromatic
rice containing a synthetic cryIA(b) gene. Moleculer Breeding 3:401-414.
Hofte H, HR Whiteley. 1989. Insecticidal crystal proteins of Bacillus
thuringiensis. Microbiol Review 53:242-255.
Kogan M. 1982. Plant resistance in pest management. In: Metcalf RL, WH
Luckmann, editor. Introduction to Insect Pest Management. Second
Edition. New York: John Wiley & Sons. pp 93-134.
Manyangarirwa W, Turnbull M, McCutcheon GS, Smith JP. 2006. Gene
pyramiding as a Bt resistance management strategy: How sustainable is
this strategy ?. Afr. J. Biotechnol 5(10):781-785.
Matsumura F. 1975. Toxicology of Insecticides. New York and London: Plenum
Press. 503 p.
Mochizuki et al. 1999. Transgenic rice plants expressing a trypsin inhibitor are
resistant against rice stem borers, Chilo suppressalis. Entomol Exper Appl
93:173-178.
Nayak P et al. 1997. Transgenic elite indica rice plants expressing CryIAc
δ-endotoxin of Bacillus thuringiensis are resistant against yellow stem borer
(Scirpophaga incertulas). Proc Natl Acad SciUSA 94:2111-2116.
Panda N, GS Khush. 1995. Host Plant Resistance To Insects. CAB International
Intl Rice Res Inst. Philippines: Los Banos. 431 p.
Rachmat A. 2006. Konstruksi vektor ekspresi gen untuk mengeliminasi gen
penyeleksi antibiotik pada tanaman padi (Oryza sativa L.) transgenik
Rahmawati S. 2004. Introduksi dua gen cry dengan “binding site” berbeda dan
penggunaan promoter terinduksi pelukaan pada padi (Oryza sativa L)
untuk memperlama ketahanan [laporan riset unggulan terpadu bidang pertanian dan pangan]. Bogor: Kementerian Riset dan Teknologi RI Lembaga Ilmu Pengetahuan Indonesia. 50 hlm.
Reese JC. 1979. Interaction of allelochemicals with nutrients in herbivore food.
In Rosenthal GA, DH Janson (Eds). Herbivores: Their Interaction with
Secondary Plant Metabolites. New York: Academic Press. pp 309-330. SAS Institute. 1990. SAS/STAT User’s Guide, Version 6. Fourth Edition. Volume
2. North Carolina: SAS Institute Inc.
Satoto. 2003. Kestabilan, pola pewarisan, dan keefektifan gen gna dan cry1Ab
terhadap wereng batang coklat dan penggerek batang kuning pada padi rojolele transgenik [disertasi]. Bogor: Program Pascasarjana, Institut Pertanian Bogor.
Satoto, I Slamet-Loedin, A Hartana, S Manuwoto, H Aswidinnoor. 2003. Ketahanan padi rojolele transgenik terhadap hama penggerek batang padi
kuning dan wereng coklat. Jurnal Penelitian Pertanian 22(3):121-128.
Schoonhoven LM, T Jermy, JJA van Loon. 1998. Plants as insect food: not the
ideal. In: Insect-Plant Biology: From Physiology to Evolution. First
edition. London: Chapman & Hall. pp 83-120.
Slamet-Loedin IH et al. 1998. Production of fertile transgenic aromatic
Indonesian javanica rice co-expressing the snowdrop lectin and cryIAb
anti-insect proteins. Proceedings of the 4th Asia Pacific Conference on
Agricultural Biotechnology. pp 206-208.
Speight MR, MD Hunter, AD Watt. 1999. Ecology of Insects: Concepts and
Applications. London: Blackwell Science Ltd. 350 p.
Tamayo MC, M Rufat, JM Bravo, BS Segundo. 2000. Accumulation of a maize proteinase inhibitor in response to wounding and insect feeding, and
characterization of its activity toward digestive proteinases of Spodoptera
littoralis larvae. Planta 211:62-71.
Van Heusden AW et al. 2000. A genetic map of an interspecific cross in Alium
based on amplified fragment length polymorphism (AFLP TM) marker.
Theor Appl Genet 100:118-126.
Wu C, Y Fan, C Zhang, N Oliva, SK Datta. 1997. Transgenic fertile japonica
rice plants expressing a modified cryIA(b) gene resistant to yellow stem
Xu D et al. 1996. Constitutive expression of a cowpea trypsin inhibitor gene,
CpTi, in transgenic rice plants confers resistance to two major rice insect