34 BAB IV
HASIL DAN PEMBAHASAN
A. PENELITIAN TAHAP I (Analisis Total Mikroba dan Isolasi Salmonella spp. pada Ikan)
1. Kondisi Sampel
Sampel diambil dari sepuluh pasar yang tersebar di Wilayah Bogor yang meliputi pasar tradisional dan pasar modern (supermarket). Masing-masing pasar, sampel yang diambil terdiri dari tiga jenis ikan yaitu ikan bawal, kembung, dan gurami. Ketiga jenis ikan ini adalah ikan yang termasuk diproduksi dalam jumlah tinggi di Indonesia (DKP, 2007). Jumlah seluruh ikan bawal sebanyak 10 ekor, ikan kembung, 10 ekor, sedangkan ikan gurami 9 ekor. Total seluruh ikan adalah 29 ekor. Jumlah ikan gurami tidak 10 ekor disebabkan oleh tidak adanya ketersedian ikan gurami pada salah satu pasar tradisional yaitu Pasar Induk. Tabel 9 menunjukkan kondisi penyimpanan ikan di berbagai pasar pada saat dilakukan pengambilan sampel.
Tabel 9. Kondisi penyimpanan sampel ikan di pasar tradisional dan pasar modern
Skala usaha dari setiap jenis pasar berbeda yaitu pasar tradisional dan modern. Namun untuk jenis pasar yang sama skala usahanya seragam. Berbeda Tempat Jenis ikan Jumlah
sampel (n) Kondisi sampel Suhu penyimpanan Wadah penyimpanan Pasar
Modern Bawal 7 Segar
Suhu
refrigerator Es
Pasar
Modern Kembung 7 Segar
Suhu
refrigerator Es
Pasar
Modern Gurami 7 Segar
Suhu
refrigerator Es
Pasar
Tradisional Bawal 3 Segar Suhu ruang
Daun pisang/keramik Pasar
Tradisional Kembung 3 Segar Suhu ruang Daun pisang/keramik Pasar
Tradisional Gurami 2 Segar Suhu ruang Daun pisang/keramik
35 dengan pasar modern, pasar tradisional memiliki skala usaha yang kecil. Sistem penjualan di pasar tradisional adalah stand-stand kecil kira-kira berukuran 3 x 3 meter. Pasokan ikan yang diperoleh para penjual di pasar tradisional umumnya berasal dari satu agen yang sama. Hal ini menunjukkan kualitas ikan berasal dari sumber yang sama. Begitu juga dengan metode penanganan oleh setiap penjual ikan, secara umum penanganan terhadap ikan juga sama. Ikan diletakkan diatas alas yang datar dengan lapisan daun pisang atau keramik. Selain itu, hal ini juga menunjukkan umur ikan pada setiap jenis pedagang adalah sama yaitu sejak ikan datang pada agen. Keseluruhan hal ini menjadi rutinitas setiap hari yang dilakukan oleh para pedagang ikan.
Setiap jenis pasar, baik pasar tradisional maupun pasar modern memiliki kondisi penyimpanan dan penanganan yang berbeda-beda terhadap sampel. Kondisi penyimpanan menyangkut hal-hal antara lain: suhu penyimpanan, wadah penyimpanan, dan tata ruang penyimpanan. Kondisi penanganan merupakan kondisi penanganan ikan setelah sampai di tingkat penjual terakhir serta penanganan ikan selama masa penjajakan. Faktor ini merupakan salah satu faktor yang dapat menyebabkan ikan menjadi cepat busuk jika tidak ditangani dengan baik.
Sampel yang telah dipilih dan dibeli selanjutnya dimasukkan ke dalam plastik steril yang telah disiapkan sebelumnya. Sampel yang telah dimasukkan ke dalam plastik steril selanjutnya dimasukkan ke dalam cool bag. Sampel yang dibeli dari pasar modern, es batu diperoleh dengan cara meminta kepada penjual namun bila sampel dibeli dari pasar tradisional maka es batu dipersiapkan terlebih dahulu. Pemberian es batu dalam cool bag bertujuan untuk mengkondisikan sampel tetap berada dalam suhu rendah sehingga kesegaran ikan tetap terjaga serta pertumbuhan mikroba menjadi terhambat. Selain itu, pemberian es batu ke dalam cool bag juga bertujuan untuk menjaga lot mikroba awal tetap pada keadaan semula yaitu saat sampel dijual sehingga hasil analisis dapat menunjukkan jumlah mikroba awal saat penjualan.
Setelah pengambilan sampel selesai dilakukan maka sampel segera di bawa ke laboratorium untuk dianalisis. Analisis dalam laboratorium berupa analisis total mikroba dan analisis Salmonella. Analisis Salmonella hingga ke
36 tahap uji biokimia lanjutan kira-kira membutuhkan waktu enam hari sedangkan untuk analisis total mikroba waktu yang dibutuhkan adalah selama dua hari sejak hari pembelian sampel.
2. Total Mikroba Ikan
Analisis total mikroba menunjukkan mutu mikrobiologi suatu bahan pangan. Mutu mikrobiologi perlu diketahui untuk melihat tingkat cemaran mikroba pada produk pangan tersebut. Hal ini menggambarkan total seluruh mikroba dalam bahan pangan tersebut sehingga dapat diketahui tingkat keamanannya untuk dikonsumsi selanjutnya.
Jumlah total mikroba merupakan indikator kualitas bahan pangan yang mencerminkan mutu dan sebagai indikator daya simpan bahan pangan. Setiap bahan pangan memiliki syarat mutu tersendiri terhadap jumlah total mikroba termasuk ikan. Batas maksimum cemaran total mikroba pada ikan segar berdasarkan Standar Nasional Indonesia (SNI) SNI 01-2719-1992 adalah 5 x 105 cfu/gram atau sebesar 5.70 log cfu/gram.
Rata-rata total mikroba ikan bawal yang berasal dari pasar modern adalah sebesar 6.47 log cfu/gram dimana total mikroba tertinggi sebesar 7.36 log cfu/gram dan yang terendah sebesar 5.41 log cfu/gram. Sementara itu rata-rata total mikroba yang berasal dari pasar tradisional adalah sebesar 7.01 log cfu/gram dimana total mikroba tertinggi sebesar 7.58 log cfu/gram dan yang terendah sebesar 6.10 log cfu/gram. Berdasarkan hasil uji statistik, rata-rata total mikroba yang berasal dari pasar tradisional tidak berbeda signifikan dengan rata-rata total mikroba yang berasal dari pasar modern untuk taraf 0.05.
Berdasarkan hasil ini maka dari ketujuh pasar modern total mikroba ikan bawal segar yang sesuai dengan persyaratan mutu ikan segar SNI 01-2719-1992 (≤ 5.70 log cfu/gram) adalah sebanyak dua supermarket (28.57 %) sedangkan lima supermarket lainnya tidak sesuai dengan persyaratan mutu ikan segar (> 5.70 log cfu/gram). Berbeda dengan pasar modern, pada pasar tradisional jumlah total mikroba ikan bawal segar dari ketiga pasar tradisional seluruhnya tidak memenuhi standar mutu ikan segar (> 5.70 log cfu/gram).
37 Gambar 3. Total mikroba pada ikan bawal yang berasal dari pasar tradisional
dan modern
Rata-rata total mikroba ikan kembung yang berasal dari pasar modern adalah sebesar 5.54 log cfu/gram dimana jumlah total mikroba tertinggi adalah sebesar 6.23 log cfu/gram dan yang terendah adalah sebesar 4.54 log cfu/gram. Sampel yang berasal dari pasar tradisional memiliki rata-rata total mikroba sebesar 6.79 log cfu/gram dimana jumlah total mikroba tertinggi adalah sebesar 7.39 log cfu/gram dan yang terendah adalah sebesar 6.49 log cfu/gram. Berdasarkan hasil uji statistik, rata-rata total mikroba yang berasal dari pasar tradisional berbeda signifikan dengan rata-rata total mikroba yang berasal dari pasar modern untuk taraf 0.05.
Hasil ini menunjukkan bahwa dari ketujuh pasar modern total mikroba ikan kembung segar yang sesuai dengan persyaratan mutu ikan segar SNI 01-2719-1992 adalah sebanyak tiga supermarket (42.86 %) sedangkan empat supermarket lainnya tidak sesuai dengan persyaratan mutu ikan segar (> 5.70 log cfu/gram). Pada pasar tradisional jumlah total mikroba ikan kembung segar dari ketiga pasar tradisional seluruhnya tidak memenuhi standar mutu ikan segar (> 5.70 log cfu/gram).
38 Gambar 4. Total mikroba pada ikan kembung yang berasal dari pasar
tradisional dan modern
Rata-rata total mikroba ikan gurami yang berasal dari pasar modern adalah sebesar 5.65 log cfu/gram dimana total mikroba tertinggi adalah sebesar 6.55 log cfu/gram dan yang terendah adalah sebesar 4.51 log cfu/gram. Sementara rata-rata total mikroba yang berasal dari pasar tradisional adalah sebesar 6.96 log cfu/gram dimana total mikroba tertinggi adalah sebesar 7.35 log cfu/gram dan yang terendah adalah sebesar 6.58 log cfu/gram. Berdasarkan hasil uji statistik, rata-rata total mikroba yang berasal dari pasar tradisional tidak berbeda signifikan dengan rata-rata total mikroba yang berasal dari pasar modern untuk taraf 0.05.
Hasil ini menunjukkan bahwa total mikroba ikan gurami segar yang sesuai dengan persyaratan mutu ikan segar SNI 01-2719-1992 adalah sebanyak tiga supermarket (42,86 %) sedangkan empat supermarket lainnya tidak sesuai dengan persyaratan mutu ikan segar (> 5.70 log cfu/gram). Sementara itu, jumlah total mikroba ikan gurami segar dari dua pasar tradisional seluruhnya tidak memenuhi standar mutu ikan segar (> 5.70 log cfu/gram).
39 Gambar 5. Total mikroba pada ikan gurami yang berasal dari pasar tradisional
dan modern
Hasil analisis kuantitatif total mikroba dari setiap jenis ikan diatas menunjukkan bahwa berdasarkan persyaratan mutu ikan segar SNI 01-2729.1-1992 masih terdapat ikan yang jumlah total mikrobanya lebih dari 5 x 105 cfu/gram (> 5.70 log cfu/gram). Tidak hanya ikan yang berasal dari pasar tradisional, ikan yang berasal dari pasar modern, beberapa diantaranya masih tidak sesuai dengan SNI 01-2729-1992. Secara umum, sanitasi dan prosedur penanganan di pasar modern lebih baik dan terstandar. Hal yang diduga menjadi penyebabnya adalah adanya faktor lain yang menyebabkan kualitas ikan sebelum sampai di pasar modern sudah menurun.
Nasran (1972) menjelaskan bahwa ada tiga faktor yang menyebabkan turunnya mutu ikan segar, yaitu cara penangkapan, faktor biologis, dan cara penanganan. Upaya yang dilakukan oleh setiap pasar modern untuk menjaga mutu ikan segar, hanya terbatas pada satu faktor saja yaitu cara penanganan dan hanya selama penjajakan saja. Selain itu, faktor lain adalah es batu yang digunakan sebagai alas ikan. Es batu yang digunakan menjadi faktor penyebab
40 kontaminasi silang terhadap ikan. Ikan yang telah lama/rusak akan meninggalkan cemaran bakteri pada alas es batu yang digunakan kembali sebagai alas ikan segar berikutnya.
Berdasarkan penelitian yang dilakukan oleh Hartini, U. S. (2005) terhadap lima sampel es batu, diperoleh bahwa total mikroba yang terdapat pada es batu berkisar antara 6.1 x 102 sampai 9.8 x 103 cfu/ml, selain itu analisis yang lebih spesifik lagi terhadap spesies bakteri yang terdapat pada es batu menggunakan perangkat API 20E antara lain diperoleh E.coli (10 %), Enterobacter sp (10 %), Enterobacter cloacae (20 %), Pseudomonas sp (10 %), Citrobacter (10 %), dan Klebsiella (20 %), hasil penelitian ini menjadi dasar terhadap adanya dugaan kontaminasi yang berasal dari es batu terhadap ikan yang dijual.
Dua faktor lain yaitu (cara penangkapan dan faktor biologis) inilah yang diduga menjadi penyebab rendahnya mutu ikan sebelum ikan sampai ke tangan penjual. Sementara itu, untuk pasar tradisional rendahnya mutu ikan diduga akibat dari buruknya penanganan dan cara penangkapan serta faktor biologis yang berasal dari ikan itu sendiri.
Cara penanganan yang teramati pada pasar tradisional saat pengambilan sampel adalah ikan diletakkan di atas alas yang terbuat dari keramik atau daun pisang dan datar. Keadaan yang demikian membuat air yang digunakan untuk mencuci ikan tidak mengalir terbuang sepenuhnya melainkan sebagian menumpuk tergenang di atas alas disamping itu, air yang digunakan untuk mencuci ikan menggunakan air yang selama proses pengambilannya tidak memperhatikan higienitas yaitu menggunakan air rendaman ikan stock sehingga membuat kontaminasi silang sangat mungkin terjadi.
41 Tabel 10. Persentase kesesuaian mutu total mikroba pada tiga jenis ikan terhadap persyaratan mutu total mikroba ikan segar SNI 01-2719-1992 pasar modern dan pasar tradisional di wilayah Bogor.
Jenis ikan Segar
Pasar Modern Pasar Tradisional PK SNI ikan
segar (%) PT SNI ikan segar (%) PK SNI ikan segar (%) PT SNI ikan segar (%) Ikan Bawal 28.57 71.43 0 100 Ikan Kembung 42.86 57.14 0 100 Ikan Gurami 42.86 57.14 0 100
Keterengan : PK SNI = Persentase kesesuaian PT SNI = Persentase ketidaksesuaian 3. Isolasi Salmonella spp.
Salmonella merupakan bakteri umumnya berada dalam jumlah kecil dalam bahan pangan namun jumlah tersebut cukup untuk menimbulkan gejala sakit (Jenie dan Fardiaz, 1989). Salmonella merupakan salah satu bakteri patogen yang sering mengkontaminasi ikan segar (Frazier dan Westhoff, 1981). Salmonella merupakan bakteri yang dapat menyebabkan keracunan pangan.
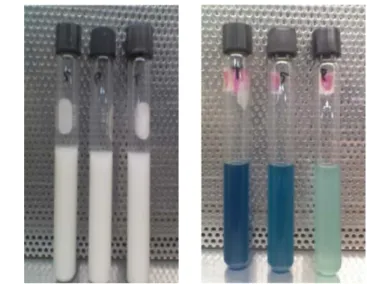
Analisis Salmonella dilakukan terhadap seluruh sampel. Analisis ini untuk mengisolasi dan meneliti terhadap keberadaan Salmonella. Analisis ini mengacu kepada metode BAM tahun 2007. Tahapan analisis Salmonella terdiri dari lima tahapan yaitu Pra pengayaan, Pengayaan selektif, isolasi Salmonella, uji biokimia awal, dan uji biokimia lanjutan. Tahap Pra pengayaan merupakan tahapan pengayaan Salmonella yang bertujuan untuk mengembalikan Salmonella yang berada dalam keadaan injury agar kembali dalam keadaan sehat serta memperkayanya. Media yang digunakan dalam tahap ini adalah Lactose Broth (LB), dimana sebanyak 25 gram sampel dimasukkan ke dalam 225 ml Lactose Broth steril. Hasil tahap Pra pengayaan yaitu dengan menginkubasi 25 gram ikan segar selama 24 ± 2 jam pada suhu 37oC pada media Lactose broth membuat media tersebut menjadi keruh. Kekeruhan ini menunjukkan adanya aktivitas mikroorganisme yang tumbuh pada media.
42 Gambar 6. Hasil inkubasi sampel homogenat ikan segar A.
Kembung. B. Gurami. C. Bawal. selama 24 ± 2 jam pada suhu 37oC pada media Lactose Broth.
Tahapan kedua dalam analisis Salmonella adalah Pengayaan selektif dimana sebanyak 1 ml hasil inkubasi Lactose Broth (LB) dimasukkan ke dalam Tetrathionate Broth (TTB) dan 0,1 ml ke dalam Rappaport Vassiliadis (RV). Masing-masing media baik Rappaport Vassiliadis (RV) maupun Tetrathionate Broth (TTB) berfungsi sebagai media penyeleksi terhadap bakteri bukan Salmonella serta sekaligus memperkaya bakteri Salmonella itu sendiri. Dalam media Rappaport Vassiliadis (RV) terdapat senyawa magnesium klorida dan malachite green dengan pH rendah (5,2 ± 2) yang berfungsi menghambat pertumbuhan mikroba alami (selective media) yang berasal dari saluran pencernaan selain Salmonella (D’Aoust, 1989). Disamping itu, Rappaport Vassiliadis (RV) mengandung soy peptone yang berfungsi sebagai sumber nitrogen, karbon, dan asam amino bagi Salmonella (Oxoid Manual, 1995) (enrichment media).
Dalam media Tetrathionate Broth (TTB), terdapat senyawa garam empedu yang berfungsi sebagai senyawa selektif yang berfungsi menghambat pertumbuhan bakteri Gram positif. Selain garam empedu, senyawa selektif lain yang terkandung dalam TTB adalah natrium tiosulfat dan tetrationat yang terbentuk akibat penambahan iodin dan kalium iodida (I2KI), dimana skedua senyawa ini berfungsi menghambat pertumbuhan bakteri koliform. Enzim tetrationat reduktase pada media TTB dapat membuat Salmonella dapat tetap
43 tumbuh yaitu denga cara meningkatkan daya tahan Salmonella terhadap efek toksik dari tetrationat (Oxoid Manual, 1995).
Keseluruhan sampel yang diuji ke tahap kedua yaitu inkubasi sampel ikan segar pada media RV dan TTB dari media LB yang telah diinkubasi membuat media menjadi keruh. Kekeruhan menunjukkan adanya aktivias mikroorganisme yang tumbuh pada media. Berdasarkan Oxoid Manual (1995) maka bakteri yang mampu tumbuh pada media RV dan TTB memiliki dugaan yang semakin kuat terhadap Salmonella.
Gambar 7. Hasil Positif Inkubasi Sampel Ikan Segar yang Berasal dari Media LB pada Media TTB (kiri) dan RV (kanan)
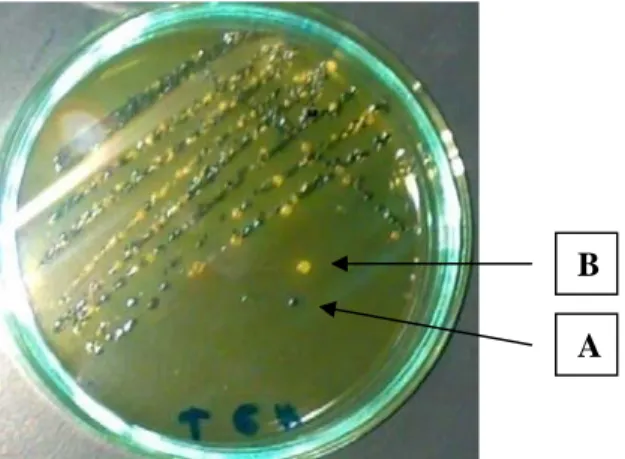
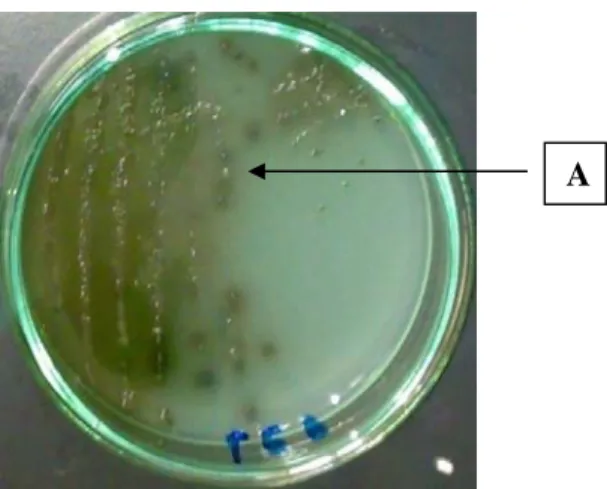
Tahap ketiga analisis Salmonella adalah isolasi Salmonella yaitu dengan menggoreskan hasil positif uji tahap dua secara kuadran ke tiga media spesifik yaitu Hektoen Enteric Agar (HEA), Xylose Desoxycholate Agar (XLDA), dan Bismuth Sulfite Agar (BSA) dan diinkubasi pada suhu 35oC selama 24±2 jam. Setelah inkubasi hasil positif akan menunjukkan tumbuhnya koloni tipikal. Koloni tipikal pada masing-masing media memiliki ciri-ciri tersendiri. Media HEA, koloni tipikal berwarna biru kehijauan dengan atau tanpa titik hitam di bagian tengahnya. Pada media XLDA, koloni tipikal berwarna merah muda dengan atau tanpa warna hitam di bagian tengahnya. Sedangkan pada media BSA, koloni tipikal berwarna coklat, abu-abu atau hitam, kadang tampak berwarna kilau metalik. Sekeliling koloni biasanya akan berwarna coklat pada
44 awalnya dan akan menjadi hitam dengan bertambahnya waktu inkubasi, yang dinamakan halo effect (BAM, 2007).
Gambar 8. Hasil Goresan Kuadran pada Media XLDA Sampel Ikan Segar yang Berasal dari Media Pengaya Selektif yang Telah Diinkubasi A. Koloni Tipikal Salmonella (Pink) dan B. Koloni Atipikal Salmonella (Kuning).
Gambar 9. Hasil Goresan Kuadran pada Media HEA Sampel Ikan Segar yang Berasal dari Media Pengaya Selektif yang Telah Diinkubasi A. Koloni Tipikal Salmonella (Hijau Muda) dan B. Koloni Atipikal Salmonella (Kuning).
B A
B A
45 Gambar 10. Hasil Goresan Kuadran pada Media BSA Sampel Ikan Segar yang Berasal dari Media Pengaya Selektif yang Telah Diinkubasi A. Koloni Tipikal Salmonella (Hijau Muda).
Berdasarkan hasil isolasi pada ketiga media, ternyata diperoleh hasil koloni tipikal terbanyak adalah sampel yang berasal dari RV yang digoreskan pada media BSA dan XLDA. Dari 29 sampel yang digores kuadran, koloni tipikal yang terbentuk sebanyak 27. Jumlah koloni tipikal yang tumbuh paling paling sedikit adalah sampel yang berasal dari RV yang digorekan pada media XLDA.
Tabel 11. Jumlah sampel terhadap koloni tipikal yang tumbuh pada media isolasi Salmonella (HEA, XLDA, BSA)
Media
XLDA BSA HEARV 4 Sampel 22 Sampel 5 Sampel
TTB 27 Sampel 27 Sampel 26 Sampel
Koloni terpilih selanjutnya diinokulasikan pada media agar miring Triple Sugar Iron Agar (TSIA) dan Lysine Iron Agar (LIA) sebagai uji biokimia awal. Pengamatan pada TSIA dan LIA diamati setelah sampel diinkubasi selama 24 jam pada suhu 35 ± 2°C. Ciri-ciri hasil positif pada TSIA ditandai dengan adanya reaksi basa pada permukaan yaitu dengan terbentuknya warna merah pada permukaan dan warna kuning pada bagian dasar dengan atau tanpa warna hitam di bagian dasar tabung dan gas pada agar (BAM, 2007). Reaksi basa merupakan hasil fermentasi Salmonella terhadap glukosa yang jumlahnya
46 terbatas dalam media. Keterbatasan ini membuat Salmonella akhirnya menggunakan pepton sebagai sumber energi yang mengakibatkan hasil sampingan berupa basa (warna merah). Warna hitam pada media mengindikasikan bahwa bakteri membentuk H2S. Hal ini disebabkan kandungan natrium tiosulfat pada agar direduksi oleh H2S yang kemudian bereaksi dengan garam besi.
Sementara itu hasil positif dari uji biokimia pada LIA memiliki ciri-ciri yaitu adanya reaksi basa pada bagian permukaan (berwarna ungu) dengan atau tanpa warna hitam pada bagian dasar tabung (menghasilkan H2S) dan gas pada agar (BAM, 2007). Reaksi basa terjadi akibat dekarboksilasi lisin menjadi amin kadaverin oleh Salmonella yang hasilnya ditunjukkan dengan berubahnya pH bromkresol ungu menjadi warna ungu.
Gambar 11. Hasil Positif Goresan Tusuk Koloni Tipikal yang Berasal dari Goresan Kuadran Media Isolasi pada Media TSIA A. (Disertai Pembentukan H2S (Hitam)) dan B. (Tanpa Disertai Pembentukan H2S).
47 Gambar 12. Hasil Positif Goresan Tusuk Koloni Tipikal yang Berasal dari
Goresan Kuadran Media Isolasi pada Media LIA A. (Disertai Pembentukan H2S (Hitam)) dan B. (Tanpa Disertai Pembentukan H2S).
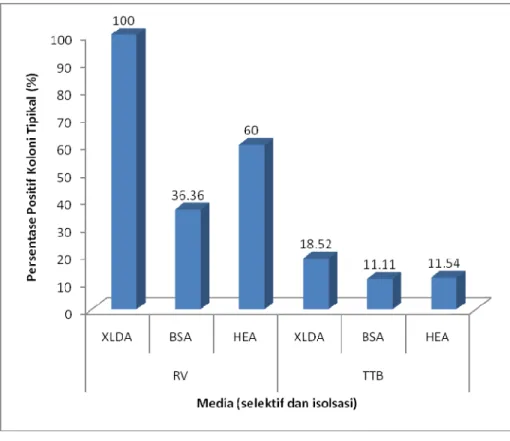
Setelah TSIA dan LIA diinkubasi, tumbuh berbagai koloni yang menghasilkan hasil uji biokimia yang berbeda-beda. Tabel 12 menunjukkan persentase koloni yang diduga positif Salmonella terhadap hasil positif uji biokimia awal pada media TSIA dan LIA. Tabel 12 memperlihatkan bahwa media selektif (RV dan TTB) yang paling banyak menghasilkan hasil positif uji biokimia adalah sampel yang ditumbuhkan pada media RV. Walaupun jumlah koloni tipikal pada media HEA, XLDA, dan BSA yang tumbuh pada media RV relatif lebih sedikit dibandingkan TTB, namun persentase hasil positif pada uji biokimia awal (TSIA dan LIA) ternyata lebih banyak. Hal ini menunjukkan bahwa selektifitas pada media RV terhadap bakteri bukan Salmonella lebih baik dibandingkan TTB. Bahkan hasil uji biokimia awal pada koloni tipikal yang berasal dari XLDA semuanya menghasilkan hasil positif (100%). Sementara dari HEA (60%), dan BSA (36.36%).
48 Tabel 12. Persentase koloni tipikal dan atipikal terhadap jumlah sampel yang tumbuh pada media isolasi serta persentase positif dugaan Salmonella setelah koloni tipikal diuji konfirmasi biokimia pada media TSIA dan LIA.
Media Tipikal Atipikal %Tipikal %Atipikal %Positif TSIA LIA %Positif TSIA LIA RV XLDA 4 29 13.79 100 4 100 BSA 22 7 75.86 24.14 8 36.36 HEA 5 29 17.24 100 3 60 TTB XLDA 27 29 93.10 100 5 18.52 BSA 27 2 93.10 6.90 3 11.11 HEA 26 29 89.65 100 3 11.54
Berbeda dengan RV, TTB merupakan Pengayaan selektif media dengan kemampuan daya tumbuh yang sangat baik untuk Salmonella. Hal ini terbukti dengan banyaknya koloni tipikal yang tumbuh pada media isolasi (XLDA, BSA, dan HEA) dari 29 sampel yang dianalisis hampir seluruhnya tumbuh koloni tipikal pada media isolasi (XLDA, BSA, dan HEA). Namun bila melihat dari hasil uji biokimia awal pada TSIA dan LIA ternyata sedikit sekali yang menunjukkan hasil positif, tidak lebih dari 20%. Hal ini menunjukkan selektifitas terhadap bakteri bukan Salmonella oleh media TTB sangat rendah namun mempunyai daya tumbuh yang sangat baik, lebih baik dibandingkan RV. Hal ini sejalan dengan hasil penelitian yang diperoleh Sylviana (2008) yang menerangkan bahwa untuk mendeteksi Salmonella pada 40 sampel karkas ayam, diketahui bahwa media RV (68,52%) lebih efektif dibandingkan dengan media TTB (23,33%).
Pada media isolasi, persentase tertinggi terhadap hasil positif uji biokimia awal adalah media Xylose Desoxycholate Agar (XLDA) baik yang berasal dari RV maupun TTB. Persentase pada XLDA yang berasal dari RV bahkan mencapai 100% sedangkan dari TTB persentasenya hanya 18.52%, walaupun demikian nilai ini adalah yang tertinggi dibandingkan yang berasal dari BSA dan HEA yang hanya bernilai 11.11% dan 11.54%. Hasil ini sesuai dengan ISO 6579 : 2002 yang menerangkan bahwa XLDA merupakan media
49 agar selektif paling utama dalam mendeteksi Salmonella. Dalam media XLDA terdapat senyawa sodium desoksikolat dan natrium tiosulfat sebagai senyawa selektif yang menghambat pertumbuhan bakteri Gram positif. Selain itu hasil ini juga menunjukkan bahwa media Pengayaan selektif yang paling baik dalam memperkaya bakteri Salmonella dan menyeleksi bakteri bukan Salmonella adalah Rappaport Vassiliadis (RV).
Gambar 13. Persentase Hasil Positif Uji Biokimia Awal Berdasarkan Koloni Tipikal yang Berasal dari Media Isolasi (HEA, XLDA, dan BSA) Setelah uji biokimia dilakukan, tahap selanjutnya adalah uji biokimia lanjutan yaitu dengan melihat hasil uji terhadap Urea Broth, uji biokimia lanjutan berfungsi untuk melihat bakteri yang terpilih apakah menghasilkan urease atau tidak. Bakteri Salmonella tidak menghasilkan urease (urease negatif) (Bell dan Kyriakides, 2003). Urease positif ditunjukkan dengan berubahnya warna Urea Broth dari kuning (pH 6,8) menjadi merah atau merah muda (pH 8,1), sementara urease negatif ditunjukkan dengan tidak adanya perubahan warna pada media (tetap kuning). Gambar 14 adalah contoh hasil
50 positif dan negarif Urea Broth setelah diinkubasi selama 24 ± 2 jam pada suhu 35oC.
Gambar 14. Hasil Inkubasi Koloni Positif TSIA atau LIA pada Media Urea Broth A. Dugaan Positif Salmonella (Kuning) dan B. Dugaan Negatif Salmonella (Pink).
Hasil uji biokimia lanjutan menunjukkan bahwa dari 26 tabung yang positif pada uji biokimia awal terdapat 20 tabung yang positif pada uji biokimia lanjutan. Hasil positif uji biokimia awal sebanyak 26 tabung berasal dari 14 sampel. Selanjutnya seluruh 26 tabung ini diuji ke tahap uji biokimia lanjutan. Hasilnya, dari 26 tabung yang diuji terdapat 20 tabung yang negatif urease sehingga disimpulkan sebagai dugaan positif Salmonella. Seluruh dugaan positif sebanyak 20 tabung ini berasal dari 9 sampel.
51 Tabel 13. Hasil positif dugaan Salmonella isolat bakteri pada uji
biokimia lanjutan (Urea Broth) terhadap isolat bakteri dugaan Salmonella uji biokimia awal (TSIA dan LIA).
Media Jumlah Tabung
Positif TSIA LIA
Jumlah Tabung Positif Urea Broth
RV XLDA 4 4 BSA 8 4 HEA 3 3 TTB XLDA 5 4 BSA 3 2 HEA 3 3
Jumlah Total Tabung 26 20
Hasil dari 20 tabung positif uji biokimia lanjutan yang berasal dari 9 sampel menunjukkan bahwa terdapat beberapa sampel yang memiliki hasil tabung positif lebih dari satu setelah diuji pada uji biokimia lanjutan. Setelah uji biokimia lanjutan, selanjutnya dilakukan uji konfirmasi spesifik terhadap bakteri Salmonella menggunakan perangkat API 20E. Namun dari 20 tabung yang positif pada uji biokimia lanjutan, dipilih 9 tabung yang mewakili masing-masing sampel. Sylviana (2008) menerangkan bahwa probabilitas tertinggi terhadap dugaan positif bakteri Salmonella adalah koloni tipikal yang berasal dari media HEA. Pembatasan mengenai jumlah sampel yang akan diuji konfirmasi API 20E adalah karena keterbatasan alat dan media yang ada. Sehingga penentuan uji konfirmasi API 20E didasarkan atas probabilitas tertingga dugaan positif bakteri Salmonella.
Selain itu, disamping didasarkan atas penelitian yang dilakukan Sylviana (2008), penentuan sampel uji yang akan dilakukan uji konfirmasi API 20E dilakukan satu uji tambahan yaitu dengan Chromogenic media, hasilnya dari 9 sampel yang diananalisis terdapat 5 sampel yang negatif dugaan Salmonella sehingga sampel yang diuji konfirmasi API 20E adalah sebanyak 4 sampel.
52 Tabel 14. Hasil uji chromegenic media terhadap isolat bekteri yang
berasal dari sampel yang diduga positif Salmonella hingga tahap uji biokimia lanjutan.
Sampel Kode Kesimpulan
Kembung GTY 6 Negatif
Gurami GTY 27 Positif
Kembung PSA J Negatif
Bawal PSB 110 Negatif
Gurami PSB 100 Positif
Kembung PSI 121 Negatif
Kembung GPJ 149 Positif
Gurami GPJ 166 Positif
Bawal GSB 137 Negatif
Ket : GTY : Giant Taman Yasmin GPJ : Giant Padjajaran GSB : Giant Sindang Barang PSA : Pasar Anyar
PSB : Pasar Bogor
Gambar 15. Hasil Positif Goresan Kuadran Koloni Dugaan Positif Salmonella yang Berasal dari Media TSIA pada Media Kromogenik setelah Inkubasi pada Suhu 37oC Selama 24 ± 2 Jam.
53 Gambar 16. Hasil Positif Goresan Kuadran Koloni Dugaan Negatif Salmonella
yang Berasal dari Media TSIA pada Media Kromogenik setelah Inkubasi pada Suhu 37oC Selama 24 ± 2 Jam.
Chromogenic media (Oxoid Salmonella Chromogenic Media II (OSCM II)) merupakan media selektif terhadap kebanyakan bakteri non-Enterobacter. Beberapa spesies bakteri Enterobacter sendiri dan sedikit bakteri lain yang mampu tumbuh pada media ini yaitu spesies yang memiliki enzim Caprylate esterase (Oxoid, 2008). Enzym Caprylate esterase hanya dimiliki oleh Klebsiella, Enterobacter, dan Proteus.
Prinsipnya, OSCM II merupakan media yang mengandung senyawa inhibigen yang terdiri dari dua komponen yaitu magenta-caprylate dan X-β-glucopyranoside. Senyawa inhibigen ini tidak toksik terhadap bakteri dan hanya dapat dipecah oleh enzim spesifik (Caprylate esterase). Ketika masuk ke dalam sel, senyawa inhibigen ini dipecah dan molekul pecahannya akan dikeluarkan dari sel (free inhibitor). Senyawa pecahan ini akan menghambat replikasi sel bakteri tersebut namun tidak membunuhnya. Selain itu, senyawa pecahan ini tidak dapat diambil oleh bakteri lain (Oxoid, 2008).
Perbedaan Salmonella dengan bakteri lain yang mampu tumbuh pada media OSCM II adalah metabolisme dari senyawa inhibigen tersebut (magenta-caprylate dan X-β-glucopyranoside). Enzim Caprylate esterase pada Salmonella akan memecah senyawa inhibigen dan melepaskannya sebagai purple chromophore sehingga sel Salmonella yang tumbuh akan berwarna ungu. Berbeda dengan bakteri bukan Salmonella, bakteri ini akan memecah X-β-glucopyranoside sebagai β-glucosidase yang menyebabkan warna biru atau
54 biru tua. Sehingga koloni bukan Salmonella yang tumbuh akan berwarna biru atau biru tua (Oxoid, 2008).
Sampel yang telah ditentukan sebagai dugaan terbesar terhadap bakteri Salmonella selanjutnya disimpan dalam media Nutrient Agar (NA) miring sebagai kultur yang siap dianalisis. Penyimpanan kultur dilakukan pada suhu rendah, yaitu disimpan dalam refrigerator. Selama uji konfirmasi belum dilakukan, kultur disegarkan kembali ke dalam media Nutrient Agar (NA) miring setiap dua minggu.
4. Hasil Uji Konfirmasi API 20E
Uji API 20E merupakan metode uji konfirmasi lanjutan untuk menentukan secara spesifik spesies suatu bakteri. Uji API 20E merupakan uji yang dilakukan untuk mengidentifikasi bakteri enterik batang gram negatif. Setiap strip terdiri dari 20 kompartemen yang harus diisi dengan suspensi bakteri (BAM, 2008). Setelah inkubasi, setiap kompartemen/tabung akan mengalami perubahan warna akibat adanya perubahan pH. Beberapa tabung membutuhkan reagen tertentu untuk mengidentifikasinya (BAM, 2008).
Sampel uji sebanyak empat tabung, masing-masing digores ke dalam media Nutrient Agar (NA) cawan terlebih dahulu untuk mendapat koloni terpisah. Setelah itu sebanyak ± 3 koloni diambil dan dimasukkan ke dalam 5 ml larutan fisiologis. Selanjutnya pengencer tersebut dimasukkan ke dalam setiap tabung pada strip API 20E dan diinkubasi pada suhu 35oC selama 24 ± 2 jam. Beberapa tabung tertentu diberi reagen tersendiri setelah inkubasi sebelum pengamatan dan dibiarkan selama 10 menit. Gambar 17 menunjukkan hasil uji API 20E setelah inkubasi dan pemberian reagen.
Gambar 17. Hasil Positif Salmonella spp. Sampel Ikan Segar (Atas) dan Hasil Negatif
Salmonella spp. Sampel Ikan Segar (Bawah) setelah Inkubasi pada Suhu
55 Berdasarkan hasil pengujian menggunakan software terhadap hasil pengamatan sampel setelah uji API 20E. Pengujian terhadap empat sampel, tiga diantaranya positif Salmonella dengan tingkat kemurnian yang tinggi. Sampel dengan kode 100, 149, dan 166 positif Salmonella spp. dengan tingkat kemurnian masing-masing sebesar 88.8%, 89.4%, dan 95.1%. Dari keempat sampel yang diuji seluruhnya termasuk ke dalam excellent identification karena persentase kemurnian yang diperoleh sangat tinggi walaupun satu diantaranya bukan Salmonella spp. Berikut tabel 15 menunjukkan persentase hasil uji konfirmasi API 20E.
Tabel 15. Kesimpulan hasil identifikasi API 20E terhadap sampel dugaan positif Salmonella.
Sumber Kode Sampel Hasil Identifikasi Persentase Identifikasi (%)
Gurami GTY 27 Pseudomonas aeruginosa 96.6
Gurami PSB 100 Salmonella spp. 88.8
Kembung GPJ 149 Salmonella spp. 89.4
Gurami GPJ 166 Salmonella spp. 95.1
Ket : GTY : Giant Taman Yasmin GPJ : Giant Padjajaran PSB : Pasar Bogor
Hasil isolasi Salmonella spp. dari keempat sampel yang diuji ternyata hasil positif Salmonella lebih banyak berasal dari pasar modern (supermarket), padahal bila dilihat dari segi sanitasi dan higienitas pasar tradisional jauh lebih buruk dibandingkan dengan pasar modern (supermarket). Kemungkinan ini didasarkan atas beberapa faktor yaitu bahwa kondisi yang menyebabkan terhambatnya pertumbuhan bakteri Salmonella spp. oleh bakteri lain sangat rendah seperti adanya bakteri-bakteri pembusuk dan bakteri asam laktat yang merupakan salah satu faktor penghambat pertumbuhan Salmonella. Ray (2001) menjelaskan bahwa bakteri Salmonella tidak dapat berkompetisi secara baik dengan bakteri-bakteri yang umum terdapat di dalam makanan. Pada pasar tradisional cemaran bakteri
56 lain sangat tinggi dibandingkan dengan pasar modern. Hal ini terbukti dalam penelitian sebelumnya mengenai total mikroba dimana dari keseluruhan sampel yang diuji rata-rata total mikroba pada sampel yang berasal dari pasar tradisional semuanya lebih tinggi dari pasar modern (supermarket).
B. PENELITIAN TAHAP II (Pengaruh Pengukusan Terhadap Salmonella dan Total Mikroba)
1. Total Mikroba Bumbu Pepes
Bumbu pepes merupakan bahan yang ditambahkan untuk meningkatkan citarasa. Bumbu pepes terdiri dari rempah-rempah yang memiliki senyawa antimikroba dan bersifat fungisidal (membunuh kapang), fungistatik (menghambat pertumbuhan kapang), bakterisidal (membunuh bakteri), bakteristatik (menghambat pertumbuhan bakteri) dan sebagainya (Fardiaz et al, 1987). Bumbu pepes yang diambil sebagai sampel adalah bumbu pepes curah yang umum dijual di pasar tradisional. Sampel diuji sebanyak tiga kali ulangan dimana setiap ulangan dilakukan pengenceran sebanyak dua kali (duplo). Analisis yang dilakukan adalah analisis kuantitatif total mikroba (AOAC, 1990).
Hasil pengujian menunjukkan rata-rata total mikroba bumbu pepes adalah sebesar 6.75 log cfu/gram. Pada ulangan pertama diperoleh total mikroba sebesar 6.81 log cfu/gram, pada ulangan kedua sebesar 6.04 log cfu/gram, dan pada ulangan ketiga sebesar 6.97 log cfu/gram. Tabel 16 menunjukkan hasil pengujian total mikroba bumbu pepes.
Tabel 16. Hasil pengujian total mikroba bumbu pepes
Sampel Ulangan Total Mikroba
(cfu/gram) Bumbu I 6.4 x 106 II 1.1 x 106 III 9.4 x 106 Rata-rata 5.6 x 106 Log Rata-rata 6.75
57 2. Ketahanan Bakteri Salmonella terhadap Proses Pengukusan
Sampel yang digunakan sebagai uji ketahanan Salmonella terhadap proses pengukusan adalah ikan kembung. Ikan kembung merupakan ikan yang umum dijadikan ikan pepes dibandingkan gurami dan bawal. Selain itu, ikan kembung juga hanya merupakan sampel indikator uji terhadap perlakuan. Perlakuan yang diujikan terhadap uji ketahanan bakteri Salmonella adalah dengan penambahan bumbu dan tanpa penambahan bumbu pepes setelah sebelumnya ikan dikontaminsi terlebih dahulu dengan kultur murni bakteri Salmonella dengan tingkat kontaminsi tinggi 105 cfu/gram. Kontaminasi dilakukan dengan cara melumuri ikan dengan cairan bakteri pengkontaminasi lalu dibiarkan selama 30 menit untuk memberi kesempatan kepada bakteri agar menempel pada sampel (Sylviana, 2008).
Perlakuan terhadap proses pengukusan dilakukan selama 30 menit dimulai pada menit ke-0 selanjutnya pengujian dilakukan setiap interval 15 menit yaitu dari menit ke-0, hingga menit ke-30. Pengukusan dilakukan setelah suhu air kukusan sudah mendidih dan mengeluarkan uap sehingga ikan yang di masukkan adalah ikan yang masuk ke dalam sistem pengolahan yang sudah bersuhu 100oC. Pengujian dilakukan sebanyak tiga kali ulangan dan masing-masing analisis adalah duplo. Analisis kuantitatif Salmonella dilakukan dengan menumbuhkannya pada media agar Hektoen Enteric Agar (HEA). HEA merupakan media tumbuh bakteri Salmonella yang paling baik dalam menumbuhkan Salmonella (Sylviana, 2008).
Salmonella yang tumbuh pada media agar Hektoen Enteric Agar (HEA) adalah Salmonella dengan ciri-ciri koloni tipikal yang tumbuh sesuai dengan ciri-ciri koloni tipikal kultur murni pengkontaminasi. Kesesuaian ini menunjukkan Salmonella yang tumbuh merupakan Salmonella yang berasal dari kultur pengkontaminasi sehingga penurunan jumlah Salmonella pengkontaminasi dapat dihitung. Selain itu, pada dasarnya Salmonella tidak dapat berkompetisi secara baik dengan bakteri-bakteri yang umum terdapat di dalam makanan (Ray, 2001). Oleh karena itu bakteri Salmonella yang berasal dari dalam bahan pangan untuk pengujiannya membutuhkan media pengaya terlebih dahulu. Bakteri koloni tipikal yang tumbuh pada media dapat
58 dipastikan merupakan bakteri Salmonella yang berasal dari kultur pengkontaminasi. Adapun ciri-ciri koloni tipikal kultur pengkontaminasi adalah berwarna hijau muda dengan titik hitam dibagian tengahnya.
Pada perlakuan tanpa bumbu, jumlah Salmonella setelah kontaminasi (menit ke-0) rata-rata berjumlah 4.62 log cfu/gram. Namun setelah dikukus dan dianalisis secara kuantitatif Salmonella sudah tidak ada hingga pengenceran terendah. Pada menit ke-15 dan ke-30 tidak terdapat satupun koloni tipikal yang tumbuh. Tabel 17 menunjukkan hasil pengujian terhadap jumlah Salmonella setelah pengukusan.
Tabel 17. Hasil analisis kuantitatif Salmonella sampel ikan tanpa bumbu pada setiap waktu pengukusan.
Waktu Pengukusan (menit)
Total Salmonella (cfu/gram) Rata-rata (cfu/gram) Ulangan I Ulangan II Ulangan III
0' 3.1 x 104 < 1 x 104 5.2 x 104 4.2 x 104 15' < 1 x 101 < 1 x 101 < 1 x 101 < 1 x 101 30' < 1 x 101 < 1 x 101 < 1 x 101 < 1 x 101
Berdasarkan hasil analisis dapat diketahui bahwa pengukusan sejak 15 menit pertama sudah tidak ada lagi koloni tipikal yang tumbuh padahal jumlah total Salmonella awal setelah kontaminasi mencapai 4.2 x 104 cfu/gram. Suhu pengukusan yang dilakukan mencapai 100oC, suhu ini cukup untuk membunuh Salmonella. Matches dan Liston (1968) dalam (Jay et al, 2005) melaporkan bahwa Salmonella sensitif terhadap panas sehingga dapat mati pada suhu pasteurisasi. Data ini menunjukkan bahwa penurunan Salmonella secara kuantitatif dapat terlihat sejak 15 menit pertama pengukusan. Menit ke-15 dan ke-30 sudah tidak ada lagi satupun koloni tipikal yang tumbuh. Terlebih lagi bila pengukusan dilakukan lebih lama.
Secara kuantitatif, tidak terdapatnya bakteri Salmonella yang tumbuh diduga karena limit deteksi terhadap metode analisis kuantitatif yang digunakan. Kemungkinan ini didasarkan atas tidak terambilnya sel Salmonella dalam pengencer saat akan diplating atau diambil untuk pengenceran
59 berikutnya. Hal ini karena Salmonella yang ada jumlah sudah sangat sedikit akibat proses perlakuan pengukusan. Berdasarkan hasil penelitian yang telah dilakukan oleh Trivedi et al, (2008) bahwa proses steam yang umum dilakukan di rumah tangga mampu menurunkan total bakteri Listeria monocytogenes sebanyak 7.61-3.23 log cfu/cm2 dengan lama waktu steam yang dilakukan adalah 30-180 detik. Penelitian Trivedi et al, (2008) adalah dengan cara melakukan mengkontaminasi kulit pada daging babi dengan kultur bakteri Listeria monocytogenes sebanyak 7.61-5.75 log cfu/cm2.
Selain itu, dugaan lain adalah bahwa baketri Salmonella belum sepenuhnya mati melainkan dalam keadaan injury sehingga analisis kualitatif perlu dilakukan. Uji kualitatif yang dilakukan adalah uji terhadap sampel yang memiliki dugaan tertinggi terhadap masih adanya Salmonella injury. Sampel yang ambil untuk uji kualitatif adalah sampel yang mengalami perlakuan pengukusan untuk waktu yang paling singkat yaitu pada 15 menit pertama pengukusan. Analisis kualitatif yang dilakukan meliputi tahap Pra pengayaan, Pengayaan selektif, Agar selektif, dan uji biokimia sebanyak tiga kali ulangan.
Tabel 18. Hasil goresan kuadran isolat bakteri sampel ikan tanpa bumbu pada media Agar selektif setelah dikukus selama 15 menit.
Analisis kualitatif hingga tahap Agar selektif hampir tidak menunjukkan adanya bakteri. Bahkan goresan pada Agar selektif yang berasal dari media TTB tidak ada satupun koloni yang tumbuh baik tipikal maupun atipikal. Sementara goresan yang berasal dari media RV pada dua kali ulangan tumbuh
Ulangan Media RV TTB
I
BSA Steril Steril HEA Steril Steril XLDA Tipikal (Pink tanpa titik hitam); kode (1) Steril
II
BSA Steril Steril HEA Steril Steril XLDA Steril Steril
III
BSA Steril Steril HEA Atipikal Steril XLDA Atipikal dan Tipikal (Pink tanpa titik hitam); kode (2) Steril
60 koloni tipikal. Hasil ini masih perlu diuji lagi pada tahap uji biokimia pada media TSIA dan LIA miring. Tabel 19 menunjukkan hasil uji biokimia.
Tabel 19. Hasil uji biokimia koloni tipikal sampel ikan tanpa bumbu.
Sampel Kode
TSIA LIA Dugaan Atas Bawah Gas H2S Atas Bawag Gas H2S
U I 1 B A - - B B - - +
U III 2 A A - - B A - - -
Ket : A : Asam (Kuning pada TSIA; Merah pada LIA) B : Basa (Merah pada TSIA; Ungu pada LIA)
Hasil uji biokimia menunjukkan adanya hasil positif pada satu sampel yaitu pada ulangan pertama. Dari tiga kali ulangan yang dilakukan terdapat satu ulangan yang positif. Persentase keberadaan Salmonella hingga 15 menit waktu pengukusan adalah sebesar 33.33%, sehingga untuk 15 menit selanjutnya sudah dapat dipastikan bahwa ikan pepes aman terhadap bakteri patogen Salmonella.
Uji kualitatif ini juga menunjukkan bahwa media Pengayaan selektif yang paling baik dalam memperkaya bakteri Salmonella dan menyeleksi bakteri bukan Salmonella adalah Rappaport Vassiliadis (RV). Sementara itu, media selektif yang baik dalam menumbuhkan bakteri Salmonella adalah Xylose Desoxycholate Agar (XLDA). Hal ini terbukti dengan tumbuhnya bakteri baik tipikal maupun atipikal hanya pada XLDA.
Perlakuan yang kedua adalah dengan penambahan bumbu. Bumbu ditambahkan ke ikan setelah ikan dikontaminasi dengan kultur murni Salmonella sebanyak ± 105 cfu/gram dan dibiarkan selama 30 menit untuk memberi kesempatan kepada bakteri untuk menempel pada sampel (Sylviana, 2008). Penambahan bumbu terhitung sebagai menit ke-0 pengukusan selanjutnya sampel dianalisis total Salmonella-nya setiap interval 15 menit hingga menit ke-30.
Pada perlakuan dengan bumbu, jumlah Salmonella setelah kontaminasi (menit ke-0) rata-rata berjumlah 2.72 log cfu/gram. Namun setelah dikukus dan dianalisis secara kuantitatif Salmonella tidak ada hingga pengenceran terendah. Pada menit ke-15 dan ke-30 tidak terdapat satupun koloni tipikal yang tumbuh.
61 Tabel 20 menunjukkan hasil pengujian terhadap jumlah Salmonella setelah pengukusan.
Tabel 20. Hasil analisis kuantitatif Salmonella sampel ikan dengan
bumbu pada setiap waktu pengukusan.
Waktu Pengukusan (menit)
Total Salmonella (cfu/gram) Rata-rata (cfu/gram) Ulangan I Ulangan II Ulangan III
0' 3.4 x 102 5.7 x 102 6.5 x 102 5.2 x 102 15' < 1 x 101 < 1 x 101 < 1 x 101 < 1 x 101 30' < 1 x 101 < 1 x 101 < 1 x 101 < 1 x 101
Berdasarkan hasil analisis dapat diketahui bahwa pada perlakuan dengan bumbu ini pun, pengukusan sejak 15 menit pertama sudah tidak terdapat koloni tipikal yang tumbuh padahal jumlah total Salmonella awal setelah kontaminasi mencapai 5.2 x 102 cfu/gram. Suhu pengukusan yang dilakukan mencapai 100oC, suhu ini cukup untuk membunuh Salmonella. Matches dan Liston (1968) dalam (Jay et al, 2005) melaporkan bahwa Salmonella sensitif terhadap panas sehingga dapat mati pada suhu pasteurisasi.
Data ini menunjukkan bahwa penurunan Salmonella secara kuantitatif dapat terlihat sejak 15 menit pertama pengukusan. Menit ke-15 dan ke-30 sudah tidak ada lagi satupun koloni tipikal yang tumbuh. Terlebih lagi bila pengukusan dilakukan lebih lama. Sama seperti analisis sebelumnya, tidak adanya bakteri Salmonella yang tumbuh tidak berarti Salmonella sepenuhnya mati, dugaan terhadap adanya bakteri Salmonella injury dan faktor limit deteksi menjadi bahan pertimbangan. Uji kualitatif dilakukan pada sampel yang diduga paling tinggi probabilitasnya terhadap keberadaan Salmonella injury yaitu pada menit ke-15 pengukusan. Analisis kualitatif yang dilakukan meliputi tahap Pra pengayaan, Pengayaan selektif, Agar selektif, dan uji biokimia sebanyak tiga kali ulangan.
62 Tabel 21. Hasil goresan kuadran isolat bakteri sampel ikan dengan
bumbu pada media Agar selektif setelah dikukus selama 15 menit.
Ulangan Media RV TTB
I
BSA Steril Steril HEA Atipikal dan Tipikal (Hijau muda tanpa titik hitam); kode (3) Steril XLDA Atipikal dan Tipikal (Pink tanpa titik hitam); kode (4) Steril
II
BSA Steril Steril HEA Steril Steril XLDA Atipikal Steril
III
BSA Steril Steril HEA Steril Steril XLDA Steril Steril Pada perlakuan dengan bumbu juga menunjukkan hasil yang serupa, analisis kualitatif hingga tahap Agar selektif, hampir tidak menunjukkan adanya bakteri. Bahkan goresan pada Agar selektif yang berasal dari media TTB tidak ada satupun koloni yang tumbuh baik tipikal maupun atipikal. Sementara goresan yang berasal dari media RV pada dua kali ulangan masih terdapat bakteri yang tumbuh namun salah satunya hanya berupa koloni atipikal. Hasil ini masih perlu diuji lagi pada tahap uji biokimia dengan media TSIA dan LIA miring.
Tabel 22. Hasil uji biokimia koloni tipikal sampel ikan tanpa dengan bumbu.
Sampel Kode
TSIA LIA Dugaan Atas Bawah Gas H2S Atas Bawah Gas H2S
U I 3 A A - - B A - - -
U I 4 A A - - B B - - -
Ket : A : Asam (Kuning pada TSIA; Merah pada LIA) B : Basa (Merah pada TSIA; Ungu pada LIA)
63 Berbeda dengan perlakuan tanpa bumbu, perlakuan dengan bumbu ternyata tidak ada satupun hasil uji yang menunjukkan hasil positif terhadap uji biokimia. Dari dua koloni tipikal yang tumbuh baik pada media HEA maupun XLDA, keduanya menghasilkan hasil negatif pada TSIA. Hal ini menunjukkan bahwa bumbu memiliki pengaruh tersendiri dalam menghambat bakteri Salmonella. Bumbu pepes terdiri dari rempah-rempah yang memiliki senyawa antimikroba dan bersifat fungisidal (membunuh kapang), fungistatik (menghambat pertumbuhan kapang), bakterisidal (membunuh bakteri), bakteristatik (menghambat pertumbuhan bakteri) dan sebagainya (Fardiaz et al, 1987). Senyawa-senyawa bakterisidal dan bakteristatik inilah yang membunuh dan menghambat pertumbahan bakteri Salmonella.
Pada perlakuan ini juga menunjukkan bahwa media RV dan XLDA memiliki kemampuan daya tumbuh dan selektifitas yang lebih baik dibandingkan media lainnya. Berbeda dengan Sylviana (2008) yang menyatakan bahwa media yang paling baik dalam menumbuhkan Salmonella adalah HEA.
Untuk kedua perlakuan diatas terdapat kesamaan mengenai perhitungan tingkat kematian Salmonella. Sanchez dan Thippareddi (2003) mengemukakan bahwa letalitas standar yang dibutuhkan dalam destruksi Salmonella pada produk daging adalah sebesar 6.5 log. Selain itu, disebutkan juga parameter destruksi termal berupa nilai D60oC dan nilai Z untuk produk daging. Dimana untuk daging yang kaya akan lemak, maka nilai D60oC adalah sebesar 1.58 menit dan nilai Z sebesar 5.56oC. sehingga dari data ini dapat diperoleh nilai D100oC sebesar 6.5 melalui persamaan :
D = Do 10{((Tref-T)/Z)}
Keterangan : D = Nilai D pada suhu tertentu (menit) Do = Nilai D pada suhu standar (referensi)
Tref = Suhu standar yang digunakan untuk niai Do (oF atau oC) T = Suhu pemanasan tertentu (oF atau oC)
64 Dari persamaan diatas dapat diperoleh nilai D100oC sebesar :
D100oC = D60oC 10{((60-T)/Z)} D100oC = 1.58 10{((60-100)/5.56)} D100oC = 1.58 10-7.194 D100oC = 1.01 10-7 menit
Hasil ini menunjukkan bahwa untuk menurunkan Salmonella sebanyak 90% (1 Log) membutuhkan waktu 1.01 10-7 menit. Namun Sanchez dan Thippareddi (2003) mengemukakan bahwa letalitas standar yang dibutuhkan dalam destruksi Salmonella pada produk daging adalah sebesar 6.5 log, itu artinya perlakuan terhadap bahan produk daging yang dilakukan harus mampu menurunkan Salmonella hingga 6.5 Log. Sehingga waktu yang dibutuhkan untuk menurunkan Salmonella sebanyak 6.5 adalah :
t100 = D100 x log = 1.01 10-7 x 6.5 = 6.56 10-7 menit
Hasil ini menggambarkan bahwa waktu yang dibutuhkan untuk menurunkan Salmonella sebanyak 6.5 log pada suhu 100oC adalah 6.56 10-7 menit yaitu untuk proses pengukusan. Nilai yang diperoleh diasumsikan bakteri Salmonella yang ada pada sampel menempel hanya pada permukaan karena proses kontaminasi yang dilakukan adalah pelumuran cairan kontaminasi. Selain itu, asumsi lain yang digunakan adalah ikan yang dimasukkan ke dalam proses pengukusan sudah mencapai 100oC, karena suhu sistem dalam pengolahan kukus diatur terlebih dahulu hingga mencapai 100oC.
3. Pengaruh Pengukusan Terhadap Kualitas Mikrobiologi Total Mikroba Ikan
Kualitas mikrobiologi suatu bahan pangan secara umum dapat diketahui dengan menganalisis total mikrobanya. Setiap bahan pangan memiliki batas maksimal yang berbeda terhadap nilai batas amannya, baik bahan mentah
65 maupun olahan. Center for Food Safety (CFS) (2007) menjelaskan dalam Guidelines for the microbiological quality of various ready-to-eat foods bahwa hasil olahan ikan (cooked) digolongkan sebagai kategori 3 dimana hasil olahan ikan (cooked) untuk hasil yang sangat baik (Satisfactory) jika jumlah total mikrobanya adalah sebanyak ≤105 cfu, dan untuk nilai yang masih dapat diterima (Acceptable) jika total mikrobanya berjumlah 105 - <106 cfu. Uji total mikroba dihitung dengan menggunakan metode AOAC tahun 1990.
Perlakuan terdiri dari dua yaitu tanpa penambahan bumbu dan dengan penambahan bumbu. Pertama ikan dipersiapkan terlebih dahulu sebanyak delapan ekor yang dibeli dari tempat dan waktu yang sama sehingga dapat diasumsikan total mikroba yang ada pada sampel kurang lebih sama. Delapan sampel ini mewakili setiap menit pengukusan termasuk menit ke-0 dan tanpa kontaminasi. Selanjutnya, pada masing-masing perlakuan, setiap sampel dikukus selama 90 menit dimana pengujian total mikroba dilakukan setiap interval 15 menit sejak menit ke-0 setelah kontaminasi hingga menit ke-90.
Untuk perlakuan tanpa penambahan bumbu, sebelum dikukus ikan terlebih dahulu dianalisis total mikroba awalnya. Setelah itu ikan dikontaminasi dengan kultur murni bakteri Salmonella, dibiarkan 30 menit dan dikukus selama 90 menit. Analisis total mikroba terhadap suatu sampel adalah tertentu dan spesifik. Dari tiga kali ulangan terhadap analisis total mikroba ikan tanpa bumbu yang dilakukan, rata-rata total mikroba ikan yang diperoleh adalah sebanyak 3.2 x 107 cfu/gram atau sebanyak 7.51 log cfu/gram. Jumlah ulangan analisis total mikroba terhadap ikan juga sama pada setiap waktu pengukusan yang dilakukan.
66 Tabel 23. Total mikroba awal ikan tanpa bumbu
Sampel Ulangan Total Mikroba (cfu/gram)
Ikan kembung I 9.4 x 107 II 6.2 x 105 III 1.6 x 106 Rata-rata 3.2 x 107 Log rata-rata 7.51
Pengukusan menyebabkan penurunan sejumlah mikroba. Pengukusan yang dilakukan berkisar antara suhu 99-101 oC. Panas ini dapat menyebabkan sejumlah mikroba mati. Tabel 24 menunjukkan hasil analisis total mikroba terhadap proses pengukusan.
Tabel 24. Total mikroba ikan tanpa bumbu setelah proses pengukusan
Waktu Pengukusan (menit)
Total Mikroba (cfu/gram) Rata-rata (cfu/gram) Ulangan I Ulangan II 0' 6.0 x 108 1.7 x 106 3.0 x 107 15' < 2.5 x 102 1.7 x 105 1.7 x 105 30' 5.1 x 102 1.8 x 103 1.2 x 103 45' 4.5 x 103 6.6 x 102 2.6 x 103 60' 2.9 x 102 < 2.5 x 102 2.9 x 102 75' 8.8 x 102 6.4 x 102 7.6 x 102 90' < 2.5 x 103 < 2.5 x 102 < 2.5 x 102
Berdasarkan tabel diatas dapat diketahui bahwa semakin lama waktu pengukusan maka semakin rendah total mikrobanya. Pemanasan pada 30 menit pertama, penurunan total mikroba sangat signifikan, yaitu mencapai 2 log koloni selanjutnya penurunun total mikroba relatif stabil dan perlahan hingga menit ke-90. Terjadi sedikit kenaikan pada beberapa analisis, hal ini mungkin
67 karena ikan yang digunakan untuk analisis pada menit ke-45 dan menit ke-75 jumlah mikroba awalnya sedikit lebih banyak.
Gambar 18. Grafik penurunan total mikroba sampel ikan tanpa bumbu pada setiap waktu pengukusan.
Berdasarkan CFS (2007) maka hasil pengukusan selama 15 menit ikan tanpa bumbu, kualitas ikan tersebut adalah Acceptable. Hal ini didasarkan atas total mikroba yang terkandung pada ikan yaitu sebanyak 1.7 x 105 cfu/gram (105 - <106 cfu/gram). Berbeda dengan waktu pengukusan mulai 30 menit dan selanjutnya dimana total mikroba ikan < 105 cfu/gram. Jumlah ini jika mengacu pada CFS (2007) maka kualitas ikan tersebut adalah Satisfactory.
Pada perlakuan dengan penambahan bumbu, rata-rata total mikroba awal sampel ikan juga sama yaitu tertentu dan spesifik. Analisis terhadap total mikroba yang dilakukan sebanyak tiga kali ulangan yang dilakukan rata-rata total mikrobanya adalah sebesar 2.4 x 105 cfu/gram atau 5.38 log cfu/gram. Setelah itu sampel dikontaminasi dan dibiarkan selama 30 menit. Selanjutnya ikan diberi bumbu masing-masing sebanyak 25 gram dan dikukus hingga 90 menit. Jumlah ulangan analisis total mikroba terhadap sampel ikan juga sama untuk setiap perlakuan selanjutnya.
68 Tabel 25. Total mikroba awal ikan dengan bumbu
Sampel Ulangan Total Miroba
(cfu/gram) I 1.22 x 105 Ikan kembung II 4.7 x 105 III 1.3 x 105 Rata-rata 2.4 x 105 Log rata-rata 5.38
Selama masa pengukusan, sampel dianalisis total mikrobanya setiap interval 15 menit. Analisis dilakukan dengan cara mengambil sampel yang mewakili waktu pengkusan masing-masing. Hasilnya, penurunan total mikroba terjadi dengan semakin lamanya waktu pengukusan. Tabel 26 menunjukkan hasil analisis total mikroba pada setiap waktu pengukusan.
Tabel 26. Total mikroba ikan dengan bumbu setelah proses pengukusan
Waktu pengukusan (menit)
Total mikroba (cfu/gram) Rata-rata (cfu/gram) Ulangan I Ulangan II Ulangan III
0' 3.5 x 106 8.5 x 105 3.5 x 106 2.6 x 106 15' 4.3 x 102 < 2.5 x 102 6.6 x 103 3.5 x 103 30' < 2.5 x 102 < 2.5 x 102 2.8 x 103 2.8 x 103 45' 8.2 x 102 < 2.5 x 102 < 2.5 x 102 8.2 x 102 60' 2.9 x 102 5.2 x 102 4.2 x 102 4.1 x 102 75' < 2.5 x 102 < 2.5 x 102 < 2.5 x 102 < 2.5 x 102 90' < 2.5 x 102 < 2.5 x 102 < 2.5 x 102 < 2.5 x 102
Berdasarkan tabel diatas dapat diketahui bahwa semakin lama waktu pengukusan maka semakin rendah total mikrobanya. Bahkan Pada 15 menit pertama penurunan total mikroba sudah sangat signifikan, hingga mencapai 3
69 log koloni selanjutnya penurunan mikroba relatif stabil dan perlahan hingga menit ke-90. Pada menit ke-75 dan ke-90 menit pengukusan, total mikrobanya sudah mencapai kurang dari 25 x 101 cfu. Jumlah ini sangat baik sebagai jumlah total mikroba. Gambar 19 menunjukkan grafik penurunan total mikroba.
Gambar 19. Grafik penurunan total mikroba sampel ikan dengan bumbu setiap waktu pengukusan.
Berdasarkan grafik diatas, dapat diketahui bahwa sampel dengan penambahan bumbu secara mikrobiologis sudah baik pada menit ke-15 pengukusan dengan jumlah total mikroba sebesar 3.5 x 103 cfu/gram. Penurunan total mikroba dari menit ke-0 hingga menit ke-15 pengukusan mencapai 3 log koloni. Jumlah ini sangat besar bila dibandingkan dengan perlakuan sebelumnya yang hanya menurunkan 2 log koloni. Hal ini menunjukkan bahwa bumbu memiliki pengaruh yang baik dalam menurunkan total mikroba. Rempah-rempah memiliki senyawa antimikroba dan bersifat fungisidal (membunuh kapang), fungistatik (menghambat pertumbuhan kapang), bakterisidal (membunuh bakteri), bakteristatik (menghambat pertumbuhan bakteri) dan sebagainya (Fardiaz et al, 1987).
Pada kedua perlakuan diatas, masing-masing memiliki waktu pengukusan tersendiri untuk menrunkan sejumlah log mikroba tertentu. Dimana untuk perlakuan tanpa bumbu ternyata setiap 15 menit pengukusan mampu menurunkan total mikroba sebanyak 2 log koloni hingga 30 menit pengukusan. Sehingga pada penelitian ini dimana total mikroba rata-ratanya setelah tiga kali ulangan adalah sebesar 4.2 x 107 cfu/gram maka untuk
70 mencapa kategori Satisfactory berdasarkan CFS (2007) dibutuhkan waktu pengukusan selama 30 menit (≤ 5 x 105 atau 5.70 log cfu/gram).