INTERKALASI BENZALKONIUM KLORIDA (BKC) KE
DALAM BENTONIT TERAKTIVASI ASAM SULFAT
SEBAGAI ADSORBEN ANION Cr(VI)
Skripsi
disusun sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
Program Studi Kimia
oleh Yulianti 4311412003
JURUSAN KIMIA
FAKULTAS METEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS NEGERI SEMARANG
2016
ii
PERNYATAAN
Saya menyatakan bahwa yang tertulis dalam Skripsi ini bebas plagiat, dan apabila dikemudian hari terbukti terdapat plagiat dalam skripsi ini, maka saya bersedia menerima sanksi sesuai ketentuan peraturan perundang-undangan.
Semarang, Juni 2016
Yulianti 4311412003
iii
PERSETUJUAN PEMBIMBING
Skripsi ini telah disetujui oleh pembimbing untuk diajukan ke Sidang Panitia Ujian Skripsi Jurusan Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Negeri Semarang.
Semarang, Mei 2016
Pembimbing I Pembimbing II
Agung Tri Prasetya, S.Si.,M.Si. Dra. Woro Sumarni, M.Si. 196904041994021001 196507231993032001
iv
PENGESAHAN
Skripsi yang berjudul
Interkalasi Benzalkonium Klorida (BKC) ke dalam Bentonit Teraktivasi Asam Sulfat sebagai Adsorben Anion Cr(VI)
disusun oleh Yulianti 4311412003
sudah dipertahankan dihadapan sidang Panitia Ujian Skripsi FMIPA Universitas Negeri Semarang pada tanggal 8 Juni 2016
Panitia:
Ketua Sekretaris
Prof. Dr. Zaenuri, S.E, M.Si,Akt Dr. Nanik Wijayati, M.Si.
196412231988031001 196910231996032002
Ketua Penguji
Dr. Jumaeri, M.Si. 196210051993031002
Anggota Penguji/ Anggota Penguji/
Pembimbing Utama Pembimbing Pendamping
Agung Tri Prasetya, S.Si.,M.Si. Dra. Woro Sumarni, M.Si. 196904041994021001 196507231993032001
v
MOTTO DAN PERSEMBAHAN
MOTTO
Man jadda wajada, selama kita bersungguh-sungguh, maka kita akan memetik buah yang manis. Segala keputusan hanya ditangan kita sendiri, kita mampu untuk itu (B. J. Habibie)
PERSEMBAHAN
Skripsi ini aku persembahkan untuk: Bapak, Ibu, dan kakakku tercinta
vi
PRAKATA
Puji dan syukur penulis panjatkan kehadirat Allah SWT yang telah melimpahkan rahmat dan hidayah-Nya sehingga penulis dapat menyelesaikan Skripsi dengan judul Interkalasi Benzalkonium Klorida (BKC) ke dalam Bentonit Teraktivasi Asam Sulfat sebagai Adsorben Anion Cr(VI).
Dalam kesempatan ini penulis mengucapkan terima kasih kepada semua pihak yang telah membantu penulis dalam melaksanakan penelitian dan penyusunan Skripsi. Ucapan terima kasih penulis sampaikan kepada:
1. Rektor Universitas Negeri Semarang,
2. Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Negeri Semarang,
3. Ketua Jurusan Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Negeri Semarang,
4. Koordinator Prodi Jurusan Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Negeri Semarang,
5. Agung Tri Prasetya, S.Si., M.Si. selaku dosen pembimbing I yang telah memberikan petunjuk, arahan, dan bimbingan dalam penyusunan Skripsi ini, 6. Dra. Woro Sumarni, M.Si. selaku dosen pembimbing II yang telah
memberikan arahan, nasehat, dan motivasi dalam penyusunan Skripsi ini, 7. Dr. Jumaeri, M.Si. selaku dosen penguji utama yang telah memberikan
masukan, pengarahan, dan bimbingan dalam penyusunan Skripsi ini,
8. Pihak lain yang tidak dapat penulis sebutkan satu per satu, yang telah membantu menyelesaikan penyusunan Skripsi ini.
Demikian ucapan terima kasih dari penulis, semoga Skripsi ini dapat bermanfaat dan memberikan sumbangan pengetahuan bagi perkembangan pengetahuan dalam penelitian selanjutnya.
Semarang, Juni 2016
vii
ABSTRAK
Yulianti. 2016. Interkalasi Benzalkonium Klorida (BKC) ke dalam Bentonit Teraktivasi Asam Sulfat sebagai Adsorben Anion Cr(VI). Skripsi, Jurusan Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Negeri Semarang. Pembimbing Utama Agung Tri Prasetya, S.Si, M.Si. dan Dosen Pendamping Dra. Woro Sumarni, M.Si.
Kata kunci: Adsorpsi, bentonit, Cr(VI), interkalasi, benzalkonium klorida.
Kromium merupakan salah satu logam berat berbahaya yang terdapat pada limbah industri. Salah satu metode untuk menurunkan kadar kromium dari limbah cair industri yang murah dan alami misalnya dengan adsorpsi menggunakan adsorben yang berbasis sumber alam. Bentonit merupakan sumber daya alam yang melimpah di Indonesia yang dapat dimanfaatkan sebagai adsorben. Bentonit mempunyai sifat mudah mengembang (swelling) dan mempunyai kation-kation yang mudah dipertukarkan sehingga dapat dimodifikasi dengan cara menyisipi surfaktan kationik ke dalam antarlapis lempung dengan metode interkalasi. Bentonit sebelumnya diaktivasi dengan H2SO4 3 M, selanjutnya diinterkalasi dengan surfaktan benzalkonium klorida 1%. Aktivasi dengan asam bertujuan untuk melarutkan pengotor pada material dan modifikasi dengan surfaktan kationik dapat mengubah muatan negatif pada permukaan bentonit menjadi bermuatan positif sehingga dapat mengikat anion Cr(VI). Penelitian ini dilakukan untuk mempelajari pengaruh interkalasi terhadap karakteristik adsorben, kapasitas adsorpsi, dan kemampuan adsorben untuk mengadsorpsi Cr(III) dan Cr(VI). Karakteristik adsorben dianalisis menggunakan metode difraksi sinar-X dan spektrofotometer infra merah. Optimasi adsorpsi meliputi pH, waktu, konsentrasi, dan kapasitas adsorpsi dianalisis menggunakan spektrofotometer serapan atom. Hasil penelitian menunjukan bahwa interkalasi benzalkonium bromida ke dalam antar lapis bentonit menyebabkan peningkatan d-spacing dari 4,5532 Ǻ menjadi
5,1702 Ǻ dan munculnya serapan baru pada bilangan gelombang 2927,72 cm-1
dan 2854,91 cm-1 yang menunjukkan adanya vibrasi simetrik dan asimetrik dari C-H pada metilen (-CH2) dan vibrasi streching C-H aromatik pada bilangan gelombang 1459,49 cm-1. Interkalasi juga meningkatkan kapasitas adsorpsi pada kondisi optimal dari 0,5032 mg/g (B0) dan 1,2251 mg/g (BA) menjadi 20,1758 mg/g. Adsorpsi BA-BKC dan BA terhadap anion Cr(VI) masing-masing mencapai 94,83% dan 5,95%. Sedangkan, adsorpsi BA-BKC dan BA terhadap ion logam Cr(III) masing-masing mencapai 69,24% dan 85,52%.
viii
ABSTRACT
Yulianti. 2016. Intercalation Benzalkonium Chloride (BKC) into Sulphate Acid-Activated Bentonite for Adsorption Cr(VI) Anionic. Skripsi, Departement of Chemistry Faculty of Mathematics and Natural Sciences Semarang State University. Agung Tri Prasetya, S.Si, M.Si. and Dra. Woro Sumarni, M.Si.
Keywords: Adsorption, bentonite, Cr(VI), intercalation, benzalkonium chloride. Chromium is one of the dangerous heavy metals found in industrial waste. One method to reduce levels of chromium from wastewater that is cheap and natural example by adsorption using adsorbents based natural resources. Bentonite is a natural that is abundant in Indonesia which can be used as adsorbent. Bentonite has swelling characteristic and have cations that are easily interchanged so that it can be modified in a way intercalate cationic surfactant into interlayer clay by intercalation method. Bentonite previously activated with H2SO4 3 M, further intercalated with 1% benzalkonium chloride surfactant. Activation with acid aimed to dissolve impurities in the material and modification with cationic surfactant can change the negative charge on the surface of bentonite become positively charged so as to bind anions of Cr(VI). This research was conducted to study the effect of intercalation on the characteristics of the adsorbent, the adsorption capasity, and the ability of the adsorbent to adsorb Cr(III) and Cr(VI). Adsorbent characteristic were analyzed using X-ray diffraction and infra-red spectrophotometer. Optimization of adsorption include pH, time, concentration, and adsorption capacity analyzed using atomic absorption spectrophotometer. The results showed that benzalkonium chloride intercalation ionto interlayer of bentonite cause in improved d-spacing of 4.5532 Ǻ be 5.1702 Ǻ and the emergence of new absorption at wave number 2927.72 cm-1 and 2891.91 cm-1 which indicates the symmetric and asymmetric vibration of CH in methylene (-CH2) and aromatic CH streching vibration at 1459.49 cm-1. Intercalation also increase the adsorption capacity under optimal conditions of 0.5032 mg/g (B0) and 1.2251 mg/g (BA) to 20.1758 mg/g. BA-BKC and BA adsorption to anions of Cr(VI) respectively reached 94.83% and 5.95%. Meanwhile, BA-BKC and BA adsorption to Cr(III) respectively reached 69.24% and 85.52%.
ix
DAFTAR ISI
Halaman
HALAMAN JUDUL ... i
PERNYATAAN ... ii
PERSETUJUAN PEMBIMBING ... iii
PENGESAHAN ... iv
MOTTO DAN PERSEMBAHAN... v
PRAKATA ... vi
ABSTRAK ... vii
ABSTRACT ... viii
DAFTAR ISI ... ix
DAFTAR TABEL ... xi
DAFTAR GAMBAR ... xii
DAFTAR LAMPIRAN ... xiii
BAB 1 PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Rumusan Masalah ... 4
1.3 Tujuan Penelitian ... 5
1.4 Manfaat Penelitian ... 5
BAB 2 TINJAUAN PUSTAKA ... 6
2.1 Kromium (Cr) ... 6
2.2 Bentonit ... 10
2.3 Aktivasi Bentonit dengan Asam Sulfat ... 13
2.4 Interkalasi Benzalkonium Klorida ke dalam Bentonit ... 14
2.5 Organoclay ... 16
2.6 Adsorpsi ... 18
2.7 Karakterisasi ... 19
BAB 3 METODE PENELITIAN ... 22
3.1 Lokasi Penelitian ... 22
x
3.3 Prosedur Penelitian... 23
BAB 4 HASIL DAN PEMBAHASAN ... 29
4.1 Pembuatan Adsorben Bentonit ... 29
4.2 Karakterisasi Adsorben Bentonit ... 31
4.3 Optimasi Penyerapan Anion Cr(VI) oleh Adsorben ... 35
4.4 Aplikasi Adsorben untuk Adsorpsi Cr(III) dan Cr(VI) ... 43
BAB 5 PENUTUP ... 45
5.1 Simpulan ... 45
5.2 Saran ... 45
DAFTAR PUSTAKA ... 47
xi
DAFTAR TABEL
Tabel Halaman
2.1 Sifat fisika dan kimia Cr ... 6
2.2 Komposisi kimia bentonit ... 13
2.3 Jarak d-spacing organoclay ... 17
4.1 Karakteristik larutan Cr(VI) yang digunakan dalam penelitian ... 29
4.2 Data d-spacing bentonit ... 32
4.3 Interpretasi spektra IR sebelum dan sesudah interkalasi ... 34
4.4 Kapasitas adsorpsi masing-masing adsorben ... 41
xii
DAFTAR GAMBAR
Gambar Halaman
2.1 Diagram distribusi Cr(III) terhadap fungsi pH (Santos et al., 2012) ... 8 2.2 Diagram distribusi Cr(VI) terhadap fungsi pH (Correa & Gomez, 2010) ... 9 2.3 Struktur montmorillonit (Othmer, 1964) ... 11 2.4 Ilustrasi interaksi lapisan montmorillonit dengan surfaktan
Benzalkonium klorida (Luo et al., 2015)... 15 4.1 Difragtogram adsorben bentonit BA dan BA-BKC ... 32 4.2 Spektra IR bentonit teraktivasi (BA) dan bentonit teraktivasi dan
terinterkalasi (BA-BKC) ... 33 4.3 Grafik hubungan pH dengan jumlah Cr(VI) teradsorpsi ... 36 4.4 Ilustrasi interaksi anion HCrO4- dengan kation benzalkonium pada
daerah antar lapis bentonit ... 37 4.5 Grafik hubungan waktu kontak dengan jumlah Cr(VI) teradsorpsi ... 39 4.6 Grafik hubungan konsentrasi awal larutan dengan jumlah
xiii
DAFTAR LAMPIRAN
Lampiran Halaman
1. Diagram Alir Penelitian ... 51
2. Pembuatan larutan induk Cr ... 61
3. Pembuatan larutan H2SO4 3 M 1000 mL ... 62
4. Data penentuan pH optimum ... 63
5. Data penentuan waktu optimum ... 65
6. Data penentuan konsentrasi optimum ... 67
7. Data penentuan kapasitas adsorpsi... 69
8. Data aplikasi adsorben untuk adsorpsi kation Cr(III) dan anion Cr(VI) ... 71
9. Karakterisasi XRD adsorben bentonit teraktivasi (BA) ... 73
10. Karakterisasi XRD adsorben bentonit teraktivasi dan terinterkalasi BKC (BA-BKC) ... 76
11. Karakterisasi FTIR adsorben bentonit teraktivasi (BA)... 78
12. Karakterisasi FTIR adsorben bentonit teraktivasi dan terinterkalasi benzalkonium klorida (BA-BKC) ... 79
1
BAB 1
PENDAHULUAN
1.1
Latar Belakang
Kegiatan industri yang semakin meningkat ternyata menimbulkan dampak negatif berupa limbah yang dapat membahayakan ekosistem maupun makhluk hidup di dalamnya. Limbah merupakan hasil samping dari proses industri yang dianggap tidak dapat digunakan kembali. Volume limbah sebagai hasil sisa produksi semakin bertambah sebanding dengan pesatnya pertumbuhan industri. Lingkungan dipaksa untuk menerima limbah, bila limbah tidak dikelola dengan baik dan melebihi daya dukung lingkungan maka lingkungan akan tercemar. Limbah yang dihasilkan dari kegiatan industri berpotensi besar memiliki sifat toksik misalnya limbah yang dihasilkan dari industri pelapisan logam, penyamakan kulit, tekstil, keramik, dan cat. Bahan pencemar dalam limbah yang sering menjadi perhatian adalah ion-ion logam berat.
Logam berat merupakan pengelompokan unsur-unsur logam yang mempunyai berat jenis lebih dari 5 g/cm3. Contoh logam berat yang termasuk ke dalam golongan tersebut adalah kromium (Cr), tembaga (Cu), besi (Fe), mangan (Mn), molybdenum (Mo), nikel (Ni), timbal (Pb), zirkonium (Zr), dan seng (Zn). Beberapa logam berat dalam konsentrasi kecil sangat di perlukan oleh makhluk hidup, contohnya sebagai atom pusat pada ko-enzim. Sayangnya, konsentrasi logam berat di alam banyak yang sudah melampaui ambang batas yang diperbolehkan, sehingga sifatnya menjadi toksik bagi makhluk hidup (Firdaus, 2012).
2
Chromium merupakan salah satu logam berat yang berbahaya yang biasanya terdapat dalam limbah industri pelapisan logam (electroplating), industri cat/pigmen, dan industri penyamakan kulit (leather tanning). Logam Cr menjadi popular karena sifat karsinogenik yang dimilikinya. Chromium terdapat di alam dalam 2 bentuk oksida, yaitu oksida Cr(III) dan Cr(VI). Uniknya, hanya Cr(VI) yang bersifat karsinogenik sedangkan Cr(III) tidak. Tingkat toksisitas Cr(VI) sekitar 100 kalinya Cr(III) (Slamet et al., 2003).
Penelitian yang telah dilakukan oleh Sunardi & Rosleni (2011), pada sampel yang diambil dari pembuangan limbah awal pada industri pelapisan logam, diperoleh kadar ion logam Cr sebesar 2802,98 mg/L. Hasil tersebut memperlihatkan kadar ion logam Cr telah melebihi ambang batas baku mutu (0,5 mg/L) yang telah ditetapkan pada Peraturan Menteri Lingkungan Hidup Republik Indonesia No. 5 Tahun 2014 tentang Baku Mutu Air Limbah, oleh karena itu pengolahan limbah cair industri pelapisan logam harus dilakukan.
Salah satu upaya untuk menurunkan kadar Cr dari limbah cair industri yang murah dan alami misalnya dengan adsorpsi menggunakan adsorben yang berbasis sumber alam. Adsorben yang pernah digunakan sebelumnya yaitu lempung (Muhdarina et al., 2010), pasir laut (Pambudi et al., 2014), zeolit alam (Ramos et al., 2008), dan limbah pertanian seperti abu sekam padi (Nurhasni et al., 2010) dan kulit kacang tanah (Rusmaya & Padmi, 2008). Alternatif penerapan metode adsorpsi dengan lempung dipilih karena keberadaannya yang cukup berlimpah hampir di seluruh wilayah Indonesia namun pemanfaatannya masih perlu dikembangkan secara berkelanjutan, selain itu, lempung bentonit memiliki
3
sifat mudah mengembang (swelling) dan mempunyai kation-kation yang mudah dipertukarkan serta luas permukaan yang cukup besar sehingga cocok dimanfaatkan sebagai adsorben (Suarya & Simpen, 2009). Namun, lempung tanpa dimodifikasi terlebih dahulu apabila diaplikasikan sebagai adsorben memberikan hasil yang kurang maksimal. Hal ini disebabkan oleh sifatnya yang mudah menyerap air, sehingga kurang stabil jika digunakan sebagai bahan penjerap, serta permukaan bentonit yang bermuatan negatif, maka kurang optimal jika diaplikasikan untuk menjerap anion logam Cr(VI). Selain itu, pori-pori yang dimilikinya sering tidak seragam (Wijaya et al., 2003).
Berdasarkan penelitian Bhattacharyya & Gupta (2007) aktivasi lempung menggunakan asam dapat mengatasi kelemahan tersebut dan menghasilkan bentonit dengan volume pori dan luas permukaan yang lebih besar, sehingga dihasilkan lempung dengan kemampuan adsorpsi yang lebih tinggi dibandingkan sebelum diaktivasi. Sedangkan Zohra et al. (2008) memodifikasi lempung dengan cara menyisipi bahan lain ke dalam antarlapis lempung dengan metode interkalasi. Interkalasi merupakan suatu proses penyisipan spesies kimia secara reversibel ke dalam antarlapis suatu struktur yang mudah mengembang tanpa merusak strukturnya. Interkalasi didasari oleh pertukaran kation yang terdapat pada antarlapis lempung seperti Na+, K+, dan Ca2+. Interkalasi ke dalam struktur lempung ini mengakibatkan peningkatan luas permukaan dan d-spacing (jarak antar lapis) yang berpengaruh terhadap kapasitas adsorpsinya. Menurut Widihati (2009), adanya interkalasi surfaktan lempung yang mengisi ruang antar lapisan lempung akan mengakibatkan perubahan mendasar dari struktur lempung yang
4
sebelumnya bersifat suka air (hidrofilik) menjadi tidak suka air (hidrofobik) pada permukaannya dan jarak antar lapisan lempung akan semakin besar. Selain itu, modifikasi dengan surfaktan kationik juga dapat mengubah muatan negatif pada permukaan bentonit menjadi bermuatan positif sehingga dapat mengikat polutan anion, khususnya anion Cr(VI).
Berdasarkan latar belakang tersebut, telah dilakukan penelitian mengenai metode interkalasi surfaktan benzalkonium klorida (BKC) ke dalam struktur lempung bentonit yang telah teraktivasi asam sulfat dan uji adsorpsinya terhadap ion logam kromium. Surfaktan BKC dipilih sebagai spesies kimia yang akan diinterkalasi ke dalam antarlapis lempung bentonit karena merupakan surfaktan jenis kationik, dimana muatan positif dari surfaktan akan berikatan dengan muatan negatif lempung. Selain itu, panjang rantai alkil pada BKC dan adanya ikatan π-π yang terbentuk karena adanya cincin benzena dapat meningkatkan sifat hidrofobik bentonit (Luo et al., 2015). Keberhasilan interkalasi ke dalam struktur lempung bentonit yang telah teraktivasi asam sulfat diharapkan menjadikan lempung ini lebih efektif sebagai adsorben untuk menjerap anion Cr(VI).
1.2
Rumusan Masalah
Rumusan masalah yang dikaji pada penelitian ini berdasarkan latar belakang tersebut adalah:
1. Bagaimana pengaruh interkalasi surfaktan benzalkonium klorida terhadap karakteristik bentonit teraktivasi asam sulfat ditinjau dari d-spacing dan gugus fungsinya?
5
2. Bagaimana pengaruh interkalasi surfaktan benzalkonium klorida terhadap kapasitas adsorpsi bentonit teraktivasi asam sulfat dalam mengadsorpsi anion Cr(VI)?
3. Bagaimana kemampuan bentonit teraktivasi asam sulfat dan bentonit teraktivasi asam sulfat dan terinterkalasi benzalkonium klorida terhadap adsorpsi kation Cr(III) dan anion Cr(VI)?
1.3
Tujuan Penelitian
Berdasarkan permasalahan tersebut maka penelitian ini bertujuan untuk: 1. Mengetahui pengaruh interkalasi surfaktan benzalkonium klorida terhadap
karakteristik bentonit teraktivasi asam sulfat ditinjau dari d-spacing dan gugus fungsinya.
2. Mengetahui pengaruh interkalasi surfaktan benzalkonium klorida terhadap kapasitas adsorpsi bentonit teraktivasi asam sulfat dalam mengadsorpsi anion Cr(VI).
3. Mengetahui kemampuan bentonit teraktivasi asam sulfat dan bentonit teraktivasi asam sulfat dan terinterkalasi benzalkonium klorida terhadap adsorpsi kation Cr(III) dan anion Cr(VI).
1.4
Manfaat Penelitian
Manfaat dari penelitian ini adalah memberi informasi mengenai pengaruh interkalasi benzalkonium klorida terhadap karakteristik bentonit teraktivasi asam sulfat dan aplikasinya untuk menurunkan logam berat, khususnya anion Cr(VI).
6
BAB 2
TINJAUAN PUSTAKA
2.1
Kromium (Cr)
Salah satu logam yang termasuk dalam golongan transisi adalah kromium. Kata kromium berasal dari bahasa Yunani (= Chroma) yang berarti warna. Dalam struktur kimia, kromium dilambangkan dengan simbol “Cr” (Palar, 1994).
2.1.1 Sifat-sifat kromium
Kromium adalah logam non ferro yang dalam tabel periodik termasuk golongan VIB dan lebih mulia dari besi. Beberapa sifat fisika dan kimia Cr dapat dilihat pada Tabel 2.1.
Tabel 2.1 Sifat fisika dan kimia Cr
Sifat Nilai
Simbol kimia Cr
Massa atom relatif 51,996
Densitas (20oC), gr/cm3 7,19
Titik didih, oC 2672
Titik lebur, oC 1857
Tekanan uap (844 oC), Pa 10-6
Kelarutan Larut dalam HCl dan H2SO4
Warna Silver
Sifat lain yang sangat menonjol adalah mudah teroksidasi dengan udara membentuk lapisan kromium oksida pada permukaan. Lapisan tersebut bersifat kaku, tahan korosi, tidak berubah warna terhadap pengaruh cuaca, tetapi larut dalam asam klorida, sedikit larut dalam asam sulfat, dan tidak larut dalam asam
7
nitrat. Karena sifat-sifat tersebut, maka dalam pemakaiannya banyak digunakan sebagai bahan paduan untuk meningkatkan ketahanan korosi sebagai bahan pelapis. Proses pelapisan krom dikenal secara luas pada industri-industri logam sebagai pengerjaan akhir (final finishing) sejak tahun 1930, karena ketahanan korosi dan tampak rupa lapisannya yang baik (Palar, 1994).
2.1.2 Distribusi Cr(III) dan Cr(VI) terhadap fungsi pH
Keberadaan Cr(III) di lingkungan dipengaruhi oleh proses fisika dan kimia, seperti hidrolisis, kompleks, reaksi redoks, dan adsorpsi. Apabila tidak terdapat agen pengompleks, Cr(III) umumnya akan membentuk heksaaquokromium(III) dan produk hidrolisisnya. Kesetimbangannya adalah:
Cr(H2O)63+ + H2O Cr(OH)(H2O)52+ + H3O+ Cr(OH)(H2O)52+ + H2O Cr(OH)2(H2O)42+ + H3O+ Cr(OH)2(H2O)42+ + H2O Cr(OH)3.aq + H3O+
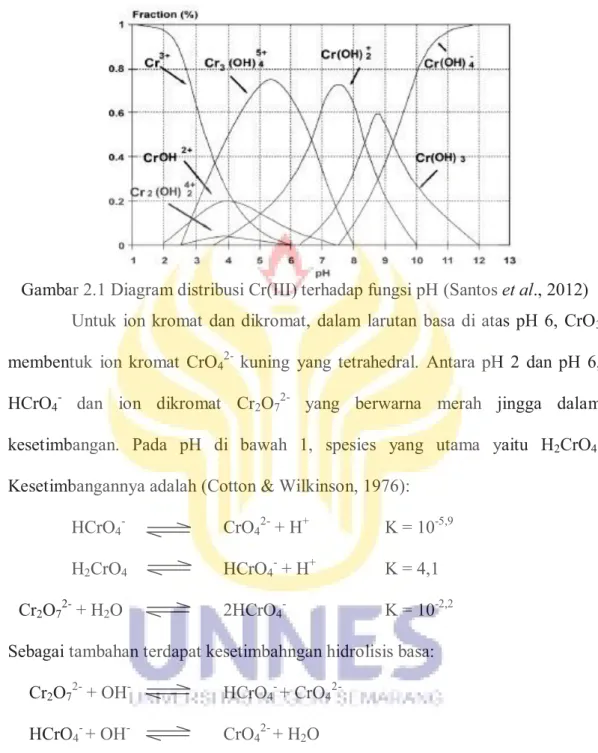
Cr(H2O)63+ merupakan asam kuat (pK ~4) yang terprotonasi membentuk Cr(OH)2+aq, Cr(OH)2+aq, dan Cr(OH)3aq yang dominan pada pH 4-10. Trihidroksokromium terdapat pada pH 6,5-11,5 sedangkan bentuk dominan Cr(III) yang terdapat di lingkungan adalah Cr(OH)2+aq dan Cr(OH)3aq. Cr(OH)3aq bersifat amfoter, pada pH tinggi akan berubah menjadi kompleks tetrahidrokso, Cr(OH)4- [pK=15,4 atau 18,3]. Diagram distribusi Cr(III) terhadap fungsi pH diperlihatkan pada Gambar 2.1.
8
Gambar 2.1 Diagram distribusi Cr(III) terhadap fungsi pH (Santos et al., 2012) Untuk ion kromat dan dikromat, dalam larutan basa di atas pH 6, CrO3 membentuk ion kromat CrO42- kuning yang tetrahedral. Antara pH 2 dan pH 6, HCrO4- dan ion dikromat Cr2O72- yang berwarna merah jingga dalam kesetimbangan. Pada pH di bawah 1, spesies yang utama yaitu H2CrO4. Kesetimbangannya adalah (Cotton & Wilkinson, 1976):
HCrO4- CrO42- + H+ K = 10-5,9 H2CrO4 HCrO4- + H+ K = 4,1 Cr2O72- + H2O 2HCrO4- K = 10-2,2 Sebagai tambahan terdapat kesetimbahngan hidrolisis basa:
Cr2O72- + OH- HCrO4- + CrO42- HCrO4- + OH- CrO42- + H2O
9
Gambar 2.2 Diagram distribusi Cr(VI) terhadap fungsi pH (Correa & Gomez, 2010)
2.1.3 Keracunan dan dampak kontaminasi kromium
Adanya kromium dalam limbah cair menandakan telah terjadi pencemaran dari limbah industri, karena senyawa kromium murni tidak pernah terdapat di alam. Apabila senyawa kromium terdapat dalam jumlah besar, maka dapat menimbulkan keracunan akut dengan gejala mual, sakit perut, dan koma. Apabila kontak dengan kulit, maka dapat menyebabkan dermatitis dan kanker.
Biasanya, senyawa kimia yang sangat beracun bagi organisme hidup adalah senyawa yang mempunyai bahan aktif dari logam berat. Sebagai logam Cr termasuk logam yang mempunyai daya racun tinggi. Daya racun yang dimiliki oleh logam Cr ditentukan oleh valensi ion-ionnya. Ion Cr6+ merupakan logam Cr yang paling banyak dipelajari sifat racunnya, bila dibandingkan ion-ion Cr3+ dan Cr2+. Sifat racun yang dibawa oleh logam ini juga dapat mengakibatkan terjadinya keracunan kronis (Palar, 1994).
Daya racun yang dimiliki oleh bahan aktif kromium akan bekerja sebagai penghalang kerja enzim dalam proses fisiologi atau metabolisme terputus. Ion Cr6+ dalam proses metabolisme tubuh akan menghambat kerja dari enzim
10
benzopiren hidroksilase, akibatnya terjadi perubahan dalam pertumbuhan sel, sehingga sel-sel tumbuh secara liar atau dikenal dengan istilah kanker. Hal itulah yang menjadi dasar dari penggolongan Cr ke dalam kelompok logam yang bersifat karsinogenik (Palar, 1994).
2.2
Bentonit
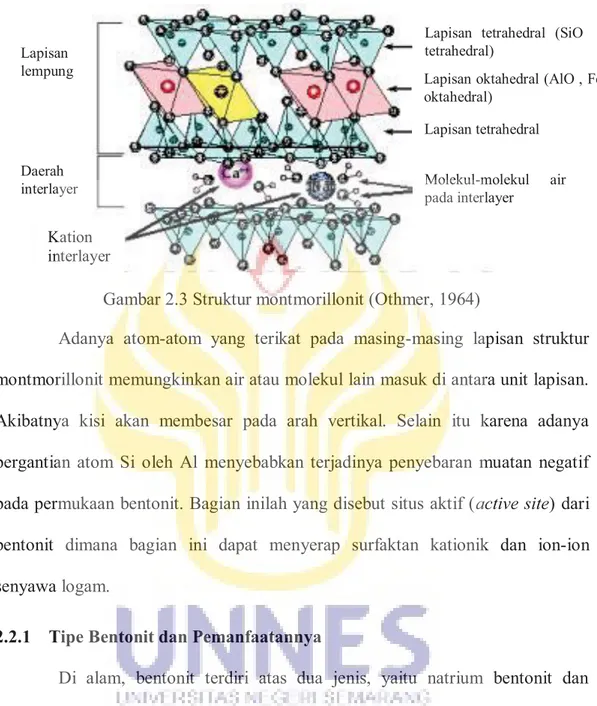
Bentonit adalah clay yang sebagian besar terdiri dari monmorillonit dengan mineral-mineral minor seperti kwarsa, kalsit, dolomit, feldspars, dan mineral minor lainnya. Montmorillonit merupakan bagian dari kelompok smectit dengan komposisi kimia secara umum (Mg,Ca)O.Al2O3.5SiO2.nH2O. Bentonit berbeda dari clay lainnya karena hampir seluruhnya (75%) merupakan mineral montmorillonit. Mineral montmorillonit terdiri dari partikel yang sangat kecil sehingga hanya dapat diketahui melalui studi menggunakan XRD (X-Ray Diffraction). Struktur montmorillonit memiliki konfigurasi 2:1 yang terdiri dari dua silikon oksida tetrahedral dan satu alumunium oksida oktahedral. Pada tetrahedral, 4 atom oksigen berikatan dengan atom silikon di ujung struktur. Empat ikatan silikon terkadang disubstitusi oleh tiga ikatan alumunium. Pada oktahedral, atom alumunium berkoordinasi dengan enam atom oksigen atau gugus-gugus hidroksil yang berlokasi pada ujung oktahedron. Al3+ dapat digantikan oleh Mg2+, Fe2+, Zn2+, Ni+, dan kation lainnya. Substitusi isomorphorous dari Al3+ untuk Si4+ pada tetrahedral dan Mg2+ dan Zn2+ untuk Al3+ pada oktahedral menghasilkan muatan negatif pada permukaan clay, hal ini diimbangi dengan adsorpsi kation di lapisan interlayer (Alemdar et al., 2005). Struktur montmorillonit diperlihatkan pada Gambar 2.3.
11
Gambar 2.3 Struktur montmorillonit (Othmer, 1964)
Adanya atom-atom yang terikat pada masing-masing lapisan struktur montmorillonit memungkinkan air atau molekul lain masuk di antara unit lapisan. Akibatnya kisi akan membesar pada arah vertikal. Selain itu karena adanya pergantian atom Si oleh Al menyebabkan terjadinya penyebaran muatan negatif pada permukaan bentonit. Bagian inilah yang disebut situs aktif (active site) dari bentonit dimana bagian ini dapat menyerap surfaktan kationik dan ion-ion senyawa logam.
2.2.1 Tipe Bentonit dan Pemanfaatannya
Di alam, bentonit terdiri atas dua jenis, yaitu natrium bentonit dan kalsium bentonit yang keduanya dapat dibedakan dari sifat mengembang (swelling) bila dicelupkan ke dalam air.
1. Natrium bentonit
Memiliki kemampuan mengembang delapan kali lipat bila dicelupkan ke dalam air dan membentuk suspensi kental setelah bercampur air dengan pH 8,5-9,8. Dapat dimanfaatkan sebagai lumpur pembilas pada kegiatan
Lapisan tetrahedral (SiO tetrahedral)
Lapisan oktahedral (AlO , FeO oktahedral) Lapisan tetrahedral Molekul-molekul air pada interlayer Lapisan lempung Daerah interlayer Kation interlayer
12
pemboran, pembuatan pelet biji besi, penyumbat kebocoran bendungan dan kolam. Selain itu digunakan juga dalam industri minyak sawit dan farmasi. 2. Kalsium bentonit
Kurang menyerap air (kurang mengembang), akan tetapi secara alamiah ataupun setelah diaktifkan dengan asam, mempunyai sifat menghisap yang baik dan tetap terdispersi dalam air. Dapat dimanfaatkan sebagai bahan pemucat warna pada proses pemurnian minyak goreng, katalis, zat pemutih, zat penyerap, dan sebagai filler pada industri kertas dan polimer (Syuhada et al., 2009).
2.2.2 Sifat Fisik dan Kimia Bentonit
Dalam keadaan kering bentonit mempunyai sifat fisik berupa partikel butiran yang halus berbentuk rekahan-rekahan atau serpihan yang khas seperti tekstur pecah kaca (concoidal fracture), kilap lilin, lunak, plastis, berwarna kuning muda hingga abu-abu, bila lapuk berwarna coklat kekuningan, kuning merah atau coklat, bila diraba terasa licin, dan bila dimasukkan ke dalam air akan menghisap air. Sifat fisik lainnya berupa:
massa jenis : 2,2-2,8 g/L indeks bias : 1,547-1,557 titik lebur : 1330-1430 oC
Bentonit berupa mineral yang memiliki gugus aluminosilikat. Unsur-unsur kimia yang terkandung dalam bentonit diperlihatkan pada Tabel 2.2.
13
Tabel 2.2 Komposisi kimia bentonit
Senyawa Na-bentonit (%) Ca-bentonit (%) SiO2 Al2O3 Fe2O3 CaO MgO Na2O K2O H2O 61,4 19,8 3,9 0,6 1,3 2,2 0,4 7,2 62,12 17,33 5,30 3,68 3,30 0,50 0,55 7,22 Sumber: Puslitbang Tekmira, 2002
Partikel bentonit bermuatan negatif yang diimbangi dengan kation yang dapat dipertukarkan dan terikat lemah (Na, Ca, Mg, atau K). Adanya kation yang dapat dipertukarkan ini memungkinkan bentonit memisahkan logam berat dari air, dan juga memisahkan senyawa organik kationik mekanisme permukaan pertukaran ion.
2.3
Aktivasi Bentonit dengan Asam Sulfat
Aktivasi adalah suatu perlakuan terhadap suatu material yang bertujuan untuk memperbesar pori sehingga mengalami perubahan sifat, baik kimia maupun fisika, yaitu luas permukaannya bertambah besar dan berpengaruh terhadap daya adsorpsinya (Bradey, 1999).
Untuk meningkatkan kemampuan adsorpsi lempung bentonit terhadap krom total maka perlu dilakukan aktivasi secara kimia dengan larutan asam. Hal ini telah didukung oleh beberapa penelitian, yakni Motlagh et al. (2011), telah melakukan modifikasi (aktivasi) lempung dengan asam mineral (H2SO4) dengan variasi konsentrasi 2-7 N. Hasilnya, dapat meningkatkan beberapa sifat fisik dan kimianya seperti luas permukaan dan porositasnya sehingga lebih efektif sebagai
14
adsorben ataupun katalis daripada lempung tanpa aktivasi. Konsentrasi asam optimum yaitu 6 N dengan luas permukaan 167 m2/g. Selain itu, dalam penelitian Munandar et al. (2014) juga menunjukkan bahwa zeolit alam dan zeolit alam teraktivasi asam sulfat 0,5 M. Aktivasi ini dapat meningkatkan luas permukaan dari 76,448 m2/g menjadi 180,459 m2/g. Bhattacharyya & Gupta (2007) melakukan penelitian menggunakan lempung montmorillonit yang diaktivasi menggunakan H2SO4 0,25 M terhadap kemampuan penjerapan (adsorpsi) ion logam Cd(II), Co(II), Pb(II), dan Ni(II) dalam air. Hasil penelitian menunjukkan bahwa luas permukaan spesifik montmorillonit adalah 19,8 m2/g, sedangkan montmorillonit yang diaktivasi dengan asam meningkat menjadi 52,3 m2/g. Kapasitas adsorpsi terhadap ion-ion logam juga mengalami peningkatan. Kapasitas adsorpsi tertinggi untuk montmorillonit teraktivasi asam adalah 34,0 mg/g terhadap ion logam Pb(II).
2.4
Interkalasi Benzalkonium Klorida ke dalam Bentonit
Interkalasi merupakan suatu proses penyisipan spesies kimia secara reversibel ke dalam antarlapis suatu struktur yang mudah mengembang tanpa merusak strukturnya. Interkalasi didasari atas pertukaran kation yang terdapat pada antarlapis lempung, seperti Na+, K+, dan Ca2+. Interkalasi ke dalam struktur lempung bertujuan untuk meningkatkan luas permukaan, d-spacing, dan keasaman permukaan (Zohra et al., 2008).
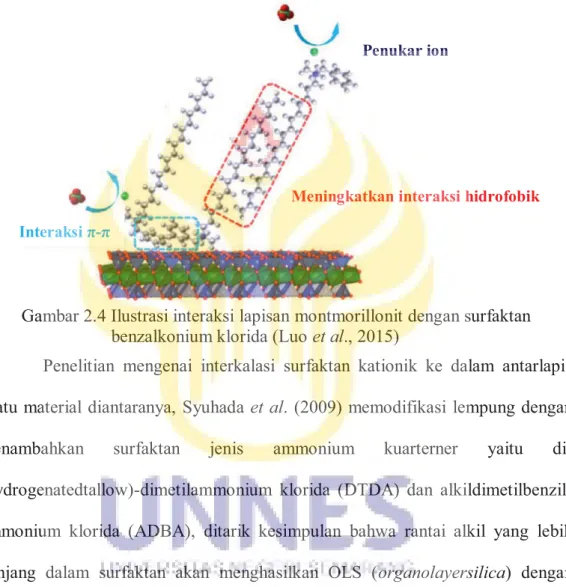
Benzalkonium klorida (C6H5CH2N+(CH3)2C18H37Cl-) merupakan salah satu contoh dari surfaktan kationik yang dapat diinterkalasikan ke dalam antarlapis lempung. Surfaktan ini memiliki gugus hidrofilik yang bermuatan
15
positif di dalam larutan dan merupakan senyawa ammonium kuarterner (NR4+). Interaksi antara lapisan montmorillonit dengan surfaktan diperlihatkan pada Gambar 2.4.
Gambar 2.4 Ilustrasi interaksi lapisan montmorillonit dengan surfaktan benzalkonium klorida (Luo et al., 2015)
Penelitian mengenai interkalasi surfaktan kationik ke dalam antarlapis suatu material diantaranya, Syuhada et al. (2009) memodifikasi lempung dengan menambahkan surfaktan jenis ammonium kuarterner yaitu di-(hydrogenatedtallow)-dimetilammonium klorida (DTDA) dan alkildimetilbenzil-ammonium klorida (ADBA), ditarik kesimpulan bahwa rantai alkil yang lebih panjang dalam surfaktan akan menghasilkan OLS (organolayersilica) dengan stabilitas panas dan peningkatan basal spacing yang lebih baik. D-spacing meningkat dari 1,49 nm menjadi 2,26 nm. Selain itu, Zeng et al. (2010) juga memodifikasi zeolit alam dengan heksadesilpiridinium bromida (HDPB), dihasilkan bahwa zeolit alam termodifikasi HDPB mempunyai kapasitas adsorpsi yang lebih tinggi yaitu 14,31 mg/g dibandingkan dengan zeolit alam yang tidak dimodifikasi (1,52 mg/g). Rahmawati (2015) melakukan penelitian tentang
Interaksi π-π
Meningkatkan interaksi hidrofobik
16
adsorpsi tanah lempung dari desa Beka yang diinterkalasi cetyl-N, N, N-trimetilammonium bromida untuk menurunkan kadar merkuri (Hg) dalam larutan. Hasil penelitian tersebut menunjukkan bahwa konsentrasi optimum N-cetyl-N, N, N-trimetil-ammonium bromida untuk diinterkalasikan ke dalam tanah lempung sebanyak 5 gram dengan kemampuan adsorpsi Hg sebesar 9,89 mg/g. Fan et al. (2014) juga melakukan penelitian menggunakan lempung montmorillonit yang diinterkalasi dengan surfaktan dodesil sulfobetaina untuk mengadsorpsi ion logam Cu2+ dan metilen biru dalam larutan. Hasil penelitian menunjukkan bahwa interkalasi surfaktan dapat meningkatkan d-spacing dari 1,55 nm menjadi 1,73 nm. Kapasitas adsorpsi dalam menjerap ion Cu2+ juga mengalami peningkatan yaitu dari 9,5 mg/g menjadi 10,2 mg/g. Suarya & Simpan (2009) melakukan modifikasi montmorillonit dengan menginterkalasikan benzalkonium klorida dengan variasi konsentrasi 0,1; 0,5; 1; dan 2% (v/v). Hasilnya, interkalasi dapat meningkatkan karakter adsorben meliputi luas permukaan dan jarak antarlapisnya. Konsentrasi surfaktan optimum yaitu 1% dengan luas permukaan dan jarak antarlapisnya adalah 27,7885 m2/g dan 14,77594 Å.
2.5
Organoclay
Secara alamiahnya, clay bersifat hidrofilik. Proses yang umum digunakan untuk mengubah sifat hidrofilik menjadi hidrofobik adalah dengan mengikatkan rantai hidrokarbon (surfaktan) pada permukaan lapisan clay. Clay yang hidrofobik dapat diperoleh dari clay hidrofilik melalui pertukaran ion dengan molekul organik yang memiliki sifat kationik seperti ion alkylammonium.
17
Clay yang telah dimodifikasi oleh molekul organik disebut sebagai organoclay. Organoclay dapat disintesis melalui modifikasi bentonit oleh amina kuarterner. Amina kuarterner yang digunakan umumnya surfaktan yang mengandung ion nitrogen. Ion nitrogen pada amina kuarterner bermuatan positif, sehingga mampu menggantikan ion natrium maupun ion kalsium pada interlayer clay. Amina yang digunakan umumnya memiliki rantai karbon panjang (12 sampai 18 atom karbon). Interkalasi surfaktan kationik dapat meningkatkan d-spacing clay. Meningkatnya d-spacing ini dapat terlihat dari data XRD. Beberapa studi menunjukkan bahwa d-spacing organoclay bergantung pada panjang rantai alkil dan rapatan pengemasan surfaktan dalam gallery clay.
Luo et al. (2015) telah melakukan penelitian mengenai organoclay dengan membuat organoclay dari montmorillonite dengan surfaktan kationik benziloktadesildimetilammonium klorida dengan melakukan variasi konsentrasi surfaktan, yaitu 0,5 ; 1 ; 2 ; dan 4 kali kapasitas tukar kation. Hasil yang diperoleh menunjukkan bahwa semakin tinggi konsentrasi surfaktan yang digunakan maka d-spacing organoclay akan semakin besar. Tabel 2.3 menunjukkan perubahan d-spacing pada setiap organoclay.
Tabel 2.3 Jarak d-spacing organoclay
No. Organoclay d (nm) 1 MMT 1,19 2 BODMA-0,5-MMT 1,96 3 BODMA-1-MMT 2,09 4 BODMA-2-MMT 3,56 5 BODMA-4-MMT 3,66
18
Organoclay berfungsi sebagai adsorben untuk penjernihan minyak daun cengkeh (Suarya & Simpen, 2009), penghilangan limbah organik, berupa fenol (Tilaki & Karimpoor, 2010) dan zat warna (Tilaki, 2010), penurunan logam berat Cr(VI) (Kumar, 2012), serta sebagai bahan dasar dalam pembuatan nanokomposit (Resende et al., 2009).
2.6
Adsorpsi
Adsorpsi adalah suatu proses yang terjadi ketika suatu fluida (cairan maupun gas) terikat pada suatu padatan dan akhirnya membentuk suatu film (lapisan tipis) pada permukaan padatan tersebut. Adsorpsi secara umum adalah proses penggumpalan substansi terlarut (soluble) yang ada dalam larutan oleh permukaan zat atau benda penyerap, dimana terjadi suatu ikatan kimia fisika antara substansi dengan penyerapnya. Definisi lain menyatakan adsorpsi sebagai suatu peristiwa penyerapan pada lapisan permukaan atau antar fasa, dimana molekul dari suatu materi terkumpul pada bahan pengadsorpsi atau adsorben (Bradey, 1999).
Mekanisme penjerapan dapat dibedakan menjadi dua, yaitu adsorpsi secara fisika (fisisorpsi) dan secara kimia (kemisorpsi). Pada proses fisisorpsi, interaksi yang terjadi antara adsorbat dan adsorben adalah gaya Van der Waals. Molekul yang terikat lebih lemah dan energi yang dilepaskan relatif rendah, sekitar 20 kJ/mol. Di sisi lain, proses kemisorpsi, interaksi adsorbat dan adsorben tersedia melalui pembentukan ikatan yang lebih kuat (ikatan kovalen), dengan energi yang dilepaskan relatif tinggi, sekitar 100 kJ/mol (Atkins, 1978).
19
Modifikasi lempung bentonit diperoleh produk senyawa alumino silikat yang memiliki sifat-sifat kimia fisik yang lebih baik dari sebelumnya. Beberapa senyawa lempung termodifikasi dapat dimanfaatkan untuk mengadsorpsi logam-logam berat melalui proses pertukaran kation (Widihati, 2009) maupun pembentukan ikatan, salah satunya sebagai adsorben anion Cr(VI).
2.7
Karakterisasi
2.7.1 Analisa D-spacing dengan Difraksi Sinar –X (XRD)
Difraksi sinar –X digunakan untuk mengidentifikasi struktur kristal suatu padatan dengan membandingkan nilai jarak d (bidang kristal) dan intensitas puncak difraksi dengan data standar. Sinar –X merupakan radiasi elektromagnetik dengan panjang gelombang sekitar 100 pm yang dihasilkan dari penembakkan logam dengan elektron berenergi tinggi. Melalui analisis XRD diketahui dimensi kisi (d = jarak antar kisi) dalam struktur mineral. Sehingga dapat ditentukan apakah suatu material mempunyai kerapatan yang tinggi atau tidak, dan difraksi sinar-x suatu kristal.
Prinsip dasar dari XRD adalah hamburan elektron yang mengenai permukaan kristal. Bila sinar dilewatkan ke permukaan kristal, sebagian sinar tersebut akan terhamburkan dan sebagian lagi akan diteruskan ke lapisan berikutnya. Sinar yang dihamburkan akan berinterferensi secara konstruktif (menguatkan) dan destruktif (melemahkan). Hamburan sinar yang berinterferensi inilah yang digunakan untuk analisis.
Difraksi sinar –X hanya akan terjadi pada sudut tertentu sehingga suatu zat akan mempunyai pola difraksi tertentu. Pengukuran kristalinitas relatif dapat
20
dilakukan dengan membandingkan jumlah tinggi puncak pada sudut-sudut tertentu dengan jumlah tinggi puncak pada sampel standar.
Di dalam kisi kristal, tempat kedudukan sederetan ion atau atom disebut bidang kristal. Bidang kristal ini berfungsi sebagai cermin untuk merefleksikan sinar –X yang datang. Posisi dan arah dari bidang kristal ini disebut indeks miller. Setiap kristal memiliki bidang kristal dengan posisi dan arah yang khas, sehingga jika disinari dengan sinar –X pada analisis XRD akan memberikan difraktogram yang khas pula.
2.7.2 Analisa Gugus Fungsi dengan Fourier Transform Infra Red(FT-IR) Spektrometri Inframerah merupakan metode yang digunakan untuk mengamati interaksi-interaksi molekul dengan radiasi elektromagnetik. Prinsip dasar spektrometri inframerah yaitu interaksi antara vibraasi atom-atom yang berikatan atau gugus fungsi dalam molekul yang dengan mengadsorpsi radiasi gelombang elektromagnetik inframerah. Absorpsi terhadap radiasi inframerah dapat menyebabkan eksitasi energi vibrasi molekul ketingkat energi vibrasi yang lebih tinggi. Untuk dapat mengabsorpsi, molekul harus mempunyai perubahan momen dipol sebagai akibat dari vibrasi. Umumnya daerah radiasi inframerah terbagi menjadi tiga yaitu daerah inframerah dekat (12800-4000 cm-1), daerah inframerah tengah (4000-200 cm-1), daerah inframerah jauh (200-10 cm-1). Daerah yang paling banyak digunakan untuk berbagai keperluan adalah 4000-690 cm-1, daerah ini biasa disebut sebagai daerah inframerah tengah (Khopkar, 2008).
Pada analisis sampel menggunakan FT-IR, radiasi IR berjalan melewati sampel. Beberapa radiasi IR diserap oleh sampel dan yang lain dilewatkan
21
(transmitted). Hasil spektrum yang ditampilkan merupakan molekul yang diserap dan ditransmisikan, menimbulkan puncak seperti sidik jari yang dihasilkan dari sampel. Seperti sidik jari yang ditampilkan tidak ada struktur molekul lain yang memiliki spektrum inframerah unik yang sama, sehingga spektroskopi inframerah sangat berguna untuk beberapa jenis analisis (Thermo, 2001).
FT-IR dapat digunakan untuk menentukan gugus-gugus fungsional yang ada pada suatu senyawa. Pada umumnya sampel yang dianalisis dapat berupa padatan, cairan , dan gas, masing-masing mempergunakan sel yang berbeda-beda (Stevens, 2001).
Analisis FT-IR dilakukan untuk mengetahui gugus fungsi dari bentonit terinterkalasi benzalkonium klorida. Setiap ikatan mempunyai frekuensi vibrasi yang khas sehingga absorpsi inframerah dapat digunakan untuk identifikasi gugus-gugus yang ada dalam suatu senyawa.
45
BAB 5
PENUTUP
5.1
Simpulan
Berdasarkan hasil penelitian dan pembahasan, maka dapat diambil simpulan sebagai berikut:
1. Interkalasi surfaktan benzalkonium klorida ke dalam bentonit teraktivasi menyebabkan peningkatan d-spacing bentonit sebesar 0,6170 Å dan munculnya serapan baru pada bilangan gelombang 2927,72 cm-1 dan 2854,91 cm-1 yang menunjukkan adanya vibrasi simetrik dan asimetrik dari C-H pada metilen (-CH2) dan vibrasi streching C-H aromatik pada bilangan gelombang 1459,49 cm-1.
2. Interkalasi surfaktan benzalkonium klorida ke dalam bentonit teraktivasi meningkatkan kapasitas adsorpsi terhadap anion Cr(VI) dari 0,5032 mg/g (B0) dan 1,2251 mg/g (BA) menjadi 20,1758 mg/g.
3. Pada kondisi optimal, adsorpsi BA-BKC terhadap anion Cr(VI) lebih besar dari pada BA. Adsorpsi BA-BKC dan BA terhadap anion Cr(VI) masing-masing mencapai 94,83% dan 5,95%. BA-BKC juga mampu mengadsorpsi ion logam Cr(III) tetapi tidak lebih baik dari BA. Adsorpsi BA-BKC dan BA terhadap ion logam Cr(III) masing-masing mencapai 69,24% dan 85,52%.
5.2
Saran
1. Perlu dilakukan penelitian lebih lanjut tentang adsorpsi bentonit termodifikasi surfaktan terhadap campuran kation Cr(III) dan anion Cr(VI).
46
2. Perlu dilakukan penelitian lebih lanjut tentang adsorpsi bentonit alam terhadap kation Cr(III) untuk mengetahui pengaruh aktivasi asam terhadap kapasitas adsorpsinya.
3. Perlu dilakukan penelitian lebih lanjut tentang adsorpsi bentonit termodifikasi surfaktan terhadap berbagai polutan organik maupun anorganik.
4. Perlu dilakukan kajian mengenai analisis luas permukaan adsorben dengan Surface Area Analyzer.
47
DAFTAR PUSTAKA
Alemdar, A., N. Oztekin, N. Gungor, O. I. Ece, & F. B. Erim. 2005. Effect of Polyethyleneimine Adsorption on the Rheological Properties of Purified Bentonite Suspensions. Colloids and Surfaces, 252: 95-98.
Anonim. 1987. Kemungkinan Pemanfaatan Buangan Mengandung Krom Sebagai Bahan Penyamak Kulit, BPPI, Semarang.
Anonim. 1996. Analytical Methods for Atomic Absorption Spectroscopy. United States of America. The Perkin-Elmer Corporation.
Atkins, P.W. 1978. Kimia Fisika. Translated by Irma, I. K. 1999. Jakarta: Erlangga.
Bhattacharyya, K.G. & S.S. Gupta. 2007. Adsorptive Accumulation of Cd(II), Co(II), Pb(II), and Ni(II) from Water on Montmorillonite: Influence of Acid Activation. Journal of Colloid and Interface Science, 310: 411-424. Bernasconi, G., H. Gerster, H. Hawster, H. Stauble, & E. Schneiter. 1995.
Teknologi Kimia. Translated by Lienda, H. Jakarta: PT. Pradnya Paramita.
Bradey, J. 1999. Kimia Untuk Universitas. Jakarta: Erlangga.
Brum, M,C., J.L. Capitaneo, & J.F. Oliveira. 2010. Removal of Hexavalent Chromium from Water by Adsorption onto Surfactant Modified Montmorillonite. Mineral Engineering, 23: 270-272.
Cotton, F.A. & G. Wilkinson. 1976. Kimia Anorganik Dasar. Translated by Sahati, S. & Yanti, R. A. K. 1989. Jakarta: UI-Press.
Fan, H., L. Zhou, X. Jiang, Q. Huang, & W. Lang. 2014. Adsorption of Cu2+ and Methylene Blue on Dodecyl Sulfobetaine Surfactant-Modified Montmorillonite. Applied Clay Science, 95: 150-158.
Firdaus, M.L. 2012. Studi Perbandingan Berbagai Adsorben Sintesis dan Alami untuk Mengikat Logam Berat. Prosiding Seminar Nasional Pendidikan Sains. Surakarta: Universitas Negeri Surakarta.
Gomez, J.S. & F.G. Correa. 2010. Removal of Chromium Hexavalent Ions from Solution by Retention onto Iron Phosphate. Journal of the Chilean Chemical Society, 55(3): 312-316. Tersedia di http://www.scielo.cl/ [diakses 8-1-2016].
Hu, B. & H. Luo. 2010. Adsorption of Hexavalent Chromium onto Montmorillonite Modified with Hydroxyaluminium and
48
Cetyltrimethylammonium Bromide. Applied Surface Science, 257: 769-775.
Kumar, A.S.K., R. Ramachandran, S. Kalidhasan, V. Rajesh, & N. Rajesh. 2012. Potential Application of Dodecylamine Modified Sodium Montmorillonite Effective Adsorbent for Hexavalent Chromium. Chemical Engineering Journal, 211: 396-403.
Luo, W., K. Sasaki, & T. Hirajima. 2015. Surfactant-Modified Montmorillonite by Benzyloctadecyldimethylammonium Chloride for Removal of Perchlorate. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 481(2015): 616-625.
Khopkar. 2008. Konsep Dasar Kimia Analitik. Jakarta: Universitas Indonesia. Motlagh, M.M.K., A.A. Youzbash, & Z.A. Rigi. 2011. Effect of Acid Activation
on Structural and Bleaching Properties of a Bentonite. Iranian Journal of Materials Science & Engineering, 8: 50-56.
Muhdarina, A.W. Mohammd, & A. Muchtar. 2010. Prospektif Lempung Alam Cengar sebagai Adsorben Polutan Anorganik di dalam Air: Kajian Kinetika Adsorpsi Kation Co(II). Reaktor, 13(2): 81-88.
Munandar, A., D. Krisdiyanto, Khamidinal, & P. Artsanti. 2014. Adsorpsi Logam Pb dan Fe dengan Zeolit Alam Teraktivasi Asam Sulfat. Prosiding6th Pemantapan Riset Kimia dan Asesmen dalam Pembelajaran Berdasar Pendekatan Saintifik. Surakarta: Universitas Negeri Surakarta.
Nurhasni, N., H. Hendrawati, & N. Saniyyah. 2010. Penyerapan Ion Logam Cd dan Cr dalam Air Limbah Menggunakan Sekam Padi. VALENSI, 310-318.
Othmer, K. 1964. Encyclopedia of Chemical Technology Second Edition. John Willwy & Sons, Inc. 3: 339-359.
Palar, H. 1994. Pencemaran dan Toksikologi Logam Berat. Jakarta: Rineka Cipta. Pambudi, D.S., A.T. Prasetya, & W. Sumarni. 2014. Adsorpsi Ion Cu(II)
Menggunakan Pasir Laut Teraktivasi H2SO4 dan Tersalut Fe2O3. Jurnal MIPA, 37(1): 53-61.
Rahmawati, N.K., Sumarni, & A. Ridhay. 2015. Interkalasi Lempung dengan Surfaktan Garam Ammonium Kuarterner dan Aplikasinya pada Penyerapan Logam Hg. Online Jurnal of Natural Science, 4(1): 84-88. Ramos, R.L., A.J. Azuara, P.E.D. Flores, R.M.G. Coronado, J.M. Barron, &
49
Solution on a Surfactant-Modified Zeolite. Colloid and Surfaces A: Physicochemichal and Engineering Aspect, 330: 35-41.
Resende, D., C. Dornelas, M.I.B. Tavares, L. Cabral, L. Simeoni, & A. Gomes. 2009. Preparation of Modified Montmorillonite with Benzethonium and Benzalkonium Chloride for Nanocomposites Preparation. Chemistry & Chemical echnology, 3(4): 291-294.
Rusmaya, D. & T. Padmi. 2008. Sorpsi Limbah Nikel Menggunakan Kulit Kacang Tanah. Jurnal Teknik Lingkungan, 14(2): 105-114.
Santos, V.C.G.D., A.P.A. Salvado, D.C. Dragunski, D.N.C. Peraro, C.R.T. Tarley, & J. Caetano. 2012. Highly Improved Chromium(III) Uptake Capacity in Modified Sugarcane Bagasse using Different Chemical Treatments. Quimica Nova, 35(8): 1-11. Tersedia di http://www.scielo.br/ [diakses 8-1-2016].
Slamet, R., Syukur, & W. Danumulyo. 2003. Pengolahan Limbah Logam Berat Chromium (VI) dengan Fotokatalis TiO2. MAKARA TEKNOLOGI, 7: 27-32.
Stevens, M.P. 2001. Kimia Polimer. Jakarta: PT. Pradnya Paramita.
Suarya, P. & I.N. Simpen. 2009. Interkalasi Benzalkonium Klorida ke dalam Montmorillonit Teraktivasi Asam dan Pemanfaatannya untuk Meningkatkan Kualitas Minyak Daun Cengkeh. JURNAL KIMIA, 3(1): 41-46.
Sunardi & Rosleini. 2011. Pemanfaatan Serbuk Besi untuk Penurunan Krom(VI) Limbah Cair Industri Pelapisan Logam. Jurnal EKOSAINS, 3(3): 22-28. Syuhada, R. Wijaya, Jayatin, & S. Rohman. 2009. Modifikasi Bentonit (Clay)
menjadi Organoclay dengan Penambahan Surfaktan. Jurnal Nanosains & Nanoteknologi, 2(1): 48-51.
Thermo, N. 2001. Introduction to Fourier Transform Infrared Spectrometry. USA: Thermo Nicolet Corporation.
Tilari, R.D. 2010. Removal of Textile Dye by Bentonite and Organo-Bentonite. Asian Journal of Chemistry, 22(6): 4559-4566.
Tilari, R.D. & S. Karimpoor. 2010. Kinetic Study on Removal of Phenol from Water by Organo-Bentonite. Asian Journal of Chemistry, 22(6): 4703-4710.
Widihati, I.A.G. 2009. Adsorpsi Ion Pb2+ oleh Lempung Terinterkalasi Surfaktan. JURNAL KIMIA, 3(1): 27-32.
50
Wijaya, K., T.I. Mudasir, & F. Asean. 2003. Adsorpsi Pengotor Minyak Daun Cengkeh oleh Lempung Teraktivasi Asam. Review Kimia, 2(1): 19-24. Xue, W.H., J. Zhu, & P. Yuan. 2007. FTIR Investigation of
CTAB-Al-Montmorillonite Complexes. Spectrochim, 67: 1030-1036.
Zeng, Y., H.W. Woo, G. Lee, & J. Park. 2010. Adsorption of Cr(VI) on Hexadecylpyridinium Bromide (HDPB) Modified Natural Zeolites. Microporous and Mesoporous Materials, 130: 83-91.
Zohra, B., K. Aicha, S. Fatima, B. Nouredine, & D. Zoubir. 2008. Adsorption of Direct Red 2 on Bentonite Modified by Cetyltrimethylammonium Bromide. Chemical Engineering Journal, 136: 295-305.