PERBANDINGAN KARAKTERISTIK PENCAIRAN
BATUBARA BANKO DAN TANITO HARUM SEBAGAI
EFEK KERJA KATALIS LOGAM TRANSISI
Muhammad Hanif1) dan Adiarso2)1)
Laboratorium Pencairan Batubara, Puspiptek, Serpong
2)
Balai Besar Teknologi Energi, Puspiptek, Serpong E-mail: hanive@yahoo.com; osraida@hotmail.com
Abstract
Characterization of two oil derived from Indonesian lower-rank coals from South Banko (SB) and Tanito Harum (TH) were carried out after liquefied in the presence of nickel/molybdenum (Ni/Mo) and cobalt/ molybdenum (Co/Mo) catalysts without added solvent. Both coals treated with Ni/Mo have high conversion than those treated with Co/Mo when reacted with hydrogen with
initial pressure of 6MPa at 400oC for 30 minutes. However, with sulfur (CS2)
added, the difference between Ni/Mo and Co/Mo catalysts for conversion of both coals is eliminated. SB-coal exhibits better conversion than that of Ni/Mo or Co/Mo-treated TH-coal. This probably due to the structure of TH coal is more condensed and stronger than that of SB coal. The effect of single metal (Ni, Co or Mo separately) could explain the different conversion between Ni/Mo and Co/Mo with and without sulfur and also the difference between SB and TH when they reacted with Ni/Mo and Co/Mo with and without added sulfur. The order of effectiveness for SB, when it reacted in the absence of sulfur, was decreased from Ni>Mo>Co. But the order was shifted to Mo>>Ni>Co. The similar order was also found for TH coal under the same conditions. The study also shows that reactivity of SB coal was higher than that of TH coal. This results in better yield of fuels. Fortunately, the TH coal is still potentially developed for introducing the efficient process of sub bituminous coal liquefaction in Indonesia.
Kata Kunci: coal liquefaction, katalis Ni/Mo, Banko, Tanito Harum
1. PENDAHULUAN 1.1. Latar belakang
Salah satu sumberdaya energi fosil yang banyak ditemukan di Indonesia adalah batubara. Deposit sumberdaya ini jumlahnya diperkirakan mencapai 107,76 milyar-ton (Anonim, 2010), dimana hampir 60%-nya terdiri dari batubara muda seperti lignit dan sub bituminus. Limpahan cadangan sedemikian harus dimanfaatkan secara maksimal melalui pengembangan berbagai macam teknologi pemanfaatan batubara muda yang sesuai dengan kebutuhan Indonesia. Salah satu teknologi yang dikembangkan yaitu teknologi konversi batubara muda menjadi BBM sintetis, yang berguna untuk mengurangi ketergantungan pada minyak bumi terutama dalam sektor transportasi.
Teknologi pencairan batubara untuk memproduksi BBM sintetis pertama-tama ditemukan oleh Weller dan Pelipetz (Weller, S. and Pelipetz, M.G., 1951), yang penelitiannya
terus dikembangkan untuk meningkatkan efisiensi prosesnya. Beberapa negara seperti Amerika Serikat, Australia, Inggris, Jerman, Jepang dan juga Indonesia telah banyak melakukan pengembangan proses ke arah komersialisasi. Sejak awal 1994, Indonesia dan Jepang telah melakukan program kerjasama riset pengembangan teknologi pencairan batubara secara langsung (Direct Brown Coal Liquefaction) untuk diterapkan di Indonesia.
Arah dan tujuan pengembangan riset adalah menciptakan proses yang efisien dan ramah lingkungan sehingga dapat diterapkan pada skala komersial. Berbagai perbaikan terhadap proses BCL yang sudah pernah diaplikasikan di Australia pada skala pilot plant telah menghasilkan banyak kemajuan, antara lain adalah pengurangan pemakaian katalis dan pelarut untuk mendapatkan konversi reaksi yang maksimum. Pengurangan jumlah katalis dapat terjadi karena dipergunakannya katalis yang sangat aktif seperti Ni, Co, Mo. Dampak lain yang
ditimbulkan: jumlah pemakaian pelarut dan limbah padat yang dihasilkan berkurang.
1.2. Permasalahan
Dalam studi ini, reaksi pencairan batubara tanpa menggunakan pelarut, tapi menggunakan katalis aktif seperti Ni/Mo dan Co/Mo telah dikaji.
Seperti diketahui, katalis Ni/Mo dan Co/Mo telah banyak digunakan di industri pengilangan minyak dan aktifitasnya lebih besar dibandingkan dengan katalis dasar besi (Fe). Namun demikian, harga katalis Ni/Mo dan Co/Mo masih mahal dibandingkan katalis dasar besi (Fe). Dalam proses skala besar, hal ini kemungkinan dapat diatasi karena penggunaan katalis logam transisi lebih kecil dibandingkan dengan jumlah katalis dasar besi (Fe).
Dari sudut pandang akademis, tidak adanya pelarut akan memudahkan analisa produk reaksi untuk mengetahui struktur kimia batubara yang terdegradasi ke dalam produk minyak secara akurat. Disamping itu, adanya katalis yang aktif untuk membantu reaksi pencairan secara cepat, dapat mengurangi penggunaan pelarut (Mastral, A.M., Mayoral, M.C., Rivera, J. and Maldonado, 1997). Jadi biaya produksi untuk mendapatkan pelarut yang berkualitas pada skala pabrik dapat dikurangi. Untuk beberapa hidrogenasi katalitik dengan Ni/Mo, Hulston et.al (Hulston, C.K.J., Redlich, P.J., Jackson, W.R., Larkins, F.P. and Marshall, M. 1997) mengindikasikan bahwa adanya pelarut (tetralin) justru mengurangi konversi dan yield asphalten, tetapi menaikkan konversi untuk reaksi berkatalis Co/Mo.
Studi pencairan batubara tanpa pelarut dengan memakai katalis Ni/Mo dan Co/Mo, lebih banyak dilakukan untuk batubara bituminous (Mastral.,1997; Anderson, R.R., 1984; Derbyshire, F.J., 1988; Davis, A., 1986) antara lain batubara dari Australia dan USA. Sedangkan untuk batubara muda jumlah studinya masih (Mastral, A.M, 1997; Hulston, C.K.J.,1997). Sebagaimana diketahui batubara dari lokasi yang berbeda akan memberikan karakteristik yang berbeda. Mengacu pada hal tersebut, maka dalam studi ini dilakukan kajian terhadap batubara muda dari Indonesia dengan metode pencairan tanpa pelarut.
Hasil penelitian dengan batubara bituminus (Hulston, C.K.J., 1997; Anderson, R.R., 1984; Derbyshire, F.J., 1988; Davis, A., 1986) membuktikan adanya efek sinergis antara Ni atau Co dengan Mo dalam mendapatkan konversi reaksi yang tinggi baik dengan penambahan sulfur ataupun tidak.
Studi tentang keaktifan katalis Ni/Mo dan Co/Mo yang diimpregnasikan kedalam support, seperti alumina (Al2O3), dalam hidrogenasi
batubara juga sudah banyak dilakukan (Laurent, E. and Delmon, B., 1993; Shabtai, J., Nag, N.K. and Massoth, F.E., 1987) dan diperoleh konversi yang baik. Akan tetapi, adanya support sangat menyulitkan untuk mengetahui peranan dan aktifitas katalis itu sendiri atau untuk memahami perbandingan aktifitas antara gabungan katalis logam transisi yang berbeda (Ni, Co or Mo).
Manfaat lain dari penggunaan katalis Ni, Co, Mo dalam proses pencairan batubara adalah mengurangi jumlah limbah padat yang dibuang. Jika memakai katalis Fe, maka jumlah limbah padat yang besar akan menjadi masalah jika tidak dilakukan pengelolaan secara tepat.
Oleh karena itu, metode pencairan batubara dengan katalis tanpa support dan tanpa pelarut diharapkan dapat mengatasi permasalahan-permasalahan di atas. Disamping itu, penggunaan kondisi reaksi yang moderat (tekanan awal dan suhu moderat) dalam studi ini dimungkinkan untuk meningkatkan efisiensi proses pencairan batubara.
1.3. Tujuan Riset
Riset dilakukan untuk mengetahui reaktifitas batubara muda, yakni lignit dan sub bituminus, pada reaksi pencairan batubara tanpa penambahan pelarut dengan memakai katalis Ni/Mo dan Co/Mo pada kondisi reaksi moderat. Aktifitas katalis dan sinergitas kombinasi dua logam diselidiki dengan melakukan pengujian memakai katalis secara individual (single) pada kondisi reaksi yang sama.
Reaksi pencairan batubara dilakukan juga dengan dan tanpa penambahan sulfur (CS2) untuk mengetahui sejauh mana pengaruh sulfur terhadap aktifitas katalis untuk mendapatkan konversi total yang tinggi.
1. Bahan dan Metode 1.1. Batubara
Batubara lignit yang dipergunakan berasal dari daerah Banko Selatan, Tanjung Enim-Sumatera Selatan. Sedangkan batubara sub bituminus diambil dari Tanito Harum, Kalimantan Selatan.
Analisa elemen batubara Banko Selatan (SB) dan Tanito Harum (TH) beserta analisa abu terdapat pada tabel 1 dan tabel 2 sebagai berikut:
Tabel 1. Analisa abu batubara Banko Selatan (SB) dan Tanito Harum (TH)
Jenis batubara % bkta C H S N O SB 73,7 5,3 0,5 1,4 19,1 TH 75,5 5,7 0,5 1,8 16,5
Tabel 2. Analisa elemen batubara Banko Selatan (SB) dan Tanito Harum (TH)
Jenis batubara Abu, % bk Inorganik, mmol/kg bk Fe Mg Na Ca SB 2,5 43 12 9 92 TH 8,3 79 60 39 130 %bk: % berat kering
%bkta: % berat kering tanpa abu
1.2. Metode Penambahan Katalis
Katalis yang dipergunakan di dalam penelitian ini adalah nikel(II) asetat, atau kobalt(II) asetat, dimana kedua katalis tersebut ditambahkan dengan konsentrasi 0,2% bk. Katalis yang lain adalah Mo yang ditambahkan sebagai senyawa ammonium heptamolybdat dengan konsentrasi 0,6% bk. Rasio berat katalis (Ni/Mo dan Co/Mo) yang dipergunakan dalam studi ini masih memenuhi range katalis untuk skala komersial yaitu 0.5-1 (Anderson, R.R., 1984).
Batubara sebanyak 10g basis kering, dicampur dengan air aquades di dalam erlenmeyer dan diaduk pada kondisi vakum selama kurang lebih 15 menit agar seluruh permukaan batubara terbasahi oleh air (membentuk slurry). Secara terpisah, senyawa katalis dilarutkan di dalam gelas beaker dengan ditambah 50ml aquades, kemudian dimasukkan ke dalam ultrasonic-bath selama 2 menit supaya seluruh senyawa terlarut sempurna (jika nikel atau kobalt dan molybdenum akan digunakan sebagai kombinasi, maka kedua katalis tersebut dicampur dengan air di dalam gelas beaker). Setelah itu, larutan katalis dimasukkan ke dalam campuran air-batubara yang sudah ada, dan pengadukkan diteruskan selama 30 menit dalam kondisi vakum agar katalis dapat terdispersi (terimpregnasi) secara sempurna ke dalam batubara.
Setelah itu campuran batubara-air-katalis dikeringkan menggunakan oven vakum pada suhu 30oC dan tekanan 0,1kPa. Kemudian, katalis disimpan di dalam kontainer kecil yang berlabel. Umur katalis yang terimpregnasi ke dalam pori batubara adalah sekitar 2 minggu. Setelah waktu itu, katalis impregnasi harus dibuat kembali. Sebelum dipergunakan untuk reaksi, batubara yang sudah diimpregnasi dengan katalis dikeringkan lagi di dalam oven vakum pada suhu 105oC dengan aliran gas nitrogen selama 1 jam.
Penambahan sulfur, sebagai senyawa CS2, sebanyak 0,03g dilakukan pada saat setelah
memasukkan umpan batubara (yang
terimpregnasi katalis atau tidak) ke dalam
autoclave/reaktor. Metode ini sudah dijustifikasi
oleh Derbyshire et. Al (Davis, A., 1986) pada saat
mensulfidasi Mo, dimana hasil konversi reaksi yang diperoleh optimum.
1.3. Kondisi Reaksi
Seluruh reaksi dilaksanakan dengan
menggunakan reaktor autoclave bervolume 35ml yang terbuat dari material stainless steel. Berat umpan batubara (baik sudah atau belum diimpregnasi dengan katalis) adalah 1g basis kering. Pertama-tama, udara di dalam autoclave dihisap dengan menggunakan pompa vakum. Setelah itu, dialirkan gas hidrogen ke dalam
autoclave sampai pada tekanan 8MpaG dan
disimpan (tekanan dijaga pada tekanan tersebut) selama beberapa menit. Kemudian dilakukan test kebocoran memakai gas detektor. Jika tidak ada kebocoran, kemudian tekanan gas hidrogen diturunkan sampai 6MPaG (sebagai standard tekanan awal). Autoclave kemudian ditempatkan pada sebuah batang penyangga/shaft (1 batang penyangga dapat memegang 2 autoclave) dimasukkan ke dalam unggun pasir (fluidised
sand-bath) yang bersuhu 460oC dan dalam
waktu 2 (dua) menit suhu reaksi 400oC (fluktuasi suhu berkisar antara + 2oC) dapat dicapai. Setelah tercapai kondisi tersebut, waktu reaksi dimulai dan suhu dijaga pada kisaran suhu 400o+2oC selama 30 menit (dalam studi ini, waktu reaksi ditentukan pada 30 menit). Setelah reaksi selesai, segera ambil shaft dari unggun pasir dan dicelupkan ke dalam bak air sambil dihembuskan udara tekan ke arah badan
autoclave, agar pendingin dapat cepat tercapai.
Pemilihan suhu 400oC dan waktu reaksi 30 menit tersebut di atas dimaksudkan untuk mencegah terjadinya reaksi cracking yang
berlebihan dan reaksi kondensasi
(repolimerisasi).
1.4. Metode Pengambilan Produk
Setelah pendinginan selesai, gas hasil reaksi dibuang (vent-off) di dalam lemari asam
(fume-hood). Gas hasil reaksi tidak dianalisa, karena
jumlahnya yang relatif kecil. Campuran produk cair dan padatan di dalam reaktor diambil dengan membilas memakai dichloromethane (CH2Cl2). Hasil pengambilan dan pembilasan dimasukkan langsung ke dalam RBF (round bottom flask) 250ml. Kemudian dilakukan fraksinasi selama 2
jam terhadap produk di dalam RBF
menggunakan distilasi lundin, untuk memisahkan air dari produk minyak dan residu.
Setelah 2 jam, RBF diambil dari kolom distilasi dan dibiarkan selama 5 menit supaya dingin dan selanjutnya diletakkan di dalam
ultrasonic-bath selama 10 menit, untuk
membantu pelarutan produk menjadi minyak atau asphalten. Setelah itu dilakukan proses filtrasi
untuk memisahkan fraksi produk residu dan fraksi produk komponen minyak (minyak dan asphalten). Fraksi residu ini adalah yang tidak larut dalam CH2Cl2 dan kemudian dikeringkan di dalam oven vakum selama 3 jam dengan dialiri gas nitrogen untuk mencegah oksidasi. Setelah pengeringan dan pendinginan di dalam desicator dilakukan penimbangan untuk mengetahui berat residu. Dari berat tersebut, dapat dilakukan perhitungan konversi total reaksi. Pada saat pengeringan fraksi residu, fraksi komponen minyak diekstrak dengan cara penguapan
memakai rotary evaporator, untuk
menghilangkan senyawa CH2Cl2 dari campurannya dengan minyak.
Penambahan hexan/shell-X4 ke dalam fraksi minyak yang sudah bebas dari dichloromethane (fraksi minyak bebas CH2Cl2 disimpan di dalam RBF 250ml) dilakukan setelahnya, pada saat RBF diletakkan di dalam ultrasonic bath. Kemudian, campuran hexan/shell-X4 dengan fraksi minyak tersebut dipisahkan secara filtrasi, setelah di-ultrasonic bath selama 2 menit dan didiamkan di luar ultrasonic bath selama 10 menit untuk mengendapkan padatan (fraksi yang tidak larut di dalam hexan/shell-X4). Fraksi yang tidak larut dalam hexan/shell-X4 disebut asphalten, fraksi yang terlarut dalam hexan/shell-X4 disebut minyak (oil).
Beberapa run diulang sebanyak dua kali. Akibatnya, konversi total yang bervariasi lebih kecil dari 2% dan asphalten bervariasi kurang dari 1%, dapat dianggap sama. Jika hasil reaksi ada yang berbeda melebihi batasan angka-angka di atas, maka perbedaannya tergolong signifikan
1.5. Perhitungan konversi dan yield Asphalten Konversi total (% bkta) didefinisikan sebagai 100% - yield residu bebas abu. Yang dimaksud sebagai abu dalam konteks ini adalah abu setelah reaksi (di dalam abu residu) yang mengandung senyawa katalis dan abu batubara.
Yield asphalten (% berat daf) adalah berat
asphaltene dibagi berat batubara bebas abu dan katalis. Mengukur atau menghitung berat mineral dan inorganik dalam abu residu sangat sulit, maka penghitungan dilakukan secara umum menggunakan asumsi mineral + inorganik di dalam residu = mineral + inorganik di dalam batubara.
Pada reaksi hidrogenasi, setelah reaksi katalis-katalis Ni, Co dan Mo akan membentuk senyawa NiO, CoO dan MoO3 (pada reaksi tanpa memakai tambahan sulfur). Tetapi, jika selama reaksi digunakan sulfur, senyawa yang terbentuk adalah NiS, CoS dan MoS2. Untuk berat masing-masing senyawa, dapat dilihat pada tabel 3.
Tabel 3. Berat masing-masing senyawa yang terbentuk selama hidrogenasi
Kons. awal di dalam batubara a Kons. katalis di residu b Kons. katalis di residu c Ni 0,2 0,0026 0,0031 Co 0,2 0,0026 0,0031 Mo 0,6 0,0090 0,0100 a % bkta b
tanpa sulfur (g/g batubara terimpregnasi)
c
dengan sulfur (g/g batubara terimpregnasi)
2. HASIL DAN PEMBAHASAN
2.1. Pengaruh penambahan katalis Ni/Mo dan Co/Mo terhadap konversi total pencairan batubara
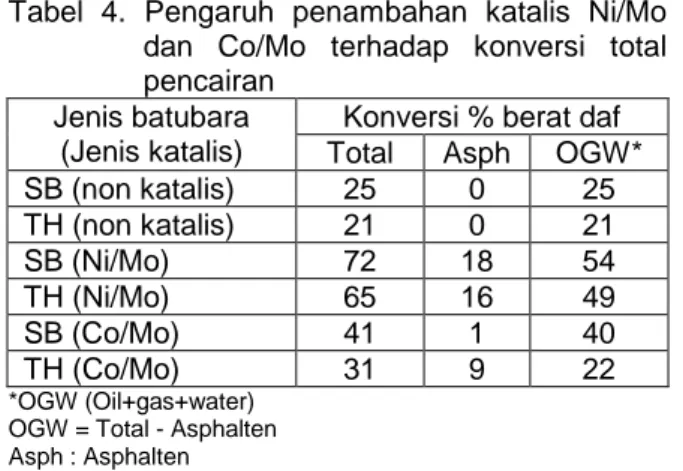
Pada Tabel 4 ditunjukkan pengaruh penambahan katalis dalam hidrogenasi selama 30 menit yang dapat meningkatkan konversi total secara signifikan dibanding reaksi tanpa menggunakan katalis. Kenaikkan konversi total dan asphalten dengan katalis Ni/Mo lebih besar (47% dan 44%) daripada dengan katalis Co/Mo (16% dan 6%) untuk kedua batubara SB dan TH.
Hasil tersebut mengindikasikan bahwa katalis Ni/Mo lebih aktif daripada katalis Co/Mo untuk kondisi reaksi pencairan tanpa pelarut. Hulston et.al juga mendapatkan hasil serupa (Hulston, C.K.J., 1997) saat mencairkan batubara lignit Loy Yang ROM, Australia.
Selain itu, juga didapatkan bahwa konversi total reaksi berkatalis Ni/Mo dan Co/Mo lebih besar untuk SB (lignit) daripada untuk TH (sub bituminus). Hal ini diterangkan oleh dua kemungkinan dengan penjelasan sebagai berikut:
Perubahan-perubahan yang dihasilkan dari perbedaan struktur dan reaksi dengan ikatan-ikatan individu di dalam struktur batubara, dimana kandungan oksigen untuk kedua batubara tersebut berbeda, mengakibatkan hasil pemutusan ikatan C=O membentuk ikatan C=C menjadi lebih mudah untuk lignit daripada sub bituminus. Selain itu, terdapat juga kemungkinan bahwa sub bituminus memiliki struktur yang lebih kuat (condensed structure) (Redlich, P.J., Jackson, W.R. and Larkins, F.P., 1989) dan stabil dibandingkan dengan lignit, sehingga dekomposisi sub bituminus lebih lambat.
Interaksi antara katalis dengan elemen-elemen di dalam struktur batubara, seperti gugus fungsi yang mengandung sulfur, diperkirakan dapat menimbulkan perubahan-perubahan pada sifat katalis. Kemungkinan ini diperkuat oleh hasil yang bervariasi pada kondisi fase sulfur (Laurent, E. 1993; Shabtai, J., Nag, N.K. and Massoth, F.E.,
1987), dimana terbukti dapat menyebabkan perbedaan yang signifikan pada aktifitas katalis.
Tabel 4. Pengaruh penambahan katalis Ni/Mo dan Co/Mo terhadap konversi total pencairan
Jenis batubara (Jenis katalis)
Konversi % berat daf
Total Asph OGW*
SB (non katalis) 25 0 25 TH (non katalis) 21 0 21 SB (Ni/Mo) 72 18 54 TH (Ni/Mo) 65 16 49 SB (Co/Mo) 41 1 40 TH (Co/Mo) 31 9 22 *OGW (Oil+gas+water) OGW = Total - Asphalten Asph : Asphalten
Kondisi reaksi: 1g batubara bk tanpa katalis atau dengan Ni/Mo atau Co/Mo pada tekanan awal 6MPaG (H2)
dipanaskan sampai suhu reaksi 400oC dan reaksi berlangsung selama 30 menit pada suhu tersebut.
Salah satu atau bahkan kedua alasan di atas juga mungkin bisa menjelaskan penyebab adanya perbedaan relatif antara Ni/Mo dan Co/Mo pada studi-studi sebelumnya. Namun, perbedaan tersebut mungkin juga disebabkan Ni/Mo dan Co/Mo cenderung memacu reaksi dengan makanisme yang berbeda (Laurent, E. and Delmon, B., 1993, Zhou, P., Dermer, O.C. and Crynes, B.L.,1984).
Selanjutnya, perbandingan reaktifitas batubara SB terhadap TH dilakukan dengan melihat rasio asphalten terhadap OGW. Rasio Asphalten/OGW untuk TH, baik dengan katalis Ni/Mo atau Co/Mo, lebih besar daripada yang untuk SB. Penyebabnya adalah reaksi dekomposisi struktur batubara TH cenderung membentuk berat molekul yang lebih besar yang tidak larut di dalam hexan atau shell-X4 sehingga akan membentuk asphalten.
Penyebab yang lainnya kemungkinan adalah kandungan oksigen batubara TH yang relatif lebih kecil dibanding SB. Hal tersebut mengakibatkan aktifitas deoksigenasi Co/Mo relatif lemah terhadap gugus C=O dalam batubara TH, sehingga konversi total SB/Co/Mo lebih besar daripada TH/Co/Mo.
Untuk menjelaskan lebih jauh pengaruh kemungkinan nomor 2 terhadap perbedaan aktifitas katalis Ni/Mo dan Co/Mo, dilakukan penambahan sulfur terhadap kedua sistem katalis.
2.2. Pengaruh penambahan sulfur pada katalis Ni/Mo dan Co/Mo terhadap konversi total pencairan batubara
Sudah banyak bukti yang mendukung adanya pengaruh positif penambahan sulfur di dalam reaksi pencairan batubara baik dengan pelarut maupun tanpa pelarut (Hulston, C.K.J., 1997; Davis, A., 1986). Meskipun demikian, pengkajian terhadap pengaruhnya pengaruhnya pada kondisi moderat dan tanpa pelarut masih belum dilakukan.
Dalam Tabel 5 diindikasikan bahwa penambahan sulfur terhadap reaksi berkatalis Ni/Mo dan Co/Mo pada SB dan TH secara efektif menaikkan konversi total dan kenaikkan tersebut untuk batubara SB dan TH pada kedua sistem katalis adalah sama besarnya.
Tabel 5. Pengaruh penambahan sulfur (CS2) pada katalis Ni/Mo dan Co/Mo terhadap konversi total pencairan batubara
Jenis batubara (Jenis katalis)
Konversi % bkta Total Asp. OGW*
SB (non kat./CS2) 26 1 25 TH (non kat./CS2) 23 1 22 SB (Ni/Mo/CS2) 82 19 63 TH (Ni/Mo/CS2) 75 24 51 SB (Co/Mo/CS2) 82 19 63 TH (Co/Mo/CS2) 74 18 56 *OGW=Oil+gas+water OGW = Total - Asphaltene
Kondisi reaksi: semuanya sama dengan Tabel 4, tapi ditambah 0.03 g sulfur (CS2) untuk reaksi tanpa katalis atau
dengan Ni/Mo atau Co/Mo.
Penambahan sulfur dalam sistem katalis Ni/Mo diperkirakan dapat mengakibatkan struktur ikatan di dalam asphalten pecah menjadi minyak atau mengakibatkan putusnya sebagian besar struktur kimia batubara secara katalitik dan panas (thermal) menjadi minyak (yang diindikasikan dengan sedikitnya perubahan pada
yield asphalten).
Penambahan sulfur terhadap sistim katalis Co/Mo mengakibatkan produksi asphalten meningkat secara signifikan. Kondisi ini menunjukkan bahwa mekanisme reaksi Co/Mo dan Ni/Mo berbeda. Co/Mo dengan bantuan sulfur memutus ikatan C=O dan cincin aromatis lalu membentuk senyawa yang berat molekulnya tinggi.
Untuk kedua sistem katalis, asio asphalten/OGW menunjukkan hasil yang sama pada batubara SB. Untuk batubara TH, di sisi lain, terdapat sedikit perbedaan antara Ni/Mo dan Co/Mo. Ini membuktikan kurangnya efektifitas Co/Mo dalam dekomposisi struktur ikatan C=O menjadi minyak (sebagian besar membentuk asphalten) meskipun di dalam reaksi sudah ditambahkan sulfur.
Hasil riset juga memperlihatkan bahwa dengan adanya penambahan sulfur, perbedaan konversi untuk kedua sistem katalis tersebut hilang. Terlepas dari itu, katalis sistem Co/Mo mengalami kenaikan lebih besar daripada Ni/Mo. Kondisi tersebut diperkirakan terjadi karena dibandingkan dengan Co/Mo, Ni/Mo tanpa sulfur sudah cukup efektif untuk mendagradasi struktur batubara. Namun jika Co/Mo digunakan, penambahan sulfur menjadi sangat bermanfaat. Untuk mengetahui sejauh mana sulfur mempengaruh masing-masing atom katalis Co atau Mo perlu dilakukan pembuktian dan penyelidikan untuk pengaruh sulfur terhadap keaktifan katalis Co/Mo
Untuk memahami perbedaan antara Ni/Mo dan Co/Mo serta keaktifan katalis tersebut dilingkungan yang cukup terdapat sulfur, maka dilakukan pengujian dengan penambahan sulfur dan tanpa penambahan sulfur terhadap masing-masing katalis yaitu Ni, Co dan Mo yang diimpregansikan ke dalam batubara secara terpisah.
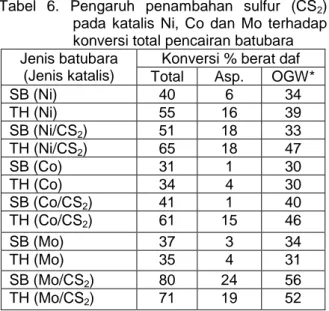
3. Pengaruh penambahan individu katalis Ni, Co, Mo, terpisah, dengan dan tanpa sulfur pada konversi total pencairan batubara Pada Tabel 6, dapat dilihat distribusi produk untuk batubara SB dan TH yang direaksikan dengan penambahan katalis Ni, Co dan Mo secara terpisah baik dengan sulfur maupun tidak dengan sulfur.
Dari eksperimen yang dilakukan terhadap batubara SB didapat hasil yang menunjukkan bahwa penambahan katalis Ni, Co dan Mo yang ditambahkan secara terpisah tanpa ditambahkan sulfur (CS2), sangat tidak aktif sebagai katalis hidrogenasi. Tingkat keaktifan katalis menurun dengan urutan sebagai berikut Ni>Mo>Co.
Penambahan sulfur, sebaliknya, dapat meningkatkan keaktifan katalis-katalis tersebut sehingga konversi total dan yield OGW juga meningkat. Kemudian tingkat keaktifan katalis berubah dengan urutan sebagai berikut Mo>>Ni>Co. Tingginya aktifitas Mo/CS2 dibandingkan dengan reaksi berkatalis sama, tapi tanpa adanya sulfur pada pencairan tanpa pelarut telah dibuktikan juga oleh peneliti-peneliti lainnya (Mastral, A.M., 1997; Hulston, C.K.J., 1997; Derbyshire, F.J., 1988; Davis, A., 1986).
Tabel 6. Pengaruh penambahan sulfur (CS2) pada katalis Ni, Co dan Mo terhadap konversi total pencairan batubara Jenis batubara
(Jenis katalis)
Konversi % berat daf
Total Asp. OGW*
SB (Ni) 40 6 34 TH (Ni) 55 16 39 SB (Ni/CS2) 51 18 33 TH (Ni/CS2) 65 18 47 SB (Co) 31 1 30 TH (Co) 34 4 30 SB (Co/CS2) 41 1 40 TH (Co/CS2) 61 15 46 SB (Mo) 37 3 34 TH (Mo) 35 4 31 SB (Mo/CS2) 80 24 56 TH (Mo/CS2) 71 19 52 *OGW=Oil+gas+water OGW = Total - Asphaltene
Kondisi reaksi semuanya sama dengan Tabel 4 dan Tabel 5. Keaktifan katalis sistem Mo/CS2 ini dimungkinkan karena selama reaksi telah terbentuk senyawa aktif Mo-S2 (Mastral, A.M., 1997), sebagaimana pyrrhotite pada kasus pemakaian katalis Fe. Keaktifan senyawa Mo-S2 semakin terjaga jika di dalam reaktor atau
autoclave terdapat cukup H2S, yang dihasilkan
dari reaksi antara gas H2 dan sulfur dari CS2. Pada studi ini, penambahan sulfur (sebagai CS2) sudah cukup untuk menghasilkan konsentrasi H2S di dalam fase gas. Sedangkan peningkatan aktifitas Ni setelah ditambahkan sulfur juga dikonfirmasikan oleh hasil riset dari Shabtai et.al (Shabtai, J., Nag, N.K. and Massoth, F.E., 1987; Shabtai, J., 1988) dan Okutani et.al (Okutani, T., 1983). Kemungkinan mekanisme yang sama dengan Mo-S2 juga mungkin terjadi.
Diperoleh dari hasil studi, konversi reaksi dari Mo/CS2 yang hampir sama dengan konversi reaksi dari Ni/Mo/CS2 pada pencairan batubara SB. Asphalten yang dihasilkan dari reaksi Ni/Mo/CS2 lebih rendah dibandingkan dengan reaksi Mo/CS2. Ini disebabkan oleh adanya efek sinergis antara atom Ni dan atom Mo yang mengakibatkan aktifitas katalis Ni/Mo/CS2 mampu mendagradasi asphalten menjadi fraksi OGW, dimana minyak yang dihasilkan meningkat jumlahnya.
Untuk batubara TH, aktifitas katalis Ni, Co dan Mo tanpa penambahan sulfur hampir sama dengan hasil penemuan untuk batubara SB. Disamping itu tingkat keaktifan katalis individu mirip dengan SB yaitu Ni>CoMo.
Penambahan sulfur terhadap sistem katalis Ni pada batubara TH mengakibatkan terjadinya peningkatan konversi yang sama dengan
batubara SB. Tetapi, hasil yang sama tidak dijumpai pada sistem katalis TH/Co/CS2. Co/CS2 dapat meningkatkan konversi untuk batubara TH sampai 27% dibandingkan terhadap SB yang hanya 10%. Sampai saat ini, keaktifan Co/CS2 pada TH masih belum dapat dijelaskan. Hulston et. Al (Hulston, C.K.J., 1997) melalui studinya yang menggunakan senyawa model (model
compound) juga belum berhasil menjelaskan
fenomena tersebut. Sangat sulit untuk mengetahui apakah pengaruh efektifitas fase Co-S bisa secara optimal terbentuk pada batubara sub bituminus dibandingkan batubara lignit.
Mekanisme fundamental menerangkan bahwa pengaruh sinergistas (promosi reaksi) yang dilakukan oleh katalis Ni dan Co (minimal di dalam reaksi dengan sulfur) adalah atom Ni atau Co meningkatkan densitas elektron pada posisi atom Mo, sehingga aktifitas katalitik atom Mo meningkat (Chianelli, R.R., Daage, M. and Ledoux, M.J., 1994). Atom Ni atau Co tersebut diperkirakan berada pada jarak yang dekat terhadap atom Mo sehingga mempunyai efek yang besar terhadap keaktifan katalis gabungan.
Untuk memperjelas perbedaan aktifitas katalis pada batubara SB dan TH adalah konsentrasi logam-logam yang digunakan di dalam eksperimen ini (0,2%bk Ni atau Co dan 0,6%bk Mo) sangat cukup sehingga beberapa atom Ni atau Co dan atom Mo dapat saling berdekatan satu dengan yang lainnya pada permukaan pori batubara SB daripada batubara TH (hal ini didukung oleh kenyataan dalam penemuan bahwa struktur batubara TH lebih kuat dan padat/condensed dibandingkan batubara SB, sehingga distribusi atom Ni atau Co dan interaksi dengan atom Mo lebih mudah terjadi pada batuabara SB dibandingkan batubara TH). Hal ini juga dibuktikan oleh Hulston et.al (Hulston, C.K.J., 1997) yang memberikan gambaran perbedaan atom Ni, Co dan Mo yang terdispersi di dalam batubara lignit dan bituminus pada saat persiapan impregnasi katalis-batubara. Pengaruh pendispersian yang berbeda menyebabkan konversi reaksi yang berbeda antara lignit SB dan sub bituminus TH dapat saja terjadi. Tetapi, perbedaan tersebut hanya menggambarkan kondisi awal penyiapan impregnasi katalis, tidak pada saat reaksi berlangsung. Kemungkinan kondisi katalis di dalam batubara masih belum diketahui pengaruhnya. Namun demikian, hasil pengujian di dalam studi ini, yang membuktikan adanya efek sinergis antara Ni dan Mo untuk batubara lignit. Hal ini juga telah dikonfirmasi oleh hasil eksperimen terdahulu terhadap batubara lignit dari Australia, Jepang dan USA (Hulston, C.K.J., 1997; Shabtai, J., Nag, N.K. and Massoth, F.E., 1987; Shabtai, J., 1988).
Untuk reaksi tanpa penambahan sulfur, variasi pemakaian jumlah sulfur dan jumlah sulfur yang sudah berada di dalam batubara akan mempengaruhi aktifitas katalis. Di dalam studi ini, kandungan sulfur di dalam kedua batubara (SB dan TH) relatif rendah dan sama untuk dapat memberikan pengaruh yang besar terhadap jalannya reaksi. Jadi perbedaan konversi antara SB dan TH pada reaksi pencairan tanpa adanya sulfur lebih banyak dipengaruhi oleh struktur batubara yang berbeda. Hasil ini menunjukkan bahwa tingginya konsentrasi Fe di dalam TH tidak efektif untuk mempercepatan reaksi.
Namun hasil pengujian mengindikasikan bahwa antara Ni dan Mo tidak mempunyai efek sinergi dala proses pencairan batubara TH, meskipun gabungan katalis Ni/Mo memberikan konversi yang lebih tinggi dibandingkan penggunaan katalis Ni dan Mo secara terpisah. Ketika sulfur ditambahkan ke dalam reaksi, efektifitas ketiga logam tersebut bervariasi dibandingkan pengaruhnya terhadap batubara SB. Tetapi, tingkat aktifitas ketiga logam tersebut di dalam pengaruh penambahan sulfur hampir mirip dibandingkan dengan SB (Mo>NiCo)
4. KESIMPULAN
Secara umum, hasil studi menunjukkan bahwa batubara Indonesia baik Banko Selatan (SB) maupun Tanito Harum (TH) dapat digunakan sebagai bahan baku proses pencairan batubara tanpa pelarut. Penambahan katalis ke dalam reaksi memiliki pengaruh yang sangat signifikan untuk meningkatkan konversi total reaksi dan
yield OGW.
Hasil eksperimen juga menunjukkan bahwa pada kondisi di dalam studi ini, katalis Ni/Mo lebih aktif dibandingkan dengan katalis Co/Mo. Perbedaan aktifitas antara Co/Mo dalam pencairan SB dan Co/Mo dalam mencairkan TH juga dipengaruhi oleh kandungan oksigen batubara SB dan TH yang berbeda. Katalis Co/Mo yang dikenal sebagai katalis deoksigenasi kurang efektif dalam degradasi batubara TH, yang kandungan oksigennya relatif lebih kecil dibandingkan dengan SB. Disamping itu faktor struktur batubara yang berbeda antara SB (lignit) dan TH (sub bituminus) turut mempengaruhi konversi reaksi yang diperoleh, karena struktur molekul batubara SB lebih lemah ikatannya dibandingkan TH, sehingga batubara SB lebih reaktif pada kondisi di dalam studi ini.
Perbedaan konversi antara Ni/Mo dan Co/Mo hilang ketika dalam reaksi katalis tersebut ditambahkan sulfur. Penambahan sulfur sangat efektif dalam peningkatan aktifitas katalis pada kondisi reaksi moderat.
Secara keseluruhan, hasil studi ini merupakan konfirmasi terhadap studi pencairan yang dilakukan sebelumnya. Hasil studi terhadap batubara SB menunjukkan bahwa batubara SB sangat berpotensi untuk digunakan sebagai bahan baku proses pencairan batubara pada kondisi moderat dengan memakai katalis Ni, Co atau Mo ataupun gabungan Ni/Mo dan Co/Mo. Untuk hasil konversi yang terbaik, katalis Mo atau Ni/Mo digunakan bila ada penambahan sulfur dan walaupun tidak ditambahkan sulfur, katalis Ni/Mo juga sudah cukup memberikan hasil optimal. Dari hasil studi ini, dapat dilakukan pengujian katalis secara terpisah untuk membantu menjelaskan perbedaan aktifitas katalis Ni/Mo dan Co/Mo serta mengetahui efektifitas penambahan sulfur terhadap reaksi pencairan batubara muda.
Meskipun batubara TH memiliki konversi lebih rendah dibandingkan batubara SB, peranan katalis Ni/Mo (tanpa penambahan sulfur) atau katalis Mo (dengan sulfur) dengan kondisi reaksi dalam studi ini, menjanjikan potensi pengembangan proses pencairan batubara sub bituminus di Indonesia.
DAFTAR PUSTAKA
Anderson, R.R., Bockrath, B.C.,"Effect of Sulphur on Coal Liquefaction in the Presence of Dispersed Iron or Molybdenum Catalysts", Fuel, 63, 1984, 329-333.
Anonim, Program Manual PTPSE: Pengkajian dan Penerapan Teknologi gasifikasi sebagai SuSBtitusi BBM dan BBG, 2010, BPPT, hal-6. Chianelli, R.R., Daage, M. and Ledoux,
M.J.,”Fundamental Studies of Transition- Metal Sufide Catalytic Materials”, Advanced in Catalyst, 40, 1994, 177-232.
Davis, A., Derbyshire, F.J., Finseth, D.H., Lin, R., Stansberry, P.G. and Terrer, M.T.,"Catalytic Hydrogenation of Coals in the ASBence of Solvent: 1. Compositional Changes of An HvA Bituminous Coal by Chemical Analysis and Reflected Flurescent Light Microscopy", Fuel, 65, 1986, 500-506.
Derbyshire, F.J., Terrer, M.T., Davis, A. and Lin, R.,"Dry Catalytic Liquefaction of A Subbituminous Coal: Structure Inferences", Fuel, 67, 1988, 1029-1035.
Hulston, C.K.J., Redlich, P.J., Jackson, W.R., Larkins, F.P. and Marshall, M.,"Hydrogenation of a Brown Coal Pretreated with
Water-Soluble Nickel/Molybdenum and
Cobalt/Molybdenum Catalysts", Fuel, 76, No.14/15, 1997, 1465-1469.
Laurent, E. and Delmon, B.," Influence, Industrial and Engineering Chemistry Research, 32, 1993, 2516.
Mastral, A.M., Mayoral, M.C., Rivera, J. and Maldonado, F.,"New Approach to Coal Structure through Its Evolution during Dry Catalytic Hydrogenation", Energy and Fuels, 11, 1997, 483-490.
Okutani, T., Yokoyama, S.I., Maekawa, Y., Furuichi, R. and Ishii, T.,”Coal Liquefaction with H2S-H2 Gas Mixture and Metal Oxide Catalysts”, Industrial Engineering Process, Design and Development, 22, 1983, 306-312.
Redlich, P.J., Jackson, W.R. and Larkins, F.P.,"Studies Related to the Structure and Reactivity of Coals: 15. Conversion Characteristics of A Suite of Australian Coals", 68, 1989, 231-237.
Shabtai, J., Nag, N.K. and Massoth, F.E.," Catalytic Functionalities of Supported Sulfides: IV. C-O Bond Hydrogenolysis Selectivity as A Function of Promoter Type", Journal of Catalyst, 104, 1987, 413-423.
Shabtai, J., Guohe, Q., Balusani, K., Nag, N.K. and Massoth, F.E.,"Catalytic Functionalities of
Supported Sulfides: V. C-N Bond
Hydrogenolysis Selectivity as A Function of Promoter Type", Journal of Catalyst, 113, 1988, 206-219.
Weller, S. and Pelipetz, M.G., "Coal Hydrogenation Catalysts: Studies of Catalyst Distribution", Industrial and Engineering Chemistry, 43, 1951, 1243-1246.
Zhou, P., Dermer, O.C. and Crynes, B.L.,"Oxygen in Coals and Coal-Derived Liquids", in 'Coal Science', 3, Eds. Gorbaty,M.L., Larsen, J.W.and Wender, I., Academic Press., Orlando, 1984,253-300.