S K R I P S I
SET 1 A D E W I W U L A N S A R I
P E R C O B A A N P E N U M B U H A N K A L U S
A G A V E A M A N I E N S I S T REL. & N O W E L L
S E R T A DET EK SI S T E R O I D N Y A
FAKULTAS FARMAS1 UNIVERSITAS AIRLANGGA
PERCOBAAN PENUMBUHAN KALUS
AGAVE AMANIENSIS TREL. & NOWELL
SERTA DETEKSI STEROIDNYA
SKRIPSI
DIBUAT UNTUK MEMENUHI TUGAS AKHIR
MENCAPAI GELAR SARJANA FARMASI
PADA FAKULTAS FARMASI
UNIVERSITAS AIRLANGGA
Disetujui oleh pembimbing
D_R/ NQOR._IFA_NSYAH
untuk yang tercinta
mas ton
dan
sahabat-sahabatku
myr, ran* et, mar, rin.
KATA PENGANTAR
Segala puji dan syukur eaya panjatkan pada Allah swt
yang melimpahkan rahmatNya, sehingga saya dapat raenyele -
saikan tugas untuk menyusun skripsi ini sebagai salah satu
syarat mencapai gelar sarjana pada Fakultas Farmasi Univer
sitas Airlangga.
Hasil yang diperoleh dari skripsi yang berjudul "Per-
cobaan Penurabuhan Kalus Agave amaniensis Trel. & Nowell
'serta Deteksi Steroidnya" ini, sangatlah sederhana dan ja-
uh dari sempurna. Naraun demikian, harapan saya, seraoga ha
sil sederhana yang diperoleh ini dapat bermanfaat sebagai
langkah awal untuk penelitian-penelitian selanjutnya.
Untuk itu perkenankanlah pada kesempatan ini saya me-
nyampaikan rasa terima kasih yang tulus dan sedalam-dalam-
nya kepada :
Bapak DR. Noor Ifaneyah, Bapak DR. Gunawan Indrayanto
serta Ibu Dra. Isnaeni MS sebagai pembimbing yang telah
berkenan meluangkan waktu untuk membimbing, memberikan sa-
ran, pengarahan dan semangat serta dorongan moral yang sa-
ngat berharga selama saya melakukan penelitian hingga se -
lesainya penulisan skripsi ini,
Kepala Kebun Raya Cabang Purwodadi - Pasuruan Jawa
Timur yang telah membantu memberikan tanaman sebagai bahan
Ketua Jurusan Biologi Farmasi dan Laboratorium Bio -
teknologi Fakultas Farmasi Universitas Airlangga yang te-
lah menyediakan fasilitas seiaraa penelitian.
Tidak lupa pula kepada bapak dan ibu dosen, rekan-
rekam mahasiswa serta semua pihak yang tidak dapat saya
sebutkan satu per satu yang telah dengan tulus ikhlas mem-
berikan dorongan moral dan bantuan, juga kepada para kar-
yawan jurusan biologi farmasi yang telah membantu kelancar-
an penelitian ini, saya sampaikan rasa terima kasih yang
tulus pula.
Terakhir kepada suami saya, atas dukungan moral dan
pengertiannya demikian juga kepada sahabat-sahabat saya,
saya sangat berterima kasih.
Semoga segala amal baik yang telah diberikan ter^ebut
.mendapat balasan yahg melimpah dari Allah sv/t,
Arnin.
Surabaya, Januari 1988
DAFTAR ISI
II. TINJAUAN PUSTAKA 1. Tinjauan tentang kultur jafcingan tanam-an ... ... ... ...
5
1.1. Media Kultur jaringan tanaraan .... ... 6
1.2. Hormon p«rtumbuhan tanaman ... 7
1.3. Teknik kultur jaringan tanaraan untuk produksi metabolit eekunder ... ... 8
2. Tinjauan tentang steroid ... 11
2.1. Deteksi steroid ...
13
Halaman
2. Alat- alat yang digunakan ... ...18
3
. Metode penelitian ... ...183-1. Pembuatan media ... ... ...18
3.2. Penanaman eksplan ... .... 2k
3*3# Pemeriksaan kalus yang terbentuk.. 27
3**+.. Pemeliharaan kalus yang telah
tum-buh ... .... 27
3.5. Deteksi steroid dari kalus ... .... 28
3.5*1. Reaksi warna pada ekstrak
kloroforra ... ... .... 23
3.5*2. Analisis kualitatif dengan
kromatotfrafi lapis tipis ..
29
IV. HASIL PENELITIAN
1. Pemeriksaan kalus yang terjadi ... .... 31
2. Subkultur kalus A,flave amaniensis Trel. &
Nowell ... '... ....
35
3. Deteksi steroid dalara kalus ... ... 36
3*1. Hasil reaksi warna Salkowski •••••• 36
3.2. Hasil reaksi warna Liebermann-.
Burchard ... .... 37
3.3. Hasil kromatografi lapis tipis
ter-hadap ekstrak kloroform ... ....
38
V. PEMBAHASAN
1. Penumbuhan kalus ... ...
^7
1
.1
. Pemilihan eksplan ... .... t+71.2. Pemilihan media uatuk penanaman eks
plan ... ....
^7
2. Deteksi steroid ualara kalas ... ... 50
Halaman
VII. SARAN' - SARAN ... . /...
53
VIII. RINGKASAN ...
54
DAFTAR TABEL
I. Komposisi kimiawi media hurashige &
Skoog ...
21
II. Korabinasi dan kadar hormon pertum
-buhan yang ditambahkan pada media MS
untuk pcnumbuhan kalus Agave amanien
sis Trel. & Nowell ... 22
III. Kombinasi hormon pertumbuhan yang
dapat menumbuhkan kalus Agave ama
-niensis Trel. & Cowell ... 32
IV. Pemeriksaan makroskopis kalus Agave
amaniensis Trel. Sc Nowell ... 3*t
V. Hasil reaksi warna ekstrak kloroform
dengan pereaksi Salkowski ... 3?
VI. Hasil reaksi warna LiebermannBur
-chard terhadap ekstrak kloroform ...
38
VII. Hasil kromatografi lapis tipis eks
trak kloroform kalus Agave
amanien-sis Trel. & Nowell ... 39
VIII. Hasil kromatografi lapis tipis eks
trak kloroform knave amaniensia
Trel. & Nowell ... i+3
IX. Jenis steroid yang terdeteksi dalam
kalus Agave amaniensirs Trel. & Nowell i
+6
DAFTAR GAMBAR
1. Skema langkah-langkah produksi
meta-bolit sekunder ...
10
2. Skema pembagian sapogenin steroid •• 12
3. Agave amaniensis Trel. & Nowell ... 15
b, Agave a m a n i o n s l G Trel* & Nowell beru.
mur
1 - 2
bulan yang digunak'an seba-gai sumber eksplan ...
17
5. Skema pembuatan media ... 20
6
. Daun Agave amaniensis Trel, & Nowellyang akan ditanam pada media •••«•• 25
7. Penanaman eksplan pada media ... 26
8
* Kalus Agave amaniensis Trel, & Nowell 359. Sel-sel kjilus Agave amaniensis Trel.
& Nowell ... 36
10, Kromatogram ekstrak kloroform kalus
Agave amaniensis Trel. & Nowell ...
41
11. Kromatogram ekstrak kloroform
Agave amaniensis Trel. & Nowell ,,. kb
BAB I
PENDAHULUAN
Penelitian-penelitian dalam bidang kultur jaringan ta
naman dimulai sejak keberhasilan White dan Gautheret pada
tahun 193^• ( ). Keberhasilan mereka ialah ber
-hasilnya dibuat suatu kultur kalus, dan kultur akar dari po
tongan jaringan tanaman tinggi pada media buatan. (
1
,2
,3
>4 )
Menurut Koblitz, kultur jaringan tanaman dapat didefi
nisikan sebagai potongan jaringan dari tanaman yang ditum-
buhkan dalam kondisi steril pada media buatan dimana sel -
selnya marapu mengadakan pembelahan dan pertambahan massa
•plasma. ( k )
Berdasarkan teori sel dan teori totipotensi sel, bah-
wa sel merupakan unit terkecil kehidupan yang mampu menga
dakan aktifitas dan bila sel tumbuhan ditanam pada media
yang sesuai akan mampu tumbuh menjadi tanaman dewasa. (
6
)Maka dari itu teknik kultur jaringan tanaman ini dapat di-
pakai sebagai teknik pembudidayaan tanaman dengan kandung-
an metabolit sekunder yang tinggi. ( 7 ). Keuntungan- ke-
untungan dari teknik ini adalah kultur bebas dari pengaruh
mikroba, kondisi dapat dikontrol sehingga produk-produk
tertentu dapat dihasilkan sesuai dengan keinginan serta
tidak tergantung pada iklim dan letak geografis. (
7,8
)jaring-an tjaring-anamjaring-an dapat dipengaruhi oleh faktor fisika aeperti u-
sia kultur, cahaya atau oleh faktor kimia seperti raacam
dan konsentrasi nutrien atau hormon pertumbuhan yang ditam
bahkan pada media atau kapasitas biosintesis pada kultur,
(
7*9
)• Karena itu produksi metabolit sekunder dari kul -tur jaringan tanaman dapat lebih besar, sama atau lebih ke
cil daripada tanaman induknya, Kadang-kadang dapat berbeda
atau bahkan kultur tersebut tidak rnampu menghasilkan meta
bolit seperti tanarnan induknya. ( 8,9 )• Dalam kultur ja -
ringan tanaman, metabolit sekunder’ yang terdapat antara
lain : alkaloid,flavonoid, steroid, tanin, asam-asam orga-
nik dan lain-lain. ( U,
5»9
)•Untuk produksi metabolit sekunder dalam skala besar,
dilakukan suatu kultur suspensi. Adapun tahapan-tahapan
dalam perabuatan kultur suspensi adalah sebagai berikut :
pertama dibuat kultur kalus dari potongan jaringan tanaman
yang mengandung metabolit sekunder tertentu pada media pa-
dat, baru kemudian kalus yang didapatkan tadi dipindahkan
ke dalam media cair dan diagitasi dengan rpm tertentu. (i*,
7,10 )
Selain untuk langkah awalpada produksi skala besar,
ternyata pada kalus dc*pat diproduksi metabolit sekunder
yang lebih bervariasi dibanding kultur suspensi. (
8
)Hal ini dapat terjadi karena kondisi lingkungan yang sa -
ngot berbeda bila sel-sel tanaman ditumbuhkan secara in
vitro dibundingkan dengan sebelumnya di alam. (
10
)menjadi kalus bila kebutuhan akan makronutrien, mlkronu -
trien, vitamin-vitarain dan suplemen organiknya telah ter-
penuhi serta pengaruh macam dan konsentrasi horrnon pertum-
buhan dari golongan auksin dan sitokinin yang ditambahkan
pada media tersebut. ( 1,2,3j6>9>10 ). Pada penelitian
yang dilakukan oleh Weier et al. 197*f ( 11 ), penambahah
auksin dan sitokinin dalam konsentrasi tertentu akan ter-
bentuk kalus pada kultur jaringan batang terabakau*
Permasalahan n£ Limbul pada pembuatan kultur kalus
ini terletak pada bagaimanakah raenentukan komposisi dan
konsentrasi horrnon auksin dan sitokinin yang tepat yang
harus ditambahkan pada media dasarnya. Selain itu apakah
metabolit sekunder yang diproduksi kultur kalus dapat sama,
berbeda atau bahkan tidak ada sama sekali seperti pada ta
naman induknya. Untuk mengetahui hal tersebut, tahapan yang :
perlu dilakukan adalah perabentukan kalus dari eksplan kemu-
dian baru dilakukan deteksi pada kalus tersebut.
Penelitian-penelitian terhadap tanaman dengan kandung-
an metabolit sekunder steroid dengan teknik kultur jaring
an tanaman telah banyak dilakukan, seperti pada Solanum s p p
Dioscorea s p p. Digitalis s p p. Apocvnum cannabinum dan
Yucca glauca ( 5 )• Namun penelitian-penelitian terhadap
tanaman jenis Agave dengan teknik kultur jaringan tanaman
masih belum banyak dilakukan. ( )
Dari skrining yang telah dilakukan, tanaman dari jenis
Agave mengandung sterol, diosgenin, hekogenin dan lain-lain.
Berdasarkan hal tersebut di atas, raaka pada peneliti
an ini akan dicoba untuk menumbuhkan kalus dari Agave ama-
niensis Trel, & Nowell pada media dasar MS dengan penambah
an hormon auksin dan sitokinin, keroudian dilakukan deteksi
steroid dalam kalus yang tumbuh,
Dalam penelitian yang dilakukan oleh Blunden et al.
( 15,16 ), kandungan steroid 'yang paling banyak pada bagi-
an pangkal daun. Maka untuk penelitian ini sebagai sumber
eksplan ( potongan jaringan ), digunakan juga bagian pang
kal daun Agave amaniensis Trel. & Nowell,
Diharapkan dari hasil penelitian ini dapat bermanfaat
sebagai langkah awal untuk penelitian-penelitian selanjut-
nya dalam penerapan metode kultur jaringan tanaman untuk
BAB IX
TINJAUAN PUSTAKA
I . Tin.iauan tentang kultur laringan tanaman
KuXtur jaringan tanaman oXeh Koblitz. ( i* ), dide -
finisikan sebagai potongan jaringan tanaman yang dipi -
sahkan dari lingkungan alamiahnya dan ditumbuhkan pada
'media buatan dalam kondisi steril, di mana sel-selnya
dapat mengadakan pembelahan dan pertambahan plasma.
Keberhasilan penelitian-penelitian yang dilakukan oleh
Gautheret, Nobecourt dan White pada tahun 1939 dalam
percobaan pembuatan kultur kalus, mengawali penelitian
berikutnya dalam bidang tersebut.(
3
, 4,5,17 )Kultur kalus adalah suatu kultur sel-sel yang ti -
dak terdiferensiasi menjadi org^n-organ seperti tanaman
induknya* (1,2,3,4,5,8,9,10,17 K Hal yang menarik dari
kalus ialah bahwa ia dapat atau mampu tumbuh dan berkem
bang menjadi tanaman baru seperti tanaman induknya apa-
bila dipindahkan pada media baru yang komposisinya con-
cok dan tergantung pula pada hormon pertumbuhan yang
ditambahkan.
Selain kultur kalus, dikenal pula kultur suspensi
yaitu sel-sel kalus yang ditanam pada media cair*(
5,10
)Dibandingkan dengan teltnik propagasi tanaman seca-
ra konvensional,teknik kultur jaringan tanaman mempu. -
ter-kontrol dapat diproduksi senyawa-senyawa tertentu sesuai
keinginan, kultur bebas dari pengaruh mikroba dan ^nsekfca,
sel dapat memproduksi senyawa-uenyawa spesifik, biotrans -
forraasi senyawa tertentu menjadi senyawa yang berguna da -
lam bidang farmasi / medis, dapat dilakukan dimana saja ti
dak tergantung letak geografis dan iklim, seleksi strain
tanaman unggul atau tanaraan dengan metabolit tinggi dan
dapat untuk multiplikasi tanaman secara cepat dan seragam.
( 7,8,9,18 )
l.i. Media kultur .jaringan tanaman ( 1,2,3»)
Keberhasilan teknik kultur jaringan tanaman sa-
ngat tergantung pada media yang digunakan dan yang pa
ling penting adalah penambahan horrnon pertumbuhan da
ri golongan auksin dan sitokinin* Kebutuhan akan hor-
mon-hormon ini juga tergantung pada spesies dan kul
tur yang akan dibuat • Kebutuhan nutrien dari kultur
jaringan tanaman terdiri atas :
- makronutrien, seperti N, P, K, Ca, Mg, S
- mikronutrien, sepertiFe, Mn, Zn, B, Cu, Co, Mo
- sumber karbon, biasa dipakai adalah sukrosa untuk
mengganti karbon yang didapat tanaman normal dari u-
dara secara fotosintesis
- suplemen organik, seperti vitamin, asam amino
- hormon pertumbuhan, golongan auksin ( IAA, NAAj^ ^ - D )
golongan sitokinin ( Kinetin, BA )
Media MS ( Murashige dan Skoog, 1962 ) telah
jaringan tanaman setelah keberhasilannya menu.iibuh-
kan kalus Nicotiana tabacum dengan berat kering
kalus 167 % lebih besar daripada bila digunakan me
dia yang pertama kali digunakan oleh Hildebrandt
e t 1 9 4 6 . ( 1 ) .
Murashige dan Skoog menyatakan bahwa pH media
dibuat
5.7
-5>8
sebelum disterilisasi secara oto-klaf pada 121°C selama 20 menit, karena pada keada-
an tersebut komponen-kornponen media berada dalarn
bentuk terlarut. Disamping itu penelitian Mann et
al. menunjukkan bahwa pengaturan pH pada 5»7 sete
lah diotoklaf pada 121°C selama 20 menit pH media
menjadi 5*0. ( 1 ). Hal ini juga berkaitan dengan
pemadatan media oleh agar, karena di b;-.wah pH 5>0
agar tidak dapat berbentuk padat. (
1
,2
)Sebagai sumber karbon yang biasa dipakai ada-
lah sukrosa. Gautheret pada 1959 mencoba beberapa
sumber karbon lain seperti galaktosa, maltosa, ma-
nosa dan laktosa pada kultur jaringan tanaman. Ter-
nyata penggunaan sukrosa lebih baik, karena setelah
media diotoklaf pada 121°C selama 20 menit, akan
terhidrolisa menjadi glukosa dan fruktosa yang di-
butuhkan oleh kultur,
1*2. Hormon pertumbuhan tanaman ( 1,2,3**+ )
Dalam kultur jaringan tanaman, yang dimaksud
dengan hormon pertumbuhan adalah zat pengatur tum
( IAA, NAA dan 2,i+-D ) dan golongan sitokinin ( Ki-
netin, BA ). Selain itu sebagai zat pengatur tumbuh
juga kadang-kadang ditambahkan cairan dari buah-
buahan, kasein hidrolisat dan ekstrak ragi.
IAA ( asam indolasetat ) merupakan auksin alara
dan selalu terdapat dalam tanaman dan berperan da
lam perpanjangan
6
el. Dalam kultur jaringan tanaraan, auksin baik alam maupun sintetis berperan da
lam pembentukan kalus dari eksplan. Golongan auk
sin sintetis seperti NAA ( asam naftalenasetat )
dan ( asam
2
,4
-diklorofenoksiasetat ) dapatditambahkan dalam konsentrasi yang lebih rendah
daripada IAA- 2,i+-D adalah yang paling poten di an-
tara ketiga senyawa tersebut.
•Golongan hormon yang lain yaitu sitokinin. Pe
ngaruh horrnon ini dalam kultur merangsang pembelah-
an sel. Peranan hormon-hormon auksin dan sitokinin
selain menginduksi pembentukan kalus, perpanjangan
dan pembelahan sel, juga mempengaruhi pembentukan
metabolit dalam sel. Pengaruh ini bervariasi ter
gantung pada konsentrasi, stabilitas dan metabolis-
me dalam jaringan selama kulturisasi. (
6
).1
.3
* Teknik kultur jaringan tanaman untuk produksi metabolit sekunder
Teknik kultur jaringan tanaman diterapkan un
tuk men^ataBi.macalah-masalah yang timbul pada pro
di mana biasanya metabolit sering diakumulasi pada
bagian tertentu dari tanaman. Dengan adanya kondi
si lingkungan yang berbeda dari kondisi tanaman a-
ealnya, sel-sel tanaman pada kultur jaringan dapat
memproduksi senyawa yang berbeda macam dan kadarnya
atau bahkan sama sekali tidak dapat memproduksi
metabolit seperti tanaman induknya. (
9
»10
)*Untuk memproduksi metabolit sekunder dalam
skala besar dipakai sistem kultur euspensi atau
kultur fermentor. Adapun tahapan-tahapan dalam pera-
buatan kultur suspensi adalah sebagai berikut se
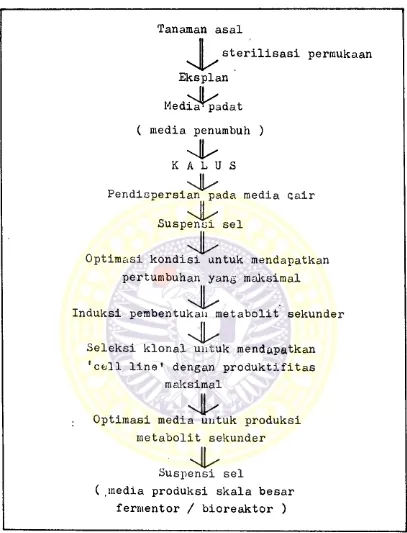
Tanaman asal
Pendispersian pada media cair
Suspensi sel
Optimasi kondisi untuk mendapatkan
pertumbuhan yang maksimal
v j U
Induksi pembentukau metabolit sekunder
4
^
Seleksi klonal untuk mendapatkan
'cell line* dengan produktifitas
maksimal
. Optimasi media untuk produksi
metabolit sekunder
Suspensi sel
( rmedia produksi skala besar
ferrnentor / bioreaktor )
Gambar 1. Skeraa langkah-langkah produksi metabolit
Dalam kultur jaringan tanaman, horrnon pertum -
buhan yang digunakan dapat berpengaruh terhadap pro
duksi metabolit sekunder. Pada kultur Trigonella
foenum-graecum. hormon kinetin dan IAA dapat mensti
mulasi produksi sitosterol dan stigmaeterol• Dalam
sel-
6
el Trigonella foenum-graecum. kinetin menaikkanpertumbuhan sedangkan 2,if-D menaikkan konsentrasi
sterol dan pertumbuhan. ( 9 ) • Pada penelitian yang
dilakukan oleh Rokem et $
1
., kadar diosgenin dalamkultur Dioscorea deltoidea dapat ditingkatkan deng
an modifikasi komponen media dan hormon pertumbuhan
pada media MS, ( 18 )
2. Tinjauan tentang steroid
Secara umum steroid adalah senyawa organik yang mem
punyai kerangka inti jperhidrosiklopentanofenantren,
dengan substituen metil pada atom C-10 dan atom C-IJ,
( 14 ). Secara garis besar steroid dibagi dua golongan
yaitu : steroid dengan atom karbon tidak lebih dari
21
,disebut steroid sederhana dan steroid dengan atom kar -
bon lebih dari
21
, misalnya sterol, sapogenin steroid,alkaloid steroid dan lain-lain.(
6
)Sterol yang terdapat dalam kultur jaringan tanam
an dikenal sebagai fitosterol, dan yan^ paling banyak
ditemukan adalah sitosterol dan stigmasterol. (
9
)Dalam tanaman, sterol dapat mengalami transformasi men
jadi saponin steroid. Saponin dapatberupa glikosida
triterpenoid atau glikosida steroid, ( 9 ). Sapogenin
steroid merupakan gugus aglikon dari glikosida steroid,
Berdasarkan cabang cincin yang tidak mengandung atom
nitrogen ( cincin spiroketal ) dan cincin yang mengan
2
.1
. Deteksi steroidUntuk mendeteksi steroid dalam tanaman dipakai
prosedur yang cepat, sederhana dan dengan sedikit
peralatan. ( 19 ). Namun kerugian metode tersebut ia-
lah tidak dapat membedakan sterol dan sapogenin ste -
roid. ( 6,19 ). Untuk itu, perlu dilakukan hidrolisa
dengan HC1 2H d;.n analisis dilakukan terhadup ekstrak
kloroform. ( 19 )
2.1.1. Kromatografi lapis tipis ( 20,21,22 )
Kromatografi adalah teknik pemisahan ber-
dasarkan perbedaan kecepatan migrasi masing-
masing komponen pada fase diam di bawah penga
ruh suatu pelarut yang bergerak. (
20
)Pada kromatografi lapis tipis fase diam berupa
suatu lapis tipis dengan ketebalan tertentu pa
da suatu lempeng*
Adapun mekanisme pemisahan terjadi seca
ra adsorpsi, partisi,pertukaran ion ataupun
filtrasi, tergantung pada adsorben yang dipa -
kai dan jenis pelarutnya. Pada umumnya mekanis
me yang terjadi adalah adsorpsi dan partisi.
( 20 ,21,2a )
Untuk analisis kualitatif, kromatografi
lapis tipis dapat membedakan campuran zat atas
3* Tin.lauan tentang tanaman Agave
3.1. Penvebaran. habitus dan klasifikasi
Agave tumbuh tersebar di ciaerah tropis dan
subtropis. Di Indonesia Agave ditanam sebagai ta
naman hias. (
23
*24
»25
)Agave mempunyai tanda-tanda raorfologi :
Merupakan tanaman herba tegak, kuat, daun ter-
susun roset, bertulang daun sejajar, daun berben-
tuk lansot, sedikit berbentuk talang, tebal berda-
ging. Daun berwarna biru atau hijau kelabu, kadang-
kadang bertepi putih. Tepi daun ada yang berduri
dengan jarak 1 - 2 cm. Pada ujung daun tumbuh duri
yang berwarna coklat hitam, panjang
1 - 2
cm.Klasifikasi Agave amaniensls Trel. & Nowell
adalah sebagai berikut : ( 26 )
Divisi s Spermatophyta
Anak divisi : Angiospermae
Kelas : Monocotyledoneae
Bangsa : Liliales
Suku : Amaryllidaceae
Marga : Agave
Jenis : Agave amaniensis Trel. Sc Nowell
Pada halaman berikut dapat dilihat bentuk ta
Gambar 3* Agave amaniensis Trel., & Nowell,
3*2. Kandungan kimia Agave amaniensis Trel. & NOwell
Agave amaniensis Trel. & Nowell mempunyai kan-
dungan kimia sapogenin steroid diosgenin, tigogenin,
hekogenin dan sterol serta senyawa steroid lain
METODE PENELITIAN BAD III
1. Bahan penelitian
1.1. Bahan kimia
Semua bahan kimia yang dipergunakan untuk
pembuatan media adalah produksi E. Merck Darmstadt,
dengan derajad 'pro analisa', kecuali apabila diee-
butkan lain. Hormon 2,4-D yang digunakan produksi
Sigma. Agar yang digunakan adalah Difco Bacto-Agar,
'Difco' certified, buatan Difco Laboratories -
Detroit Michigan USA. Steroid pembanding sitosterol
dan hekogenin produksi Sigma serta diosgenin pro
duksi E. Merck Darmstadt.
-1.2. Potongan .jaringan ( eksplan )
Potongan jaringan berasal dari pangkal daun
Agave amaniensis Trel. & Nowell, berumur 1-2 bulan,
yan& diperoleh dari Kebun Raya Cabang Purwodadi -
Pasuruan Jawa Timur. Pada halaraan berikutnya da -
pat dilihat Agave amaniensis Trel. & Nowell yang
Gambar Z+* Agave amaniensis Trel. & Nowell
berumur
1-2
bulan yang diguna -kan sebagai sumber eksplan,
1.3. Media
Media ysng digunakan dalam penelitian ini ada-
lah media standar Murashige & Skoog, 1^62 ( media
MS ) yang terdiri atas makroelemen, mikroelemen,
vitamin, suplemen organik dan hormon pertumbuhan
dari golongan aukuin dan aitokinin*
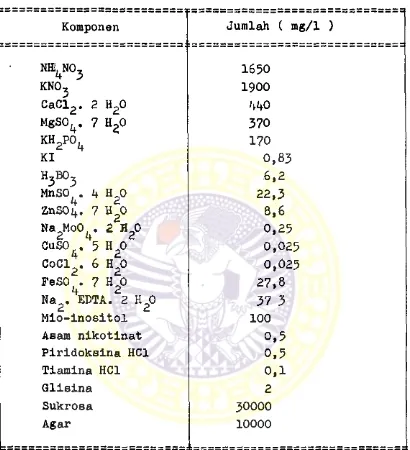
IComposisi media MS yang digunakan dalara pe
nelitian ini tertera pada tabel 1. Sedangkan kode
media, kombinasi dan kadar hormon pertumbuhan ter
2* Alat-alat yang digunakan
pll-meter Fisher untuk mengatur pH larutan media.
Otoklaf
?3
1 ( American Portable Autoclave '.'/AF CoInc. ), untuk sterilisasi media dan air suling.
Laminar air flow cabinet digunakan untuk pengerja-
an 'aseptis.
Kieselgel 60 F
?_5k
( E. Merck, Darmstadt ).3« Metode penelitian
3*1* Pembuatan media
Semua bahan kimia komponen media Muranhige &
Skoog ( MS ) dibuat dan disimpan dalam bentuk la
rutan stok, kecuali mio-inositol dan sukrosa. Da
lam penelitian ini media dibuat 'padat dengan pe -
nambahan agar
1%*
Pembuatan media padat dalam per-cobaan ini sesuai dengan metode Murashige & Skoog
dalam Bhojwani, 1983 (!)• Untuk masing-masing kom
ponen media dasar MS dibuat stok dengan konsentra
si sebesar 100 kali jumlah yang tertera pada ta -
bel I, Jadi untuk memperoleh media dengan volume
dari masing-masing larutan stok diambil
10
ml, di-tambah
100
mg mio-inositol dan30
g sukrosa ; di-tambnh hormon yang tergantung pada konsentrasi
dan macam yang digunakan dalam percobaan, kemudi-
an ditambahkan air culing samp^i volume lebih-ku-
rang tiga per emnat volume akhir dan pH larutan
diatur antara
5,7
-5,6
dengan penambahan larutanNaOH 0,1 N atau larutan HC1 0,1 N. Setelnh ditam-
bah agar
10
g, volume dibuat menjadi1
liter dengan menambahkan air suling. Kemudian campuran
tersebut dipanaskan cambil diaduk sampai jernih.
Larutan dituang ke dalam botol-botol kultur, ma -
sing-macing sebanyak lebih-kurang i
+0
ml, kemudianditutup rapat-rapat dengan aluminium foil dan di-
sterilkan dalam otoklaf 121°C selama 20 menit.
Media disimpan dalam ruang bersuhu 20 - 25°C bila
tidak dipakai. Untuk lebih jelasnya, pembuatan me
dia tersebut di atas dapat dilihat pada skema be
rikut ini ( gambar
5
)> komposisi hormon dan kodeLarutan stok
komponen media MS
dengan konsentrasi
100
kalii
Masing-masing diambil 10 ml
Ditambah 100 mg mio-inositol
i
Ditambah 30 g sukrosa
i
Ditambah hormon pertumbuhan
( jumlah sesuai dengan macam
yang akan dibuat untuk perco
baan )
Ditambah air suling
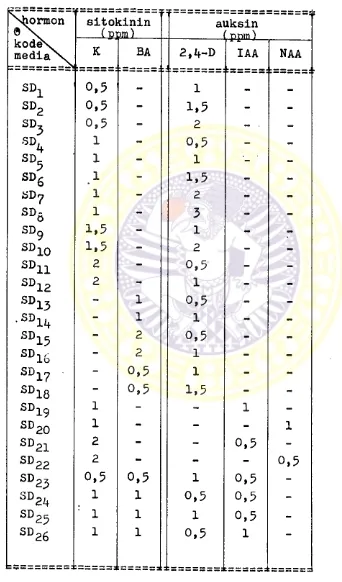
Tabel II. Kombinasi aan kadar hormon pertumbuhan yang di-
tambahkan pada media MS untuk periumbuhan kalus
Agave amaniensis Trel. & Nowell
Keterangan :
0
= untuk setiap rnacam media dibuat5
<botol
= tidak ditambahkan hormon tersebut
K = kinetin
BA ss benziladenin
2
,if-D = asam2
,if-diklorofenoksiasetatXAA = asam indolasetat
NAA- = asam naftalenasetat
3*2. Penanaman eksplan
Penanaman eksplan Agave amaniensis pada media
dilakukan sesuai dengan metode yang dikemukakan oleh
Reinert dan Yeoman (
6
) sebagai berikut : pangkaldaun Agave amaniensis muda-yang akan dipakai sebagai
eksplan dicuci bersih dengan air suling, kemudian di
rendam dalam alkohol 90
%
seloma 2 menit. Setelahitu disterilkan dalam larutan pensteril •Clorox1 4 0$
( 'Clorox' 100% mengandung NaOCl 5,25$ sebagai bahan
aktifnya ) selama 4 menit, dsn dicuci / dibilas de
ngan air suling steril 3 - 5 kali untuk menghilang-
kan sisa-sisa larutan pensteril, Hssplan yang telah
steril dipotong-potong dengan ukuran + 1 x 0 , 3 cm
dan ditanam pada media MS dengan berbagai komposisi
dan konsentrasi hormon pertumbuhan yang berbeda-be -
da. Semua pekerjaan ini dilakukan secara aseptis da
lam *laminar air flow cabinet1* Botol'kultur yang te
lah berisi / ditanami eksplan tersebut disimpan da
lam ruang bersuhu 20 - 25°C. Gambar 6 * berikut ini
menunjukkan daun Agave amaniensis muda ( gambar 6A ),
i
dan gambar 6B, potongan melintang daun yang berukuran
±
1 X 0,3 cm. Sedangkan gambar 7. menunjukkan carapenanaman eksplan pada media, yaitu dengan cara me-
nempatkan eksplan diatas media dengan raenggunakan
Gambar
6
. Daun Agave amaniensis vane akanditanam pada media.
Keterangan :
A : bagian daun yang dipakai untuk eksplan
Gambar 7, Penanaman eksplan pada media,
Keterangan :
penanaman dilakukan dengan cara meletakkan
eksplan steril di atas media padat dengan
satu sisi potongan melintang daun / ekplan
3.3* Pemeriksaan kalus yang terbentuk
Kalus dinyatakan terbentuk, apabila terbentuk
suatu massa sel yang tidak terorganisasi atau tidak
terdiferensiasi menjadi organ tanaman induknya.
( 1,2,3 )
Kalus yang tumbuh mempunyai tokstur kompak atau ra-
puh dan dapat bervvarna kekuningan, putih, hijau atau
hitam, ( 3 )• Kemudian untuk melihat sel-sel kalus
yang terbentuk dilakukan pemeriksaan mikroskopis.
Pemeliharaan kalus yang telah tumbuh
Untuk pemeliharaan dan perbanyakan kultur kalus
dilakukan subkultur yaitu kalus dari satu botol kul
tur dipindahkan ke beberapa media segar ( 3), de
ngan cara sebagai berikut :
botol kultur yang berisi kalus dibuka tutup alumini-
umnya kemudian mulut botol diflambir dengan lampu
spiritus. Dengan menggunakan skalpel steril, kalus
dipindahkan ke dalam botol yang berisi media segar.
Setelah diisi kalus, botol media segar tersebut ditu
tup dengan aluminium foil kembali setelah diflambir
dengan lampu spiritus. Pekerjaan ini dilakukan dalam
3*5. Deteksi steroid dari kalus ( 6 )
Kalus yang terbentuk dipisahkan dari media agar
yang menempel* Setelah dikeringkan dalam lemari pe-
ngering atau.lampu pengering pada suhu 40 - 60°C, di
serbuk dan dihomogenkan. Kemudian serbuk kalus terse
but ditimbang 1 g dihidrolisis dengan 2 0 ml asam klo
rida 2 N pada suhu 100°C selama.dua jam, setelah di-
ngin dinetralkan dengan natrium' hidroksida 1 N dan
disaring. Filtrat yang didapat diekstraksi dengan
i
kloroform tiga kali menggunakan corong pisah. Residu
hasil hidrolisis setelnh dikeringkan dalam lemari pe
ngering bersuhu 40 - 60°C, direfluks tiga kali sela
ma dua jam dengan 30 ml kloroform kemudian disaring,
Filtrat yang didapat dicampur dengan ekstrak kloro
form dan diuapkan sampai kental,.Pada ekstrak kental
yang didapat dilakukan analisis kualitatif dengan
menggunakan reaksi warna dan kromatografi lapis ti -
pis.
3.5.1* Reaksi warna r>ada ekstrak kloroform
- Reaksi warna Salkowski ( 19 )
Sedikit ekstrak dalam tdbung reaksi ditam-
bah asam sulfat pekat volume sama melalui
dinding tabung perlahan-lahan. Diamati war-
: na yang terjadi di antara dua lapisan, kemu
dian dikocok dan diamati juga warna pada la
pisan asam dan pada lapisan kloroformnya.
steroid pemuanding. Dalam penelitian ini
steroid yang dipakai sebagai pembanding
adalah sitosterol, diosgenin dan hekogenin.
- Reaksi warna Liebermann-Burchard ( 19 )
Ekstrak dalam tabling reaksi ditambah de-
ngan tiga tetes asam asetat anhidrat,
dikocok dan ditambah satu tetes asam sul-
fat pekat kemudian dikocok perlahan-lahan
dan diamati warna yang terjadi. Hal yang
soma dilakukan pula terhadap steroid pem
banding.
Analisis kualitatif dengan kromatografi la
pis tipis
Ekstrak kental ditotolkan pada lempeng
jadi Kieselgel 60 F 254 kemudian dimasukkan
ke dalam bejana kromatografi yang telah je-
nuh dengan fase gerak. Untuk deteksi ini
tentukan, lempeng diangkat, dikeringkan dan
disemprot dengan pereaksi penampak noda
Lempeng hasil kromatografi dikeringkan da
lam lemari pengering pada suhu 100 - 105°C
selaina 5 - 1 0 menit, Warna noda yang tampak
dan harga dibandingkan dengan steroid
BAB IV
HASIL PENELITIAN
1. Pemeriksaan kalus yang ter.iadi
Hasil penanaman eksplan daun Agave amaniensis
Trel. & Nowell menunjukkan, bahwa pembentukan kalus ter-
baik pada media MS dengan penambahan kinetin sebesar
1 ppm dan 2,4-D sebeaar 1 ppm. Sedangkan bila konsentra-
kinetin dan 2,4-D diperbesar dan atau diperkecil, per
tumbuhan kalus lambat sekali dan teksturnya rapuh bah-
kan kalus tidak dapat tumbuh sama sekali,
Pada media MS dengan penambahan hormon sitokinin
yang lain yaitu benziladenin, pertumbuhan kalus tidak
sebaik dan secepat seperti pada media di atas ( kine
tin 1 ppm dan 2,4-D 1 ppm ), begitu juga pada media MS
dengan penambahan kinetin, benziladenin, 2,4-D dan IAA
yang lain. Pada tabel III., dapat dilihat kombinssi
hormon pertumbunan pada media MS yang dapat menumbuhkan
kalus Agave amaniensis Trel. & Nowell. Pemeriksaan se-
'cara makroskopis kalus Agave amaniensis pada media yang
Tabel III. Kombinasi hormon pertumbuhan yang dapat
raenumbuhkan kalus Agave amaniensis Trel.
8
tKeterangan :
© = untuk setiap macara media dibuat 5 ( lima )
botol
= tidak ditambahkan hormon tersebut
K ss kinetin
BA = benziladenin
2,4-D = asam 2,4-diklorofenoksiasetat
IAA' = asam indolasetat
NAA = asam naftalenasetat
Pertumbuhan kalus diamati saat permukaan eksplan
terlihat kasar dan beberapa hari kemudian terli-
hat adanya massa sel yang tidak terdiferensiasi
menjadi organ seperti tanaman asalnya.
Kombinasi hormon yang dapat menumbuhkan kalus a-
Secara makroskopis, pemeriksaan kalus yang tumbuh
pada kelima macam media adalah sebagai berikut :
Tabel IV . Pemeriksaan makroskopis kalus Agave amaniensis
Trel. & Nowell
Media Tekstur Warna Diferensiasi
SD
5
kompak putih keku- tidak terjadiningan
SD
1
X rapuh putih tidak terjadisd13 rapuh putih keco- tidak terjadi
klatan
SD18 kompak putih keco- tidak terjadi
klatan
SD
2
^ kompak kuning muda tidak terjadiKeterangan :
sd5 = media MS + kinetin
1
ppm + 2,4-D1
ppmSDU = media MS + kinetin
2
ppm +2
,4
-D0,5
ppmsd13 - media MS + benziladenin
1
ppm + 2,4-D 0,5 ppmSD18 media MS + benziladenin 0,5 P P ® + 2,4-D 1, 5 ppm
SD2^ s: media MS + kinetin
1
ppm + benziladenin1
ppm +E. Subkultur kalus Agave amaniensis Trel. & Nowell
Pada kalus yang telah tumbuh perlu dilakukan perae-
liharaah, yaitu dengan cara subkultur yang dilakukan
setiap empat minggu. Karena setelah empat minggu pada
kalus mulai terlihat adanya pencoklatan. Deraikian ju-
ga untuk perbanyakan kalus dilakukan subkultur.
Kalus yang tumbuh pada media SDxi> SD13’ SD18 dan
bila dilakukan subkultur akan mengalami pencoklatan dan
akhirnya mati, sedangkan pada kalus yang tumbuh pada
media hal tersebut tidak terjadi, Gambar berikut
menunjukkan bentuk dan warna kalus yang tumbuh pada
Mii>
~ m ' 1 •••**
Gambar 8 . Kalus Agave amaniensis Trel. & Nowell.
Keterangan :
kalus Agave amaniensis pada media SD^ setelah
empat minggu disubkultur ( terlihat mulai ter
Pemeriksaan mikroskopis sel-sel kalus dilakukan
setelah empat minggu kalus disubkultur. Dari hasil peme
riksaan mikroskopis, sel-sel kalus berbentuk heterogen
dan berdinding transparan sehingga isi sel dapat ter-
lihat seperti pada gambar di bav/ah ini :
Gambar 9* Sel-sel kalus A g a v e amanlennis Trel. & Nowell
Keterangan :
kalus pada media MS dengan kinetin 1 ppm dan
2,4-D 1 ppm setelah empat minggu kalus disub
kultur ( pembesaran 1 0 0 kali )
3 . Deteksi steroid dalam kalus
3.1. Hasil reaksi warna Salkowaki
Neaksi warna dilakukan balk terhadap ekstrak
kloroform dari kalus maupun terhadap ekstrak klo
roform dari tanamannya, dan umur tanaman yang di-
sebagai sumber eksplan.
• Pada deteksi steroid ini sebagai steroid pem-
banding digunakan sitosterol, diosgenin dan heko-
genin. Hasil reaksi warna Salkowski dapat dilihat
pada tabel V di bawah ini :
Tabel V . Hasil reaksi warna ekstrak kloroform dengan
pereaksi Salkowski
2 a t Hasil pengamatan
warna cincin lapisan asam lap.
- Sitosterol merah. jingga merah jingga kuning
jernih
- Diosgenin coklat merah jingga kuning
jernih
- Hekogenin kuning kuning jernih jernih
tak bei
warna
- Ekstrak dari
kalus
coklat raerah coklat kuning
jernih
- Ekatrak dari
tanaman
coklat coklat tua jernih
3.2. Hasil reaksi warna Liebermann-Burchard
Reaksi ini juga dilakukan terhadap ekstrak
kloroform dari kalus dan ekstrak ekstrak kloro
form dari tanamannya. Tabel VI berikut ini menun-
Tabel VI, Hasil reaksi warna Liebermann-Burchard ter- .
- Ekstrak dari kalus
*- Ekatrak dari tanaman
ungu biru - biru
coklat
kuning jernih
ungu - coklat - hijau
coklat kehitaman
3.3. Hasil kromatografi lapis tipis terhadap ekstrak
kloroform
Kromatografi lapis tipis dilakukan terhadap
ekstrak kloroform dari kalus dan juga ekstrak klo
roform dari tanaman Agave amaniensis Trel. & No -
well. Fasa gerak yang digunakan adalah n-heksan :
etilasetat =
8
:2
, kloroform : etilasetat =9
:1
, kloroform :metanol =9
:1
, karbuntetraklor-id : etilasetat =
1 : 1
dengan penampak noda anisaldehid sulfat. Hasil kromatografi lapis tipis
terhadap ekstrak kloroform kalus dapat dilihat
pada tabel VII dyn gambar 10, Untuk hasil kroma
tografi lapis tipis terhadap ekstrak kloroform
e
c
Keterangan gambar 10 :
S = sitosterol
D = diosgenin
A s= ekstrak kloroform kalus Agave amaniensis
Keterangan gambar 11 :
S = sitosterol
D ss diosgenin
B = ekstrak kloroform tanaman Agave amaniensis
Tabel IX. Jenis steroid yang terdetekei dalam
kalus Agave amaniensis Trel, & Nowell
Jenis steroid Hasil
Sterol +
Diosgenin +
Hekogenin +
Lain-lain +
Keterangan tabel :
+ = mengandung senyawa steroid
+ = dengan faea gerak tertentu menunjukkan
positip, dengan fase gerak lain menun-
jukfaan negatip
- = tidak mengandung senyawa steroid
lain-lain = kemungkinan mengandung senyawa steroid
PEMBAHASAN
!• Penumbuhan kalus
1.1. Pemillhan eksplan
Untuk penumbuhan kalus dari suatu potongan
jaringan tanaraan dipengaruhi oleh beberapa faktor
antara lain : umur tanaman, ukuran eksplan, kuali-
tas tanaman sumber eksplan dan media yang diguna
kan. Walaupun menurut teori sel dan totipotensi
sel ( 1,2,3 ) mengatakan bahwa setiap bagian tanam
an bila ditanam pada kondisi yang sesuai dapat turn
buh menjadi kalus, tetapi ternyata derajat keber -
hasilannya berbeda untuk setiap bagian tanaman.
Untuk propagasi tanaman jenis Agave sebagai eksplan
dipakai biji. ( 1,12 )* Sedangkan Nickell dan Rou-
tien,menggunakan daun sebagai eksplan untuk kultur
Agave toumcvana. ( 4 )• Juga Blunden dalam
penelitiannya menyatakan bahwa kandungan steroid
pada tanaman Agave terakumulasi di bagian pangkal
daun. ( 15,16 ). Maka untuk penelitian ini sebagai
eksplan adalah bagian pangkal daun Agave amanien
sis yang masih muda.
1.2* Pemilihan media untuk penanaman eksplan
Dalam penelitian media yang digunakan adalah
karena sesuai dengan metode yang dikemukakan oleh
Dodds,1982; Bhojwani,1983; George dan Sherrington,
1984; bahwa media dasar MS dapat digunakan untuk
kultur jaringan dari banyak tanaman baik monokotil
maupun dikotil. Pada monokotil pembentukan kalus
dapat dirangsang dengan penambahan hormon kinetin
dan 2,4-D. ( 1,2,3 )
Pada avfal penelitian telah dicoba menanam eks
plan pada media dasar MS dengan penambahn kinetin
dengan konsentrasi mulai 0,5 ppm sampai 2 ppm dan
2,4-D 0,5 ppm, ternyata yang dapat menumbuhkan ka
lus. adalah pada media dasar MS dengan konsentrasi
kinetin 2 ppm dan 2,4-D 0,5 ppm, Tetapi kalus yang
tumbuh terlihat rapuh, pucat dan selanjutnya tidak
tampak adanya pertambahan massa sel-sel kalus.
Hal ini mungkin disebabkan karena jumlah 2,4-D
yang ditambahkan tidak cukup untuk merangsang pem
bentukan sel-sel kalus dari eksplan,
Kemudian dicoba pada konsentrasi 2,4-D 1 ppm dan
konsentrasi kinetin yang ditambahkan antara 0,5
ppm sampai 2 ppm, dan yang dapat menumbuhkan kalus
pada konsentrasi kinetin 1 ppm dan 2,4-D 1 ppm#
Pada penambahan 2,4-D yang lebih besar dari 1 ppm
terjadi pencoklatan pada eksplan. Hal ini disebab
kan oleh konsentrasi 2,4-D yang cukup besar yang
ditambahkan pada media. 2,4-D dalam konsentrasi
me-matikan sel-sel eksplan. ( 1 )
Pada kombinasi auksin dan sitokinin yang lain
( tabel III )f kalus dapat tumbuh, tetapi untuk
selanjutnya tidak tarapak adanya pertambahan massa
sel-sel kalus dan terjadi pencoklatan.
Pada langkah selanjutnya untuk mempertahankan
kelangsungan hidup kalus yang telah tumbuh pada
kelima macam media ( tabel III ), masing-raasing
dipindahkan ke media segar dengan komposisi hormon
yang sama dengan media asalnya ( disubkultur ).
Ternyata dari kelima macam media tersebut, hanya
pada media dengan kinetin 1 ppm .dan 2,4-D 1 ppm
saja kalus dapat bertahan . Maka untuk selanjutnya
kalus yang tumbuh pada media MS dengan kinetin 1 ppm
dan 2,4-D 1 ppm tersebut saja yang dipakai untuk
penelitian berikutnya.
Dalam kultur jaringan tanaraan, proses penco -
klatan dapat terjadi karena adanya sejenis ensim
oksidase seperti polifenoloksidase, yang dilepas-
kan atau diproduksi oleh jaringan bila lingkungan-
nya tidak sesuai atau bila jaringan tersebut dilu-
kai. ( 1 )
Seharusnya untuk subkultur dilakukan sebelum
kultur melewati fase linier di mana kecepatan per-
turabuhan sel-sel kalus mencapai maksimum. Setelah
dan pertumbuhan akhirnya menurun. ( 2 ). Untuk me-
ngetahtti kecepatan pertumbuhan kalus dapat dilaku
kan dengan cara memeriksa pertambahan bobot basah
kalus setelah interval waktu tertentu. C 3 )
Pada kalus Agave amaniensis ini kecepatan per-
tumbuhannya belum dapat diamati karena sangat ter-
batasnya jumlah kalus. Pada penelitian yang telah
dilakukan terhadap kultur jaringan tanaman jenis
Agave, ternyata untuk pemeliharaan kalus yang baru
tumbuh dari eksplan diperlukan waktu yang cukup
panjang, ( 12 ). Kemungkinan fase ini yan^ disenut
'lag phase*, fase di mana terjadi penyesuaian sel-
sel terhadap kondisi luarnya. ( 1 )
2. Deteksi steroid dalam kalus
Deteksi steroid dalam kalus Agave amaniensis dila
kukan untuk mengetahui apakah dalam kalus yang tumbuh
dari eksplan mempunyai kandungan yang sama dengan tana
man induknya atau tidak,
Karena terbatasnya kalus yang didapat maka deteksi
steroid dilakukan terhadap ekstrak kloroform hasil hi-
drolisa. Sehingga tidak dapat diketahui sterol yang ter-
deteksi pada ekstrak kloroform tersebut berasal dari
sterol bentuk bebas atau sterol yang berasal dari hasil
hidrolisa glikosida sterin,
Pada reaksi warna Salkowski dan Liebermann-Burchard
warna pembanding dan ekstrak kloroform tidak sama. Hal
Hasil kromatografi lapis tipis pada fase gerak ter
tentu warna noda yang dihasilkan kadang-kadang berimpit
sehingga warna yang dihasilkan juga tidak jelas dan pe-
nentuan harga juga sulit* Hal tersebut karena kela-
rutan komponen-komponen tersebut harapir sama dalam fa
se gerak. Dalam hal ini untuk mendeteksi diosgenin dalam
kalus Agave amaniensis sulit dilakukan / hasilnya mera-
gukan,
Dari hasil kromatografi lapis tipis, pada ekstrak
kalus menunjukkan adanya sterol. Meskipun sebagai sterol
pembanding digunakan sitosterol, sterol yang terdapat
dalam ekstrak tidak dapat disimpulkan sebagai sitosterol.
Baik sitosterol maupun senyawa sterol yang lain ( kholer*
sterol, kampesterol dan stigmasterol ) mempunyai harga
dan warna noda yang sama. Jadi dengan kromatografi
lapis tipis baik kholesterol, kampesterol, stigmasterol
KESIMPULAN
Dari hasil penelitian dan pembasan dapat disimpul-
kan bahwa :
1. Kalus Agave_.amaniensis Trel* & Nowell dapat tumbuh pada
media dasar MS dengan penambahan hormon kinetin 1 ppm
dan 2,4-D 1 ppm*
2. Dengan metode analisis yang dilakukan, dalam kalus
Agave amaniensis Trel. & Nowell, steroid yang terdetek-
SARAN-SA^AN
Dari hasil penelitian ini perlu dilakukan penelitian
lebih lanjut :
1. Untuk mengoptimasi pertumbuhan kalus Agave amaniensis
Trel* & Nowell dengan kombinasi hormon pertumbuhan
yang lain atau modifikasi pada media dasar MS.
.2, Untuk mengetahui jenis sterol yang terdapat dalam ka-
lus Agave amaniensis Trel. & Nowell.
3. Untuk analisa kuantitatif steroid pada kalus Agave ama
niensis Trel. & Nowell.
RINGKASAN bab viii
Eksplan Agave amaniensis Trel. & Nowell dapat tumbuh
baik menjadi kalus bila ditanam pada media dasar MS dengan
penambahan hormon kinetin 1 ppm dan 2,4-D 1 ppm.
Kalus yang didapatkan mempunyai tekstur yang kompak dan
berwarna kekuningan. Pada media dasar MS dengan kombinasi
hormon yang lain, kalus yang tumbuh mempunyai tekstur yang
rapuh. Pada pemeliharaan selanjutnya, kalus yang berasal
dari media dasar MS dengan hormon kinetin 1 ppm dan 2,4-D
1 ppm dapat terjadi proliferasi sel-sel-Italus. Sedangkan
pada kalus dari media yang lain, tidak terjadi.
Pada kultur jaringan kadang-kadang kandungan metabo-
litnya tidak sama dengan kandungan tanaman induknya.
Untuk itu pada kalus Agave amaniensis ini dilakukan detek
si steroid. Ternyata dari hasil analisa dengan KLT menun-
jukkan bahwa dalam kalus Agave amaniensis terdeteksi ada-
nya steroid yang sama dengan tanaman induknya, yaitu adaa
BAB IX
KEPUSTAKAAN
1. George,.EF., and Sherrington, PD. 1984. Plant propagation
by tissue culture, handbook and directory of commer
cial laboratories. Exegetics Ltd. England, pp 1-29
184-244, 284-307, 334-333.
2. Bhojwani, SS and Razdan, MK. 1983. Plant tissue culture :
Theory and practice- Elsevier. Amsterdam,Oxford,
New York, Tokyo, pp 1-41, 46-47.
3. Dodds, JS., Robert, LW. 1982. Experiment in plant tissue
.culture. Cambrige University Press. London, New York.
PP 1-47, 54-33, 149-153..
4. Puhan, Z., Martin, SM. 1971. The industrial potensial
of plant cell culture. Nat. Res. Counc. of Canada
pp 13-39.
5. Stohs, SJ., Rosenberg, 1975. Steroid and steroi metabo
lism in plant tissue culture, Lloydia. 58. (3) :
181-192.
6 . Isnaeni. 1986. Optimasi pembentukan kalus Solanum
ma-mmosum L dan identifikasi senyawa steroidnya. Tesis.
Universitas Airlangga. Surabaya, pp 2-83.
7. Crocomo J. Otto, Euginio Aquarone, Otto R. Gottlieb. 1981.
Biosynthesis of secondery product in vitro. Thorpe
A. Trevor ( edit. ). Plant tissue culture method
and application in agriculture. Academic Press.
New York, pp 360-370.
8 . Indrayanto, G. 1986. Prospek kultur jaringan tanaman
9. Staba, EJ. 1980. Plant tissue culture as a source of
biochemical. CRC Press Boca Raton Inc, Florida.
PP 60, 72-74.
10. Indrayanto, G. Produksi metabolit sekunder dengan
tek-nik kultur jaringan tanaman. Seminar nasional me-
tabolit sekunder. PAU Bioteknologi Universitas
Gadjah Mada. Yogyakarta. pp 1-13.
11. Abidin Z, 1983. Dasar-dasar pengetahuan tentang zat
pengatur tumbuh. Penerbit Angkasa. Bandung,
pp 1-36, 55-62.
12. Evans,Sharp, Ammirato, Yamada. 1983- Handbook of plant
cell culture. Techniques for propagation and
breeding. Macmillan Publishing Co. Canada, pp 52,
56-57.
13. Rini Dhamayanti, 1986« Skrining steroid dari beberapa
jenis Agave, Skripsi. Universitas Airlangga.
Surabaya, pp 5-75*
lit. Tarigan, P. 1980. Beberapa aspek kimia sapogenin ste-
roid_pa_d5L tumbuhan di Indonesia. Alumni. Bandung,
pp 120-127.
15. Blunden, G., Yiyi and Jewers K. 1978. Steroidal
eapo-genin from leaves of Agaveae species.
Photochemistry. iZ. : 1923-1925.
16. Blunden, G., Carabot, CA., Jewers, K. 1980. Steroidal
sapogenins from leaves of some species of Agave
and Furcraea. Phytochemistry. 19. : 2M39-2490*
17. Staba, E J . 1985* Milestones in plant tissue culture
systems for the production of secondary products.
Journ. of Nat. Prod. i±8. (2) : 203-206.
18. Rokem, JS., Tal, B., Golden, I. Method for increasing
Diosgenin production by Dioscorea cell in suspen
sion cultures. Journ. of Nat.; Prod. 48, (2) :
19.
Fong, HHS., Norman, RF. Phvtochemical Screening.
Departement of Pharmacology. College of Pharmacy.
University of Illinois at the Medical Center.
Chicago, pp 55-42.
Stahl, E. 1969. Thin layer chromatography, 2nd edition.
Springer Verlag, Berlin, Heidelberg, New York,
p 127.
Macek, K. 1972. Pharmaceutical application of thin
layer and paper chomatographv, Elsevier Publishing
Co. pp 393-399.
Departemen Kesehatan Republik Indonesia. 1979. Farma-
kope Indonesia. Edisi III. pp 780-784.
Steenis, CGGJ, 1978. Flora. PT Pradnya Paramita. Jakar
ta. pp 154-156.
Backer, CA., and Bakhuizen van den Brink Jr., RC, 1968,
Flora of Java. Vol III. Wolters-Noordhoff NV.
Groningen - The Nederlands. pp
163-164-Hegnauer, R. 1963. Chemotaxonomie der Pflanzen. Band II.
Birkhauser Verlag, Basel, otuttgart. pp 25-45.
Strasburger, E., et al. 1971. Lehrbuch der Botanik fur
Hochshulen, 30 Auflage. Gustav, Fischer, Verlag,