y s M S T d d M S d j m o f s g s s Muncak dan Mun yang terseb sepuluh spe M. rooseve Spesies M 15 sub spe Thailand, M di Indonesia dan Nias, M. m. banc Selatan dan dan Pulau (Maryanto e juga munca muntjak. De ordo famili sub famili genus spesies sub spesies Gambar 2 n Status Ko cak (Muntia ar luas di As esies, namu ltorum, M. M. muntjak (i esies yang t alaysia dan a adalah: M. M. m. r canus di Pu n Pulau Jawa Jawa; da et al. 2008). ak jawa me ensie (1970) : Artiodac : Cervida : Cervina : Muntiac : Muntiac : Muntiac Muncak (M periode ra onservasiny acus sp) ter sia (Gamba un saat ini h feae, M. c indian muntj tersebar mu Indonesia. m. montanu robinsoni d ulau Bangka a; M. m. ple an M. m. Sub spesie emiliki gamb mengklasifi ctyla ae ae cus cus muntjak cus muntjak Muntiacus mu anggah velve ya rgolong artio r 2 dan 3). P hanya tersis rinifrons da tjak) sering ulai dari Ind Beberapa s us di Pulau S di Kepulau a dan Belitu echaricus di nainggolan es M. m. Mu baran morfo kasikan mun muntjak, Zim untjak muntja t. odactyla (he Pada awalny a lima spes n M. muntj disebut bar dochina, Ind ub spesies Sumatera (b an Riau ung, M. m. Pulau Kalim ni di Pulau untjak Zimm ologis yang ncak sebaga mmermann 1 ak, Zimmerm ewan berku ya, muncak sies, yaitu: M jak (Ma et rking deer, t dia, Srilanka muncak yan bagian utara (Bintan) da muntjak di matan, Bawa u Bali dan mermann 178 mirip deng ai berikut: 1780 ann 1780) j uku genap) terdiri atas M. reevesi, al. 1986). terdiri atas a, Vietnam, ng terdapat dan barat) an Linga; Sumatera al, Matasiri, n Lombok 80, disebut gan indian antan pada
Muncak (M. m. muntjak) dan sub spesies muncak lainnya yang tersebar di Indonesia merupakan satwa yang dilindungi di Indonesia, seperti yang tercantum di dalam Daftar Lampiran Peraturan Pemerintah Republik Indonesia Nomor 7 tahun 1999, sejak tanggal 27 Januari 1999 (PHKA 2004). Namun demikian, satwa ini belum tercantum di dalam Daftar Appendix CITES (Convention on International Trade in Endangered Species of Fauna and Flora). Berdasarkan data International Union for Conservation of Nature and Natural Resources (IUCN), terdapat satu spesies muncak dengan status vulnerable di dunia, yaitu Muntiacus crinifrons (Black Muntjak) yang berasal dari China (Wemmer 1998). Sedangkan spesies muncak lainnya termasuk bahan penelitian ini (M. m. muntjak) masih memiliki status least concern (IUCN 2011). Populasi muncak di habitat asli diduga semakin menurun, seperti yang terjadi pada populasi spesies satwa liar Indonesia lainnya. Penyebab utama dari penurunan populasi muncak di Indonesia adalah hilangnya habitat satwa seiring dengan alih fungsi hutan sebagai lahan pertanian, dan maraknya perburuan liar.
Gambar 3 Lokasi penyebaran muncak di Indonesia yang meliputi Pulau Sumatera, Pulau Jawa, Pulau Kalimantan, Pulau Bali dan Lombok (Sumber: IUCN 2011).
Morfologi dan Karakteristik Reproduksi Muncak Jantan
Secara umum, tubuh seluruh spesies muncak (Muntiacus sp) ditutupi oleh rambut pendek, lembut, berwarna kuning hingga coklat tua serta abu-abu kecoklatan. Rambut di bagian perut berwarna lebih terang (Worlddeer 2005; Maryanto et al. 2008). Muncak jantan berukuran lebih besar dari betina dengan berat badan 22 kg (jantan) dan 20 kg (betina) (Philips 1984), memiliki ranggah, taring dan kelenjar preorbital di bagian frontal wajah. Kelenjar ini berfungsi sebagai penghasil sekreta yang berfungsi sebagai marker untuk menentukan daerah teritorialnya (Jackson 2002). Ukuran tubuh M. muntjak sedikit lebih besar
dibandingkan dengan M. crinifrons, yaitu dengan rataan panjang tubuh 1043 mm, tinggi bahu 611 mm, panjang kepala 209 mm dengan ukuran fossa lacrimalis lebih kecil dari pada fossa orbitalis (Ma et al. 1986).
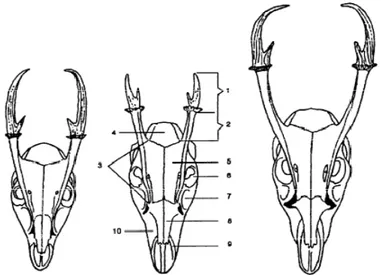
Ranggah merupakan organ asesoris reproduksi sekunder yang tumbuh apabila seekor rusa jantan telah mencapai pubertas (Wallace dan Birtles 1985). Selain sebagai simbol keindahan, ranggah juga digunakan sebagai organ pertahanan saat terjadi perkelahian dengan jantan lainnya (Price et al. 2005). Dari seluruh Cervidae jantan di dunia, hanya ada beberapa spesies yang tidak memiliki ranggah, yaitu chinese water deer (Hydropotes inermis), rusa musk (Moschus chrysogaster) dan mouse deer (Moschiola mimenoides). Selain pada rusa jantan, ranggah juga ditemukan pada rusa betina, yaitu pada rheindeer (Rangifer tarandus), namun ukuran ranggahnya lebih kecil dibandingkan rheindeer jantan (Rajaram 2004). Muncak yang tergolong Cervidae memiliki bentuk ranggah yang berbeda dengan ranggah Cervidae lainnya, yaitu berukuran pendek dengan ujung tanduk cenderung melengkung ke dalam pada muncak berumur tua dan memiliki pedikel (dasar ranggah) yang panjang (Gambar 4). Panjang ranggah pada beberapa spesies muncak bervariasi, yaitu 29-47 mm pada M. reevesi, 38-47 mm pada M. rooseveltorum, 36-49 mm pada M. feae, 48-55 mm pada M. crinifrons dan 48-84 mm pada M. Muntjak (Ma et al. 1986).
Gambar 4 Morfologi tulang kepala muncak jantan (Muntiacus sp). Muntiacus reevesi (kiri), Muntiacus feae (tengah) dan Muntiacus muntjak (kanan). Ranggah (1), pedicle (2), frontal ridge (3), os temporale (4), os frontale (5), foramen orbitalis (6), fossa lacrimalis (7), os nasale (8), os premaxillaris (9), dan os maxillaris (10) (Sumber: Ma et al. 1986).
Ciri khas muncak jantan lainnya adalah sepasang gigi taring atas yang tumbuh dari os maxillaris dengan ukuran sekitar 2 cm yang tetap terlihat saat mulutnya tertutup. Pada saat melakukan aktivitas reproduksi, taring lebih berperan sebagai alat pertahanan saat terjadi kompetisi dengan jantan lainnya dari pada ranggah (Chapman 1997). Selain itu, muncak memiliki vokalisasi spesifik berupa suara gongongan sebagai panggilan atau peringatan kepada muncak lainnya agar menghindar dari predator. Namun vokalisasi tersebut tidak digunakan pada saat aktivitas reproduksi dan untuk penentuan teritorialnya (Oli dan Jacobson 1995).
Perilaku reproduksi M. muntjak secara umum mirip dengan Cervidae lainnya, yaitu poligami pada jantan dan poliestrus pada betina. Aktivitas organ reproduksi jantan dan betina berlangsung setelah muncak berumur di atas satu tahun. Siklus estrus muncak betina berkisar antara 14-21 hari dengan durasi estrus selama dua hari. Sedangkan periode gestasi berlangsung selama 210 hari dengan jumlah anak 1-2 ekor per kelahiran (Jackson 2002) dengan jarak per kelahiran sekitar tujuh bulan (Barrette 2008). Aktivitas reproduksi formosan muntjak (Muntiacus reeves micrurus) menunjukkan pola yang tidak berhubungan dengan periode pertumbuhan ranggah dan konsentrasi testosteron. Walaupun diketahui testosteron dibutuhkan dalam konsentrasi tinggi untuk pertumbuhan ranggah, namun pada saat konsentrasi testosteron rendah, spermatogenesis tetap berlangsung (Pei et al. 2009). Hal ini dibuktikan dengan ditemukannya spermatozoa selama satu siklus ranggah (Liu et al. 2004).
Aktivitas reproduksi muncak seperti tersebut diatas berbeda dengan Cervidae yang hidup di negara empat musim yang dipengaruhi oleh panjang-pendeknya hari (photoperiod). Pada saat intensitas pencahayaan sedikit, terjadi peningkatan sekresi hormon gonadotropin, aktivitas testikular dan aktivitas reproduksi lainnya (Lincoln 1985; Semiadi 1995). Ukuran testis, kelenjar asesoris kelamin, sekresi hormon dan spermatogenesis mengalami perubahan mengikuti siklus ranggah. Pada saat ranggah keras aktivitas reproduksi semakin meningkat, yang ditandai dengan terjadinya perkawinan antara rusa jantan dan betina (Lincoln 1985). Namun demikian pada beberapa spesies rusa lainnya ditemukan adanya variasi pada aktivitas perkawinan. Pada red deer (Cervus elaphus), aktivitas reproduksi dimulai dua bulan sebelum musim gugur berlangsung (Suttie dan Kay 1985). Sedangkan pada roe deer (Capreolus
capreolus), perkawinan lebih sering terjadi pada musim panas antara bulan Mei sampai Agustus (Sempere 1990; Blottner et al. 1996).
Pertumbuhan dan Siklus Ranggah
Ranggah merupakan satu-satunya organ pada mamalia yang mengalami perpanjangan dan mampu beregenerasi secara berulang. Setiap tahun ranggah lepas dan tumbuh kembali dari blastema dan selanjutnya bercabang. Ranggah terdiri atas kulit, syaraf, buluh darah, jaringan fibrosa, tulang rawan (kartilago) dan tulang keras. Struktur ranggah tersebut berbeda dengan tanduk pada ruminansia lain seperti kerbau dan kambing. Tanduk ruminansia merupakan jaringan yang mengalami keratinisasi yang tumbuh dibawah kontrol sel-sel mesenkim pada lapisan basal tanduk. Pada beberapa spesies rusa, ranggah dapat tumbuh sekitar 2 cm per hari, sehingga ranggah disebut sebagai organ yang mengalami pertumbuhan tercepat dibandingkan organ lainnya (Price dan Allen 2004; Price et al. 2005). Regenerasi ranggah bersifat tahunan dan terjadi secara berulang disepanjang hidup Cervidae jantan. Fenomena tersebut dipengaruhi oleh keberadaan testosteron dengan
konsentrasi berbeda sesuai dengan tahapan regenerasi ranggah (Suttie et al. 1992). Pada roe deer (Capreolus capreolus), pertumbuhan ranggah
berlangsung setelah bulan Januari di saat periode pencahayaan dan konsentrasi testosteron mulai meningkat. Namun pada sebagian besar Cervidae lainnya, proses tersebut terjadi pada musim panas (Sempere dan Boissin 1981).
Pertumbuhan ranggah pada Cervidae yang hidup di daerah beriklim tropis, sub tropis, dan beriklim sedang, terbagi atas empat tahapan pertumbuhan, yaitu tahap pedicle, tahap ranggah lunak (velvet), tahap ranggah keras (hard antler) dan tahap lepas ranggah (casting) (Fennessy dan Suttie 1985). Suatu siklus ranggah diawali dengan inisiasi pertumbuhan pedicle pada Cervidae jantan yang memasuki usia pubertas. Pada red deer (Cervus elaphus), inisiasi tersebut berhubungan erat dengan peningkatan konsentrasi testosteron plasma sebagai respon terhadap perubahan sekresi LH. Pertumbuhan ranggah pada jantan pubertas dan dewasa terjadi pada saat konsentrasi testosteron plasma menurun atau rendah yang disebabkan adanya mekanisme umpan balik negatif terhadap hipotalamus dan hipofise karena tingginya konsentrasi testosteron selama periode ranggah keras. Akibatnya sekresi GnRH dan LH berkurang (Gambar 5) (Fennessy dan Suttie 1985). Peningkatan testosteron plasma secara
signifik pada pada yang d Gamba pedicle usia p osifika diferen trabec transis Tahap antlero selanju osifika pedicle kan terjadi tahap castin beberapa sp dilaporkan p ar 5 Regula releasi velvet (RK). ( Analisis h e dan awal pubertas dije asi intramem nsiasi sel-se cular bone sional yang p ini ditan ogenik yang utnya berd asi endokon e. Sedangka pada saat p ing, konsent pesies rusa ada red dee
si hormonal ing hormone (RV), pengel (Modifikasi da histologi terh pertumbuha elaskan oleh mbran, dita el antlerogen di dalam p berlangsun dai dengan terdapat pa iferensiasi ndral yang an tahap ke proses peng trasi hormo temperate er (Price et a pertumbuha (GnRH), lute upasan kulit v ari Fennessy hadap form an ranggah Li dan Sutt andai denga nik menjadi periosteum. g pada saa n terbentuk ada permuka menjadi ko ditandai de empat adala gelupasan k n tersebut konsentrasi al. 2005). an ranggah einizing horm velvet atau sh dan Suttie 19 masi dan id pada Cerv tie (1994). T an dimulain osteoblas ya Tahap ked at panjang p knya jaring aan apikal. S ondrosit. Ta engan berla ah tahap os kulit velvet r sangat rend nya tidak te pada Cervid one (LH), cas hedding (S), d 985). dentifikasi ta idae jantan Tahap pertam nya proses ang selanjut dua adalah pedicle men gan kartilag Sel-sel antle ahap ketiga angsungnya ifikasi endok ranggah. Na dah dan ba erdeteksi, se ae. Gonadot sting (C), ran dan ranggah ahapan osif yang mema ma adalah t proliferasi tnya membe tahap osif ncapai 5-10 go oleh se erogenik ters a adalah t a kondrogen kondral rang amun hkan eperti tropin nggah keras fikasi asuki ahap dan entuk fikasi mm. el-sel sebut ahap nesis ggah.
Tahap ini merupakan tahap akhir yang ditandai dengan berlanjutnya proses osifikasi kondrogenik hingga terbentuk ranggah. Onset formasi ranggah ditandai dengan munculnya selaput tipis (velvet skin) yang menutupi bagian ujung distal pedicle.
Biosintesis dan Metabolisme Androgen
Pada hewan jantan terdapat tiga jenis hormon steroid yang berperan penting dalam sistem reproduksi, yaitu testosteron, dihidrotestosteron dan estradiol. Dari ketiga jenis hormon steroid tersebut, testosteron memiliki peran dominan. Sekitar 95% testosteron disintesis dan disekresikan oleh sel-sel Leydig tubuli semeniferi testis, sedangkan sebagian kecil lainnya disekresikan oleh kelenjar adrenal. Selain testosteron, sel-sel Leydig testis juga mensekresikan androgen lainnya, yaitu dehidrostestosteron (DHT), dehidroepiandrosteron (DHEA) dan androstenedion yang kurang memiliki efek androgen dibandingkan testosteron. Sel-sel Leydig juga menghasilkan beberapa hormon steroid lainnya dalam jumlah kecil, seperti estradiol, estron, pregnenolon, 17α-hidroksipregnenolon dan 17α-hidroksiprogesteron (Braunstein 1997).
Pada vertebrata, biosintesis hormon steroid seperti testosteron dan metabolitnya berasal dari kolesterol sebagai prekursor hormon (Koolman dan Röhm 2001). Biosintesis testosteron oleh sel-sel Leydig dapat berlangsung akibat stimulus luteinizing hormone (LH) yang dihasilkan oleh sel-sel LH di hipofise anterior. Hormon ini bekerja secara sinergis dengan follicle stimulating hormone (FSH) dan prolaktin. Peran prolaktin pada proses sintesis testosteron adalah dengan meningkatkan jumlah dan afinitas reseptor LH di membran sel Leydig. Adanya interaksi antara LH dan reseptornya akan mengaktifkan sistem adenilat siklase, termasuk aktivasi protein kinase dan sintesis RNA (Pineda 2003), sehingga terjadi peningkatan sintesis pregnenolon dengan jumlah rantai karbon 21 (C21) dari kolesterol (C27) oleh mitokondria sel-sel Leydig. Hasil akhir dari proses tersebut adalah testosteron (C19) (Koolman dan Röhm 2001; Pineda 2003).
Jalur biosintesis hormon androgen (Gambar 6) diawali dengan proses konversi kolesterol menjadi pregnenolon oleh enzim cytochrome P450 side-chain cleavage (P450scc) yang berlangsung di mitokondria sel Leydig. Pregnenolon selanjutnya berdifusi ke sitoplasma dan dikonversikan melalui jalur ∆5 atau ∆4 dengan produk akhir testosteron. Pada jalur ∆5, pregnenolon diubah menjadi 17α-pregnenolon oleh P450c17/C17 hidroksilase dan akan berubah menjadi
DHEA domin menja dehidr Jalur pregne terjadi andros testos Gamba A oleh P450c an dibandin di testost rogenase (1 ∆4 lebih d enolon men nya konve stenedion o teron sebag ar 6 Regulas hitam m testis, manusia Hikim c17/C17,20 l ngkan denga teron mela 17β-HSD) d ominan dite njadi proge ersi proge leh P450c17 gai produk ak si steroidoge menunjukkan garis hitam a. STAR = et al. 2005). iase/desmol an jalur ∆4. alui andro dan 3β-hid emukan pad steron oleh esteron m , sedangkan khir oleh 17β nesis androg proses yan tebal menun = steroidoge lase. Pada t Walaupun ostenedion roksisteroid da testis ro h 3β-HSD. enjadi 17α n androsten β-HSD (Hikim
gem oleh lut ng berlangsu njukkan jalur enic acute testis manus DHEA dap oleh 17 dehidrogen odensia den Tahap sela α-hidroksipro nedion akan m et al. 2005 teinizing horm ng di mitoko steroidogen regulatory p sia, jalur ∆5 at dikonvers β-hidroksist nase (3β-H ngan meng anjutnya ad ogesteron diubah me 5). mone (LH). K ondria sel L nik dominan protein (Sum lebih sikan eroid HSD). ubah dalah dan enjadi Kotak eydig pada mber:
Testosteron yang memasuki sirkulasi darah terikat pada albumin serum dan steroid hormone-binding globulin (SHBG). Senyawa ini merupakan suatu glikosilasi protein dimer yang terutama diekspresikan di hati dan selanjutnya memasuki sel secara difusi. Testosteron dapat dikonversikan menjadi 5α-DHT oleh dua tipe isoenzim mikrosomal, yaitu 5α-reduktase-1 dan 5α-reduktase-2. Enzim 5α-reduktase-2 akan mengkonversi testosteron menjadi 5α-DHT pada organ genital. Enzim ini dikode oleh gen SRD5A2 yang terdapat di kromosom 2 (2p23) dan hanya diekspresikan oleh jaringan genital yang bergantung pada androgen. Selain itu, testosteron juga dapat diaromatisasi menjadi estradiol-17β oleh enzim aromatase sitokrom P450 (P450arom) di jaringan perifer. Walaupun estradiol-17β merupakan hormon steroid utama pada betina, namun pada jantan hormon ini diperlukan dalam konsentrasi kecil pada proses spermatogenesis, libido, dan beberapa fungsi reproduksi lainnya (Meaden dan Chedrese 2009).
Menurut Hodges dan Heistermann (2003); Heisterman (2010), hormon steroid yang beredar di sirkulasi darah akan mengalami perubahan metabolik di hati atau ginjal sebelum dieliminasi oleh tubuh. Perubahan yang terjadi secara alami bervariasi di antara spesies hewan, baik dari jenis metabolit maupun jalur ekskresinya. Informasi yang diperoleh dari variasi tersebut, pada tahap berikutnya akan bermanfaat untuk memilih teknik pengukuran metabolit hormon steroid dan interpretasi hasil yang akurat. Metabolisme hormon steroid seperti androgen secara mayoritas berlangsung di hati, namun beberapa aktivitas katabolik juga berlangsung di ginjal. Metabolit steroid yang dihasilkan akan diekskresikan oleh ginjal melalui urin, sedangkan sistem empedu mengekskresikan metabolit melalui feses (Amaral et al. 2009).
Hormon androgen yang beredar di sirkulasi darah akan dikonversikan oleh hati menjadi beberapa metabolit androgen, seperti androsteron dan etiokolanolon. Metabolit androgen tersebut selanjutnya akan terkonjugasi dengan glukoronik dan asam sulfat sebelum diekskresikan melalui urin sebagai 17-ketosteroid (sekitar 20-30%), sedangkan sisanya merupakan hasil metabolisme steroid kelenjar adrenal (Meaden dan Chedrese 2009).
Metode Pengukuran Konsentrasi Metabolit Steroid
Penentuan konsentrasi hormon reproduksi jantan (androgen) dapat dilakukan dengan berbagai cara, seperti pemeriksaan hormon dari plasma (Morais et al. 2002), urin dan feses (Busso et al. 2004). Teknik pemeriksaan rutin melalui plasma yang diperoleh dari darah juga dapat dilakukan pada hewan
ternak, namun teknik tersebut sedikit berisiko bila dilakukan pada satwa liar, karena harus melewati prosedur imobilisasi dengan bahan kimia dan restrain fisik (Hamasaki et al. 2001). Oleh karena itu perlu dilakukan teknik pemeriksaan lainnya yaitu dengan teknik non invasif. Teknik ini sangat sesuai bila diaplikasikan pada satwa liar untuk tujuan penelitian jangka panjang (longitudinal study), baik di lingkungan in situ maupun ex situ. Dengan pendekatan non invasif, hewan terhindar dari stres akibat proses restrain yang biasa dilakukan pada teknik invasif. Teknik non invasif dapat diaplikasikan untuk menganalisis metabolit hormon yang terdapat pada feses dan urin (Mateo dan Cavigelli 2005; Washburn et al. 2004). Poole et al. (1984), menggunakan teknik tersebut untuk menentukan konsentrasi testosteron dari sampel feses dan urin gajah liar afrika (Loxodonta africana), Hamasaki et al. (2001) pada sika deer (Cervus nippon), Morato et al. (2004) pada jaguar (Panthera onca), dan Mauget et al. (2007) pada chinese water deer (Hydropotes inermis)
Pada tahap berikutnya penelitian mengenai teknik ini terus berkembang, terutama yang berhubungan dengan improvisasi metode analisis, transportasi dan purifikasi sampel (Ziegler dan Wittwer 2005). Proses validasi monitoring non invasif terhadap variasi metabolit androgen yang terdapat di dalam ekstrak feses juga telah dilakukan pada beberapa spesies satwa liar, seperti spotted hyena (Crocuta crocuta) (Dloniak et al. 2004) dan Gajah Afrika (Loxodonta africana) (Ganswindt et al. 2005). Pada satwa betina aplikasi teknik ini telah dilaporkan untuk menentukan siklus ovariumnya, seperti pada badak putih (Ceratotherium simum simum) (Patton et al. 1999; Schwarzenberger et al. 1998), schimitar horned-oryx (Oryx dammah) (Morrow dan Monfort 1998) dan okapi (Okapia jhonstoni) (Kusuda et al. 2007).
Ada beberapa tahapan yang dilakukan untuk menganalisis profil hormon reproduksi dengan memanfaatkan sampel feses, yaitu: 1) koleksi sampel feses dari lapangan, 2) penanganan dan persiapan sampel feses, dan 3) analisis laboratorium. Sebelum sampling dilakukan, perlu diketahui kondisi lapangan tempat sampel berada dan jumlah feses yang akan dikoleksi. Hal tersebut berkaitan dengan proses transportasi sampel dari lapangan hingga tahap analisis laboratorium dilakukan (Ziegler dan Wittwer 2005). Proses penyimpanan sampel sangat menentukan kualitas hormon yang akan dianalisis. Metabolisme bakteri gastrointestinal yang terdapat di feses secara cepat akan merusak hormon yang diekskresikan (Heistermann 2010). Metode terdahulu yang dilakukan untuk
sampling feses di lapangan adalah menyimpan sampel menggunakan alkohol sebagai bahan preservatif hingga tahap analisis dilakukan. Namun metode ini memiliki kelemahan, yaitu dapat menyebabkan terjadinya perubahan struktur
steroid hormon akibat terbatasnya udara pada saat transportasi (Khan et al. 2002). Untuk itu, telah dilakukan beberapa metode penyimpanan
yang dapat mempertahahankan kondisi sampel yang dikoleksi, seperti pembekuan sampel (freezing samples), dan pengeringan sampel (drying samples). Proses pengeringan (lyophilization) sampel feses merupakan tahapan penting untuk mengawetkan metabolit hormon steroid agar dapat disimpan dalam waktu lama, sehingga konsentrasi metabolit steroid yang akan diperiksa tidak berubah secara signifikan (Hunt dan Wasser 2003). Tahap berikutnya adalah ekstraksi sampel di yang dilanjutkan dengan tahap analisis laboratorium. Sampel feses yang telah diekstraksi dapat dianalisis secara langsung dengan teknik enzymeimmunoassay menggunakan antibodi spesifik terhadap hormon yang akan dideteksi (Ziegler dan Wittwer 2005).
Pengukuran hormon dan metabolit hormon biasanya dilakukan dengan prosedur imunologi menggunakan antibodi hormon atau antibodi grup spesifik hormon. Ada dua metode immunoassay yang tersedia, yaitu radioimmunoassay (RIA) dan enzyme immunoassay (EIA). Metode RIA dilakukan dengan melabel hormon dengan marker radioaktif tertentu, sedangkan EIA menggunakan preparasi enzim atau enzim yang dilabel dengan biotin. Metode EIA lebih dipilih karena tidak menimbulkan efek radioaktif seperti RIA. Selain itu biaya asai lebih murah dibandingkan dengan RIA (Hodges dan Heistermann 2003). Aplikasi metode EIA terhadap metabolit androgen feses dari spesies rusa telah dilaporkan pada pampas deer (Ozotoceros bezoarticus bezoarticus) (Pereira et al. 2005), dan red brocket buck (Mazama americana) (Versiani et al. 2009). Meode tersebut telah terbukti sebagai metode yang tepat
dan praktis untuk mengetahui status reproduksi pada kedua spesies rusa tersebut.
Anatomi Organ Reproduksi Jantan
Anatomi organ reproduksi jantan bervariasi pada berbagai spesies hewan. Variasi tersebut berhubungan erat dengan fungsi reproduksinya serta penyesuaian terhadap anatomi organ reproduksi betina. Secara umum, organ reproduksi jantan terdiri atas: sepasang testis dan saluran-salurannya: duktus epididimidis dan duktus deferens yang menyalurkan produk eksokrin testis
menuju uretra (Colville dan Bassert 2002). Selain itu terdapat pula kelenjar asesoris kelamin yang terdiri atas: glandula vesikularis, glandula prostata dan glandula bulbouretralis (Tabel 1). Kelenjar asesoris kelamin tersebut berperan sebagai organ yang menghasilkan bahan pembentuk plasma semen (Haron et al. 1999). Uretra adalah saluran reproduksi jantan yang berjalan di sepanjang penis dan berfungsi untuk menyalurkan urin dan semen. Sedangkan penis merupakan organ kopulasi jantan yang menyalurkan semen ke dalam organ reproduksi betina saat terjadi ejakulasi (Senger 2005).
Tabel 1 Kelenjar asesoris kelamin pada beberapa spesies hewan.
Spesies Glandula Vesikularis Glandula Prostata Glandula Bulbourethralis
Sapi + + + Anjing - + - Kuda + + + Kucing - + + Llamas - + + Domba + + + Babi + + + (Sumber: Pineda 2003).
Secara anatomi testis berada di luar tubuh dan dilindungi oleh kulit tebal yang disebut skrotum. Testis merupakan organ elipsoidal padat dengan ukuran bervariasi pada setiap spesies hewan. Pada kucing, ukuran testis relatif lebih kecil bila dibandingkan domba dan kambing. Selain itu orientasi testis pada tubuh hewan juga bersifat spesifik spesies, seperti testis sapi yang menjulur kearah vertikal dari sumbu tubuh, testis kuda dan anjing pada posisi horizontal, sedangkan testis babi dan kucing berada di bagian ventral anus (Senger 2005). Testis dexter et sinister digantung dan dipisahkan di dalam skrotum oleh funikulus spermatikus yang terdiri atas duktus deferens, buluh darah (arteri dan vena) dan syaraf serta dibungkus oleh peritoneum. Dari arah superfisial ke profundal, testis dilapisi oleh skrotum, tunika dartos, fasia spermatikus eksterna, tunika vaginalis lamina parietalis dan tunika vaginalis lamina viseralis, serta tunika albuginea (Dyce et al. 1996). Mayoritas jaringan parenkim testis ditempati oleh tubuli seminiferi. Komposisi jaringan parenkim testis babi terdiri atas 87% tubuli seminiferi dan 7% sel sel Leydig dengan jumlah sel sertoli sekitar 42 juta per gram testis (Almeida et al. 2006).
j S a A G S t s e Seca jantan yan (spermatoge Spermatoge menghasilka androgen b (Senger 200 A. Gambar 7 A el (S Fl lu (C 19 Spermatog Siklu tahapan sp seminiferi te epitel tubu berdiferensi (Franςa et a berupa suat Pada sperm menjadi spe ara fungsion ng berpera enesis) dan enesis berla an sel gam berlangsung 05). Anatomi testis ectron microg ST), dengan s agela (F) ya men tubuli. P CT), dan bulu 978 (B) di dala enesis dan us epitel tub ermatogene estis dan du li semenife asi, yaitu al. 1999). Sp tu kesatuan matogenesis ermatozoa (h nal testis me an penting n steroidoge angsung di met jantan di jaringan s. Skema tes graph jaringa sel-sel germin ang berasal Pada jaringan uh darah (BV am Senger 2 Tahapan E buli seminife esis (sperma urasinya (N eri testis t u sperma permatogene n diferensias s terjadi p (haploid). Pe erupakan org g dalam enesis atau tubuli sem (spermatoz interstisial B
stis sapi dan an parenkim t nal (GC) yang dari perkem n interstisial te V). (Sumber: 005). Epitel Tubul eri testis da atogenic sta akai et al. terdiri atas atogonia, esis merupa si selular ya proses difer embentukan gan utama proses ga sintesis ho meniferi test zoa), sedan testis, yaitu B. bagian-bagia testis kuda (B g dikelilingi ole mbangan sper erdapat sel L Constantine i Semenifer apat diklasif ages) yang 2004). Seca tiga tipe spermatosi akan fungsi f ang komplek rensiasi sp spermatozo dari sistem ametogenes ormon stero is (Gambar gkan prose u pada annya (A) da B). Tubulus eh membran rmatid dapat Leydig (LC), j escu 2007 (A ri Testis fikasikan be berlangsun ara histolog sel germ t dan fundamenta ks (Dreef et ermatogonia oa dari sper reproduksi sis jantan oid jantan. r 7) untuk es sintesis -sel Leydig an scanning seminiferus basal (BM). t diamati di aringan ikat A); Johnson erdasarkan g di tubuli gis, lapisan minal yang spermatid l dari testis t al. 2007). a (diploid) rmatogonia
terseb spesif secara hewan bentuk germin akroso Gamba epitel kambi durasi dan p pada monye terjadi selain durasi tritiate but terjadi m ik. Sperma a sentripetal n mamalia, k dan ukura nal dan pros om dan inti s ar 8 Sperma dari sper – sperm Senger 2 Penelitian tubuli sem ng (Capra h spermatog pada babi L hewan-hew et ekor pan dalam 12 penentuan dari setiap d thymidine melalui tahap togenesis d menuju adl tahapan te an inti sel ses pembela sel spermatid togenesis pa rmatogonia (A matid, dan d 2005). tentang kar miniferi testis hircus) (Fran enesis pada Landrace (G wan tersebut njang (Mac tahap (Dree tahapan sp tahapan. Pa e secara i pan (stage) imulai dari l uminal tubu ersebut dap spermatid, ahan sel sec
d (Almeida e ada mamalia. A1) – sperma diferensiasi s rakteristik ta s telah dila nςa et al. 19 a ferret (Mu Garcia-Gil et t terjadi dal caca fascicu ef et al. 200 permatogene arameter ters intratestikula tertentu ya apisan basa li (Gambar 8 pat dibedaka posisi sel cara meiosis et al. 2006). . Terbagi ata togonia (B), m spermatid me ahapan sper akukan pada 99; Onyang stela putoriu t al. 2002). am delapan ularis) dan 07). Franςa esis, dapat p sebut dapat ar menggun ng ditandai al tubuli sem 8) (Russel e an berdasa di dalam la s atau perke as tahapan p meiosis dari s enjadi sperm rmatogenesi a berbagai o et al. 200 us furo) (Na Tahapan s n tahap. S manusia, s a et al. (199 pula diketah diukur deng nakan hypo dengan tipe miniferi, berg t al. 1990). P arkan perub apisan epite mbangan si proliferasi (mi spermatosit p matozoa (Sum is atau tah hewan, se 00), tahapan akai et al. 20 spermatogen Sedangkan spermatogen 99) menyata hui frekuensi gan teknik in odermic ne e sel gerak Pada ahan elium stem itosis) primer mber: apan eperti n dan 004), nesis pada nesis akan, i dan njeksi eedle.
Setelah melalui tahapan berikutnya, jaringan testis difiksasi dengan glutaraldehid buffer 4% dan dibuat sediaan histologi untuk selanjutnya diwarnai dengan pewarna toluidine blue. Durasi spermatogenesis pada berbagai spesies hewan bervariasi, pada sapi berlangsung selama 54 hari, babi 39 hari, domba 47 hari dan manusia 74 hari (Juneja dan Koide 2000).
Androgen adalah hormon steroid jantan yang berperan penting dalam proses spermatogenesis. Target androgen pada jaringan testis adalah sel Leydig dan sel Sertoli. Testosteron merupakan androgen utama yang disintesis oleh sel Leydig testis. Hormon ini memiliki efek parakrin pada sel Sertoli, yaitu sebagai salah satu komponen penting pada saat spermatogenesis. Sedangkan pada sel Leydig, testosteron memiliki efek otokrin yang berfungsi untuk menginisiasi diferensiasi dan fungsi sel Leydig pada masa pubertas (Shan et al 1997). Aktivitas androgen pada jaringan testis seperti pada sel Leydig dan sel Sertoli dapat diketahui melalui deteksi terhadap reseptor yang terdapat pada sel-sel tersebut. Aksi androgen dimediasi oleh reseptor intraselular yang berperan sebagai faktor transkripsi akibat adanya ikatan antara ligan dengan reseptor tersebut (Madjig et al. 1995).
Beberapa peneltian tentang lokalisasi reseptor androgen telah dilaporkan, seperti pada tikus (Bremner et al. 1994), yang menyatakan bahwa reseptor androgen pada setiap tahapan spermatogenesis menunjukkan ekspresi berbeda. Pada sel Sertoli testis tikus, ekspresi reseptor androgen dapat dideteksi pada tahap II-VII dengan level tertinggi pada tahap VII dari siklus tubuli seminiferi. Selain itu, reseptor androgen ditemukan juga pada jaringan testis lainnya seperti sel myoid peritubular, arteriol dan sel Leydig, namun tidak ditemukan pada sel-sel germinal. Ekspersi reseptor androgen pada jaringan sel-selain sel-sel Sertoli, tidak berhubungan dengan tahapan spermatogenesis yang berlangsung pada tubuli seminiferi yang berdekatan dengan jaringan tersebut.
Hill et al. (2004) menyatakan, spermatogenesis dapat berlangsung normal jika konsentrasi androgen (testosteron) intraselular lebih tinggi dari pada konsentrasi testosterone plasma di sirkulasi. Pada tikus, konsentrasi testosteron intraselular adalah 40-50 kali lebih tinggi dari pada konsentrasi testosteron plasma (1-2 ng/ml). Apabila konsentrasi testosteron intraselular lebih rendah, maka sel germinal akan kehilangan beberapa tahapan spermatogenesis yang spesifik. Namun kondisi tersebut dapat diperbaiki bila diberikan testosteron dosis tinggi yang selanjutnya akan berikatan dengan reseptornya di sel Sertoli.
Morfologi dan Kualitas Semen
Kualitas semen merupakan salah satu parameter yang dapat menentukan status reproduksi pada Cervidae jantan. Pada red deer (Cervus elaphus), kualitas semen menunjukkan perbedaan pada setiap periode reproduksinya, yaitu pada periode pre-mating, mating dan post-mating. Kualitas semen yang terbaik ditemukan pada saat periode musim kawin (mating), yang berlangsung dari akhir September sampai akhir Oktober. Kondisi tersebut ditandai dengan tingginya libido rusa jantan untuk mengawini betina (Gizejewski 2004). Selanjutnya dijelaskan oleh Monfort et al. (1995) bahwa musim juga berpengaruh pada kualitas semen eld’s deer (Cervus eldi thamin). Volume semen tertinggi pada rusa tersebut ditemukan pada musim dingin yaitu: 3.49 ± 0.36 ml, musim panas: 2.95 ± 0.42 ml dan musim gugur 2.11 ± 0.61 ml. Sedangkan volume terendah ditemukan pada musim semi 0.69 ± 0.03 ml.
Spermatozoa merupakan sel berbentuk panjang dan motil, berperan sebagai agen pengantar genom haploid jantan menuju oosit betina. Spermatozoa terbagi atas kepala yang mengandung inti (nukleus) dan ekor (flagellum) yang memiliki bagian leher (connecting piece), badan ekor (mid-piece), ekor utama (principle piece) dan ujung ekor (end-piece) (Gambar 9) (Manandhar dan Sutovsky 2007). Secara umum, kepala spermatozoa berbentuk oval dengan struktur kromatin padat dan berinti tipis serta dilapisi oleh tudung akrosom di bagian anterior dan selubung post akrosom di bagian posterior (Barth dan Oko 1989). Struktur kromatin pada inti spermatozoa lebih padat 6–10 kali lipat dibandingkan struktur kromatin pada tahap metafase kromosom saat pembelehan sel somatis (Manandhar dan Sutovsky 2007). Sedangkan akrosom merupakan struktur pelindung dengan lapisan ganda, terletak di antara plasma membran dan bagian anterior kepala spermatozoa, berfungsi sebagai pelindung inti selama tahap akhir formasi spermatozoa. Selain itu akrosom mengandung akrosin, enzim hialuronidase dan enzim-enzim hidrolitik lainnya yang berperan dalam proses fertilisasi (Garner dan Hafez 2000).
Ekor spermatozoa merupakan struktur organel silinder, memanjang dari posterior kepala yang berfungsi sebagai penggerak dan sumber energi bagi spermatozoa. Bagian penghubung (connecting piece) ekor atau leher tersusun atas struktur kompleks yang menghubungkan kepala dan ekor. Permukaan kepala bagian posterior berbentuk konkaf (basal plate) dihubungkan dengan permukaan ekor yang konveks (capitulum) oleh struktur filamen padat. Capitulum
s G t d a d t e memanjang pada lapisa spermatozo berkurangny Gambar 9 M ro p m m E H Peluang Pe Tek teknologi ini dicegah de pengemban antar negar (semen) ha diduga tidak berkaitan d mengoptima tersebut ma Insem efektif dan d I kearah kau an terluar a bergabu ya aktivitas g Morfologi sper odensia (B). principal piec mamalia. A. S musculus), C. E. kuda (Equ H. manusia (H emanfaatan nologi repro dapat dima engan mem gbiakan. Pe ra dapat dila sil preserva k bermusim dengan pen alisasi siste upun komer minasi buat dapat diapli
dal yang ter dari serabu ung denga glutation yan rmatozoa ma Secara umum ce dan end-Spermatozoa . tikus (Rattu us caballus), Homo sapiens Ejakulat M oduksi telah anfaatkan pa manfaatkan ertukaran m akukan mela asi dan kriop m, memberi nerapan bio m reproduk rsial. an merupak kasikan di b I rsusun atas ut padat. n ooplasm ng berasal d amalia. (I) Sk m terdiri atas -piece. (II) G a opossum (D us novergicus F. babi (Su s) (Sumber: M uncak berkemban ada satwa lia materi gen materi genet alui teknik IB preservasi. P peluang un oteknologi r ksinya, baik kan salah sa bidang budi II sembilan m Lapisan ini ma, proses
ari oosit (Su
kema sperma kepala, conn Gambaran m Didelphis virg s), D. kelinci s scrofa), G Manandhar da ng pesat pad ar maka keja etik dari s tik antar da B dengan m Perilaku rep tuk dilakuka reproduksi k untuk tuju atu teknik re daya ternak mikrotubuli da akan terp ini didug utovsky et al atozoa ungula necting piece mikroskopis s giniana), B. m (Oryctolagus . sapi (Bos an Sutovsky 2 da hewan te adian inbree atwa diluar aerah konse menggunaka produksi mu annya pene dengan tuj uan konserv eproduksi y k dengan tu an berakhir pisah saat ga akibat l. 1996).
ata (A) dan e, mid-piece, permatozoa mencit (Mus s cuniculus), taurus) dan 2007). ernak. Bila eding dapat r kawasan ervasi atau an ejakulat uncak yang elitian yang uan untuk vasi satwa yang cukup juan untuk
meningkatkan populasi dan mutu genetik ternak. Menurut Pesch dan Hoffmann (2007), teknik IB menggunakan ejakulat hasil kriopreservasi telah dilakukan pada program budidaya sapi sejak 60 tahun yang lalu, dan bertujuan untuk mencegah penularan agen infeksi organ genital yang dapat terjadi pada perkawinan alami. Namun, menurut Rizal (2005), teknik ini belum banyak dilakukan pada ternak ruminansia kecil karena terdapat beberapa kendala teknis, seperti sulitnya deposisi semen pada saluran reproduksi betina saat pelaksanaan IB, ukuran serviks yang kecil serta tidak memungkinkan dilakukannya palpasi rektal seperti pada ternak besar. Dengan demikian diperlukan upaya untuk meningkatkan kualitas ejakulat dan saat yang tepat untuk pelaksanaan IB.
Menurut Morrow et al. (2009), aplikasi IB untuk tujuan manajemen genetik pada Cervidae dan sapi non domestik (antelop) mengalami beberapa kendala, seperti; 1) terbatasnya informasi tentang karakterisitik reproduksi yang bersifat spesifik spesies, 2) sulitnya untuk mengurangi stres akibat handling yang dilakukan, 3) kegagalan kebuntingan, dan 4) tantangan terhadap regulasi impor semen. Teknik IB pada spesies non domestik tersebut telah diuji coba pada beberapa peternakan rusa dan antelop dengan mengadaptasi protokol IB pada sapi.
Sejauh ini penerapan teknik IB pada Cervidae sudah dilakukan pada red deer (C. elaphus) dengan metode IB intrauterin dengan tindakan laparoskopi (High dan Bowen 1991; Asher et al. 2000), pada white-tailed deer (Odocoileus virginianus) dengan IB intraservikal dan intrauterin (Jacobson et al. 1989) dan pada rheindeer (Rangifer tarandus) secara intraservikal dan intravaginal (Asher et al. 2000). Namun teknik IB dengan berbagai metode tersebut belum pernah dilakukan pada muncak.
Sebelum pelaksanaan IB, perlu dilakukan pengenceran spermatozoa ejakulat dengan bahan pengencer tris kuning telur seperti yang diaplikasikan pada rusa (Asher et al. 2000). Selain tris kuning telur terdapat pula bahan pengencer lainnya, yaitu tris, sitrat, susu skim dan bahan pengencer komersial. Untuk proses pengenceran, diperlukan komponen pengencer, yaitu larutan buffer (natrium sitrat dan tris buffer) yang berfungsi sebagai pengontrol pH. Ejakulat yang telah diencerkan selanjutnya dipreservasi dengan berbagai teknik seperti rapid freezing tanpa krioprotektan (Agca dan Crister 2002), serta kriopreservasi dengan bahan pengencer, krioprotektan dan antioksidan (Rizal 2005).
Pemanfaatan ejakulat untuk IB pada muncak dapat dilakukan dengan mengadaptasi prosedur pengenceran, preservasi dan kriopreservasi yang dilakukan pada white-tailed deer (Ake-Lopez et al. 2010), yang melakukan kriopreservasi spermatozoa yang dikoleksi dari duktus epididimidis. Sebagai bahan krioprotektan digunakan tris-fruktosa dan tryladil. Teknik IB dengan pemanfaatan semen beku post-thawed yang dipreservasi dengan sitrat kuning telur juga telah dilakukan pada wapiti (C. elaphus) (High dan Bowen 1991). Selain itu kriopreservasi spermatozoa iberian red deer telah dilakukan dengan menggunakan krioprotektan tes-tris-fruktosa dengan komposisi kuning telur 10% dan gliserol 4% (Martinez-Pastor et al. 2005).