v
In the day of trouble He will keep me
safe in His dwelling; He will hide me
in the shelter of His tabernacle and set
me high upon a rock
Psalm 27:5
Kupersembahkan karyaku ini kepada :
♥
Tuhan Yesus atas segala berkat dan perlindunganNya
♥
Papaku Alm. Soenarto dan mamaku Dewi Ratnawati sebagai
ungkapan terima kasihku atas kasih sayang yang telah kalian
berikan
♥
Adikku Edwin Yakub Winarto
♥
Koko Anton, yang selalu memberi dukungan dan mencintai
vii PRAKATA
Puji syukur dan terima kasih ke hadirat Tuhan Yang Maha Esa atas bimbingan dan kasih-Nya yang begitu besar sehingga penulis dapat menyelesaikan skripsi yang berjudul Identifikasi Kandungan Kafein dalam Ekstrak Etanolik Daun Teh (Camellia sinensis L.) dari Daerah Boyolali dengan Metode KLT-Densitometri.
Skripsi ini ditulis sebagai salah satu syarat untuk mencapai gelar kesarjanaan pada Fakultas Farmasi Universitas Sanata Dharma Yogyakarta.
Penulisan skripsi ini tidak mungkin terwujud tanpa adanya bimbingan, pengarahan dan bantuan dari berbagai pihak, maka pada kesempatan ini penulis mengucapkan banyak terima kasih kepada:
1. Rita Suhadi, M.Si., Apt. Selaku Dekan Fakultas Farmasi Universitas Sanata Dharma Yogyakarta atas semua kesempatan yang diberikan untuk menuntut ilmu dan melaksanakan penelitian.
2. Erna Tri Wulandari M.Si.,Apt. selaku dosen pembimbing, yang telah memberikan bimbingan yang sangat berguna demi terselesaikannya skripsi ini.
3. Yohanes Dwiatmaka, M.Si. selaku dosen penguji atas masukan dan saran kepada penulis.
viii
7. Seluruh staff laboratorium Farmakognosi Fitokimia dan Laboratorium Kimia Analisis Instrumen Universitas Sanata Dharma, Yogyakarta: Mas Wagiran, Mas Sigit, Mas Sarwanto, Mas Parlan, Mas Kunto, dan Mas Bimo yang telah menemani dan membantu selama penelitian.
8. Keluarga yang kucintai yang menjadi semangat dan tujuan perjuanganku. 9. Anthony, atas pinjaman laptopnya, cinta, rasa sayang, perhatian, dukungan
dan kesabarannya.
10.Teman–teman seperjuangan praktikum semester 1-3, Tony, Oktav, Arum, Aroma.
11.Sahabat-sahabatku, Yuni, Winny, Yenni, Rico, Linda dan seluruh teman-teman FKK Angkatan 2006.
12.Semua pihak yang tidak dapat disebutkan satu persatu yang telah membantu terwujudnya skripsi ini.
Penulis menyadari atas keterbatasan dan kekurangan penulis, maka ini jauh dari sempurna. Oleh karena itu penulis mengharapkan kritik dan saran dari segenap pembaca, semoga skripsi ini bermanfaat bagi perkembangan ilmu pengetahuan khususnya dalam hal penelitian di bidang Farmakognosi dan berguna bagi pembaca.
ix
x
kandungan kimia suatu tanaman. Salah satu minuman teh yang saat ini banyak dikonsumsi masyarakat Indonesia adalah teh hijau, yang berfungsi sebagai stimulan karena adanya kandungan kafein di dalamnya. Kafein dalam daun teh yang berbentuk basa bebas dapat diekstraksi menggunakan pelarut etanol 70% karena kafein dalam bentuk basa dapat larut dalam pelarut organik. Berdasarkan gugus kromofor dalam struktur kafein yang bertanggung jawab atas penyerapan energi radiasi sinar UV, maka untuk identifikasi kuantitatif kandungan kafein digunakan metode KLT-densitometri. Tujuan penelitian ini adalah untuk mengetahui kandungan kafein dalam ekstrak etanolik daun teh dari daerah Boyolali dengan metode KLT-densitometri.
Penelitian ini merupakan penelitian noneksperimental karena tidak ada perlakuan terhadap subyek uji. Langkah penelitian terdiri atas identifikasi secara kualitatif, yaitu pemeriksaan kandungan kafein secara KLT, dan dilanjutkan dengan identifikasi secara kuantitatif dengan KLT-densitometri. Prinsip metode KLT-densitometri adalah dengan mengukur kerapatan bercak senyawa uji yang dipisahkan dengan KLT dan dibandingkan dengan kerapatan bercak senyawa standar yang dielusi bersama-sama.
Hasil identifikasi kualitatif secara KLT menunjukkan ekstrak etanolik daun teh mengandung kafein dengan Rf 0,39 dibandingkan standar kafein dengan Rf 0,40. Pada identifikasi kuantitatif secara densitometri diperoleh rata-rata kadar kafein dalam ekstrak etanolik daun teh yang berasal dari daerah Boyolali sebesar (1,2439 ± 0,1039) % b/b .
xi ABSTRACT
One of tea garden in Jawa Tengah is located at Kabupaten Boyolali, the exact place is Kecamatan Selo which is located at 1.300-1.500 m above the surface of the sea. A higher area will influence tthe amount and effect of chemical contains in a plant. One of tea beverage which is mostly consumed by Indonesian people is green tea, which is used as a stimulant because of it’s caffeine contains. Caffeine in tea’s leaves in base forms can be extracted by ethanol 70% because caffeine in base forms is soluble in organic solvent. According to the chromophor in caffeine structure which is responsible to absorption of UV radiation energi, TLC-densitometry method is used as quantitative identification of caffeine contains. The purpose of this research is to determine the amount of caffeine in tea’s leaves ethanolic extract.
This research is a nonexperimental research because there is no treatment to the subject. The step of this research are consist of qualitative identification, a determination of caffeine by TLC, and then followed by quantitative identification by TLC-densitometry. The principle of this method is by measuring the density of sample chromatogram which is separated by TLC and compared to the density of standard chromatogram wich is eluted together.
The result of qualitative identification by TLC shows that tea’s leaves ethanolic extract contains caffeine with Rf 0,39 compared to caffeine standard with Rf 0,40. While quantitative identification by densitometry shows that the rate amount of caffeine in tea’s leaves ethanolic extract from Boyolali is (1,2439 ± 0,1039) % w/w.
xii
HALAMAN PERSETUJUAN PEMBIMBING ... iii
HALAMAN PENGESAHAN ... iv
HALAMAN PERSEMBAHAN ... v
PRAKATA ... vi
PERNYATAAN KEASLIAN KARYA ... ix
INTISARI ... x
ABSTRACT ... xi
DAFTAR ISI ... xii
DAFTAR TABEL ... xvi
DAFTAR GAMBAR ... xvii
DAFTAR LAMPIRAN ... xviii
BAB I. PENGANTAR ... 1
A. Latar Belakang ... 1
1. Perumusan masalah ... 2
2. Keaslian penelitian ... 3
3. Manfaat penelitian ... 3
B. Tujuan Penelitian ... 4
BAB II. TINJAUAN PUSTAKA ... 5
A. Teh ... 5
xiii
2. Deskripsi ... 5
3. Penggolongan ... 5
4. Kandungan kimia ... 6
5. Jalur biosintesis kafein ... 7
6. Penggunaan ... 9
B. Syarat Penanaman Teh ... 9
1. Curah hujan ... 9
2. Tinggi tempat ... 10
3. Tanah ... 10
C. Pembuatan Simplisia ... 10
1. Pengumpulan bahan baku ... 10
2. Sortasi basah ... 11
2. Pemilihan pelarut ... 14
3. Maserasi ... 14
4. Penguapan ... 16
E. Kromatografi Lapis Tipis (KLT) ... 16
F. Densitometri ... 19
xiv
2. Rancangan penelitian ... 21
B. Definisi Operasional ... 21
C. Alat dan Bahan ... 22
1. Alat penelitian ... 22
2. Bahan penelitian ... 22
D. Tata Cara Penelitian ... 22
1. Pengumpulan bahan ... 22
2. Determinasi tanaman ... 23
3. Pembuatan simplisia daun teh ... 23
4. Pembuatan serbuk daun teh ... 23
5. Pembuatan ekstrak etanolik daun teh ... 23
6. Identifikasi kafein secara kualitatif dengan KLT ... 24
7. Identifikasi kafein secara kuantitatif dengan KLT-densitometri . 24 E. Analisis Hasil ... 26
BAB IV.HASIL DAN PEMBAHASAN ... 27
A. Pengumpulan Bahan ... 27
B. Determinasi Tanaman ... 28
C. Sortasi Basah ... 28
D. Pencucian ... 28
xv
F. Sortasi Kering ... 30
G. Pembuatan Serbuk Daun ... 30
H. Pembuatan Ekstrak Etanolik Daun Teh ... 32
I. Identifikasi Kafein secara Kualitatif dengan KLT... 34
J. Identifikasi Kafein secara Kuantitatif dengan KLT-Densitometri ... 38
1. Penentuan panjang gelombang maksimum standar dan sampel .. 38
2. Pembuatan kurva baku ... 41
3. Penetapan kadar kafein sampel dengan KLT-Densitometri ... 42
BAB V. KESIMPULAN DAN SARAN ... 45
A. Kesimpulan ... 45
B. Saran ... 45
DAFTAR PUSTAKA ... 46
LAMPIRAN ... 49
xvi
Tabel II. Hasil KLT standar kafein dan sampel ... 36 Tabel III. Data pembuatan kurva baku kafein... 41 Tabel IV. Hasil pengukuran AUC dan kadar kafein pada kromatogram ekstrak
etanolik daun teh ... 43
xvii
DAFTAR GAMBAR
Gambar 1. Struktur kafein ... 7
Gambar 2. Jalur biosintesis kafein ... 8
Gambar 3. Ekstrak etanol cair ... 33
Gambar 4. Ekstrak kental daun teh ... 33
Gambar 5. Kromatogram ekstrak etanolik daun teh dan larutan standar kafein pada silika gel GF254 dengan deteksi lampu UV 254 nm ... 36
Gambar 6. Gugus kromofor dalam struktur kafein ... 37
Gambar 7. Kurva penelusuran panjang gelombang maksimum standar kafein dengan TLC densitometry scanner ... 39
Gambar 8. Kurva penelusuran panjang gelombang maksimum sampel dengan TLC densitometry scanner ... 40
xviii
Lampiran 2. Foto bahan dan alat penelitian ... 51
Lampiran 3. Data pengentalan ekstrak etanolik daun teh ... 52
Lampiran 4. Perhitungan perolehan ekstrak kental ... 53
Lampiran 5. Perhitungan rendemen ekstrak kental daun teh ... 54
Lampiran 6. Hasil pengukuran AUC standar kafein dengan TLC densitometry scanner pada panjang gelombang 274 nm ... 55
Lampiran 7. Hasil pengukuran AUC sampel dengan TLC densitometry scanner pada panjang gelombang 274 nm ... 60
1 BAB I PENGANTAR
A. Latar Belakang
Teh merupakan tanaman yang membutuhkan curah hujan yang tinggi dan suhu rendah. Daerah dataran tinggi menjadi daerah yang sesuai untuk penanaman tanaman teh. Salah satu daerah perkebunan teh di Jawa Tengah berada di Kabupaten Boyolali, tepatnya di Kecamatan Selo, yang terletak pada ketinggian 1.300-1.500 dpl (di atas permukaan laut).
Ketinggian suatu tempat akan mempengaruhi kadar dan efek kandungan kimia suatu tanaman. Berdasarkan penelitian Purnamasari (2009) yang berjudul Perbandingan Aktivitas Daya Antioksidan Infusa Teh Hijau (Camellia sinensis L.) dari Daerah Wonosobo dan Daerah Karanganyar dengan Menggunakan Metode Deoksiribosa, infusa teh hijau dari daerah Karanganyar dengan ketinggian 1.200 m dpl memiliki aktivitas penangkapan radikal hidroksil yang lebih besar (nilai ES50 rata-rata = 0,029 mg/ml) daripada infusa teh hijau daerah Wonosobo (nilai ES50 rata-rata = 0,032 mg/ml) dengan ketinggian 760 m dpl.
Proses ekstraksi dapat berlangsung dengan sempurna apabila digunakan cairan penyari yang sesuai. Kafein dalam daun teh berbentuk basa bebas sehingga dapat larut dalam pelarut organik. Salah satu pelarut organik yang dapat melarutkan kafein adalah etanol sehingga etanol digunakan sebagai cairan penyari.
Kafein memiliki gugus kromofor dalam strukturnya. Berdasarkan gugus kromofor dalam struktur kafein yang bertanggung jawab atas penyerapan energi radiasi sinar UV, maka untuk identifikasi kuantitatif kandungan kafein digunakan metode KLT-densitometri.
Pada penelitian ini akan dilakukan identifikasi kandungan kafein di dalam ekstrak daun teh hasil proses maserasi dengan cairan penyari etanol, baik secara kualitatif maupun kuantitatif. Identifikasi secara kualitatif akan dilakukan menggunakan Kromatografi Lapis Tipis (KLT), dengan membandingkan Rf dan warna kromatogram antara standar dan sampel. Sementara identifikasi secara kuantitatif dilakukan menggunakan TLC densitometry scanner, dengan membandingkan kerapatan antara kromatogram standar dan sampel yang dielusi bersama-sama dengan KLT.
Penelitian ini diharapkan dapat bermanfaat bagi industri farmasi maupun masyarakat dalam mengidentifikasi kandungan kafein dari daun teh dan dalam penggunaannya sebagai stimulan.
1. Perumusan masalah
3
2. Keaslian penelitian
Sejauh pengetahuan penulis penelitian mengenai identifikasi kandungan kafein ekstrak etanolik daun teh dengan metode KLT-densitometri belum pernah dilakukan. Penelitian yang sudah ada : Pengaruh Sari Daun Teh (Camellia sinensis L.) dan Herba Urang-Aring (Eclipta prostrata L.) Terhadap Pertumbuhan Rambut Kelinci Jantan serta Skrining Fitokimianya (Rangga, 1995), Uji Hepatoprotektif Infus Daun Teh (Camellia sinensis.(L.).O.K) pada Tikus Jantan Terangsang Parasetamol (Yuningsih, 1998), Penetapan Kadar Flavonoid Total Terhitung sebagai Kuersetin dengan Menggunakan Metode Kolorimetri dalam Teh Hijau dan Teh Hitam (Merk X) (Pertiwi, 2002), Uji Aktivitas Penangkapan Radikal Hidroksil oleh Ekstrak Etanol Daun Teh Hijau dan Teh Hitam dengan Metode Deoksiribosa (Kuntari, 2002), Perbandingan Daya Antioksidan Infusa Teh Hijau (Camellia sinensis L.) dari Daerah Wonosobo dan Daerah Karanganyar dengan Menggunakan Metode Deoksiribosa (Purnamasari, 2009).
3. Manfaat penelitian a. Manfaat teoritis
Penelitian ini diharapkan dapat memberikan informasi bagi ilmu pengetahuan mengenai kandungan kafein dalam ekstrak etanolik daun teh dengan metode KLT-densitometri.
b. Manfaat praktis
B. Tujuan Penelitian
5 BAB II
TINJAUAN PUSTAKA
A. Teh 1. Keterangan botani
Tanaman teh termasuk ke dalam famili Theaceae, suku Camellia, dan memiliki nama ilmiah Camellia sinensis L.. Nama umum atau dagang biasa disebut Tea (Inggris), Pu erh cha (Cina), Teh (Jawa). Nama daerah : Teh (Melayu), Nteh (Sunda), Teh (Jawa Tengah) (Hutapea, 1994).
2. Deskripsi
Teh merupakan tanaman perkebunan, dipanen secara manual, dan dapat tumbuh pada ketinggian 200-2.300 m dpl. Berdaun kecil, ujung agak tumpul, dan permukaannya mengkilap. Batang pohonnya tegak, berkayu, dan bercabang-cabang. Bunga di ketiak daun, berkelamin dua, berwarna putih cerah dengan kepala sari berwarna kuning. Buahnya kotak, berdinding tebal, berwarna hijau saat muda, dan berwarna cokelat kehitaman saat tua. Biji keras, berjumlah 1 – 3 (Arisandi, 2006).
3. Penggolongan
Ada 2 kelompok varietas teh yang terkenal, yaitu varietas assamica yang berasal dari Assam dan varietas sinensis yang berasal dari Cina. Varietas assamica daunnya agak besar dengan ujung yang runcing, sedangkan varietas sinensis daunnya lebih kecil dan ujungnya agak tumpul (Arisandi, 2006).
pengolahan tertentu. Secara umum berdasarkan proses pengolahannya, teh dapat diklasifikasikan menjadi tiga jenis, yaitu teh hijau, teh oolong, dan teh hitam. Teh hijau dibuat dengan cara menginaktivasi enzim oksidase/fenolase yang ada dalam pucuk daun teh segar, dengan cara pemanasan atau penguapan menggunakan uap panas, sehingga oksidasi enzimatik terhadap katekin dapat dicegah. Teh hitam dibuat dengan cara memanfaatkan terjadinya oksidasi enzimatis terhadap kandungan katekin teh. Sementara, teh oolong dihasilkan melalui proses pemanasan yang dilakukan segera setelah proses penggulungan daun, dengan tujuan untuk menghentikan proses fermentasi. Oleh karena itu, teh oolong disebut sebagai teh semi-fermentasi, yang memiliki karakteristik khusus dibandingkan teh hitam dan teh hijau (Hartoyo, 2003).
4. Kandungan kimia
Setiap 100 gram daun teh mengandung 7-80% air, polifenol 25%, protein 20%, karbohidrat 4%, kafein 2,5-4,5%, teofilin, teobromin, tanin, serat 27%, dan pektin 6%. Teh mengandung alkaloid purin, yaitu kafein mencapai 4%, serta sedikit teofilin dan teobromin (Arisandi, 2006).
Kafein secara alami di dalam tanaman terdapat dalam bentuk basa. Kafein bebas dalam bentuk basa tidak dapat larut dalam air, tetapi kafein dalam bentuk garam yang dihasilkan dari reaksi dengan asam dapat larut dalam air. Kafein bebas dalam bentuk basa larut dalam eter, kloroform atau pelarut organik lain, tetapi garam kafein tidak larut (Robbers, 1996).
7
bagian dari sistem siklik. Kafein dalam teh berfungsi sebagai stimulan susunan saraf pusat (Roberts, 1998).
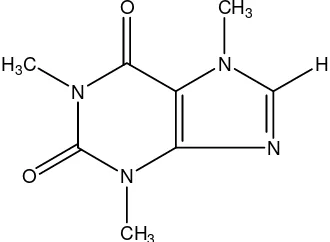
Kafein memiliki sinonim 1, 3, 7 – trimetil xantin dan memiliki rumus molekul C8H10N4O2. Pemerian kafein berupa serbuk putih atau bentuk jarum mengkilat putih, biasanya menggumpal, tidak berbau, rasa pahit, agak sukar larut dalam air, dalam etanol, mudah larut dalam kloroform, sukar larut dalam eter (Anonim, 1995). Sedangkan menurut Popl (1990), kafein dapat larut dalam etanol dan kloroform. Struktur kafein adalah sebagai berikut :
N
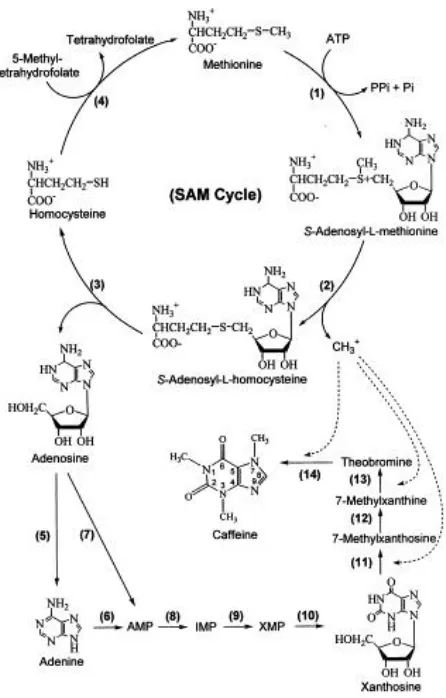
Gambar 1. Struktur kafein 5. Jalur biosintesis kafein
Gambar 2. Jalur biosintesis kafein
9
(Hiroshi, 1996).
6. Penggunaan
Teh terkenal memiliki efek antimikrobia, antimutagenik, dan antioksidan. Selain itu, teh hijau dapat menurunkan resiko kanker, menurunkan kadar kolesterol/lemak dalam tubuh, serta sebagai terapi diare dan muntah (Anonim, 2009).
Kandungan kafein dan teobromin dalam teh berfungsi untuk merangsang susunan saraf pusat dan aktivitas jantung, karena keduanya sama-sama memiliki efek stimulan. Sementara teofilin dapat menstimulasi kerja jantung dan melebarkan pembuluh darah koroner (Arisandi, 2006).
Sifat antioksidan yang dimiliki teh disebabkan oleh kandungan flavonoid, yang juga mampu memperkuat dinding sel darah merah dan mengurangi kecenderungan trombosis, serta menghambat oksidasi LDL sehingga mengurangi terjadinya proses aterosklerosis di pembuluh darah. Sedangkan sifat antimutagenik yang dimiliki teh disebabkan oleh tanin, yang mengandung epigallocatechin galat, yang mampu mencegah kanker lambung dan kerongkongan (Arisandi, 2006).
B. Syarat Penanaman Teh 1. Curah hujan
mm. Curah hujan yang kurang dari batas minimum akan mengakibatkan penurunan produksi, terutama di daerah yang relatif rendah letaknya (Setyamidjaja, 2000).
2. Tinggi tempat
Tanaman teh di Indonesia hanya ditanam di dataran tinggi. Penanaman teh dilakukan pada ketinggian 400 m - > 1.200 m dpl, sehingga daerah penanaman teh dapat dibagi menjadi 3 daerah berdasarkan ketinggian tempat, yaitu :
a. Daerah dataran rendah : 400 – 800 m dpl b. Daerah dataran sedang : 800 – 1.200 m dpl
c. Daerah dataran tinggi : di atas 1.200 m dpl (Setyamidjaja, 2000). 3. Tanah
Area penanaman teh dunia terdapat pada tanah dengan jenis yang berbeda-beda. Teh di India Utara ditanam pada tanah kuarter dan aluvial, di Sri Lanka dan India Selatan pada hasil pelapukan batuan archaen. Teh di pulau Jawa ditanam pada tanah hasil erupsi yang berasal dari pelapukan granit, gneis,batu pasir, dan deposit baru kegiatan vulkanis. Tipe tanah untuk tanaman teh di Indonesia dibedakan menjadi 2 jenis utama, yaitu tanah andosol (di pulau Jawa, pada ketinggian di atas 800 m dpl) dan tanah podsolik (di Sumatra) (Setyamidjaja, 2000).
C. Pembuatan Simplisia 1. Pengumpulan bahan baku
11
tergantung pada :
a. Umur tanaman yang dipanen. Umur tanaman yang dipanen berpengaruh pada kadar senyawa aktif. Apabila umur tanaman pada saat panen sama, maka mutu simplisia yang dihasilkan juga akan sama.
b. Lingkungan tempat tumbuh. Lingkungan tempat tumbuh yang berbeda dapat mengakibatkan perbedaan kadar kandungan senyawa aktif. Pertumbuhan tanaman dipengaruhi tinggi tempat, keadaan tanah, dan cuaca.
d. Waktu panen. Waktu panen sangat erat hubungannya dengan pembentukan senyawa aktif di dalam bagian tanaman yang akan dipanen. Waktu panen yang tepat adalah pada saat bagian tanaman tersebut mengandung senyawa aktif dalam jumlah yang terbesar. Panen dapat dilakukan dengan tangan, menggunakan alat atau mesin. Dalam hal ini ketrampilan pemetik diperlukan, agar diperoleh simplisia yang benar, tidak tercampur dengan bagian lain dan tidak merusak tanaman induk. Alat atau mesin yang digunakan untuk memetik perlu dipilih yang sesuai. Alat yang terbuat dari logam sebaiknya tidak digunakan bila diperkirakan akan merusak senyawa aktif simplisia seperti fenol, glikosida, dan sebagainya (Anonim, 1985).
2. Sortasi basah
itu pembersihan simplisia dari tanah yang terikut dapat mengurangi jumlah mikroba awal (Anonim, 1985).
3. Pencucian
Pencucian dilakukan untuk menghilangkan tanah dan pengotor lainnya yang melekat pada bahan simplisia. Pencucian dilakukan dengan air bersih, misalnya air dari mata air, air sumur atau air PAM. Bahan simplisia yang mengandung zat yang mudah larut dalam air yang mengalir, pencucian agar dilakukan dalam waktu yang sesingkat mungkin. Pencucian sayur-sayuran 1 kali dapat menghilangkan 25% dari jumlah mikroba awal. Jika dilakukan pencucian 3 kali, jumlah mikroba yang tertinggal hanya 42% dari jumlah mikroba awal. Pencucian tidak dapat membersihkan semua mikroba karena air pencucian yang digunakan biasanya mengandung sejumlah mikroba juga (Anonim, 1985).
4. Pengeringan
Tujuan pengeringan ialah untuk mendapatkan simplisia yang tidak mudah rusak, sehingga dapat disimpan dalam waktu yang lebih lama. Dengan mengurangi kadar air dan menghentikan reaksi enzimatik maka penurunan mutu atau perusakan simplisia dapat dicegah. Air yang masih tersisa dalam simplisia pada kadar tertentu dapat merupakan media pertumbuhan kapang dan jasad renik lainnya. Pengeringan simplisia dilakukan dengan menggunakan sinar matahari atau menggunakan suatu alat pengering. Hal-hal yang perlu diperhatikan selama proses pengeringan adalah suhu pengeringan, kelembaban udara, aliran udara, waktu pengeringan dan luas permukaan bahan.
13
pengeringannya. Bahan simplisia dapat dikeringkan pada suhu 30-90°C, tetapi suhu yang terbaik adalah tidak melebihi 60°C (Anonim, 1985).
5. Sortasi kering
Sortasi setelah pengeringan sebenarnya merupakan tahap akhir pembuatan simplisia. Tujuan sortasi untuk memisahkan benda-benda asing seperti bagian-bagian tanaman yang tidak diinginkan dan pengotor-pengotor lain yang masih ada dan tertinggal pada simplisia kering (Anonim, 1985).
D. Penyarian
Penyarian (ekstraksi) merupakan kegiatan penarikan zat yang dapat larut dari bahan yang tidak dapat larut dengan cairan penyari. Pada proses penyarian terjadi perpindahan masa zat aktif yang semula berada di dalam sel akan ditarik oleh cairan penyari. Hasil penyarian akan semakin baik apabila ukuran serbuk semakin halus, karena permukaan serbuk simplisia yang bersentuhan dengan cairan penyari semakin luas. Pertimbangan ini tidak selalu dapat dilaksanakan karena dengan semakin halus serbuk simplisia juga akan mengganggu proses penyarian. Hal ini dikarenakan serbuk yang terlalu halus dapat membentuk suspensi yang sulit dipisahkan dari hasil penyarian (Anonim, 1986).
1. Ekstrak
2. Pemilihan pelarut
Pelarut yang digunakan dalam proses ekstraksi harus memenuhi syarat berikut :
a. Memiliki selektivitas tinggi terhadap zat yang akan diekstraksi
b. Tidak bereaksi dengan zat yang akan diekstraksi dan dengan zat lain yang ada dalam tanaman
c. Murah
d. Tidak berbahaya bagi manusia dan lingkungan e. Mudah menguap
Alkohol alifatik, mulai dari 1 sampai 3 atom karbon, atau campuran antara alkohol dan air, merupakan pelarut yang sangat baik untuk proses ekstraksi semua kandungan kimia tanaman yang berbobot molekul rendah seperti alkaloid, saponin, dan flavonoid (Samuelsson, 1999).
3. Maserasi
15
Cairan penyari yang digunakan dapat berupa air, etanol, air-etanol atau pelarut lain. Keuntungan cara penyarian dengan maserasi adalah cara pengerjaan dan peralatan yang digunakan sederhana dan mudah diusahakan. Kerugian cara maserasi adalah pengerjaannya lama dan penyariannya kurang sempurna (Anonim, 1986).
Maserasi pada umumnya dilakukan dengan cara : 10 bagian simplisia dengan derajat halus yang cocok dimasukkan ke dalam bejana, kemudian dituangi dengan 75 bagian cairan penyari, ditutup dan dibiarkan selama 5 hari terlindung dari cahaya, sambil berulang-ulang diaduk. Setelah 5 hari, sari diambil, ampas diperas. Ampas ditambah cairan penyari secukupnya dan diaduk kembali sehingga diperoleh seluruh sari sebanyak 100 bagian. Bejana ditutup dibiarkan di tempat sejuk, terlindung dari cahaya, selama 2 hari. Kemudian endapan dipisahkan (Anonim, 1986).
Pada penyarian dengan cara maserasi, perlu dilakukan pengadukan. Pengadukan diperlukan untuk meratakan konsentrasi larutan di luar butir serbuk simplisia, sehingga dengan pengadukan tersebut tetap terjaga adanya derajat perbedaan konsentrasi yang sekecil-kecilnya antara larutan di dalam sel dengan larutan di luar sel. Maserasi dapat dilakukan modifikasi, misalnya maserasi dengan mesin pengaduk. Pengunaan mesin pengaduk yang berputar terus-menerus, waktu proses maserasi dapat dipersingkat menjadi 6 sampai 24 jam (Anonim, 1986).
diperlukan tetapi ikut terlarut dalam cairan penyari seperti malam dan lain-lain (Anonim, 1986).
4. Penguapan
Penguapan merupakan proses terbentuknya uap dari permukaan cairan. Kecepatan terbentuknya uap tergantung pada difusi uap melalui lapisan batas di atas cairan yang diuapkan. Kecepatan penguapan tergantung pada kecepatan pemindahan panas. Oleh karena itu luas permukaan penguapan harus seluas mungkin dan lapisan batas dikurangi (Anonim, 1986).
Ekstrak cair dapat diubah menjadi ekstrak kental dengan cara penguapan. Salah satu cara penguapan yang dapat dilakukan adalah dengan menggunakan penguap rotasi-hampa udara (Vacuum Rotary Evaporator). Penguapan akan berlangsung dalam waktu yang lebih singkat ketika luas permukaan penguapan semakin besar. Melalui pengaturan kedalaman pencelupan di dalam penangas air, suhu penangas, hampa udara dan suhu pendinginan, maka kondisi optimal dapat tercapai (Voigt, 1994).
E. Kromatografi Lapis Tipis (KLT)
17
Campuran yang akan dipisah, berupa larutan, ditotolkan berupa bercak atau pita. Setelah pelat atau lapisan ditaruh di dalam bejana tertutup rapat yang berisi fase gerak yang cocok, pemisahan terjadi selama pengembangan. Selanjutnya, senyawa yang tidak berwarna harus dideteksi (Stahl, 1985).
Fase diam yang umum ialah silika gel, aluminium oksida, kieselgur, selulosa dan turunannya, dan lain-lain. Panjang lapisan fase diam kurang lebih 200 mm dengan lebar 200 atau 100 mm. Sebelum digunakan, fase diam disimpan dalam lingkungan yang tidak lembab dan bebas dari uap laboratorium (Stahl, 1985).
Fase gerak adalah cairan pembawa yang terdiri atas satu atau beberapa pelarut. Fase gerak bergerak di dalam fase diam, yaitu suatu lapisan berpori, karena ada gaya kapiler. Sistem pelarut multikomponen ini harus berupa suatu campuran sesederhana mungkin yang terdiri atas maksimum tiga komponen (Stahl, 1985).
Bercak ditotolkan pada jarak 15 mm dari tepi bawah lapisan. Jarak suatu bercak awal, yang berukuran 3-5 mm, ke bercak awak lainnya dan jarak antara bercak paling pinggir dengan tepi samping sekurang-kurangnya 10 mm. Lapisan fase diam tidak boleh rusak selama penotolan cuplikan itu. Biasanya ditotolkan 1-10 µl larutan cuplikan 0,1-1%. Untuk menotolkan disarankan agar menggunakan mikropipet berujung runcing, khusus berskala 1 µl dan bervolume 10 µl (Stahl, 1985).
senyawa yang diketahui, dengan konsentrasi yang telah diketahui pula. Bila mungkin, senyawa pembanding ini sama dengan senyawa yang terdapat dalam larutan cuplikan (Stahl, 1985).
Terdapat berbagai kemungkinan untuk deteksi senyawa tak berwarna pada kromatogram. Deteksi paling sederhana adalah jika senyawa menunjukkan penyerapan di daerah UV 254 nm atau jika senyawa itu dapat dieksitasi ke fluoresensi radiasi UV 365 nm. Selain itu, senyawa juga dapat dideteksi dengan pereaksi semprot dan pemanasan (Stahl, 1985).
Identifikasi senyawa pada lempeng KLT dinyatakan dengan harga Rf. Angka ini diperoleh dengan membagi jarak yang ditempuh oleh totolan cuplikan dengan jarak yang ditempuh oleh pelarut. Keduanya diukur dari titik awal, dan harga Rf beragam mulai dari 0 sampai 1 (Gritter, 1985). Penilaian visual kromatogram diperoleh dengan pengamatan 2 bercak dengan harga Rf dan ukuran yang hampir sama (Anonim, 1979). Selain itu, beberapa sifat, misalnya fluorosensi atau pemadaman flurosensi, dan terutama warna hasil reaksi warna juga dapat dijadikan penilaian visual. Informasi mengenai identitas seringkali dapat juga diperoleh dengan membandingkan perubahan warna pada pemanasan, dan selanjutnya pada penyimpanan pelat (Stahl, 1985).
19
F. Densitometri
Densitometri merupakan salah satu metode analisa KLT kuantitatif. Metode ini dilakukan dengan cara mengukur kerapatan bercak senyawa uji yang dipisahkan, dibandingkan dengan kerapatan bercak senyawa standar yang dielusi bersama-sama. Syarat-syarat senyawa standar adalah murni, inert, dan stabil (Hardjono, 1983).
Alat densitometri mempunyai sumber sinar yang bergerak di atas bercak pemisahan pada lempeng kromatografi yang akan ditetapkan kadar komponennya. Lazimnya lempeng itu digerakkan menyusuri berkas sinar tersebut. Bercak yang kecil dan intensif akan menghasilkan suatu puncak kurva absorbsi yang sempit dan tajam, sebaliknya bercak yang lebar akan menghasilkan puncak kurva absorbsi yang melebar dan tumpul (Sudjadi, 1988).
Banyaknya sinar yang direfleksikan akan ditangkap oleh suatu alat yang disebut reflection photomultiplier yang akan diteruskan ke pencatat atau rekorder untuk diubah menjadi suatu puncak atau kromatogram. Luas puncak atau tinggi puncak sesuai dengan konsentrasi senyawa pada noda yang diukur kerapatannya (Mintarsih, 1990).
Penelusuran bercak akan mendapatkan hasil yang baik apabila dilakukan pada panjang gelombang maksimum, karena perubahan konsentrasi pada bercak sedikit saja sudah dapat terdeteksi. Pengukuran dilakukan dengan menelusuri bercak yang akan ditetapkan kadarnya pada kisaran panjang gelombang zat tersebut (Mintarsih, 1990).
yang diserap (absorbansi), intensitas sinar yang dipantulkan (reflaktansi) atau intensitas sinar yang diflurosensikan. Teknik pengukuran berdasarkan refleksi dimana sinar datang sebagian diserap dan sebagian lagi dipantulkan.
Ada dua cara penetapan kadar dengan alat densitometer. Pertama, setiap kali penetapan ditotolkan sediaan baku dari senyawa yang bersangkutan dan dielusi bersama dalam satu lempeng, kemudian AUC (luas daerah di bawah kurva) sampel dibandingkan dengan harga AUC zat baku. Yang kedua, dengan membuat kurva baku hubungan antara jumlah zat baku dengan AUC. Kurva baku diperoleh dengan membuat totolan zat baku pada pelat KLT dengan bermacam-macam konsentrasi (minimal 3 bermacam-macam konsentrasi). Bercak yang diperoleh dicari AUC nya dengan alat densitometer. Dari kurva baku diperoleh persamaan y = bx + a, dimana x adalah banyaknya zat yang ditotolkan dan y adalah AUC (Supardjan, 1987).
G. Keterangan Empiris
21 BAB III
METODOLOGI PENELITIAN
A. Jenis dan Rancangan Penelitian 1. Jenis penelitian
Penelitian ini merupakan jenis penelitian noneksperimental karena tidak ada perlakuan terhadap subyek uji.
2. Rancangan penelitian
Penelitian dilakukan melalui beberapa tahap yaitu : a. Pengumpulan bahan
b. Determinasi tanaman
c. Pembuatan simplisia daun teh d. Pembuatan serbuk daun teh
e. Pembuatan ekstrak etanolik daun teh
f. Identifikasi kafein secara kualitatif dengan KLT
g. Identifikasi kafein secara kuantitatif dengan KLT-densitometri
B. Definisi Operasional
1. Daun teh yang digunakan diambil pada pucuk daun nomor 1-4, berasal dari Kecamatan Selo, Boyolali, dan tidak mengalami proses fermentasi atau disebut juga teh hijau.
dikentalkan menggunakan Vaccum Rotary Evaporator yang dilanjutkan dengan oven hingga diperoleh ekstrak kental yang tidak dapat dituang.
3. Identifikasi kandungan kafein dalam ekstrak etanolik daun teh dilakukan secara kualitatif dengan metode KLT dan dilanjutkan secara kuantitatif menggunakan metode KLT-densitometri.
C. Alat dan Bahan 1. Alat penelitian
Alat-alat yang digunakan dalam penelitian ini adalah oven (Memmert), timbangan analitik (Mettler Toledo, Model AB-204), UV Cabinet, penangas air, alat-alat gelas (Pyrex), shaker (Innova 2100), Vaccum Rotary Evaporator (Janke & Kunkel Kika-Labortechnik, RV 05-ST), TLC Densitometry scanner (Camag TLC Scanner 3, seri no.160602).
2. Bahan penelitian
Bahan yang digunakan dalam penelitian ini adalah daun teh dari Kecamatan Selo, Boyolali. Bahan kimia yang digunakan meliputi etil asetat p.a (Merck), metanol p.a (Merck), plat fase diam silika gel GF254p.a (Merck). Bahan lainnya berupa kafein standar (Brataco), etanol 70% teknis, aquades, kertas saring, kloroform teknis, asam sulfat 1N, ammonia 6N, Na sulfat anhidrat.
D. Tata Cara Penelitian 1. Pengumpulan bahan
23
teh di Kecamatan Selo, Boyolali, Jawa Tengah dan diambil pada bulan Juni 2009.
2. Determinasi tanaman
Determinasi tanaman dilakukan dengan menggunakan acuan/pustaka Flora of Java (Backer dan Bakhuizen Van Den Brink, 1963) untuk memastikan kebenaran tanaman teh yang digunakan.
3. Pembuatan simplisia daun teh
Daun teh dibersihkan dari pengotor-pengotor seperti tanah, batang, semut, serta pengotor lainnya kemudian dicuci dengan air keran yang mengalir. Pencucian dilakukan sampai air bilasan tidak keruh lagi. Daun teh dikeringkan menggunakan oven pada suhu 45°C selama 2 hari. Pengeringan dihentikan sampai daun mudah dipatahkan. Daun teh yang telah kering dibersihkan lagi dari pengotor-pengotor yang masih tersisa.
4. Pembuatan serbuk daun teh
Daun yang telah kering diserbuk menggunakan blender sehingga dihasilkan serbuk kering daun teh. Serbuk daun kemudian diayak menggunakan pengayak dengan nomor mesh 12/50 (inchi).
5. Pembuatan ekstrak etanolik daun teh
hari hingga diperoleh ekstrak kental yang tidak dapat dituang.
6. Identifikasi kafein secara kualitatif dengan KLT a. Pembuatan larutan standar kafein
Sebanyak 0,01 g kafein dilarutkan dalam 10 ml kloroform-metanol (60:40). b. Pembuatan larutan sampel
Sebanyak 1 g ekstrak etanolik daun teh, ditambah 5 ml asam sulfat 1N, dipanaskan sampai mendidih selama 5 menit. Disaring dalam keadaan panas, didinginkan, kemudian dialkaliskan dengan 5 ml ammonia 6N dalam corong pisah dan diekstraksi dengan 5 ml kloroform. Larutan kloroform dipisahkan dan sisa-sisa air dihilangkan dengan sedikit Na-sulfat anhidrat, selanjutnya sari kloroform dipekatkan sampai 0,1 ml. Residu ditambah 1 ml kloroform-metanol (60:40).
c. Kromatografi lapis tipis
Larutan standar dan sampel ditotolkan sebanyak 5 µl, kemudian keduanya dielusi bersama-sama dengan fase gerak etil asetat:metanol:air (100:13,5:10) v
/v dalam 1 plat fase diam silika gel GF254p.a dengan deteksi UV 254 nm. 7. Identifikasi kafein secara kuantitatif dengan KLT-densitometri
a. Pembuatan larutan stok kafein
Timbang seksama 0,25 gram kafein, dilarutkan dalam kloroform-metanol (60:40) sampai volumenya tepat 25,0 ml.
b. Pembuatan larutan intermediet kafein
25
sampai volumenya tepat 10,0 ml sehingga diperoleh seri konsentrasi larutan baku 0,2; 0,4; 0,6; 0,8 dan 1 % b/v.
c. Pembuatan larutan sampel
Timbang seksama 1 g ekstrak etanolik daun teh, ditambah 5,0 ml asam sulfat 1N, dipanaskan sampai mendidih selama 5 menit. Disaring dalam keadaan panas, didinginkan, kemudian dialkaliskan dengan 5,0 ml ammonia 6N dalam corong pisah dan diekstraksi dengan 5,0 ml kloroform. Larutan kloroform dipisahkan dan sisa-sisa air dihilangkan dengan sedikit Na-sulfat anhidrat, selanjutnya sari kloroform dipekatkan sampai 0,1 ml. Residu ditambah 1 ml kloroform-metanol (60:40).
d. Kromatografi lapis tipis
Seri larutan baku dan larutan sampel ditotolkan sebanyak 5 µl. Keduanya dielusi bersama-sama dengan fase gerak etil asetat:metanol:air (100:13,5:10) v
/v dalam 1 plat fase diam silika gel GF254.
e. Penentuan panjang gelombang maksimum standar dan sampel
Seri larutan baku dengan konsentrasi 0,2; 0,4; 0,6; 0,8 dan 1 % b/v serta larutan sampel diukur serapan maksimumnya pada panjang gelombang 200 – 380 nm. Panjang gelombang maksimum standar dan sampel diperoleh pada saat terjadi puncak kurva.
f. Pembuatan kurva baku
persamaan regresi linier.
g. Penetapan kadar kafein dalam sampel
Kromatogram sampel diukur AUC nya pada panjang gelombang standar dan ditetapkan kadarnya menggunakan persamaan regresi linier yang diperoleh yaitu y = b x + a, dimana y adalah AUC, b adalah slope, a adalah koefisien regresi, dan x adalah konsentrasi xat yang ditotolkan.
E. Analisis Hasil
27 BAB IV
HASIL DAN PEMBAHASAN
A. Pengumpulan Bahan
Daun tanaman teh segar diperoleh dari Kecamatan Selo, Kabupaten Boyolali, Jawa Tengah, yang berada di antara gunung Merapi dan Merbabu dengan ketinggian 1.300-1.500 m dpl dengan curah hujan 3.222 mm per tahun. Menurut Setyamidjaja (2000), penanaman teh pada daerah dataran tinggi terletak pada ketinggian lebih dari 1.200 m dpl (suhu mencapai 18°-19°C) dengan curah hujan 2.000-2.500 mm.
Semakin tinggi daerah penanaman teh maka suhu udara menjadi semakin rendah. Hal ini diperlukan bagi tanaman teh karena tanaman ini dapat tumbuh dengan baik pada suhu udara yang sejuk. Menurut Setyamidjaja (2000), suhu udara yang baik bagi tanaman teh berkisar antara 13°-25°C. Selain itu, daerah ini memiliki curah hujan yang tinggi yang sesuai untuk penanaman teh. Tanaman teh tidak tahan terhadap kekeringan sehingga memerlukan daerah penanaman dengan curah hujan yang cukup tinggi dan merata sepanjang tahun.
dihasilkan dengan optimal. Daun teh yang dipetik adalah pucuk daun nomor 1-4 dihitung dari pucuk ranting.
B. Determinasi Tanaman
Determinasi tanaman berguna untuk memastikan apakah tanaman yang digunakan sesuai dengan yang dimaksud dalam penelitian. Determinasi dilakukan di Laboratorium Farmakognosi Fitokimia, Fakultas Farmasi, Universitas Sanata Dharma Yogyakarta dengan menggunakan kunci determinasi yang terdapat dalam buku Flora of Java (Backer dan R.C. Bakhuizen Van Den Brink Jr, 1963). Berdasarkan hasil determinasi, tanaman yang digunakan benar-benar tanaman teh dengan nama ilmiah Camellia sinensis L. (Lampiran 1.).
C. Sortasi Basah
Daun teh harus melewati tahap sortasi basah sebelum dicuci, yaitu daun teh dibersihkan terlebih dahulu dari bahan-bahan asing seperti tanah, batang, rumput, semut, serta pengotor lainnya. Hal ini dikarenakan tanah merupakan sumber mikroba yang potensial (Anonim, 1985). Tujuan tahap sortasi ini antara lain untuk memisahkan daun yang baik dan tidak cacat, serta memisahkan daun yang masih baik dengan daun yang rusak akibat kesalahan panen atau serangan patogen, serta kotoran berupa bahan asing yang mencemari tanaman.
D. Pencucian
29
dilakukan dengan merendam daun di dalam wadah berisi air maka mikroba dan kotoran yang menempel pada daun akan tetap menempel pada daun. Cemaran mikroba pada daun dapat mempengaruhi kandungan kimia yang dihasilkan. Menurut Anonim (1985), pencucian dilakukan dengan air bersih, misalnya air dari mata air, air sumur atau air PAM. Tujuan pencucian ini adalah untuk menghilangkan kotoran-kotoran dan mengurangi mikroba yang melekat pada daun. Penggunaan air yang kotor akan menyebabkan jumlah mikroba pada daun tidak akan berkurang bahkan akan bertambah. Pencucian dilakukan sampai air cucian/bilasan terlihat bersih dan dalam waktu yang sesingkat mungkin untuk menghindari larut dan terbuangnya zat yang terkandung dalam daun.
E. Pengeringan
Tujuan pengeringan ini adalah untuk meminimalkan kandungan air daun teh sehingga dapat mengurangi resiko pertumbuhan jamur selama penyimpanan. Proses pengeringan ini dapat mengurangi kandungan air dalam daun teh.
yang sama dan kering secara merata. Pengeringan dianggap sudah berakhir apabila daun sudah dapat dipatahkan dengan mudah.
Cara pengeringan lain adalah dengan penjemuran daun di bawah sinar matahari, namun cara ini membutuhkan waktu yang lama, yaitu lebih dari 1 minggu, sehingga cara pengeringan menggunakan oven lebih dipilih, selain karena waktu pengeringan lebih singkat, suhu pengeringan juga dapat dikendalikan.
F. Sortasi Kering
Daun teh yang telah kering melewati tahap sortasi lagi, yaitu sortasi kering, yang merupakan tahap akhir pembuatan simplisia. Tujuan sortasi kering ini adalah untuk memisahkan benda-benda asing seperti bagian tanaman yang tidak diinginkan dan pengotor lain yang masih tertinggal pada daun yang telah kering. Adanya pengotor lain misalnya batang akan mempengaruhi kandungan kimia daun karena kandungan kimia yang akan diambil menjadi tidak murni berasal dari daun tetapi mungkin juga berasal dari batang.
G. Pembuatan Serbuk Daun
31
banyak tersari.
Dalam pembuatan simplisia diperlukan suatu aturan derajat halus serbuk. Secara umum, semakin kecil ukuran serbuk daun maka luas permukaannya akan semakin besar. Namun apabila ukuran serbuk terlalu kecil justru akan menyulitkan saat proses penyarian karena ukuran partikel serbuk yang terlalu kecil akan meningkatkan gaya kohesi antar partikel serbuk sehingga serbuk cenderung menggumpal dan tersuspensi sehingga sulit untuk diekstraksi.
Menurut Anonim (1977), kecuali dinyatakan lain, seluruh simplisia harus dihaluskan menjadi serbuk dengan derajat halus 4/18. Derajat halus dinyatakan dengan nomor pengayak, yang dinyatakan dengan 2 nomor. Nomor pengayak 4/18 (cm) memiliki pengertian semua serbuk dapat melewati pengayak dengan nomor 4 dan tidak lebih dari 40% melewati pengayak dengan nomor 18. Penentuan jenis ayakan, yang dinyatakan dengan nomor mesh, dilakukan melalui konversi angka derajat halus yaitu mengalikan 4/18 dengan 2,54 (1 inchi). Hasil konversi menunjukkan nomor mesh yang digunakan adalah 10/45 (inchi), namun karena keterbatasan alat maka digunakan pengayak dengan nomor mesh 12/50 (inchi). Penggunaan pengayak yang berbeda ini tidak berpengaruh terhadap hasil penyarian. Serbuk yang diambil adalah serbuk yang dapat melewati pengayak dengan nomor mesh 12 dan yang tidak lebih dari 40% melewati pengayak dengan nomor mesh 50.
maserasi juga akan semakin besar. Dengan demikian, kandungan kimia daun yang tersari juga akan lebih banyak.
H. Pembuatan Ekstrak Etanolik Daun Teh
Penyarian serbuk daun dilakukan dengan proses maserasi. Proses penyarian ini dipilih karena sederhana dan mudah dilakukan. Menurut Popl (1990), kafein dapat larut dalam etanol dan kloroform. Etanol 70% dipilih sebagai pelarut karena daun teh mengandung kafein dalam bentuk basa bebas yang dapat larut dalam pelarut organik sehingga kombinasi etanol dan air diharapkan dapat melarutkan kafein yang bersifat semi polar. Pada proses maserasi, penyarian dilakukan selama 3 hari berturut-turut agar kandungan kimia dapat tersari secara optimal.
33
Gambar 3. Ekstrak etanol cair
Ekstrak hasil proses maserasi berupa ekstrak etanol cair yang mudah dituang, yang selanjutnya dipekatkan menggunakan Vaccum Rotary Evaporator hingga volume ekstrak tinggal seperempat volume awal. Pada proses penguapan menggunakan Vaccum Rotary Evaporator, penguapan pelarut menjadi lebih cepat karena tekanan vakum yang dapat diatur sesuai dengan tekanan dimana pelarut menguap. Tekanan diatur pada 175 mbar untuk menguapkan etanol 70%, kemudian setelah seluruh etanol menguap, tekanan diubah menjadi 72 mbar untuk menguapkan air. Selain itu, suhu juga diatur dan dijaga pada suhu 50° C untuk menjaga stabilitas kandungan kimia. Apabila suhu terlalu tinggi kemungkinan kandungan kimia di dalam daun teh akan rusak. Pemekatan dilakukan sampai didapatkan ekstrak yang sukar dituang.
Gambar 4. Ekstrak kental daun teh
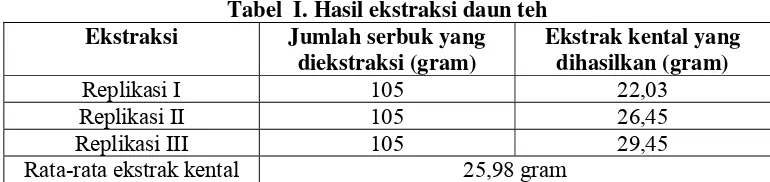
Tabel I. Hasil ekstraksi daun teh Ekstraksi Jumlah serbuk yang
diekstraksi (gram)
Rata-rata ekstrak kental 25,98 gram
Proses ekstraksi dilakukan 3 kali replikasi menggunakan bahan serbuk daun teh sebanyak 105 gram. Berdasarkan hasil ekstraksi diperoleh ekstrak kental daun teh yang tidak dapat dituang dan beraroma khas sebanyak 22,03; 26,45; dan 29,45 gram sehingga diperoleh rata-rata ekstrak kental yang dihasilkan sebanyak 25,98 gram.
I. Identifikasi Kafein secara Kualitatif dengan KLT
35
Sedangkan F pada F254 berarti fosforesensi, menunjukkan adanya indikator fosforesensi anorganik sehingga pada panjang gelombang 254 nm fase diam ini akan berfosforesensi (Jork, 1990). Fase gerak yang digunakan adalah etil asetat:metanol:air (100:13,5:10) v/v karena merupakan fase gerak yang sesuai untuk identifikasi alkaloid (Anonim, 1987). Selain itu, fase gerak ini bersifat semipolar, sehingga diharapkan kandungan kafein yang bersifat semipolar dapat ikut terelusi oleh fase gerak.
Standar yang digunakan adalah kafein murni karena syarat suatu standar adalah murni atau tunggal, yaitu hanya mengandung 1 jenis senyawa saja serta strukturnya sama atau mirip dengan senyawa yang diuji. Deteksi yang digunakan adalah UV 254 nm yang merupakan metode deteksi fisik.
Plat fase diam harus diaktifkan terlebih dahulu sebelum penotolan, dengan cara dipanaskan menggunakan oven pada suhu 110-120° C selama 30 menit (Sethi, 1996). Proses ini bertujuan untuk mengurangi kandungan air pada fase diam yang disebabkan oleh proses penyimpanan.
sulfat anhidrat untuk menghilangkan sisa-sisa air. Fase kloroform tersebut dipekatkan hingga 0,1 ml dan ditambah kloroform:metanol (60:40), kemudian ditotolkan pada plat fase diam.
Tabel II. Hasil KLT standar kafein dan sampel
Larutan Rf Deteksi
UV 254 nm Standar kafein 0,40 Ungu Sampel replikasi I 0,39 Ungu Sampel replikasi II 0,39 Ungu Sampel replikasi III 0,39 Ungu
Hasil pengembangan menunjukkan bahwa pada standar hanya muncul 1 kromatogram saja dengan Rf 0,40 dan pada masing-masing replikasi sampel juga hanya muncul 1 kromatogram saja dengan Rf 0,39. Hasil pengembangan ini menunjukkan kemiripan Rf antara standar (Rf 0,40) dan sampel (Rf 0,39).
Gambar 5. Kromatogram ekstrak etanolik daun teh dan larutan standar kafein pada silika gel GF254 dengan deteksi lampu UV 254 nm
37
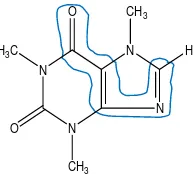
Metode deteksi fisik yang digunakan adalah lampu UV 254 nm karena dalam strukturnya kafein memiliki gugus kromofor yang bertanggung jawab atas penyerapan energi radiasi sinar UV.
N
Gambar 6. Gugus kromofor dalam struktur kafein
Pendaran yang dihasilkan antara standar dan sampel menunjukkan kesamaan. Dengan demikian, sampel diduga mengandung kafein. Pada deteksi ini, fase diam mengalami fosforesensi pada panjang gelombang UV 254 nm sedangkan kromatogram standar dan sampel berpendar ungu karena kafein memiliki struktur yang rigid.
gelombang 254 nm. Selisih antara keduanya tidak terlalu jauh sehingga pada deteksi dengan lampu UV 254 nm kromatogram standar dan sampel berpendar ungu. Metode deteksi ini sudah cukup sensitif untuk identifikasi kualitatif kafein. Berdasarkan hasil deteksi dengan lampu UV 254 nm serta dilihat dari perbandingan Rf dan kromatogram antara standar dan sampel, dapat dikatakan bahwa sampel mengandung kafein.
J. Identifikasi Kafein secara Kuantitatif dengan KLT-Densitometri Hasil identifikasi kualitatif dengan KLT menunjukkan bahwa sampel mengandung kafein, selanjutnya dilakukan identifikasi secara kuantitatif menggunakan TLC densitometry scanner. Alat ini menggunakan prinsip densitometri, dimana kerapatan kromatogram senyawa uji yang dipisahkan diukur dan dibandingkan dengan kerapatan kromatogram senyawa standar yang dielusi bersama-sama (Hardjono, 1983). Metode KLT-densitometri ini dipilih karena kafein memiliki gugus kromofor yang bertanggung jawab atas penyerapan energi radiasi sinar UV. Sumber radiasi yang digunakan pada penelusuran kafein adalah lampu deuterium atau D2 karena lampu ini menghasilkan radiasi pada panjang gelombang 160-380 nm.
1. Penentuan panjang gelombang maksimum standar dan sampel
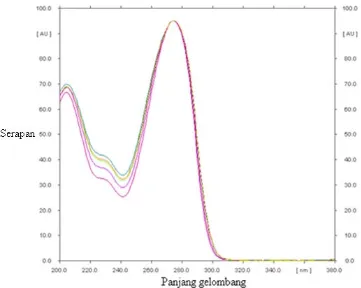
39
pada bercak sedikit saja sudah dapat terdeteksi (Mintarsih,1990). Panjang gelombang maksimum standar dicapai saat terjadi serapan maksimum yang ditunjukkan oleh puncak kurva. Penelusuran panjang gelombang maksimum dilakukan pada standar kafein.
Gambar 7. Kurva penelusuran panjang gelombang maksimum standar kafein dengan TLC densitometry scanner
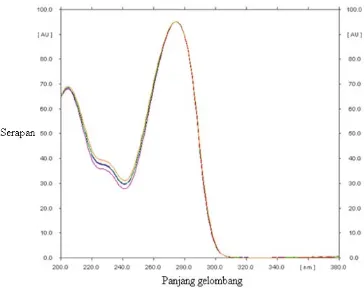
nm dapat digunakan selanjutnya untuk pengukuran AUC standar maupun sampel, kemudian dilakukan penelusuran panjang gelombang maksimum sampel pada panjang gelombang 200-380 nm untuk memastikan bahwa senyawa yang terkandung dalam sampel adalah kafein.
Gambar 8. Kurva penelusuran panjang gelombang maksimum sampel dengan TLC densitometry scanner
41
2. Pembuatan kurva baku
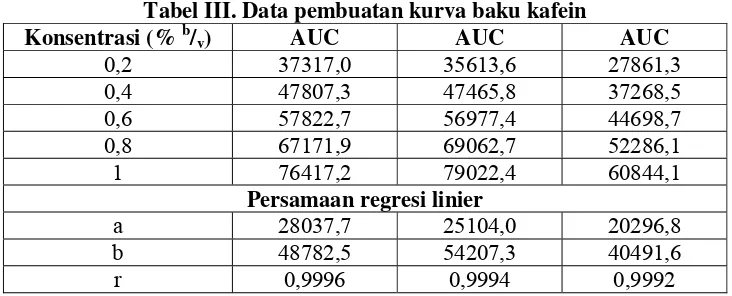
Digunakan 5 seri standar dengan konsentrasi yang berbeda-beda, yaitu 0,2; 0,4; 0,6; 0,8; dan 1% b/v. Tujuan pembuatan kurva baku ini adalah untuk mendapatkan persamaan regresi linier yang selanjutnya digunakan untuk menghitung kadar kafein dalam ekstrak etanolik daun teh. Pembuatan kurva baku dilakukan untuk mencari persamaan regresi linier dengan nilai r terbesar, yang paling mendekati 1. Lima seri standar tersebut dielusi menggunakan fase gerak dan fase diam yang sama dengan identifikasi kualitatif, dan dilakukan pengukuran AUC 5 seri standar pada panjang gelombang 274 nm dengan TLC densitometry scanner sehingga didapatkan data kurva baku berupa luas area di bawah kurva atau AUC. Berdasarkan pengukuran tersebut, didapat hasil sebagai berikut :
Tabel III. Data pembuatan kurva baku kafein
Konsentrasi (% b/v) AUC AUC AUC
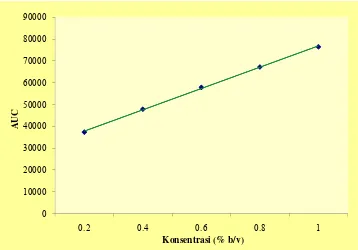
Gambar 9. Kurva hubungan konsentrasi dengan AUC pada kurva baku kafein dengan persamaan regresi linier y = 48782,5 x + 28037,7
Berdasarkan kurva hubungan antara konsentrasi dan AUC, dapat dilihat korelasi yang baik antara konsentrasi dan AUC dengan garisnya yang linier dimana konsentrasi yang semakin meningkat akan menyebabkan AUC juga meningkat sehingga persamaan garis yang diperoleh dapat digunakan untuk menghitung kadar kafein dalam ekstrak etanolik daun teh.
3. Penetapan kadar kafein sampel dengan KLT-Densitometri
Digunakan sampel dengan 4 kali replikasi dengan konsentrasi awal 0,2 g/ml. Empat replikasi sampel tersebut dielusi menggunakan fase gerak dan fase diam yang sama dengan analisa kualitatif, dan dilakukan pengukuran AUC pada panjang gelombang 274 nm dengan Camag densitometer sehingga didapatkan data berupa luas area di bawah kurva atau AUC. Berdasarkan pengukuran tersebut, didapat hasil sebagai berikut :
43
Tabel IV. Hasil pengukuran AUC dan kadar kafein pada kromatogram ekstrak etanolik daun teh
Replikasi AUC Kadar (% b/v) Kadar (% b/b)
Kadar diperoleh dengan memasukkan nilai AUC sampel ke dalam y pada persamaan regresi linier yang telah dipilih sehingga didapatkan nilai x yaitu kadar kafein dalam sampel. Kadar kafein dari ekstrak etanolik daun teh yang diperoleh berdasarkan perhitungan adalah (1,2439 ± 0,1039) % b/b. Berdasarkan analisis hasil secara kuantitatif tersebut dapat diketahui bahwa di dalam setiap 100 gram serbuk daun teh dengan larutan pengekstraksi etanol 70% rata-rata terdapat 1,2439 gram kafein.
erupsi dan lelehan lahar gunung berapi, sedangkan jenis tanah di Kecamatan Selo, Boyolali adalah kombinasi tanah jenis andosol dan latosol, dimana tanah jenis
45 BAB V
KESIMPULAN DAN SARAN
A. Kesimpulan
Ekstrak etanolik daun teh yang berasal dari daerah Boyolali mengandung kafein sebesar (1,2439 ± 0,1039) % b/b dengan metode KLT-densitometri.
B. Saran
DAFTAR PUSTAKA
Anonim, 1977, Materia Medika, Jilid I, xx, Departemen Kesehatan Republik Indonesia, Jakarta.
Anonim, 1979, Farmakope Indonesia III, 782, Departemen Kesehatan Republik Indonesia, Jakarta.
Anonim, 1985, Cara Pembuatan Simplisia, 4, 7, 10, Departemen Kesehatan Republik Indonesia, Jakarta.
Anonim, 1986, Sediaan Galenik, 8, 25, 32, Departemen Kesehatan Republik Indonesia, Jakarta.
Anonim, 1987, Analisis Obat Tradisional, Jilid 1, 58, 60, Dirjen POM, Jakarta. Anonim, 1995, Farmakope Indonesia IV, 7, 254, Departemen Kesehatan Republik
Indonesia, Jakarta.
Anonim, 2001, Herbal Drugs and Phytopharmaceuticals, Edisi 2, 491, CRC Press, America.
Anonim, 2009, http://www.farsinet.com/hottea/greenblacktea.html, diakses tanggal 8 Desember 2009.
Arisandi, 2006, Khasiat Berbagai Tanaman Untuk Pengobatan, 457, Eska Media, Jakarta.
Anonim, 2007, Pemastian Mutu Obat : Kompendium Pedoman dan Bahan-bahan Terkait, GMP dan Inspeksi, diterjemahkan oleh Fabiola C.R. Hutabarat, S.Si., Apt., Volume 2, Penerbit EGC, Jakarta.
Backer, C.A. dan R.C. Bakhuizen Van Den Brink Jr, 1963, Flora of Java, Vol.1, 3-6, 29-34, 47, 318-320, N.V.P., Noordhoff, Groningen, The Netherlands.
Bruneton, J., 1999, Pharmacognosy Phytochemistry Medicinal Plants, 2nd edition, 371, Lavoisier Publishing, Perancis.
Gritter, R.J., 1985, Introduction to Chromatography, diterjemahkan oleh Kosasih Padmawinata, Edisi II, 6, 8, 107, ITB, Bandung.
47
Hartoyo, A., 2003, Teh & Khasiatnya bagi Kesehatan, Sebuah Tinjauan Ilmiah, 11, Penerbit Kanisius, Yogyakarta.
Hiroshi, A., 1996, Biosynthesis of Caffeine in Leaves of Coffee, www.ncbi.nlm.nih.gov, diakses tanggal 3 Februari 2010.
Hutapea, J.R., 1994, Inventaris Tanaman Obat Indonesia, Jilid 3, 155, Depkes RI, Jakarta.
Jork, H., 1990, Thin-Layer Chromatography Reagents and Detection Methods, 12, VCH, New York.
Kuntari, C., 2002, Uji Aktivitas Penangkapan Radikal Hidroksil oleh Ekstrak Etanol Daun Teh hijau dan Teh Hitam dengan Metode Deoksiribosa, Skripsi, Fakultas Farmasi Universitas Sanata Dharma, Yogyakarta.
Lin, Y.L., 1996, Composition of Polyphenols in Fresh Tea Leaves and Associations of Their Oxygen-Radical-Absorbing Capacity with Antiproliferative Actions in Fibroblast Cells, http://www.pubs.acs.org, diakses tanggal 3 Februari 2009.
Mintarsih, E.R.R., 1990, Penetapan Kadar Alkaloid Kinina dalam Akar, Batang, dan Daun Chinchona Succirubra Pavon et Klotzsch dari Daerah Kaliurang secara Spektrodensitometri (TLC-scanner), Skripsi, Fakultas Farmasi Universitas Gajah Mada, Yogyakarta.
Pertiwi, M.V., 2002, Penetapan Kadar Flavonoid Total Terhitung sebagai Kuersetin dengan Menggunakan Metode Kolorimetri dalam Teh Hijau dan Teh Hitam (Merk X), Skripsi, Fakultas Farmasi Universitas Sanata Dharma, Yogyakarta.
Purnamasari, G., 2009, Perbandingan Daya Antioksidan Infusa Teh Hijau (Camellia sinensis L.) dari Daerah Wonosobo dan Daerah Karanganyar dengan Menggunakan Metode Deoksiribosa, Skripsi, Fakultas Farmasi Universitas Sanata Dharma, Yogyakarta.
Popl, M., 1990, Chromatographic Analysis of Alkaloids, 43, Marcel Dekker Inc., New York.
Rangga, H.C.S., 1995, Pengaruh Sari Daun Teh (Camellia sinensis L.) dan Herba Urang-Aring (Eclipta prostrata L.) Terhadap Pertumbuhan Rambut Kelinci Jantan serta Skrining Fitokimianya, Skripsi, Fakultas Farmasi Universitas Sanata Dharma, Yogyakarta.
Roberts, M.F., 1998, Alkaloids Biochemistry, Ecology, and Medicinal Applications, 23, Plenum Press, New York.
Samuelsson, G., 1999, Drugs of Natural Origin, a Text Book of Pharmacognosy, 47, Swedish Pharmaceutical Press, Stockholm.
Sethi, P.H., 1996, High Performance Thin Layer Chromatography Quantitative Analysis of Pharmaceutical Formulations, 40, CBS Publishers, New Delhi.
Setyamidjaja, D., 2000, Teh Budidaya dan Pengolahan Pasca Panen, 22-25, Penerbit Kanisius, Yogyakarta.
Stahl, E., 1985, Analisis Obat Secara Kromatografi dan Mikroskopi, 3-17, Penerbit ITB, Bandung.
Sudjadi, 1988, Metode Pemisahan, 75, Penerbit Kanisius, Yogyakarta.
Supardjan, A. M., 1987, Pemisahan Tetrasiklin dan Hasil Pemisahannya dalam Sediaan Tetrasiklin secara KLT-densitometri, Lembaga Penelitian Universitas Gajah Mada, Yogyakarta.
Voigt, 1994, Buku Pelajaran Teknologi Farmasi, Edisi 5, 579-582 Gadjah Mada University Press, Yogyakarta.
49
LAMPIRAN
Hasil determinasi tanaman teh sebagai berikut :
1b-2b-3b-4b-12b-13b-14b-17b-18b-19b-20b-21b-22b-23b-24b-25b-26b-27b-28b- 29b-30b-31b-403b-404b-405b-414a-415b-451b-466b-467b-468b-469b-470f-617b-618c-619b-620b-621b-622b-623a-624b-625a Familia 625. Theaceae -1a-2b-Genus 1. Camellia -1a-2b – Spesies Camellia sinensis L.
51
Lampiran 2. Foto bahan dan alat penelitian
(a) (b)
(c) (d)
(e) (f)
(g) (h) Keterangan :
(a) : Tanaman teh dari perkebunan di Boyolali, Jawa Tengah (b) : Daun teh
(c) : Timbangan analitik (Mettler Toledo, Model AB-204)
(d) : Vaccum Rotary Evaporator (Janke & Kunkel Kika-Labortechnik, RV 05- ST)
(e) : Shaker (Innova 2100) (f) : Oven (Memmert) (g) : UV Cabinet
Lampiran 3. Data pengentalan ekstrak etanolik daun teh
Vaccum Rotary Evaporator Ekstrak Daun Teh (Camellia sinensis L.)
∆p (%) 50
Suhu (° C) 50
∆p (mbar) 10
Volume awal (ml) 500
Tekanan (mbar) 175 dan 72
Waktu 1 jam 30 menit
Oven
Suhu (° C) 45
53
Lampiran 4. Perhitungan perolehan ekstrak kental
Hasil Ekstrak
Kental Replikasi I Replikasi II Replikasi III Berat serbuk awal
(g) 105 105 105
Berat cawan
kosong (g) 61,57 78,74 74,48
Berat cawan +
ekstrak kental (g) 83,60 105,19 103,93
Berat ekstrak
kental (g) 22,03 26,45 29,45
Rata-rata ekstrak
Lampiran 5. Perhitungan rendemen ekstrak kental daun teh
Replikasi I
Berat bahan kering = 105 gram Berat ekstrak kental = 22,03 gram
Rendemen ekstrak kental = 105
Rendemen ekstrak kental = 105
Rendemen ekstrak kental = 150
45 , 29
55
65
Lampiran 8. Perhitungan kadar kafein dalam sampel Persamaan kurva baku : y = 48782,5 x + 28037,7 1. Untuk y = 39019,1
39019,1 = 48782,5 x + 28037,7 39019,1– 28037,7 = 48782,5 x
10981,4 = 48782,5 x 0,2251 = x
x = 0,2251% b/v = 0,2251g/100 ml = 0,002251 g/ml Jumlah yang ditotolkan = 5 µl
Berat kafein dalam 5 µl = 0,002251 g/ml x 0,005 ml = 1,1255 x 10-5 g
Penimbangan sampel
Berat cawan kaca = 17,3173 g Berat cawan kaca + ekstrak = 18,3197 g Berat ekstrak = 1,0024 g
Berat kafein dalam 5 ml = ,
, x 5 ml = 0,0113 g
Berat kafein dalam 25,98 g ekstrak = ,
, x 25,98 g = 0,2929 g
Berat kafein dalam 105 g serbuk = ,
, x 105 g = 1,1838 g
2. Untuk y = 39062,0
39062,0 = 48782,5 x + 28037,7 39062,0 – 28037,7 = 48782,5 x
11024,3 = 48782,5 x 0,2260 = x
x = 0,2260 % b/v = 0,2260 g/100 ml = 0,002260 g/ml Jumlah yang ditotolkan = 5 µl
Berat kafein dalam 5 µl = 0,002260 g/ml x 0,005 ml = 1,1300 x 10-5 g Penimbangan sampel
Berat cawan kaca = 17,3170 g Berat cawan kaca + ekstrak = 18,3196 g Berat ekstrak = 1,0026 g
Berat kafein dalam 5 ml = ,
, x 5 ml = 0,0113 g
Berat kafein dalam 25,98 g ekstrak = ,
, x 25,98 g = 0,2928 g
Berat kafein dalam 105 g serbuk = ,
, x 105 g = 1,1834 g
67
3. Untuk y = 39436,0
39436,0 = 48782,5 x + 28037,7 39436,0 – 28037,7 = 48782,5 x
11398,3 = 48782,5 x 0,2337 = x
x = 0,2337% b/v = 0,2337 g/100 ml = 0,002337 g/ml Jumlah yang ditotolkan = 5 µl
Berat kafein dalam 5 µl = 0,002337 g/ml x 0,005 ml = 1,1685 x 10-5 g
Penimbangan sampel
Berat cawan kaca = 17,3174 g Berat cawan kaca + ekstrak = 18,3202 g Berat ekstrak = 1,0028 g
Berat kafein dalam 5 ml = ,
, x 5 ml = 0,0117 g
Berat kafein dalam 25,98 g ekstrak = ,
, x 25,98 g = 0,3031 g
Berat kafein dalam 105 g serbuk = ,
, x 105 g = 1,2250 g
4. Untuk y = 43283,1
43283,1 = 48782,5 x + 28037,7 43283,1 – 28037,7 = 48782,5 x
15245,4 = 48782,5 x 0,3125 = x
x = 0,3125 % b/v = 0,3125 g/100 ml = 0,003125 g/ml Jumlah yang ditotolkan = 5 µl
Berat kafein dalam 5 µl = 0,003125 g/ml x 0,005 ml = 1,5625 x 10-5 g
Penimbangan sampel
Berat cawan kaca = 17,3174 g Berat cawan kaca + ekstrak = 18,3212 g Berat ekstrak = 1,0038 g
Berat kafein dalam 5 ml = ,
, x 5 ml = 0,0156 g
Berat kafein dalam 25,98 g ekstrak = ,
, x 25,98 g = 0,4038 g
Berat kafein dalam 105 g serbuk = ,
, x 105 g = 1,6320 g
69
SD = ∑ = 0,2078
Kadar rata-rata = , , , , = 1,2439 % b/b
SE = = ,
√ = 0,1039
CV = x 100% = ,
BIOGRAFI PENULIS