KARAKTERISTIK SUBSTRAT ANTIMIKROBA BAKTERI
ASAM LAKTAT HASIL ISOLASI DARI DAGING SAPI
DAN AKTIVITAS ANTAGONISTIKNYA
TERHADAP BAKTERI PATOGEN
SKRIPSI
RATIH PERMANASARI
PROGRAM STUDI TEKNOLOGI HASIL TERNAK FAKULTAS PETERNAKAN
INSTITUT PERTANIAN BOGOR 2008
RINGKASAN
RATIH PERMANASARI. D14204026.2008. Karakteristik Substrat Antimikroba Bakteri Asam Laktat Hasil Isolasi dari Daging Sapi dan Aktivitas Antagonistiknya terhadap Bakteri Patogen. Skripsi. Program Studi Teknologi Hasil Ternak, Fakultas Peternakan, Institut Pertanian Bogor.
Pembimbing Utama : Irma Isnafia Arief, S.Pt, MSi
Pembimbing Anggota : Dr. Ir. Rarah Ratih Adjie Maheswari, DEA
Program swasembada daging oleh pemerintah harus didukung dengan adanya diversifikasi produk yaitu dengan mikroorganisme terutama asam, tidak hanya ragam tapi juga kesehatan. Salah satu produk yang dikembangkan dengan bantuan mikroorganisme asam yaitu sosis fermentasi atau biasa disebut salami, namun dalam pengembangannya terdapat beberapa kendala salah satunya yaitu pada impor kultur starter. Kultur starter impor harganya cukup mahal, sehingga dilakukan pengisolsian bakteri asam sendiri.
Bakteri yang diisolasi merupakan mikroorganisme yang mempunyai dua efek, yaitu efek positif sebagai bahan starter untuk proses fermentasi sehingga menghasilkan pangan dengan rasa asam yang dikehendaki dan antimikroba alami yang bermanfaat bagi keamanan pangan dan efek negatifnya yaitu dapat mengkontaminasi bahan pangan yang menyebabkan kebusukan serta kerusakan pangan.
Penelitian ini bertujuan untuk mempelajari karakteristik substrat antimikroba bakteri asam laktat hasil isolasi dari daging sapi sebanyak 12 isolat dan aktivitas antagonistiknya terhadap tiga bakteri patogen yaitu Staphylococcus aureus (ATCC 25923), Escherichia coli (ATCC 25922), dan Salmonella typhimurium (ATCC 14028) berupa zona hambat. Pengujian pertama yaitu untuk mengetahui karakteristik morfologis isolat bakteri asam laktat dengan pewarnaan Gram. Pewarnaan Gram menunjukkan warna biru yang berarti 12 isolat tersebut adalah Gram positif berbentuk batang dan bulat. Pengujian kedua yaitu uji konfrontasi supernatan dengan tiga bakteri uji. Pengujian dilakukan untuk identifikasi senyawa antimikroba yang bekerja saat uji konfrontasi. Pengujian ini menunjukkan bahwa 12 isolat bakteri asam laktat tersebut menghasilkan senyawa antimikroba, baik berupa asam organik, hidrogen peroksida, diacetil maupun bakteriosin. Supernatan yang dihasilkan dengan penetralan, zona hambat tidak terbentuk saat konfrontasi, sedang tanpa penetralan zona hambat yang dihasilkan saat konfrontasi lebih bening. Hal ini menunjukkan bahwa senyawa antimikroba yang dominan bekerja adalah asam organik.
Hasil penelitian menunjukkan bahwa antimikroba yang bekerja dominan pada konfrontasi terhadap tiga bakteri uji Staphylococcus aureus (ATCC 25923), Escherichia coli (ATCC25922), dan Salmonella typhimurium (ATCC 14028) baik pada kecepatan sentrifuse 6.000 rpm maupun 10.000 rpm adalah asam organik. Jenis isolat bakteri yang mempunyai diameter zona hambat terbaik adalah isolat bakteri 1A5, yang berarti bahwa senyawa antimikroba yang dihasilkan dari isolat 1A5 adalah asam organik.
Penghambatan mikroba oleh suatu senyawa antimikroba dinyatakan dengan nilai MIC (Minnimum Inhibitory Concentration) yaitu konsentrasi terendah yang dapat menghambat pertumbuhan mikroba sebanyak 90% dari inokulum asal selama
inkubasi 24 jam. Konsentrasi penghambatan minimum (MIC) antimikroba (asam organik) isolat bakteri asam laktat 1A5 terhadap tiga bakteri patogenStaphylococcus aureus(ATCC 25923), Escherichia coli (ATCC25922),dan Salmonella typhimurium (ATCC 14028) menunjukkan bahwa untuk menghambat 90% pertumbuhan bakteri uji dibutuhkan konsentrasi minimum dari supernatan isolat bakteri asam laktat 1A5 ini adalah sebesar 90%.
Kata-kata kunci : Antimikroba, bakteri asam laktat, Minnimum Inhibitory Concentration
ABSTRACT
The Characteristic of Antimicroba Lactic Acid Bacteria Substrate Isolated from Beef and It’s Antagonistic Activity to Patogen Bacteria
Permanasari, R., I.I. Arief and R.R.A. Maheswari
This research was conducted to study the characteristic of antimicrobe lactid acid bacteria substrate that isolated from beef of 12 isolated and it s antagonistic activity to three pathogen bacteria, such as Staphylococcus aureus (ATCC 25923), Escherichia coli (ATCC25922), dan Salmonella typhimurium (ATCC 14028) in the clear inhibitory zone. The first experiment compare sentrifuge velocity. In the 6.000 rpm, inhibitory zone disposed more turbid than it caused from 10.000 rpm velocity. It mean that sentrifuge velocity influencetial to decomposed velocity from lactic acid bacteria, so it caused inhibitory zone from 6.000 rpm more turbid. The best inhibitory zone from 12 confrontation isolated lactic acid bacteria that sentrifuge with 10.000 rpm use Staphylococcus aureus (ATCC 25923), Escherichia coli (ATCC25922),dan Salmonella typhimurium(ATCC 14028) showed that isolate with the best inhibitor is 1A5 isolate. Inhibitory microbe with antimicrobe could expalined with MIC score, that is the lowest concentration that could inhibit microbe growth as much as 90 % from its inoculum until 24 hours incubation. Minimum inhibitory concentration antimicrobe 1A5 lactic acid bacteria isolated to three patogen bacteria Staphylococcus aureus (ATCC 25923), Escherichia coli (ATCC25922), dan Salmonella typhimurium (ATCC 14028) showed that inhibition on 90 % bacteria growth, we need the lowest concentration from supernatan lactic acid bacteria 1A5 as much as 90 %.
KARAKTERISTIK SUBSTRAT ANTIMIKROBA BAKTERI
ASAM LAKTAT HASIL ISOLASI DARI DAGING SAPI
DAN AKTIVITAS ANTAGONISTIKNYA
TERHADAP BAKTERI PATOGEN
RATIH PERMANASARI D14204026
Skripsi ini merupakan salah satu syarat untuk memperoleh gelar Sarjana Peternakan pada
Fakultas Peternakan Institut Pertanian Bogor
PROGRAM STUDI TEKNOLOGI HASIL TERNAK FAKULTAS PETERNAKAN
INSTITUT PERTANIAN BOGOR 2008
KARAKTERISTIK SUBSTRAT ANTIMIKROBA BAKTERI
ASAM LAKTAT HASIL ISOLASI DARI DAGING SAPI
DAN AKTIVITAS ANTAGONISTIKNYA
TERHADAP BAKTERI PATOGEN
Oleh
RATIH PERMANASARI D14204026
Skripsi ini telah disetujui dan disidangkan di hadapan Komisi Ujian Lisan pada tanggal 21 Juli 2008
Pembimbing Utama Pembimbing Anggota
Irma Isnafia Arief, S.Pt, M.Si Dr. Ir. Rarah R. A. Maheswari, DEA. NIP 132 243 330 NIP 131 671 595
Dekan Fakultas Peternakan Institut Pertanian Bogor
Dr. Ir. Luki Abdullah, M.Agr.Sc NIP 131 955 581
RIWAYAT HIDUP
Penulis dilahirkan pada tanggal 21 Maret 1986 di Sragen, Jawa Tengah. Penulis adalah anak kedua dari tiga bersaudara dari pasangan Bapak Radjimin dan Ibu Martini S. Pd.
Pendidikan dasar diselesaikan pada tahun 1998 di SDN Gemolong 1, pendidikan lanjutan menengah pertama diselesaikan pada tahun 2001 di SMPN 1 Gemolong dan pendidikan lanjutan menengah atas diselesaikan pada tahun 2004 di SMUN 1 Gemolong. Penulis diterima sebagai mahasiswa pada Jurusan Teknologi Hasil Ternak, Fakultas Peternakan, Institut Pertanian Bogor melalui jalur Undangan Seleksi Masuk IPB (USMI) pada tahun 2004.
Selama mengikuti pendidikan, penulis aktif di Badan Eksekutif Mahasiswa Tingkat Persiapan Bersama sebagai staf sosial kesejahteraan mahasiswa (BEM TPB, 2004-2005), Badan Eksekutif Mahasiswa Fakultas Peternakan (2005-2006) sebagai staf informasi dan komunikasi. Penulis pernah menjadi asisten praktikum Mata Kuliah Ilmu dan Teknologi Pengolahan Susu, asisten mata kuliah Mikrobiologi Hasil Ternak dan asisten penelitian antimikroba dan laktoferin. Penulis juga mengikuti pelatihan Hazard Analysis and Critical Control Points (HACCP), lolos seleksi Program Kreatifitas Mahasiswa (PKM) bidang kewirausahaan dan berpartisipasi dalam beberapa kepanitiaan yaitu Masa Perkenalan Kampus Mahasiswa Baru (MPKMB 2005) dan Masa Perkenalan Fakultas (MPF 2006) serta beberapa kepanitiaan seminar.
KATA PENGANTAR
Segala puji bagi Allah SWT atas segala rahmat, hidayah dan keberkahan-Nya yang telah diturunkan kebumi kepada seluruh umat manusia. Shalawat dan salam semoga selalu tersampaikan pada Nabiyullah SAW.
Karya tulis yang berjudul Karakteristik Substrat Antimikroba Bakteri Asam Laktat Hasil Isolasi dari Daging Sapi dan Aktivitas Antagonistiknya terhadap Bakteri Patogen dibuat dalam rangka memenuhi tugas akhir skripsi, sebagai syarat dalam memenuhi gelar sarjana Peternakan di Institut Pertanian Bogor, Program Studi Teknologi Hasil Ternak.
Umur simpan daging sapi segar yang pendek, sehingga perlu adanya biopreservatif yang non toksik untuk daging sapi tersebut. Bakteri Asam Laktat hasil isolasi dari daging perlu dibuktikan mempunyai aktivitas antimikroba terhadap bakteri patogen sehingga dapat dikembangkan sebagai biopreservatif. Bakteri asam laktat merupakan penghasil senyawa antimikroba yaitu asam organik, hidrogen peroksida, diasetil dan bakteriosin yang dapat digunakan sebagai pengawet daging sehingga mempunyai umur simpan yang lebih lama.
Besar harapan penulis agar karya tulis ini dapat bermanfaat dan juga dapat digunakan sebagai penambah ilmu pengetahuan pembacanya. Akhir kata penulis menyadari bahwa karya ini masih jauh dari kata sempurna yang disebabkan oleh kelemahan penulis sebagai hamba Allah yang tidak akan pernah lepas dari segala bentuk kesalahan.
Bogor, Agustus 2008 Penulis
DAFTAR ISI Halaman RINGKASAN ... i ABSTRACT... iii RIWAYAT HIDUP ... iv KATA PENGANTAR... v DAFTAR ISI... vi
DAFTAR TABEL... viii
DAFTAR GAMBAR ... ix DAFTAR LAMPIRAN ... x PENDAHULUAN... 1 Latar Belakang... 1 Tujuan ... 2 TINJAUAN PUSTAKA ... 3 Mikrobiologi Daging ... 3
Bakteri Asam Laktat ... 5
Antimikroba... 5 Bakteriosin... 6 Hidrogen Peroksida ... 8 Asam Organik ... 8 Bakteri Patogen ... 9 E.coli... 9 S. Typhimurium... 10 S. aureus... 11 Kurva Pertumbuhan ... 11
Analisis Aktivitas Antimikroba... 12
METODE... 13
Lokasi dan Waktu ... 13
Materi... 13 Bahan... 13 Alat ... 13 Rancangan ... 13 Prosedur ... 14 Penelitian Pendahuluan ... 14 Pewarnaan Gram ... 14 Penelitian Utama ... 14 Uji Antagonistik ... 15
HASIL DAN PEMBAHASAN... 19
Penelitian Pendahuluan ... 19
Karakteristik Bakteri Uji ... 20
Penelitian Utama... 21
Identifikasi Keberadaan Substrat Antimikroba... 22
Aktivitas Substrat Antimikroba pada kecepatan 10.000 rpm ... 24
Identifikasi Substrat Asam Organik ... 23
Minimum Inhibitory Concentration (MIC)... 29
KESIMPULAN DAN SARAN... 33
Kesimpulan... 33
Saran ... 33
UCAPAN TERIMA KASIH ... 34
DAFTAR PUSTAKA... 35
DAFTAR TABEL
Nomor Halaman
1. Batas Maksimum Cemaran Mikroba pada Daging (cfu/g) ... 4
2. KarakteristikSalmonella... 10
3. Karakteristik Isolat Bakteri Asam Laktat... 19
4. Total Populasi Awal Bakteri Uji ... 20
5. Rataan Diameter Zona Hambat Supernatan BAL terhadap Bakteri Uji... 21
7. Aktivitas Asam Organik dari Isolat BAL Tanpa Penambahan Buffer ... 23
8. Nilai Total Asam Tertitrasi Substrat Antimikroba Isolat 1A5 ... 28
DAFTAR GAMBAR
Nomor Halaman
1. Kemampuan Antagonistik Isolat BAL terhadap Bakteri Uji
E. coli... 26
2. Minimum Inhibitory Concentration padaS. aureus... 29
3. Minimum Inhibitory Concentration padaE. coli... 29
DAFTAR LAMPIRAN
Nomor Halaman
1. Analisis Ragam Asam Organik terhadap EC (6.000 rpm) ... 42
2. Analisis Ragam Asam Organik terhadap SA (6.000 rpm) ... 42
3. Analisis Ragam Asam Organik terhadap ST (6.000 rpm) ... 42
4. Analisis Ragam Asam Organik terhadap EC (10.000 rpm)... 42
5. Analisis Ragam Asam Organik terhadap SA (10.000 rpm)... 43
6. Analisis Ragam Asam Organik terhadap ST (10.000 rpm) ... 43
7. Analisis Ragam pH... 43
8. Morfologi Isolat Bakteri Asam Laktat yang Diperoleh dari Pengamatan Mikroskopis... 44
9. Gambar Konfrontasi Isolat BAL terhadap Bakteri Uji ... 46
10. Minimum Inhibitory Concentration... 47
PENDAHULUAN
Latar Belakang
Daging sapi adalah salah satu pangan hasil ternak sebagai penyumbang protein hewani terbesar. Daging sapi mempunyai sifat mudah rusak, dan untuk memperpanjang daya simpan daging sapi agar tetap layak dikonsumsi perlu adanya perlakuan khusus salah satunya dengan pendinginan.Meningkatnya jumlah penduduk Indonesia, akan semakin meningkatkan pula kebutuhan permintaan pasar akan bahan pangan, terutama untuk pangan asal hewan, yaitu daging sapi. Mutu dan keamanan daging mempunyai peranan penting dalam mendukung program swasembada daging memenuhi kebutuhan pangan hewani.
Program swasembada daging oleh pemerintah harus didukung dengan adanya diversifikasi produk yaitu dengan mikroorganisme terutama asam, tidak hanya ragam tapi juga kesehatan. Salah satu produk yang dikembangkan dengan bantuan mikroorganisme asam yaitu sosis fermentasi atau biasa disebut salami, namun dalam pengembangannya terdapat beberapa kendala salah satunya yaitu pada impor kultur starter. Kultur starter impor harganya cukup mahal, sehingga dilakukan pengisolasian bakteri asam sendiri.
Bakteri yang diisolasi merupakan mikroorganisme yang mempunyai dua efek, yaitu efek positif sebagai bahan starter untuk proses fermentasi sehingga menghasilkan pangan dengan rasa asam yang dikehendaki dan antimikroba alami yang bermanfaat bagi keamanan pangan dan efek negatifnya yaitu dapat mengkontaminasi bahan pangan yang menyebabkan kebusukan serta kerusakan pangan.
Alternatif dalam mengatasi masalah pembusukan daging tersebut adalah dengan pengawetan yang bertujuan untuk mengamankan daging segar dan produk daging dari pembusukan serta memperpanjang masa simpannya. Salah satu metode preservasi adalah penambahan bahan pengawet. Pengawet kimia dan antibiotik mempunyai kelemahan yaitu (1) adanya bahaya mikroorganisme yang resisten terhadap antibiotik dan dapat menimbulkan infeksi pada konsumen, (2) konsumen menjadi sensitif atau resisten terhadap antibiotik tertentu sehingga dapat mengganggu pemakaian untuk tujuan kesehatan, (3) kemungkinan toksisitas karena residu yang masih aktif dalam daging, (4) beberapa pengawet kimia diserap oleh
bahan organik (darah, feses, jaringan) sehingga mengurangi efektivitas antimikroba (McKane dan Kandel, 1985).
Kelompok bakteri asam laktat (BAL) banyak digunakan untuk keperluan proses pengawetan bahan pangan. BAL dapat meningkatkan keamanan pangan dengan menghambat pertumbuhan bakteri pembusuk gram positif dan gram negatif, karena BAL menghasilkan produk metabolit yang mempunyai sifat antimikroba antara lain diasetil, hidrogen peroksida, asam-asam organik dan bakteriosin (Schved et al., 1993). Bakteriosin lebih aman digunakan, karena tidak mengandung toksin sehingga tidak membahayakan saluran pencernaan, serta dapat didegradasi oleh enzim-enzim pencernaan.
Tujuan
Penelitian ini bertujuan untuk: (1) mempelajari karakteristik substrat antimikroba BAL hasil isolasi dari daging sapi dan aktivitas antagonistik terhadap bakteri patogen (2) mencari konsentrasi penghambatan minimum substrat antimikroba terhadap bakteri patogen (Minimum Inhibitory Concentration).
TINJAUAN PUSTAKA
Mikrobiologi Daging
Mutu mikrobiologi dari suatu produk makanan ditentukan oleh jumlah dan jenis mikroorganisme yang terdapat dalam bahan pangan. Hal ini akan menentukan ketahanan simpan dari produk tersebut ditinjau dari kerusakan oleh mikroorganisme. Keamanan produk ditentukan oleh jumlah mikroorganisme patogenik yang terdapat didalamnya. Populasi mikroorganisme yang berada pada suatu bahan pangan umumnya bersifat sangat spesifik dan tergantung pada jenis bahan pangan dan kondisi tertentu dari penyimpanannya (Buckleet al.,1987).
Daging sangat memenuhi persyaratan untuk perkembangan mikroorganisme, termasuk mikroorganisme perusak atau pembusuk. Hal ini disebabkan daging mempunyai kadar air tinggi antara 68% - 75%, kaya akan zat yang mengandung nitrogen dengan kompleksitas yang berbeda, mengandung sejumlah karbohidrat yang dapat difermentasikan, kaya akan mineral dan kelengkapan faktor untuk pertumbuhan mikroorganisme, mempunyai pH yang menguntungkan bagi sejumlah mikroorganisme sekitar 5,3 6,5 (Soeparno, 1994).
Kualitas daging didefinisikan sebagai sejumlah sifat yang menentukan pada daging itu yang berpengaruh terhadap penerimaan konsumen (Mountney, 1976). Warna dan daya mengikat air, dan beberapa aroma daging terdeteksi sebelum dan sesudah pemasakan dan akan memberikan sensasi yang lebih lama terhadap konsumen dibandingkan denganjuiceness, tekstur, keempukan, rasa dan kebanyakan aroma yang terdeteksi saat pengunyahan (Lawrie, 1998).
Pada saat ternak masih hidup, pH daging berkisar antara 6,8 7,2 (Forest et al.,1975), atau menurut Buckle et al. (1987) berkisar antara 7,2 7,4. setelah disembelih akan terjadi penurunan pH karena terjadi penimbunan asam laktat dalam jaringan otot akibat glikolisis anaerob. Pada beberapa ternak, penurunan pH terjadi satu jam pertama setelah ternak dipotong dan saat tercapai rigormotis, pH tetap tinggi sekitar 6,5 6,8. Namun ada juga penurunan pH yang sangat cepat yaitu mencapai 5,4 5,5, sehingga menyebabkan terjadinya peningkatan keasaman akibat pertumbuhan mikroorganisme (Forest et al., 1975). Nilai pH daging sapi setelah proses perubahan glikolisis menjadi asam laktat berhenti berkisar antara 5,1 6,2 (Buckleet al., 1987).
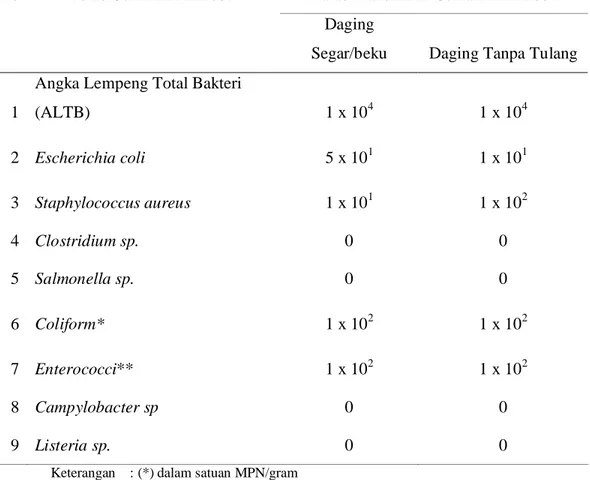
Kebanyakan bakteri tumbuh dipermukaan daging, namun tidak tertutup kemungkinan ditemukan bakteri dalam daging. Bakteri yang dapat mencapai jaringan dalam karkas dengan berbagai cara, diantaranya melalui mekanisme berikut : (1) jaringan ternak sehat dapat mengandung sebuah populasi kecil bakteri namun dinamis bila bakteri secara terus-menerus memperoleh akses kedalam jaringan ternak hidup, dengan penetrasi membran mukosa saluran respirasi dan pencernaan, untuk mengganti yang telah dibasmi oleh mekanisme ketahanan tubuh ternak, (2) bakteri dari usus dapat menyerang jaringan karkas, baik selama pemotongan atau agonal invasion maupun setelah pemotongan atau post mortem invasion, (3) bakteri dapat terbawa ke jaringan oleh luka sebelum pemotongan, (4) bakteri yang mengkontaminasi permukaan karkas dapat mempenetrasi ke lapisan jaringan otot yang lebih dalam (Gill, 1982). SNI mensyaratkan batas maksimum cemaran mikroba seperti tercantum dalam Tabel 1.
Tabel 1. Batas Maksimum Cemaran Mikroba pada Daging (CFU/g) SNI 01-6366-2000
No Jenis Cemaran Mikroba Batas Maksimum Cemaran Mikroba Daging
Segar/beku Daging Tanpa Tulang
1
Angka Lempeng Total Bakteri
(ALTB) 1 x 104 1 x 104 2 Escherichia coli 5 x 101 1 x 101 3 Staphylococcus aureus 1 x 101 1 x 102 4 Clostridium sp. 0 0 5 Salmonella sp. 0 0 6 Coliform* 1 x 102 1 x 102 7 Enterococci** 1 x 102 1 x 102 8 Campylobacter sp 0 0 9 Listeria sp. 0 0
Keterangan : (*) dalam satuan MPN/gram (**) dalam satuan kuallitatif
Tipe bakteri yang umum dijumpai pada daging adalah strain dari Pseudomonas, Moraxella, Acinetobacter, Lactobacillus, Brochotrix thermophacta dan beberapa genera dari familiEnterobacteriaceae (Gill, 1982).
Bakteri Asam Laktat
Bakteri asam laktat (BAL) sering ditemukan secara alamiah dalam bahan pangan. Bakteri ini hidup pada susu, daging segar, dan sayur-sayuran dalam jumlah yang kecil (Jenie dan Rini, 1995). Pada proses fermentasi daging spontan, bakteri asam laktat yang berasal dari bahan mentah atau lingkungan menyebabkan baik terbentuknya asam laktat dari penggunaan karbohidrat, maupun rendahnya nilai pH yaitu 5,9 4,6 (Hugas dan Monfort, 1997).
Bakteri asam laktat berbentuk bulat maupun batang, Gram positif dan (dengan sedikit pengecualian) tidak motil secara permanen. Walaupun BAL dapat hidup dengan dan tanpa oksigen, sumber energi terbesarnya untuk tumbuh adalah fermentasi gula. Bakteri ini mempunyai kapasitas respirasi yang sangat terbatas dan oleh karena itu tidak dapat memperoleh ATP dari proses respirasi (Stanier et al., 1963).
Bakteri asam laktat secara umum dibagi menjadi dua kelompok, homofermentatif dan heterofermentatif. Kelompok pertama hanya menghasilkan asam laktat selama fermentasi gula. Kelompok kedua membentuk sejumlah karbon dioksida, etil alkohol, asam asetat dan gliserol bersamaan dengan sejumlah besar asam laktat (Fardiaz, 1992).
Bakteri asam laktat juga berfungsi sebagai manipulator populasi mikroflora pada saluran pencernaan. Manfaat ini diperoleh karena bakteri tersebut menghasilkan bakteriosin (Tagget al., 1976). Bakteri asam laktat juga digunakan sebagai probiotik karena mampu : (1) menghasilkan asam laktat yang dapat menurunkan pH, (2) dalam kondisi aerob memproduksi hidrogen peroksida dan (3) memproduksi komponen penghambat yang spesifik misalnya bakteriosin (Fuller, 1992).
Antimikroba
Zat antimikroba adalah senyawa biologis atau kimia yang dapat menghambat pertumbuhan dan aktivitas mikroba. Beberapa grup senyawa kimia utama yang bersifat antimikrobial adalah fenol dan senyawa fenolik, alkohol, halogen, logam
berat dan senyawanya, zat warna, deterjen, senyawa amonium kuartener, asam dan basa dan gas khemosterilen. Mekanisme penghambatan pertumbuhan mikroba oleh senyawa antimikroba antara lain : (1) perusakan dinding sel sehingga mengakibtkan lisis atau menghambat pembentukan dinding sel pada sel yang sedang tumbuh, (2) mengubah permeabilitas membran sitoplasma yang menyebabkan kebocoran nutrient di dalam sel, (3) denaturasi protein sel, (4) perusakan sistem metabolisme dalam sel dengan cara menghambat kerja enzim intraseluler (Pelczaret al., 1979).
Menurut Fardiaz (1989), zat antimikroba dapat bersifat bakterisidal (membunuh bakteri), bakteristatik (menghambat pertumbuhan bakteri), fungisidal (membunuh kapang), fungistatik (menghambat petumbuhan kapang), dan germisidal (menghambat germinasi spora bakteri). Kemampuan suatu zat antimikroba dalam menghambat pertumbuhan mikroba dipengaruhi oleh beberapa faktor, antara lain (1) konsentrasi zat pengawet, (2) waktu penyimpanan, (3) suhu lingkungan, (4) sifat-sifat mikroba (jenis, konsentrasi, umur dan keadaan mikroba), (5) sifat-sifat-sifat-sifat fisik dan kimia makanan termasuk kadar air, pH, jenis dan jumlah senyawa di dalamnya.
Menurut Fardiaz (1992), makanan mungkin mengandung komponen yang dapat menghambat pertumbuhan jasad renik. Komponen antimikroba tersebut terdapat dalam makanan dalam berbagai cara, yaitu (1) terdapat secara alamiah didalam bahan pangan, (2) ditambah dengan sengaja ke dalam makanan, (3) terbentuk selama pengolahan atau oleh jasad renik yang tumbuh selama fermentasi makanan. Zat-zat yang digunakan sebagai antimikroba harus mempunyai beberapa kriteria ideal antara lain tidak bersifat racun bagi bahan pangan, ekonomis, tidak menyebabkan perubahan citarasa dan aroma makanan, tidak menyebabkan timbulnya galur resisten dan sebaiknya membunuh daripada hanya menghambat pertumbuhan mikroba (Frazier dan Westhoff, 1988).
Bakteriosin
Sejumlah strain bakteri tertentu mampu menghasilkan substansi protein, biasanya memiliki bobot molekul yang kecil yang mampu menghambat bakteri lain, secara umum substansi ini dikenal dengan nama bakteriosin (Cintas et al., 1998; Joosten et al., 1996). Bakteriosin secara alami dihasilkan oleh bakteri yaitu suatu senyawa protein yang mempunyai aktivitas antimikrobial misalnya melawan patogen pencemar makanan (foodborne) dan organisme berspora lainnya (Janeset al,. 1999).
Istilah bakteriosin pertama kali dilaporkan oleh Jacob dalam Tagg et al. (1976) pada tahun 1953. Hal ini berdasarkan atas suatu senyawa yang dihasilkan oleh Escherichia coliyang disebutcolicin dan dikarakterisasi sebagai suatu senyawa yang bersifat letal terhadap intraspesies dengan reseptor spesifik. Tagg et al.,(1976) menambahkan beberapa kriteria yang mencakup sebagai berikut: (1) mempunyai spektra aktivitas yang relatif sempit, terpusat disekitar spesies penghasil (secara philogenik dekat), (2) senyawa aktif terutama terdiri dari fraksi protein, (3) bersifat bakterisidal, (4) mempunyai reseptor spesifik pada sel sasaran dan (5) gen determinan terdapat pada plasmid yang berperan pada produksi dan imunitas.
Bakteriosin bakteri asam laktat dapat dibagi dalam 2 subklas yaitu (i) lanbiotik, bakteriosin kecil yang mengandung asam amino yang tak lazim seperti dehidroalanina, lantionina dan -metilantionina, contohnya nisin yaitu peptida kationik berukuran 3,4 kDa dan (ii) nonlanbiotik, suatu kelompok bakteriosin dengan berbagai ukuran (2,5 37 kDa) yang mengandung asam amino reguler, kelompok ini meliputi laktokoksin yang merupakan peptida kationik kecil berukuran 5 sampai 10 kDa (Venema et al., 1993). Lanbiotik dapat dibagi menjadi dua subgrup: lanbiotik berbentuk linier (nisin) dan lanbiotik yang berbentuk bulat (duramisin) (Engelke et al., 1992).
MenurutSchnell et al., (1988) sintesis bakteriosin oleh galur produsen terjadi selama pertumbuhan fase eksponensial, biasanya mengikuti pola klasik sintesis protein. Beberapa bakteriosin disintesis dalam bentuk lengkap secara langsung melalui jalur ribosom. Lanbiotik disintesis secara ribosomal sebagai prepemtida kemudian mengalami modifikasi.
Bakteriosin sering diartikan sebagai protein dengan efek antagonis intraspesifik atau memiliki aktivitas sebagai bakterisidal atau bakteriostatik terhadap bakteri dan biasanya berkerabat dekat dengan spesies penghasil (Ecker, 1992; Gonzaleset al., 1995). Bakteriosin sering dihubungkan dengan senyawa antimikroba berupa protein yang mudah didegradasi oleh enzim proteolitik dan mampu menghambat pertumbuhan mikroba spesies lain yang biasanya berkerabat dekat dengan spesies penghasil (Jacket al., 1995). Substansi ini diproduksi oleh beberapa strain bakteri, termasuk dalam hal ini BAL (Gorris dan Bennik, 1994). Umumnya hampir semua substansi yang diproduksi oleh BAL mampu menghambat
pertumbuhan BAL lainnya, dan beberapa diantaranya memiliki efek bakterisidal terhadap bakteri lain yaitu bakteri pembusuk dan patogenik asal makanan seperti Staphylococcus aureus, Listeria monocytogenes, Clostridium botulinum(Gorris dan Bennik, 1994). Bakteriosin bersifat irreversible, mudah dicerna, berpengaruh positif terhadap kesehatan, aktif pada konsentrasi rendah dan pada bakteri asam laktat biasanya digunakan sebagai biopreservatif makanan (Vuyst dan Vandamme, 1993). Hidrogen Peroksida
Hidrogen peroksida (H2O2) merupakan oksidator, bleaching agent dan anti bakteri. Hidrogen peroksida murni tidak berwarna, berbentuk cairan seperti sirup, dan memiliki bau yang menusuk. Senyawa ini dapat terdekomposisi menjadi air dan oksigen. Pada suhu ruang dekomposisi H2O2 berjalan lambat. Perubahan kondisi lingkungan seperti pH dan suhu mempengaruhi kecepata H2O2 terdekomposisi. Kenaikan suhu, keefisienan dalam menghancurkan bakteri meningkat karena kecepatan terdekomposisi juga semakin cepat (Branenet al., 1990).
Fungsi H2O2 sebagai antimikroba tergantung pada kemampuan oksidatifnya. Kemampuan untuk mengoksidasi menyebabkan perubahan tetap pada sistem enzim sel mikroba. Kemampuan bakterisidal dari H2O2 beragam tergantung pH, konsentrasi, suhu, waktu, dan tipe serta jumlah mikroorganisme. Pada kondisi tertemtu spora bakteri ditemukan paling resistan terhadap H2O2, diikuti dengan bakteri gram positif. Bakteri yang paling sensitif terhadap H2O2 adalah bakteri gram negatif, terutama koliform (Branen, 1993).
Asam Organik
Terbentuk asam laktat dan asam organik oleh bakteri asam laktat dapat menyebabkan penurunan pH. Akibatnya mikroba yang tidak tahan terhadap kondisi pH yang relatif rendah akan terhambat (Fardiaz, 1982). Akumulasi produk akhir asam yang rendah pH-nya menghasilkan penghambatan yang luas terhadap gram positif maupun gram negatif (Jenie, 1996).
Efek penghambatan dari asam organik terutama berhubungan dengan jumlah asam yang tidak terdisosiasi. Asam yang tidak terdisosiasi dapat berdifusi secara pasif kedalam membran sel. Asam tersebut di dalam sel membelah menjadi proton dan anion mempengaruhi pH didalamnya (Rini, 1995).
Efek antimikroba dari asam organik disebabkan oleh molekul yang tidak terdisosiasi. Konstanta disosiasi (pKa) asam adalah 4,8 untuk asam asetat, 4,9 untuk asam propionat, dan 3,8 untuk asam laktat. Efektivitas antimikroba asam laktat adalah terendah disebabkan pKa nya yang rendah (Ray, 2000).
Bakteri Patogen
Jenis bakteri yang dapat mengkontaminasi makanan terbagi menjadi dua jenis yaitu bakteri menyebabkan makanan menjadi rusak atau disebut bakteri perusak dan bakteri yang menyebabkan keracunan pada manusia atau disebut bakteri patogen. Penularan bakteri terhadap manusia melalui dua cara yaitu (1) intoksikasi, makanan mengandung toksn yang dihasilkan bakteri yang tumbuh di dalam makanan tersebut, dan (2) infeksi, penyakit yang disebabkan oleh masuknya bakteri ke dalam tubuh melalui makanan yang telah terkontaminasi dan adanya reaksi dari tubuh terhadap keberadaan atau metabolit-metabolit yang dihasiilkan bakteri selama tumbuh di dalam tubuh. Bakteri uji merupakan bakteri yang bersifat patogen dan digunakan sebagai tolak ukur untuk mengetahui besarnya tingkat aktivitas antimikroba.
Bakteri patogen dibedakan menjadi dua bagian berdasarkan sifat pewarnaan Gram yaitu Gram positif dan Gram negatif. Bakteri Gram positif adalah bakteri yang memberi respon berwarna biru jika dilakukan uji pewarnaan Gram sedangkan bakteri Gram negatif memberi respon warna merah (Suriawiria, 2005). Kelompok bakteri Gram positif diantaranya Staphylococcus aureus, Listeria monocytogenes dan Clostridium perfringens, sedangkan bakteri Gram negatif diantaranya adalah Escherichia coli enteropatogenik danSalmonella typhimurium.
Escherichia coli
Escherichia coli merupakan bakteri Gram negatif, tidak mempunyai kapsul, umumnya mempunyai fimbriae, bersifat motil atau nonmotil dengan flagella peritrikat, berukuran lebar 1 1,5 m dan panjang 2 - 6 m, bersifat fakultatif anaerob, tunggal atau berpasangan, mempunyai suhu optimum pertumbuhan 37oC, tetapi dapat tumbuh pada rentang suhu 15-45oC. Nilai aw optimum adalah 0,96. bakteri ini sangat sensitif terhadap panas dan dapat diinaktifkan pada suhu pasteurisasi atau selama pemasakan makanan (Willshaw et al., 2000; Supardi Sukamto, 1999).
Escherichia coli merupakan bakteri flora normal di dalam saluran pencernaan hewan dan manusia, sehingga mudah mencemari air. Kontaminasi bakteri ini pada makanan biasanya berasal dari kontaminasi air yang digunakan. Dosis yang dapat menimbulkan gejala infeksiEscherichia coli pada makanan berkisar antara 108 109 sel. Bahan makanan yang sering terkontaminasi oleh Escherichia coli antara lain daging sapi, daging ayam, daging babi, ikan dan makanan hasil laut lainnya, telur dan produk olahannya, sayuran, buah-buahan, sari buah, serta susu (Supardi dan Sukamto, 1999).
Salmonella typhimurium
Salmonella merupakan bakteri Gram negatif yang tidak berspora dan tidak toleran terhadap konsentrasi garam tinggi (Jay, 2000). Salmonella dapat menyebabkan gastroenteritis, demam enterik (typhoid dan paratyphoid), septikemia (mikroorganisme berkembangbiak dalam aliran darah), diare (McKane dan Kandel, 1985), nausea, dan muntah (Alcamo, 1983). Jenis Salmonella yang menggunakan tubuh manusia sebagai host antara lain S. typhi, S. paratyphi, S. schottmuelleri, S. hirschfeldi. Gejala klinis dari keracunan Salmonella tampak setelah 8-72 jam (Brandlyet al.,1968),S. typhi dapat memproduksi kapsul anti fagositik.
Karakteristik Salmonella berdasarkan ICMSF (1996) yang disitir Blackburn dan McClure (2002) dapat dilihat pada Tabel 2.
Tabel 2. KarakteristikSalmonella
Syarat Pertumbuhan Minimum Maksimum
Suhu (0C) 5,2 46,2
pH 3,8 9,5
aw 0,94 >0,99
Sumber :ICMS (1996)
Salmonella typhimurium bersifat motil dengan flagella peritrikat (Fardiaz, 1992). Bakteri ini mempunyai ukuran panjang 2,0 3,0 m dan lebar 0,6 0,7 m mampu tumbuh pada kondisi aerobik maupun anaerobik (Pelezar dan Reid, 1977).
Salmonella typhimurium tumbuh pada kisaran suhu 2oC sampai 47oC, sedangkan pada kisaran pH 3,6 sampi 9,5 (dengan pH optimum untuk pertumbuhan 6,5 7,5) bakteri dapat tumbuh pada kisaran suhu 25 sampai 43oC. Nilai aw optimum untuk pertumbuhan adalah 0,94 0,99. Bakteri ini merupakan bakteri pathogen
berbahaya, selain dapat menyebabkan gejala gastrointestinal (gangguan perut), juga dapat menyebabkan demam tifus (Salmonella typhimurium) dan paratifus (Salmonella paratyphi) (Fardiaz, 1992). Makanan yang sering terkontaminasi oleh Salmonella typhimurium adalah telur, susu, ikan daging ayam, daging sapi serta hasil olahannya.
Staphylococcus aureus
Staphylococcus aureus termasuk famili Micrococcaceae, merupakan bakteri gram positif, berbentuk kokus yang terdapat dalam bentuk tunggal, berpasanganm tetrad, atau berkelompok seperti buah anggur. Kebanyakan galur Staphylococcus aureus bersifat patogen dan memproduksi enterotoksin yang tahan akan panas. Beberapa galur, terutama yang bersifat patogen, memproduksi koagulase, bersifat proteolitik, lipolitik dan -hemolitik. Bakteri ini sering terdapat pada pori-pori dan permukaan kulit, kelenjar keringat, dan saluran usus, serta dapat menyebabkan intoksikasi dan infeksi bisul, pneumonia, mastitis pada hewan (Fardiaz, 1983).
Suhu optimum pertumbuhan Staphylococcus aureus adalah 35 37oC, suhu minimum 6,7oC dan suhu maksimum 45,5oC. Bakteri ini dapat tumbuh pada pH 4,0 9,8 dengan pH optimum sekitar 7,0 7,8. Pertumbuhan pada pH mendekati 9,8 hanya mungkin bila substratnya mempunyai komponen yang baik untuk pertumbuhannya (Supardi dan Sukamto, 1999).
Keracunan pangan Stapilokokal disebabkan olehStaphylococci khususnya S. aureus tumbuh didalam bahan pangan dan membentuk enterotoksin sebagai produk metabolitnya. Gejala-gejala keracunan yang ditimbulkan adalah mual, muntah, kram perut dan diare. Gejala keracunan ini terjadi antara 1 8 jam (biasanya 2-4 jam) setelah mengkonsumsi bahan pangan yang telah terkontaminasi (Parker, 2000).
Kurva Pertumbuhan
Fardiaz (1992), menyatakan bahwa pada organisasi uniseluler pertumbuhan berarti pertambahan jumlah sel. Sedangkan menurut Pelzar dan Chan (1988) menyatakan bahwa istilah pertumbuhan umum digunakan untuk bakteri dan mikroorganisme lain dan biasanya mengacu pada perubahan didalam hasil panen (pertambahan total masa sel) dan bukan perubahan individu organisme.
Kurva pertumbuhan mikroba merupakan gambaran dari pertumbuhan secara bertahap sejak awal hingga terhenti mengadakan mengadakan kegiatan. Secara umum fase pertumbuhan bakteri terbagi menjadi lima fase, yaitu fase 1) fase lag, 2) fase logaritmik, 3) fase pengurangan pertumbuhan, 4) fase stasioner, dan 5) fase kematian (Suriawiria, 2005).
Analisis Aktivitas Antimikroba
Penghambatan mikroba oleh suatu senyawa antimikroba dinyatakan dengan nilai MIC yaitu konsentrasi terendah yang dapat menghambat pertumbuhan mikroba sebanyak 90% dari inokulum asal selama inkubasi 24 jam (Cosentino, 1999). Nilai MIC senyawa antimikroba yang lebih rendah menunjukkan bakteri lebih sensitive terhadap senyawa tersebut (Naufalin, 2005).
Fase pertumbuhan bakteri berpengaruh pada sensitifitas bakteri terhadap senyawa antimikroba. Menurut Thompson dan Hintom (1996), bakteri pada fase stasioner lebih sensitive terhadap antimikroba asam lemak rantai pendek daripada bakteri fase pertumbuhan. Hal ini disebabkan penambahan asam rantai pendek seperti propionate pada fase pertumbuhan E. coli dapat dimanfaatkan sebagai pembentuk asam lemak yang berinkorporasi dengan atom karbon yang lain kedalam membrane sitoplasma. Kerusakan dinding sel mikroba dan kebocoran kandungan sel mikroba akibat interaksi dengan antimikroba dapat dipelajari dengan SEM (Lambert et al., 2001; Burt dan Reinders, 2003).
METODE
Lokasi dan Waktu
Penelitian ini dilaksanakan pada bulan Nopember 2007 sampai bulan April 2008. Lokasi penelitian dilakukan di laboratorium penelitian bagian Ilmu produksi Ternak Perah dan Laboratorium Ruminansia Besar, Fakultas Peternakan, Institut Pertanian, Bogor.
Materi
Bahan bahan utama yang akan digunakan dalam penelitian ini adalah 12 isolat bakteri asam laktat yang berasal dari daging sapi (koleksi Arief et al., 2006). Bakteri uji yang digunakan adalah koleksi ATCC (Staphylococcus aureus (ATCC 25923), Escherichia coli (ATCC25922), dan Salmonella typhimurium (ATCC 14028)). Media yang digunakan adalahdeMan Rogosa Sharp Agar (MRSA),deMan Rogosa Sharp Broth (MRSB), Muller Hilton Agar (MHA), Nutrient Broth (NB), Yeast Extrak (YE), Nutrient Agar (NA), larutan pengencer Buffer Peptone Water (BPW) 1 %, danaquades.
Alat alat yang digunakan dalam penelitian ini adalah jarum Ose, cawan Petri, pipet volumetrik, pipet 5 ml, pipet pasteur, mikro pipet, tabung reaksi, gelas ukur, inkubator, pH meter, kertas saring, pemanas Bunsen, jangka sorong,autoclaf, alumunium foil, oven,spektrofotometer, membran filter (0,22 µm, millipore) dan alat sentrifuse 6.000 dan 10.000 rpm pada suhu 4oC.
Rancangan
Rancangan percobaan yang digunakan untuk melihat aktivitas antimikroba pada bakteri uji adalah rancangan acak lengkap (RAL) pola searah dengan tiga kali ulangan. Model analisis yang digunakan sebagai berikut :
Yij= µ +Ai + ij Keterangan :
Yij = respon pengaruh perlakuan sifat antimikroba bakteri asam laktat µ = rata-rata
Ai =pengaruh sifat antimikroba bakteri asam laktat ij =galat percobaan
Peubah yang diamati adalah diameter zona hambat yang terbentuk. Data yang diperoleh dilakukan uji asumsi, jika data data memenuhi asumsi maka data dianalisis dengan uji parametrik (anova). Jika data tidak memenuhi asumsi, maka data dianalisis menggunakan uji non parametrik (kruskal wallis). Jika perlakuan menunjukkan pengaruh yang nyata maka dilanjutkan dengan uji tukey (parametrik) dan uji beda rataan ranking (non parametrik) (Steel dan Torrie, 1995).
Prosedur Penelitian Pendahuluan
Penelitian ini meliputi pemeriksaan kembali dari 12 isolat yang diduga bakteri asam laktat hasil isolasi dari daging sapi melalui pewarnaan Gram dan uji katalase.
Pewarnaan Gram (Hadioetomo, 1990).Sampel bakteri dari koloni yang homogen dioleskan pada kaca objek kemudian difiksasi panas. Olesan bakteri kemudian diteteskan dengan kristal violet selama satu menit, kemudian diratakan, dibilas dengan akuades dan dikering udarakan. Setelah kering, olesan bakteri diteteskan iodium Gram selama dua menit, kemudian dibilas akuades dan ditiriskan. Preparat dicuci dengan pemucat warna yaitu etanol 95%, tetes demi tetes selama 30 detik, kemudian dicuci segera dengan akuades dan ditiriskan. Preparat selanjutnya diteteskan safranin selama 30 detik, dibilas dengan akuades dan ditiriskan. Setelah kering preparat di amati dibawah mikroskop dengan perbesaran 100 X. Bakteri yang termasuk dalam kelompok Gram positif akan menunjukkan warna biru keunguan sedangkan kelompok bakteri Gram negatif adalah berwarna merah safranin. Hasil pengamatan preparat didokumentasikan dalam bentuk fotografik.
Penelitian Utama
Penelitian utama meliputi uji konfrontasi, identifikasi senyawa antimikroba, pengukuran pH dari supernatan bebas sel bakteri asam laktat 12 jenis isolat bakteri, pengukuran total asam tertitrasi (TAT), serta penentuan konsentrasi minimum penghambatan terhadap bakteri uji oleh isolat bakteri yang ditunjukkan oleh diameter zona hambat terbesar.
Uji Konfrontasi Isolat Bakteri Asam Laktat Asal Daging terhadap Bakteri Uji
Persiapan Bakteri Uji. Bakteri uji yang digunakan adalah Staphylococcus aureus (ATCC 25923), Escherichia coli (ATCC 25922), dan Salmonella typhimurium (ATCC 14028).Bakteri uji dibiakkan pada mediaNutrien Agar (NA) selama 24 jam pada suhu 37oC, untuk memperoleh kultur kerja. Sebanyak satu ose kultur kerja tersebut diperbanyak dengan cara dibiakkan kedalam tabung berisi media Nutrien Broth (NB) sebanyak 5 ml dan diinkubasi selama 24 jam pada suhu 37oC. Standardisasi kultur bakteri uji umur 24 jam dilakukan dengan cara penyetarakan kekeruhannya sesuai standarMc. Farland no. 2, untuk menghasilkan populasi bakteri setara 6 x 108 sel bakteri/ml. Konfrontasi bakteri uji dengan substrat antimikroba menggunakan konsentrasi bakteri 6 x106 sel bakteri/ml yang diperoleh dengan cara mengencerkannya dalamBuffer Pepton Water (BPW) steril.
Persiapan Supernatan Bebas Sel dari Isolat Bakteri Asam Laktat. Sebanyak 12 spesies bakteri asam laktat yang diisolasi dari daging sapi lokal masing-masing diinokulasikan ke MRS Broth dan diinkubasikan pada suhu 37oC selama 24 jam. Supernatan dipanen melalui sentrifugasi. Kondisi sentrifugasi yang digunakan yaitu (a). kecepatan 6.000 rpm pada suhu 4oC selama 15 menit tanpa filtrasi dan (b). 10.000 rpm pada suhu 4oC selama 20 menit dengan filtrasi (0,22 µm). Supernatan yang diperoleh siap diuji aktivitas antimikrobanya dengan menggunakan metode difusi agar/agar well diffusion.
Persiapan Media dengan Metode Konfrontasi Difusi Agar (Bromberg et al., 2004). Suspensi bakteri uji yang telah diencerkan dengan populasi 6 x106 sel bakteri/ml diambil sebanyak 1 ml dengan pipet steril ke dalam cawan Petri steril. MediaMuller Hilton Agar (MHA) steril bersuhu ±50oC sebanyak 20 ml dituangkan kedalamnya,untuk membentuk ketebalan agar. Campuran dihomogenkan dengan cara cawan Petri digerakkan membentuk angka delapan diatas bidang datar. Setelah media agar mengeras dibuat sumur berdiameter 5 mm dengan menggunakan ujung pipet Pasteur steril sebanyak jumlah isolat yang diuji yaitu 8 buah, yang merupakan duplo untuk setiap bakteri uji. Pada dasar sumur ditutup denganbacteriological agar dengan tujuan supernatan tidak merembes di dasar media agar.
Konfrontasi dilakukan dengan menambahkan sebanyak 50 µl supernatan kedalam sumur yang telah disiapkan. Cawan Petri beserta isinya diletakkan selama 2 jam dalam refrigerator agar supernatan meresap kedalam media agar. Selanjutnya cawan diinkubasi pada suhu 37oC selama 24 jam untuk memberikan kesempatan supernatan beraktivitas terhadap bakteri uji. Zona bening yang terbentuk menunjukkan adanya hambatan terhadap pertumbuhan bakteri uji oleh supernatan. Diameter zona bening (mm) diukur dengan jangka sorong sebanyak tiga kali pada posisi yang berbeda dan dirata-ratakan.
Pengukuran pH (DSN, 1992).Sebelum persiapan karakterisasi substrat antimikroba dilakukan pengukuran nilai pH supernatan menggunakan pH meter yang terlebih dulu dikalibrasi dengan buffer untuk pH 4 dan 7. Kalibrasi dilakukan setiap akan melakukan pengukuran. Pengukuran dilakukan dengan mencelupkan elektroda ke dalam supernatan bebas sel setelah terlebih dahulu elektroda dibersihkan dengan akuades. Skala nilai pH dibaca pada saat muncul kata ready atau angka penunjuk telah berada pada posisi tetap.
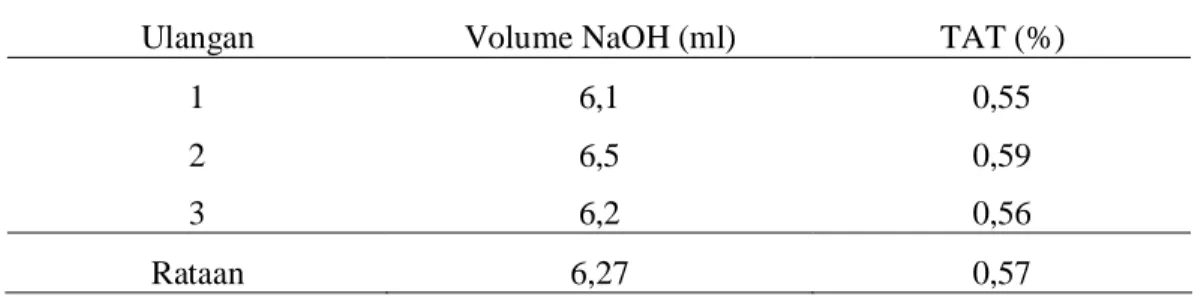
Pengukuran Total Asam Tertitrasi (DSN, 1992). Supernatan dipipet sebanyak 10 ml kedalam labu Erlenmeyer, kemudian ditambahkan tiga tetes larutan indikator phenophtalein (PP 1%). Supernatan bebas sel kemudian dititrasi dengan larutan NaOH 0,1 N sampai terbentuk warna merah muda.
Perhitungan :
Jumlah Asam = b x c x 90 x 100% a x 1000
Keterangan : a = bobot/volume sampel, dinyatakan dalam ml b = volume larutan NaOH, dinyatakan dalam ml c = normalitas larutan NaOH
Karakterisasi Substrat Antimikroba
Bakteriosin. Supernatan bebas sel hasil sentrifugasi dikondisikan pada pH 7,0 dengan penambahan NaOH 1 N dan disaring dengan 0,22 m membran filter (Millipore). Selanjutnya supernatan bebas sel yang merupakan ekstrak kasar bakteriosin tersebut siap untuk diuji aktivitasnya dengan metode difusi agar/agar well diffusion (Bromberget al., 2004). Setiap pengujian dilakukan sebanyak 3 kali ulangan, masing-masing ulangan dilakukan secara duplo.
Bila dihasilkan zona bening berarti terdapat substrat bakteriosin di dalam supernatan bebas sel. Aktivitas penghambatan senyawa antimikroba yang dihasilkan dinyatakan dalam satuanArbritary Unit (AU), 1AU = 1 mm2/ml. Isolat bakteri yang memiliki penghambatan terbaik pada uji antagonistik ini akan diteliti lanjut untuk penentuan nilaiminimum inhibitory concentration (MIC).
AU = Luas zona bening-Luas sumur Volume substrat
Minimum Inhibitory Concentration (MIC) (Kubo, 1993)
Minimum Inhibitory Concentration (MIC) adalah konsentrasi terendah senyawa antimikroba yang mampu menghambat pertumbuhan bakteri uji pada kondisi yang telah ditentukan. Tahapan penentuan MIC meliputi :
a. Persiapan media penentuan MIC
Media untuk pertumbuhan bakteri uji yang digunakan adalahNutrient Broth (NB) steril dengan pH 7,0 yang didistribusikan kedalam tabung reaksi masing-masing sebanyak 9 ml. Selanjutnya ditambahkan 1 ml inokulum bakteri uji dengan konsentrasi log 7 cfu/ml berumur 24 jam.
b. Penentuan MIC Substrat Antimikroba
Bakteri uji yang digunakan untuk penentuan MIC substrat antimikroba adalah Staphylococcus aureus, Escherichia coli enteropatogenik,dan Salmonella typhimurium. Penentuan MIC bertujuan untuk mendapatkan konsentrasi minimal dari substrat antimikroba untuk menghambat pertumbuhan bakteri uji yang termasuk bakteri patogen. Prosedur penentuan MIC ekstrak kasar dilakukan sebagai berikut: substrat antimikroba yang telah difilter, dipipet sebanyak 10 ml, 20 ml, 30 ml, 40 ml, 50 ml, 60 ml, 70 ml, 80 ml, 90 ml, dan 100 ml kemudian dimasukkan kedalam masing-masing tabung reaksi yang
berisi bakteri uji berumur 24 jam dengan konsentrasi log 7 cfu/ml dalam MRSB masing-masinng sebanyak 90 ml, 80 ml, 70 ml, 60 ml, 50 ml, 40 ml, 30ml, 20 ml, 10 ml. Pertumbuhan bakteri uji diamati secara manual untuk menentukan tidak terjadinya pertumbuhan pada bakteri tersebut. Selain itu kekeruhan yang menunjukkan pertumbuhan bakteri uji diukur pula dengan spektrofotometer untuk menentukan nilai absorbansinya (optical density) pada panjang gelombang 520 nm.
Minimum Inhibitory Concentration
Supernatan bebas sel + MRSB (konsentrasi 100%-0%)
+
Media MIC+
Bakteri uji Populasi 6x107 SpektrofotometerInkubasi
24 Jam pada
suhu 37
oC
Penentuan
MIC
HASIL DAN PEMBAHASAN
Penelitian Pendahuluan
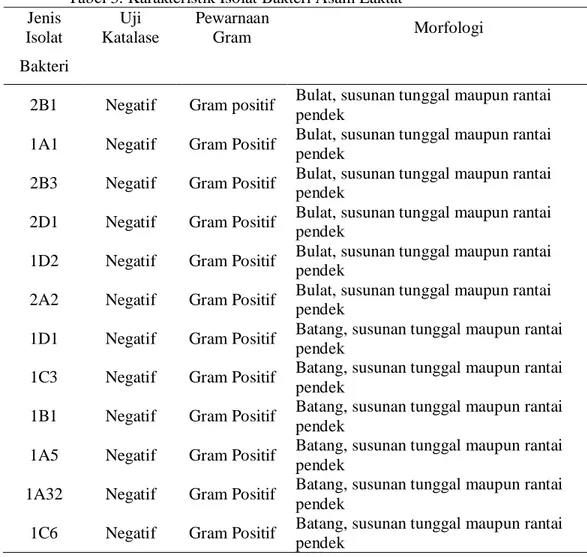
Penelitian pendahuluan ini meliputi persiapan kultur isolat bakteri asam laktat (BAL) hasil isolasi dari daging sapi yaitu uji katalase dan pewarnaan Gram serta persiapan bakteri uji, yang bertujuan untuk memeriksa karakteristik morfologis dan kemurnian isolat bakteri yang akan digunakan. Isolat yang digunakan terdapat 12 isolat bakteri asam laktat yang telah diisolasi dari daging sapi dan telah diidentifikasi pada penelitian sebelumnya (Hidayati, 2006) dapat dilihat pada Tabel 3. Isolat bakteri asam laktat ini diisolasi dari daging sapi untuk mendapatkan biopreservatif alami yang berasal dari daging dang untuk daging. Karakterisktik morfologis yang diamati meliputi respon terhadap pewarnaan Gram, bentuk dan susunan sel serta uji katalase.
Tabel 3. Karakteristik Isolat Bakteri Asam Laktat Jenis Isolat Uji Katalase Pewarnaan Gram Morfologi Bakteri
2B1 Negatif Gram positif Bulat, susunan tunggal maupun rantai pendek
1A1 Negatif Gram Positif Bulat, susunan tunggal maupun rantai pendek
2B3 Negatif Gram Positif Bulat, susunan tunggal maupun rantai pendek
2D1 Negatif Gram Positif Bulat, susunan tunggal maupun rantai pendek
1D2 Negatif Gram Positif Bulat, susunan tunggal maupun rantai pendek
2A2 Negatif Gram Positif Bulat, susunan tunggal maupun rantai pendek
1D1 Negatif Gram Positif Batang, susunan tunggal maupun rantai pendek
1C3 Negatif Gram Positif Batang, susunan tunggal maupun rantai pendek
1B1 Negatif Gram Positif Batang, susunan tunggal maupun rantai pendek
1A5 Negatif Gram Positif Batang, susunan tunggal maupun rantai pendek
1A32 Negatif Gram Positif Batang, susunan tunggal maupun rantai pendek
1C6 Negatif Gram Positif Batang, susunan tunggal maupun rantai pendek
Persiapan bakteri asam laktat dilakukan untuk mengetahui morfologis dan kemurnian isolat bakteri asam laktat tersebut. Pemeriksaan karakteristik yang dilakukan antara lain uji katalase dan pewarnaan Gram.
Morfologi isolat bakteri asam laktat yang diperoleh dari pengamatan mikroskopis dapat dilihat pada Lampiran 8. Menurut Fardiaz (1992), kelompok Lactobacillus sp. Mempunyai bentuk batang yang panjang, katalase negatif dan tergolong dalam bakteri Gram positif. Hasil pengujian menunjukkan bahwa jenis isolat 1D1, 1C3, 1B1, 1A5, 1A32, dan 1C6 tergolong dalam Gram positif yang mempunyai bentuk batang dengan susunan tunggal atau rantai. Isolat lainnya yaitu 2B1, 1A1, 2B3, 1A2, 2D1 dan 2A2 tergolong dalam kelompok bakteri Gram positif yang berbentuk bulat/ coccus susunan rantai pendek termasuk kedalam kelompok famili Strepcoccocaceae. Hal ini sesuai dengan penelitian terdahulu yang menyatakan bahwa isolat bakteri tersebut tergolong dalam kelompok bakteri genus Lactobacillus spdan Strepcoccocaceae (Hidayati, 2006). Karakteristik bakteri asam laktat yang diperoleh sesuai dengan Frazier dan Westhooff (1978), bahwa Lactobacillus sp. berbentuk batang, mempunyai susunan sel tunggal atau rantai, dan Gram positif. Sedangkan Streptococcus berbentuk bulat dengan susunan rantai panjang maupun pendek (Fardiaz, 1992).
Hasil dari persiapan kultur bakteri asam laktat ini menunjukkan bahwa kultur tidak tercemar, seperti yang diperoleh pada penelitian sebelumnya (Hidayati, 2006) sehingga dapat dinyatakan bahwa kultur masih homogen dan tidak tercemar.
Karakteristik Bakteri Uji
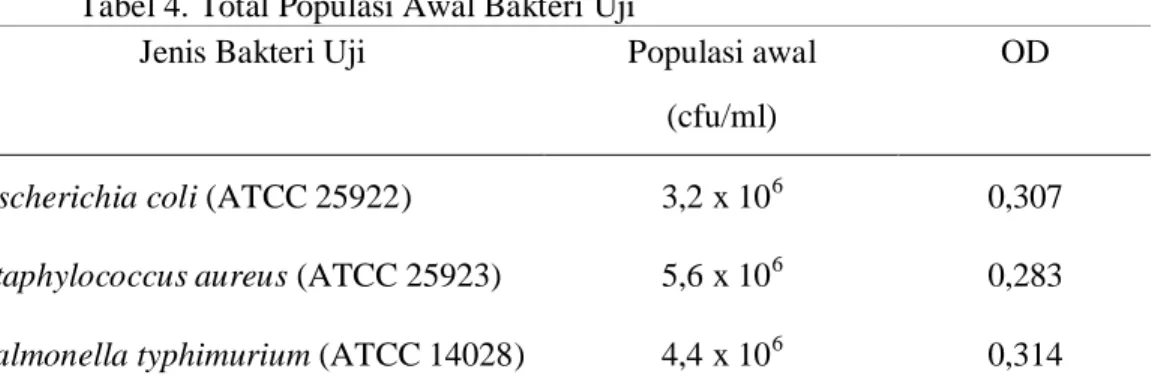
Persiapan bakteri uji dilakukan untuk penentuan jumlah populasi awal dari bakteri uji. Total populasi awal bakteri uji dapat dilihat pada Tabel 4.
Tabel 4. Total Populasi Awal Bakteri Uji
Jenis Bakteri Uji Populasi awal OD
(cfu/ml)
Escherichia coli(ATCC 25922) 3,2 x 106 0,307
Staphylococcus aureus(ATCC 25923) 5,6 x 106 0,283
Bakteri uji yang digunakan antara lain Escherichia coli (ATCC 25922), Staphylococcus aureus(ATCC 25923) dan Salmonella typhimurium(ATCC 14028). Pemilihan ketiga bakteri uji ini mengacu pada ketentuan SNI 01-6366-2000 yang menyatakan bahwa ketiga bakteri tersebut perlu mendapatkan perhatian khusus sebagai cemaran mikroba pada daging (Tabel 1).
Penelitian Utama
Penelitian utama adalah identifikasi substrat antimikroba dari isolat BAL. Identifikasi substrat antimikroba ditentukan berdasarkan hasil konfrontasinya dengan bakteri uji. Identifikasi keberadaan substrat antimikroba dengan kecepatan sentrifugasi 6.000 rpm dan 10.000 rpm, pengujian terhadap asam organik, bakteriosin dan konsentrasi penghambatan minimum/MIC.
Identifikasi Keberadaan Substrat Antimikroba
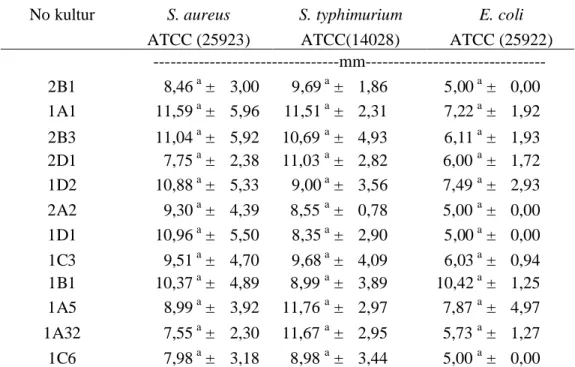
Substrat antimikroba diperoleh dengan cara melakukan sentrifugasi terhadap kultur untuk memisahkan sel dan supernatant bebas sel pada kecepatan 6.000 rpm selama 20 menit pada suhu 4oC. Rataan diameter Zona Hambat 6.000 rpm dapat dilihat pada Tabel 6.
Tabel 6. Rataan Diameter Zona Hambat Supernatan BAL terhadap Bakteri Uji
No kultur S. aureus S. typhimurium E. coli ATCC (25923) ATCC(14028) ATCC (25922)
---mm---2B1 8,46 a ± 3,00 9,69 a ± 1,86 5,00 a ± 0,00 1A1 11,59 a ± 5,96 11,51 a ± 2,31 7,22 a ± 1,92 2B3 11,04 a ± 5,92 10,69a ± 4,93 6,11 a ± 1,93 2D1 7,75 a ± 2,38 11,03a ± 2,82 6,00a ± 1,72 1D2 10,88 a ± 5,33 9,00 a ± 3,56 7,49a ± 2,93 2A2 9,30 a ± 4,39 8,55a ± 0,78 5,00a ± 0,00 1D1 10,96 a ± 5,50 8,35 a ± 2,90 5,00 a ± 0,00 1C3 9,51 a ± 4,70 9,68 a ± 4,09 6,03 a ± 0,94 1B1 10,37 a ± 4,89 8,99a ± 3,89 10,42 a ± 1,25 1A5 8,99 a ± 3,92 11,76a ± 2,97 7,87a ± 4,97 1A32 7,55 a ± 2,30 11,67a ± 2,95 5,73a ± 1,27 1C6 7,98 a ± 3,18 8,98a ± 3,44 5,00a ± 0,00 Keterangan : Huruf yang sama pada kolom yang sama menunjukkan tidak berbeda nyata Diameter lubang sumur 5 mm
Substrat antimikroba diperoleh dari sentrifugasi dengan kecepatan 6.000 rpm tanpa penyaringan. Pengaruh pengujian sentrifugasi pada kecepatan 6.000 rpm selama 20 menit terhadap zona hambat yang terbentuk cenderung lebih keruh. Hal ini disebabkan pada perlakuan sentrifuge dengan kecepatan 6.000 rpm (4oC, 20 menit) tidak dilakukan penyaringan dengan kertas saring 0,22 µm, sehingga ada kemungkinan bahwa pada kecepatan 6.000 rpm ini belum terjadi pengendapan sel secara sempurna.
Berdasarkan hasil sidik ragam, perlakuan isolat yang berbeda terhadap bakteri uji Staphylococcus aureus (ATCC 25923) tidak berpengaruh nyata. Hal ini menunjukkan bahwa penghambatan masing-masing isolat terhadap bakteri uji tidak terdapat perbedaan. Hasil sidik ragam dengan perlakuan 12 isolat yang berbeda terhadap bakteri uji Salmonella typhimurium (ATCC 14028) tidak berpengaruh nyata, begitu pula hasil sidik ragam terhadap bakteri uji E. coli(ATCC 25922). Hal ini menunjukkan bahwa pada kecepatan sentrifugasi 6.000 rpm (4oC, 20 menit) antara 12 isolat tidak ada perbedaan terhadap zona bening yang terbentuk.
Substrat antimikroba isolat BAL 1C3, 1A1, 2B3, 1D2, 1B1, 1A5, 2D1, dan 1A32 yang dihasilkan dari kecepatan sentrifugasi 6.000 rpm (4oC, 20 menit) dapat menghambat ketiga bakteri uji, sedangkan substrat isolat BAL 2B1, 1D1, 1C6, dan 2A2 tidak dapat menghambat bakteri uji. E.coli. seluruh bakteri asam laktat menghasilkan substrat antimikroba ditunjukkan oleh adanya zona hambat pada bakteri uji. Antimikroba yang dihasilkan oleh bakteri asam laktat dapat berupa asam organik, hidrogen peroksida, diacetil dan bakteriosin.
Identifikasi Substrat Antimikroba dari Isolat BAL
Identifikasi jenis substrat antimikroba menggunakan supernatan bakteri asam laktat diperoleh dengan cara sentrifugasi dengan kecepatan 10.000 rpm selama 20 menit. Peningkatan kecepatan sentrifugasi bertujuan untuk mendapatkan supernatan yang betul-betul bebas sel, karena dengan kecepatan 6.000 rpm masih didapatkan zona hambat yang bersifat parsial, yang diduga masih terdapat sel-sel bakteri asam laktat yang belum mengendap secara sempurna. Hasil pengamatan dengan supernatan yang disentrifugasi pada kecepatan 10.000 rpm diperoleh zona bening (penghambatan total dengan diameter untuk tiap-tiap ulangan yang relatif konstan).
Bakteriosin merupakan substrat antimikroba yang paling penting dihasilkan oleh bakteri asam laktat. Identifikasi keberadaan bakteriosin dalam supernatan bebas sel dapat dilakukan melalui beberapa pengujian diantaranya: (a) netralisasi pengaruh asam dalam supernatan dengan penambahan buffer pH 7,0; (b) penambahan enzim proteolitik dan, (c) pengujian stabilitas melalui pemanasan.
Hasil konfrontasi antara supernatan yang sudah dinetralisasi dengan buffer phospat dan disterilkan melalui filter 0,22 µm adalah tidak didapatkan kembali zona hambat bening di sekitar sumur, sementara itu supernatan yang sama tapi tidak dinetralkan tetap menunjukkan adanya zona hambat seperti dilihat pada Tabel 7.
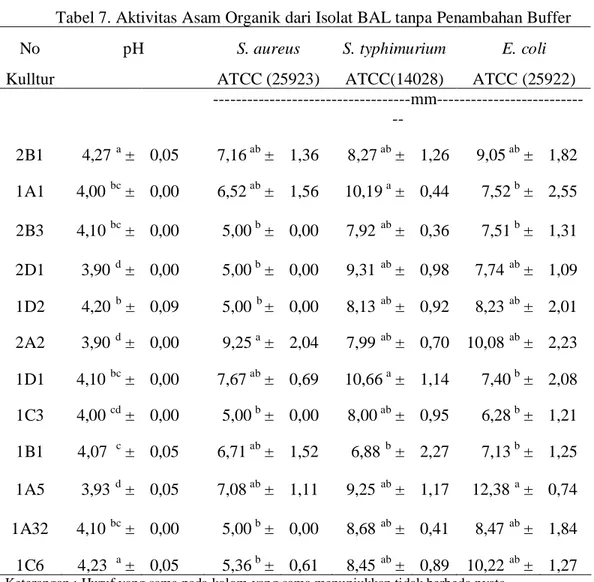
Tabel 7. Aktivitas Asam Organik dari Isolat BAL tanpa Penambahan Buffer
No pH S. aureus S. typhimurium E. coli
Kulltur ATCC (25923) ATCC(14028) ATCC (25922) -mm --2B1 4,27a ± 0,05 7,16 ab ± 1,36 8,27 ab ± 1,26 9,05 ab ± 1,82 1A1 4,00bc ± 0,00 6,52 ab ± 1,56 10,19 a ± 0,44 7,52 b ± 2,55 2B3 4,10bc ± 0,00 5,00 b ± 0,00 7,92 ab ± 0,36 7,51 b ± 1,31 2D1 3,90d ± 0,00 5,00 b ± 0,00 9,31 ab ± 0,98 7,74ab ± 1,09 1D2 4,20 b ± 0,09 5,00 b± 0,00 8,13 ab ± 0,92 8,23ab ± 2,01 2A2 3,90d ± 0,00 9,25 a ± 2,04 7,99 ab ± 0,70 10,08ab ± 2,23 1D1 4,10bc ± 0,00 7,67 ab ± 0,69 10,66 a ± 1,14 7,40 b ± 2,08 1C3 4,00cd ± 0,00 5,00 b ± 0,00 8,00 ab ± 0,95 6,28 b ± 1,21 1B1 4,07 c ± 0,05 6,71 ab ± 1,52 6,88b ± 2,27 7,13 b ± 1,25 1A5 3,93d ± 0,05 7,08 ab ± 1,11 9,25 ab ± 1,17 12,38a ± 0,74 1A32 4,10bc ± 0,00 5,00 b ± 0,00 8,68 ab ± 0,41 8,47ab ± 1,84 1C6 4,23 a ± 0,05 5,36 b ± 0,61 8,45 ab ± 0,89 10,22ab ± 1,27 Keterangan : Huruf yang sama pada kolom yang sama menunjukkan tidak berbeda nyata
Diameter lubang sumur 5 mm
Hasil konfrontasi berupa tidak terbentuknya zona hambat oleh supernatant bebas sel yang telah dinetralisasi menunjukkan bahwa tidak terdapat bakteriosin
dalam supernatan atau bila terdapat bakteriosin jumlah konsentrasinya terlalu rendah untuk mampu menghambat bakteri uji. Komponen utama substrat antimikroba yang mampu menghambat bakteri uji adalah asam organik, ditunjukkan oleh nilai pH dari masing-masing supernatan yang rendah yaitu antara 3,90 dan 4,27.
Asam organik merupakan salah satu substrat antimikroba yang dihasilkan oleh bakteri asam laktat. Asam organik seperti asam asetat dan asam laktat, merupakan hasil metabolit primer dari bakteri asam laktat. Asam organic memiliki kemampuan penghambatan melalui penurunan pH lingkungan sel bakteri. Asam laktat merupakan penghambat yang baik untuk bakteri bukan pembentuk spora pada lingkungan dengan pH 5,0 tetapi tidak efektif menghambat kapang dan khamir (Davidson dan Branen, 1993).
PertumbuhanSalmonella dihambat pada pH dibawah 4,4 untuk asam laktat dan 5,4 untuk asam asetat. Produksi asam oleh isolat bakteri asam laktat mampu menghambat dan menonaktifkan strain enteropathogenic Escherichia coli. Asam laktat dapat menghambat Bacillus subtilis, Escherichia coli, Pseudomonas fluorescens dan Staphylococcus aureus. Aksi sinergis dari asam laktat dan asetat dapat menghambat pertumbuhan Escherichia coli dan Salmonella (Vuyst dan Vandame, 1994).
Mekanisme penghambatan bakteri oleh asam-asam organik berhubungan dengan keseimbangan asam-basa, penambahan proton, dan produksi energi oleh sel. Keseimbangan asam basa pada sel mikroba ditunjukkan dengan pH yang mendekati normal. Interaksi dengan senyawa kimia akan mengganggu keseimbangan asam-basa dan mengakibatkan kerusakan sel. Protein, asam nukleat, dan fosfolipid dapat rusak oleh perubahan pH. Ketersediaan ion-ion logam akan mengganggu permeabilitas membran, karena membran kurang permeabel terhadap ion dibandingkan dengan molekul yang tidak bermuatan. Perubahan permeabilitas membran akan menghasilkan efek ganda, yaitu mengganggu transport nutrisi kedalam sel dan menyebabkan metabolit internal keluar dari sel (Davidson dan Branen, 1993).
Akumulasi dari produk akhir asam dan pH rendah seperti halnya pembentukan hidrogen peroksida akan menghasilkan spektrum penghambatan yang luas, meliputi bakteri Gram positif dan negatif. Pada pH yang telah diatur, asam dengan nilai pKa tertinggi akan memiliki jumlah asam yang tidak terdisosiasi
terbanyak, dan menghasilkan aktivitas antimikrobial terkuat. Asam asetat (pKa=4,74) memiliki jumlah asam tidak terdisosiasi 2 atau 4 kali lipat pada interval pH 4,0 4.6 dibandingkan dengan asam laktat (pKa=3,85), sehingga mempunyai kemampuan lebih menghambat dari pada asam laktat (Vuyst dan Vandame, 1994).
Nilai pH eksternal yang rendah mengakibatkan asidifikasi sel sitoplasma, sementara asam yang tidak terdisosiasi menjadi lipofilik. Asam lipofilik seperti asam laktat dan asetat dalam bentuk tidak terdisosiasi dapat masuk kedalam sel mikroba, dan pH intra seluler yang lebih tinggi, berdisosiasi untuk menghasilkan ion-ion hidrogen, dan menurunkan pH intraselulernya sehingga mengganggu sistem transport substrat (Surono, 2004). Sensitifitas bakteri terhadap asam tergantung pada beberapa faktor seperti aktivitas air, kadar garam, potensial redoks, dan perlakuan panas (Vuyst dan Vandame, 1994).
Penghambatan Asam Organik dari Isolat BAL terhadapStaphylococcus aureus
(ATCC 25923). Berdasarkan hasil sidik ragam, perlakuan isolat yang berbeda terhadap bakteri ujiStaphylococcus aureus (ATCC 25923) menunjukkan hasil yang berpengaruh nyata (P<0,05). Isolat 2A2 mempunyai penghambatan yang paling besar yaitu (9,25 ± 2,04) dan memiliki nilai pH yang cukup rendah yaitu 3,90. Diantara isolat lainnya, 1C3, 2B3, 2D1, 1D2, 1A32 dan 1C6 memiliki diameter zona hambat yang sama dan paling kecil. Perbedaan aktivitas penghambatan masing-masing isolat BAL terhadap bakteri uji dipengaruhi oleh senyawa antimikroba yang dihasilkan. Bakteri ujiS. aureus(ATCC 25923) tergolong dalam bakteri Gram positif. Struktur dinding sel bakteri Gram positif relatif lebih sederhana sehingga memudahkan senyawa antimikroba untuk masuk ke dalam sel dan menemukan sasaran untuk bekerja (Pelczar dan Chan, 1988). Aktivitas antimikroba (Asam Organik) dari isolat BAL terhadapStaphylococcus aureus(ATCC 25923) dapat dilihat pada Tabel 7.
Penghambatan Asam Organik dari Isolat BAL terhadap Salmonella typhimurium(ATCC 14028). Berdasarkan hasil sidik ragam, perlakuan isolat yang berbeda terhadap bakteri uji Salmonella typhimurium (ATCC 14028) menunjukkan hasil yang berpengaruh nyata (P<0,05). Secara umum semua jenis isolat dapat menghambat pertumbuhan bakteri uji Salmonella typhimurium(ATCC 14028). Isolat bakteri yang menghasilkan penghambatan terbesar pada bakteri uji S. typhimurium
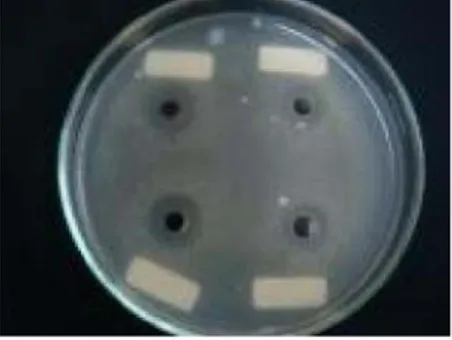
adalah 1D1 dan 1A1 yaitu sebesar (10,66 ± 1,14) dan (10,19 ± 0,44). Jenis isolat 1B1 mempunyai penghambatan yang paling kecil terhadap bakteri uji S. typhimurium yaitu sebesar (6,88 ± 2,27). Jenis isolat lainnya memiliki keragaman diameter zona hambat sesuai dengan tingkat kepekaanS. typhimurim terhadap senyawa antimikroba yang dihasilkan. Bakteri uji S. typhimurium tergolong dalam bakteri Gram negatif. Hal ini membuktikan bahwa antimikroba yang dihasilkan efektif dalam menghambat bakteri Gram negatif. Aktivitas antimikroba (asam organik) dari isolat bakteri asam laktat terhadapSalmonella typhimurium(ATCC 14028) dapat dilihat pada Tabel 7. Penghambatan Asam Organik dari Isolat BAL terhadapE. coli(ATCC 25922). Berdasarkan hasil sidik ragam, perlakuan isolat yang berbeda terhadap bakteri ujiE. coli (ATCC 25922) menunjukkan hasil yang berpengaruh nyata (P<0,05). Penghambatan terbesar terhadap E. coli (ATCC 25922) dihasilkan oleh jenis isolat 1A5 yaitu sebesar (12,38±0,74), sedangkan terdapat lima isolat dengan penghambatan terkecil yaitu 1D1(7,40 ± 2,08), 1C3 (6,28 ± 1,21), 1A1 (7,52 ± 2,55), 2B3 (7,51 ± 1,31) dan 1B1 (7,13 ± 1,25). Keragaman penghambatan pertumbuhan bakteri uji oleh berbagai jenis isolat bakteri menunjukkan bahwa antimikroba yang dihasilkan memiliki keaktifan yang berbeda terhadap pertumbuhan bakteri ujiE. coli. Menurut Fardiaz (1989), kemampuan suatu zat antimikroba dalam menghambat pertumbuhan dipengaruhi oleh beberapa faktor, antara lain: (1) konsentrasi zat pengawet, (2) waktu penyimpanan, (3) suhu lingkungan, (4) sifat-sifat mikroba seperti jenis, umur, konsentrasi, dan keadaan mikroba, (5) sifat-sifat fisik dan kimia makanan termasuk kadar air, pH, jenis senyawa dan jenis senyawa didalamnya. Kemampuan antagonistik isolat bakteri asam laktat terhadap bakteri uji E. coli dapat dilihat pada Gambar 1.
Menurut Scheved et al. (1993) bakteri asam laktat dapat menghasilkan substansi antimikroba seperti asam-asam organik, hidrogen peroksida, dan bakteriosin. Mekanisme dari masing-masing antimikroba yang dihasilkan memiliki mekanisme yang berbeda dalam menghambat bakteri uji.
Menurut Naidu (2000), bakteri Gram positif lebih tahan terhadap asam. Hal ini sesuai dengan hasil uji konfrontasi (Tabel 7) yaitu bakteri uji Gram negatif (Salmonella typhimurium (ATCC 14028) dan Escherichia coli (ATCC 25922) memiliki diameter zona hambat yang lebih besar dibandingkan dengan bakteri uji Gram positif yaitu Staphylococcus aureus (ATCC 25923). Efek penghambatan dari asam organik terutama berasal dari jumlah asam yang tidak terdisosiasi (Jennie, 1996a). Bakteri asam laktat mempunyai hasil primer metabolitnya adalah asam laktat. Asam lipofilik seperti asam laktat dan asam asetat dalam bentuk tidak terdisosiasi dapat menembus sel mikroba (Jennie, 1996a) sehingga merubah permeabilitas membran.
Uji antagonistik supernatan isolat bakteri asam laktat 2B1, 1D1, 1C6, dan 2A2 hasil sentrifugasi dengan kecapatan 6.000 rpm tidak dapat menghambat bakteri uji E. coli, namun supernatan isolat yang sama saat dihasilkan dengan sentrifugasi dengan kecepatan 10.000 rpm dapat menghambat ketiga bakteri uji. Hal ini diduga senyawa antimikroba yang masih membentuk kumpulan dalam isolat tersebut yang disentrifugasi dengan kecepatan 6.000 rpm belum pecah sehingga aktivitas senyawa antimikroba tersebut belum optimal. Sedangkan pada supernatan isolat bakteri asam laktat 2B3, 1D2, 2D1, dan 1A32 yang dihasilkan dengan kecepatan sentrifugasi 6.000 rpm dapat menghambat ketiga bakteri uji dengan menghasilkan zona bening, sedangkan supernatan isolat yang sama saat dihasilkan dengan kecepatan sentrifugasi 10.000 rpm tidak menghasilkan zona hambat pada bakteri ujiStaphilococcus aureus. Hal ini diduga pada keempat isolat tersebut terdapat senyawa antimikroba lain selain asam organik, namun saat kecepatan sentrifugasi 10.000 rpm senyawa antimikroba yang lain mengendap, sehingga tidak dapat menghambat aktivitas bakteri uji.
Rataan diameter zona hambat yang terbentuk dari substrat antimikroba (asam organik) 12 isolat bakteri, 1A5 mempunyai penghambatan yang paling baik terhadap ketiga bakteri uji dan memiliki nilai total asam tertitrasi cukup tinggi yang
berbanding lurus terhadap nilai pH. Nilai total asam tertitrasi substrat antimikroba isolat 1A5 dapat dilihat pada Tabel 8.
Tabel 8. Nilai Total Asam Tertitrasi Substrat Antimikroba Isolat 1A5
Ulangan Volume NaOH (ml) TAT (%)
1 6,1 0,55
2 6,5 0,59
3 6,2 0,56
Rataan 6,27 0,57
Hidrogen peroksida adalah salah satu substrat antimikroba yang dihasilkan oleh bakteri. Kadar hidrogen peroksida yang dihasilkan oleh bakteri asam laktat dalam isolat bakteri asam laktat dalam penelitian ini tidak dapat diukur nilainya. Hal ini disebabkan produksi dari hidrogen peroksida yang sangat sedikit dan sifatnya yang mudah menguap (volatil).
Hidrogen peroksida dihasilkan oleh enzim NADH oksidase dan superoksidase dismutase, dimana oksigen berperan sebagai elektron akseptor ekternal dan NADH oksidase dimiliki oleh hamper semua bakteri asam laktat. Reaksi pembentukan hidrogen peroksida akan mengikat oksigen sehingga membentuk suasana anaerob yang tidak nyaman bagi bakteri aerob. Pengujian kadar hidrogen peroksida menunjukkan tidak ada hydrogen peroksida yang dapat dihitung, karena jumlahnya yang sangat sedikit dan bersifat volatil. Beberapa peneliti berpendapat bahwa hidrogen peroksida tidak dapat berakumulasi dalam jumlah banyak secara invivo, karena terdekomposisi oleh adanya peroksidase (Surono, 2004).
Bakteriosin lebih aktif pada bakteri Gram positif dibandingkan dengan Gram negatif (Vuys dan Vandame, 1994) dan mempunyai spektrum yang relatif sempit terdiri dari senyawa utama protein (Tagg et al., 1976). Bakteriosin dalam penghambatannya terlebih dahulu masuk kedalam sel sasarannya, melewati dinding atau membran sitoplasma agar dapat masuk ke dalam sel sasaran untuk menghambat bakteri (Hurst, 1983). Penelitian ini tidak metemukan bakteriosin pada 12 isolat, karena saat uji antagonistik antara 12 supernatan isolat bakteri asam laktat yang telah dinetralkan dengan bakteri uji, tidak terbentuk zona hambat.
Penentuan MIC (Minimum Inhibitory Concentration) Isolat BAL 1A5
Pengujian lebih lanjut terhadap antimikroba (asam organik) bakteri asam laktat adalah menentukan nilai MIC terhadapStaphylococcus aureus(ATCC 25923), Escherichia coli enteropatogenik (ATCC 25922), dan Salmonella typhimurium (ATCC 14028). Konfrontasi antar supernatan bebas sel dalam media nutrient broth dengan konsentrasi yang berbeda digunakan untuk penentuan MIC. Menurut Consentino et al., (1999), MIC dinyatakan sebagai konsentrasi terendah supernatan bebas sel yang dapat menghambat pertumbuhan mikroba sebanyak 90% selama inkubasi 24 jam.
Gambar 2.Minimum Inhibitory Concentration padaS. aureus
Gambar 3.Minimum Inhibitory Concentration padaE.coli
Hasil konfrontasi dari 12 isolat bakteri asam laktat yang digunakan menunjukkan bahwa isolat bakteri 1A5 memiliki aktivitas penghambatan yang paling baik. Nilai MIC substrat antimikroba isolat bakteri 1A5 dapat dilihat pada Tabel 9.
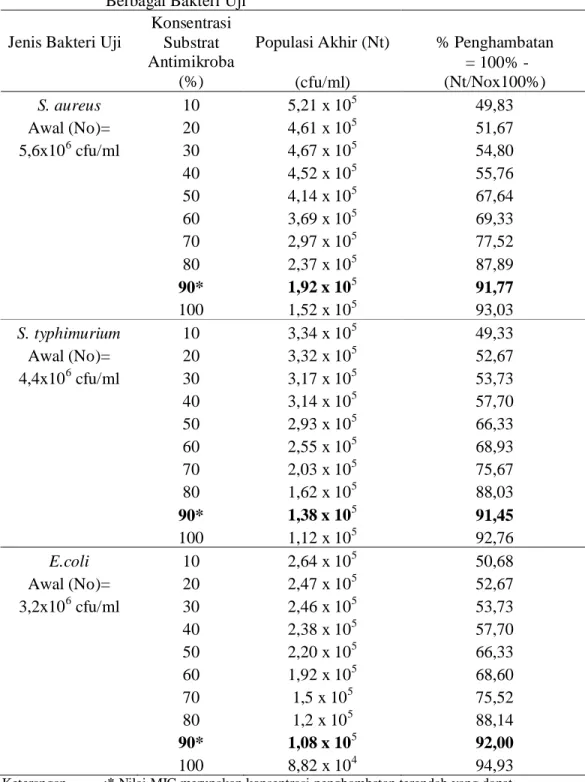
Tabel 9. Nilai MIC Substrat Antimikroba (Asam Organik) Isolat 1A5 terhadap Berbagai Bakteri Uji
Jenis Bakteri Uji Populasi Akhir (Nt) % Penghambatan Konsentrasi Substrat Antimikroba (%) (cfu/ml) = 100% -(Nt/Nox100%) S. aureus 10 5,21 x 105 49,83 Awal (No)= 20 4,61 x 105 51,67 5,6x106cfu/ml 30 4,67 x 105 54,80 40 4,52 x 105 55,76 50 4,14 x 105 67,64 60 3,69 x 105 69,33 70 2,97 x 105 77,52 80 2,37 x 105 87,89 90* 1,92 x 105 91,77 100 1,52 x 105 93,03 S. typhimurium 10 3,34 x 105 49,33 Awal (No)= 20 3,32 x 105 52,67 4,4x106cfu/ml 30 3,17 x 105 53,73 40 3,14 x 105 57,70 50 2,93 x 105 66,33 60 2,55 x 105 68,93 70 2,03 x 105 75,67 80 1,62 x 105 88,03 90* 1,38 x 105 91,45 100 1,12 x 105 92,76 E.coli 10 2,64 x 105 50,68 Awal (No)= 20 2,47 x 105 52,67 3,2x106cfu/ml 30 2,46 x 105 53,73 40 2,38 x 105 57,70 50 2,20 x 105 66,33 60 1,92 x 105 68,60 70 1,5 x 105 75,52 80 1,2 x 105 88,14 90* 1,08 x 105 92,00 100 8,82 x 104 94,93
Keterangan :* Nilai MIC merupakan konsentrasi penghambatan terendah yang dapat menurunkan pertumbuhan bakteri uji lebih dari 90%
Konsentrasi minimum penghambatan atau MIC merupakan konsentrasi terendah yang dapat menghambat pertumbuhan mikroba lebih dari 90 %. Konsentrasi minimum penghambatan masing-masing bakteri uji berbeda-beda. Kosentrasi minimum penghambatan untuk bakteri uji Staphylococcus aureus (ATCC 25923) adalah sebesar 90%. Hal ini menunjukkan bahwa konsentrasi yang dibutuhkan untuk dapat menghambatS. aureus lebih dari 90 % adalah 90% substrat antimikroba (asam organik) dari isolat bakteri 1A5. Hal ini membuktikan bahwa antimikroba (asam organik) yang dihasilkan oleh isolat bakteri 1A5 dalam penghambatan terhadap Staphylococcus aureus (ATCC 25923) kurang efektif. Gambar 2 menunjukkan bahwa semakin bening larutan menunjukkan semakin banyakStaphylococcus aureus yang dihambat oleh 1A5. Penghambatan isolat bakteri 1A5 terhadapStaphylococcus aureus dapat dilihat pada Gambar 2.
Konsentrasi minimum penghambatan untuk bakteri uji Salmonella typhimurium (ATCC 14028) adalah sebesar 90%. Hal ini menunjukkan bahwa konsentrasi yang dibutuhkan untuk dapat menghambat Salmonella typhimurium (ATCC 14028) lebih dari 90 % adalah 90% substrat antimikroba (asam organik) dari isolat bakteri 1A5. Gambar 4 menunjukkan bahwa semakin bening larutan menunjukkan semakin banyak Salmonella typhimurium yang dihambat oleh 1A5. Penghambatan isolat bakteri 1A5 terhadap Salmonella typhimurium dapat dilihat pada Gambar 4.
Konsentrasi minimum penghambatan untuk bakteri uji Escherichia coli (ATCC 25922) adalah sebesar 90%. Hal ini menunjukkan bahwa konsentrasi yang dibutuhkan untuk dapat menghambatEscherichia coli(ATCC 25922) lebih dari 90 % adalah 90% substrat antimikroba (asam organik) dari isolat bakteri 1A5. Hal ini membuktikan bahwa antimikroba (asam organik) yang dihasilkan oleh isolat bakteri 1A5 dalam penghambatan terhadap E. coli kurang efektif. Gambar 3 menunjukkan bahwa semakin bening larutan menunjukkan semakin banyakE. coli yang dihambat oleh 1A5. Penghambatan isolat bakteri 1A5 terhadap E. coli dapat dilihat pada Gambar 3.
Menurut Naufalin (2005), Nilai MIC senyawa antimikroba yang lebih rendah menunjukkan bakteri lebih sensitif terhadap senyawa tersebut. Hal ini membuktikan bahwa bakteri ujiE. coli mempunyai taraf sensitifitas yang paling tinggi dari ketiga