1 BAB I PENDAHULUAN
A. Latar Belakang
Zat pewarna tekstil sintesis yang umum digunakan adalah pewarna direct. Sifat pewarna direct adalah larut dalam air, Sehingga dapat langsung
dipakai dalam pencelupan serat selulosa seperti katun, rayon, dan rami. Pewarna direct relatif murah harganya dan mudah pemakaiannya. Pewarna direct merupakan pewarna tekstil dengan komposisi 87% azo tanpa logam, 5% azo kompleks logam, 5% stilben, oksazin 1% dan zat lain-lainnya 1% (Dede Karyana 2010: 8). Zat warna sintesis yang memiliki struktur aromatik akan sulit dibiodegradasi, khususnya zat warna reaktif karena terbentuknya ikatan kovalen yang kuat antara atom C dari zat warna dengan atom O, N atau S dari gugus hidroksi, amina atau thiol dari polimer (Christie, 2001 : 135). Zat warna reaktif adalah zat warna yang dapat mencelup serat selulosa dalam kondisi tertentu dan membentuk reaksi kovalen dengan serat (Isminingsih, 1982).
2
dapat menghilangkan kandungan semua zat warna, khususnya yang terbentuk dari pewarna-pewarna reaktif yang memiliki kelarutan tinggi dan biodegradability yang rendah (Sun et al., 2013). Sehingga dibutuhkan proses pengolahan limbah yang efektif, murah, dan aman.
Proses adsorpsi merupakan salah satu metode yang efektif untuk menghilangkan zat-zat tertentu dari limbah buangan industri. Beberapa kelebihan proses adsorpsi daripada metode lainnya adalah proses adsorpsi tidak meninggalkan lumpur, dan secara sempurna menyerap zat yang ingin dipisahkan, bahkan dari suatu larutan (Velmurugan et al., 2011). Selain itu, proses adsorpsi juga membutuhkan tempat pengolahan yang lebih kecil daripada pengolahan secara biologi, tidak dipengaruhi oleh bahan kimia beracun, dan memiliki kemampuan yang baik dalam menghilangkan kontaminan organik (Sun et al., 2013).
Menurut Eekenfelder (Syaiful, dkk., 2011) Adsorpsi adalah proses pemusatan molekul atau ion adsorbat secara fisik atau kimia pada permukaan adsorben sebagai akibat dari ketidakseimbangan gaya permukaan. Proses Adsorpsi memiliki banyak kelebihan yaitu relatif sederhana, efektifitas, dan efisiensinya tinggi serta tidak memberikan efek samping berupa zat beracun (Ii, dkk., 2012). Untuk proses adsorpsi ini perlu ada bahan adsorben yang mudah didapat.
3
pembuatan tepung ubi jalar menjadi nata yang dikenal sebagai nata de ipomoea. Nata de ipomoea tersusun dari selulosa-selulosa mempunyai situs
aktif yang memungkinkan untuk mengikat gugus aktif yang ada pada senyawa pewarna. Oleh sebab itu, perlu diteliti seberapa jauh nata de ipomoea dapat digunakan sebagai adsorben senyawa pewarna.
Proses Adsorpsi dipengaruhi oleh banyak faktor seperti kecepatan pengadukan, luas permukaan, jenis dan karakteristik Adsorben, jenis dan karakteristik adsorbat, kelarutan adsorbat, struktur molekul adsorbat dan konsentrasinya, pH, temperatur dan daya adsorpsi yang tinggi dari suatu adsorben dapat diperoleh dengan mengatur berbagai faktor yang mempengaruhi proses adsorpsi. Pada penelitian ini akan mempelajari pengaruh waktu adsorpsi dan konsentrasi zat warna terhadap daya adsorpsi pada adsorpsi direct red teknis dengan adsorben nata de ipomoea pada suhu tetap.
B. Identifikasi Masalah
Beberapa objek yang dapat dimunculkan sebagai masalah yang berkaitan dengan judul penelitian adalah:
1. Bahan yang digunakan untuk pembuatan nata. 2. Zat warna yang dipakai.
3. Variasi waktu kontak.
4 C. Pembatasan Masalah
Penelitian ini dibatasi permasalahannya agar tidak berkembang terlalu luas. Pembatasan masalah dalam penelitian ini adalah sebagai berikut:
1. Bahan yang dipakai untuk membuat nata adalah limbah tepung ubi jalar putih.
2. Zat warna yang digunakan adalah direct red teknis.
3. Variasi waktu kontaknya yaitu 10 menit; 20 menit; 30 menit; 60 menit; 90 menit; dan 120 menit.
4. Variasi konsentrasi zat warna tekstil (b/v) adalah 50 ppm; 75 ppm; 100 ppm; dan 150 ppm.
D. Perumusan Masalah
1. Berapakah waktu kontak pada adsorpsi direct red teknis dengan adsorben nata de ipomoea pada saat kesetimbangan?
2. Bagaimanakah pengaruh konsentrasi zat pewarna direct red teknis pada adsorpsi direct red teknis dengan adsorben nata de ipomoea pada saat kesetimbangan?
3. Bagaimana pola isoterm adsorpsi direct red teknis dengan adsorben nata de ipomoea?
E. Tujuan Penelitian
5
2. Mengetahui pengaruh konsentrasi zat pewarna direct red teknis pada adsorpsi direct red teknis dengan adsorben nata de ipomoea pada saat kesetimbangan.
3. Mengetahui pola isoterm adsorpsi direct red teknis dengan adsorben nata de ipomoea.
F. Manfaat Penelitian
1. Memberikan informasi adsorben alternatif untuk mengadsorpsi zat warna tekstil direct red teknis.
2. Memberi informasi waktu kontak setimbang, dan pengaruh konsentrasi zat pewarna direct red teknis pada adsorpsi direct red teknis dengan adsorben nata de ipomoea pada kesetimbangan.
6 BAB II
KAJIAN PUSTAKA
A. Deskripsi Teori 1. Ubi jalar
Ubi jalar memiliki nama latin Ipomoea batatas (L.) Lam., tergolong family Convolvulaceae (suku kangkung-kangkungan) yang terdiri dari tidak kurang 400 galur (species). Namun dari sekian banyak galur ini, menurut Onwueme (1978) hanya ubi jalar yang mempunyai nilai ekonomis sebagai bahan pangan. Nama ubi jalar berbeda-beda di tiap negara. Di Spanyol dan Philipina dikenal dengan nama camote, di India shaharkuand, kara-imo di Jepang, anamo di Nigeria, getica di Brazil, apichu di Peru dan ubitora di Malaysia. Di Indonesia sendiri ada berbagai sebutan untuk ubi jalar seperti: Mantang di Banjar Kalimantan; Hui atau Boled di Jawa Barat; Ketela rambat atau Muntul di daerah Jawa Tengah dan Jawa Timur.
Tanaman ini dapat diusahakan di berbagai tempat, baik dataran rendah maupun dataran tinggi/pegunungan, serta di segala macam tanah. Tetapi yang paling cocok dan potensial, dengan hasil produksi yang bagus dan tinggi adalah di tanah pasir berlempung yang gembur dan halus. Tanah dengan pH 5.6-6.6 lebih disukai untuk pertumbuhannya. Suhu rata-rata optimal 24-25°C dengan distribusi hujan yang baik pada kisaran curah hujan 750-1250 mm. Menurut beberapa referensi, sistematika tanaman Ubi jalar (Ipomoea batatas (L.) ) adalah sebagai berikut:
7 Ordo : Solanales
Famili : Convolvulaceace Genus : Ipomoea
Spesies : Ipomoea batatas
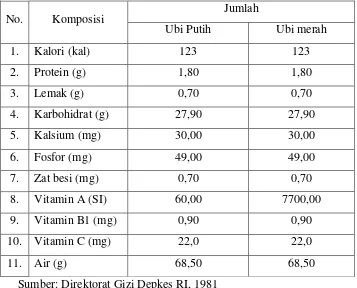
Berdasarkan jumlah total produksi ubi jalar dunia, Indonesia merupakan negara penghasil kedua terbesar setelah Cina. Sekitar 98% pertanaman ubi jalar dunia berada di negara-negara berkembang dengan distribusi : China 80%, negara negara Asia lainnya 6%, Afrika 5% dan Amerika Latin 2%. Perkembangan produksi ubi jalar di Indonesia menunjukkan angka yang kurang menggembirakan karena kurangnya dukungan dari industri pengolahan ubi jalar menjadi produk yang lebih disukai masyarakat. Selain ubi jalar berdaging putih dan merah yang sudah umum dimanfaatkan, pada saat ini telah banyak pula dilakukan pengolahan ubi jalar berdaging ungu, terutama sebagai makanan fungsional karena kandungan antioksidannya (berupa antosianin) yang tinggi. Kandungan gizi ubi jalar segar dapat dilihat pada Tabel 1.
2. Starter/Bibit nata (Acetobacter xylinum)
Klasifikasi ilmiah bakteri Acetobacter xylinum sebagai berikut: Kerajaan : Bacteria
Filum : Proteobacteria
8 Familia : Psedomonadaceae Genus : Acetobacter xylinum
Tabel 1. Kandungan gizi dalam 100 gram ubi jalar segar
No. Komposisi Jumlah
Ubi Putih Ubi merah
1. Kalori (kal) 123 123
2. Protein (g) 1,80 1,80
3. Lemak (g) 0,70 0,70
4. Karbohidrat (g) 27,90 27,90
5. Kalsium (mg) 30,00 30,00
6. Fosfor (mg) 49,00 49,00
7. Zat besi (mg) 0,70 0,70
8. Vitamin A (SI) 60,00 7700,00
9. Vitamin B1 (mg) 0,90 0,90
10. Vitamin C (mg) 22,0 22,0
11. Air (g) 68,50 68,50
Sumber: Direktorat Gizi Depkes RI, 1981
Bibit murni bakteri Acetobacter xylinum dapat kita peroleh dibalai penelitian kimia. Namun jauhnya letak balai penelitian dari pemukiman penduduk, ditambah birokrasi yang terkesan berbelit dan panjang membuat masyarakat awam merasa enggan (Marlinda, 2003: 18).
9
Namun selain dibalai penelitian kimia, kita dapat mendapatkan starter dengan membeli kultur jaringan Acetobacter Xylinum. 1 ose dapat diperbanyak menjadi 1 liter starter. Cara membuat starter dari kultur jaringan sebagai berikut:
a. satu ose kultur jaringan dimasukan dalam Erlenmeyer yang telah berisi media. Media kultur jaringan terdiri dari 100 ml air kelapa, gula pasir 5-10%, ammonium sulfat 0.03% dan kondisi pH sekitar 4-4,5 (Asam Cuka 5% 50 ml). Pastikan semua peralatan yang dipakai sudah steril dan bersih. b. Kemudian tutup dengan kain Saug/kertas HVS.
c. Didihkan selama 15-30 menit.
d. Setelah mendidih, diinkubasi pada suhu kamar selama 3-4 hari. Kemudian tumbuh pelikel (calon nata).
e. Setelah tumbuh pelikel, starter dapat diperbanyak sesuai kebutuhan.
3. Selulosa bakteri (Nata)
Selulosa bakteri (nata) adalah polimer yang sebagian besar terdiri dari selulosa, berbentuk agar dan berwarna putih. Massa ini berasal pertumbuhan Acetobacter xylinum pada permukaan media cair yang asam dan mengandung gula. (Afrizal, 2008).
Pemberian nama nata tergantung pada jenis substrat pertumbuhan Acetobacter xylinum, sehingga nama dari nata yang berbahan baku dari ubi
10
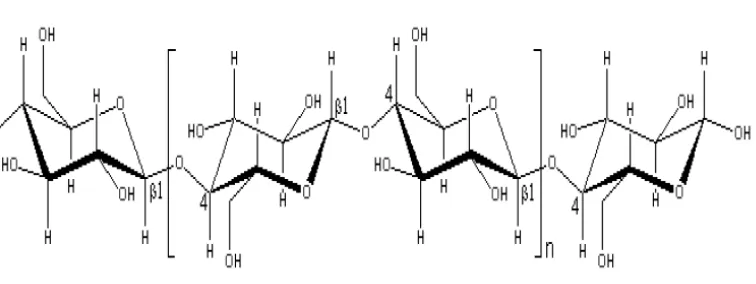
bentukan mikroorganisme Acetobacter xylinum. Struktur kimia selulosa sebagai berikut:
Gambar 1. Struktur Kimia Selulosa
11
dalam pembentukan kofaktor enzim ekstraseluler yang dihasilkan oleh bakteri Acetobacter xylinum (Pambayun, 2002). Nata merupakan makanan berkalori rendah karena mengandung serat tinggi hasil sintesis gula oleh bakteri Acetobacter xylinum berbentuk agar, berwarna putih dan mengandung air (Jannur majesty, dkk., 2015).
4. Adsorpsi
Adsorpsi adalah proses proses melekatnya partikel-partikel atau zat-zat pada permukaan. Adsorpsi terjadi jika gaya tarik menarik antara zat terlarut dengan permukaan penyerap dapat mengatasi gaya tarik menarik antara pelarut dengan permukaan. Zat atau molekul yang terserap kepermukaan disebut adsorbat sedangkan zat atau molekul yang menyerap disebut adsorben. (Sukardjo, 1989 : 190). Pada proses adsorpsi dalam larutan jumlah zat yang teradsorpsi tergantung dari jenis adsorben, temperatur, dan juga tekanan (Atkin, 1997: 190-191). Adapun Adsorpsi dapat terjadi melalui dua cara yaitu:
a. Adsorpsi fisik (fisisorpsi)
12
permukaan yang polar dan non polar. Adsorpsi juga mungkin terjadi dengan mekanisme pertukaran ion. Permukaan padatan dapat mengadsorpsi ion-ion dari larutan dengan mekanisme pertukaran ion. Karena itu ion pada gugus senyawa permukaan padatan adsorbennya dapat bertukar tempat dengan ion-ion adsorbat. Mekanisme pertukaran ini merupakan penggabungan dari mekanisme kemisorpsi dan fisisorpsi, karena adsorpsi jenis ini akan mengikat ion-ion yang diadsorpsi dengan ikatan secara kimia, tetapi ikatan ini mudah dilepas kembali untuk dapat terjadinya pertukaran ion (Atkin, 1982: 206). Banyak zat yang teradsorpsi dalam proses adsorpsi fisik berupa lapisan monomolekul dan banyak adsorpsi fisik akan makin kecil dengan naiknya suhu (atkins, 1997: 437). b. Adsorpsi kimia (kemisorpsi)
Adsorpsi kimia dapat terjadi bila terdapat interaksi kimia antara molekul zat yang teradsorpsi dengan molekul adsorben. Pada adsorpsi ini melibatkan pertukaran elektron antara molekul yang teradsorpsi dengan permukaan. Panas yang dihasilkan pada kemisorpsi lebih besar dari panas yang dihasilkan pada fisisorpsi, yaitu 40 Kj/mol. Ikatan yang terjadi adalah ikatan kovalen atau ionik, atau keduanya.
13
organik lebih baik dibandingkan dengan perlakuan biologi yang konvensional. Faktor-faktor yang mempengaruhi adsorpsi ialah (Cornel Miller, 1995: 25) struktur dan konsentrasi zat kimia (adsorbat), struktur dan konsentrasi adsorben, pH media, ukuran partikel, kapasitas pertukaran elektron, dan suhu.
Menurut Adamson (1990), faktor-faktor yang mempengaruhi adsorpsi antara lain:
1.) Luas permukaan adsorben
Luas permukaan berkaitan dengan struktur kristal, jumlah dan ukuran pori yang ada pada adsorben. Jumlah pori yang banyak dan lebar akan memperbesar kapasitas adsorpsi. Semakin besar luas permukaan adsorben maka semakin besar pula kapasitas dan laju adsorpsinya.
2.) Sifat dan konsentrasi adsorben
14 3.) Sifat dan konsentrasi adsorbat
Sifat-sifat adsorbat dapat dikatakan sebagai faktor terpenting yang menentukan perilaku adsorpsi. Sifat-sifat adsorben antara lain: struktur molekul, jumlah dan posisi gugus fungsi, dan jenis gugus fungsi fungsional. Semakin tinggi konsentrasi adsorbat, maka laju adsorpsi akan semakin cepat, namun pada kondisi tertentu akan stabil karena sudah jenuh sehingga terjadi proses kesetimbangan.
4.) Temperatur/suhu
Perubahan suhu dapat mempengaruhi perilaku dengan cara mengubah karakter komponen dasar sistem adsorpsi, seperti sifat kimia adsorbat dan muatan permukaan adsorben. Adsorpsi merupakan proses eksotermik, maka bila dalam kesetimbangan kapasitas adsorpsi akan menurun sejalan dengan kenaikan. Suhu meningkat menyebabkan reaktivitas energi ion semakin besar sehingga lebih banyak ion yang dapat melewati tingkat energi untuk melakukan interaksi secara kimia dengan pori-pori permukaan. Disamping itu reaktifitas ion yang semakin besar akan meningkatkan pula difusi ion dalam pori-pori adsorben.
5.) Pengaruh pH dan adsorpsi hidrolitik
15
afinitas lebih besar terhadap permukaan. Sebaliknya, pada pH tinggi permukaan cenderung bermuatan negatif, dan afinitas anion menjadi lemah karena tolakan elektrostatis, dan mengakibatkan rendahnya daya adsorpsi adsorbat. Terjadinya hidrolisis adsorbat oleh pelarut akan membentuk asam atau basa yang banyak teradsorpsi secara hidrolitik. Menurut Adamson (1990), proses adsorpsi terbagi menjadi 4 tahap yaitu:
1.) Transfer molekul-molekul zat terlarut yang teradsorpsi menuju lapisan film yang mengelilingi adsorben.
2.) Difusi zat terlarut yang teradsorpsi melalui lapisan film (film diffusion process).
3.) Difusi zat terlarut yang teradsorpsi melalui kapiler/pori dalam adsorben (pore diffusion process).
4.) Adsorpsi zat terlarut yang teradsorpsi pada dinding pori atau permukaan adsorben (proses adsorpsi sebenarnya).
5. Pewarna Direct red teknis
Pada tahun 1876 Otto Witt mengusulkan teori tentang zat warna, bahwa
16
Bila kromofor berikatan dengan sistem aromatik akan diperoleh senyawa yang berwarna, contohnya azo benzena berwarna orange, gabungan sistem aromatik dan kromofor tersebut disebut kromogen (Dede karyana, 2010: 1-2). Kromogen seperti azo benzena belum bisa dipakai sebagai zat warna karena intensitas warnanya rendah dan belum mempunyai daya celup tetapi bila dimasukkan satu atau lebih gugus auksokrom maka akan menjadi zat warna. Dilthey dan Wizinger mengemukakan bahwa auksokrom ada yang bersifat donor elektron dan ada juga yang bersifat penarik elektron. Bila auksokrom pemberi elektron diletakan pada arah berlawanan dengan auksokrom penarik elektron dalam struktur molekul zat warna maka akan memperbesar sistem konjugasi zat warna, sehingga selain meningkatkan intensitas warna juga akan menimbulkan efek batokromik, yaitu panjang gelombang maksimum (λ maks) zat warnanya akan semakin besar (Dede
karyana, 2010:1-2).
Pewarna direct bersifat larut dalam air, sehingga dapat langsung dipakai dalam pencelupan serat selulosa seperti katun, rayon, dan rami. Zat warna direct red relatif murah dan mudah dalam pemakaiannya, namun warnanya kurang cerah dan tahan luntur hasil celupannya kurang baik. Pewarna direct merupakan pewarna tekstil dengan komposisi 87% azo tanpa logam, 5% azo kompleks logam, 5% stilben, oksazin 1% dan zat lain-lainnya 1% (Dede karyana, 2010: 8-9).
17
degradasinya dibutuhkan waktu yang lama. Senyawa azo bila terlalu lama berada di lingkungan dapat menjadi sumber penyakit karena sifatnya karsinogen dan mutagenik. Penggolongan limbah pewarna pada tekstil sulit dilakukan karena struktur aromatis pada pewarna yang sulit dibiodegradasi, khususnya zat warna reaktif karena terbentuknya ikatan kovalen yang kuat antara atom C dari zat warna dengan atom C dari zat warna dengan atom O, N, atau S dari gugus hidroksi, amina atau thiol dari polimer (Christie, 2001: 135).
Zat warna reaktif pertama kali diproduksi tahun 1956. Zat warna jenis ini pada aplikasinya sulit dihilangkan karena adanya ikatan kovalen yang kuat antara atom karbon dari zat warna dengan atom O, N, atau S dari gugus hidroksi, amino atau thiol dari polimer. Zat warna reaktif mempunyai berat molekul yang relatif kecil.
Keuntungan zat warna reaktif adalah spektra absorpsinya tajam dan jelas, strukturnya relatif sederhana, dan warnanya lebih terang (Hunger K, 2003). Zat warna reaktif adalah suatu zat warna yang dapat mengadakan reaksi dengan serat, sehingga zat warna tersebut merupakan bagian dari serat. Oleh karena itu hasil celupan zat warna reaktif mempunyai ketahanan cuci yang sangat baik (Rasyid Djufri, 1976: 92).
Menurut pemakaiannya zat warna reaktif dapat pula dibagi menjadi: a. Pemakaian secara dingin, yaitu zat warna reaktif yang mempunyai
kereaktifan tinggi.
18 kereaktifan rendah.
Adapun struktur kimia zat warna direct red ditunjukkan pada gambar 2.
S O
O- O
OH S N N O O -O O NH NH O N N O -C H3 S S O O -O O O -O Na+ Na+ Na+ Na+
Gambar 2. Struktur Pewarna tekstil tipe Direct Red 79
6. Spektroskopi UV-Vis
Bila cahaya UV-tampak (UV-Vis) dikenakan pada senyawa, maka sebagian dari cahaya tersebut diserap oleh molekul yang mempunyai tingkatan energi yang spesifik (Marham Sitorus, 2009: 8). Spektrum cahaya oleh molekul dalam daerah spektrum ultraviolet dan terlihat tergantung pada struktur elektronik dari molekul. Spektra ultraviolet dan terlihat dari senyawa-senyawa organik berkaitan erat erat dengan transisi-transisi diantara tingkatan-tingkatan tenaga elektronik (Hardjono, 1991: 11). Absorpsi radiasi oleh suatu sampel diukur pada berbagai panjang gelombang dan informasi ini diteruskan ke perekam untuk menghasilkan spektrum UV-Vis (Fessenden & Fessenden, 1999: 437).
19
dengan yang dibutuhkan oleh transisi elektronik (Silverstein, Blassler, & Morrill, 1986: 306-307). Absorbansi pada panjang gelombang tertentu didefinisikan sebagai:
A = log Keterangan: A = absorbansi
I0 = intensitas radiasi yang datang I = intensitas radiasi yang diteruskan
Absorbansi suatu senyawa dengan panjang gelombang tertentu bertambah dengan makin banyaknya molekul yang mengalami transisi (Fessenden & Fessenden, 1999: 437-439).
Sinar ultraviolet (UV) mempunyai panjang gelombang antara 200-400 nm, sedangkan untuk sinar tampak (visibel) mempunyai panjang gelombang 400-750 nm. Konsentrasi dari analit di dalam larutan bisa ditentukan dengan mengukur absorban pada panjang gelombang tertentu dengan mengunakan hokum Lambert-Beer (Rohman, 2007).
Hukum Lambert-Beer menyatakan hubungan antara serapan dan panjang jalan melewati medium yang menyerap, dan hubungan antar konsentrasi species penyerap dan tingkat absorpsi. Hukum ini menyatakan absorban zat terlarut adalah proposional dengan konsentrasi. Hubungannya secara matematis dapat dinyatakan sebagai berikut:
20 Keterangan:
A : Absorbansi
ε : koefisien absorbansi molar
C : konsentrasi larutan (mol/L-1) b : Tebal Kuvet
Dari persamaan lambert-beer, ada hubungan antara A (absorbansi) dan C (konsentrasi) dengan adanya persamaan regresi larutan standar Y = bx + a, dimana Y adalah absorbansi, dan X adalah konsentrasi. Dengan mengalurkan Absorbansi yang terukur spektrometer UV-Vis, kita dapat mengetahui konsentrasi sampel.
7. Spektroskopi Infra Merah
Bila sinar inframerah dilewatkan melalui cuplikan senyawa organik, maka sejumlah frekuensi diserap sedang frekuensi yang lain diteruskan atau ditransmisikan tanpa diserap (Hardjono, 2007: 45). Sinar inframerah berada pada kisaran panjang gelombang 1–100 µm. Daerah 0,7–2,5 µm disebut inframerah dekat dan daerah 14,3–50 µm disebut inframerah jauh. Daerah yang paling berguna untuk mengenal struktur senyawa adalah daerah 2,5–15 µm (Silverstein, 1986: 95).
21
mengalami vibrasi dan osilasi. Bila molekul tersebut menyerap radiasi inframerah, maka Molekul akan terjadi kenaikan amplitudo vibrasi. Selain itu, Molekul akan berada dalam keadaan vibrasi tereksitasi. Panjang gelombang dari absorpsi oleh suatu tipe ikatan tertentu, tergantung pada macam vibrasi dari ikatan tersebut. Oleh karena itu, tipe ikatan yang berbeda menyerap radiasi inframerah pada panjang gelombang karakteristik yang berlainan (Fessenden & Fessenden, 1999: 315). Pada suhu biasa molekul-molekul organik dalam keadaan vibrasi yang tetap, setiap ikatan mempunyai frekuensi rentangan/stretching dan bending yang karakteristik dan dapat menyerap pada frekuensi tersebut (Hardjono, 2007: 48).
Untuk menginterpretasikan spektrum inframerah secara sederhana dapat dilakukan dengan mengetahui harga dasar serapan gugus fungsional/ikatan. Harga dasar serapan inframerah untuk beberapa tipe ikatan dapat dilihat pada Tabel 2. (Hardjono, 1992:14).
Tabel 2. Harga Dasar Serapan Inframerah untuk Beberapa Tipe Ikatan Tipe Ikatan Frekuensi (cm-1) Panjang Gelombang (µ)
OH 3600 2,8
NH 3500 2,9
CH 1100, 3000 9,1; 3,3
C≡N 2250 4,4
C≡C 2150 4,6
C=O 1715 5,8
C=C 1650 6,1
22
lingkungan yang sedikit berbeda, sehingga serapan infra merah atau spektrum infra merahnya juga berbeda (Harjono Sastrohamidjojo, 1992: 3-4)
Menurut fengel dan Wegener (Astika, 2006) menyatakan bahwa gugus fungsi pada rantai selulosa adalah gugus hidroksil yang terikat pada setiap unit selulosa. Adanya gugus hidroksil ini akan menentukan sifat kimia dan kimia bagi selulosa.
8. Isoterm Adsorpsi
Menurut Kusmiyati, dkk. (2012) isoterm adsorpsi menggambarkan keadaan kesetimbangan adsorpsi dengan perbedaan konsentrasi adsorben dalam larutan pada temperatur yang tetap. Keadaan setimbang adalah suatu keadaan dinamis yang tercapai ketika laju partikel teradsorpsi ke permukaan sama dengan laju desorpsinya (Lenny, 2012). Pola isoterm adsorpsi ada dua yaitu isoterm adsorpsi Langmuir dan isoterm adsorpsi Freundlich.
a. Isoterm Adsorpsi Langmuir
Menurut Zawani (I. Hartati, dkk., 2011) isoterm adsorpsi Langmuir mengasumsikan semua sisi permukaan adsorben mempunyai energi yang sama dan penangkapan adsorbat hanya pada lapisan pertama serta tidak terjadi proses migrasi adsorbat di permukaan adsorben. Persamaan isoterm adsorpsi Langmuir dapat ditulis sebaigai berikut:
23
Persamaan (1) jika diubah menjadi bentuk linear maka akan diperoleh persamaan sebagai berikut:
... (8)
Keterangan
qe = Jumlah zat terlarut yang teradsorps per gram Adsorben pada kesetimbangan(mg/gram)
Qo = Jumlah zat terlarut yang teradsorps per gram Adsorben membentuk lapis tunggal (mg/gram)
Ce = Konsentrasi larutan akhir atau pada kesetimbangan (ppm) b = Konstanta kapasitas Langmuir
Grafik isoterm adsorpsi Langmuir didapatkan dengan mengalurkan C,/q, dan Ce yang akan menghasilkan garis lurus dengan kemiringan atau slope 1/Qo dan intersep 1/b Qo seperti pada Gambar 3.
Gambar 3.Grafik isoterm adsorpsi Langmuir 1/b Q0
1/Q0 = tan α
Ce
24 b. Isoterm Adsorpsi Freundlich
Isoterm Freundlich biasanya digunakan untuk menggambarkan karakteristik adsorpsi pada permukaan heterogen (I. Haryati, dkk., 2011: 28). Persamaan isoterm adsorpsi Freundlich dapat ditulis sebagai berikut:
...(9) Persamaan (3) jika diubah menjadi bentuk linear maka akan diperoleh
persamaan sebagai berikut:
………...………..(10)
Keterangan
qe = Jumlah zat terlarut yang teradsorp per gram adsorben pada kesetimbangan (mg/gram)
Ce = Konsentrasi larutan akhir atau pada kesetimbangan (ppm) k = Konstanta kapasitas Freundlich
n = Konstanta intensitas adsorpsi
Gambar 4. Grafik isoterm adsorpsi Freundlich Log k
log Ce
25
Grafik isoterm adsorpsi Freundlich didapatkan dengan mengalurkan log qe dan log Ce yang akan menghasilkan garis lurus dengan kemiringan atau slope 1/n dan intersep log k seperti pada Gambar 4.
B. Penelitian yang Relevan
Lijuan Wang dan Jian Li (2013) mengunakan selulosa dari jerami padi untuk mengadsorpsi pewarna CI Reactive Red 228 yang memperoleh kapasitas maksimum selulosa jerami padi untuk adsorpsi Reactive Red 228 adalah 190 mg/g pada pH 3 dengan konsentrasi 0,4 g/L dan konsentrasi awal 80 mg/L. Proses adsorpsi dan keseimbangan CI Reactive Red 228 yang baik dilengkapi model kinetik pseudo dan model langmuir masing-masing orde kedua.
Yusra Safa, dan Haq Nawaz Bhatti (2011) mengunakan arang sekam padi untuk menghilangkan Direct red 31 dan direct orange 26 dalam model batch. Penelitian dilakukan dengan fungsi dari pH, konsentrasi biosorben, ukuran partikel biosorben, konsentrasi pewarna awal, waktu kontak dan suhu. Hasil penelitian menunjukan bahwa model langmuir memberikan korelasi terbaik dari data eksperimen untuk kedua pewarna.
C. Kerangka Berfikir
26
Penggunaan pewarna sintetik dapat menyebabkan percemaran lingkungan karena pewarna sintetik mengandung gugus amina seperti azo yang sulit didegradasi.
Pengelolaan limbah multak diperlukan oleh sebab itu perlu dicari
pengelolaan limbah alternatif. Pengelolahan Adsorpsi merupakan salah satu cara yang dipilih dalam penelitian ini. Pada proses adsorpsi ini mengunakan adsorben yang dihasilkan dari bahan adsorben alternatif. Bahan adsorben alternatif yang digunakan harus murah dan mudah didapatkan.
Limbah air tepung ubi jalar ialah bahan yang sudah terpakai dan termasuk limbah rumah tangga. Limbah ini mengandung pati yang cukup besar. Semua bahan yang mengandung pati sangat berpotensi untuk dijadikan bahan dalam pembuatan selulosa bakteri (nata). Nata yang dihasilkan yang terbuat dari pati yang berasal dari air limbah tepung ubi jalar dinamakan nata de ipomoea. Nata de ipomoea mempunyai gugus-gugus alkohol yang
memiliki potensi untuk digunakan sebagai adsorben alternatif. Sehingga adsorben pada penelitian ini adalah Nata de ipomoea.
27
28 BAB III
METODE PENELITIAN
A. Subjek dan Objek Penelitian 1. Subjek Penelitian
Subjek dalam penelitian ini adalah nata de ipomoea. 2. Objek Penelitian
Objek penelitian ini adalah daya adsorpsi direct red Teknis.
B. Variabel Penelitian 1. Variabel Bebas
Variabel bebas dari penelitian ini: a. Waktu kontak
b. Konsentrasi zat pewarna direct red teknis 2. Variabel terikat
Variabel terikat dari penelitian ini adalah
Daya adsorpsi nata de ipomoea terhadap pewarna direct red teknis
C. Alat dan Bahan Penelitian 1. Alat
a. Neraca analitik b. Stopwatch c. Magnetic stirrer
29 e. Beker gelas 100 ml
f. Labu takar 1000 ml g. Labu takar 250 ml h. Labu takar 100 ml i. Gelas ukur 100 ml j. Spatula
k. Pipet Volume 1 ml, 5 ml, 25 ml. l. Aluminium foil
m. Kaca arloji n. Kertas saring o. Pipet tetes p. botol flavon q. Corong biasa
r. Spektroskopi UV-Vis s. Spektroskopi IR
2. Bahan Penelitian a. Ubi jalar
b. Starter bakteri Acetobacter xylinum
c. Serbuk direct red teknis d.Gula pasir
30 g. Alkohol teknis
D. Prosedur Penelitian
1. Pembuatan Nata de ipomoea
a. Ubi jalar dicuci sampai bersih dari tanah, dikupas kulitnya, kemudian diparut.
b. Parutan ubi jalar yang sudah halus direndam dalam air selama 12 jam, setelah itu menyaring dan memerasnya untuk mendapat sari patinya. Sebelum dididihkan Air sari pati ubi jalar harus terbebas dari kotoran dan serat-serat.
c. 1 Liter air sari pati ubi jalar dimasukkan kedalam panci. Perebusan dilakukan sampai mendidih. setelah mendidih masukan gula pasir (dalam1 liter air rebusan ditambahkan gula 100 gr).
d. Air rebusan yang telah dimasukkan gula pasir di aduk sampai larut dengan sempurna.
e. Setelah larut sempurna, air rebusan dimasukan kedalam loyang. Pastikan bahwa loyang dalam kondisi bersih dan steril.
f. Setelah itu air rebusan didinginkan.
31
h. Loyang ditutup rapat dengan mengunakan Koran dan pastikan Koran dalam kondisi bersih dan steril. Sehingga tidak mengganggu pertumbuhan nata de ipomoea.
i. Hindari loyang agar tidak mengalami goncangan, bila ingin melihat hasilnya, dapat dilihat pada hari ke 3.
j. Loyang hasil pembibitan dibiarkan selama 1 minggu.
k. Kemudian merendam hasil nata untuk menghilangkan keasamannya selama 2 hari.
l. Pada hari ke 9, nata dapat dipanen.
2. Pembuatan adsorben dari Nata de ipomoea
a. Nata yang sudah dipanen dikeringkan sampai kering.
b. Setelah kering, Nata di cuci dengan alkohol untuk mencegah tumbuhnya jamur.
c. Nata dijemur sampai kering.
d. Nata yang sudah kering, dipotong kecil-kecil.
e. Potongan nata yang telah dipotong kecil-kecil untuk digunakan sebagai adsorben.
3. Pembuatan larutan direct red teknis
32
dibutuhkan adalah 1000 mg dilarutkan dengan akuades kemudian dimasukan dalam labu takar 1000 mL dan diencerkan sampai tanda.
b. Larutan induk kemudian diencerkan untuk mendapatkan larutan standar 10 ppm, 20 ppm, 30 ppm,40 ppm, 50 ppmdan 60 ppm mengunakan rumus pengenceran sebagai berikut:
x = x
Keterangan:
= Volume larutan standar yang diencerkan = Konsentrasi larutan yang diencerkan (ppm) = Volume larutan hasil pengenceran
= Konsentrasi larutan hasil pengenceran (ppm)
4. Proses adsorpsi pewarna direct red teknis
a. Penentuan waktu kontak pada massa dan konsentrasi pewarna tetap. 1.) Larutan zat warna direct red teknis dengan konsentrasi 100 ppm
sebanyak 100 ml dibuat dengan melakukan pengenceran 10 ml larutan induk 1000 ppm dalam labu ukur 100 ml.
2.) Adsorben Nata de ipomoea ditimbang sebanyak 1 gram dimasukan ke dalam erlenmeyer 250 ml.
33
4.) Larutan zat warna direct red teknis dengan konsentrasi 100 ppm sebanyak 100 ml dimasukan Erlenmeyer 250 ml.
5.) Larutan diaduk dengan magnetic stirrer selama 2 menit, setelah itu didiamkan pada variasi waktu adsorpsi selama 10 menit.
6.) Setelah waktu perendaman selesai. Adsorben Nata de ipomoea dipisahkan dengan larutan zat warna direct red.
7.) Kemudian filtratnya diukur absorbansinya.
8.) Pengulangan kembali langkah a s/d e untuk variasi waktu kontak nata de ipomoea dengan variasi waktu yang lain yaitu 20 menit; 30 menit; 60
menit; 90 menit; dan 120 menit.
9.) Setelah itu kita dapat melakukan perhitungan daya adsorpsinya untuk membuat kurva variasi waktu kontak terhadap daya adsorpsinya.
b. Penentuan konsentrasi pewarna optimum pada saat massa adsorben tetap dan waktu kontak tetap.
1.) Adsorben Nata de ipomoea ditimbang sebanyak 1 gram dimasukan ke dalam erlenmeyer 250 ml.
2.) kemudian masukan batang stirrer.
3.) Larutan zat warna direct red teknis dengan konsentrasi 50 ppm sebanyak 100 ml dimasukan Erlenmeyer 250 ml.
4.) Larutan diaduk dengan magnetic stirrer selama 1 jam.
34 6.) Filtrat diukur absorbansi.
7.) Pengulangan kembali langkah a s/d e untuk variasi konsentrasi 75 ppm, 100 ppm, 125 ppm dan 150 ppm.
8.) Setelah itu kita dapat melakukan perhitungan daya adsorpsinya untuk membuat kurva variasi konsentrasi terhadap daya adsorpsinya. dan pola isotermnya.
E. Teknik Pengumpulan Data
Data yang diperoleh dari penelitian berupa data kualitatif maupun kuantitatif. 1. Data Kualitatif
Data kualitatif hasil analisis dengan spektroskopi inframerah (FTIR) untuk mengetahui gugus-gugus yang terdeteksi pada adsorben nata de ipomoea sebelum dan sesudah adsorpsi.
2. Analisis Kuantitatif
Data kuantitatif berupa absorbansi larutan dianalisis dengan spektroskopi UV-VIS guna menghitung konsentrasi sebelum dan sesudah adsorpsi pada variasi waktu kontak dan konsentrasi pewarna direct red teknis pada adsorpsi pewarna direct red teknis.
F. Teknik Analisis Data
1. Penentuan Persamaan Garis Regresi.
35 Y = aX + b
a = ∑ ∑ ∑
∑ ∑ b =
∑ ∑ ∑ ∑ ∑ ∑
Keterangan:
Y = absorbansi larutan.
X = konsentrasi sisa larutan sampel a = koefisien kemiringan / slope b = tetapan larutan standar / intersep n = jumlah larutan sampel
2. Penentuan Konsentrasi Pewarna Direct Red Teknis.
Untuk menentukan konsentrasi pewarna direct red teknis akhir setelah proses adsorpsi dapat dilakukan dengan mensubstitusikan pada persamaan garis regresi linier yang sudah diperoleh. Selanjutnya masing-masing harga absorbansi dari larutan sampel dimasukkan kedalam persamaan: Y = aX + b atau X =
Berdasarkan rumus perhitungan tersebut maka konsentrasi pewarna direct red teknis dalam larutan dapat ditentukan. Perhitungan ini dilakukan
36 3. Perhitungan Daya Adsorpsi
qe =
qt =
Keterangan:
qe =Jumlah zat terlarut yang teradsorp per gram adsorben (daya adsorpsi) pada kesetimbangan (mg/gram)
qt =Jumlah zat terlarut yang teradsorp per gram adsorben (daya adsorpsi) pada waktu ke-t (mg/gram)
V = Volume larutan adsorbat (Liter) W = Massa Adsorben (gram)
Co = Konsentrasi sampel sebelum diadsorpsi (mg/L) Ce = Konsentrasi sampel sesudah diadsorpsi (mg/L) pada kesetimbangan
Ct = Konsentrasi yang teradsorpsi = C awal – C akhir = A mg/L Daya adsorpsi ialah konsentrasi teradsorpsi (mg) / massa adsorben (gram)
37
BAB IV
HASIL PENELITIAN DAN PEMBAHASAN
A. Hasil Penelitian
1. Panjang Gelombang Maksimum (λ maks) Larutan Direct Red Teknis Penentuan panjang gelombang maksimum (λ maks) dengan mengukur absorbansi sembarang konsentrasi (ppm) pada panjang gelombang 350-700 nm mengunakan spektrofotometer UV-VIS. Pada pengukuran ini, konsentrasi yang diukur adalah 100 ppm. Panjang λ maks larutan pewarna
direct red teknis yang telah terukur adalah 512 nm. Absorbansi yang
muncul pada 512 nm ialah 1,234. kurva panjang gelombang maksimumnya dapat dilihat pada Gambar 5.
38
2. Kurva Standar Larutan Pewarna Direct Red Teknis
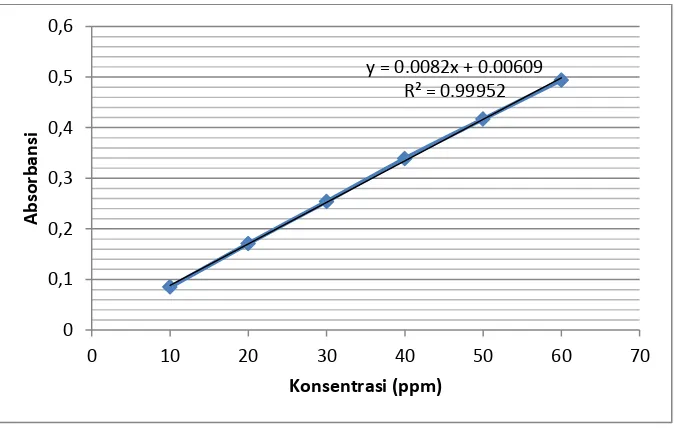
[image:38.595.153.491.483.697.2]Penentuan kurva standar larutan pewarna direct red teknis ditentukan dengan mengukur absoransi larutan pewarna yaitu 10, 20, 30, 40, 50, dan 60 ppm. Kemudian diukur absorbansinya mengunakan spektrofotometer UV-VIS pada panjang gelombang (λ) maksimum 512 nm. Untuk data absorbansi larutan standar pewarna direct red teknis dapat dilihat pada Tabel 3:
Tabel 3. Data absorbansi larutan standar pewarna direct red teknis
Konsentrasi (ppm) Absorbansi
10 0,085
20 0,171
30 0,254
40 0,339
50 0,417
60 0,494
Dari data pada Tabel 3 dapat dibuat kurva antara absorbansi terhadap konsentrasi larutan standar pewarna direct red teknis.
Gambar 6. Kurva larutan standar pewarna direct red teknis y = 0.0082x + 0.00609
R² = 0.99952
0 10 20 30 40 50 60 70
0 0,1 0,2 0,3 0,4 0,5 0,6
Konsentrasi (ppm)
A
b
sor
b
an
39
Setelah diplotkan diperoleh persamaaan liniernya yaitu persamaan garisnya : Y = 0,00820 X + 0.00609 dengan nilai R yaitu 0,99952.
3. Penentuan Waktu Kontak Pada Adsorpsi Direct Red Teknis Dengan Adsorben Nata De Ipomoea Pada Saat Kesetimbangan.
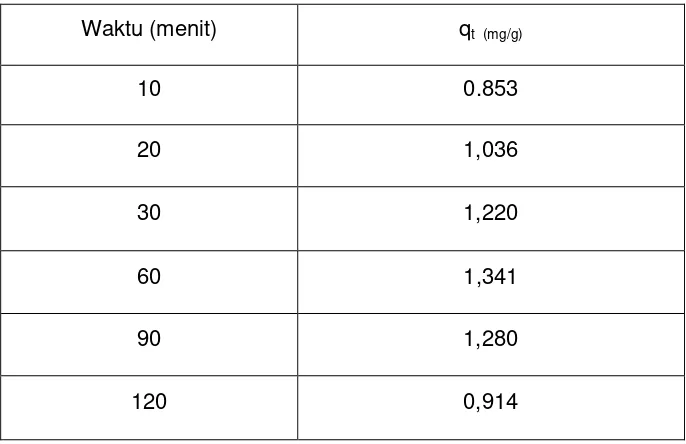
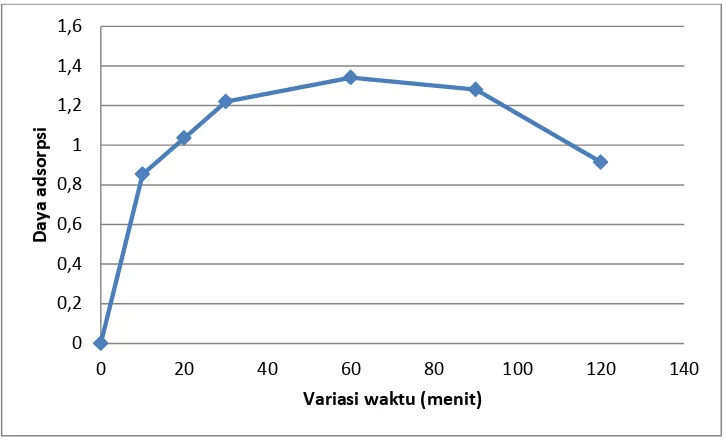
[image:39.595.149.492.500.722.2]Proses adsorpsi nata de ipomoea pada variasi waktu kontak bertujuan untuk menentukan waktu kontak pada adsorpsi direct red teknis dengan adsorben nata de ipomoea pada saat kesetimbangan. Berdasarkan data daya adsorpsi hasil perhitungan, kita dapat mengetahui waktu kontak saat kesetimbangan. Proses adsorpsi dilakukan pada variasi waktu kontak 10 menit; 20 menit; 30 menit; 60 menit; 90 menit; dan 120 menit yang diukur absorbansi dengan spektrofotometer UV-Vis pada panjang gelombang 512 nm. Untuk menentukan konsentrasi sebelum dan sesudah adsorpsi secara lengkap dapat dilihat di Lampiran 2. Data daya adsorpsi nata de ipomoea pada variasi waktu kontak dapat dilihat pada Tabel 4.
Tabel 4. Data variasi waktu kontak dan daya adsorpsi adsorben Nata de Ipomoea pada adsorpsi pewarna Direct Red Teknis
Waktu (menit) qt (mg/g)
10 0.853
20 1,036
30 1,220
60 1,341
90 1,280
40 Keterangan:
qt = Daya adsorpsi pada waktu ke-t
4. Pengaruh Variasi Konsentrasi Pada Adsorpsi Direct Red Teknis Dengan Adsorben Nata De Ipomoea Pada Saat Kesetimbangan.
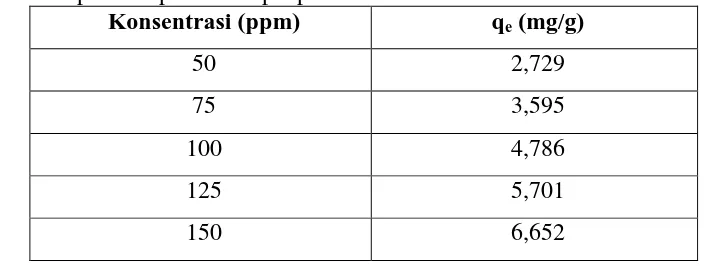
[image:40.595.174.526.588.721.2]Proses adsorpsi nata de ipomoea pada variasi konsentrasi bertujuan untuk mengetahui pengaruh konsentrasi zat pewarna direct red teknis pada adsorpsi direct red teknis dengan adsorben nata de ipomoea pada saat kesetimbangan. Proses adsorpsi dilakukan sampai kesetimbangan yaitu Selama 1 jam. Filtrat hasil adsorpsi diukur absorbansi mengunakan spektrofotometer UV-Vis pada panjang gelombang 512 nm. Dalam menentukan konsentrasi sebelum dan sesudah adsorpsi, nilai pengukuran absorbansi dikalibrasi kedalam persamaan garis regresi pada kurva standar yaitu Y = 0,00820X + 0,00609 dengan nilai R = 0,99952 yang secara lengkap dapat dilihat di Lampiran 3. Proses adsorpsi dilakukan pada variasi konsentrasi 50; 75; 100; 125; dan 150 ppm. Data daya adsorpsi nata de ipomoea pada variasi konsentrasi adsorpsi dapat dilihat pada Tabel 5.
Tabel 5. Data variasi konsentrasi adsorpsi dan daya adsorpsi adsorben Nata de Ipomoea pada adsorpsi pewarna Direct Red Teknis
Konsentrasi (ppm) qe (mg/g)
50 2,729
75 3,595
100 4,786
125 5,701
41
Keterangan:
qe = Daya adsorpsi pada waktu kesetimbangan
5. Karakterisasi Adsorben Nata De Ipomoea Sebelum dan Sesudah Proses Adsorpsi Mengunakan Spektrofotometer infra merah (FTIR).
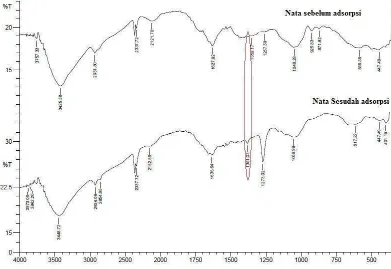
Spektrum inframerah Adsorben Nata De Ipomoea akan memunculkan informasi gugus fungsi yang terdeteksi pada Spektrofotometer infra merah. Untuk mengetahui informasi daerah serapan FTIR yang lebih lengkap dapat dilihat pada lampiran 9, sedangkan untuk spektra Infra merah untuk nata de ipomoea sebelum dan sesudah proses adsorpsi secara lengkap di lampiran
[image:41.595.153.544.405.674.2]10. Sedangkan untuk melihat perubahan gugus yang terjadi dapat dilihat pada gambar dibawah ini.
42
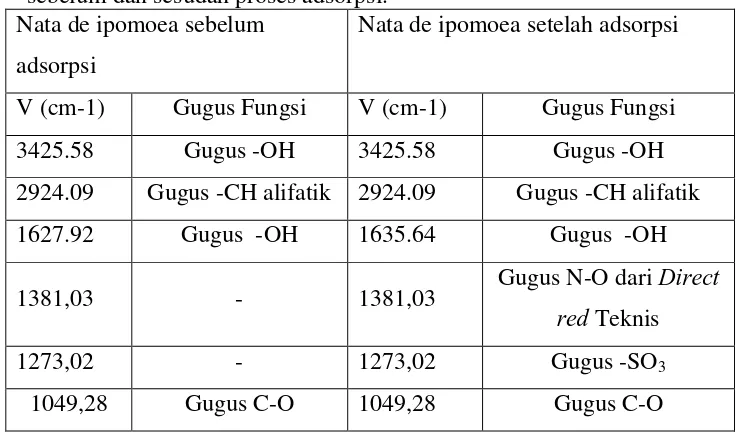
Tabel 6. Interpretasi gugus fungsi dari spektrum inframerah nata de ipomoea sebelum dan sesudah proses adsorpsi.
Nata de ipomoea sebelum adsorpsi
Nata de ipomoea setelah adsorpsi
V (cm-1) Gugus Fungsi V (cm-1) Gugus Fungsi 3425.58 Gugus -OH 3425.58 Gugus -OH 2924.09 Gugus -CH alifatik 2924.09 Gugus -CH alifatik 1627.92 Gugus -OH 1635.64 Gugus -OH 1381,03 - 1381,03 Gugus N-O dari Direct
red Teknis
1273,02 - 1273,02 Gugus -SO3
1049,28 Gugus C-O 1049,28 Gugus C-O
B. Pembahasan
Penelitian ini bertujuan untuk mengetahui waktu kontak, pengaruh konsentrasi zat pewarna direct red teknis pada adsorpsi direct red teknis dengan adsorben nata de ipomoea pada kesetimbangan dan menentukan pola isoterm adsorpsinya.
1. Penentuan Waktu Kontak Pada Adsorpsi Direct Red Teknis Dengan Adsorben Nata De Ipomoea Pada Saat Kesetimbangan.
43
Gambar 8. kurva daya adsorpsi adsorben nata de ipomoea vs variasi waktu kontak
Berdasarkan kurva daya adsorpsi adsorben nata de ipomoea vs variasi waktu kontak, kenaikan daya adsorpsi meningkat sampai waktu adsorpsi pada 60 menit dan saat mencapai 90 menit terjadi penurunan adsorpsi. Ketika 60 menit inilah titik pada saat kesetimbangan karena tidak ada pertambahan daya adsorpsi, namun daya adsorpsinya semakin menurun setelahnya. Hal ini terjadi karena semakin lama waktu adsorpsi yang terjadi kontak antara adsorben dan adsorbat menyebabkan adsorbat akan semakin banyak yang teradsorpsi sehingga daya adsorpsinya akan semakin besar sampai mencapai titik kesetimbangan. Pada saat mencapai titik kesetimbangan, akan terjadi titik jenuh atau setimbang dimana permukaan kosong adsorben telah terisi penuh oleh adsorbat. Hal ini terjadi kesetimbangan antara laju adsorpsi sama besar dengan laju desorpsi yang menyebabkan daya adsorpsinya tidak berbeda jauh bahkan cenderung menurun. 0 0,2 0,4 0,6 0,8 1 1,2 1,4 1,6
0 20 40 60 80 100 120 140
D ay a ad sor p si
44
2. Pengaruh Variasi Konsentrasi Zat Pewarna Direct Red Teknis Pada Adsorpsi Direct Rred Teknis Dengan Adsorben Nata De Ipomoea Pada Saat Kesetimbngan.
Adsorpsi nata de ipomoea terhadap pewarna direct red teknis pada variasi konsentrasi adsorpsi dilakukan untuk mengetahui pengaruh variasi konsentrasi zat pewarna direct red teknis pada adsorpsi direct red teknis dengan adsorben nata de ipomoea. Variasi konsentrasi adsorpsinya yaitu 50 ppm, 75 ppm, 100 ppm, 125 ppm, dan 150 ppm. Dengan waktu adsorpsi selama 1 jam, sedangkan massa adsorben yang digunakan adalah 1 gram. Berdasarkan hasil pengukuran pada tabel 5 di dapat kurva dibawah ini.
Gambar 9. kurva daya adsorpsi adsorben nata de ipomoea vs variasi konsentrasi direct red teknis.
Berdasarkan gambar 11 memperlihatkan bahwa variasi konsentrasi pewarna direct red teknis memiliki pengaruh terhadap daya adsorpsi. Semakin besar konsentrasi pewarna direct red teknis, maka semakin meningkat daya
0 1 2 3 4 5 6 7
0 20 40 60 80 100 120 140 160
D
ay
a
ad
sor
p
si
45
adsorpsinya. Hal ini terjadi karena konsentrasi yang semakin meningkat menyebabkan daya dorong molekul adsorbat untuk terikat pada permukan adsorben. Interaksi molekul adsorbat dan adsorben yang semakin besar maka akan meningkatkan daya adsorpsi. Pada penelitian ini, konsentrasi 150 ppm tidak dapat dikatakan sebagai konsentrasi optimum, karena berdasarkan kurva pada gambar diatas menunjukan bahwa masih ada kemungkinan peningkatan daya adsorpsi seiring semakin besarnya konsentrasi pewarna direct red teknis.
3. Pola isoterm Adsorpsi Pewarna Direct Red Teknis Menggunakan Adsorben Nata De Ipomoea
Dari data hasil variasi konsentrasi maka dapat ditentukan data model isoterm adsorpsinya. Hal ini untuk mengetahui jenis adsorpsi yang terjadi dan ikatan yang terjadi.
Gambar 10. Grafik isoterm langmuir
Penentuan pola isoterm Langmuir dilakukan dengan membuat grafik hubungan antara konsentrasi adsorbat dalam keadaan setimbang / daya
y = 0.065x + 7.687 R = 0.711
0,000 2,000 4,000 6,000 8,000 10,000 12,000 14,000
0 20 40 60 80 100
Ce
/q
e (
m
g/g)
46
[image:46.595.149.514.209.435.2]adsorpsi ( Ce/qe ) dengan konsentrasi adsorbat dalam keadaan setimbang ( Ce ), sehingga diperoleh grafik isotherm Langmuir untuk adsorpsi nata de ipomoea terhadap pewarna direct red teknis. Gambar 10 memperlihatkan grafik isoterm Langmuir yang menghasilkan persamaan y = 0,065x + 7,687 dengan nilai R sebesar 0,711.
Gambar 11. Grafik isoterm freundlich
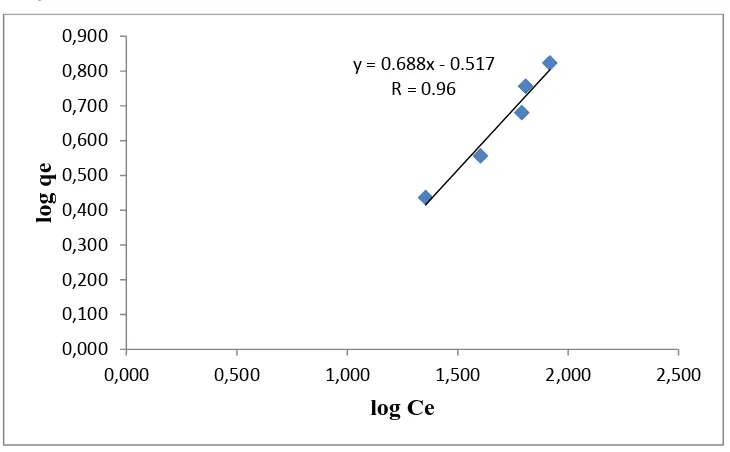
Penentuan pola isoterm freundlich dilakukan dengan membuat grafik hubungan antara log daya adsorpsi ( log qe ) dengan konsentrasi adsorbat dalam keadaan setimbang ( log Ce), sehingga diperoleh grafik isoterm freundlich untuk adsorpsi nata de ipomoea terhadap pewarna direct red teknis. Gambar 11. Memperlihatkan persamaan y = 0,688x - 0.517 dengan nilai R sebesar 0.96.
Berdasarkan nilai linier dari masing-masing grafik terlihat bahwa pola isoterm adsorpsi pewarna direct red teknis mengunakan adsorben nata de ipomoea lebih cenderung mengikuti pola isoterm menurut teori freundlich. Hal ini terlihat dari gambar kurva pada no. 12 dan 13 diatas. Nilai koefisien
y = 0.688x - 0.517 R = 0.96
0,000 0,100 0,200 0,300 0,400 0,500 0,600 0,700 0,800 0,900
0,000 0,500 1,000 1,500 2,000 2,500
log q
e
47
korelasi pada isoterm adsorpsi freundlich lebih besar dibandingkan dengan pola isoterm langmuir yaitu 0,958 dengan nilai k 0,304.
Model isoterm freundlich menunjukan bahwa adsorben memiliki permukaan yang heterogen, dan setiap tempat memiliki panas adsorpsi yang berbeda. Adsorbat yang telah terikat pada adsorben dapat mengikat adsorbat lain sehingga pada adsorpsi ini membentuk lapisan multilayer. Menurut Yusra dan Haq (2011) nilai n >1 menunjukan bahwa pada proses adsorpsi, adsorbat teradsorpsi dengan baik pada adsorben secara fisisorpsi.
Pada penelitian yang telah dilakukan nilai 1/n sebesar 0,688 dan nilai n sebesar 1,453. Menurut Ganapaty dan Mariappan (Margaretha, 2014: 45) bahwa nilai 1/n antara 0 sampai 1 dan nilai n antara 1-10 menunjukan bahwa adsorbat dapat terikat dengan baik pada adsorben.
4. Spektrum IR Adsorben Nata De Ipomoea Sebelum Adsorpsi dan Setelah Adsorpsi
48
49 BAB V
KESIMPULAN DAN SARAN
A. Kesimpulan
Berdasarkan hasil penelitian yang telah dilakukan, maka diperoleh beberapa kesimpulan sebagai berikut :
1. Waktu kontak setimbang pada adsorpsi direct red teknis dengan adsorben nata de ipomoea yaitu pada 60 menit.
2. Peningkatan konsentrasi direct red teknis akan meningkatkan daya adsorpsi adsorben nata de ipomoea.
3. Hasil adsorpsi pewarna direct Red Teknis mengunakan nata de Ipomoea mengikuti pola isoterm adsorpsi freundlich.
B. Saran
Berdasarkan penelitian yang telah dilakukan, maka peneliti merekomendasikan beberapa saran :
1. Jika akan melakukan penelitian lanjutan dengan bahan nata de ipomoea, perlu dilakukan variasi pH untuk menentukan pengaruh pH terhadap daya adsorpsi serta perlunya perlakuan khusus untuk memodifikasi adsorben nata de ipomoea yaitu menghilangkan zat penggangu dari senyawa aktif pada
50
DAFTAR PUSTAKA
Abdul Rohman. (2007). Kimia Farmasi Analisis. Yogyakarta: Pustaka Pelajar. Afrizal, (2008). Selulosa Bakterial Nata De Coco sebagai Adsorban pada Proses
Adsorpsi Logam Cr(III). Jurnal Gradien. 4: hal. 308
Adamson, A.W., 1990, Physical Chemistry of Surface, 5th ed, John Willey & Sons, New York.
Atkins, P.W. (1997). Physical chemisty, Oxford University Press, Alih Bahasa: I.I Karthohadiprodjo, Jilid 2, Edisi 4. Jakarta: Erlangga
Christie, R. M. (2001). Colour Chemistry. London: RSC Paperpack, The Royal Society of Chemistry,UK.
Cornell, D.W and G.J. Miller. (1995). Kimia dan Ekotoksikologi Pencemaran. Penerbit Universitas Indonesia. Jakarta. P 343-392 (diterjemahkan oleh : Yanti Koestoer).
Dede Karyana. (2010). Pengantar Kimia Zat Warna. Bandung: Sekolah Tinggi Tekstil.
Fengel, D., dan Wegener, G. (1984). Wood: Chemistry, Ultrastructure, Reactions. Page 389-396: Berlin: Walter de Gruyter.
Fessenden, Ralph J. & Fessenden, Joan S. (1997). Kimia Organik Jilid I. Edisi Ketiga. (Terjemahan A. H. Pudjaatmaka). Jakarta: Erlangga. (Buku asli: 1986).
Fessenden, Ralph J. dan Fessenden, Joan S.. (2010). Dasar-dasar Kimia Organik. (Alih bahasa Sumariah M., Kamianti A., dan Tilda S.S. Tanggerang: Binarupa Aksara.
Jovic, M., Stancovic D., Manojlovic, D., Andelkovic, I., Milic, A., Dojcinovic, B., dan Roglic G. (2013). Study of The Electrochemical Oxidation of Reactive Textile Dyes Using Platinum Electrode. International Journal of Electrochemical Science, 8: 168-183
Geissman, T. A. & Crout, D. H. G. (1969). Organic Chemistry of Secondary Plant Metabolism. California: Freeman, Cooper & Company.
51
Hardjono Sastrohamidjojo. (1991). Spektroskopi. Yogyakarta: Liberty.
Hardjono Sastrohamidjojo. (1992). Spektroskopi Inframerah. Yogyakarta: Liberty. Hardjono Sastrohamidjojo. (2007). Spektroskopi. Edisi Ketiga. Yogyakarta:
Liberty.
Hayati, Marlinda. (2003). Membuat Nata de Coco. Yogyakarta: Adicita karya Nusa.
Hunger, K. (2003). Industrial Dyes, Chemistry, Properties, Applications. Germany. Wiley VCH Verlag GmbH & Co.KgaA, Weinheim.
Isminingsih dan R.Djufri. 1982. Pengantar Kimia Zat Warna. Sekolah Tinggi Teknologi Tekstil. Bandung
I. Hartati, dkk., (2011). Potensi Xanthate Pulpa Kopi Sebagai Adsorben Pada Pemisahan Ion Timbal Dari Limbah Industri Batik. Semarang: Universitas Wahid Hasyim
Jannur majesty, dkk. (2015). Pengaruh Penambahan Sukrosa dan Lama Fermentasi Terhadap Kadar Serat Nata Dari Sari Nanas (Nata de Pina). Jurnal Keteknikan Pertanian Tropis dan Biosistem, Vol. 3 No. 1, 80-85 Kusmiyati, Puspita Adi L., dan Kunthi Pratiwi (2012). Pemanfaatan Karbon Aktif
Arang Batubara (KAAB) untuk menurunkan kadar Ion Logam Berat Cu2+ dan Ag+ pada Limbah Industri Cair. Reaktor, 14 (1); 51-60)
Lenny Marlyn Estiaty. (2012). Kesetimbangan dan Kinetika Adsorpsi ion Cu2+ pada Zeolit-H. Jurnal Riset Geologi dan Pertambangan, 22 (2):115-129.
Li, et al., (2013). Adsorption of C.I. Reactive Red 228 dye from aqueous solution by modified cellulose from flax shive: Kinetics, equilibrium, and thermodynamics. Industrial Crops and Products 42 (2013) 153–158
Marham Sitorus. (2009). Spektroskopi. Yogyakarta: Graha Ilmu.
Margaretha Aditya Kurnia Purnaningtyas. (2014). Adsorpsi Pewarna Direct Red Teknis oleh Selulosa Asetat dari Jerami Padi. Skripsi. Yogyakarta: Universitas Negeri Yogyakarta
Natalia Puspita S dan Amaria. (2013). Kinetika Adsorpsi Ion Sianida (CN-) oleh Hibrida Amino Silika Gel Terimpregnasi Fe(III). UNESA Journal of Chemistry, 2(3)
52
Pecsock, R. L. & Shield, L. D. (1976). Modern Methods of Chemical Analysis. Second Edition. New York: John Wiley & Sons
Rasyid Djufri. (1976). Teknologi Pengelantangan Pencelupan dan Pencapan. Bandung: Institut Teknologi Tekstil.
Rizky Dirga Harya P. (2012). Ekstraksi Serat Selulosa dari Tanaman Eceng Gondok (Eichornia crassipes) dengan Variasi Pelarut. Skripsi.Universitas Indonesia
Silverstein, R.M., G.B. Bassler., and T.C.D. Morcill. 1986. Penyelidikan Spektrometrik Senyawa Organik. Alih Bahasa : A.J. hartomo, dan Anny Victor Purba. Erlangga. Jakarta. Hlm 191-195.
Sjamsul Arifin. (1986). Buku Materi Pokok Kimia Organik Bahan Alam Modul 4-6. Jakarta: Universitas Terbuka, Dekdikbud.
Soekardjo. (1989). Kimia Fisika. Yogyakarta: Bina Aksara.
Sri Hastuti, Syarif H.W., dan Setyoningsih. (2012). Penggunaan Serat daun Nanas Sebagai Adsorben Zat Warna Procion Red Mx 8b. Jurnal EKOSAINS. 4(1): 41-47
Sun, et al., (2013), Adsorption of Reactive Dyes on Activated Carbon Developed from Enteromorpha prolifera, College of Chemistry & Chemical Engineering, Qingdao University, Qingdao, China.
Syaiful Bahri, Muhdarina, Nurhayati, dan Fitri Andiyani. (2011). Isoterma dan Termodinamika Adsorpsi Kation Cu2+ Fasa Bercair pada Lempung cengar Terpilar. Jurnal natur Indonesia. 14(1):7-13.
Yusra Safa, dan Haq Nawaz Bhatti, H.N. (2011). Kinetic and Thermodinamic Modeling for the removal of Direct-31 and Direct-26 Dyes from Aqueus Solution by Rice Husk. Desalination, 272: 313-322
Velmurugan, et al., (2011), Dye Removal From Aqueous Solution Using Low Cost Adsorbent, School of Civil Engineering, SASTRA University, Tamil Nadu, India.