PEMBUATAN BIOETHANOL DARI AIR
CUCIAN BARAS (AIR LERI)
SKRIPSI
Disusun Oleh :
TOMMY 0931010051
JURUSAN TEKNIK KIMIA
FAKULTAS TEKNOLOGI INDUSTRI
UNIVERSITAS PEMBANGUNAN NASIONAL “ VETERAN”
JAWA TIMUR
PEMBUATAN BIOETHANOL DARI
AIR CUCIAN BARAS (AIR LERI)
SKRIPSI
Diajukan Untuk Memenuhi Sebagai Persyaratan Dalam Memperoleh Gelar Sarjana Teknik
Jurusan Teknik Kimia
Oleh :
TOMMY
NPM : 0931010051
JURUSAN TEKNIK KIMIA
FAKULTAS TEKNOLOGI INDUSTRI
UNIVERSITAS PEMBANGUNAN NASIONAL “VETERAN”
PEMBUATAN BIOETHANOL DARI AIR CUCIAN
BARAS (AIR LERI)
Disusun Oleh : TOMMY NPM : 0931010051
Telah dipertahankan dihadapan dan diterima oleh Tim Penguji Pada Tanggal
03-juni-2013 Tim Penguji,
1.
Prof.Dr.Ir. Soemargono, SU NIP. 19522208 197701 1 006 2.
Ir. Lucky Indrati Utami, MT NIP. 19581005 198803 2 001
Mengetahui :
Dekan Fakultas Teknologi Industri
Universitas Pembangunan Nasional “Veteran” Jawa Timur
Pembimbing,
KATA PENGANTAR
Puji syukur penyusun panjatkan ke hadirat Tuhan Yang Maha Esa atas Karunia dan rahmat-Nya sehingga penyusun dapat menyelesaikan laporan skripsi ini.
Penelitian ini merupakan salah satu syarat yang harus dipenuhi oleh mahasiswa tingkat akhir sebelum dinyatakan lulusan sebagai Sarjana Program Studi Teknik Kimia, Fakultas Teknologi Industri, Universitas Pembangunan Nasional “VETERAN” Jawa Timur.
Pada kesempatan ini penyusun melakukan penelitian dengan judul “Pembuatan
Bioethanol dari Air Cucian Beras ( Air Leri ) ”. Terima kasih sebesar – besarnya penyusun tujukan kepada semua pihak yang telah membantu penelitian hingga tersusunnya laporan ini, terutama kepada :
1. Bapak Ir. Sutiyono, MT. selaku Dekan Fakultas Teknologi Industri, Universitas Pembangunan Nasional “VETERAN” Jawa Timur, serta selaku Dosen penguji. 2. Ibu Ir. Retno Dewati, MT. selaku Ketua Program Studi Teknik Kimia, Fakutas
Teknologi Industri, Universitas Pembangunan Nasional “VETERAN” Jawa timur.
3. Ibu Ir. Ni Ketut Sari, MT. selaku Dosen pembimbing dalam penelitian ini.
4. Bapak Prof.Dr.Ir.Soemargono, SU dan Ibu Ir. Lucky Indrati Utami, MT. selaku Dosen penguji.
5. Kepada Orang tua tersayang, terima kasih atas dukungan doa dan restunya kepada kami.
6. Kepada Teman special kami Luana Erviana yang memberikan dukungan, informasi dan keikhlasan dalam penyusunan laporan penelitian ini.
Penyusun mengucapkan terima kasih yang sebesar – besarnya atas segala bantuan, fasilitas, yang telah diberikan kepada kami. Penyusun menyadari masih banyak kekurangan pada penyusunan laporan ini. Oleh karena itu kami mengharapkan saran dan kritik yang membangun atas laporan ini
Akhir kata, penyusun mohon maaf yang sebesar – besarnya kepada semua pihak, apabila dalam melaksanakan penelitian dan dalam penyusunan laporan ini penyusun melakukan kesalahan baik yang disengaja maupun tidak di sengaja.
Surabaya, 31 Mei 2013
DAFTAR ISI
BAB II TINJAUAN PUSTAKA 2.1 Teori Umum... 4
2.2 Landasan Teori... 17
BAB III PROSES PRODUKSI 3.1 Bahan yang Digunakan... 24
3.2 Alat yang Digunakan... 24
3.3 Gambar Alat Percobaan... 24
3.4 Peubah yang dilakukan... 25
3.5 Prosedur Percobaan... 26
3.6 Diagram Alir... 30
BAB IV HASIL DAN PEMBAHASAN 4.1 Analisa Bahan Baku Awal... 35
4.2 Proses Hidrolis... 35
4.3 Kurva Pertumbuhan Sacharomyces cereviseae... 39
4.4 Hasil Fermentasi... 41
4.5 Hasil Distilasi... 43
BAB V TINJAUAN PUSTAKA 5.1 Kesimpulan... 44
5.2 Saran... 44
INTISARI
Penelitian Pembuatan Bioethanol dari Air Cucian Beras ( Air Leri ) mengkaji kaulitas produk bioethanol yang lebih baik dan ramah lingkungan dengan meningkatkan kualitas limbah rumah tangga yang berupa air cucian beras (air leri).
Beras merupakan bahan makanan pokok sebagian besar penduduk di Indonesia. Komponen terbesar beras adalah karbohidrat yang sebagian besar terdiri dari pati yang berjumlah 85 – 90 %. Kandungan yang lain dari karbohidrat beras adalah selulosa, hemiselulosa, dan pentosan. Zat pati yang tertinggi terdapat pada bagian endosperm, makin ke tengah maka kandungan patinya makin menipis tetapi kandungan bukan pati makin meningkat. Namun dari itu semua terdapat salah satu bagian yang terlupakan oleh sebagian besar orang yakni pemanfaatan limbah dari beras dalam proses pencucian beras sebelum dimasak yang pastinya juga masih mengandung karbohidrat.
Proses pembuatan Bioethanol dimulai dari proses hidrolisa pati dengan variable suhu Konsentrasi HCl 10 % ; 20 % ; 30 %, dan pH larutan 3, 4, 5, untuk menghidrolisa pati. Kemudian diteruskan fermentasi dengan waktu fermentasi 5,6,7 hari, dan proses distilasi dengan variabel suhu 78 oC.
Dari proses hidrolisis diperoleh kadar glukosa yang terbaik adalah 22 % dengan menambahkan HCl 20 % ke dalam 100 ml larutan air cucian beras (air leri) dengan pH 4.Pada proses fermentasi kondisi terbaik untuk menghasilkan etanol yaitu dengan menggunakan kadar glukosa sebesar 22 %. Proses fermentasi berlangsung selama 7 hari dan menghasilkan ethanol sebesar 35,59 % Setelah proses fermentasi tersebut menghasilkan kadar glukosa sisa 8 %.
BAB I
PENDAHULUAN
I.1 Latar Belakang
Pada saat ini industri kimia telah berkembang pesat di Indonesia, hal ini disebabkan karena kebutuhan manusia yang semakin meningkat dan beragam. Dengan adanya kebutuhan tersebut, maka industri-industri kimia berusaha untuk memenuhinya. Oleh karena itu kebutuhan akan bahan-bahan kimia juga meningkat, salah satu bahan kimia adalah bioethanol (anonim, 2012).
Ethanol atau ethyl alcohol (C2H5OH) merupakan cairan tak berwarna, ramah
lingkungan, dapat diuraikan, sedikit mengandung zat – zat beracun dan kecil kemungkinannya menyebabkan polusi lingkungan jika tertumpah. Pembakaran ethanol berfungsi untuk menghasilkan karbondioksida dan air. Ethanol merupakan bahan bakar yang tinggi nilai oktannya (anonim, 2012).
Alkohol banyak digunakan dalam kehidupan sehari-hari, misalnya sebagai bahan kosmetik, industri minuman, bahan minuman, bahan pelarut organik dan sebagai bahan bakar. Kebutuhan ini akan bertambah banyak dengan adanya kemungkinan alkohol menggantikan minyak bumi sebagai bahan bakar. Dimana bahan bakar dari alkohol ini merupakan bahan bakar yang bersumber dari bahan yang dapat diperbaharui dan tentunya bertolak belakang dengan bahan bakar minyak bumi atau gas yang sekarang digunakan yang lama kelamaan akan semakin habis (Ni Ketut Sari, 2012).
dibutuhkan untuk industri lain seperti pembuatan bir dan pembuatan bumbu masak. Karena banyaknya kebutuhan industri yang menggunakan tetes sebagai bahan baku, maka secara tidak langsung persediaan tetes akan semakin habis. Oleh karena itu, diperlukan adanya pembaharuan atau alternatif bahan baku lain yaitu dengan memanfaatkan limbah kulit buah cokelat sebagai bahan baku pembuatan bioethanol (Ni Ketut Sari, 2012).
Beras merupakan bahan makanan pokok sebagian besar penduduk di Indonesia. Komponen terbesar beras adalah karbohidrat yang sebagian besar terdiri dari pati yang berjumlah 85 – 90 %. Kandungan yang lain dari karbohidrat beras adalah selulosa, hemiselulosa, dan pentosan. Zat pati yang tertinggi terdapat pada bagian endosperm, makin ke tengah maka kandungan patinya makin menipis tetapi kandungan bukan pati makin meningkat. Namun dari itu semua terdapat salah satu bagian yang terlupakan oleh sebagian besar orang yakni pemanfaatan limbah dari beras dalam proses pencucian beras sebelum dimasak yang pastinya juga masih mengandung karbohidrat ( Darmadjati, 1988).
Dengan alasan beserta kandungan pati diatas maka dalam penelitian ini kami menggunakan limbah cucian beras (air leri) untuk dijadikan salah satu alternatif dalam pembuatan bioethanol.
I.2 Tujuan Penelitian
I.3 Manfaat Penelitian
Adapun manfaat dari penelitian ini antara lain :
a. Untuk mencari bahan baku alternatif pembuatan ethanol.
BAB II
TINJAUAN PUSTAKA
II.1 Teori Umum
II.1.1 Beras
Gambar II.1. Beras
Komposisi Kimia Beras
Komposisi kimia beras pecah kulit yang digunakan sebagai bahan dasar pembuatan ethanol secara umum dapat dilihat pada Tabel II-1.
Tabel II-1. Nilai Gizi Beras (dalam 100 gram bagian yang dapat dimakan)
Komposisi (Satuan) Jumlah
Sumber : Badan Penelitian dan Pengembangan Industri (1990)
ke tengah maka kandungan patinya makin menipis tetapi kandungan bukan pati makin meningkat (Darmadjati, 1988).
II.1.2 Air Leri
Air leri merupakan air yang berasal dari proses pencucian beras sebelum ditanak menjadi nasi. Dimana pada saat ini pemanfaatan air leri hanya sebatas sebagai minuman ternak, untuk menyiram tanaman, atau hanya dibuang begitu saja. Proses pencucian beras menyebabkan ikut melarutnya zat gizi yang terlepas dari biji beras ke dalam air cucian beras tersebut. Zat-zat gizi yang ikut dalam cucian beras meliputi karbohidrat, thiamin, dan senyawa organik lainnya dimana kandungan tersebut masih berpotensi sebagai bahan dasar pembuatan ethanol (Darmadjati, 1988).
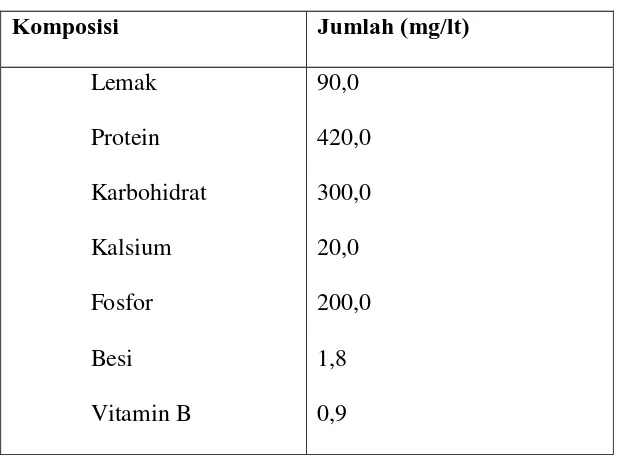
Tabel II-2. Nilai Gizi Air Leri / Larutan Pencucian Beras
Komposisi Jumlah (mg/lt)
Lemak
Sumber : Badan Penelitian dan Pengembangan Industri (1990)
II.1.3 Karbohidrat
Karbohidrat merupakan sumber kalori utama bagi manusia selain protein dan lemak. Karbohidrat yang mempunyai rumus empiris (CH2O)n ini juga mempunyai peranan penting
tubuh yang berlebihan, kehilangan mineral dan berguna untuk membantu metabolisme lemak dan protein. Di alam, karbohidrat dibentuk dari reaksi CO2 dan H2O dengan bantuan sinar
matahari melalui proses fotosintesis dalam sel tanaman yang berklorofil, sedangkan besar bahan-bahan yang merupakan sumber karbohidrat diperoleh dari umbi-umbian dan batang tanaman misalnya sagu. Sumber karbohidrat yang merupakan bahan makanan pokok di berbagai daerah di Indonesia adalah biji-bijian, khususnya beras dan jagung (Winarno, 1994). Pada umumnya karbohidrat dapat dikelompokkan menjadi tiga bagian yaitu :
a. Monosakarida
Merupakan suatu molekul yang terdiri dari 5 atau 6 atom C. Monosakarida yang mengandung satu gugus aldehide disebut aldosa. Sedangkan ketosa mempunyai satu gugus keton. Monosakarida dengan 6 atom C disebut heksosa, Misal glukosa (dekstrosa / gula anggur). Sedangkan yang mempunyai 5 atom C disebut pentosa, misal xilosa, arabinosa, dan ribose (Winarno, 1994).
b. Oligosakarida
Merupakan polimer dari 2 - 10 monosakarida. Biasanya bersifat larut dalam air. Oligosakarida yang terdiri dari 2 molekul monosakarida disebut disakarida. Contoh dari disakarida adalah sukrosa. Oligosakarida dapat diperoleh dari hasil hidrolisis polisakarida dengan bantuan enzim tertentu atau hidrolisis dengan asam (Winarno, 1994).
c. Polisakarida
Disusun oleh banyak molekul monosakarida. Polisakarida dalam bahan makanan berfungsi sebagai bahan penguat tekstur (selulosa, hemiselulosa, pectin dan lignin). Dan sebagai sumber energi (pati, glikogen, fruktan). (Winarno, 1994)
II.1.4 Glukosa
tumbuh-tumbuhan, madu, darah. Dalam bentuk ikatan terdapat sebagai glikosida di dalam tubuh binatang, sebagai disakarida, dan polisakarida di dalam tubuh tumbuhan. Glukosa juga dapat dihasilkan melalui hidrolisis polisakarida atau disakarida, dengan asam atau enzim. Sebagai aldoheksosa, glukosa memiliki 6 atom karbon di dalam rantai molekulnya. Salah satu ujung rantai tersebut merupakan gugus aldehid. Atom-atom karbon nomor 2 sampai nomor 5 di dalam rantai adalah gugus chiral. Dengan demikian terdapat 16 kemungkinan konfigurasi isomer pada glukosa. Semua konfigurasi isomer tersebut telah dikenal sebagian terdapat bebas di alam, sebagian yang lain harus dibuat secara sintetis. Tidak kurang dari 32 macam organisme yang telah diteliti dapat menghasilkan glukosa isomerase diantaranya, Pseudomonas, Aerobacter, Escherchia, Bacillus, Brevibacterium, Paralactobacterium,
Leuconostoc, dan Streptomyces (Soebijanto, 1986).
II.1.5 Alkohol
Ethanol atau ethyl alcohol (C2H5OH) merupakan cairan tak berwarna, ramah
lingkungan, dapat diuraikan, sedikit mengandung zat – zat beracun dan kecil kemungkinannya menyebabkan polusi lingkungan jika tertumpah. Pembakaran ethanol berfungsi untuk menghasilkan karbondioksida dan air. Ethanol merupakan bahan bakar yang tinggi nilai oktannya (Syamsul D, Bahri, 1987).
Bioetanol merupakan cairan hasil proses fermentasi gula dari polisakarida menggunakan bantuan mikroorganisme. Bioetanol dapat dibuat dari berbagai bahan hasil pertanian. Secara umum bahan - bahannya dapat dibagi dalam 3 golongan yaitu :
1. Bahan yang mengandung turunan gula (sakarin) : molase, gula tebu, gula bit, sari buah. 2. Bahan yang mengandung pati : biji - bijian, kentang, tapioka.
Bahan - bahan yang mengandung sakarin dapat langsung di fermentasi, akan tetapi bahan yang mengandung pati dan selulosa harus dihidrolisis terlebih dahulu menjadi komponen yang sederhana. Meskipun pada dasarnya fermentasi dapat langsung menggunakan enzim tetapi saat ini industri fermentasi masih memanfaatkan mikroorganisme karena cara ini jauh lebih mudah dan murah, mikroba yang banyak digunakan dalam proses fermentasi adalah khamir, kapang dan bakteri (Krisno agus dan budiyanto, 2002).
Ethanol yang diinginkan sebagai hasil dari fermentasi ini mempunyai rumus dasar C2H5OH dan mempunyai sifat-sifat fisik sebagai berikut:
1. Cairan tidak berwarna
2. Berbau khas, menusuk hidung 3. Mudah menguap
4. Titik didih 78,32 oC 5. Larut dalam air dan ether
6. Densitas pada 15 oC adalah 0,7937
7. Spesifik panas pada 20 oC adalah 0,579 cal/gr oC 8. Panas pembakaran pada keadaaan cair adalah 328 Kcal 9. Viskositas pada 20 oC adalah 1,17 cp
10.Flash point adalah sekitar 70 oC 11.Berat molekul adalah 46,07 gr/mol
12.Terjadi dari reaksi fermentasi monosakarida
13.Bereaksi dengan asam asetat, asam sulfat, asam nitrit, asam ionida (Kirck Othmer, 1963).
II.1.6 ASAM KLORIDA (HCl)
Asam klorida adalah larutan akuatik dari gas hidrogen klorida (HCl). Ia adalah asam kuat, dan merupakan komponen utama dalam asam lambung. Senyawa ini juga digunakan secara luas dalam industri. Asam klorida harus ditangani dengan keselamatan yang tepat karena merupakan cairan yang sangat korosif (Anonim, 2012).
Rumus molekul : HCl
Massa molar : 36,46 g/mol (HCl)
Titik lebur : −27,32 °C (247 K), larutan 38% Titik didih : 110 °C (383 K),
larutan 20,2%; 48 °C (321 K), larutan 38%.
Kelarutan : dalam air Tercampur penuh Keasaman (pKa) : −8,0
Viskositas : 1,9 mPa·s pada 25 °C, larutan 31,5% (Anonim, 2012).
II.1.7 Hidrolisis
Hidrolisis merupakan proses pemecahan suatu senyawa menjadi senyawa yang lebih sederhana dengan bantuan molekul air. (Kirck Othmer, 1963)
Jenis hidrolisis ada lima macam yaitu sebagai berikut : 1.Hidrolisis murni
Pada proses ini hanya melibatkan air saja. Proses ini tidak dapat menghidrolisis secara efektif karena reaksi berjalan lambat. Hidrolisis murni ini biasanya hanya untuk senyawa yang sangat reaktif dan reaksinya dapat dipercepat dengan memakai uap air (Kirck Othmer, 1963).
2.Hidrolisis dengan larutan asam
Menggunakan larutan asam sebagai katalis. Larutan asam yang digunakan dapat encer atau pekat, seperti H2SO4 atau HCl (Kirck Othmer, 1963).
(C6H10O5)n + 1/2n H2O 1/2n C12H22O11
Enzim Amilase
1/2n C6H12O6
1/2n C12H22O11 + 1/2n H2O
3.Hidrolisis larutan basa
Menggunakan larutan basa encer maupun pekat sebagai katalis. Basa yang digunakan pada umumnya adalah NaOH atau KOH. Selain berfungsi sebagai katalis, larutan basa pada proses hidrolisis berfungsi untuk mengikat asam sehingga kesetimbangan akan bergeser ke kanan (Kirck Othmer, 1963).
4.Alkali fusion
Hidrolisis ini dilakukan tanpa menggunakan air pada suhu tinggi, misalnya dengan menggunakan NaOH padat (Groggins, 1958).
5.Hidrolisis dengan enzym
Hidrolisis ini dilakukan dengan mengunakan enzym sebagai katalis. Enzym yang digunakan dihasilkan dari mikroba seperti enzym α-amylase yang dipakai untuk hidrolisis pati menjadi glukosa dan maltosa (Groggins, 1958).
II.1.8 Fermentasi
Arti kata fermentasi selama ini berubah-ubah. Kata fermentasi berasal dari bahasa latin “Fervere” yang berati merebus (to boil). Arti kata dari bahasa latin tersebut dapat
dikaitkan dengan kondisi cairan bergelembung atau mendidih. Keadaan ini disebabkan adanya aktivitas ragi pada ekstraksi buah-buahan atau biji-bijian. Gelembung-gelembung karbon dioksida dihasilkan dari katabolisme anaerobik terhadap kandungan gula. Fermentasi pada umumnya mempunyai pengertian suatu proses terjadinya perubahan kimia pada suatu substrat organik melalui aktivitas enzim yang dihasilkan oleh mikroba, walaupun dalam beberapa hal dapat juga terjadi tanpa adanya sel-sel hidup (mikroba) (Gumbira Sa’id, 1989).
Substrat yang dapat difermentasikan menjadi alkohol :
2. Bahan-bahan berpati (starchy materials) : tapioka, maizena, barley, gandum, padi, dan kentang. Jagung dan ubi kayu adalah dua kelompok substrat yang menarik perhatian. 3. Bahan-bahan lignoselulosa (lignosellulosic material) : sumber selulosa dan lignoselulosa
berasal dari limbah pertanian dan kayu. Akan tetapi, hasil etanol dari lignoselulosa sedikit karena kekurangan teknologi untuk mengkonversi pentosa menjadi etanol.
(Krisno agus dan Budiyanto, 2002).
Bahan-bahan yang mengandung sakarin dapat langsung di fermentasi, akan tetapi bahan yang mengandung pati dan selulosa harus dihidrolisis terlebih dahulu menjadi komponen yang sederhana. Meskipun pada dasarnya fermentasi dapat langsung menggunakan enzim tetapi saat ini industri fermentasi yang benar-benar masih memanfaatkan mikroorganisme karena cara ini jauh lebih mudah dan murah, mikroba yang banyak digunakan dalam proses fermentasi adalah khamir, kapang dan bakteri
(Krisno agus dan budiyanto, 2002).
Ethanol merupakan bentuk alami yang dihasikan dari proses fermentasi yang banyak ditemukan dalam produk bir, anggur, spiritus dan masih banyak lagi. Minuman beralkohol dapat digolongkan menjadi dua bagian, yaitu :
1.Produk hasil fermentasi yang dikonsumsi langsung.
2.Produk hasil fermentasi yang didistilasi lebih dahulu sebelum dikonsumsi. ( B. Kartika, 1992).
Dalam pembentukan alkohol melalui fermentasi, peran mikrobiologi sangat besar dan biasanya mikrobiologi yang digunakan untuk fermentasi mempunyai beberapa syarat sebagai berikut :
1. Mempunyai kemampuan untuk memfermentasi karbohidrat yang cocok secara cepat.
3. Mempunyai genetik yang stabil (tidak mudah mengalami mutasi). 4. Toleran terhadap alkohol yang tinggi (antara 14 – 15 %).
5. Mempunyai sifat regenerasi yang cepat ( B. Kartika, 1992).
Minuman beralkohol yang dihasilkan tanpa distilasi (hasil fermentasi) biasanya mempunyai kadar alkohol antara 3 – 18 %. Untuk mempertinggi kadar alkohol dalam produk sering kali hasil fermentasi di distilasi dan kadar alkohol yang dihasilkan antara 29 – 50 %. Prinsipnya reaksi proses pembentukan ethanol dengan fermentasi sebagai berikut :
Pada hasil fermentasi biasanya terbentuk larutan alkohol yang encer, karena sel-sel khamir akan mati bila kadar ethanol melebihi 12 – 15 % (Gumbira Sa’id, 1989).
II.1.9 Saccharomyces Cereviceae
Jenis khamir yang paling banyak digunakan adalah Saccharomyces Cereviseae. Secara komersial khamir roti telah diproduksi pada tahun 1846 dengan ditemukan proses “wina” oleh Mautner menggunakan bahan dasar malt dan jagung. Biakan Saccharomyces Cereviceae secara khusus digunakan dalam pembuatan khamir roti dan fermentasi alkohol.
Saccharomyces Cereviseae ini bersifat fermentatif kuat. Tetapi dengan adanya oksigen,
Saccharomyces Cereviseae ini juga melakukan respirasi yaitu mengoksidasi gula menjadi
karbondioksida dan air. 70 % dari glukosa di dalam substrat akan diubah menjadi karbondioksida dan air, sedang sisanya tanpa ada nitrogen akan diubah menjadi produk penyimpanan cadangan. Selain alkohol dan karbondioksida, Saccharomyces Cereviceae juga memproduksi gliserol, asam suksinat, alkohol rantai panjang, 2,3 – butadiol, asetaldehida, asam acetat, dan asam laktat dalam jumlah kecil. (Srikandi Fardiaz, 1992)
Adapun sifat-sifat dari Saccharomyces Cereviseae antara lain adalah :
C6H12O6 2 C2H5OH + 2CO2
1. Berbentuk bulat, ellips (bulat telur). 2. Tidak berflagella.
3. Tidak mempunyai klorofil. 4. Dapat membentuk spora.
Ragi ini memerlukan bahan makanan dan keadaan lingkungan tertentu untuk pertumbuhannya dan perkembang biakkannya. Unsur-unsur yang diperlukan, seperti : karbon, hidrogen, oksigen, fosfor, kalium, nitrogen, belerang, kalsium, besi, dan magnesium. Selain itu juga diperlukan vitamin-vitamin (D.Syamsul Bachri, 1987).
II.1.10 Distilasi Batch
Distilasi diferensial biasanya dilakukan secara batch dalam bejana distilasi, uap yang terbentuk (Vm) segera diembunkan dan distilat (D) yang terjadi dipisahkan dari liquida yang tertinggal dalam bejana (W). Karena uap akan lebih banyak mengandung komponen yang lebih volatile maka kadar residu yang lebih volatile makin lama makin kecil, dapat persamaan sebagai berikut:
Vm = - d/dt (W . xW)
Vm = - W . dxW /dt - xW . dW/dt
Vm = D . yD
Pengurangan kecepatan aliran dalam still-pot = kecepatan aliran keluar
W . dxW /dt + xW . dW/dt = - D . yD
Dimana: komposisi liquida di bottom (xw), komposisi liquida komponen i (xi), komposisi uap
di distilat (yD) dan komposisi uap komponen i (yi).
Didefinisikan dimensionless waktu () adalah sebagai berikut:
Persamaan diatas merupakan model Differential-Algebraic-Equations (DAEs) untuk distilasi batch sederhana sistem multi komponen, dengan asumsi tidak membentuk dua phase liquida. Persamaan diatas dengan forward-finite-difference, akan diperoleh komposisi liquida di bottom (xi,j+1) sebagai fungsi , sehingga didapat sebagai berikut :
xi,j+1 = xi,j + (yi,j– xi,j)
Dimana komposisi liquida mula-mula di bottom (xi,j) dan ditentukan, sedangkan
II.2 Landasan Teori
Air leri merupakan air yang berasal dari proses pencucian beras sebelum ditanak menjadi nasi. Dimana pada saat ini pemanfaatan air leri hanya sebatas sebagai minuman ternak, untuk menyiram tanaman, atau hanya dibuang begitu saja. Proses pencucian beras menyebabkan ikut melarutnya zat gizi yang terlepas dari biji beras ke dalam air cucian beras tersebut. Zat-zat gizi yang ikut dalam cucian beras meliputi karbohidrat, thiamin, dan senyawa organik lainnya dimana kandungan tersebut masih berpotensi sebagai bahan dasar pembuatan ethanol (http://id.wikipedia.org/wiki/Beras).
Pati atau amilum adalah karbohidrat kompleks yang tidak larut dalam air, berwujud bubuk putih, tawar dan tidak berbau. Tetapi pati akan terlarut sempurna jika dilakukan pemanasan terlebih dahulu (http://id.wikipedia.org/wiki/Beras).
II.2.1 Hidrolisis
Pati merupakan komponen yang lebih kompleks daripada disakarida. Sebelum difermentasi, pati harus dipecah dengan menggunakan enzim amilase (banyak terdapat dalam gandum yang berkecambah) menjadi komponen disakarida yaitu maltosa. Dengan menggunakan enzim lain yaitu maltase, maltosa akan dihidrolisa menjadi glukosa
(Gumbira Sa’id, 1987).
Proses hidrolisis dipengaruhi dengan beberapa faktor, antara lain sebagai berikut : a. Jumlah kandungan karbohidrat pada bahan baku
Bahan yang hendak di hidrolisis diaduk dengan air panas dan jumlah bahan kering umumnya sekitar 18 – 22 % (Soebijanto, 1986).
b. pH operasi atau konsentrasi asam yang digunakan
pH berpengaruh terhadap jumlah produk hidrolisis, pH ini erat hubungannya dengan konsentrasi asam, dimana pH makin rendah bila konsentrasi asam yang digunakan lebih besar, pH yang baik sekitar 2,3 (Soebijanto, 1986).
Untuk mengatur pH air tape menjadi pH 4,5 – 5,5 agar sesuai dengan syarat tumbuh Saccharomyces cereviceae (ragi roti). Jika nilai pH lebih dari 5,5 maka dapat ditambahkan HCl 0,1 N agar nilai pH berada pada kisaran yang diinginkan. Begitu juga sebaliknya, jika nilai pH kurang dari 4,5 dapat ditambah NaOH 0,1 N sampai nilai pH berada pada kisaran yang telah ditentukan (Soebijanto, 1986).
c. Waktu hidrolisis
Semakin lama pemanasan, warna semakin keruh dan semakin besar pula konversi pati yang dihasilkan. Waktu optimum yang diperoleh untuk proses hidrolisis asam yaitu 60 menit (Soebijanto, 1986).
d. Rasio HCl
II.2.2 Pertumbuhan Mikroorganisme
Pertumbuhan Mikroorganisme
Pertumbuhan sel merupakan puncak aktivitas fisiologik yang saling mempengaruhi secara beraturan. Proses pertumbuhan ini sangat kompleks mencakup pemasukan nutrient dasar dari lingkungan ke dalam sel, konversi bahan-bahan nutrient menjadi energi dan berbagai konstituent sel yang vital serta perkembangbiakkan. Pertumbuhan mikroorganisme dapat ditandai dengan peningkatan jumlah dan masa sel, sedangkan kecepatan petumbuhan tergantung pada lingkungan fisik dan kimianya (Krisno agus dan Budiyanto, 2002).
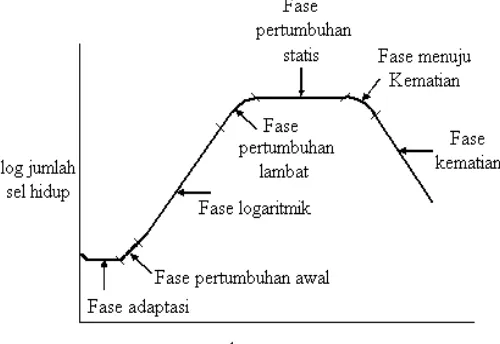
Pertumbuhan mikroorganisme dapat digambarkan sebagai kurva berikut :
Gambar II.1. kurva Pertumbuhan Kultur Jasad Renik Keterangan Gambar :
a. Fase Adaptasi
1. Medium dan lingkungan pertumbuhan
Jika nutrient yang tersedia dan kondisi lingkungan yang baru sangat berbeda dengan sebelumnya, diperlukan waktu penyesuaian untuk mensintesa enzim – enzim yang dibutuhkan untuk metabolisme (Krisno agus dan Budiyanto, 2002).
2. Jumlah inokulum
Jumlah awal sel yang semakin tinggi akan mempercepat fase adaptasi (Krisno agus dan Budiyanto, 2002).
b. Fase Pertumbuhan Awal
Setelah mengalami fase adaptasi, sel mulai membelah dengan kecepatan yang masih rendah karena baru selesai tahap penyesuaian diri
(Krisno agus dan Budiyanto, 2002). c. Fase Pertumbuhan Logaritmik
Sel jasad renik membelah dengan cepat dan konstan, dimana pertumbuhan sangat dipengaruhi oleh medium tempat tumbuhnya, seperti pH, kandungan nutrient, suhu dan kelembabab udara. Pada fase ini sel membutuhkan energi lebih benyak dari fase lainnya dan juga paling sensitive terhadap keadan lingkungan
(Krisno agus dan Budiyanto, 2002). d. Fase Pertumbuhan lambat
Pada fase ini pertumbuhan populasi jasad renik diperlambat dikarenakan beberapa sebab :
1.Zat nutrisi didalam medium sudah sangat berkurang.
2.adanya hasil – hasil metabolisme yang mungkin beracun atau dapat menghambat pertumbuhan jasad renik
e. Fase Pertumbuhan Statis (tetap)
Pada fase ini, jumlah populasi sel tetap, karena jumlah sel yang mati sama dengan jumlah sel yang tumbuh. Ukuran sel menjadi lebih kecil, karena sel terus membelah sementara nutrisi yang ada semakin berkurang. Pada fase ini sel memjadi lebih tahan terhadap keadaan akstrim seperti panas, dingin, radiasi, dan bahan kimia (Krisno agus dan Budiyanto, 2002).
f. Fase Menuju Kematian dan Fase Kematian
Pada fase ini sebagian populasi jasad renik mulai mengalami kematian karena beberapa sebab, yaitu :
1. Nutrient didalam medium sudah habis 2. Energi cadangan didalam sel habis
Jumlah sel yang mati akan semakin banyak, dan kecepatan kematian dipengaruhi oleh kondisi nutrient, lingkungan dan jenis jasad renik
(Krisno agus dan Budiyanto, 2002).
II.2.3 Fermentasi
Faktor – faktor yang mempengaruhi dalam proses fermentasi antara lain sebagai berikut : 1. pH
pH yang baik untuk fermentasi, yaitu antara pH 4 – 5. pH ini adalah pH yang disenangi oleh ragi dan pada pH ini dapat menahan perkembangan banyak jenis bakteri. Untuk mengasamkan biasanya dipergunakan asam sulfat. Yang lebih baik lagi adalah asam laktat, karena asam laktat baik untuk pertumbuhan ragi, tetapi keburukannya dapat tumbuh bakteri asam butirat yang dapat merugikan fermentasi dari ragi (D. Syamsul Bahri, 1987).
2. Waktu
3. Suhu
Pada umumnya suhu yang baik untuk proses fermentasi antara 25 – 30 ºC. Semakin rendah suhu fermentasi akan semakin tinggi alkohol yang di hasilkan. Hal ini dikarenakan pada suhu yang rendah fermentasi akan lebih lengkap dan kehilangan alkohol karena terbawa oleh gas karbondioksida akan lebih sedikit (Krisno agus dan budiyanto, 2002).
4. Bahan Nutrient
Kecepatan fermentasi akan dipengaruhi oleh konsentrasi garam logam dalam perasan. Pada konsentrasi yang rendah akan menstimulur. Aktivitas dan pertumbuhan khamir, sedangkan pada konsentrasi tinggi akan menghambat pertumbuhan khamir. Unsur yang dibutuhkan untuk aktivitas khamir antara lain Mg, K, Zn, CO, Fe, Ca, Cu, P, S, dan N. Sebagai sumber P dan N perlu ditambahkan ammonium phospat. Sebagai sumber N lainnya dapat pula ditambahkan ammonium klorida dan ammonium karbonat. Vitamin yang berfungsi sebagi faktor pertumbuhan khamir (Krisno agus dan budiyanto, 2002).
5. Konsentrasi Gula
Gula yang ditambahkan bertujuan untuk memperoleh kadar alkohol yang lebih tinggi, walaupun jika kadar gula tertalu tinggi aktivitas khamir dapat terhambat. Kadar gula yang baik untuk permulaan fermentasi adalah 16 %. Hal ini bertujuan untuk mempercepat pertumbuhan khamir pada awal fermentasi. Penambahan kadar gula akan mengarahkan fermentasi lebih sempurna serta menghasilkan alkohol yang tinggi. Kadar gula yang optimum untuk aktivitas pertumbuhan khamir adalah 10 % (Krisno agus dan budiyanto, 2002).
II.2.4 Distilasi batch
Faktor yang mempengaruhi dalam proses destilasi batch yaitu Suhu Pemanasan. Disini suhu pemanasan pada saat dilakukan distilasi batch dijaga antara suhu 78 oC, hal ini dilakukan agar air yang terkandung didalam air leri tidak ikut menguap.
II.3 Hipotesa
BAB III
RENCANA PENELITIAN
III.1 Bahan - bahan yang digunakan
Bahan dasar yang digunakan dalam penelitian ini adalah limbah cucian beras (air leri) yang diperoleh dari cucian beras. Air cucian beras ini diperoleh dari Kantin Pusat Universitas Pembangunan Nasional “Veteran” Jawa Timur, Surabaya dan juga diperoleh dari air cucian beras dari rumah anggota penelitian ini. Air cucian beras inilah yang nantinya akan kami analisa kadar glukosanya untuk kemudian kami lakukan proses hidrolisa.
Untuk bakteri Saccharomyces cereviseae kami peroleh dengan cara mengkultur terlebih dahulu. Dan untuk Asam klorida kami peroleh dari salah satu toko kimia di Jalan Tidar Surabaya.
III.2 Alat yang digunakan
Alat-alat yang digunakan untuk proses meliputi alat hidrolisa, alat fermentasi dan alat distilasi batch secara mini plant.
III.3 Gambar Alat yang digunakan
Fermentasi
III.4 Peubah yang dijalankan
1. Proses Hidrolisis
Peubah yang ditetapkan
a. Suhu = 30oC
b. Waktu Hidrolisa = 1 hari c. Volume bahan baku = 100 ml
Peubah yang dijalankan
a. Konsentrasi HCl = 10 % ; 20 % ; 30 %
b. pH larutan = 3, 4, 5
2. Proses Fermentasi
Peubah yang ditetapkan
a. Suhu = 30 oC
b. pH hasil analisa = 4
c. Saccharomyces Cereviseae = 10 % volume cairan fermentasi
Peubah yang dijalankan
a. Waktu Fermentasi = 5, 6, 7 (hari)
3. Distilasi
Peubah yang ditetapkan
III.4 Prosedur Penelitian
III.4.1. Hidrolisis
1. Mencampurkan bahan baku dengan larutan HCl sesuai dengan konsentrasi yang dijalankan dan juga menyesuaikan pH dengan pH yang dijalankan dan pada suhu 30oC selama 1 hari.
2. Menganalisa kadar glukosa pada filtrat hasil hidrolisa dan mencari kondisi terbaik untuk dilakukan fermentasi.
III.4.2. Pembuatan Media
1. Membuat Nutrient Agar
Bahan :
Ekstrak Daging = 0,6 gram Pepton = 1 gram Agar – agar = 2,8 gram Aquadest = 200 ml Cara :
1. Bahan tersebut dicampur dalam erlenmeyer / beker gelas, dipanaskan sampai larut semua.
2. Sterilkan dalam autoclave selama 15 menit.
3. Dinginkan sampai kira-kira 70oC, lalu pindahkan dalam petridist yang steril. Kerjakan dalam ruang steril.
2. Pembuatan Media Cair untuk Pembiakan Kultur
Bahan :
Ekstrak Daging = 0,3 gram Pepton = 0,5 gram NaCl = 0,5 gram Aquadest = 100 ml Cara :
1. Bahan – bahan tersebut dicampur dalam erlenmeyer, lalu dipanaskan sampai mendidih selama 5 menit.
2. Buatlah suasana asam dari campuran itu dengan ditambahkan asam sitrat hingga pH 4. Chek dengan pH universal.
3. Saringlah campuran itu sehingga diperoleh cairan murni.
4. Sterilkan media ini selama 15 menit pada inkubator yang dilengkapi dengan lampu UV. Didinginkan dan media siap ditanami.
5. Setelah ditanami sebentar – sebentar di goyang / di shaker.
3. Membuat media cair untuk kurva pertumbuhan
Bahan :
Kecambah pendek = 15 gram
Gula = 25 gram
Aquadest = 500 ml KH2PO4 = 5 gram
Cara :
1. 15 gram kecambah (tauge) pendek yang baru tumbuh. Tumbuklah kasar – kasar, kemudian rebuslah dengan aquadest sebanyak 500 cc.
3. Didihkan selama 30 menit, lalu disaring.
4. Filtrat dibuat pH = 4, dengan penambahan asam sitrat. 5. Lalu disterilkan.
6. Filtratnya setelah dingin ditambahkan biakan Saccharomyces Cerevisiae.
7. Lalu diinkubasi selama 48 jam, setiap 2 jam sekali diambil sampel (contoh) untuk dianalisa sel keringnya ( sebentar – sebentar dikocok / dishaker ).
8. Analisa sel keringnya :
Setiap 2 jam sekali contoh diambil 10 ml, lalu disaring, kemudian dioven pada suhu 105oC – 110 oC. Selama 30 menit, lalu dimasukkan ke Exikator. Setelah dingin ditimbang, kemudian dioven lagi dan seterusnya sampai beratnya konstan.
9. Setelah selesai percobaan. Buat kurva pertumbuhannya.
4. Pembuatan Starter Untuk Fermentasi
1. 3 gram kecambah pendek yang baru tumbuh. Tumbuk kasar kemudian rebuslah dengan aquadest sebanyak 100 ml.
2. Tambahkan gula 5 gram dan KH2PO4 1 gram.
3. Didihkan selama 30 menit, lalu saring.
4. Filtrat dibuat pH 4 dengan penambahan asam sitrat. 5. Lalu disterilkan.
6. Filtratnya setelah dingin ditambahkan biakan Saccharomyces Cereviseae sebanyak 10 ml.
7. Lalu dikocok sampai awal exsponensial kemudian masukkan dalam media fermentasi.
III.4.3. Fermentasi
2. Menambahkan NaOH 1N ke dalam filtrat hasil hidrolisa yang akan difermentasi hingga mencapai pH fermentasi yang telah ditetapkan ( 4 ), kemudian disterilkan dalam inkubator yang dilengkapi dengan UV selama 15 menit.
3. Matikan lampu UV dan Memasukkan starter ke dalam larutan tersebut dalam kondisi anaerobik.
4. Menutup rapat botol untuk melakukan fermentasi dan mengamati selama 5 – 7 hari. 5. Kemudian hasil fermentasi yang didapat didistilasi.
III.4.4. Prosedur Proses Distilasi
III.5 Blok Diagram Pembuatan Bioethanol dari Air Cucian Beras (Air Leri)
Limbah air cucian beras (air leri) 100 (ml)
Hidrolisis 1 hari; suhu 30 oC
HCl 10, 20, 30 (%) pH 3, 4, 5
Filtrasi
Padatan
Filtrat Uji Glukosa
Fermentasi Waktu Fermentasi
5,6,7 (hari) Saccharomyces Cerevisiae 10 % x volume cairan
Filtrasi
Filtrat
Padatan
Distilasi
Analisa Ethanol Uji Glukosa sisa
III.6. Diagram Proses Fermentasi
A. Bagan Pembuatan Nutrient Agar
Cara Kerja :
1. Bahan tersebut dicampur dalam erlenmeyer / beker gelas, dipanaskan sampai larut semua.
2. Sterilkan dalam autoclave selama 15 menit.
3. Dinginkan sampai kira-kira 70oC, lalu pindahkan dalam petridist yang steril. Kerjakan dalam ruang steril.
4. Media padat dalam petridist siap ditanami.
Ekstrak daging (0,6 gram) Pepton (1 gram) Agar-agar (2,8 gram)
Aquadest (500 ml) dipanaskan
Sterilisasi (15 menit)
Didinginkan
Pindahkan dalam petridist Dikerjakan dalam ruang steril
B. Bagan Pembuatan Media Cair Untuk Pembiakan Kultur
Cara Kerja :
1. Bahan – bahan tersebut dicampur dalam erlenmeyer, lalu dipanaskan sampai mendidih selama 5 menit.
2. Buatlah suasana asam dari campuran itu dengan ditambahkan asam sitrat hingga pH 4. Chek dengan pH universal.
3. Saringlah campuran itu sehingga diperoleh cairan murni.
4. Sterilkan media ini selama 15 menit pada inkubator yang telah dilengkapi dengan lampu UV.
5. Didinginkan dan media siap ditanami.
6. Setelah ditanami sebentar – sebentar di goyang / di shaker.
Ekstrak daging (0,3 gram) Pepton (0,5 gram) NaCl (0,5 gram)
Aquadest (100 ml) dipanaskan
Sterilisasi (15 menit)
Didinginkan
Media siap ditanami
Di goyang atau di shaker
C. Bagan Pembuatan Media Cair Untuk Kurva Pertumbuhan
Cara Kerja :
1. 15 gram kecambah (tauge) pendek yang baru tumbuh. Tumbuklah kasar – kasar, kemudian rebuslah dengan aquadest sebanyak 500 cc.
2. Tambahkan gula sebanyak 25 gram. 3. Didihkan selama 30 menit, lalu disaring.
4. Filtrat dibuat pH = 4, dengan penambahan asam sitrat. 5. Lalu disterilkan.
6. Filtratnya setelah dingin ditambahkan biakan Saccharomyces Cerevisiae.
7. Lalu diinkubasi selama 48 jam, setiap 2 jam sekali diambil sampel (contoh) untuk dianalisa sel keringnya ( sebentar – sebentar dikocok / dishaker ).
Kecambah pendek 15 gram ditumbuk kasar
Aquadest (500 ml), direbus
Ditambahkan gula ( 25 gram ) dan KH2PO4 ( 5 gram )
Didihkan 30 menit, lalu disaring
Asam sitrat dibuat pH 4
Disterilkan ( 15 menit )
Diinkubasi ( 48 jam ) Setiap 2 jam diambil sampel
Saccharomyces Cereviceae (3 ose)
8. Analisa sel keringnya :
Setiap 2 jam sekali contoh diambil 10 ml, lalu disaring, kemudian dioven pada suhu 105oC – 110 oC. Selama 30 menit, lalu dimasukkan ke Exikator. Setelah dingin ditimbang, kemudian dioven lagi dan seterusnya sampai beratnya konstan.
D. Bagan Pembuatan Starter
Cara Kerja :
1. 3 gram kecambah pendek yang baru tumbuh. Tumbuk kasar kemudian rebuslah dengan aquadest sebanyak 100 ml.
2. Tambahkan gula 5 gram dan KH2PO4 1 gram.
3. Didihkan selama 30 menit, lalu saring.
4. Filtrat dibuat pH 4,5 dengan penambahan asam sitrat. 5. Lalu disterilkan.
6. Filtratnya setelah dingin ditambahkan biakan Saccharomyces Cereviseae sebanyak 10 ml.
7. Lalu dikocok sampai awal exsponensial kemudian masukkan dalam media fermentasi. Kecambah pendek 15 gram ditumbuk kasar
Aquadest (100 ml), direbus
Ditambahkan gula ( 5 gram ) dan KH2PO4 ( 1 gram )
Didihkan 30 menit, lalu disaring
Asam sitrat dibuat pH 4
Disterilkan ( 15 menit )
Dikocok/dishaker
Saccharomyces Cereviceae (3 ose)
BAB IV
HASIL DAN PEMBAHASAN
IV.1 Analisa Bahan Baku (Limbah air cucian beras (air leri))
Berdasarkan hasil analisa bahan awal (limbah air cucian beras (air leri)) diperoleh data sebagai berikut :
Tabel IV.1. Kadar Karbohidrat dan Kadar Glukosa pada Limbah air cucian
beras (air leri)
Sampel Kadar Glukosa (%) Kadar Karbohidrate (%)
1 26,47 19,78
Sumber : Balai Besar Laboratorium Kesehatan Surabaya
IV.2. Proses Hidrolisis
Tabel IV-2. Hasil Analisa Kadar Glukosa
Sumber : Labolatorium Analisa Pangan UPN “Veteran” Surabaya
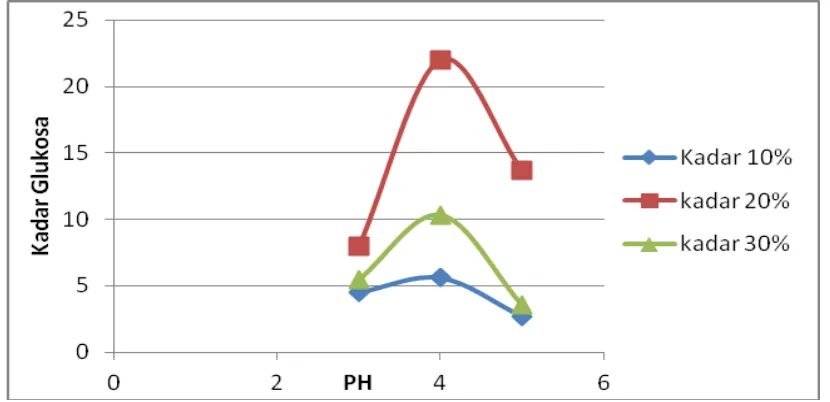
Gambar IV.1. Pengaruh pH hidrolisis dan berat kadar HCl terhadap kadar glukosa
No Kode
Sampel
pH Kadar Hcl (%)
Hasil Analisa Glukosa (g/100 ml)
1 A 4 30 10,30
2 B 4 20 22,00
3 C 3 30 5,50
4 D 5 30 3,60
5 E 4 10 5,60
6 F 5 10 2,70
7 G 3 20 8,00
8 H 3 10 4,50
Dari gambar IV.1 diperoleh hasil . Hasil terbaik dapat dilihat dari grafik yakni pada pH 4 dengan kadar glukosa 22.0 %. Dan dari grafik ini pula dapat dilihat bahwa kadar HCl terbaik yakni 20 %. Hal ini disebabkan karena pada konsentrasi 10 % terjadi degradasi glukosa yang terbentuk menjadi struktur kimia yang lain, sehingga dapat menurunkan konversi reaksi. Sedangkan pada konsentrasi yang lebih tinggi yaitu 30% tampak kadar glukosa menurun. Hal ini dikarenakan pada konsentrasi yang tinggi terjadi proses pembakaran karbohidrat sehingga karbohidrat yang dirubah menjadi glukosa menjadi sedikit dan pada akhirnya glukosa yang dihasilkan juga sedikit, dan kadar glukosa yang diperoleh pun semakin kecil.
IV.3 Kurva Pertumbuhan Bakteri Saccharomyces cerevisiae
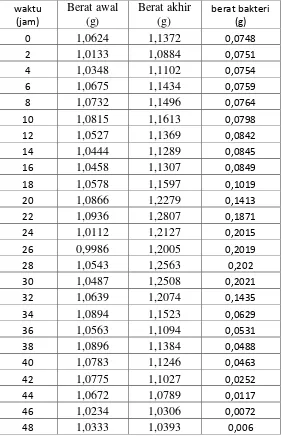
Tabel IV-3. Hasil Pengamatan Kurva Pertumbuhan
Gambar IV-2. Kurva Pertumbuhan Bakteri Saccharomyces cerevisiae
IV.4 Hasil Fermentasi
Dari hasil analisis diperoleh kadar glukosa sisa sebagai berikut :
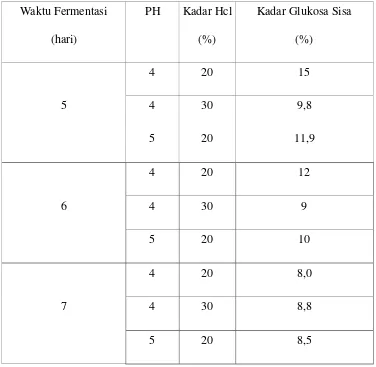
Tabel IV-4. Pengaruh Lama Fermentasi Terhadap Kadar Glukosa Sisa yang
Dihasilkan pada Proses Fermentasi
Waktu Fermentasi (hari)
PH Kadar Hcl (%)
Kadar Glukosa Sisa (%)
5
4 20 15
4 30 9,8
5 20 11,9
4 20 12
6 4 30 9
5 20 10
4 20 8,0
7 4 30 8,8
5 20 8,5
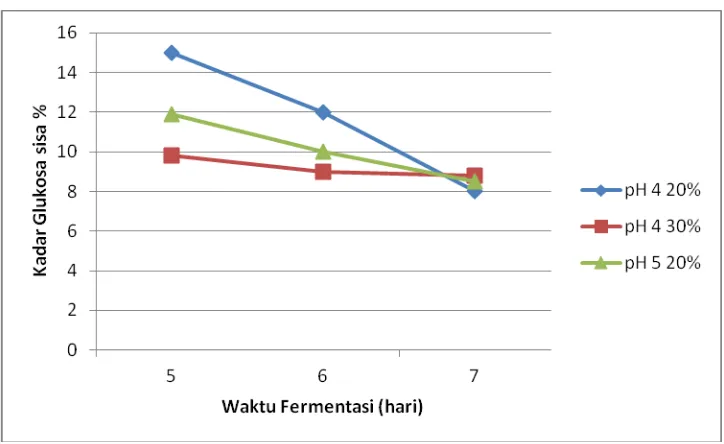
Gambar IV-3. Hubungan antara kadar glukosa sisa terhadap lama fermentasi
Tabel IV-4. Kadar Ethanol yang diperoleh dari Proses Fermentasi menggunakan
alkoholmeter
Sampel PH Kadar Hcl (%) Kadar Ethanol (%)
1 4 20 8
2 4 30 8
3 5 20 7,5
Pada gambar IV.3. diatas dapat dilihat bahwa pada setiap perlakuan didapatkan hasil bahwa semakin lama waktu fermentasi, kadar glukosa sisa semakin rendah. Kadar glukosa sisa paling kecil (8 %) pada waktu fermentasi 7 hari. Sedangkan kadar glukosa sisa terbesar (15 %) yaitu pada fermentasi dengan waktu fermentasi 5hari.
Namun tahapan dalam penelitian kami ini sebenarnya terdapat beberapa tahapan yang seharusnya tidak perlu dilakukan. Untuk perhitungan kadar glukosa sisa sebenarnya tidak perlu dilakukan secara keseluruhan, karena tahapan ini hanya berfungsi untuk mengecek apakah masih ada glukosa yang belum terkonversi menjadi bioetanol setelah dilakukannya proses fermentasi.
Dan yang seharusnya dilakukan adalah mengecek berapa kadar etanol yang terbentuk dari proses fermentasi denngan menggunakan piknometer dan bukan menggunakan alkoholmeter, karena hasil yang didapatkan akan kurang valid.
IV.5 Analisa Hasil Distilasi
Dari hasil analisis diperoleh kadar ethanol sebagai berikut :
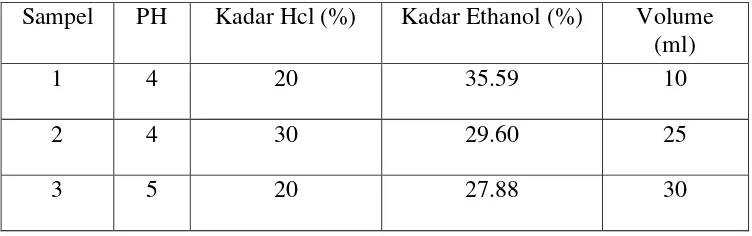
Tabel IV-5. Kadar Ethanol yang diperoleh dari Proses Distilasi
Sampel PH Kadar Hcl (%) Kadar Ethanol (%) Volume (ml)
1 4 20 35.59 10
2 4 30 29.60 25
3 5 20 27.88 30
Sumber : Labolatorium Penelitian Dan Konsultasi Industri Surabaya
BAB V
KESIMPULAN DAN SARAN
V.1. Kesimpulan
1. Kadar Glukosa awal pada air cucian beras adalah 16,47 %.
2. Dari proses hidrolisis diperoleh kadar glukosa yang terbaik adalah 22 % dengan menambahkan HCl 20 % ke dalam 100 ml larutan air cucian beras (air leri) dengan pH 4.
3. Pada proses fermentasi kondisi terbaik untuk menghasilkan etanol yaitu dengan menggunakan kadar glukosa sebesar 22 %. Proses fermentasi berlangsung selama 7 hari dan menghasilkan ethanol sebesar 35,59 % Setelah proses fermentasi tersebut menghasilkan kadar glukosa sisa 8 %.
4. Air cucian beras (air leri) dapat digunakan sebagai bahan baku alternatif pembuatan bio-ethanol.
V.2. Saran
Diharapkan penelitian ini dapat dikembangkan dengan proses hidrolisis enzim untuk memecah selulosa dan waktu fermentasi yang lebih lama guna melihat sejauh mana kemampuan mikroorganisme dalam mengkonversi glukosa menjadi ethanol. Selain itu untuk mendapatkan kadar ethanol yang jauh lebih tinggi dan murni, ada baiknya dilakukan proses distilasi bertingkat.
DAFTAR PUSTAKA
Anonim. 2012. Asam Klorida. http://id.wikipedia.org/wiki/Asam_klorida. Diakses tanggal 27 Juni 2012
Anonim. 2012. Beras. http://id.wikipedia.org/wiki/Beras. Diakses tanggal 27 Juni 2012 Anonim. 2012. http://lin2suliz.wordpress.com/edisi-baru-thn-2009/. Diakses tanggal 10
September 2012
Anonim.2012.
http://www.esru.strath.ac.uk/EandE/Web_sites/02-03/biofuels/what_bioethanol.htm. Diakses tanggal 3 September 2012 Badan Penelitian dan Pengembangan Industri (1990)
Bahri, Syamsul D., 1987, Laporan Penelitian Pembuatan Alkohol dari Nira Aren dan Lontara, pp. 11–13, Departemen Perindustrian Balai Penelitian Kimia, Ujung Pandang.
Balai Besar Laboratorium Kesehatan Surabaya
Budiyanto, Krisno Agus., 2002, Mikrobiologi Dasar, pp. 71–75, Universitas Muhammadiyah Malang, Malang.
Darmadjati, 1988, Struktur Kandungan Gizi Beras dalam Ismunadji M, pp. 13-31, Pusat Litbang Tanaman Pangan, Bogor.
Fardiaz, Srikandi., 1992, Mikrobiologi Pangan, Edisi 1., pp. 245-254, PT. Gramedia Pustaka Utama, Jakarta.
Groggins, P H., 1958, Unit Processes in Organic Synthesis, 5th ed., Mc. Graw Hill Kogakasha, Tokyo.
Henley dan Seader, (1998), Separation Process, Publishing Company.Inc 1998, New York Kartika, B., 1992, Petunjuk Evaluasi Produk Industri Hasil Pertanian, pp. 209–218,
Pusat Antar Universitas, UGM., Yogyakarta. Labolatorium Analisa Pangan UPN “Veteran” Surabaya Labolatorium Penelitian Dan Konsultasi Industri Surabaya
Ni Ketut Sari, 2012 http://niketutsari.wordpress.com pemanfaatan-limbah-cair-tepung-tapioka-sebagai-ethanol Diakses tanggal 28 Mei 2012
Ni Ketut Sari, 2012 http://niketutsari.wordpress.com/2012/04/29/b-bab-2-proses-kimia-dan-biologi-pembuatan-bioethanol-dari-rumput-gajah Diakses tanggal 29 April 2012 Othmer, Kirck., 1963, Encyclopedia of Chemical Technologi, 2nd ed., Volume 10., pp.
523-528, Mc. Graw Hill Kogakasha, Tokyo.
Sa’id, E Gumbira., 1987, Bioindustri, Penerapan Teknologi Fermentasi, pp. 264-273, PT. Melton Putra, Jakarta.
Sa’id, E Gumbira., 1989, Fermentor, pp. 9-27, Institut Pertanian Bogor, Bogor. Supranto, 1998, “Proses Industri Kimia II”, Teknik, Kimia FT UGM, Yogyakarta.
Tjokroadikoesoemo, P Soebijanto., 1986, HFS dan Industri Ubi Kayu Lainnya, pp. 6-17, PT. Gramedia Pustaka Utama, Jakarta.