STUDI DORMANSI, KADAR AIR KRITIKAL, DAN
PENINGKATAN KECEPATAN PERKECAMBAHAN
BENIH KENANGA (Cananga odorata Lam. Hook. F. &
Thoms.)
ZAHROUL ATHIYAH A34403047
PROGRAM STUDI
PEMULIAAN TANAMAN DAN TEKNOLOGI BENIH
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
2008
RINGKASAN
ZAHROUL ATHIYAH. A34403047. Studi Dormansi, Kadar Air Kritikal, dan Peningkatan Kecepatan Perkecambahan Benih Kenanga (Cananga odorata Lam. Hook. F. & Thoms.). (Dibimbing FAIZA C. SUWARNO dan DHARMAWATI F. DJAM’AN).
Penelitian ini bertujuan mengetahui karakteristik dormansi pada benih kenanga, mengetahui kadar air kritikal benih kenanga sehingga akan diketahui apakah benih kenanga adalah benih ortodok, intermediat, atau rekalsitran, dan mempelajari teknik-teknik meningkatkan kecepatan perkecambahan benih kenanga. Penelitian ini dilaksanakan pada bulan Mei hingga Juli 2007 di Laboratorium Balai Penelitian Teknologi Perbenihan Pakuan, Ciheuleut, dan Laboratorium Ilmu dan Teknologi Benih IPB, Darmaga, Bogor.
Penelitian ini terdiri dari 3 percobaan. Percobaan pertama merupakan studi penentuan karakteristik dormansi pada benih kenanga. Percobaan kedua mengkaji tentang penentuan Kadar Air Kritikal benih kenanga. Percobaan ketiga mengkaji teknik-teknik peningkatan kecepatan perkecambahan benih kenanga. Percobaan 1 menggunakan Rancangan Acak Lengkap satu faktor. Perlakuannya yaitu pengecambahan benih kenanga utuh, pengecambahan benih kenanga tanpa testa, pengecambahan benih kenanga dengan skarifikasi, pengecambahan benih kenanga dengan skarifikasi dan perendaman dalam KNO3. Percobaan 2 dan 3 menggunakan Rancangan Acak Kelompok satu faktor. Perlakuan percobaan 2 yaitu kontrol, desikasi vacuum selama 3, 6, 9, dan 12 jam, pengering-anginan selama 24, 36, 48, dan 60 jam. Perlakuan percobaan 3 yaitu kontrol, perendaman dalam KNO3 1%, 2.5%, dan5% selama 60 menit, perendaman dalam air kelapa 50% dan 100% selama 4 jam, perendaman dalam larutan Shiimarocks 500 ppm, 1000 ppm, dan 1500 ppm selama 24 jam. Peubah yang diamati antara lain Kadar Air (KA) benih, Daya Berkecambah (DB), Potensi Tumbuh Maksimum (PTM), Indeks Vigor (IV), Kecepatan Tumbuh (KCT), dan Jumlah Daun (JD).
Pada percobaan 2 dan 3, kondisi penempatan blok perkecambahan dapat digambarkan sebagai berikut; blok 1 kisaran intensitas cahaya matahari pada pagi, siang dan sore hari mulai dari 1500 sampai diatas 20000 lux, blok 2 kisaran dari 1400 sampai diatas 20000 lux, sedangkan blok 3 intensitas cahayanya hanya mulai 300 sampai 2500 lux saja.
Pelaksanaan percobaan pertama sulit dilakukan, karena benih kenanga memiliki embrio yang berukuran kecil, testa yang sangat keras, liat dan berlapis-lapis, sehingga menyebabkan benih sulit berkecambah. Benih kenanga diduga juga memiliki lapisan endosperma pada kotiledon benih yang menghambat proses perkecambahan. Karakteristik dormansi benih kenanga belum dapat diketahui karena benih yang diberi perlakuan skarifikasi dan tanpa testa terserang cendawan Aspergillus.
Hasil percobaan kedua menunjukkan bahwa penurunan kadar air tidak berpengaruh terhadap semua peubah pengamatan.:daya berkecambah, potensi tumbuh maksimum, indeks vigor, kecepatan tumbuh dan jumlah daun sehingga kadar air kritikal tidak dapat ditentukan. Daya berkecambah awal hanya 58.7%, lebih rendah dari standar mutu benih nasional yaitu 80%. Perlakuan pengering-anginan secara manual cenderung menurunkan kadar air yang lebih besar jika
dibandingkan penurunan kadar air secara desikasi vakum, akan tetapi penurunan kadar air dengan pengeringanginan secara manual lebih tidak terkontrol dan sulit dijadikan standar. Perlakuan penurunan kadar air benih pada taraf K0 (perlakuan kontrol dengan KA 38.27%) mempunyai nilai rataan PTM dan DB berturut-turut 67.7% dan 58.7% walaupun jika dibandingkan dengan taraf perlakuan yang lainnya 14.47%, hasilnya tidak berbeda nyata. Hal ini menunjukkan bahwa benih kenanga tidak termasuk dalam benih rekalsitran.
Hasil percobaan ketiga menunjukkan perlakuan pemberian beberapa taraf KNO3, air kelapa, dan shiimarocks tidak dapat secara nyata mempercepat daya berkecambah, potensi tumbuh maksimum, kecepatan tumbuh, kecepatan tumbuh relatif, maupun jumlah daun. Meskipun demikian, perlakuan air kelapa dengan konsentrasi 50% memiliki kecepatan perkecambahan 1.82%/etmal, cenderung lebih tinggi secara statistik dengan α 18% jika dibandingkan dengan perlakuan perendaman benih dalam larutan Shiimarocks 1000 ppm yaitu 1.00%/etmal.
STUDI DORMANSI, KADAR AIR KRITIKAL, DAN
PENINGKATAN KECEPATAN PERKECAMBAHAN
BENIH KENANGA (Cananga odorata Lam. Hook. F. &
Thoms.)
Skripsi Sebagai Salah Satu Syarat Untuk Memperoleh Gelar Sarjana Pertanian Pada Fakultas Pertanian Institut Pertanian Bogor
ZAHROUL ATHIYAH A34403047
PROGRAM STUDI
PEMULIAAN TANAMAN DAN TEKNOLOGI BENIH
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
2008
LEMBAR PENGESAHAN
Judul : STUDI DORMANSI, KADAR AIR KRITIKAL, DAN PENINGKATAN KECEPATAN PERKECAMBAHAN BENIH KENANGA (Cananga odorata Lam. Hook. F. & Thoms.).
Nama : Zahroul Athiyah
NRP : A34403047
Mengetahui, Dekan Fakultas Pertanian
Institut Pertanian Bogor
Prof. Dr. Ir. Didy Sopandie, M.Agr NIP. 131 124 019
Tanggal Lulus :
Pembimbing 1
Dr. Ir. Faiza C. Suwarno, MS NIP. 130 937 898
Pembimbing 2
Dra. Dharmawati F. Djam’an NIP. 710 020 186 Menyetujui,
RIWAYAT HIDUP
Penulis dilahirkan di Nganjuk pada tanggal 12 April 1985 dari keluarga Bapak Toha dan Ibu Siti Hafsah sebagai anak kelima dari lima bersaudara.
Pada tahun 1997 penulis menyelesaikan pendidikan dasarnya di SD Negeri Tanjungkalang VI Ngronnggot Nganjuk. Tahun 2000 penulis lulus dari MTs Negeri 1 Tanjungtani Nganjuk dan melanjutkan ke SMU Negeri 1 Tanjunganom Nganjuk. Pada tahun 2003 penulis diterima sebagai mahasiswa program studi Pemuliaan Tanaman dan Teknologi Benih, Departemen Agronomi dan Hortikultura, Fakultas Pertanian, IPB melalui jalur SPMB (Seleksi Penyaringan Mahasiswa Baru).
Selama perkuliahan penulis pernah mengikuti program magang di Balai Pengkajian Teknologi Pertanian-BPTP Karangploso Malang tahun 2005, menjadi Asisten Praktikum mata kuliah Penyimpanan Benih, tahun ajaran 2006-2007, dan pada tahun 2007-2008 menjadi salah satu tutor pengajar KF (Keaksaraan Fungsional) yang diselenggarakan LPPM (Lembaga Penelitian dan Pengembangan Masyarakat) IPB.
Penulis juga cukup banyak menulis diantaranya Peranan Tanaman Transgenik dalam Pembangunan Pertanian Di Indonesia, pada tahun 2006, Hutan Indonesia, Hutan ”Dunia”, dalam Lomba essay Korea, tahun 2006. Tulisan lainnya adalah Prakarya ”Seed Scrabble” sebagai Sarana Pendidikan Pelestarian Keragaman Hayati Tumbuhan Indonesia, dalam LKTM (Lomba Karya Tulis Mahasiawa) bidang seni, tahun 2007, dan Pengembangan Produk Onibiyu (Onigiri Ubikayu) dalam Rangka Diversifikasi Pangan Produk Lokal, dalam LKTN (Lomba Karya Tulis Nasional ) Bidang Sosial Ekonomi Pertanian, tahun 2007.
Sebagai salah satu syarat untuk memperoleh gelar sarjana pertanian penulis melakukan penelitian dengan judul “Studi Dormansi, Kadar Air Kritikal, dan Peningkatan Kecepatan Perkecambahan Benih Kenanga (Cananga Odorata Lam. Hook. F. & Thoms.) dibawah bimbingan Dr. Ir. Faiza C. Suwarno, MS. dan Dra. Dharmawati F. Djam’an.
KATA PENGANTAR
Segala puji dan syukur penulis ucapkan kepada Allah SWT, atas segala rahmat dan karunia yang tiada henti Ia curahkan, dan juga atas kemurahan hati-Nya sehingga penulis dapat menyelesaikan penelitian dan skripsi yang berjudul Studi Dormansi, Kadar Air Kritikal, dan Peningkatan Kecepatan Perkecambahan Benih Kenanga (Cananga odorata Lam. Hook. F. & Thoms.) ini dengan baik dan tanpa hambatan yang berarti. Judul tersebut penulis ajukan sehubungan dengan prospek kenanga yang mampu menghasilkan minyak atsiri yang bernilai ekonomi tinggi akan tetapi perkembangan produktifitas yang lambat di Indonesia. Keluaran yang diharapkan adalah adanya pengetahuan awal tentang sifat-sifat benih kenanga sebagai bahan perbanyakan.
Pada kesempatan ini pula penulis ingin mengucapkan terima kasih yang setulus-tulusnya kepada seluru pihak yang membantu dalam kelancaran pelaksanaan penelitian maupun dalam penyusunan tugas akhir ini, yaitu:
1. Dr. Ir. Faiza C. Suwarno, MS sebagai pembimbing 1 yang telah memberikan bimbingan, nasehat, kritik dan saran dalam penyelesaian tugas akhir ini.
2. Dra. Dharmawati F. Djam’an sebagai pembimbing 2 yang telah memeberikan bimbingan, nasehat, kritik dan saran dalam penyelesaian tugas akhir ini.
3. Ir. Abdul Qadir, MSi sebagai Dosen penguji dari Departemen Agronomi dan Hortikultura.
4. Pimpinan BPTP (Balai Penelitian Teknologi Perbenihan Kehutanan) yang telah memberikan kesempatan tempat dan waktu kepada penulis untuk pelaksanaan penelitian.
5. Dr. Ir. Sobir, MSi sebagai Pembimbing Akademik 6. Dosen-dosen yang telah memberikan kritik dan saran
7. Ibu Enok, Bpk Ateng, Bpk Amoy, Bpk Dwi, Bpk Yatna, dan seluruh staff Balai Penelitian dan Pengembangan Teknologi Perbenihan Kehutanan atas bantuan dan dukungannya.
8. Ibu, Bapak, serta kakak-kakakku yang telah memberikan semangat dan dukungannya dalam menyelesaikan tugas akhir ini.
9. Kanda Rochi-suamiku, jazakumullah khoiron katsiro atas semangat dan dukungannya, Robbana yazidlana bilbaarokah, wash-shobar, wal-maghfiroh, warrohmah. Semoga pernikahan kita barokah selamanya.
10. Seluruh teman-teman PMTB 40 atas dukungan, perhatian dan persahabatannya.
11. Ayash, Yusuf, Fian, Ahmad, Rhamdan, Kiki, Zaki, Farhan, Iqbal, Rahman, dan ummi atas perhatian dan semangatnya.
12. T9 crew (Aida, Ria, Heni, Alm. Nyimas, Tedi, Dian, Arya) atas tausiyah dan semangat dari kalian
13. Temen-temenku di A-team, PJM,KF, Andika House (Sunda Karya red.), Muslimah kost atas dukungan dan persahabatannya
14. Keluarga besar Mahasiswa dan staff Fakultas Pertanian yang tidak dapat disebutkan satu-satu.
Skripsi ini ditulis sebagai tugas akhir dan syarat memperoleh gelar Sarjana Pertanian pada Program Studi Pemuliaan Tanaman dan Teknologi Benih, Departemen Agronomi dan Hortikultura, Fakultas Pertanian, Institut Pertanian Bogor. Penulis menyadari sepenuhnya bahwa tugas akhir ini masih jauh dari sempurna. Oleh karena itu, kritik dan saran yang membangun sangat diperlukan untuk perbaikan tulisan ini. Semoga tulisan ini dapat memberikan informasi yang berguna bagi pihak yang membutuhkan.
Bogor, Maret 2008
DAFTAR ISI
Halaman
DAFTAR TABEL ... vii
DAFTAR GAMBAR... ix PENDAHULUAN Latar Belakang ... 1 Tujuan ... 3 Hipotesis... 3 TINJAUAN PUSTAKA Kenanga ... 4 Perkecambahan ... 6
Sifat Benih Ortodok dan Rekalsitran ... 8
Dormansi ... 8
Perlakuan Benih ... 9
BAHAN DAN METODE Waktu dan Tempat ... 14
Bahan dan Alat mm... 14
Metode Penelitian ... 14
Pelaksanaan Percobaan ... 16
Pengamatan ... 19
HASIL DAN PEMBAHASAN Kondisi Umum ... 24
Percobaan 1. Studi Karakteristik Dormansi Benih ... 26
Percobaan 2. Penentuan Kadar Air Kritikal... 28
Percobaan 3. Peningkatan Kecepatan Perkecambahan ... 36
KESIMPULAN DAN SARAN Kesimpulan ... 43
Saran... 43
DAFTAR PUSTAKA ... 45
DAFTAR TABEL
Nomor Halaman
Teks
1. Karakteristik dan Tipe Dormansi pada Berbagai Benih ... 10 2. Kondisi Intensitas Cahaya dalam Rumah Kaca pada Pagi, Siang dan
Sore Hari ... 26 3. Analisis Ragam Pengaruh Penurunan Kadar Air Benih Kenanga
Terhadap Peubah Kadar Air (KA), Daya Berkecambah (DB), Potensi Tumbuh Maksimum (PTM, Indeks Vigor (IV), Kecepatan Tumbuh
(KCT), dan Jumlah Daun (JD)... 29 4. Uji Lanjut Pengaruh Perlakuan Penurunan Kadar Air Benih Kenanga
Terhadap Tolok Ukur Daya Berkecambah dan Potensi Tumbuh
Maksimum ... 30 5. Pengaruh Perlakuan Penurunan Kadar Air Benih Kenanga terhadap
Peubah Kecepatan Tumbuh (KCT), dan Hari Pertama Tumbuh Benih
Kenanga ... 34 6. Pengaruh Perlakuan Penurunan Kadar Air Benih Terhadap Jumlah
Kecambah Normal dan Jumlah Daun Per Tanaman ... 35 7. Analisis Ragam Pengaruh Perlakuan Percepatan Perkecambahan
Terhadap Potensi Tumbuh Maksimum (DB), Potensi Tumbuh Maksimum (PTM, Kecepatan Tumbuh (IV), Kecepatan Tumbuh
(KCT), dan Jumlah Daun (JD)... 37 8. Pengaruh Perlakuan Percepatan Perkecambahan Benih Kenanga
terhadap Peubah Kecepatan Tumbuh (KCT), dan Hari Pertama
Tumbuh Benih Kenanga ... 40 9. Pengaruh Perlakuan Percepatan Perkecambahan Benih Terhadap
Jumlah Kecambah Normal dan Jumlah Daun Per Tanaman ... 41
Lampiran
1. Rekapitulasi Analisis Ragam Pengaruh Penurunan Kadar Air Benih Kenanga Terhadap Peubah Kadar Air (KA), Daya Berkecambah (DB), Potensi Tumbuh Maksimum (PTM, Indeks Vigor (IV),
Kecepatan Tumbuh (KCT), dan Jumlah Daun (JD) ... 48 2. Rekapitulasi Analisis Ragam Pengaruh Perlakuan Percepatan
Perkecambahan Terhadap Potensi Tumbuh Maksimum (DB), Potensi Tumbuh Maksimum (PTM, Kecepatan Tumbuh (IV), Kecepatan
Tumbuh (KCT), dan Jumlah Daun (JD) ... 49 3. Data Percobaan Penurunan Kadar Air Kritikal Benih Kenanga ... 50 4. Data Percobaan Peningkatan Kecepatan Perkecambahan Benih
DAFTAR GAMBAR
Nomor Halaman
Teks
1. Cananga odorata Bunga, Daun dan Buah Agregat. (Sumber www.
hear.org/pier.caodop.htm) ... 4
2. Prosedur Pelaksanaan Percobaan Pertama ... 17
3. Prosedur Pelaksanaan Percobaan Kedua... 18
4. Prosedur Pelaksanaan Percobaan Ketiga ... 19
5. Penentuan Waktu Perhitungan Awal dan Perhitungan Akhir Perkecambahan pada Benih Cananga Odorata ... 21
6. Kurva Persentase Kecambah Normal Benih Cananga odorata Selama Pengamatan ... 21
7. a). Lapisan Endosperma Benih Kenanga yang Masih Menempel di Daun b). Kecambah yang Mengalami Kelayuan dan Kerontokan Daun Pertama c). Kecambah yang Mengalami Kekeringan d). Kecambah Kenanga yang Mengalami Kesulitan Membuka Kulit Benih e). Irisan Buah Kenanga Membujur. ... 24
8. Histogram Pengaruh Penurunan Kadar Air Benih Kenanga Terhadap Peubah Daya Berkecambah (DB) ... 31
9. Histogram Pengaruh Penurunan Kadar Air Benih Kenanga Terhadap Peubah Potensi Tumbuh Maksimum (PTM) ... 32
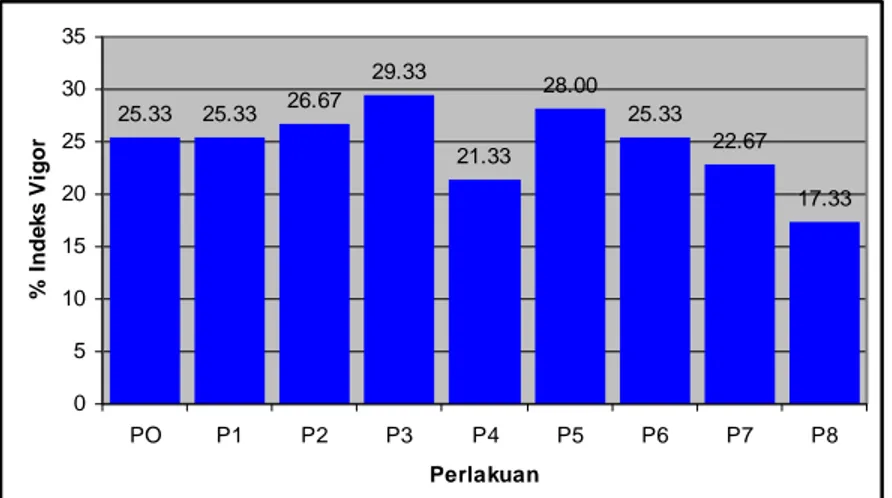
10. Histogram Pengaruh Penurunan Kadar Air Benih Kenanga Terhadap Peubah Indeks Vigor (IV). ... 33
11. Histogram Pengaruh Penurunan Kadar Air Benih Kenanga Terhadap Peubah Kecepatan Tumbuh (KCT). ... 34
12. Histogram Pengaruh Perlakuan Percepatan Perkecambahan Benih Kenanga Terhadap Peubah Daya Berkecambah (DB)... 37
13. Histogram Pengaruh Perlakuan Percepatan Perkecambahan Benih Kenanga Terhadap Peubah Potensi Tumbuh Maksimum (PTM). ... 38
14. Histogram Pengaruh Perlakuan Percepatan Perkecambahan Benih Kenanga Terhadap Peubah Indeks Vigor (IV)... 39
15. Histogram Pengaruh Perlakuan Percepatan Perkecambahan Benih Kenanga Terhadap Peubah Kecepatan Tumbuh (KCT) ... 39
PENDAHULUAN
Latar Belakang
Tahun 2006 Indonesia menargetkan peningkatan ekspor minyak atsiri dalam 10-20 tahun ke depan menjadi US$ 300-500 juta. Statistik perdagangan minyak atsiri Indonesia menunjukkan, ekspor 20 jenis minyak atsiri kasar tahun 2004 mencapai US$ 90 juta. Akan tetapi, pada tahun yang sama masih mengimpor produk turunan minyak atsiri senilai US$ 13,17 juta (Siagian, 2006).
Produksi minyak atsiri dari tanaman kenanga (Cananga odorata Lam. Hook. F. & Thoms.) masih terkendala oleh kurangnya bahan baku bunga kenanga, walaupun di beberapa daerah di Indonesia telah aktif memproduksi minyak atsiri. Di Boyolali, areal seluas 468 ha mampu menghasilkan minyak atsiri 113,63 ton/th (Trinugroho, 2006) untuk memasok kebutuhan ekspor ke pasar Singapura, Prancis, Belanda, dan Amerika Serikat (Anonim, 2006). Bunga kenanga dari 1.429 ha perkebunan rakyat Kabupaten Blitar yang disuling menjadi minyak atsiri juga diekspor ke Perancis, Belanda, Inggris, serta Amerika Serikat, dan memasok 70% kebutuhan dunia akan bahan baku parfum dan kosmetik (Widyastuti, 2003).
Permintaan ekspor minyak atsiri yang terus meningkat tidak disertai dengan pengadaan bahan baku yang mencukupi. Luas areal kenanga di Jawa Barat tahun 1999 adalah 2.232,93 ha, akan tetapi luas areal tanaman yang produktif hanya 248,00 ha dengan jumlah total produksi 55,16 ton (BPS Dinas Perkebunan Propinsi DT I Jawa Barat, 1999).
Kenanga yang merupakan tanaman asli Indonesia juga mempunyai banyak manfaat di antaranya sebagai obat tradisional untuk menyembuhkan nyeri hati, sesak nafas, bronchitis, pembengkak limfa, malaria, dan hepatitis (Wijayakusuma, 2005), aromaterapi, bahan pembuat kosmetik, pengharum rambut, penolak nyamuk Aedes aegypti (Republika, 2004), sabun, dan bahan-bahan parfum. Batang pohon kenanga pun dapat digunakan sebagai bahan baku furnitur.
Upaya peningkatan produktivitas minyak atsiri dilakukan dengan cara menambah tegakan kenanga atau memperluas lahan yang ada dan mengadakan peremajaan tanaman kenanga yang telah tua. Pembangunan hutan atau kebun kenanga dapat diawali dengan penyediaan benih dan bibit kenanga yang
berkualitas. Pengetahuan tentang penanganan benih membutuhkan suatu informasi tentang karakteristik atau sifat benih kenanga.
Benih kenanga yang berkualitas harus memenuhi standar benih bermutu. Mutu benih meliputi mutu fisik, genetik, fisiologik, dan patologik. Mutu genetik berarti benih mempunyai identitas genetik yang murni dan mantap, dan bila ditanam mewujudkan kinerja pertanaman yang homogen sesuai dengan deskripsi oleh pemulianya. Mutu fisiologik adalah mutu benih yang ditentukan oleh daya hidup (viabilitas) benih, sehingga mampu menghasilkan tanaman yang normal.
Penyediaan benih kenanga yang berkualitas membutuhkan suatu penelitian yang mendukung penanganan benih, perkecambahan benih kenanga yang baik, bagaimana karakteristik benih apakah termasuk dalam benih rekalsitran atau benih ortodok, berapa kadar air kritikal benih kenanga, pematahan dormansi benih, dan bagaimana penanganan benihnya.
Permasalahan yang timbul dalam usaha di atas adalah benih kenanga cukup sulit dikecambahkan karena lambatnya proses perkecambahan. Sunanto (1993) menyebutkan bahwa umumnya benih kenanga akan mulai berkecambah dan tumbuh setelah 4-6 minggu disemaikan. Di samping itu terdapat perbedaan pendapat tentang tipe benih kenanga. Hasanah (2002) menyebutkan bahwa kenanga termasuk dalam benih rekalsitran, sedangkan Manner dan Elevitch (2006) menyebutkan bahwa kenanga adalah benih ortodok, yang berarti akan meningkat viabilitasnya bila dikeringkan, walaupun tidak ada data yang mendukung.
Usaha mempercepat dan meningkatkan daya bekecambah memerlukan perlakuan-perlakuan yang sesuai dengan kondisi atau sifat benih tersebut. Larutan KNO3 sangat dikenal sebagai bahan kimia yang digunakan sebagai promotor perkecambahan. Copeland dan McDonald (2001) menyebutkan bahwa konsentrasi 0.1-0.2% atau 2% KNO3 adalah konsentrasi yang sering digunakan dalam pengujian perkecambahan benih oleh Association of Official Seed Analysts (AOSA) dan International Seed Testing Association (ISTA).
Penggunaan air kelapa dalam penelitian tentang aspek perbenihan sampai sekarang belum banyak digunakan. Prawira (1999) menyebutkan bahwa perlakuan perendaman benih dalam air kelapa muda selama 4 jam dengan kepekatan 30%
memberikan pengaruh yang signifikan terhadap tolok ukur kecepatan tumbuh 1.73%/etmal dibandingkan dengan kontrol 1.65%/etmal pada benih Gmelina
arborea. Shiimarocks adalah salah satu nama dagang suatu larutan yang
mengandung mineral-mineral penting bagi pertumbuhan tanaman. Shiimarocks mampu meningkatkan viabilitas potensial dan vigor pada berbagai benih, yaitu benih kangkung dengan konsentrasi 500 dan 1500 ppm, benih kacang panjang dengan konsentrasi 1000 dan 1500 ppm (Junisusanti, 2003). Sitorus (2005) menyebutkan bahwa perlakuan invigorasi pada kacang tanah dengan Shiimarocks mampu meningkatkan Berat Kering Kacambah Normal (BKKN).
Penelitian ini merupakan langkah awal dalam mencari informasi tentang sifat benih kenanga dan teknik penanganannya untuk pengembangan tanaman kenanga sebagai salah satu sumber minyak atsiri.
Tujuan Penelitian
Penelitian ini bertujuan mengetahui karakteristik dormansi pada benih kenanga, mengetahui kadar air kritikal benih kenanga untuk mengetahui apakah benih kenanga tergolong benih ortodok, intermediat, atau rekalsitran, dan mempelajari teknik-teknik meningkatkan kecepatan perkecambahan benih kenanga.
Hipotesis
Hipotesis yang diajukan dalam penelitian ini antara lain: 1. Benih kenanga memiliki dormansi fisik atau fisiologi .
2. Benih kenanga memiliki kadar air kritikal benih yang tinggi dalam kisaran 12-35 %.
3. Terdapat teknik perlakuan benih yang dapat meningkatkan kecepatan perkecambahan benih kenanga.
TINJAUAN PUSTAKA
Kenanga
Kenanga (Cananga odorata Lam. Hook. F. & Thoms.) merupakan tanaman asli Indonesia. Menurut FAO (1999) pohon ini tingginya dapat mencapai 35 meter. Tanaman ini dapat hidup subur pada dataran rendah di daerah tropik yang lembab pada suhu 21-320C dengan ketinggian 1500-2000 mm dpl. Tanaman ini dapat menghasilkan bunga yang sangat harum, yang dapat diambil minyak atsiri.
FAO (1999) menyebutkan bunga kenanga termasuk dalam tipe bunga majemuk, muncul bergerombol pada ranting-ranting dan batang-batang. Bunga mempunyai 6 petal dengan panjang mencapai 7-8 cm berwarna hijau kekuningan tersusun saling bertumpang tindih dan mempunyai 3 sepal (Gambar 1). Berdasarkan penelitian di Ivory Coast mengindikasikan bahwa penyerbukan bunga kenanga dibantu oleh serangga golongan Coleoptera sebagai polinator. Buah terbentuk 4-12 buah bergerombol yang ditopang oleh reseptakel yang kuat. Buah berwarna hijau dengan berbagai ukuran, hingga berwarna kehitaman jika telah mencapai masak fisiologis. Benih berwarna kecoklatan, berukuran kecil 6-7 mm panjangnya dan lebar 4-5 mm mempunyai permukaan benih yang bergerigi dan benih dilindungi oleh kulit benih yang keras.
Gambar 1. Cananga odorata Bunga, Daun dan Buah Agregat (Sumber
Sunanto (1993) menyatakan bahwa tanaman kenanga (Cananga odorata) terbagi dalam 3 kelompok jenis tanaman.
1. Cananga odorata forma macrophylla
Tajuk pohon berbentuk kerucut, cabang-cabangnya berdekatan rapat sesamanya, pada pangkal batang terdapat lekukan-lekukan. Daunnya agak tegak membundar dengan ukuran sekitar 20 x 20 cm Tinggi pohon 20-30 m.
2. Cananga odorata forma genuine
Tajuk pohon berbentuk kerucut, langsing. Cabang-cabang tidak berdekatan sesamanya, dimana pada pangkal batang terdapat tonjolan-tonjolan. Daun agak meruncing dengan ukuran sekitar 15-17 cm.
3. Tanaman berbentuk perdu.
Tingginya hanya mencapai 2-3 m, dan berbunga sepanjang tahun.
Cananga odorata varietas nana dapat berbuah, dan mahkota bunga
berjumlah 6 sedangkan Cananga odorata varietas fruticosa tidak berbuah dan mahkota bunganya tidak berjumlah 6.
Manner dan Elevitch (2006) menyebutkan tanaman kenanga dapat dikembangkan secara cepat umumnya dengan menggunakan benih (generatif), selain itu dapat juga dikembangkan secara vegetatif yaitu dengan cara stek dan cangkok. Perkembangbiakan dengan vegetatif ini memiliki kelemahan yaitu memiliki tingkat keberhasilan yang beragam.
Penelitian-penelitian kenanga dalam aspek perbenihan belum banyak dilakukan. Penelitian dalam aspek perbenihan yang telah dilakukan adalah aspek pematahan dormansi. Novianti (1992) menyatakan bahwa kenanga mempunyai after ripening dan kulit benih yang keras, sehingga diperlukan periode konservasi lebih dari 2 minggu dalam suhu kamar untuk mendapatkan persentase daya berkecambah yang baik. Durmistan (1991) menyatakan bahwa pematahan dormansi yang paling baik adalah dengan pengampelasan dan kombinasi perlakuan pengampelasan dan perendaman GA3 400 ppm selama 12 jam dapat meningkatkan Potensi Tumbuh Maksimum 13.33%, Daya Berkecambah 6.66%, dan Kecepatan Tumbuh benih 1.53%/etmal terhadap kontrol. Satyanti (2003)
menyatakan pematahan dormansi secara fisik dengan atau tanpa skarifikasi dan merendam benih dalam air (250C) selama 75 jam adalah sama baiknya, perlakuan ini menunjukkan pengaruh yang signifikan dengan nilai daya berkecambah 83.33% dibandingkan dengan perendaman dalam air (250C) selama 51 jam dengan nilai Daya Berkecambah 33.33% (tanpa skarifikasi), 50% (dengan skarifikasi). Pematahan dormansi dengan kimiawi dengan menggunakan KNO3 5% selama 60 menit menunjukkan pengaruh yang signifikan dengan nilai daya berkecambah 76.67% dibandingkan perendaman KNO3 2.5% selama 60 menit. Pematahan dormansi secara biologis berupa stratifikasi menggunakan bakteri dekomposer tidak ada kecambah yang dihasilkan sehingga persentase perkecambahan belum diketahui.
Perkecambahan
Perkecambahan benih merupakan pertumbuhan aktif dari embrio, sehingga terjadi retaknya kulit benih dan munculnya tanaman muda. Copeland dan McDonald (2001) menyebutkan bahwa batasan perkecambahan secara fisiologis adalah munculnya radikula dari testa benih, sedangkan menurut teknologis benih, perkecambahan benih adalah muncul dan berkembangnya struktur penting embrio yang mengindikasikan perkecambahan yang normal pada kondisi lingkungan yang optimum.
Proses perkecambahan dipengaruhi oleh banyak faktor, diantaranya air, oksigen, temperatur, cahaya, dan media perkecambahan. Proses perkecambahan menurut Torrey dalam Berlyn (1972) mencakup proses imbibisi (proses penyerapan air dari lingkungan), hidrasi dan aktivasi, inisiasi pertumbuhan embrio, pemunculan embrio dari kulit benih, pertumbuhan dan perkembangan embrio.
Proses-proses perkecambahan benih didukung oleh senyawa-senyawa yang menstimulir perkecambahan. Senyawa-senyawa ini dapat menyebabkan perkecambahan lebih cepat, dapat menginduksi vigor bibit lebih besar, meningkatkan sensitivitas terhadap cahaya atau mensubtitusi kebutuhan cahaya atau suhu rendah yang dibutuhkan benih.
Pengamatan kriteria kecambah normal menurut Poulsen (1989) bahwa yang termasuk dalam kecambah normal adalah kecambah utuh dengan semua struktur penting benih (akar, plumula, kotiledon, dan poros embrio) lengkap, sehat, dan berkembang dengan baik. Durmistan (1991) menyebutkan bahwa benih kenanga yang termasuk dalam kriteria kecambah normal adalah akar primer yang lurus ke bawah dengan beberapa serabut akar melekat disekelilingnya, hipokotil lurus berwarna putiih kehijauan dengan tinggi tidak kurang dari 4 cm dan kotiledon membuka lebar berwarna hijau serta berukuran sama besar.
Sadjad (1980) memberikan batasan-batasan kriteria kecambah normal antara lain:
a. Kecambah memperlihatkan kemampuan berkembang terus menjadi suatu tanaman normal, apabila ditumbuhkan dalam kondisi optimum
b. Kecambah memiliki struktur penting yaitu : perakaran berkembang baik; hipokotil harus berkembang sehat, tidak rusak, dan tidak menunjukkan kerusakan pada jaringan penghubung; plumula sehat; dua kotiledon yang sehat.
c. Kecambah mendapat sedikit kerusakan pada suatu struktur tumbuhnya, tetapi masih menunjukkan pertumbuhan yang kuat dan seimbang antara pertumbuhan struktur satu dengan yang lainnya.
d. Kecambah dari tanaman pohon yang tumbuh epigeal dengan perkembanagn hipokotil dan radikula 2-4 kali panjang benihnya, asalkan semua struktur tumbuh menunjukkan pertumbuhan yang baik.
e. Kecambah yang bercendawan, tetapi cendawan tersebut tidak merintangi pertumbuhan kecambah sehingga seluruh pertumbuhan struktur tumbuhnya normal.
Sedangkan untuk kriteria kecambah abnormal antara lain:
1. Kecambah yang rusak; kecambah cacat, belah, patah, luka-luka, khususnya pada jaringan penghubung pada epikotil, hipokotil, atau akar; kecambah tanpa akar primer.
2. Kecambah yang lemah, tidak menunjukkan pertumbuhan struktur yang seimbang.
3. Kecambah yang rusak dan membusuk pada bagian-bagian struktur tumbuhnya sehingga kecambah tidak tumbuh normal.
Sifat Benih Ortodok dan Rekalsitran
Stubsgaard (1992) menyebutkan bahwa ada dua grup benih berdasarkan karakteristik benih terhadap kemunduran benih dan daya simpannya yaitu rekalsitran dan ortodok. Benih ortodok adalah benih yang mempunyai daya simpan yang lama pada kondisi kering, sedangkan rekalsitran adalah benih yang tidak tahan dehidrasi.
Benih ortodok merupakan benih yang mengalami desikasi secara alami pada pohon induknya. Benih ini dapat dikeringkan sampai kadar air rendah disimpan di kondisi kering dengan tidak mengalami kemunduran dalam kurun waktu yang lama
Benih rekalsiran merupakan benih yang tidak tahan desikasi, benih ini akan mengalami kematian bila dikeringkan sampai batas kadar air tertentu. Benih ini sulit untuk dipertahankan viabilitasnya dalam waktu yang lama sehingga tidak dapat disimpan lama. Stubsgaard (1992) menyatakan bahwa sebagian besar benih-benih yang termasuk dalam benih-benih rekalsitran adalah benih-benih-benih-benih yang berdaging dan spesies tanaman kehutanan. Benih ini rekalsitran sebagian besar ditemukan di daerah tropik lembab.
King dan Roberts (1980) menyebutkan pengeringan pada benih rekalsitran akan menyebabkan penurunan viabilitas, pada benih rambutan (Nepheliun
lappaceum) akan menurun viabilitasnya bila kadar airnya dibawah 20%,
sedangkan benih kopi (Coffea arabica) dengan karakteristik testa benih keras akan menurun viabilitasnya bila kadar airnya dibawah 35%. Schmidt (2000) menyebutkan bahwa kadar air simpan pada benih rekalsitran adalah 12-14%.
Dormansi
Dormansi benih pada umumnya diartikan sebagai benih yang tidak berkecambah walaupun kondisi lingkungan optimum untuk proses perkecambahan. Schimdt (2000) menyatakan bahwa dormansi adalah suatu
strategi menunda proses perkecambahan pada kondisi optimum dimana benih tidak mati.
Penyebab dormansi pada benih sangat beragam. Bonner et. al. (1994) mengklasifikasikan dormansi menjadi 1) Dormansi kulit benih (faktor eksternal), kulit benih impermeabel terhadap gas atau air. 2) Dormansi embrio (faktor internal) terdapat senyawa penghambat (inhibitor). 3) Dormansi morfologi terjadi pada benih yang tidak sempurna dalam proses pembentukan benih. 4) Dormansi sekunder disebabkan karena perlakuan, pelukaan saat pengumpulan, penanaman atau penanganan benih. 5) Kombinasi Dormansi, benih mengalami dormansi karena terdapat lebih dari dua penyebab dormansi. 6). Dormansi rangkap, dormansi berasal dari dormansi embrio baik di radikula atau pada epikotil.
Spesies benih tertentu memiliki dua atau lebih tipe dormansi yang disebut sebagai ‘double dormancy’ atau ‘combined dormancy’. Schmidt (2000) menyebutkan fenomena ini dapat ditemukan contohnya pada benih berdaging dengan inhibitor kimia dan kulit benih yang keras atau immature embrio dengan tipe dormansi yang lain. Tipe-tipe dormansi benih pada berbagai benih sangat bermacam-macam, diantaranya dormansi embrio, dormansi mekanis, fisik, kimia, fotodormansi dan thermodormansi, sedangkan karakteristik dormansi benih dapat dilihat dalam Tabel 1.
Perlakuan Benih
Koller (1972) menyatakan dalam proses perkecambahan terdapat faktor lingkungan yang berpengaruh diantaranya air, energi, CO2, kondisi media tumbuh, persediaan hara mineral, dan persaingan antar individu benih. Copeland dan McDonald (2001) menyebutkan terdapat bahan-bahan yang dapat merangsang perkecambahan diantaranya KNO3, Hidrogen Peroksida (H2O2), Thiourea, Giberelin (GA3), Auksin (IAA), Sitokinin, dan Ethilen (C2H2).
Hartmann dan Kester (1959) menyebutkan perlakuan-perlakuan sebelum perkecambahan yang mampu menstimulir perkecambahan, diantaranya:
a. skarifikasi mekanik yang dapat mengurangi masalah dengan kulit benih keras
Tabel 1. Karakteristik dan Tipe Dormansi pada Berbagai Benih.
Metode pematahan dormansi
Tipe dormansi Karakteristik Contoh spesies
Alami Buatan Immature embryo Benih secara fisiologis belum mampu
berkecambah, karena embryo belum masak walaupun biji sudah masak
Fraxinus excelcior, Ginkgo biloba, Gnetum gnemon
Pematangan secara alami setelah biji disebarkan
Melanjutkan proses fisiologis pemasakan embryo setelah biji mencapai masa lewat-masak (after-ripening) Dormansi mekanis Perkembangan embryo secara fisis
terhambat karena adanya kulit biji/buah yang keras
Pterocarpus, Terminalia spp, Melia volkensii
Dekomposisi bertahap pada struktur yang keras
Peretakan mekanis
Dormansi fisis Imbibisi/penyerapan air terhalang oleh lapisan kulit biji/buah yang impermeable
Beberapa Legum & Myrtaceae
Fluktuasi suhu Skarifikasi mekanis, pemberian air panas atau bahan kimia
Dormansi chemis Buah atau biji mengandung zat penghambat (chemical inhibitory compound) yang menghambat perkecambahan
Buah fleshy (berdaging) Pencucian (leaching) oleh air, dekomposisi bertahap pada jaringan buah
Menghilangkan jaringan buah dan mencuci bijinya dengan air
Foto Dormansi
Biji gagal berkecambah tanpa adanya pencahayaan yang cukup. dipengaruhi oleh mekanisme biokimia fitokrom
Sebagian besar spesies temperate, tumbuhan pioneer tropika humida seperti eucalyptus dan Spathodea
Pencahayaan Pencahayaan
Thermo Dormansi
Perkecambahan rendah tanpa adanya perlakuan dengan suhu tertentu
Sebagian besar spesies temperate, tumbuhan pioneer daerah tropis-subtropis kering, tumbuhan pioneer tropika humida
Penempatan pada suhu rendah di musim dingin Pembakaran
Pemberian suhu yang berfluktuasi
Stratifikasi atau pemberian perlakuan suhu rendah Pemberian suhu tinggi Pemberian suhu berfluktuasi
11
b. perendaman benih dalam air yang dapat mengurangi masalah kulit benih keras, menghilangkan inhibitor, melunakkan benih, dan mempercepat waktu perkecambahan
c. skarifikasi dengan asam yang dapat mengurangi masalah kulit benih keras atau kulit benih yang impermeable
d. stratifikasi dingin yang dapat digunakan pada benih yang mempunyai sifat after-ripening dan kulit benih yang keras
e. perendaman dengan larutan potasium nitrat f. pengaturan cahaya
Kalium Nitrat (KNO3), Air Kelapa, dan mineral Shiimarock merupakan bahan-bahan yang digunakan dalam penelitian ini yang bertujuan untuk menstimulir perkecambahan.
1. Kalium Nitrat (KNO3)
Larutan KNO3 sangat dikenal sebagai bahan kimia yang digunakan dalam promotor perkecambahan. International Seed Testing Assosiation (ISTA) merekomendasikan penggunaan KNO3 dengan konsentrasi 0.1-0.2% atau 2% KNO3 sebagai promotor perkecambahan dalam sebagian besar pengujian perkecambahan benih (Copeland dan McDonald, 2001).
Larutan KNO3 dapat berinteraksi dengan suhu dalam menstimulir perkecambahan benih. Bewley dan Black (1943) menyebutkan bahwa pematahan dormansi dengan KNO3 diduga berhubungan dengan aktifitas lintasan pentosa fosfat, ketersediaan O2 yang terbatas mengakibatkan lintasa pentosa fospat, menjadi nonaktif, karena O2 digunakan untuk aktifitas respirasi melalui lintasan lain. Perlakuan benih dengan akseptor hidrogen seperti nitrat, nitrit, dan methylene
blue diduga dapat membantu proses reoksidasi NADPH sehingga mengaktifkan
kembali lintasan pentosa fospat.
Sastrapradja (Kebun Raya Bogor) dalam Sunanto (1993) penggunaan KNO3 pada kenangasebagai perangsang pertumbuhan ternyata tidak memberikan hasil yang baik. Satyanti (2003) mengaplikasikan KNO3 dengan konsentrasi 1%, 2.5%, dan 5 % dalam usaha pematahan dormansi benih kenanga. Persentase perkecambahan benih dengan perlakuan KNO3 1 % selama 30 menit adalah
12
36.67% sedangkan 60 menit adalah 63.33%. Perlakuan KNO3 2.5% selama 30 menit adalah 70% sedangkan 60 menit adalah 60%, dan perlakuan KNO3 5% selama 30 menit adalah 70% sedangkan 60 menit adalah 76.67%
2. Air Kelapa
Air kelapa merupakan endosperma buah kelapa yang berbentuk cair. Air kelapa ini termasuk dalam senyawa organik kompleks yang sering digunakan dalam kultur jaringan. Air kelapa diketahui mengandung nutrisi yang tinggi diantaranya gula, gula alkohol, asam amino, asam organik, vitamin, fitohormon, dan elemen-elemen organik seperti Kalium, Natrium, Kalsium, Magnesium, Besi, tembaga, posfor, sulfat, dan khlor (Tulecke et al. dalam Mandang, 1993). Air kelapa juga sebagai sumber yang dapat digunakan untuk perkembangan embrio diantaranya sitokinin endogen (Wattimena, 1988). Mustika (1994) menyatakan peranan air kelapa yang dapat memicu tinggi tanaman karena terdapat zat pengatur tumbuh yang salah satunya auksin.
Bewley dan black (1943) menyebutkan bahwa Auksin dalam benih, salah satu komponen IAA sebagai prekusor, dalam perkecambahan bekerja secara enzimatis, dan akan ditransportasikan ke ujung koleoptil dalam perkecambahan benih.
Penggunaan air kelapa dalam penelitian tentang aspek perbenihan sampai sekarang belum banyak digunakan. Prawira (1999) menyebutkan bahwa perlakuan perendaman benih dalam air kelapa muda selama 4 jam dengan kepekatan 30% memberikan pengaruh yang signifikan terhadap tolok ukur daya berkecambah dibandingkan kontrol yaitu 30.88% dari 25.79%, tolok ukur kecepatan tumbuh yaitu 1.73%/etmal dari 1.65%/etmal pada benih Gmelina arborea.
3. Unsur-unsur Mineral
Epstein (1972) menyebutkan bahwa unsur mineral sangat penting dalam proses fisiologi metabolisme tumbuhan, mengaktivasi beberapa enzim atau zat pengatur, dan berperan sebagai co-factor dalam pertumbuhan tanaman. Epstein juga menyebutkan beberapa fungsi mineral seperti Mg sebagai komponen
13
penyusun klorofil, Mg dan Mn sebagai kofaktor enzim. B berperan terhadap metabolisme karbohidrat yaitu degradasi glukosa dalam proses glikolisis.
Shiimarock adalah salah satu nama dagang produk jepang berbentuk larutan yang mengandung berbagai mineral penting yang dibutuhkan dalam proses perkembangan dan pertumbuhan benih atau tanaman. Saut (2002) menyebutkan bahwa Shiimarocks merupakan larutan yang mengandung 22 jenis mineral essensial bagi tanaman. Shiimarocks berperan sebagai katalis anorganik yang sangat esensial untuk fotosintesis, mencegah dan menyembuhkan penyakit-penyakit fisiologis yang disebabkan oleh kekurangan mineral, mempercepat pertumbuhan akar dan menghasilkan rambut akar.
Shimarocks dan produk lain yang sejenis sering disebut mineral 22 karena didalamnya terkandung 22 mineral atau hara essensial. 22 mineral tersebut adalah Fosfor (P), Kalium (K), kalsium (Ca), Magnesium (Mg), Molibdenum (Mo), Tembaga (Cu), Rubidium (Rb), Seng (Zn), Silikon (Si), Besi (Fe), Cobalt (Co), Natrium (Na), Litium (Li), Titanium (Ti), Vanadium (V), Aluminium (Al), Barium (Ba), Nikel (Ni), selenium (Se), Germanium (Ge), Tungsten-Wolfram (W), dan Mangan (Mn).
Beberapa penelitian menunjukkan bahwa shiimarocks mampu meningkatkan viabilitas potensial dan vigor pada berbagai benih. Saut (2002) menyebutkan bahwa perlakuan perendaman benih tomat dalam Shiimarocks 500 ppm selama 24 jam, 1000 ppm selama 48 jam pada benih terung, dan 500 ppm selama 48 jam atau 1000 ppm selama 24 jam pada benih cabai menunjukkan peningkatan viabilitas benih-benih tersebut. Benih kangkung dengan konsentrasi 500 dan 1500 ppm, benih kacang panjang dengan konsentrasi 1000 dan 1500 ppm (Junisusanti, 2003). Sitorus (2005) menyebutkan bahwa perlakuan invigorasi pada kacang tanah dengan Shiimarocks mampu meningkatkan Berat Kering Kacambah Normal (BKKN).
14
BAHAN DAN METODE
Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan Mei hingga Juli 2007 di Laboratorium Balai Penelitian Teknologi Perbenihan Pakuan, Ciheuleut, dan Laboratorium Ilmu dan Teknologi Benih IPB, Darmaga, Bogor.
Bahan dan Alat
Bahan yang digunakan dalam penelitian ini adalah benih kenanga (Cananga Odorata (Lam.) Hook. F. & Thoms.) yang telah mencapai masak fisiologis dengan ditandai kulit buah hijau tua, coklat sampai yang berwarna hitam. Benih tersebut didapatkan dari pertanaman pohon kenanga yang ada dilingkungan Kampus IPB Darmaga Bogor. Bahan-bahan lain yang digunakan adalah larutan KNO3, air kelapa muda, mineral Shiimarocks, air destilata, aluminium foil, sodium hipoklorit, dan pasir sebagai media perkecambahan.
Alat-alat yang digunakan adalah seperangkat alat pengunduh benih, nampan sebagai tempat kering angin, light meter, pinset, gunting kuku, cawan petri, pipet, kertas merang, bak wadah perkecambahan dengan ukuran 30 x 25 x 15 cm, sprayer, label, alat tulis, alat penguji kadar air yaitu timbangan analitik, aluminium foil, desikator, dan oven.
Metode Penelitian
Penelitian ini terdiri dari 3 percobaan, Percobaan pertama merupakan studi penentuan karakteristik dormansi pada benih kenanga. Percobaan kedua mengkaji tentang penentuan Kadar Air Kritikal benih kenanga. Perlakuan pada percobaan ini terdiri dari 9 taraf dengan 3 ulangan sehingga terdapat 27 satuan percobaan. Percobaan ketiga mengkaji teknik-teknik peningkatan kecepatan perkecambahan benih kenanga dengan 9 perlakuan dan 3 ulangan sehingga terdapat 27 satuan percobaan.
Percobaan 1 menggunakan Rancangan Acak Lengkap satu faktor. Perlakuan-perlakuan untuk menentukan karakteristik benih pada percobaan ini antara lain:
15
b. Pengecambahan benih kenanga tanpa testa (D2)
c. Pengecambahan benih kenanga dengan skarifikasi (D3)
d. Pengecambahan benih kenanga dengan skarifikasi dan perendaman dalam KNO3 (D4).
Model rancangan percobaan 1 adalah sebagai berikut: Yij = μ+ αi+ εij
Keterangan:
Yij = Nilai pengamatan pada perlakuan taraf ke-i
µ = Rataan umum
αi = Pengaruh perlakuan ke-i
εij = Galat percobaan pada perlakuan ke-i dan ulangan ke-j
Percobaan 2 dan 3 menggunakan Rancangan Acak Kelompok satu faktor. Perlakuan-perlakuan untuk menentukan Kadar Air kritikal dalam percobaan 2 antara lain:
1. Kontrol (K0)
2. Desikasi Vacuum selama 3 jam (K1) 3. Desikasi Vacuum selama 6 jam (K2) 4. Desikasi Vacuum selama 9 jam (K3) 5. Desikasi Vacuum selama 12 jam (K4) 6. Pengering-anginan selama 24 jam (K5) 7. Pengering-anginan selama 36 jam (K6) 8. Pengering-anginan selama 48 jam (K7) 9. Pengering-anginan selama 60 jam (K8)
sedangkan perlakuan-perlakuan untuk percepatan perkecambahan dalam percobaan 3 antara lain:
a. Kontrol (P0)
b. Perendaman benih dalam KNO3 1% selama 60 menit (P1) c. Perendaman benih dalam KNO3 2.5% selama 60 menit (P2) d. Perendaman benih dalam KNO3 5% selama 60 menit (P3) e. Perendaman benih dalam Air kelapa 50 % selama 4 jam (P4) f. Perendaman benih dalam Air kelapa 100 % selama 4 jam (P5)
16
g. Perendaman benih dalam Shiimarocks 500 ppm selama 24 jam (P6) h. Perendaman benih dalam Shiimarocks 1000 ppm selama 24 jam (P7) i. Perendaman benih dalam Shiimarocks 1500 ppm selama 24 jam (P8) Model rancangan percobaan yang digunakan dalam masing-masing percobaan adalah sebagai berikut:
Yij = μ+ αi+ βj + εij
Keterangan:
Yij = Nilai pengamatan pada kelompok ke-j dan perlakuan taraf ke-i
µ = Rataan umum
αi = Pengaruh kelompok ke-i
βj = Pengaruh perlakuan ke-j
εij = Pengaruh acak pada kelompok ke-i dan perlakuan ke-j
Data yang diperoleh dianalisis menggunakan uji-F pada taraf 5%. Apabila didapatkan hasil yang berbeda nyata, maka dilakukan uji lanjut dengan uji Duncan Multiple Range Test (DMRT) taraf 5%. Analisis data ini dilakukan dengan bantuan program Statistical Analysis System (SAS) 6.12.
Pelaksanaan Percobaan
Benih kenanga didapatkan dari pertanaman pohon kenanga yang ada di lingkungan Kampus IPB Darmaga Bogor. Buah kenanga yang dipilih adalah buah yang mempunyai ukuran seragam dan telah mencapai masak fisiologis. Masak fisik benih kenanga berarti buah berwarna hijau tua sampai berwarna kehitaman (Sunanto, 1993.). Benih yang dipilih adalah benih yang mempunyai warna, penampakan, tidak tergores, dan mempunyai ukuran yang seragam.
Total kebutuhan benih dari seluruh perlakuan sebanyak 3200 benih. Jika asumsi buah homogen mempunyai 5 benih /buah, maka dibutuhkan buah kenanga sebanyak 640 buah.
FAO (1999) menyebutkan bahwa benih kenanga berwarna coklat, kecil, dengan panjang 6-7 mm dan pendek 4-5 mm, berbentuk pipih, ovate dan diselimuti kulit benih yang berkayu keras, dalam 1 kg benih terdapat 17500-21000
17
butir. Bobot 1000 butir benih kenanga pada penelitian ini adalah 71.04 gram dengan Kadar Air 27.32% jika dikonversi dalam kg terdapat sekitar 14000 butir. Kadar Air 27.32% adalah Kadar Air awal benih kenanga yang telah dikering-anginkan selama 24 jam. Informasi ini dapat digunakan dalam operasional pembibitan benih kenanga.
Kadar Air merupakan aspek penting selama proses penanganan benih. Aspek ini dapat menentukan kondisi fisiologi dan aktifitas biokimia benih. Percobaan 1 dan 2 menggunakan benih kenanga yang mempunyai Kadar Air 38.16%, yaitu benih kenanga yang telah dibersihkan daging buah, dicuci dengan air mengalir, dan dikeringkan dengan tisu, sedangkan pada percobaan 3 benih kenanga yang digunakan mempunyai Kadar Air 27.32%.
Percobaan 1. Penentukan Karakteristik Benih
Tahapan-tahapan pelaksanaan percobaan pertama terlihat pada Gambar 2.
ll
Gambar 2. Prosedur Pelaksanaan Percobaan Pertama
Percobaan 2. Penentuan Kadar Air Kritikal
Perlakuan penurunan Kadar Air kritikal benih dilakukan dengan cara bertahap sehingga waktu tanam benih bersamaan. Tahapan-tahapan benih
Penyiapan Alat dan Bahan
Pemotongan Kulit Benih Sesuai dengan Perlakuan yang Diberikan
Pengamatan Persentase Benih Terkontaminasi dan Daya Berkecambah
Dilakukan Selama 7 hari
Sterilisasi Alat dengan Metode Oven pada Suhu 1050C Selama 24 jam, sedangkan Sterillisasi Bahan dengan Sodium Hipoklorit 0.5%
18
dikeringkan terlebih dahulu adalah benih dengan perlakuan pengering-anginan 60 jam, 12 jam kemudian mengering-anginkan benih dengan perlakuan pengering-anginan 48 jam, 12 jam kemudian mengering-anginkan benih dengan perlakuan pengering-anginan 36 jam, 12 jam kemudian mengering-anginkan benih dengan perlakuan pengering-anginan 24 jam, 12 jam kemudian mengering-anginkan benih dengan perlakuan pengering-anginan 12 jam, 3 jam kemudian anginkan benih dengan perlakuan desikasi 9 jam, 3 jam kemudian anginkan benih dengan perlakuan desikasi 6 jam, 3 jam kemudian mengering-anginkan benih dengan perlakuan desikasi 3 jam.
Tahapan-tahapan pelaksanaan percobaan kedua terlihat pada Gambar 3.
Gambar 3. Prosedur Pelaksanaan Percobaan Kedua
Pengukuran Kadar Air benih pada setiap perlakuan sedangkan sebagian benih yang digunakan untuk pengujian viabilitas, direndam dalam larutan sodium hipoklorit 0.5% terlebih dahulu selama 5 menit. Jika tahapan-tahapan tersebut tidak dapat dilakukan dalam satu hari, maka pengujian akan dilakukan pada hari berikutnya dengan kondisi benih tersimpan dalam aluminium foil.
Percobaan 3. Peningkatan Percepatan Perkecambahan
Perlakuan percepatan perkecambahan benih dilakukan dengan cara bertahap sehingga waktu tanam benih bersamaan. Tahapan-tahapan benih diberi perlakuan terlebih dahulu adalah benih dengan perlakuan perendaman benih dalam Shiimarock 500, 1000, 1500 ppm selama 24 jam, 20 jam kemudian memberikan perlakuan perndaman benih dalam Air Kelapa 50 dan 100% selama 4
Pemilahan Benih, Ekstraksi Benih Pencucian Benih
Perlakuan Penurunan Kadar Air Benih
Pengukuran Kadar Air Benih Pengujian Viabilitas Benih
19
jam. 3 jam kemudian memberikan perlakuan perendaman benih dalam KNO3 1, 2.5, dan 5% selama 60 menit. Benih-benih yang telah diberi perlakuan akan direndam dalam larutan sodium hipoklorit 0.5% selama 5 menit dan ditanam untuk pengujian viabilitas. Jika tahapan-tahapan tersebut tidak dapat dilakukan dalam satu hari, maka pengujian akan dilakukan pada hari berikutnya dengan kondisi benih tersimpan dalam aluminium foil.
Tahapan-tahapan pelaksanaan percobaan ketiga terlihat pada Gambar 4.
Gambar 4. Prosedur Pelaksanaan Percobaan Ketiga
Pengujian viabilitas benih dilakukan dengan penanaman setelah mendapat perlakuan sesuai dengan penelitian dengan posisi bebas pada kedalaman 0.5 cm pada media pasir yang telah disterilkan. Pasir sebagai media tanam disterilkan dengan oven 1500C selama 48 jam.
Pemeliharaan dilakukan pada pertanaman benih kenanga selama pengamatan dengan cara penyiraman dan menjaga kelembaban benih tetap terjaga akan tetapi tidak menggenang. Penyiangan gulma pada wadah pertanaman, dan jika terdapat serangan cendawan maka dilakukan penyemprotan Dithane.
Pengamatan
Pengamatan pada penelitian ini antara lain pada peubah Kadar Air dan beberapa parameter viabilitas benih.
Perlakuan Percepatan Perkecambahan Benih
Pengujian Viabilitas Benih
Pengering-anginan Benih Selama 24 jam Dilanjutkan dengan Perendaman Benih dalam Air 75 jam Pemilahan Benih, Ekstraksi Benih Pencucian Benih
20
1. Kadar Air Benih (KA)
Pengukuran Kadar Air benih dilakukan dengan cara mengeringkan benih dalam oven suhu 103±20C selama17±1 jam. Pengukuran Kadar Air benih dilakukan dengan tiga ulangan serta 25 benih tiap ulangan. Pengukuran Kadar Air benih dilakukan sebelum perlakuan diberikan yaitu Kadar Air awal dan pada setiap periode penurunan Kadar Air secara berkala.
Bo 1 B Bo Air Kadar = − X 100 %
Dimana : Bo = Bobot awal sebelum dioven B1 = Bobot akhir setelah dioven
2. Parameter Viabilitas Potensial
Parameter ini dihitung dengan menggunakan tolok ukur Daya Berkecambah. Daya Berkecambah benih merupakan peubah dari parameter viabilitas potensial yang menunjukkan kemampuan benih berkecambah, tumbuh dan berproduksi normal pada kondisi lingkungan optimal.
Daya Berkecambah (DB)
Penentuan waktu perhitungan awal dan akhir ditentukan berdasarkan kurva persentase kumulatif kecambah normal dan kurva persentase kecambah normal benih Cananga odorata (Gambar 5). Penentuan waktu perhitungan Daya Berkecambah dan peubah yang lainnya pada percobaan ini, didapatkan dari data pengamatan yang dimulai dari hari ke-15 sampai hari ke-60. Kurva persentase kecambah normal menunjukkan puncak kurva pada hari ke-30 dengan persamaan y = 0.196x - 0.0032x2 - 0.91 dengan simpangan baku sebesar 1.44 dan nilai r sebesar 0.54 (Gambar 6) sedangkan dari kurva persentase kumulatif kecambah normal didapatkan kecenderungan puncak kurva pada hari ke-40, sehingga waktu perhitungan pertama adalah hari ke-30 sedangkan waktu perhitungan kedua adalah hari ke-40.
21 KONTROL 0 10 20 30 40 50 60 70 1 5 9 13 17 21 25 29 33 37 41 45 49 53 57 Hari V ia b ilit as ( % ) % Kumulatif Kecambah Normal (kurva A) % Kecambah Normal (kurva B) :
Gambar 5. Kurva % Kumulatif Kecambah Normal dan Kurva % Kecambah Normal Perkecambahan Benih Cananga odorata
Gambar 6. Kurva Persentase Kecambah Normal Benih Cananga odorata Selama Pengamatan A B Hari 0.0 11.0 22.0 33.0 44.0 55.0 66.0 0.00 1.22 2.45 3.67 4.89 6.11 7.34 % Kecambah Normal Y = 0.196X - 0.0032X2 - 0.91 r = 0.54
22
Persamaan persentase Daya Berkecambah adalah
∑
∑
+ = ditanam yang benih ) P (P DB 1 2 X 100%Dimana : P1 = jumlah kecambah normal pada hari ke-30 P2 = jumlah kecambah normal pada hari ke-40
3. Parameter Vigor Kekuatan Tumbuh a. Kecepatan Tumbuh benih (KCT)
Peubah ini mengindikasikan Vigor Kekuatan Tumbuh (VKT) karena benih yang lebih cepat tumbuh lebih mampu menghadapi kondisi lapang yang suboptimum. KCT diukur dengan jumlah tambahan perkecambahan setiap hari pengamatan dibagi etmalnya. KCT (% etmal) = etmal 2 ke KN % − + ….. + etmal n ke KN % −
KN ke-2 : Kecambah normal pada hari ke-2 setelah tanam KN ke-n : Kecambah normal pada hari pengamatan terakhir 1 etmal : 24 jam sejak saat penanaman
b. Indeks Vigor (IV)
Peubah Indeks vigor merupakan perbandingan antara jumlah kecambah normal pada hitungan pertama dengan jumlah seluruh benih yang ditanam.
∑
∑
= ditanam yang Benih P IV 1 X100%Dimana : P1 = jumlah kecambah normal pada hari ke-30
4. Parameter Viabilitas Total
Potensi Tumbuh Maksimum (PTM)
Potensi Tumbuh Maksimum merupakan peubah dari parameter viabilitas total benih. PTM diperoleh dengan menghitung jumlah benih yang berkecambah dengan kriteria perkecambahan yang ditinjau dari
23
aspek fisiologis. Tinjauan ini telah menyatakan bahwa benih berkecambah adalah benih yang telah mampu memunculkan radikula atau plumula.
∑
∑
= ditanam yang benih h berkecamba yang benih PTM X 100 %5. Parameter Vigor Bibit Jumlah Daun (JD)
Peubah ini dihitung pada akhir pengamatan dengan menghitung rata-rata jumlah daun per tanaman pada setiap bak perkecambahan.
24
HASIL DAN PEMBAHASAN
Kondisi Umum
Kondisi ruang dan kelembaban udara pada ruangan persiapan penanaman dan pemberian perlakuan adalah sekitar 25.2 0C , dengan RH 59%.
Kondisi Benih
Buah kenanga termasuk dalam buah buni dengan ciri-ciri fisik buah berwarna hijau tua, berbentuk lonjong, panjang kurang lebih 2 cm. Buah tersebut jika dipotong membujur akan terdapat 1-12 benih yang tersusun berjajar (lihat Gambar 7e), benih-benih tersebut diselimuti oleh daging buah.
Gambar 7). a). Lapisan Endosperma Benih Kenanga yang Masih Menempel di Daun b). Kecambah yang Mengalami Kelayuan dan Kerontokan Daun Pertama c). Kecambah yang Mengalami Kekeringan d). Kecambah Kenanga yang Mengalami Kesulitan Membuka Kulit Benih e). Irisan Buah Kenanga Membujur
a
a
d
c
b
e
25
Benih kenanga termasuk benih kehutanan yang cukup sulit penanganan dalam pengecambahannya. Benih dengan karakteristik kulit keras dan liat adalah salah satu kendala dalam proses perkecambahan benih.
Kendala-kendala penelitian dalam proses perkecambahan antara lain: a. benih kesulitan mengangkat kotiledon saat setelah proses field emergence b. kecambah kesulitan membuka kotiledon saat setelah benih mampu field
emergence (Gambar 7d)
c. kecambah yang mampu membuka kotiledon dalam waktu yang lebih lama menyebabkan plumula (daun pertama) keriting bahkan rawan patah (Gambar 7b)
d. kecambah patah saat mengangkat kotiledon dari dalam permukaan tanah Benih kenanga memiliki ciri khusus diantaranya testa terdiri dari 3 lapisan dari 3 integumen. Testa terluar merupakan membran putih yang terbentuk dari integumen luar, lapisan tengah merupakan lapisan berkayu dari integumen tengah, sedangkan lapisan paling dalam merupakan lapisan dari integumen dalam (Corner, 1973). Struktur testa yang berlapis-lapis dan sangat keras inilah kemungkinan penyebab embrio sulit menembus kulit benih dan membuka kotiledon (lihat Gambar 7d) disamping itu pada Gambar a) terlihat terdapat lapisan endosperma yang melapisi kotiledon, endospesma tersebut juga diduga mengakibatkan kesulitan membukanya kotiledon.
Kecambah-kecambah yang mampu membuka kotiledon terpaut lama dengan waktu field emergence, plumula yang muncul akan mengeriting dan akan rawan patah. Hal ini diduga karena kehabisan energi atau cadangan makanan sementara kecambah belum mampu berfotosintesis.
Beberapa kecambah mengalami kematian dini yaitu terjadi pengeringan kecambah dari tajuk kecambah. Hal ini diduga juga karena benih kehabisan cadangan makanan bukan karena terserang cendawan. Menurut Bennet (1996) efek dari defisiensi unsur Cl adalah layu pada ujung daun, klorosis dan tumbuh menjadi kerdil, sedangkan kekurangan unsur Ca antara lain mengakibatkan kematian pada titik tumbuh pucuk dan akar.
26
Intensitas Cahaya
Tempat penelitian ini berlokasi di Rumah kaca, bak perkecambahan diletakkan di bawah meja dalam Rumah kaca dengan kondisi intensitas cahaya yang digambarkan dalam Tabel 2.
Tabel 2. Kondisi Intensitas Cahaya dalam Rumah Kaca pada Pagi, Siang dan Sore Hari
Blok Pagi (lux) Siang (lux) Sore (lux) 1 1.560-13.000 1700 – 20.000* 2.600-15.000 2 1.400-9.200 1680 – 20.000* 1.600-17.200
3 450-2.100 300-1.740 380-2.500
Catatan : *) Skala maksimal lux meter yang digunakan adalah 20.000 lux
Pada blok 1 kisaran intensitas cahaya matahari pada pagi, siang dan sore hari mulai dari 1500 sampai diatas 20000 lux, sedangkan pada blok 2 kisaran cahayanya dari 1400 sampai diatas 20000 lux. Blok 3 intensitas cahayanya sangat rendah yaitu pada kisaran 300 sampai 2500 lux, karena pada daerah ini sinar cahaya matahari pagi, siang dan sore tertutupi oleh meja.
Lakitan (1996) menyebutkan proses pertumbuhan dan perkembangan beberapa jenis tanaman sangat dipengaruhi oleh panjang hari atau lama penyinaran yang diterima dalam setiap periode 24 jam, akan tetapi beberapa tanaman tidak dipengaruhi oleh lama penyinaran. Cahaya dapat mempercepat atau memperlambat perkecambahan, tergantung dari jenis benih, kondisi kelembaban yang tinggi, tempat yang gelap dapat mencegah perkecambahan benih. Menurut salah satu distributor benih kenanga, benih kenanga harus segera dikecambahkan dengan kelembaban yang tinggi dan sinar yang cukup dengan media campuran tanah dan pasir, cukup air dan pupuk.
Percobaan 1 Studi Karakteristik Dormansi Benih
Benih kenanga memiliki kulit yang keras dan liat sehingga sulit untuk berkecambah. Perlakuan menghilangkan kulit benih (testa) dan membuang sebagian testa bertujuan agar embrio dapat segera tumbuh tanpa hambatan.
27
Namun, pelaksanaan percobaan ini tidak mudah dilakukan terutama karena ukuran benihnya yang kecil, kulit keras, dan liat. Tidak ada satupun yang tumbuh, dan benih yang diberi perlakuan terserang cendawan, meskipun medianya dalam keadaan steril.
a. Benih dengan perlakuan D1 (benih utuh) tidak terserang cendawan karena cendawan tidak dapat menembus kulit benih yang keras untuk mengkontaminasi bagian dalam benih.
b. Benih dengan perlakuan D2 yaitu benih kenanga tanpa testa atau bagian embrionya saja, semua terkontaminasi oleh cendawan Aspergillus niger dengan sangat cepat pada hari kedua.
c. Benih dengan perlakuan D3 (perlakuan skarifikasi) dan D4 (perlakuan skarifikasi dan perendaman dalam KNO3), terkontaminasi cendawan, akan tetapi dengan intensitas yang lebih rendah pada hari kedua.
Kontaminan pada benih dapat disebabkan beberapa sebab, diantaranya patogen telah menginfeksi benih dan berada dalam jaringan sejak proses pembungaan atau proses penyerbukan, dan kontaminan hanya pada permukaan benih saja. Letak kontaminan benih dapat berbeda-beda tergantung dari jenis patogen, patogen dapat mempertahankan diri dalam bentuk miselium di embryo, endosperma, kulit benih, dan permukaan biji (Sadjad et al., 1975). Kontaminan cendawan Aspergillus yang cepat pada bagian dalam benih kenanga dapat mengindikasikan bahwa dalam struktur organ cadangan makanan benih kenanga mengandung sukrosa. Gunawan et al. (2004) menyebutkan bahwa untuk membiakkan kelompok cendawan Aspergillus sebaiknya menggunakan media tanam yang mengandung sukrosa.
Karakteristik dormansi benih belum diketahui karena tidak adanya data yang memadai untuk menganalisa bahkan menjawab hipotesis. Perlu adanya teknik khusus dalam proses eksisi embryo.
Studi literatur menurut Durmistan (1991) benih kenanga pada saat masak fisiologi mempunyai embrio yang kecil, untuk berkecambah diperlukan waktu lebih 8 minggu dan selama itu embrio berkembang dan menambah ukurannya sampai mampu berkecambah. Durmistan (1991) juga menduga bahwa dormansi benih kenanga disebabkan kulit benih yang keras terbukti efektifnya pematahan
28
dormansi dengan pengampelasan kulit benih, kulit benih yang terdiri dari sel-sel kayu menyumbat pori-pori hilum sehingga menyebabkan terhambatnya gas dan air masuk ke dalam benih.
Bewley dan Black (1982) menyebutkan pada benih kenanga masalah yang dihadapi adalah embrio yang belum sempurna (immature embryo) sehingga memerlukan waktu untuk mencapai kedewasaan dan berdeferensiasi pada tingkat anatomi dan morfologi yang lengkap. Fenomena ini terjadi pula pada spesies
Annona crassiflora yang memerlukan 220 hari untuk memperbesar embrio yang pada awalnya hanya 2 mm. Novianti (1992) menyebutkan bahwa after-ripening benih kenanga patah setelah 2 minggu, dengan persentase Daya Berkecambah 63.22%.
Percobaan 2. Penentuan Kadar Air Kritikal 1. Kadar Air Kritikal
Kadar Air kritikal pada benih tanaman pangan adalah Kadar Air dimana viabilitas mulai nyata menurun secara statistik atau menurun hingga 80%. Oleh karena itu batas minimal viabilitas benih kenanga belum ditentukan dalam standarisasi mutu benih kehutanan maka kadar air kritikal didefinisikan sebagai tingkat kadar air dimana viabilitas benih mulai menurun secara nyata.
Data pengaruh perlakuan penurunan kadar air benih kenanga terhadap peubah Kadar Air (KA), Daya Berkecambah (DB), Potensi Tumbuh Maksimum (PTM), Indeks Vigor (IV), Kecepatan Tumbuh (KCT), dan Jumlah Daun (JD) dengan 3 ulangan dapat dilihat dalam Tabel Lampiran 3. Tabel Lampiran 3 menunjukkan kondisi Kadar Air, Daya Berkecambah, Potensi Tumbuh Maksimum, Indeks Vigor, Kecepatan Tumbuh, dan Jumlah Daun dalam setiap ulangan.
Analisis ragam pengaruh berbagai taraf penurunan Kadar Air benih terhadap beberapa tolok ukur viabilitas benih (Tabel Lampiran 1) menunjukkan bahwa faktor penurunan Kadar Air tidak memberikan pengaruh yang nyata terhadap peubah Potensi Tumbuh Maksimum, Daya Berkecambah, Indeks Vigor, Kecepatan Tumbuh, dan Jumlah Daun seperti yang terlihat dalam Tabel 3.
29
Tabel 3. Analisis Ragam Pengaruh Penurunan Kadar Air Benih Kenanga Terhadap Peubah Kadar Air (KA), Daya Berkecambah (DB), Potensi Tumbuh Maksimum (PTM, Indeks Vigor (IV), Kecepatan Tumbuh (KCT), dan Jumlah Daun (JD)
Peubah F hitung KK Nilai-P
KA 29.35** 11.96 0.0001
DB 2.00 tn 27.22 0.1129
PTM 1.99 tn 23.06 0.1152
IV 0.48 tn 29.98 0.8503
KCT 0.86 tn 20.15 0.5709
Rata-rata JD per tanaman 0.80 tn 12.85 0.6150
Rata-rata JD per perlakuan 11.92 tn 20.91 0.1260 Keterangan :
**) berpengaruh sangat nyata 1% tn) berpengaruh tidak nyata
Kadar Air benih kenanga setelah diberi beberapa perlakuan penurunan Kadar Air baik desikasi secara manual maupun secara vakum dapat dilihat pada Tabel 4, Rata-rata Kadar Air benih kenanga yang didesikasi vakum selama 3, dan 6 jam (K1 dan K2) secara berurutan adalah 37.07% dan 39.16%. Kadar Air tersebut tidak berbeda nyata dengan perlakuan kontrol dengan rata-rata 38.27%. Kadar Air benih yang didesikasi vakum selama 9 jam (27.06%) tidak berbeda nyata dengan benih yang didesikasi vakum selama 12 jam (21.65%), serta pengering-anginan selam 24 jam (27.31%). Perlakuan penurunan Kadar Air secara manual baik selama 36, 46, dan 60 jam tidak menunjukkan perbedaan yang nyata dengan rata-rata secara berurutan 16.04%, 16.85%, dan 14.47%.
Tabel 4 menunjukkan bahwa perlakuan pengering-anginan secara manual akan memberikan kecenderungan penurunan Kadar Air yang lebih besar jika dibandingkan dengan penurunan Kadar Air secara desikasi vakum, akan tetapi penurunan Kadar Air dengan cara manual lebih kurang terkontrol dan sulit dijadikan standar. Novianti (1992) menyatakan bahwa benih kenanga mempunyai kisaran KA yang luas (34.49-13.43%) untuk mempertahankan viabilitasnya dan dalam penelitian ini diduga ada kaitannya dengan lapisan kulit benih yang tebal sehingga walaupun KA turun dari 38.27%-14.47% embrio masih mampu terlindung dan masih mampu berkecambah.
30
Tabel 4. Pengaruh Perlakuan Penurunan Kadar Air benih Kenanga Terhadap Peubah Kadar Air (KA), Daya Berkecambah (DB), Potensi Tumbuh Maksimum (PTM, Indeks Vigor (IV), Kecepatan Tumbuh (KCT), dan Jumlah Daun (JD) VP VT VKT VB Taraf Perlakuan KA (%) Kecepatan Pengeringan (%/waktu) DB (%) PTM (%) IV (%) KCT (%/etmal) JD K0 38.27 a 0 58.7 64.0 33.3 2.19 3.9 K1 37.07 a 12.4 26.7 53.3 22.7 1.25 4.2 K2 39.16 a 6.5 40.0 53.3 30.7 1.70 4.1 K3 27.06 b 3.0 32.0 44.0 26.7 1.30 4.1 K4 21.65 bc 1.8 33.3 46.7 32.0 1.38 4.1 K5 27.31 b 1.1 29.3 41.3 24.0 1.28 3.8 K6 16.04 cd 0.4 28.0 30.7 21.3 1.06 4.1 K7 16.85 cd 0.4 29.3 37.3 21.3 1.12 4.3 K8 14.47 d 0.2 20.0 26.7 18.7 0.76 2.9
Keterangan : angka-angka yang diikuti oleh huruf yang sama pada kolom yang sama tidak berbeda nyata pada uji Duncan 5%
K0 = Kontrol
K1 = Desikasi Vacuum 3 jam K2 = Desikasi Vacuum 6 jam K3 = Desikasi Vacuum 9 jam K4 = Desikasi Vacuum 12 jam
K5 = Pengering-anginan 24 jam K6 = Pengering-anginan 36 jam K7 = Pengering-anginan 48 jam K8 = Pengering-anginan 60 jam
Metode kecepatan pengeringan juga berpengaruh terhadap viabilitas benih, pengeringan kadar air dengan lebih lambat akan menyebabkan kehilangan nilai viabilitas lebih banyak, hal ini berkaitan dengan integritas komponen sel (Bewley dan Black, 1943). Tabel 4 dibaca secara statistik dengan α 11% menunjukkan nilai kecepatan pengeringan %/waktu yang besar, nilai vibilitasnya kecil. Perlakuan K0 dengan kecepatan pengeringan 0 nilai DB relatif paling tinggi yaitu 58.7%, sedangkan perlakuan K1 dengan kecepatan pengeringan 12.4%/waktu menunjukkan %DB hanya 26.7%. Perlakuan K8 dengan Kecepatan pengeringan 0.2%/waktu hanya memiliki %DB yang rendah yaitu 20% hal tersebut karena %KA yang rendah.
Pengelompokan nilai Kadar Air terhadap persentase Daya Berkecambah dalam penelitian ini terdapat 3 kelompok kisaran persen Kadar Air yaitu kisaran 37.07-39.16% dari perlakuan K0, K1, dan K2 dengan nilai % DB 40-58.7%. Kisaran kelompok kedua adalah % KA 27.06-27.31% dari perlakuan K3, K4, dan
31
K5 dengan nilai % DB 29.3-33.3%, dan kisaran kelompok ketiga adalah %KA 14.47-16.85% dengan nilai % DB 20.0-29.3%.
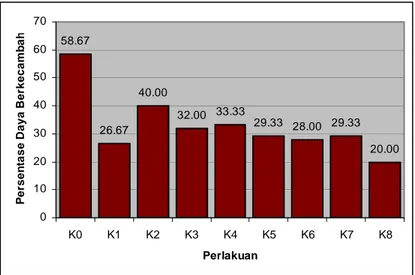
Gambar 8 dengan lebih jelas menunjukkan bahwa %DB perlakuan K8 (20%) tidak berbeda nyata secara statistik dengan % DB perlakuan kontrol (58.7%), akan tetapi perlakuan ini memiliki % DB paling tinggi dibandingkan perlakuan yang lain.
58.67 26.67 40.00 32.00 33.33 29.33 28.00 29.33 20.00 0 10 20 30 40 50 60 70 K0 K1 K2 K3 K4 K5 K6 K7 K8 Perlakuan P e rsen ta se D aya Berk ecamb a h
Gambar 8. Histogram Pengaruh Penurunan Kadar Air Benih Kenanga Terhadap Peubah Daya Berkecambah (DB)
Persentase KA benih kenanga dari 38.27% (%KA perlakuan kontrol) diturunkan hingga 14.47% tidak mempengaruhi persentase viabilitas potensial secara statistik. Hal ini dapat diduga bahwa benih kenanga tidak termasuk dalam benih rekalsitran karena titik Kadar Air Kritikal tidak ditemukan dengan adanya % DB awal hanya 58.7% bukan 100%. Dugaan ini juga didukung dengan adanya data kadar air benih yang diturunkan hingga 14.47 % benih kenanga masih dapat tumbuh walaupun dengan persentase viabilitas potensial yang kecil. Hal tersebut bertentangan dengan pendapat Hobir (1989) tentang karakteristik benih ylang-ylang sebagai kerabat dekat kenanga, bahwa benih ylang-ylang-ylang-ylang diduga bersifat rekalsitran (tidak tahan dikeringkan).
Satyanti (2005) menyebutkan benih kenanga diklasifikasikan dalam benih ortodok, karena mempunyai kisaran Kadar Air benih antara 15.09-21.96% dengan rata-rata 18.81%. Persentase perkecambahan benih kenanga segar tidak menentu
32
dan relatif rendah (Manner dan Elevitch, 2006) dan akan meningkat bila benih disimpan selama 6-12 bulan sebelum disemaikan, walaupun belum ada data yang relevan.
Pernyataan diatas belum dapat menjelaskan apakah termasuk ortodok atau intermediet, haruslah ada pengujian lanjutan tentang klasifikasi benih kenanga dalam benih ortodok atau intermediet seperti perlakuan penyimpanan benih dalam kondisi suhu rendah atau perlakuan lama penyimpanan terhadap viabilitas benih kenanga dengan data yang aktual.
2. Pengaruh Pengeringan Terhadap Viabilitas Benih
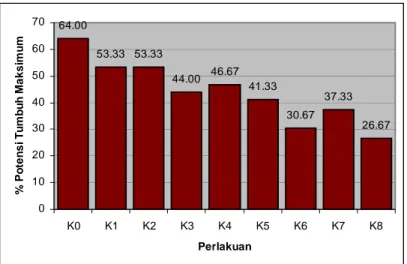
Penurunan kadar air tidak berpengaruh terhadap parameter Viabilitas Total, Viabilitas Kekuatan Tumbuh dengan peubah pengamatan, peubah Potensi Tumbuh Maksimum, Indeks Vigor, Kecepatan Tumbuh terlihat dalam Tabel 4. Gambar 9 menunjukkan perlakuan kontrol (64%) mempunyai persentase cenderung paling tinggi dibandingkan perlakuan yang lain.
64.00 53.33 53.33 44.00 46.67 41.33 30.67 37.33 26.67 0 10 20 30 40 50 60 70 K0 K1 K2 K3 K4 K5 K6 K7 K8 Perlakuan % P o te ns i Tum bu h M a k s im um
Gambar 9. Histogram Pengaruh Penurunan Kadar Air Benih Kenanga Terhadap Peubah Potensi Tumbuh Maksimum (PTM)
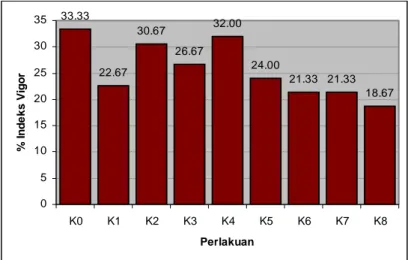
Tolok ukur Indeks Vigor merupakan perbandingan antara jumlah kecambah normal pada hitungan pertama dengan jumlah seluruh benih yang ditanam. Indeks Vigor dan Kecepatan Tumbuh merupakan peubah yang berhubungan dengan parameter Vigor Kekuatan Tumbuh karena benih yang lebih
33
cepat tumbuh lebih mampu menghadapi kondisi lapang yang suboptimum. Berdasarkan hasil sidik ragam Tabel 3 menunjukkan tingkat penurunan Kadar Air benih tidak berpengaruh terhadap Indeks Vigor maupun Kecepatan Tumbuh benih.
Gambar 10 dan 11 menunjukkan kondisi benih yang dilihat dari peubah Kecepatan Tumbuh dan Indeks Vigor. Walaupun kedua peubah tersebut merupakan bagian dari parameter Vigor Kekuatan Tumbuh, peubah KCT lebih menunjukkan kekuatan tumbuh dari benih tersebut karena pengamatan peubah KCT dilakukan setiap hari sedangkan peubah IV hanya sekali dilakukan yaitu pada saat first count. Nilai KCT pada perlakuan kontrol juga memiliki %/etmal yang paling tinggi. 33.33 22.67 30.67 26.67 32.00 24.00 21.33 21.33 18.67 0 5 10 15 20 25 30 35 K0 K1 K2 K3 K4 K5 K6 K7 K8 Perlakuan % Inde k s V igor
Gambar 10. Histogram Pengaruh Penurunan Kadar Air Benih Kenanga Terhadap Peubah Indeks Vigor (IV)
Menurut Sadjad et al. (1999) benih vigor tentu menjadi cepat proses reaktivasinya apabila kondisi sekeliling untuk tumbuh optimum dan proses metabolisme tidak terhambat. Baik proses katabolik maupun proses anabolik normal dan benih menunjukkan kecepatan tinggi dalam proses perkecambahan.