INTENSITAS WARNA HEPAR TIKUS Sprague dawley DALAM
PENGAWETAN MENGGUNAKAN LARUTAN FIKSATIF
Skripsi
Diajukan untuk Memenuhi Persyaratan Memperoleh Gelar Sarjana Kedokteran (S.Ked)
Oleh :
RADEN MUHAMAD HIDAYAT
11161030000072
PROGRAM STUDI PENDIDIKAN DOKTER
FAKULTAS KEDOKTERAN
UNIVERSITAS ISLAM NEGERI SYARIF HIDAYATULLAH
JAKARTA
iv
ABSTRAK
Raden Muhamad Hidayat. Fakultas Kedokteran. Intensitas Warna Hepar Tikus Sprague
dawley dalam Pengawetan Menggunakan Larutan Fiksatif. 2019.
Latar Belakang Pada pembelajaran anatomi, metode belajar dengan pengamatan kadaver yang
diawetkan. Pengawetan pada kadaver biasa dilakukan dengan formalin. Kekurangan pengawetan formalin adalah sifat formalin yang berbahaya bagi yang berkontak dengan formalin, baik terhirup, kontak langsung, dan tertelan. Penggunaan formalin juga membuat struktur anatomi menjadi kering dan berubah warna menjadi kecokelatan karena adanya reaksi oksidasi, hal ini membuat mahasiswa kesulitan dalam mengidentifikasi dan membedakan struktur anatomi. Pengurangan konsentrasi formalin dan penambahan gliserin dan alkohol dapat menjadi alternatif larutan pengawet. Pengawetan bisa dilakukan dalam jangka waktu panjang. Kulit sebagai barrier yang dapat mempengaruhi penetrasi cairan pengawet untuk masuk ke dalam jaringan. Berdasarkan waktu normal pembusukan suatu organ juga sangat berpengaruh terhadap hasil pengawetan, pada penelitian ini digunakan hepar yang merupakan organ awal yang mengalami pembusukan.
Metode yang digunakan adalah metode eksperimental laboratorium. Sampel yang digunakan
adalah 12 ekor berdasarkan rumus MEAD. Tikus jantan Sprague dawley yang baru saja mati (<2 jam). Enam tikus Sprague dawley yang sudah mati dikuliti kemudian dimasukkan ke dalam toples kaca yang berisi campuran larutan fiksatif (formalin 5% alkohol 70% gliserin 80%) dan enam lainnya yang masih memiliki kulit langsung dimasukkan ke dalam toples tersebut. Toples kaca larutan fiksatif ditutup rapat dan disimpan selama 10 bulan. Setelah itu, organ hepar diambil dan dinilai intensitas warnanya.
Hasil Pada pengukuran intensitas warna hepar tikus pada kelompok dikuliti didapatkan 2 hepar
tikus berintensitas warna terang dan 4 hepar tikus berintensitas warna gelap. Pada pengukuran intensitas warna hepar tikus pada kelompok tidak dikuliti didapatkan seluruh data (enam hepar tikus) berintensitas warna gelap. Hal ini mungkin terjadi karena metode homogenitas larutan yang kurang memadai.
Kesimpulan Dari hasil penelitan intensitas warna hepar tikus Sprague dawley yang dilakukan
pengawetan menggunakan larutan fiksatif (formalin 5%, alkohol 70% dan gliserin 80%) dengan perlakuan dikuliti dan tidak dikuliti diperoleh hasil intensitas warna hepar kedua perlakuan secara umum berada pada intensitas warna gelap namun terdapat 2 tikus dari 6 tikus dengan perlakuan dikuliti mendapatkan hasil intensitas warna terang.
v
ABSTRACT
Raden Muhamad Hidayat. Faculty of Medicine. The intensity of the liver color of Sprague
dawley mice in preservation using fixative solutions. 2019.
Background In anatomy learning, the methods with cadaveric observations are needed.
Preservation in cadaver is usually done with formalin. Weakness of formalin preservation in mention : formalin is dangerous for those who come into contact with formaldehyde, whether inhaled, direct contact, and swallowed. The use of formaldehyde also makes the anatomical structure dry and changes color to brown due to oxidation reactions, this makes it difficult for students to identify and differentiate anatomical structures. Reducing the concentration of formalin and the addition of glycerin and alcohol can be an alternative preservative solution. Preservation can be done in the long term. Skin as a barrier that can affect the penetration of preservative fluid to enter the tissue. Based on the normal time of decomposition of an organ is also very influential on the results of preservation, in this study used liver which is the initial organ that experienced decay.
Methode used is an experimental laboratory method. The sample used was 12 animals based on
the MEAD formula. we used Sprague Dawley male rats that had just died (<2 hours). Six dead
Sprague dawley rats were then put into a glass jar containing a mixture of fixative solution
(formalin 5% alcohol 70% glycerin 80%) and six others who still had skin were directly put into the jar. Glass jar of fixative solution is tightly closed and stored for 10 months. After that, the liver is removed and the color intensity assessed.
Result In measuring the intensity of the liver color of rats in the skinned group, there were 2 liver
rats with bright color intensity and 4 liver rats with dark color intensity. In measuring the intensity of the liver color of rats in the skinless group, all data (six liver rats) had a dark color intensity. This might occur because the method of homogeneity of the solution is inadequate.
Conclusion From the results of the Sprague dawley rat's liver color intensity testing, the
preservation using fixative solution (formalin 5%, alcohol 70% and glycerin 80%) with hulled and non-hulled treatments obtained the results of the hepatic color intensity. 2 rats from 6 mice treated with skinned got the bright color intensity.
vi
KATA PENGANTAR
Assalamualaikum Warahmatullaahi Wabarakaatuh, Bismillahirrohmaanirrohim,
Segala puji bagi Allah SWT, yang telah memberikan kekuatan dan kesempatan sehingga saya dapat menyelesaikan laporan penelitian sesuai dengan jadwal dan waktu yang ditentukan. shalawat serta salam tercurah kepada pemimpin para nabi dan rosul sayyidina Muhamad saw. sehingga saya bisa menkmati nikmatnya iman dan Islam.
Alhamdulillahirobbilalamin, selesainya penulisan laporan penelitian ini, penulis menyadari
bahwa laporan ini tidak dapat tersusun dengan baik tanpa dukungan, bantuan dan bimbingan dari berbagai pihak. Oleh karena itu, penulis mengucapkan banyak terima kasih kepada :
1. Orang tua tercinta, Raden Abdul Rahim dan Tini Eva Yulia Kartini yang telah membimbing sedari penulis di dalam rahim sampai detik ini.
2. Ayahanda penulis yaitu Kyai Haji Muhammad Husni Thamrin Padmawija Al-Banjari yang telah bersusah payah membimbing penulis dalam ilmu agama. Beserta ibunda penulis yaitu Dr Indah Yulianto, dr., Sp.KK(K),yang telah menginspirasi penulis untuk giat dan semangat menjalani pendidikan kedokteran.
3. dr. Hari Hendarto, Ph.D., Sp.PD-KEMD selaku Dekan Fakultas Kedokteran UIN Syarif Hidayatullah Jakarta.
4. Dr. dr. Achmad Zaki, M.Epid., Sp.OT selaku ketua Program Studi Kedokteran UIN Syarif Hidayatullah Jakarta.
5. dr. Lucky Brilliantina, M.Biomed dan Rr Ayu Fitri Hapsari, S.Si., M.Biomed selaku dosen pembimbing yang selalu memberi bimbingan, ilmu dan arahan selama menjalankan dan menyusun laporan penelitian ini.
6. drg. Laifa Annisa Hendarmin, Ph.D selaku penanggung jawab modul riset Program Studi Kedokteran angkatan 2016.
7. dr. Devy Ariany, M.Biomed dan dr. Nurmila Sari, M.Kes selaku penguji skripsi.
8. Sahabat dan teman seperjuangan angkatan 2016 yang selalu mendorong diri penulis untuk lebih baik dan merasa memiliki keluarga.
9. Chaerani Kurniatin dan Muhammad Ilham Indraprasta, teman sepenelitian yang sudah berjuang bersama menghadapi segala rintangan selama penelitian dan penyusunan laporan penelitian.
10. Mas Panji, Pak Bacok dan Mba Din sebagai laboran anatomi dan histologi atas bantuannya selama menjalankan penelitian ini.
11. Sahabat Kehidupan DEMA yaitu Annisa Futihandayani beserta seluruh anggota DEMA FKUIN 2019 yang telah menginspirasi penulis.
12. Seluruh kabinet kompas DEMA FKUIN Jakarta 2019/2020 terutama Badan Pengurus Harian yang terdiri dari 16 mahasiswa pilihan.
vii 13. Tempat berbagi suka dan duka perjalanan kehidupan pendidikan kedokteran Raden Tasy
Shafira Alfein.
14. Teman-teman dan keluarga besar kaderisasi Pesantren Al-Ihya yang selalu berdoa untuk kesuksesan penulis.
15. Teman-teman kontrakan Pak Haji yang selalu suportif dengan apa yang saya kerjakan. 16. Seluruh pihak yang telah membantu dan memberi dukungan baik secara langsung maupun
tidak langsung yang tidak bisa disebutkan satu persatu.
Penulis menyadari bahwa laporan penelitian ini masih jauh dari kata sempurna. Oleh karena itu, penulis mengharapkan kritik dan saran yang membangun untuk laporan penelitian ini agar kedepannya dapat jauh lebih baik. Besar harapan penulis bahwa laporan penelitian ini dapat memberikan manfaat bagi semua pihak. Semoga penelitian yang telah dilakukan bisa menjadi ilmu yang bermanfaat sehingga menjadi amal jariyah dan diberkahi oleh Allah SWT. Aamiin.
Wassalamualaikum Warahmatullahi Wabarakaatuh.
Ciputat, 26 Desember 2019
viii
DAFTAR ISI
LEMBAR PERNYATAAN KEASLIAN KARYA ... i
LEMBAR PERSETUJUAN PEMBIMBING ... ii
LEMBAR PENGESAHAN ... iii
ABSTRAK ... iv
KATA PENGANTAR ... vi
DAFTAR ISI ... viii
DAFTAR GAMBAR ... xi
DAFTAR TABEL ... xii
DAFTAR SINGKATAN ... xiii
DAFTAR LAMPIRAN ...xiv
BAB I PENDAHULUAN ...1 1.1 Latar Belakang ...1 1.2 Rumusan Masalah ...2 1.3 Hipotesis ...3 1.4 Tujuan ...3 1.5 Manfaat ...3 1.5.1 Bagi Peneliti ...3 1.5.2 Bagi Institusi ...3
BAB 2 TINJAUAN PUSTAKA...4
2.1 Anatomi Hepar Manusia dan Tikus ...4
2.2 Kulit ...6
2.3 Formalin ...8
2.4 Alkohol ... 10
ix 2.6 Proses Pembusukan... 11 2.7 Pengawetan Kadaver ... 13 2.8 Kerangka Teori ... 15 2.9 Krangka Konsep ... 16 2.10 Definisi Operasional ... 17
BAB 3 METODE PENELITIAN ... 18
3.1 Desain Penelitian ... 18
3.2 Waktu dan Tempat Penelitian ... 18
3.2.1 Tempat Penelitian ... 18
3.2.2 Waktu Penelitian ... 18
3.3 Populasi dan Sampel Penelitian ... 18
3.3.1 Kriterian Inklusi ... 19 3.3.2 Kriteria Eksklusi... 19 3.3.3 Kelompok perlakuan ... 19 3.4 Variabel Penelitian ... 19 3.4.1 Variabel Bebas ... 19 3.4.2 Variabel Terikat ... 19
3.5 Alat dan Bahan Penelitian ... 20
3.5.1 Alat Penelitian ... 20
3.5.2 Bahan Penelitian... 20
3.6 Objek Penelitian ... 20
3.7 Cara Kerja Penelitian ... 21
3.7.1 Pengulitan Tikus ... 21
3.7.2 Pembuatan larutan pengawet ... 21
3.7.3 Pengawetan tikus ... 22
3.7.4 Pengambilan organ ... 22
3.8 Pengolahan Data ... 22
x
BAB IV HASIL DAN PEMBAHASAN ... 24
4.1 Kekurangan Penelitian ... 25
BAB V KESIMPULAN DAN SARAN ... 26
5.1 SIMPULAN... 26
5.2 SARAN ... 26
DAFTAR PUSTAKA ... 27
xi
DAFTAR GAMBAR
Gambar 2.1 Anatomi Permukaan dan Alas Hepar ...4
Gambar 2.2 Letak Hepar Tikus ...5
Gambar 2.3 Anatomi Hepar Tikus ... 5
Gambar 2.4 Histologi Kulit ...6
Gambar 2.5 Histologi Kulit ...7
Gambar 2.6 Mekanisme Zat Masuk ke dalam Kulit...8
xii
DAFTAR TABEL
xiii
DAFTAR SINGKATAN
CCE Comified Cell Emvelope
HL Horny Layer
SC Stratum Corneum
BMZ Basal Membrane Zone
xiv
DAFTAR LAMPIRAN
Lampiran 1 Foto Makroskopik ... 29 Lampiran 2 Surat Keterangan Lolos Kaji Etik ... 31 Lampiran 3 Identitas Penulis ... 32
1
BAB I PENDAHULUAN 1.1 Latar Belakang
Pembelajaran kedokteran tidak dapat dipisahkan dari ilmu anatomi. Salah satu metode untuk mempelajari anatomi dengan baik adalah dengan menggunakan tubuh manusia yang diawetkan atau kadaver. Metode ini akan memudahkan mahasiswa untuk mengenal dan mengetahui bentuk asli organ tubuh manusia.1 Tujuan pengawetan adalah mengawetkan seluruh preparat dengan seksama dan lengkap, jaringan kenyal seperti jaringan yang masih hidup, warna organ paling tidak mempertahankan warna seperti saat masih hidup dan kekenyalan pembuluh darah yang baik.2 Pada laboratorium anatomi pengawetan bisa dilakukan dalam waktu yang singkat berkisar harian hingga mingguan. Dapat juga dilakukan pengawetan dalam waktu yang panjang bergantung terhadap kebutuhan laboratorium berkisar 6 bulan hingga 3 tahun.1,2
Secara umum metode pengawetan mengalami periode kuno yang fokus untuk tujuan sentimentil, periode anatomis yang fokus dalam proses pembelajaran dokter, periode modern yang fokus untuk menciptakan larutan yang paling baik pengawetannya dan paling tidak membahayakan bagi pembelajar anatomi.3 Periode modern terpengaruh oleh penemuan formalin oleh August Wilhelm von Hoffmann pada tahun 1896, larutan ini mudah didapat dan murah.2,4 Larutan fenol-formalin dengan formalin konsentrasi 37%
digunakan oleh Fakultas Kedokteran Universitas Airlangga dan memberikan efek negatif. Konsentrasi formalin yang tinggi tersebut berbahaya bagi yang berkontak dengan formalin tersebut, baik terhirup, kontak langsung, dan tertelan. Paparan akut zat ini akan menyebabkan iritasi pada organ yang terkena kontak. Paparan kronik zat ini dapat menyebabkan terjadinya perubahan susunan genetik pada sel dan menyebabkan mutasi.5,6 Penggunaan formalin ini dapat membuat struktur anatomi kadaver menjadi kering dan berubah warna menjadi kecoklatan karena adanya reaksi oksidasi, hal ini membuat mahasiswa kesulitan dalam mengidentifikasi dan membedakan struktur anatomi. Penggunaan formalin juga dapat menyebabkan penurunan elastisitas jaringan.4,7
Pemakaian formalin kadar rendah (5-7,5%) menurut Viskasari (2012) memberikan kualitas kadaver yang baik dibandingankan dengan kadar formalin yang lebih tinggi.7 Untuk menunjang hasil elastisitas yang baik, gliserin 10-15% dapat ditambahkan
2 kedalam campuran larutan. Gliserin secara selular dapat masuk ke membran lipid bilayer kemudian mempertahankan permeabilitasnya dan mampu mempertahankan air di dalam sel.1,8 Panzacchi (2019) menggunakan alkohol 70% untuk mengawetkan tikus Sprague
dawley. Untuk menunjang fungsi antibakteri pada formalin yang berkurang karena
pengurangan konsentrasi, dipakai alkohol yang juga berfungsi sebagai antibakteri. Alkohol memiliki molekul yang dengan mudah berikatan dengan molekul protein membran sel dan membuat membran sel bakteri mengalami denaturasi.1,8,9
Berbagai hal akan mempengaruhi berbagai macam faktor, salah satunya adalah kemampuan penetrasi larutan fiksatif. Kemampuan penetrasi larutan fiksatif dipengaruhi ketebalan jaringan dan ada tidaknya barrier yang menghalangi masuknya zat fiksatif.10 Kulit memiliki ketebalannya masing masing tergantung dimana kulit itu berada. Kulit mempunyai berbagai fungsi salah satunya adalah fungsi pertahanan tubuh yaitu mencegah masuknya zat maupun mikroorganisme dari luar tubuh.11
Organ hepar merupakan organ yang membusuk segera setelah individu mati bersama dengan organ dengan penyusun protein yang sama yaitu otak dan ginjal. Hal ini juga berkaitan dengan hepar yang berisi enzim proteolitik yang melakukan autolisis terhadap jaringan sendiri.11
Berdasarkan pada latar belakang diatas, maka penelitian ini dilakukan untuk mengetahui hasil pengawetan hepar tikus dengan keadaan ada tidaknya kulit sebagai barrier. Pada penelitian ini juga digunakan formalin konsentrasi rendah (5%) dengan campuran alkohol 70% dan gliserin 80% diharapkan mengurangi dampak negatif paparan formalin konsentrasi tinggi dan tetap menghasilkan pengawetan dengan baik.
1.2 Rumusan Masalah
Bagaimana intensitas warna hepar tikus Sprague dawley dengan perlakuan dikuliti dan tidak dikuliti setelah diawetkan menggunakan larutan fiksatif dengan metode perendaman?
3
1.3 Hipotesis
Intensitas warna hepar tikus Sprague dawley dengan perlakuan dikuliti menjadi lebih terang daripada intensitas warna hepar tikus Sprague dawley dengan perlakuan tidak dikuliti.
1.4 Tujuan
Mengetahui intensitas warna hepar tikus Sprague dawley sesudah diawetkan 10 bulan menggunakan larutan fiksatif dengan perlakuan dikuliti dan tidak dikuliti.
1.5 Manfaat 1.5.1 Bagi Peneliti
1. Diketahui pengetahuan tentang penggunaan larutan fiksatif terhadap pengawetan organ hepar.
2. Menambah ilmu pengetahuan tentang pengawetan kadaver. 3. Memperoleh gelar Sarjana Kedokteran.
1.5.2 Bagi Institusi
1. Menambahkan referensi baru pada institusi terkait pengawetan kadaver.
2. Campuran larutan fiksatif bisa diterapkan di laboratorium anatomi institusi sehingga menunjang pembelajaran anatomi.
4
BAB 2
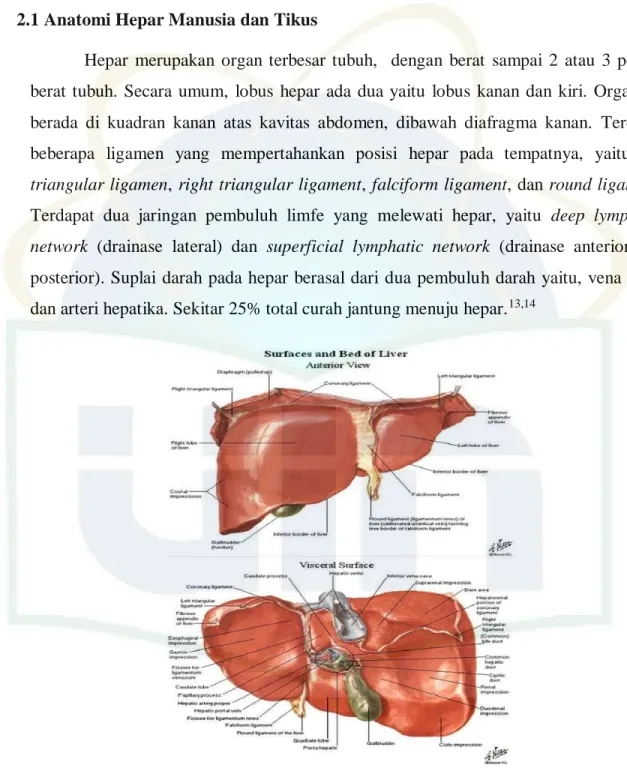
TINJAUAN PUSTAKA 2.1 Anatomi Hepar Manusia dan Tikus
Hepar merupakan organ terbesar tubuh, dengan berat sampai 2 atau 3 persen berat tubuh. Secara umum, lobus hepar ada dua yaitu lobus kanan dan kiri. Organ ini berada di kuadran kanan atas kavitas abdomen, dibawah diafragma kanan. Terdapat beberapa ligamen yang mempertahankan posisi hepar pada tempatnya, yaitu left
triangular ligamen, right triangular ligament, falciform ligament, dan round ligament.
Terdapat dua jaringan pembuluh limfe yang melewati hepar, yaitu deep lymphatic
network (drainase lateral) dan superficial lymphatic network (drainase anterior dan
posterior). Suplai darah pada hepar berasal dari dua pembuluh darah yaitu, vena porta dan arteri hepatika. Sekitar 25% total curah jantung menuju hepar.13,14
Gambar 2.1 Anatomi Permukaan dan Alas Hepar Sumber : Netter FH, 2011
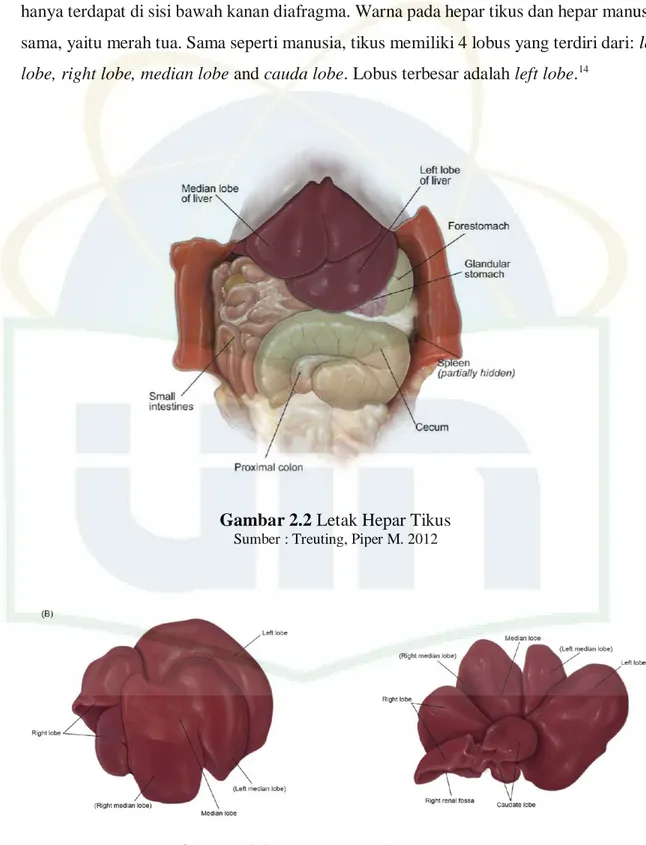
5 Hepar tikus memliki berat 4-5 gram atau diperkirakan 2-3% berat tubuh tikus. Hepar tikus berada pada seluruh sisi bawah diafragma, berbeda dengan manusia yang hanya terdapat di sisi bawah kanan diafragma. Warna pada hepar tikus dan hepar manusia sama, yaitu merah tua. Sama seperti manusia, tikus memiliki 4 lobus yang terdiri dari: left
lobe, right lobe, median lobe and cauda lobe. Lobus terbesar adalah left lobe.14
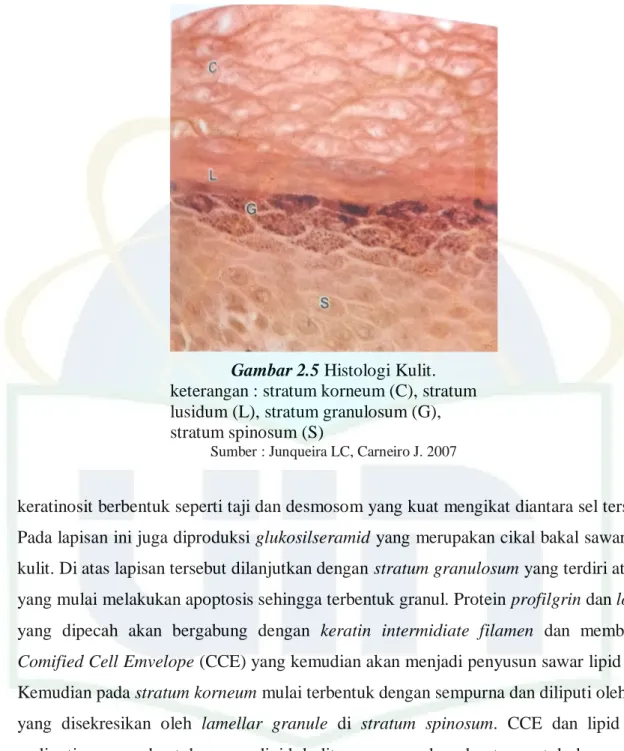
Gambar 2.3 Anatomi Hepar Tikus
Sumber : Treuting, Piper M. 2012
Gambar 2.2 Letak Hepar Tikus
6 Penggunaan tikus Sprague dawley biasa pada penelitian untuk melakukan cek terhadap toksisitas. Pemakaian hewan coba diatur oleh kode etik, harus menggunakan hewan dengan kerugian paling kecil. Pada penelitian ini digunakan tikus Sprague dawley karena organnya lebih besar dibandingkan dengan mencit dan mudah untuk diobservasi.
2.2 Kulit
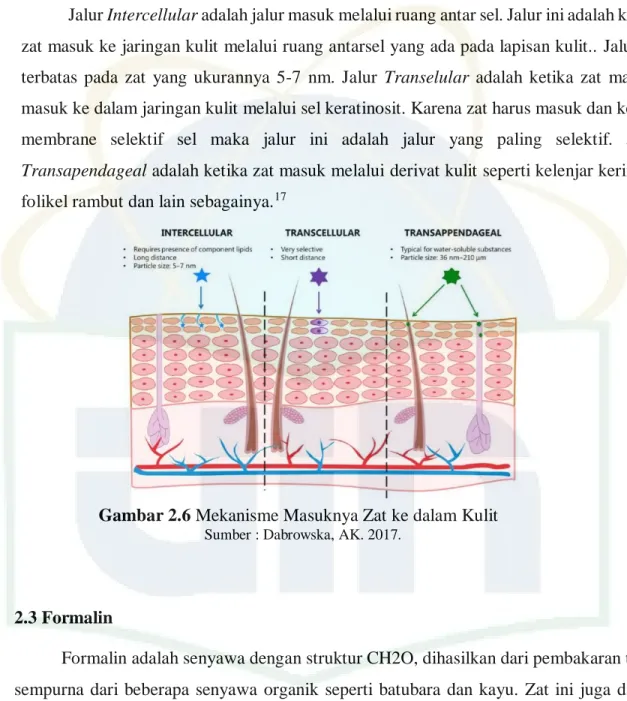
Kulit merupakan organ yang terlihat secara kasat mata dan organ ini menampakkan secara langsung kapan mengalami gangguan atau kerusakan melalui warna, bentuk dan sensasi. Kulit memiliki beberapa turunan yaitu kulit, rambut dan kelenjar. Kulit merupakan organ terbesar tubuh dengan luas sekitar 2 m2 dan berat 5 kg pada manusia dengan tinggi 70 kg. Kulit tertebal berada pada telapak tangan dan telapak kaki, tebalnya bisa 10 kali tebal kulit lain. Kulit menjalankan beberapa fungsi penting dalam tubuh, salah satunya fungsi perlindungan fisik, termasuk di dalamnya perlindungan terhadap larutan. Dalam menjalankan fungsi ini kulit memiliki struktur histologi yang penting yaitu: stratum basalis, stratum spinosum, stratum granulosum stratum lusidum, dan stratum corneum epidermis.11,14,16
Secara histologi, stratum basale menempel pada basal zone membrane (BMZ) yang mematri keratinosit diatasnya dengan protein struktural bernama hemidesmosom. struktur ini yang menahan pajanan fisis pada kulit sehingga kulit tetap berada pada tempatnya. Stratum spinosum merupakan lapisan di atas stratum basal. Lapisan ini terdiri atas
Gambar 2.4 Histologi Kulit Sumber : Junqueira LC, Carneiro J. 2007
7 keratinosit berbentuk seperti taji dan desmosom yang kuat mengikat diantara sel tersebut. Pada lapisan ini juga diproduksi glukosilseramid yang merupakan cikal bakal sawar lipid kulit. Di atas lapisan tersebut dilanjutkan dengan stratum granulosum yang terdiri atas sel yang mulai melakukan apoptosis sehingga terbentuk granul. Protein profilgrin dan loricin yang dipecah akan bergabung dengan keratin intermidiate filamen dan membentuk
Comified Cell Emvelope (CCE) yang kemudian akan menjadi penyusun sawar lipid kulit.
Kemudian pada stratum korneum mulai terbentuk dengan sempurna dan diliputi oleh lipid yang disekresikan oleh lamellar granule di stratum spinosum. CCE dan lipid yang meliputinya membentuk sawar lipid kulit yang menahan larutan untuk berpenetrasi kedalam.11,16
Kulit pada kehidupan sehari-hari sangat rentan terpajan oleh zat-zat di lingkungan. Sesuai dengan fungsinya, kulit menjalankan fungsi untuk melindungi jaringan di bawahnya dari pajanan tersebut. Seluruh kulit berperan dalam fungsi ini namun lapisan yang paling berperan dalam menjalankan fungsi ini adalah stratum corneum (SC) atau yang biasa
Gambar 2.5 Histologi Kulit. keterangan : stratum korneum (C), stratum lusidum (L), stratum granulosum (G), stratum spinosum (S)
8 disebut horny layer (HL). Ada tiga cara zat dari lingkungan dapat masuk ke dalam kulit melalui tiga jalur, yaitu: Intercellular, Transcellular and Transappendegael.16,17
Jalur Intercellular adalah jalur masuk melalui ruang antar sel. Jalur ini adalah ketika zat masuk ke jaringan kulit melalui ruang antarsel yang ada pada lapisan kulit.. Jalur ini terbatas pada zat yang ukurannya 5-7 nm. Jalur Transelular adalah ketika zat mampu masuk ke dalam jaringan kulit melalui sel keratinosit. Karena zat harus masuk dan keluar membrane selektif sel maka jalur ini adalah jalur yang paling selektif. Jalur
Transapendageal adalah ketika zat masuk melalui derivat kulit seperti kelenjar keringat,
folikel rambut dan lain sebagainya.17
2.3 Formalin
Formalin adalah senyawa dengan struktur CH2O, dihasilkan dari pembakaran tidak sempurna dari beberapa senyawa organik seperti batubara dan kayu. Zat ini juga dibuat secara komersial menggunakan oksidasi fase uap katalitik metanol dengan udara sebagai pengoksidasi. Juga ditambahkan perak, aluminium, tembaga atau arang sebagai pengkatalis. Formalin dipasaran dijual dengan konsentrasi 37% dengan tambahan metanol
Gambar 2.6 Mekanisme Masuknya Zat ke dalam Kulit
9 10-15% sebagai pencegahanan terjadinya polimerisasi. Zat ini tersedia dalam bentuk gas dan cair. Secara fisik cairan formalin berwarna seperti air, sedikit asam, baunya sangat menyengat dan korosif. Titik beku zat ini pada 117°C dan titik nyala pada 85°C. Jika tertelan dan terhirup, zat ini dapat menyebabkan gangguan kesehatan. Pada orang orang yang tidak bertanggung jawab, formalin dipakai untuk pengawet makanan pada ikan asin, ikan segar, ayam basah, mie basah dan tahu. Nama lain senyawa ini yaitu Metanal, Formic Aldehyde, Formol, Morbicid dan lain lain.5,6
Penggunaan utama zat ini yaitu pada pembersih guna membunuh kuman dengan cara mengikat menghambat gugus amino dan ikatan peptida. Seperti pada pembersih lantai, kapal, gudang dan pakaian, Pembasmi lalat dan serangga lain, bahan pada sutra buatan, zat pewarnaan cermin kaca dan bahan peledak, pelapis pada kertas dan pengeras lapisan gelatin, penggunaan untuk pupuk, bahan membuat parfum, bahan pengawet produk kosmetik dan pengeras kuku, pencegah korosi pada sumur minyak, bahan untuk insulasi busa dan lain lain.6
Menurut OSHA (Occupational Safety and Health Administration) batas paparan maksimal pada 2 ppm adalah 15 menit. Jika terhirup 0,1 sampai 5 ppm dapat menyebabkan iritasi pada hidung dan tenggorok, 10 sampai 20 ppm dapat menyebabkan rasa terbakar pada hidung dan tenggorokan, 25-50 ppm dapat menyebabkan kerusakan jaringan dan luka saluran napas, pada konsentrasi sangat tinggi dapat menyebaban kematian. Uap atau larutan senyawa ini dapat menyebabkan luka bakar derajat satu dengan tanda rasa sakit,
Gambar 2.7 Struktur Kimia Formalin
10 perubahan warna kulit, dan mengeras. Pada 4-20 ppm kontak dengan mata bisa menyebabkan kebutaan. Pada paparan kronik dapat menyebabkan gangguan tidur, irritabilitas, mengantuk, gangguan pernapasan, penurunan daya ingat hilang konsentrasi, dan masalah kesuburan.5,6
Mekanisme paparan formalin masih belum diketahui secara jelas, namun beberapa dugaan dikemukakan, yaitu kontak dengan protein sel dan mengganggu fungsi sel. Pada konsentrasi tinggi, formalin dapat membuat sel mati. Sesaat setelah formalin terserap di darah, dalam jumlah yang besar dapat mengacaukan sistem keseimbangan asam-basa.6
Pada seluruh proses di atas, paparan pada anak berefek lebih parah, mengingat kemampuan ekspirasi dan metabolisme tidak secepat tubuh orang dewasa.6
2.4 Alkohol
Alkohol adalah unsur organik yang ditandai dengan adanya ikatan hidroksil (-OH) dalam sebuah cincin hidrokarbon. Kegunaan alkohol dewasa ini sangat beragam. Seperti pada pembuatan parfum, pembuatan pemanis, pencampur bensin, pembuatan minuman keras dan lain sebagainya. Jenis alkohol yang saat ini paling sering dipakai adalah methanol dan etanol.7,18
Sebagai pegawet kadaver, alkohol sudah popular dipakai sejak jaman sebelum masehi. Larutan ini sebatas dikenal namun tidak dijadikan sebagai larutan terbaik untuk pengawetan kadaver. Larutan ini adalah larutan anti mikroba sama seperti formalin. Menurut Panzacchi (2012) penggunaan pengawetan menggunakan alkohol 70% menghasilkan hasil yang baik dalam pengawetan dalam jangka waktu satu tahun. Senyawa ini dengan mudah mengikat struktur protein mikroba dan meningkatkan permaebilitas sel bakteri sehingga membunuh bakteri. Dewasa ini, alkohol dikombinasikan dengan gliserin menjadi larutan fiksatif alkohol-gliserin.7,8,9,18
2.5 Gliserin
Gliserin atau sering disebut dengan gliserol merupakan senyawa kimia non toksik berbentuk cairan kental dan manis. Rumus kimia senyawa ini adalah C3H8O3. Gliserin memliki titik didih dan titik lebur yang lebih tinggi dibandingkan dengan air, hal ini membuat densitas gliserin lebih tinggi dibandingkan dengan air. Gliserin secara umum
11 dipakai dalam pembuatan pelembab kulit, kondisioner rambut, krim cukur, pasta gigi, kapsul obat, krim topikal dan lain sebagainya.19
Pada laboratorium anatomi gliserin dipakai untuk pengawetan kadaver. Zat ini dimanfaatkan karena densitasnya yang tinggi dan memiliki efek melembabkan jaringan dan mempertahankan kekenyalannya. Menurut Hammer (2012) pengawetan dengan etanol-gliserin memberikan hasil yang baik. Pada organ hepar didapatkan kekenyalan jaringan yang baik. Hal ini dikarenakan gliserin akan membuat jaringan terdehidrasi dengan baik.7,8 Gliserin pada tingkat selular akan masuk ke dalam sel dan menggantikan air di dalamnya. Begitu pula akan masuk ke celah membran lipid bilayer dan mempertahankan osmolaritas intrasel.7
2.6 Proses Pembusukan
Proses pembusukan diawali dengan terjadi kematian. Pada makhluk hidup, kematian akan terjadi menjadi kematian seluler dan kematian somatik. Pada kematian somatik, seseorang akan kehilangan reflek neuron dan kepribadian. Sedangkan pada kematian seluler, dipastikan seluruh fungsi tubuh hilang.1,2
Proses pembusukan diawali dari terjadinya post mortem hypostatis, yaitu terhentinya jantung dan berhentinya aliran darah. Darah akan berkumpul dibawah tubuh, dan terjadi perubahan warna yang awalnya merah menjadi warna ungu di seluruh tubuh. Kemudian, sekitar 2 jam setelah itu, akan terjadi rigor mortis yang ditandai dengan kekakuan otot. Hal ini didasari karena terjadinya breakdown ATP dan tempat perlekatan aktin dan miosin bertemu. Keadaan ini akan mencapai puncaknya pada 12 jam setelah kematian dan akan mulai menghilang pada 24 jam setelah kematian. Namun sebelum
Rigor Mortis terjadi, akan terjadi kepayahan seluruh anggota gerak namun masih bisa
berkontraksi. Setelah Rigor Mortis, yaitu tepatnya 36 jam setelah itu maka tubuh jenazah akan lemas. Kemudian terjadi pendinginan alami dari suhu normal yaitu 37°C.3,4
Kecepatan organ dalam membusuk bervariasi berdasarkan pada letak dan fungsi organ. Berikut golongan organ berdasarkan kecepatan pembusukannya; Early, Organ dalam yang cepat membusuk antara lain jaringan intestinal, medulla adrenal, pankreas, otak, lien, usus, uterus gravid, uterus post partum, hepar, dan darah. Moderate, organ dalam yang lambat membusuk antara lain paru-paru, jantung, ginjal, diafragma, lambung,
12 otot polos dan otot rangka. Late, uterus non gravid dan prostat merupakan organ yang lebih tahan terhadap pembusukan karena memiliki struktur yang berbeda dengan jaringan yang lain yaitu jaringan fibrosa.1,2,8
Pembusukan organime melalui dua proses penghancuran yaitu, autolisis dan putrefaksi. Autolisis adalah penghancuran jaringan secara mandiri tanpa aktifitas mikroorganisme sedangkan putrefaksi adalah penghancuran jaringan yang didominasi oleh mikroorganisme.4
Autolisis diawali oleh berhentinya aliran darah sehingga suplai oksigen ke sel berkurang dan menyebabkan penurunan pH. Penurunan pH ini menyebabkan enzim intrinsik yang bekerja sel sendiri dan menghancurkan nukleoprotein, kromatin, sitoplasma dan membran sel, sehingga keluar isi sel berupa protein yang mampu mendenaturasi protein di luar sel dimana enzim ini berasal. Penghancuran jaringan oleh proses ini tidak dapat terlihat kasat mata namun dapat dilihat secara mikroskopik. Kerusakan sel ini akan mempermudah proses yang satunya yaitu putrefaksi, hal ini berkaitan dengan kerusakan struktur sel dan jaringan.2,3
Dalam waktu 24 jam setelah kematian, tubuh manusia tidak dilingkupi oleh bakteri dari luar tubuh, ini berkaitan dengan masih aktifnya sel imun tubuh hingga 48 jam setelah kematian. Putrefaksi terjadi saat mikroorganisme di dalam tubuh yaitu organisme yang berada di saluran pencernaan akan menginvasi seluruh tubuh dengan melakukan hemolisis dan fermentasi jaringan tubuh. Karena reaksi redoks yang terjadi kemudian menyebabkan penipisan oksigen dalam tubuh dan menurunkan jumlah bakteri aerob obligat, sehingga terjadi pertumbuhan drastis bakteri anaerob seperti Micrococci,
Pseudomonas dan Acinetobacter. Proses ini akan tampak pertama kali pada fossa illiaca dekstra berkaitan dengan caecum yang berada superfisial di daerah tersebut.2,3,8
Pembusukan protein tubuh dilakukan oleh aktifitas enzim, namun setiap individu mengalami kecepatan yang berbeda bergantung pada kelembapan, aktifitas bakteri dan suhu lingkungan. Kelembapan yang tinggi membantu terjadinya pembusukan, proses enzimatik akan meningkat sesuai dengan suhu optimum enzim. Protein tubuh yang pertama kali mengalami pembusukan adalah protein yang menyusun sistem saraf dan epitel. Protein yang membentuk otot lebih sulit dihancurkan dibanding protein yang disebutkan sebelumnya, terlebih protein penyusun kartilago dan jaringan ikat. Bakteri
13 yang sangat berkaitan dengan penguraian protein adalah Pseudomonas, Bacillus dan
Micrococcus spp. Protein yang dipecah akan berubah menjadi banyak molekul salah
satunya adalah hidrogen sulfat, sulfida, ammonia dan gas yang memilki gugus sulfhidril (-SH), molekul molekul ini bertanggung jawab atas bau busuk yang ditimbulkan saat terjadinya pembusukan.1,2
2.7 Pengawetan Kadaver
Pengawetan mayat atau dalam bahasa Inggris Embalming adalah perlakuan terhadap jasad yang telah mati dengan bahan kimia tertentu agar terhindar dari pembusukan. Sarana pengawetan bisa secara alami seperti pendinginan, pengeringan, dan lain lain. Sarana pengawetan juga bisa secara artifisial seperti injeksi pada arteri, pencelupan, pengeringan, pengeluaran isi tubuh dan lain lain. Awalnya budaya dan metode pengawetan mayat banyak dilakukan oleh peradaban kuno seperti Mesir, Babilonia, Aztec, Maya, Cina dan lain lain.1
Metode dalam pengawetan jaringan beragam. Metode injeksi arteri dapat dilakukan dengan menginjeksikan cairan pengawet ke pembuluh darah, pembuluh darah yang biasa diinjeksikan adalah arteri karotis komunis dan arteri femoralis. Injeksi ini dibantu dengan pemompa cairan. Metode cavity embalming adalah metode dimana dilakukan penghisapan seluruh cairan internal kadaver dan digantikan dengan cairan pengawet. Metode hypodermic embalming adalah metode dengan menginjeksikan cairan pengawet di bawah kulit yang ingin diawetkan. Metode perendaman adalah metode merendam seluruh preparat dalam cairan pengawet.3,20
Secara makroskopis penilaian terhadap pengawetan kadaver sebagai berikut: pengawetan organ dan jaringan dengan minimal distorsi, mencegah pengerasan dan pengeringan berlebih, mencegah pertumbuhan bakteri atau jamur, mengurangi biohazard bagi pengguna kadaver, mencegah kerusakan lingkungan kerja karena penguapan pengawet dan mengurangi efek oksidasi oleh pengawet.2,20
Hammer (2012) menggunakan larutan fiksatif etanol-gliserin dan memberikan hasil preparat tanpa jamur dan bakteri serta aroma kadaver yang lebih lemah. Viskasari (2012) menggunakan formalin dengan kadar 5-7,5% ditambah dengan glisern dan bubuk
14 fenol menghasilkan kadaver dengan warna lebih terang serta bebas bakteri dan jamur. Ahmad (2011) menyatakan larutan formalin 4% baik dalam menjaga keutuhan struktur jaringan otot dan otak tikus secara makroskopik dan mikroskopik. Thiel (1992) membuat larutan dengan kandungan formalin konsentrasi rendah dan menghasilkan kualitas jaringan yang mirip dengan asli.1,4,7,8
15
2.8 Kerangka Teori
menghambat
Bakteri menggunakan jaringan tubuh untuk dijadikan sumber
energi Bakteri menyebar ke seluruh tubuh Pertumbuhan bakteri ↑ Inaktifitas sel imun Sel hancur Membran sel hancur Menurunkan pH intrasel Enzim intrasel bekerja pada sel
sendiri Suplai O2 ke jaringan menurun Jantung berhenti bekerja kematian makhluk hidup pembusukan autolisis Putrefaksi Efek fiksatif Inaktivasi enzim Larutan fiksatif Menggantkan air di dalam lapisan lipid bilayer Ketidakseimbangan
permaebilitas sel bakteri Mengikat
protein bakteri berikatan dengan
protein
gliserin
16
2.9 Krangka Konsep
Formalin 7,5%
Intensitas Warna hepar Hepar tikus Sprague
dawley
Tidak Dikuliti Dikuliti
Tikus yang direndam dalam pengawet Efek fiksatif Gliserin 80% Alkohol 70% Keterangan : = variabel terikat = variabel bebas
17
2.10 Definisi Operasional
No Variabel Definisi
Operasional Alat Ukur
Cara Pengukuran Skala Pengukuran 1. Intensitas Warna Hepar
Warna hepar tikus
Sprague dawley yang sudah diawetkan. Indra penglihatan dan dokumentasi menggunakan kamera Canon EOS 3000D Membandingkan warna hepar tikus Sprague dawley menggunakan skala : 1 : terang #D0C8B3RGB code:R: 208 G: 200 B: 179 HSV:43.45° 13.94% 81.57% 2. gelap #86816E RGB : R: 134 G: 129 B: 110 110HSV:47.5° 17.91% 52.55% Ordinal
18
BAB 3
METODE PENELITIAN
3.1 Desain Penelitian
Desain yang digunakan pada penelitian ini adalah desain eksperimental.
3.2 Waktu dan Tempat Penelitian 3.2.1 Tempat Penelitian
Pengambilan sampel dilakukan di Animal House Fakultas Kedokteran Universitas Islam Negeri Syarif Hidayatullah Jakarta. Pembuatan larutan, perendaman sampel dan pengambilan organ hepar dilakukan di Laboratorium Anatomi Fakultas Kedokteran Universitas Islam Negeri Syarif Hidayatullah Jakarta.
3.2.2 Waktu Penelitian
Penelitian ini dilaksanakan bulan Februari 2018 dan berakhir pada Desember 2018.
3.3 Populasi dan Sampel Penelitian
Penelitian ini menggunakan sampel tikus Sprague dawley yang telah mendapatkan perlakuan perendaman dengan larutan fiksatif selama 10 bulan. Tikus yang digunakan adalah tikus Sprague dawley yang baru saja mati <2 jam dengan berat berkisar antara 150-300 gram. Hewan uji dikelompokkan atas dua kelompok, yaitu kelompok dikuliti dan tidak dikuliti.
Untuk menentukan jumlah sampel yang dipakai, digunakan rumus MEAD. 𝐸 = 𝑁 − 𝐵 − 𝑇
E = derajat kebebasan komponen kesalahan ( 10 – 20 ) N = Jumlah sampel dalam penelitian
B = Blocking component meggambarkan pengaruh lingkungan yang diperbolehkan dalam penelitian
T = Jumlah Kelompok Perlakuan 𝐸 = 𝑁 − 𝐵 − 𝑇
19 ≥ 10 = 𝑁 − 1 − 1
≥ 10 = 𝑁 − 2 ≥ 12 = 𝑁
Dengan penghitungan tersebut dan keterbatasan penyediaan sampel, maka kami menggunakan jumlah sampel minimal yaitu 12 ekor tikus yang sudah mati.
3.3.1 Kriterian Inklusi
1. Tikus jantan strain Sprague dawley 2. Tikus sudah mati <2 jam
3.3.2 Kriteria Eksklusi
1. Tikus sudah berbau busuk
2. Tikus sudah menunjukkan perubahan warna akibat pembusukan
3.3.3 Kelompok perlakuan
• Kelompok Dikuliti
Pada kelompok ini tikus Sprague dawley yang baru saja mati dikuliti seluruh tubuhnya sehingga terangkat seluruh kulitnya kecuali bagian kepala kemudian langsung dimasukkan ke dalam campuran formalin 5%, alkohol 70% dan gliserin 80%. • Kelompok Tidak Dikuliti
Pada kelompok ini tikus Sprague dawley yang baru saja mati langsung dimasukkan ke dalam campuran formalin 7,5%, alkohol 70% dan gliserin 80%.
3.4 Variabel Penelitian 3.4.1 Variabel Bebas
Variabel bebas pada penelitian ini adalah perlakuan dikuliti dan tidak dikuliti.
3.4.2 Variabel Terikat
Variabel terikat pada penelitian ini adalah intensitas warna pada sediaan anatomi hepar tikus putih galur Sprague Dawley.
20
3.5 Alat dan Bahan Penelitian 3.5.1 Alat Penelitian
Alat yang digunakan pada penelitian ini sebagai berikut: • Toples eter
• minor set • kassa
• masker bedah
• sarung tangan pemeriksaan • silinder ukur 200 ml • silinder ukur 1000 ml • drum plastik 200 L • pengaduk
• toples kaca preparat • lemari penyimpanan • wadah spesimen
3.5.2 Bahan Penelitian
Bahan yang dipakai pada penelitian ini sebagai berikut: • eter • formalin 37%, • formalin 5%, • gliserin 80%, • alkohol 70% 3.6 Objek Penelitian
Penggunaan tikus Sprague dawley biasa digunakan pada penelitian untuk melakukan cek terhadap toksisitas. Pemakaian hewan coba diatur oleh kode etik, harus menggunakan hewan dengan kerugian paling kecil. Pada penelitian ini digunakan tikus
Sprague dawley karena organnya lebih besar dibandingkan dengan mencit dan mudah
21
3.7 Cara Kerja Penelitian
Penelitian ini dilakukan dengan langka langkah ini: pengulitan tikus, pembuatan larutan pengawet, pengawetan tikus dan pengambilan organ.
3.7.1 Pengulitan Tikus
Tikus yang dipakai adalah tikus jantan galur Sprague Dawley. Tikus dilakukan adaptasi selama dua minggu di dalam Animal House Fakultas Kedokteran UIN Jakarta. Tikus ini melalui proses sacrifice yaitu dengan cara cardiac puncture. Tikus dimasukkan dalam toples eter dan setelah terbius diinjeksikan jarum ke jantung tikus untuk mengambil darah. Kemudian tikus yang sudah mati dikuliti sebanyak 6 ekor dan segera dimasukkan ke dalam larutan pengawet.
3.7.2 Pembuatan larutan pengawet
Larutan dibuat dengan cara mengencerkan formalin 37% menjadi formalin 5%. Pengenceran kami lakukan dengan cara mencampurkan formalin 37% dengan air dalam drum plastik 200 L.
Pengenceran ini dilakukan dengan dasar rumus pengenceran yaitu: 𝑚1𝑣1 = 𝑚2𝑣2
m1 : Konsentrasi Formalin 37%
m2 : Konsentrasi Formalin yang diinginkan v1 : Volume Formalin 37%
v2 : Target penambahan volume Proses pembuatan larutan :
1. Formalin 37% diencerkan menjadi 10% (Formalin 37% 10 liter + 27 liter air kran). 2. Formalin 10% diencerkan menjadi formalin 5% (formalin 10% 7 liter + 7 liter air
kran).
3. Masukkan formalin 5% ke masing-masing toples kaca sebanyak 1125 ml.
4. Masukkan alkohol 70% ke dalam toples sebanyak 37,5 ml kemudian aduk menggunakan metode konvensional.
5. Masukkan gliserin 80% ke dalam toples sebanyak 37,5 ml kemudian aduk menggunakan metode konvensional.
22 6. Setelah dimasukkan formalin 5% sebanyak 1125 ml, alkohol 70% 37,5 ml, dan gliserin 80% 37,5 ml maka dalam satu toples terkumpul cairan fiksatif sebanyak 1200 ml
3.7.3 Pengawetan tikus
Pengawetan dilakukan dengan metode perendaman selama 10 bulan yaitu pada bulan Februari 2018 dan berakhir pada Desember 2018 di dalam toples kaca preparat.
3.7.4 Pengambilan organ
Organ diambil dengan melakukan insisi pada abdomen. Dilakukan pengambilan dengan pinset dan pemotongan ligamen hepar dengan scalpel. Setelah seluruhnya terambil maka dilakukan penilaian intensitas warna secara langsung dan dilakukan pengambilan gambar.
3.8 Pengolahan Data
Setelah seluruh data terkumpul, maka dilakukan penghitungan jumlah tikus
Sprague dawley yang masuk dalam kelompok terang dan kelompok gelap dengan
23 3.9 Alur Penelitian Tidak dikuliti Pengolahan data Pengambilan organ hepar Pembuatan larutan fiksatif Ditunggu selama 10 bulan dalam toples
kaca
direndam dalam toples kaca Larutan pengawetan Dikuliti 12 tikus Sprague dawley mati Formalin 5%, Alkohol 70% dan Gliserin 80% Pembuatan laporan penelitian Dilihat intensitas warna Pengambilan sampel
24
BAB IV
HASIL DAN PEMBAHASAN
Berikut hasil intensitas warna pada pengawetan hepar tikus Sprague Dawley yang dikuliti dan tidak dikuliti dengan perendaman dalam larutan fiksatif (formalin 5%, alkohol 70% dan gliserin 80%).
Tabel 4.1 : Hasil Pengamatan Intensitas Warna Hepar Tikus Sprague dawley
Kelompok terang gelap
dikuliti 2 4
tidak dikuliti 0 6
Terlihat pada tabel 4.1 keseluruhan data didominasi oleh intensitas gelap. Pada kelompok tidak dikuliti seluruh hepar tikus berintensitas warna gelap. Pada kelompok dikuliti terdapat 2 tikus berintensitas terang dan 4 tikus berintensitas gelap.
Pada penelitian Viskasari (2012) didapatkan hasil pengawetan menggunakan formalin konsentrasi 5-7,5% pada kadaver memberikan warna yang lebih terang dibandingkan dengan penggunaan formalin konsentrasi tinggi.7 Namun pada penelitian ini ada dua data yang mendapatkan intensitas warna terang. Hal ini berkaitan dengan kemampuan penetrasi larutan ke jaringan hepar membaik karena tidak perlu menembus kulit via interseluler, transeluler ataupun transapendageal. Hal ini ditunjang dengan ukuran molekul formalin yaitu 11 nm sehingga dengan mudah masuk melalui celah antar sel.
Pada penelitian Ahmad (2011) menyebutkan penggunaan formalin 4% dapat mencegah jaringan otot dan otak tikus mempertahankan warna terang pada jaringan. Selain itu pada penelitian tersebut, juga didapatkan ketidakadaan jamur, konsistensi yang baik dan jaringan yang utuh.4,15 Berbeda dengan penelitian ini, pada penelitian ini hampir seluruh data menunjukan warna yang gelap. Hal ini mungkin terjadi karena dilakukan pembuatan larutan dilakukan dengan kurang baik yaitu pencampuran hanya dilakukan dengan pengaduk kayu dan stainless, sehingga homogenitas cairan kurang baik. Hal ini mungkin
25 membuat hanya formalin konsentrasi 37% tidak seutuhnya berubah menjadi formalin konsentrasi 5% sehingga reaksi oksidasi yang dapat membuat intensitas warna hepar menjadi gelap.
4.1 Kekurangan Penelitian
1.Air untuk mengencerkan formalin menggunakan air keran biasa.
2.Campuran larutan dihomogenisasi dengan metode sederhana diaduk menggunakan kayu. 3.Hewan coba yang sebelumnya dipakai pada penelitian lain yang dapat mengubah warna hepar tikus.
4.Tidak ada kelompok kontrol berupa tikus dengan perendaman formalin 37% yang bersama direndam selama 10 bulan.
5. Tidak ada kelompok berupa masing masing cairan dalam larutan fiksatif berupa larutan formalin 5% saja, alkohol 70% saja dan gliserin 80% saja.
26
BAB V
KESIMPULAN DAN SARAN 5.1 SIMPULAN
Dari hasil penelitan intensitas warna hepar tikus Sprague dawley yang dilakukan pengawetan menggunakan larutan fiksatif (formalin 5%, alkohol 70% dan gliserin 80%) dengan perlakuan dikuliti dan tidak dikuliti diperoleh hasil intensitas warna hepar kedua perlakuan secara umum berada pada intensitas warna gelap namun terdapat 2 tikus dari 6 tikus dengan perlakuan dikuliti mendapatkan hasil intensitas warna terang.
5.2 SARAN
1. Perlu digunakan aquades untuk mengencerkan formalin.
2. Homogenasi cairan seharusnya dilakukan dengan alat pengaduk larutan fiksatif 3. Perlu digunakan tikus yang tidak mengalami perlakuan pada penelitian sebelumnya. 4. Perlu diadakan kontrol terhadap kelompok sampel yang merupakan tikus dengan
perlakuan formalin 37%, formalin 5%, alkohol 70% dan gliserin 80% yang direndam selama 10 bulan.
27
DAFTAR PUSTAKA
1. Balta, Joy Y., Cronin, Michael., Cryan, John F., O’mahony, Siobhain M. Human
Preservation Technique in Anatomy a 21th Century Medical Education Perspective.
Ireland : Wiley Periodicals; 2015.
2. Brenner, Erich. Human Body Preservation – Old and New Techniques. Austria: Division for Clinial and Functional Anatomy, Department of Anatomy, Histology and Embriology, Innsbruck Medical University; 2014. p.316-344.
3. Batra, Arvinder P. S., Khurana, Baljit S., Mahajan, A. Embalming anad Other Method of Dead Body Preservation. India : International Journal of Medical Toxicology & Legal Medicine Vol 12 No.3. 2010
4. Habibi, Ahmad Azwar. Penggunaan Beberapa Campuran Larutan Formalin pada Pengawetan Jaringan Otot dan Otak Tikus (Tesis). Jakarta : Fakultas Kedokteran Universitas Indonesia; 2011.
5. Environmental Health and Savety. Formaldehyde Safety Guidlines. Canada : Concordia University; 2016, p.1-7
6. Badan Pengawas Obat dan Makanan Republik Indonesia. Formalin (Larutan Formaldehid). Jakarta : Direktorat Pengawas Produk dan Bahan Berbahaya; 2008, h.1-8
7. Kalanjati, Viskasari P., Prasetiowati, Lucky., Alimsardjono, Haryanto. The Use of Lower Formalin-Containing embalming Solution for Anatomy Cadaveer Preparation. Surabaya : Departemen Anatomi dan Histologi Fakultas Kedokteran Universitas Airlangga; 2012. h.203-207
8. Hammer, Neils., Loffler, Sabine., Feja, Christine., Sandrock, Mara., Schmidt, Wolfgang. Ethanol-Glycerin Fixation With Thymol Conservation : Potential Alternative to Formaldehyde and Phenol Embalming. Germany : Faculty of Medicine, Institute of Anatomy, University of Leipzig ; 2012
9. Panzacchi, Simona., Gnudi, Federica., Mandrioli, Daniele., Montella, Rita. Effects of short and long-term alcohol-based fixation on Sprague-Dawley rat tissue morphology, protein and nucleic acid preservation. Italy : Elsevier. 2019
28 10. Musyarifah, Zulda., Agus, Salmiah. Proses Fiksasi pada Pemeriksaan Histopatologis.
Padang : Jurnal Universitas Andalas; 2018. Diunduh dari
http://jurnal.fk.unand.ac.id/index.php/jka pada tanggal 14 Januari 2020.
11. Menaldi, Sri Linuwih SW., Bramono, Kusmarinah., Indriatmi, Wresti. Ilmu Penyakit Kulit dan Kelamin Edisi 7. Jakarta : Badan Penerbit FK UI; 2018:3-6.
12. Janawa, RC., Wilson, Andrew S., Percival, Steven L. Decomposition of Human Remains.
University of Bradford. 2009. Diunduh dari : 02-12-2019.
https://www.researchgate.net/publication/225914421.
13. Netter, Frank H. Atlas of Human Anatomy 25th Edition. Jakarta: EGC, 2014
14. Richard L Drake; Wayne Vogl; Adam W M Mitchell. 2014. Gray’s Anatomy: Anatomy of the Human Body. Elsevier; 2014
15. Treuting, Piper M., Suzanne M. Dintzis, Charles W. Frevert, Denny Liggitt. 2012. Comparative Anatomy and Histology: A Mouse and Human Atlas.
16. Mescher, Anthony L. Junqueira Basic Histology Text and Atlas 14th Edition. New York : Mc-Graw Hill Education; 2016, p.281-286
17. Dabrowska, AK., Spano, F., Derler, S., Adlhart, C., Spencer, ND., Rossi, RM. The Relationship Between Skin Function, Barrier Properties, Body-Dependent Factors.
Switzerland : Wiley. 2017. Diunduh dari : 17-12-2019
https://www.ncbi.nlm.nih.gov/pubmed/29057509
18. Leroy, Wade G. Alcohol Chemical Compound. Washington : Britannica Encyclopedia. 2019. Diunduh dari : https://www.britannica.com/science/alcohol. 02-12-2019
19. Kara, Rogers. Glycerol Chemical Compound. London : Britannica Encyclopedia. 2015. Diunduh dari : https://www.britannica.com/science/glycerol#ref26585 02-12-2019 20. Bajracharya S, Magar A. Embalming: An Art of Preserving Human Body. Kathmandu
29
LAMPIRAN
Lampiran 1
Foto Makroskopik
Dikuliti
Gambar 6.1 Sediaan hepar tikus 1 dikuliti Gambar 6.2 Sediaan hepar tikus 2 dikuliti Gambar 6.3 Sediaan hepar tikus 3 dikuliti
Gambar 6.4 Sediaan hepar tikus 4 dikuliti Gambar 6.5 Sediaan hepar tikus dikuliti
30 Tidak Dikuliti
Gambar 6.7 Sediaan hepar tikus 1 tidak
dikuliti
Gambar 6.8 Sediaan hepar tikus 2 tidak dikuliti Gambar 6.9 Sediaan hepar tikus 3 tidak dikuliti
31
Lampiran 2
32 Lampiran 3 Identitas Penulis Identitas Penulis Nama NIM
: Raden Muhamad Hidayat : 11161030000072
Tempat Tanggal Lahir Agama
Alamat Sekarang
: Bogor, 20 Juli 1998 : Islam
: Jl. Jati Nomer 24, Keceamatan Ciputat Timur, Tangerang Selatan
Alamat Asal : Perumahan Ciomas Permai Blok E/9 Nomer 3
Email No.Hp
: rraddenn@gmail.com : 085288878098
Riwayat Pendidikan
2004-2010 : SDN Layungsari 1 Bogor Selatan
2010-2013 : SMP Insan Kamil Bogor
2013-2016 : SMA Insan Kamil Bogor