III. METODE PENELITIAN
A. Materi Penelitian
Alat-alat yang digunakan dalam penelitian ini adalah Plankton-net, buku(Davis, 1955), (Sachlan ,1982) dan (Thomson, 1966) untuk mengidentifikasi, alat pengukur TSS, TDS, BOD5, nitrat, silika dan ortofosfat.
Bahan-bahan yang digunakan dalam penelitian ini adalahsampel mikroalga yang diambil pada Sungai Pekacangan yang terkena limbah industri tapioka dan bahan kimia untuk analisis O2, CO2, BOD5, TSS, TDS, nitrat, ortofosfat, silika, COD dan skrining kandungan minyak. Spesifikasi alat dan bahan dapat dilihat pada lampiran 1.
B. Teknik Penelitian
Sampel penelitian diambil di Sungai Pekacangan terletak di desa Timbang Kecamatan Kejobong Kabupaten Purbalingga.Penelitian ini dilakukan dengan menggunakan metode survei dengan teknik pengambilan sampel purposive sampling. Sampel penelitian diambil dari 4 stasiun berdasarkan rona lingkungan yang ada, yaitu lingkungan sebelum pembuangan limbah cair tapioka, tepat pembuangan limbah cair tapioka dan 1 km setelah pembuangan limbah cair tapioka dan 2 km setelah pembuangan limbah cair tapioka.Analisis kualitas perairan dilakukan di Laboratorium Lingkungan Fakultas Biologi Unsoed dan Identifikasi sampel mikroalga dan skrining dilakukan di Laboratorium Akuatik dan Laboratorium Pengajaran Fakultas Biologi Unsoed.Penelitian ini dilakukan pada bulan Juni-Oktober 2014.Pengambilan sampel diulang sebanyak 3 kali dengan interval waktu 2 minggu.
C. Parameter Penelitian
Parameter penelitian meliputi parameter utama dan parameter pendukung.Parameter utama yaitu jumlah jenis dan jumlah individu mikroalga.Parameter pendukung yaitu kualitas fisika dan kimia (kedalaman, suhu, penetrasi cahaya, pH, O2terlarut, COD, BOD5, CO2 bebas, kecepatan arus, TSS, TDS, nitrat, orthophospat dan silika).
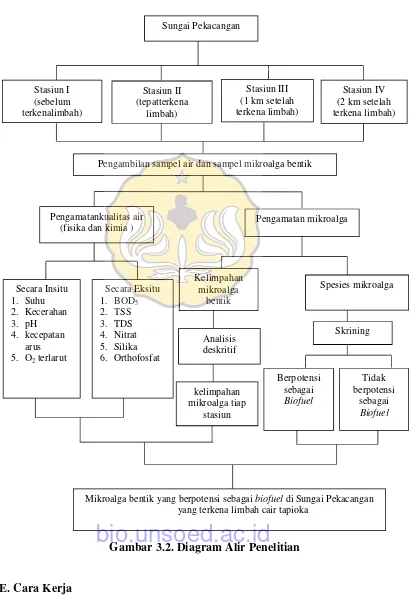
D. Diagram Alir Penelitian
Gambar 3.2. Diagram Alir Penelitian
E. Cara Kerja
1. Pengambilan sampel Mikroalga di Sungai Pekacangan
Pengambilan sampel mikroalga dilakukan menggunakanmetode transek kuadran.Substrat dasar perairan dibuatkuadranpada masing-masing stasiun
Sungai Pekacangan
Pengambilan sampel air dan sampel mikroalga bentik
Spesies mikroalga
Mikroalga bentik yang berpotensi sebagaibiofueldi Sungai Pekacangan yang terkena limbah cair tapioka
Skrining
kelimpahan mikroalga tiap
stasiun
menggunakan pipa PVC yang berdiameter 1 cm dan tinggi 4 cm. pengambilan dilakukan secara acak. Pada waktu pengambilan subtrat diusahakan agar substrat tidak kontak dengan air, yaitu dengan cara menutup ujung pipa bagian atas dengan ibu jari dan bagian bawah dengan jari manis. kemudian pipa dimasukan ke dasar perairan sampai jari manis menyentuh permukaan dasar, ujung bawah dibuka dengan cara menarik jari manis. selanjutnya pipa ditusukan pada substrat sampai kedalaman 4 cm (sampai substrat mencapai ujung pipa bagian atas). Setelah subtrat mencapai ujung bagian bawah ditutup kembali dengan jari manis. Kemudian pipa diangkat dan substrat yang terbawa di dalam pipa dimasukan ke dalam kantong plastik.Pengambilan di setiap stasiun masing masing 40 kali tusukan pada tiga tempat, yaitu pada kedua sisi pinggir masing-masing 10 tusukan dan di tengah 20 tusukan.Substrat yang didapat dimasukkan ke ember plastik dan diencerkan dengan aquades kemudian disaring dengan saringan bertingkat.Selanjutnya disaring menggunakan plankton-net dan hasilnya dimasukkan ke dalam botol film.Sedangkan substrat dari batu yang ada diperairan diambil dan dikuas secara hati-hati sambil sesekali disemprot menggunakan akuades dan ditampung di ember penampung. Air yang tertampung disaring menggunakan plankton net no.25.Hasil penyaringan dimasukkan ke dalam botol film.
2. Pengukuran kualitas air
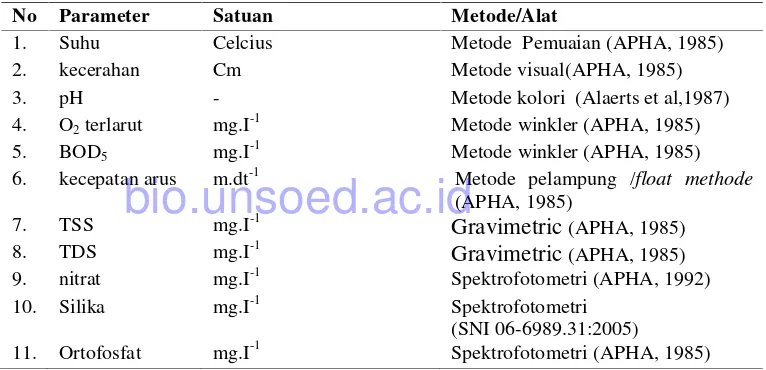
Pengukuran kualitas air dan metode yang digunakan (Tabel 3.1) Tabel 3.1. Parameter kualitas air(fisika dan kimia )
No Parameter Satuan Metode/Alat
1. Suhu Celcius Metode Pemuaian (APHA, 1985) 2. kecerahan Cm Metode visual(APHA, 1985) 3. pH - Metode kolori (Alaerts et al,1987) 4. O2terlarut mg.I
-1
Metode winkler (APHA, 1985) 5. BOD5 mg.I-1 Metode winkler (APHA, 1985)
6. kecepatan arus m.dt-1 Metode pelampung /float methode (APHA, 1985)
7. TSS mg.I-1 Gravimetric(APHA, 1985) 8. TDS mg.I-1 Gravimetric(APHA, 1985) 9. nitrat mg.I-1 Spektrofotometri (APHA, 1992) 10. Silika mg.I-1 Spektrofotometri
(SNI 06-6989.31:2005)
2.1. Suhu
Pengukuran suhu dilakukan menggunakan termometer elektrik, dengan cara memasukkan elektroda termometer ke dalam air ± 30 cm dari atas permukaan air.
2.2. Kecepatan arus
Kecepatan arus diukur menggunakan metode pelampung/float methode (APHA, 1985) yaitu botol plastik 0,5 l diisi air sampai 80% kemudian digulung dengan tali sepanjang 1 m dan dihayutkan ke sungai. Waktu yang diperlukan sampai gulungantali habis kemudian dicatat.
Kecepatan arus (m. dt ) = ……….(3-1)
2.3. Penetrasi cahaya
Penetrasi cahaya diukur dengan metode visual (APHA, 1985).Keping secchi dimasukkan ke dalam air dengan menggunakan tali secara perlahan sampai batas mulai tidak terlihat oleh mata dan diukur jarak kedalamannya (x).kemudian diturunkan lagi dan diangkat secara perlahan sampai batas yang terlihat oleh matadan diukur jarak kedalamannya (y).
Pengukuran kecerahan dihitung dengan rumus = ………(3-2) 2.4. pH (puissance d’Hydrogen)
pH perairan diukur menggunakan metode kolori meter (Alaerts, 1987) dengan menggunakan kertas pH indikator. Kertas pH indikator dicelupkan ke dalam air sampai beberapa menit kemudian warnanya dicocokkan dengan warna standar.
2.5. TSS (Total Suspended Solid)
Pengukuran TSS dilakukan menggunakan metode gravimetric (APHA, 1985). Kertas saring whatman no. 41 dibilas dengan akuades, kemudian dikeringkan dalam oven dengan suhu 1050C selama 1 jam, kemudian didinginkan dalam desikator selama 10 menit dan ditimbang (B gr). Sampel air sungai diambil 100 ml dikocok sampai merata dan disaring dengan keras saring yang sudah ditimbang, kemudian kertas saring dengan zat tersuspensi yang tertampung
dikeringkan dalam oven 1050C selama 10 menit ditimbang (A gr).Selanjutnya dihitung dengan menggunakan rumus sebagai berikut. Pengukuran kecerahan dihitung dengan rumus
TSS = X 100mg.l-1………(3-3) Keterangan
A : berat kertas saring dan zat tersuspensi B : berat kertas saring
C : berat air sampel yang dianalisis
2.6. Oksigen Terlarut
Pengukuran oksigen terlarut dilakukan dengan menggunakan metode winkler (APHA, 1985).Botol winkler volume 25 ml secara perlahan-lahan ditenggelamkan ke dalam perairan sampai terisi air penuh dan bukaan botol menghadap searah dengan arus, untuk menghindari adanya gelembung udara di dalam botol tersebut. Air sampel diberi 1 ml larutan MnSO4 pekat dan dikocok hingga endapan larut. Sampel diambil sebanyak 100 ml kemudian dimasukkan ke dalam labu Erlenmeyer lalu ditambahkan larutan Na2S2O3 0,025 N hingga larutan berubah warna kuning muda.Kemudian ditetesi 10 tetes indikator amilum hingga warnanya berubah menjadi biru.Titrasi dilanjutkan dengan larutan Na2S2O30,025 N hingga warna biru pekat hilang.Nilai oksigen terlarut dihitung dengan rumusberikut.
Oksigen terlarut = 8mg.l-1………(3-4) Keterangan
1000/100 : satu liter dalam 100 ml sampel air p : jumlah Na2S2O30,025 N yang digunakan titrasi q : normalitas larutan Na2S2O3
8 : bobot setara O2
2.7. PengukuranBiological Oxygen Demand(BOD)
BOD5 diukur dengan metode SNI 06-2503-1991 yaitu sampel air diencerkan dengan tingkat pengenceran 0,5 dimana 250 ml sampel dicampurkan dengan 250 ml pengencer. Larutan pengencer terdiri dari larutan FeCl3, CaCl2, buffer ortofosfat, MgSO4 dan bubuk inhibitor nitrifikasi dengan masing-masing 1 ml tiap liter air pengencer. Sampel yang telah diencerkan dimasukkan kedalam 2 botol Winkler
bervolume 250 ml. Botol Winkler pertama diperiksa kandungan oksigennya yang dinyatakan sebagai DO0, sedangkan botol Winkler kedua diperiksa setelah 5 hari dan dinyatakan sebagai DO5. Sampel air ditambahkan MnSO4 dan KOH-KI masing-masing 1 ml, kemudian dikocok sampai homogen dan didiamkan sampai timbul endapan, lalu ditambahkan 1 ml H2SO4 pekat hingga homogen atau sampai semua endapan menjadi larut dan berwarna coklat kekuningan.Air larutan diambil sebanyak 100 ml dengan gelas ukur, kemudian dimasukkan ke dalam erlenmeyer.Indikator amilum ditambahkan sebanyak 3-5 tetes hingga berwarna biru tua, lalu dititrasi dengan Na2S2O3 0,025 N sampai jernih. Mengukur blanko yang dibuat menggunakan akuades dengan perlakukan dengan cara yang sama seperti cara kerja untuk air sampel. Kandungan BOD dihitung dengan persamaan :
BOD=( ) ( ) ( ) ...………(3-5)
Keterangan :
X0 = kandungan O2terlarut sampel hari ke-0 X5 = kandungan O2terlarut sampel hari ke-5 B0 = kandungan O2terlarut blanko hari ke-0 B2 = kandungan O2terlarut blanko hari ke-5 P = faktor pengenceran
2.8. Pengukuran Ortofosfat
Pengukuran ortofosfat dengan cara spektrofotometri (Metode SNI 06-6989.31:2005)yaitu air sampel 50 ml disaring menggunakan kertas Whatman no.1, kemudian dipindahkan pada erlenmeyer 50ml dan ditambah 1 ml H2SO4 dan 0,4 gr K2S2O8 tetesi dengan indikator PP 2 tetes dan NaOH hingga larutan berwarna merah muda, lalu ditambahkan 8 ml reagen campuran dan ditunggu selama 5 menit. Larutan tersebut kemudian diukur absorbansi dan konsentrasinya dengan spektrofotometer pada panjang gelombang 880 nm.Hasil absorbansi dan konsentrasi yang diperoleh dicatat.
2.9. Pengukuran Nitrat
Metode digunakan dengan spektrofotometri (Metode APHA 1992:4005-NO3.4-87) yaitu dengan cara sampel air 50 ml disaring dengan kertas Whatman no.41 menggunakan vaccum pump. Sampel
1 ml HCl. Larutan tersebut kemudian diukur absorbansi dan konsentrasinya dengan spektrofotometer pada panjang gelombang 220 nm. Hasil absorbansi dan konsentrasi diperoleh dicatat.
3. Identifikasi, Perhitungan Kelimpahan Mikroalga dan Perhitungan Luas Permukaan Substrat Tempat.
Identifikasi mikroalga bentik menggunakan mikroskop cahaya
Olympus, dengan perbesaran 10X40, perhitungan mikroalga dengan menggunakan perbesaran 10X10 dandiulang sebanyak 3 kali. Mikroalga yang telah diperoleh diidentifikasi mengacu pada buku (Davis, 1955), (Sachlan ,1982) dan (Thomson, 1966).
Mikroalga yang telah diamati dihitung kelimpahannya dengan mengunakan rumus modifikasi dari “Inverted Microscope Methode Counts“ (APHA, 1992) :
Organisme.mm-2= ………..(3-6)
Keterangan :
N : Jumlah organisme yang diamati At : Luas gelas penutup (mm2) 324 mm2
Vt : Volume air yang terkonsentrasi (ml) 110 ml Ac : luas daerah hitung (mm2) 1,11279 mm2 Vs : Volume air yang diamati (ml) 0,04 ml As : luas permukaan substrat (mm2)
4. Isolasi Mikroalga
Isolasi mikroalga dilakukan dengan menggunakan pipet Pasteur yang diameter ujungnya dibuat lebih kecil dari pipet aslinya, dengan cara pipet asli dipanaskan kemudian ditarik hingga ujungnya lebih kecil. Dengan bantuan mikroskop, ujung pipet diarahkan ke salah satu mikroalga dalam media cair di cawan petri.Setelah mikrolaga dan ujung pipet terlihat di bawah mikroskop, mikroalga tersebut dihisap secukupnya sehingga masuk ke ujung pipet.Mikroalga yang didapat kemudian dipindahkan ke tabung reaksi yang berisi media Zahrouk.Selanjutnya dilakukan skrining kandungan minyak.
5. Skrining Kandungan Minyak Mikroalga
Kandungan lipid pada mikroalga dapat diketahui melalui pewarnaan denganNileRed(Cookseyetal., 1987).Larutan stok Nile Reddibuat dengan melarutkan 1 mg serbuk Nile Red ke dalam 1 ml aceton. Mikroalga dibuat preparat segar dan diwarnai, caranya diambil 10 µl larutan Nile Red di teteskan pada 1 ml sampel Mikroalga dan diulang sebanyak 3 kali. Setelah 20-30 menit Mikroalga yang terwarnai diamati di bawah Mikroskop
flourescence dengan filter blue violet dengan panjang gelombang 440-480 nm. Mikroalga yang mempunyai kandungan lipid akan menampakkan pembendaharan berwarna kuning/ merah mengkilat (Cooksey et al., 1987).
F. Metode Analisis
1. Data hasil perhitungan kelimpahan mikroalga bentik dianalisis secara deskritif dan kelimpahan relatif di hitung dengan rumus
= 100%………(3-7)
Keterangan :
KR : Kelimpahan Relatif Ni : Jumlah individu ke-i N : Jumlah seluruh individu
2. Mikroalga yang diperoleh pada stasiun yang tepat terkena limbah dianalisis dengan melakukan skrining untuk mengetahui kandungan minyak. Apabila pada hasil skrining mikroalga menunjukkan pembendaran warna kuning atau merah dideskripsikan mengandung biofuel diberi tanda (+). Mikroalga yang tidak menunjukkan pembendaran berarti tidak berpotensi sebagaibiofueldiberi tanda (-).