BAHAN AJAR
MATERIAL TEKNIK
(ME-2301)
Oleh :
Dr.Eng. Markus Karamoy Umboh, ST, MT NIP. 19750518 199903 1 001
Ir. Fencje A. Rauf, MT NIP. 19580515 198703 1 001
JURUSAN TEKNIK MESIN FAKULTAS TEKNIK
UNIVERSITAS SAM RATULANGI MANADO
2017
DAFTAR ISI
Hal aman
LEMBAR PENGESAHAN i
KONTRAK PERKULIAHAN ii
ANALISIS ISTRUKSIONAL iii
KATA PENGANTAR v
DAFTAR ISI v
Bab I. Ikhtisar Material Teknik
1.1. Sifat-sifat Material 1
1.2. Material Teknik dan Pengelompokannya 1 Bab II Pengujian Material
2.1. Kekuatan Logam 3
2.1.1. Uji Tarik 3
2.1.2. Uji Keras 14
2.1.3. Uji Impak 18
2.1.4. Uji Kelelahan (Fatigue Test) 20
2.1.5. Uji Creep (Perayapan) 21
2.2. Pengujian Tidak Merusak 24
2.2.1. Uji Visual 24
2.2.2. Uji Ultrasonik 24
2.2.3. Uji Dye Penetran 25
2.2.4. Uji Radiografi 25
Bab III Atom Dan Ikatannya
3.1. Teori Atom 27
3.1.1. Struktur Atom 27
3.1.2. Konfigurasi Elektron 29
3.2. Susunan Periodik Unsur 31
3.2.1. Ikatan-Ikatan antar Atom 33 Bab IV Struktur Logam
4.1. Pembentukan Kristal 35
4.1.1. Sel Satuan 35
4.1.2. Kristalografi 42
4.1.3. Difraksi Sinar-X 48
4.2. Ketidaksempurnaan Kristal 49
4.2.1. Cacat Titik dan Surface Imperfection 50
4.2.2. Dislokasi 51
4.2.3. Slip dan Twin 52
Bab V DIAGRAM FASA
5.1. Latar Belakang Pemaduan 58
5.2. Diagram Fasa Sistem Satu Komponen 58 5.3. Diagram Fasa Sistem Dua Komponen 59 5.4. Diagram Fasa Sistem Tiga Komponen 62 Bab VI BAJA KARBON
6.1. Struktur Besi-Baja 65
6.2. Diagram Fasa Fe-Fe3C 66
6.3. Klasifikasi Baja Karbon 72
6.4. Transformasi Isotermal 73
6.5. Transformasi Pendinginan Kontinu 79 Bab VII Ikhtisar Pembuatan Baja
7.1. Pengerolan Panas 81
7.2. Ekstrusi Logam Dan Paduan 81
7.3. Proses Tempa 81
7.4. Proses Pembentukan Lain 82
DAFTAR PUSTAKA
BAB III
ATOM DAN IKATANNYA
3.1. Teori Atom
Rutherford berpendapat bahwa atom adalah nukles bermuatan positif, yang membawa bagian terbesar massa atom tersebut, dengan elektron-elektron yang mengelompok di sekelilingnya. Dia mengemukakan bahwa elektron-elektron tersebut berevolusi mengelilingi nukleus itu dengan orbit-orbit yang berbentuk lingkaran sehingga gaya sentrifugal dari elektron-elektron yang berevolusi ini tepat sama dengan gaya tarik menarik elektrostatik antara nukleus bermuatan positif ini dengan elektron-elektron bermuatan negatif. Untuk menghindari kesulitan bahwa elektron yang berputar harus, berdasarkan hukum elektrodinamika klasik, terus menerus memancarkan energi dalam bentuk radiasi elektromagnetik, Bohr, pada tahun 1913, terpaksa menarik kesimpulan bahwa, dari semua orbit yang mungkin ada, hanya beberapa orbit tertentu saja yang diperbolehkan. Orbit-orbit yang diskrit ini diasumsikan memiliki sifat yang begitu luar biasa sehingga ketika suatu elektron berada pada salah satu dari antara orbit-orbit ini, tidak ada radiasi yang bisa terjadi.
Kumpulan yang terdiri dari orbit-orbit yang stabil ini ditandai dengan kriteria bahwa momentum angular dari elektron-elektron pada orbit-orbit ini dinyatakan oleh
nh/2π (3.1)
Dimana : h = konstanta Planck
n = bilangan bulat (n = 1, 2, 3, dan seterusnya)
3.1.1. Struktur Atom
Pada tahun 1911, Rutherford mengemukakan teori atomnya sebagai berikut :
- Atom tersusun dari
a. Inti atom yang bermuatan positif
b. Elektron-elektron bermuatan negatif yang beredar mengelilingi inti.
- Inti atom bermuatan positif karena mengandung proton. Oleh karena atom bersifat netral, maka jumlah proton dalam inti sama dengan jumlah elektron yang mengelilingi inti.
- Jari-jari atom sekitar 10-8 cm, sedangkan jari-jari inti atom jauh lebih kecil lagi : 10-13 cm.
Atom-atom dari unsur yang berbeda akan memiliki berat, ukuran, dan sifat- sifat yang juga berbeda. Perbedaan ini disebabkan oleh perbedaan jumlah proton dari masing-masing atom. Jumlah proton dari atom suatu unsur disebut nomor atom unsur tersebut. Unsur hidrogen, misalnya, mempunyai nomor atom 1. Ini berarti bahwa atom hidrogen mengandung 1 proton. Demikian pula unsur karbon yang memiliki nomor atom 6 akan mengandung 6 proton pada setiap atomnya.
Gambar 3.1. Struktur atom
Penelitian para ilmuwan pada awal abad ke-20 menunjukkan bahwa atom- atom dari unsur yang sama ternyata dapat memiliki massa dan ukuran yang berbeda.
Meskipun sifat-sifat kimia atom-atom dari unsur yang sama juga pasti sama, kenyataannya sifat-sifat fisika atom-atom itu bisa berbeda. Gejala atau fenomena ini disebut isotop (bahasa Yunani : iso = sama, topos = tempat), suatu istilah yang diciptakan oleh seorang asisten Rutherford yang bernama Frederick Soddy (1877 – 1956) pada tahun 1911.
James Chadwick (1891 – 1974) menemukan bahwa dalam inti atom terdapat jenis partikel lain di samping proton. Partikel ini tidak bermuatan listrik (netral), dan itulah sebabnya diberi nama netron. Penemuan netron juga menerangkan mengapa proton-proton dalam inti stabil. Netron berfungsi sebagai penyekat, sehingga tidak ada tolak menolak antar proton dalam inti atom.
Jumlah netron yang berbeda menyebabkan atom-atom dari unsur yang sama dapat mempunyai berat atau massa yang berbeda. Jumlah proton + netron dalam inti atom disebut berat atom atau massa atom atau nomor massa atau bilangan massa.
Dengan demikian tiga definisi isotop dapat kita rumuskan :
1. Isotop adalah unsur-unsur sejenis yang memiliki jumlah proton sama, tetapi jumlah netron berbeda.
2. Isotop adalah unsur-unsur sejenis yang memiliki nomor atom sama, tetapi berat atom berbeda.
3. Isotop adalah unsur-unsur sejenis yang memiliki sifat kimia sama, tetapi sifat fisika berbeda.
Nomor atom dan berat atom suatu unsur dituliskan masing-masing di sebelah kiri bawah dan kiri atas dari lambang unsur tesebut. Misalnya lambang 126C menyatakan bahwa atom karbon mempunyai nomor atom 6 dan berat atom 12.
Untuk atom netral, elektron yang bermuatan negatif akan sama jumlahnya dengan proton yang bermuatan positif. Maka untuk atom yang netral (tidak bermuatan) maka jumlah elektron dapat menunjukkan nomor atom. Sedangkan untuk atom yang bermuatan jumlah elektron tidak menunjukkan nomor atom.
Atom-atom dapat melepaskan elektron dan dapat menerima elektron. Artinya elektron-elektron dari atom dapat berubah. Perubahan jumlah elektron dari atom netral, menyebabkan atom bermuatan. Atom bermuatan negatif, karena atom tersebut menerima elektron, sehingga elektronnya bertambah. Atom bermuatan positif, karena atom tersebut melepaskan elektron sehingga elektronnya berkurang.
3.1.2. Konfigurasi Elektron
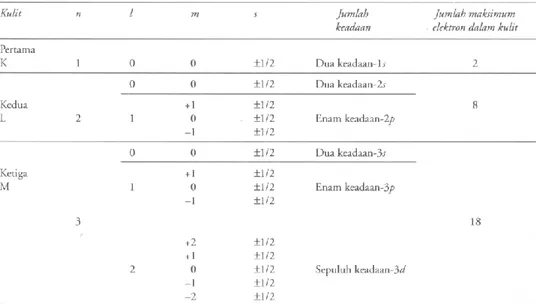
Elektron bergerak dengan orbit tetap mengelilingi nukleus dengan pergerakan elektron sebagai suatu fungsi gelombang. Fungsi ini hanya menyebutkan secara spesifik probabilitas ditemukannya satu elektron dengan energi tertentu di dalam ruang yang mengelilingi nukleus tersebut. Situasi ini semakin diperumit oleh kenyataan bahwa elektron berperilaku tidak saja seakan- akan berevolusi mengelilingi nukleus tetapi seakan-akan juga melakukan spin (berputa-putar dengan cepat) mengelilingi sumbunya sendiri. Akibatnya, sebagai ganti menspesifikasi gerak suatu elektron di dalam atom dengan satu bilangan tunggal n, seperti dikehendaki teori Bohr, kita sekarang perlu menspesifikasi keadaan elektron dengan menggunakan empat bilangan. Bilangan-bilangan ini, dikenal sebagai bilangan kuantum elektron, yaitu n, l, m, dan s, dimana n adalah bilangan kuantum utama, l bilangan kuantum orbital (azimutal), m bilangan kuantum magnetik, dan s adalah bilangan kuantum spin. Satu premis dasar lain dari
teori kuantum modern mengenai atom adalah Prinsip Eksklusi Pauli. Prinsip ini menyatakan bahwa tidak ada dua elektron yang terletak pada atom sama yang bisa memiliki nilai-nilai numerik yang sama untuk himpunan empat bilangan kuantum mereka.
Jika kita ingin memahami cara bagaimana Tabel Periodik yang berisi elemen-elemen (unsur) kimia tersusun berdasarkan struktur elektronik atom- atomnya, kita sekarang harus mempertimbangkan pengaruh keempat bilangan kuantum tadi dan keterbatasan-keterbatasan yang ditempatkan pada nilai-nilai numerik yang dipakai oleh keempat bilangan kuatum tersebut. Bilangan kuantum terpenting adalah bilangan kuantum utama karena bilangan ini terutama bertanggung jawab menentukan energi dari elektron. Bilangan kuantum utama dapat memiliki nilai integral (bilangan bulat) yang dimulai dengan n = 1, yaitu keadaan energi terendah, dan elektron-elektron yang memiliki nilai ini adalah elektron yang paling stabil, di mana stabilitas berkurang dengan bertambah besarnya n. Elektron-elektron yang memiliki bilangan kuantum utama n dapat memiliki nilai integral untuk bilangan kuantum orbital l antara 0 dan (n – 1). Jadi jika n = 1, l hanya mungkin bernilai 0, sedangkan untuk n = 2, l = 0 atau 1, dan untuk n = 3, l = 0, 1, atau 2. Bilangan kuantum orbital berkaitan dengan momentum angular dari elektron yang berevolusi, dan menentukan apa yang dalam istilah mekanika nonkuantum diangga sebagai bangun dari orbit. Untuk nilai n tertentu, elektron yang memiliki nilai l terendah akan memiliki energi terendah, dan semakin tinggi nilai l, semakin besarlah energinya.
Kedua bilangan kuantum lainnya, m dan s, terkait masing-masing dengan orientasi orbit elektron yang mengitari nukleus, dan dengan orientasi dari arah spin elektron tersebut. Untuk nilai l tertentu, suatu elektron dapat memiliki nilai integral untuk bilangan kuantum dalam m dari +l melalui 0 hingga –l. Jadi untuk l = 2, m dapat memiliki +2, +1, 0, -1, dan -2. Energi dari elektron-elektron yang mempunyai nilai n dan l yang sama tetapi dengan nilai m yang berbeda adalah sama, dengan syarat tidak ada medan magnetik yang hadir. Ketika suatu medan magnetik diberikan, energi dari elektron-elektron dengan nilai Zeeman. Bilangan kuantum spin s, untuk elektron yang memiliki nilai n, l, dan m yang sama, dapat memiliki salah satu dari dua nilai, yaitu +½ atau -½. Fakta bahwa nilai-nilai ini adalah nilai nonintegral belum perlu kita perhatikan saat ini. Kita hanya harus ingat bahwa dua elektron dalam suatu atom dapat memiliki nilai yang sama untuk bilangan kuantum
n, l dan m, dan bahwa kedua elektron ini akan memiliki spin dengan orientasi yang berlawanan. Hanya dalam suatu medan magnetik sajalah energi dari kedua elektron yang spinnya berlawanan ini akan berbeda.
Tabel 3.1 Alokasi keadaan pada ketiga kulit kuantum pertama
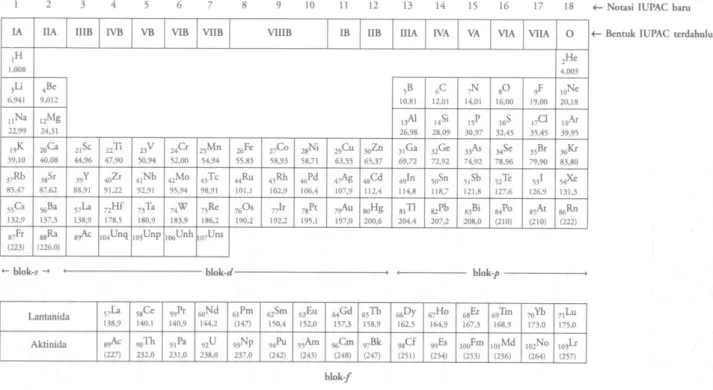
3.2. Susunan Periodik Unsur
Tabel periodik merupakan cara klasifikasi elemen kimia yang sangat berharga, di mana elemen merupakan satu kumpulan yang berisi atom – atom sejenis. Pada Tabel 3.2 diperlihatkan versi tipikal suatu Tabel Periodik. Dari 107 elemen yang muncul, 90 diantarannya terdapat di alam, sisanya diproduksi di reaktor – reaktor nuklir atau akselerator – akselerator partikel. Di samping lambang kimia setiap elemen, dicantumkan bilangan atomik (Z) dari elemen bersangkutan, yang dapat dianggap sebagai jumlah proton dalam nukleus atau jumlah elektron yang mengorbit mengelilingi atom. Elemen – elemen biasanya diklasifikasikan ke dalam periode (baris horisontal), yang bergantung pada kulit elektron mana yang sedang diisi, dan golongan (kolom vertikal). Elemen yang terletak dalam satu golongan mempunyai konfigurasi elektron yang sama pada kulit paling luar, dan, sebagai akibat langsungnya, memiliki sifat – sifat kimia yang sama.
Tabel 3.2. Tabel Periodik Elemen (dari Puddephatt and Monaghan, 1986; seizin Oxford University Press).
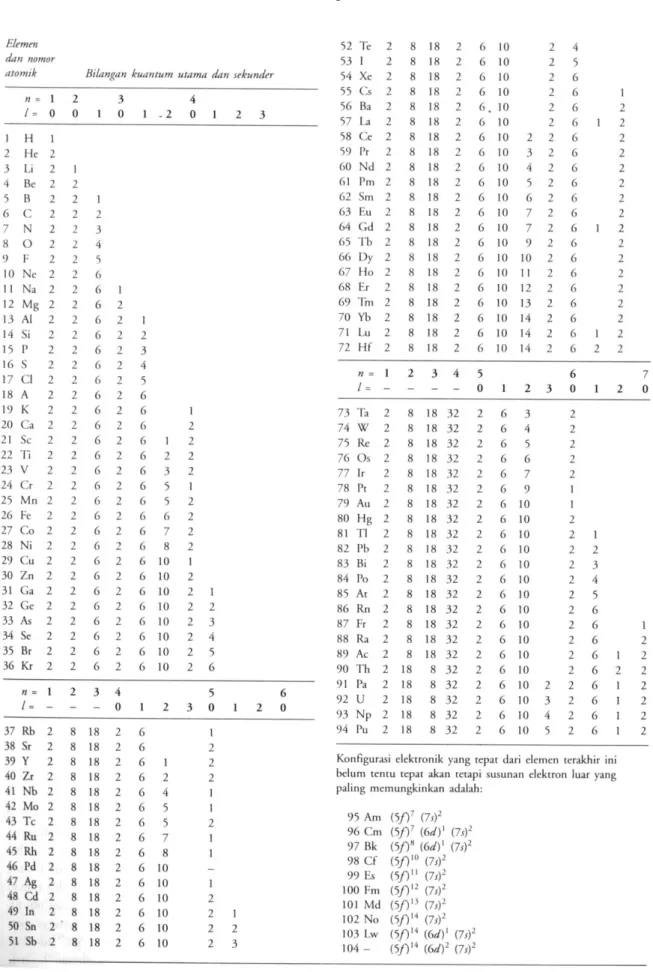
Tabel 3.3. Bilangan Kwantum Elektron
3.2.1. Ikatan-Ikatan Atar Atom
Biasanya kita mengenal empat tipe pengikat utama dalam material, yaitu pengikat metalik, pengikat ionik, pengikat kovalen, dan pengikat yang relatif jauh lebih lemah yaitu pengikat van der Waals. Namun demikian, pada bebagai material padat bisa saja pengikat memiliki karakter campuran, atau karakter antara. Pertama – tama akan kita bahas ciri – ciri kimiawi yang dimiliki setiap jenis pengikatan.
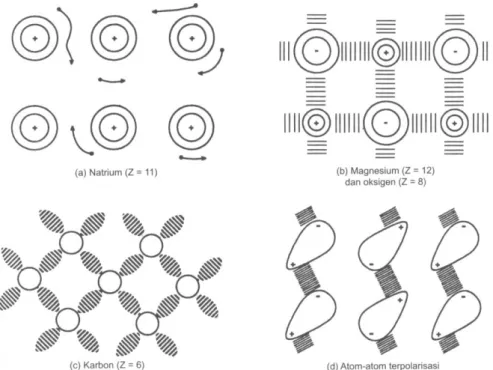
Seperti telah kita lihat, elemen – elemen dengan karakteristik metalik yang paling menonjol dikelompokkan di sisi kiri Tabel Periodik (Tabel 3.2). Secara umum, elemen – elemen ini memiliki sedikit elektron valensi, di luar kulit tertutup terluar, yang relatif mudah lepas. Di dalam suatu logam, setiap elektron valensi
“bebas” ternagi rata ke seluruh atom, bukannya terikat pada satu atom tertentu, dan membentuk bagian dari apa yang disebut sebagai “gas elektron” yang berputar – putar secara acak di tengah – tengah susunan yang teratur dari inti – inti elektron bermuatan-positif, atau kation (Gambar 3.2a). Penerapan suatu gradien potensial listrik akan menyebabkan “gas” tersebut terbawa melalui struktur tanpa hambatan berarti, sehingga jelaslah mengapa konduktivitas listrik sangat baik pada keadaan metalik. Ikatan metalik berasal dari tarik – menarik antara kation dan elektron bebas dan, sesuai perkiraan, timbullah komponen tolak – menolak dari gaya ketika didekatkan. Namun demikian, gaya – gaya pengikat dalam struktur metalik tidak memiliki arah dalam ruang dan kita dapat langsung mensimulasi karakteristik penumpukan dan pengisian ruang dari atom – atom tersebut dengan sistem – sistem permodelan yang menggunakan bola – bola berukuran sama (bola – bola polistiren, bahkan dengan gelembung – gelembung busa sabun). Sifat – sifat lain seperti keuletan, konduktivitas panas dan transmitansi radiasi elektromagnetik juga dipengaruhi langsung oleh ketanpaarahan dan mobilitas elektron yang tinggi dari ikatan metalik.
Ikatan ionik terjadi apabila elektron ditransfer dari atom – atom elemen metalik aktif ke atom – atom elemen nonmetalik aktif, sedemikian rupa sehingga ion – ion resultannya dapat memiliki kulit tertutup yang stabil. Sebagai contoh, struktur ionik magnesia (MgO), suatu oksida keramik, terbentuk ketika setiap atom mangnesium (Z = 12) kehilangan dua elektron dari kulit-L-nya (n = 2) dan elektron –elektron ini diikat oleh sebuah atom oksigen (Z = 8), menghasilkan konfigurasi oktet stabil pada kulit-L-nya (Tabel 3.3). Secara keseluruhan, muatan – muatan ionik tersebut berada dalam keseimbangan dan strukturnya secara listrik netral.
(Gambar 3.2b). Anion biasanya lebih besar daripada kation. Pengikatan ionik bersifat omnidirectional (kesemua arah), pada dasarnya bersifat elektrostatik dan bisa jadi sangat kuat, sebagai contoh, magnesia yang merupakan oksida tahan api yang sangat bermanfaat (t.l = 2930°C). Pada temperatur rendah sampai temperatur sedang, struktur seperti ini adalah isolator listrik, namun, pada umumnya, akan menjadi konduktif pada temperatur tinggi ketika agitasi termal dari ion – ionnya meningkatkan mobilita struktur tersebut.
Pemakaian bersama elektron valensi merupakan ciri utama dari tipe pengikatan primer kuat yang ketiga. Ikatan – ikatan kovalen terjadi ketika elektron – elektron valensi dengan spin berlawanan dari atom – atom tetangganya dapat berpasang – pasangan di dalam orbital – orbital berarah spasial yang bertumpang tindih, sehingga setiap atom dapat mencapai konfigurasi elektronik yang stabil (Gambar 3.2c).. Karena terorientasi dalam ruang tiga dimensional, ikatan – ikatan yang terlokalisir ini berbeda dengan ikatan logam atau ikatan ionik. Selain itu, elektron – elektron yang ikut serta di dalam ikatan – ikatan terikat dengan kuat sehingga padatan – padatan kovalen umumnya memiliki konduktivitas listrik rendah dan bertindak sebagai isolator, kadang – kadang sebagai semikonduktor (misalnya silikon). Jenis pengikatan yang terakhir ditimbulkan oleh gaya Van Der Waals yang terjadi ketiga atom-atom, atau gugus-gugus atom, yang berdekatan bertindak sebagai dipol listrik. Misalkan dua atom dengan perbedaan ukuran yang sangat besar berkombinasi membentuk sebuah molekul sebagai hasil pengikatan kovalen. “Awan” elektron yang terbentuk untuk keseluruhan molekul dapat dikatakan berbentuk seperti buah pir dan memiliki distribusi muatan elektron yang tidak simetris. Sebuah dipol listrik telah terjadi sehingga gaya tarik menarik elektrostatik searah yang lemah bisa hadir di dalam agregatberisi molekul-molekul seperti itu (Gambar 3.2d). Tidak ada elektron-elektron yang “bebas’ maka tidak terdapat konduksi listrik. Pengikatan Van Der Waals relatif lebih lemah dibandingkan dengan ketiga bentuk pengikatan yang lainnya.
Gambar 3.2. Skema (a) pengikatan metalik, (b) pengikatan ionik, (c) pengikatan kovalen, dan (d) pengikatan van der Waals.