UNIVERSITAS INDONESIA
PENGARUH METODE PEMBENTUKAN KOKRISTAL
TERHADAP LAJU PELARUTAN KARBAMAZEPIN
MENGGUNAKAN ASAM TARTRAT SEBAGAI KOFORMER
SKRIPSI
RIZKIANNA
0806328026
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM PROGRAM STUDI FARMASI
DEPOK JULI 2012
UNIVERSITAS INDONESIA
PENGARUH METODE PEMBENTUKAN KOKRISTAL
TERHADAP LAJU PELARUTAN KARBAMAZEPIN
MENGGUNAKAN ASAM TARTRAT SEBAGAI KOFORMER
SKRIPSI
Diajukan sebagai salah satu syarat untuk memperoleh gelar sarjana Farmasi
RIZKIANNA
0806328026
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM PROGRAM STUDI FARMASI
DEPOK JULI 2012
iii
Saya yang bertanda tangan di bawah ini dengan sebenarnya menyatakan bahwa skripsi ini saya susun tanpa tindakan plagiarisme sesuai dengan peraturan yang berlaku di Universitas Indonesia.
Jika di kemudian hari ternyata saya melakukan plagiarisme, saya akan bertanggung jawab sepenuhnya dan menerima sanksi yang dijatuhkan oleh Universitas Indonesia kepada saya.
Depok, 9 Juli 2012
Skripsi ini adalah hasil karya saya sendiri, dan semua sumber baik yang dikutip maupun dirujuk telah saya
v Skripsi ini diajukan oleh :
Nama : Rizkianna
NPM : 0806328026
Program Studi : Sarjana Farmasi
Judul Skripsi : Pengaruh Metode Pembentukan Kokristal Terhadap Laju Pelarutan Karbamazepin Menggunakan Asam Tartrat Sebagai Koformer Telah berhasil dipertahankan dihadapan Dewan Penguji dan diterima sebagai bagian persyaratan yang diperlukan untuk memperoleh gelar Sarjana Farmasi pada Program Studi S1 Reguler Farmasi, Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Indonesia.
Segala puji dan syukur penulis panjatkan kepada Allah SWT atas limpahan rahmat dan kuasa-Nya, penulis dapat menyelesaikan skripsi ini. Penulisan skripsi ini dilakukan dalam rangka memenuhi salah satu syarat untuk mencapai gelar Sarjana Farmasi pada Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Indonesia. Penulis mengucapkan rasa terima kasih dan rasa hormat kepada:
1. Dr. Iskandarsyah, M.S., Apt., selaku pembimbing yang telah membimbing dan mengarahkan penulis.
2. Prof. Dr. Yahdiana Harahap, M.S., Apt., selaku Ketua Departemen Farmasi FMIPA UI yang telah memberikan kesempatan untuk melakukan penelitian dan penyusunan skripsi ini;
3. Dra. Maryati Kurniadi M.Si., Apt., selaku pembimbing akademis yang telah memberikan bimbingan selama penulis menempuh pendidikan di Departemen Farmasi FMIPA UI.
4. Seluruh dosen Departemen Farmasi FMIPA UI atas ilmu pengetahuan, pendidikan, saran dan bantuannya selama ini.
5. Seluruh pegawai dan laboran Departemen Farmasi UI terutama Mbak Devfanny dan Pak Imih atas bantuannya selama penulis melakukan penelitian.
6. Distributor bahan-bahan kimia, khususnya PT. Indofarma Tbk, atas bantuan bahan yang diberikan.
7. Keluargaku tercinta, Mama, Abi, Ana, Rijal dan Reza yang tak henti-hentinya memberikan perhatian, dukungan serta motivasi untuk menyelesaikan penelitian serta pendidikan di farmasi dengan sebaik mungkin.
8. Teman – teman terdekat, Devi, Hana, Sri Rahayu, Nada, Pewe, Nadia dan Fara yang telah menemani mengarungi dunia farmasi bersama dalam suka dan duka selama kurang lebih empat tahun.
vii
10. Semua pihak yang tidak dapat disebutkan namanya yang juga banyak memberikan bantuan selama penelitian dan penyusunan skripsi ini.
Akhir kata, penulis berharap Allah SWT berkenan membalas segala kebaikan semua pihak yang telah membantu. Penulis menyadari sepenuhnya bahwa dalam penyusunan skripsi ini masih banyak kekurangan dan jauh dari sempurna. Untuk itu penulis mengharapkan segala kritik dan saran yang mendukung dan bermanfaat dari para pembaca. Semoga skripsi ini membawa manfaat bagi pengembangan ilmu pengetahuan.
Penulis 2012
Sebagai sivitas akademik Universitas Indonesia, saya yang bertanda tangan dibawah ini:
Nama : Rizkianna NPM : 0806328026
Program Studi : S1 Reguler Farmasi Departemen : Farmasi
Fakultas : Matematika dan Ilmu Pengetahuan Alam Jenis Karya : Skripsi
demi pengembangan ilmu pengetahuan, menyetujui untuk memberikan kepada Universitas Indonesia Hak Bebas Royalti Nonekslusif (Non-exclusive Royalty-Free Right) atas karya ilmiah saya yang berjudul:
Pengaruh Metode Pembentukan Kokristal Terhadap Laju Pelarutan Karbamazepin Menggunakan Asam Tartrat Sebagai Koformer.
beserta perangkat yang ada (jika diperlukan). Dengan Hak Bebas Royalti Noneksklusif ini Universitas Indonesia berhak menyimpan, mengalihmedia/formatkan, mengelola dalam bentuk pangkalan data (database), merawat, dan memublikasikan tugas akhir saya selama tetap mencantumkan nama saya sebagai penulis atau pencipta dan sebagai pemilik Hak Cipta.
Demikian surat pernyataan ini saya buat dengan sebenarnya. Dibuat di : Depok
Pada tanggal : 9 Juli 2012 Yang menyatakan
Nama : Rizkianna Program Studi : Sarjana Farmasi
Judul : Pengaruh Metode Pembentukan Kokristal Terhadap Laju Pelarutan Karbamazepin Menggunakan Asam Tartrat sebagai Koformer
Karbamazepin merupakan obat yang termasuk ke dalam Biopharmaceutical Classification System kelas dua dengan kelarutan yang rendah dan permeabilitas yang tinggi, sehingga laju pelarutan menjadi tahap yang membatasi laju absorpsi obat. Penelitian ini dimaksudkan untuk meningkatkan laju pelarutan karbamazepin dengan pembentukan kokristal menggunakan asam tartrat sebagai koformer. Pembuatan kokristal dilakukan dengan metode penguapan pelarut dan
solvent drop grinding. Formulasi karbamazepin dan asam tartrat dibuat dengan perbandingan 1:0, 1:1, dan 2:1. Kokristal dikarakterisasi dengan FTIR, XRD, dan DSC kemudian dibandingkan dengan karbamazepin. Berdasarkan uji difraksi sinar-x, terjadi perubahan bentuk dan ukuran kristal pada kokristal. Hasil spektrum inframerah menunjukan adanya interaksi berupa ikatan hidrogen antara karbamazepin dan asam tartrat. Laju pelarutan paling tinggi diperoleh dari metode penguapan pelarut dengan perbandingan 1:1. Peningkatan laju pelarutan mencapai 2,55 kali dari karbamazepin standar dengan DE180 sebesar 9,60%.
Kata Kunci : asam tartrat, efisiensi disolusi, karbamazepin, kokristal, laju pelarutan.
xv + 65 hal : 28 gambar; 2 tabel; 18 lampiran Daftar acuan : 32 (1989 – 2011)
Name : Rizkianna
Study Program : Bachelor of Pharmacy
Title : The Effect of Cocrystal Formation Method on Carbamazepine Dissolution Rate With Tartaric Acid as Coformer
Carbamazepine is a drug that belongs to the Biopharmaceutical Classification System class II with low solubility and high permeability, so that the dissolution rate becomes rate limiting step of drug absorption. This study is intended to enhance the dissolution rate of carbamazepine by forming cocrystal with tartaric acid as coformer. Cocrystal were made by solvent evaporation and solvent drop grinding method. Formulations of carbamazepine and tartaric acid were made with a ratio of 1:0, 1:1, and 2:1. Cocrystal was characterized by FTIR, XRD, and DSC compared with carbamazepine. Based on the x-ray diffraction test, the changes in shapes and sizes of the crystals was shown. Moreover, the infrared spectrum showed hydrogen bonding interaction between carbamazepine and tartaric acid. The highest dissolution rate was obtained from solvent evaporation method with ratio of 1:1. Enhancement of dissolution rate reached 2.55 times from standard with DE180 9.60%.
Key words : carbamazepine, co-crystals, dissolution efficiency, dissolution rate, tartaric acid
xv +65 pages : 28 figures; 2 tables; 18 appendixes Bibliography : 32 (1989 – 2011)
HALAMAN SAMPUL ... i
HALAMAN JUDUL ... ii
SURAT PERNYATAAN BEBAS PLAGIARISME... iii
LEMBAR PERNYATAAN ORISINALITAS ... iv
LEMBAR PENGESAHAN ... v
KATA PENGANTAR ... vi
LEMBAR PERSETUJUAN PUBLIKASI KARYA ILMIAH ... viii
ABSTRAK ... ix
ABSTRACT ... x
DAFTAR ISI ... xi
DAFTAR GAMBAR ... xii
DAFTAR TABEL ... xiv
DAFTAR LAMPIRAN ... xv
BAB 1. PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Tujuan Penelitian ... 2
BAB 2. TINJAUAN PUSTAKA ... 3
2.1 Karbamazepin ... 3 2.2 Asam Tartrat ... 4 2.3 Kokristal ... 5 2.4 Kelarutan ... 8 2.5 Laju Pelarutan ... 11 2.6 Karakterisasi Kokristal ... 13
BAB 3. METODOLOGI PENELITIAN ... 16
3.1 Lokasi dan Waktu Penelitian ... 16
3.2 Alat ... 16
3.3 Bahan ... 16
3.4 Cara Kerja ... 16
BAB 4. HASIL DAN PEMBAHASAN ... 21
4.1 Pembuatan Kokristal Karbamazepin-Asam Tartrat.. ... 21
4.2 Pembuatan Campuran Fisik Karbamazepin-Asam Tartrat... ... 22
4.3 Pembuatan Kurva Kalibrasi ... 22
4.4 Penetapan Kadar Karbamazepin ... 22
4.5 Karakterisasi Kokristal ... 23
BAB 5. KESIMPULAN DAN SARAN ... 45
5.1 Kesimpulan ... 45
5.2 Saran ... 45
Gambar 2.1 Struktur kimia karbamazepin... 3
Gambar 2.2 Struktur kimia asam tartrat... 4
Gambar 2.3 Ikatan hidrogen dalam pembentukan kokristal... 6
Gambar 2.4 Mekanisme pelarutan zat terlarut... 10
Gambar 4.1 Kurva kalibrasi karbamazepin dalam medium aquademineralisata pada panjang gelombang 286 nm... 22
Gambar 4.2 Bentuk makroskopik serbuk hasil kokristalisasi... 24
Gambar 4.3 Bentuk mikroskopik serbuk hasil kokristalisasi... 25
Gambar 4.4 Hasil overlay spektrum inframerah karbamazepin murni (hitam), asam tartrat (hijau) dan kokristal karbamazepin-asam tartrat metode penguapan pelarut perbandingan 1:1 (biru)... 28
Gambar 4.5 Hasil overlay spektrum inframerah karbamazepin murni (hitam), asam tartrat (hijau) dan kokristal karbamazepin-asam tartrat metode solvent drop grinding perbandingan 1:1 (biru)... 29
Gambar 4.6 Hasil overlay spektrum inframerah karbamazepin murni (hitam), dan karbamazepin dari metode solvent dropgrinding perbandingan 1:0 (hijau)... 30
Gambar 4.7 Hasil overlay spektrum inframerah karbamazepin murni (hitam), dan karbamazepin dari metode penguapan pelarut perbandingan 1:0 (hijau)... 31
Gambar 4.8 Hasil overlay spektrum inframerah karbamazepin murni (abu-abu), asam tartrat (hijau), dan campuran fisik karbamazepin-asam tartrat perbandingan 1:1 (biru)... 32
Gambar 4.9 Difraktogram karbamazepin murni... 33
Gambar 4.10 Difraktogram kokristal karbamazepin-asam tartrat metode penguapan pelarut perbandingan 1:1... 33
Gambar 4.11 Difraktogram kokristal karbamazepin dan asam tartrat metode solvent drop grinding perbandingan 1:1... 34
Gambar 4.12 Difraktogram karbamazepin dari metode penguapan pelarut dengan perbandingan 1:0... 34
Gambar 4.13 Difraktogram karbamazepin dari metode solvent drop grinding dengan perbandingan 1:0... 35
Gambar 4.14 Difraktogram campuran fisik karbamazepin-asam tartrat perbandingan 1:0... 35
Gambar 4.15 Termogram Differential Scanning Calorimetry (DSC) karbamazepin murni... 36
Gambar 4.16 Termogram Differential Scanning Calorimetry (DSC) kokristal karbamazepin-asam tartrat metode penguapan pelarut perbandingan 1:1... 37
Gambar 4.17 Termogram Differential Scanning Calorimetry (DSC) kokristal karbamazepin-asam tartrat metode solvent drop grinding perbandingan 1:1... 38
karbamazepin dari metode penguapan pelarut dengan
perbandingan 1:0... 39 Gambar 4.19 Termogram Differential Scanning Calorimetry (DSC)
karbamazepin dari metode solvent drop grinding dengan
perbandingan 1:0... 39 Gambar 4.20 Termogram Differential Scanning Calorimetry (DSC)
campuran fisik karbamazepin-asam tartrat perbandingan 1:1.. 40 Gambar 4.21 Kurva laju pelarutan karbamazepin murni dan hasil
kokristalisasi pada metode penguapan pelarut... 42 Gambar 4.22 Kurva laju pelarutan karbamazepin murni dan hasil
kokristalisasi pada metode solvent drop grinding... 42 Gambar 4.23 Kurva laju pelarutan karbamazepin murni dan campuran fisik
karbamazepin-asam tartrat perbandingan 1:1... 43 Gambar 4.24 Diagram efisiensi disolusi karbamazepin pada menit ke-180.. 44
Tabel 2.1. Istilah Kelarutan... 9 Tabel 3.1. Perbandingan jumlah karbamazepin dan asam tartrat... 17
Lampiran 1. Spektrum serapan karbamazepin... 50
Lampiran 2. Spektrum inframerah karbamazepin... 51
Lampiran 3. Spektrum inframerah asam tartrat... 52
Lampiran 4. Data persentase kehilangan bobot pada pembentukan kokristal.. 53
Lampiran 5. Data serapan karbamazepin dalam berbagai konsentrasi pada medium aquademineralisata pada panjang gelombang 286 nm... 53
Lampiran 6. Data kadar karbamazepin dalam sampel dan penimbangan sampel untuk uji laju pelarutan... 54
Lampiran 7. Data uji laju pelarutan karbamazepin murni... 55
Lampiran 8. Data uji laju pelarutan karbamazepin pada sampel metode penguapan pelarut ... 56
Lampiran 9. Data uji laju pelarutan karbamazepin pada sampel metode solvent drop grinding... 57
Lampiran 10. Data uji laju pelarutan campuran fisik karbamazepin dan asam tartrat dengan perbandingan 1:1... 58
Lampiran 11. Data efisiensi disolusi karbamazepin pada menit ke 180... 58
Lampiran 12. Contoh perhitungan kehilangan bobot... 59
Lampiran 13. Bagan perhitungan kurva kalibrasi karbamazepin... 60
Lampiran 14. Contoh perhitungan jumlah sampel yang ditimbang untuk uji laju pelarutan... 61
Lampiran 15. Contoh perhitungan jumlah kumulatif karbamazepin terlarut... 62
Lampiran 16. Contoh perhitungan efisiensi disolusi pada menit ke-180... 63
Lampiran 17. Sertifikat analisis karbamazepin ... 64
1.1 Latar Belakang
Pelarutan merupakan tahapan yang membatasi atau mengontrol laju absorpsi obat-obat yang mempunyai kelarutan yang rendah, karena tahapan ini biasanya merupakan tahapan yang paling lambat dari berbagai tahapan yang ada dalam pelepasan obat dari bentuk sediaannya dan perjalanannya ke dalam sirkulasi sistemik (Martin, Swarbrick dan Cammarata, 1990).
Karbamazepin merupakan senyawa trisiklik yang efektif dalam pengobatan depresi bipolar. Pada mulanya obat ini dipasarkan untuk pengobatan neuralgia trigeminal, tetapi kemudian terbukti bermanfaat untuk epilesi. (Katzung, 2002). Didalam sistem BCS (Biopharmaceutical Classification System) dijelaskan bahwa karbamazepin termasuk dalam kelas II, yaitu obat dengan kelarutan rendah serta permeabilitas tinggi (Chi-Yuan dan Benet, 2005), sehingga laju pelarutan menjadi tahap yang membatasi laju absorpsinya.
Salah satu cara peningkatan laju pelarutan zat aktif adalah dengan kokristalisasi. Kokristal merupakan kompleks kristal yang terdiri dari dua atau lebih konstituen molekul yang terikat bersama-sama dalam kisi kristal melalui interaksi nonkovalen terutama ikatan hidrogen (Trask, Motherwell dan Jones, 2006). Pembentukan kokristal dapat memperbaiki kelarutan, laju disolusi, bioavailabilitas dan stabilitas zat aktif. Metode yang sering digunakan untuk membentuk kokristal adalah metode pelarutan dan metode grinding (Qiao, Li, Schlindwein, Malek, Davies, dan Trappitt, 2011).
Metode pelarutan merupakan cara yang paling umum digunakan untuk memperoleh kokristal. Metode ini dibagi menjadi beberapa macam metode, salah satunya adalah metode penguapan pelarut dimana pelarut diuapkan untuk mencapai kondisi lewat jenuh sehingga dihasilkan kokristal. Metode grinding
merupakan metode pembentukan kokristal yang menggunakan aspek mekanik. Salah satu contoh metode ini adalah solvent drop grinding dimana ditambahkan sedikit pelarut untuk mempercepat proses pembentukan kokristal (Qiao, Li, Schlindwein, Malek, Davies, dan Trappitt, 2011).
Pembentukan kokristal telah terbukti berhasil dalam meningkatkan kelarutan obat-obat yang kelarutan dalam airnya rendah, diantaranya pembentukan kokristal antara indometasin-sakarin (Basavoju, Bostrom dan Velaga, 2008) dan kokristal itrakonazol dengan asam tartrat, asam suksinat, asam fumarat dan asam malat sebagai koformer menggunakan metode penguapan pelarut (Remenar, et al., 2003).
Sebelumnya penelitian mengenai peningkatan laju pelarutan karbamazepin telah dilakukan melalui pembentukan kokristal dengan menggunakan nikotinamid (Buanz, Parkinson dan Gaisford, 2011) dan sakarin (Hickey, et al., 2007) sebagai koformer.
Pada penelitian ini digunakan asam tartrat untuk membentuk kokristal karbamazepin menggunakan metode penguapan pelarut dan solvent drop grinding. Kokristal yang didapat diharapkan memiliki kelarutan yang lebih baik. Uji laju pelarutan dilakukan terhadap karbamazepin dan kokristal karbamazepin-asam tartrat dari kedua metode. Kokristal yang didapat akan dikarakterisasi dengan FT-IR, X-ray powder diffractometry dan differential scanning calorimetry.
1.2 Tujuan Penelitian
1. Membuat dan mengkarakterisasi kokristal karbamazepin-asam tartrat dengan metode penguapan pelarut dan solvent drop grinding.
2. Mengevaluasi pengaruh metode pembentukan kokristal terhadap laju pelarutan karbamazepin.
2.1 Karbamazepin
N
O H2N
[Sumber: O’Neil, et al., 2001]
Gambar 2.1 Struktur kimia karbamazepin (telah diolah kembali)
Nama kimia : 5H-Dibenz[b,f]azepine-5-carboxamide Nama lain : 5-carbamoyl-5H-dibenz[b,f]azepine Berat Molekul : 236,27
Rumus Empiris : C15H12N2O Titik Lebur : 190 – 193o
Kelarutan : praktis tidak larut dalam air, larut dalam alkohol, aseton dan propilen glikol.
Khasiat : Antikonvulsi (O’Neil, et al., 2001)
Karbamazepin merupakan serbuk kristal berwarna putih atau hampir putih, mengandung tidak kurang dari 98% dan tidak lebih dari 102% C15H12N2O, dihitung terhadap zat yang telah dikeringkan (British Comission Secretariat, 2009). Pada mulanya karbamazepin digunakan untuk pengobatan trigeminal neuralgia, kemudian ternyata obat ini efektif terhadap bangkitan parsial kompleks dan bangkitan tonik-klonik. Selain mengurangi kejang, karbamazepin mempunyai efek nyata pada perbaikan psikis yaitu perbaikan kewaspadaan dan perasaan, sehingga dipakai juga untuk mengobati kelainan psikiatri seperti mania-bipolar (Gunawan, 2007). Karbamazepin bekerja dengan menghambat kanal ion natrium
tinggi pada neuron. Obat ini juga bekerja secara prasinaptik untuk mengurangi transmisi sinaptik (Katzung, 2002).
Kecepatan absorpsi karbamazepin bervariasi pada pasien yang berbeda-beda. Kadar puncak biasanya dicapai 6-8 jam setelah pemberian obat. Distribusi obat ini lambat, dan volume distribusi kira-kira 1L/kg. Karbamazepin hanya 70% terikat dengan protein plasma, tidak ada pendesakan oleh obat-obatan lain dari ikatannya dengan protein plasma (Katzung, 2002).
Karbamazepin memiliki empat bentuk polimorf, yaitu bentuk I, bentuk II, bentuk III, dan bentuk IV. Selain itu terdapat pula karbamazepin dihidrat (Kipouros, Kachrimanis, Nikolakakis dan Malamataris, 2005). Didalam sistem BCS (Biopharmaceutical Classification System) dijelaskan bahwa karbamazepin termasuk dalam kelas II, yaitu obat dengan kelarutan rendah serta permeabilitas tinggi (Chi-Yuan dan Benet, 2005). Bioavailabilitas obat kelas II dibatasi oleh laju disolusinya, sehingga peningkatan yang kecil pada laju disolusinya akan sangat berpengaruh pada bioavailabilitasnya. Oleh karena itu, peningkatan laju disolusi obat ini menjadi faktor yang diperlukan untuk memperbaiki bioavailabilitasnya.
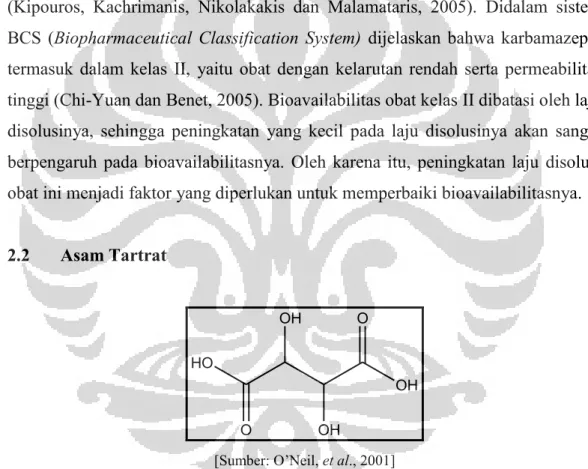
2.2 Asam Tartrat OH OH O HO O OH [Sumber: O’Neil, et al., 2001]
Gambar 2.2 Struktur kimia asam tartrat (telah diolah kembali)
Nama kimia : (2R,3R)-2,3-Dihydroxybutanedioic acid.
Nama lain : L-(þ)-2,3-Dihydroxybutanedioic acid; 2,3-dihydroxysuccinic acid; E334; dtartaric acid; L-(þ)-tartaric acid.
Berat Molekul : 150,09 Rumus Empiris : C4H6O6
Titik lebur : 168-170oC
Kelarutan : pada suhu 20°C asam tartrat parktis tidak larut dalam kloroform, larut dalam 1:0,75 bagian air, larut dalam 1:2,5 bagian etanol 95%, 1:250 bagian eter, 1:1,7 bagian methanol, larut dalam gliserin; larut dalam 1:0,5 bagian air dengan suhu 100°C (Rowe, Sheskey dan Owen, 2006). Asam tartrat merupakan kristal putih atau hampir putih, tidak berbau dan rasa sangat asam (Rowe, Sheskey dan Owen, 2006). Asam tartrat memiliki empat donor dan enam akseptor ikatan hidrogen sehingga dapat digunakan sebagai koformer dalam proses kokristalisasi. Dalam penelitian sebelumnya, asam tartrat digunakan sebagai koformer dalam proses kokristalisasi dengan piridin betain, dimana terjadi pembentukan ikatan hidrogen antara gugus hidroksil yang berasal dari asam tartrat dengan gugus karboksilat yang berasal dari piridin betain (Dega-Szafran, Dutkiewicz dan Kosturkiewicz, 2010). Selain itu, pernah dilakukan pembentukan kokristal itrakonazol-asam tartrat dengan rasio molar (2:1) menggunakan metode penguapan pelarut yang menghasilkan peningkatkan laju pelarutan itrakonazol (Remenar, et al., 2003).
2.3 Kokristal
2.3.1 Pengertian Kokristal
Kokristal dapat didefinisikan sebagai kompleks kristal yang terdiri dari dua atau lebih konstituen molekul yang terikat bersama-sama dalam kisi kristal melalui interaksi nonkovalen terutama ikatan hidrogen (Trask, Motherwell dan Jones, 2006). Pembentukan kokristal melibatkan penggabungan zat aktif obat dengan molekul lain yang dapat diterima secara farmasi dalam sebuah kisi kristal. Agar dapat membentuk kokristal, zat aktif yang digunakan harus memiliki gugusan yang mampu berikatan secara nonkovalen dengan koformer.
Koformer atau disebut juga dengan agen kokristalisasi yang digunakan harus memiliki sifat sebagai berikut, tidak toksik dan inert secara farmakologi, mudah larut dalam air, dapat berikatan secara nonkovalen contohnya ikatan hidrogen dengan obat, dapat meningkatkan kelarutan obat dalam air, kompatibel
secara kimia dengan obat dan tidak membentuk ikatan yang kompleks dengan obat. Koformer dapat berupa zat tambahan pada makanan, pengawet, eksipien farmasi dan zat aktif lain (Yadav, Shete, Dabke, Kulkarni, dan Sakhare, 2009). Beberapa contoh koformer yang sering digunakan dalam pembentukan kokristal yaitu sakarin, turunan asam dikarboksilat (asam fumarat, asam suksinat, asam tartrat), dan amida (nikotinamida).
Pembentukan kokristal dapat memperbaiki beberapa sifat yang dimiliki oleh suatu zat seperti kelarutan, laju pelarutan, bioavailabilitas dan stabilitas fisik. Fase multi-kristal yang dihasilkan akan mempertahankan aktivitas intrinsik zat aktif obat namun disisi lain memiliki sifat fisikokimia yang berbeda (Mirza, Miroshnyk, Heinamaki dan Yliruusi, 2008). Ikatan hidrogen yang merupakan interaksi nonkovalen adalah suatu kunci dalam pembentukan kokristal (Sekhon, 2009).
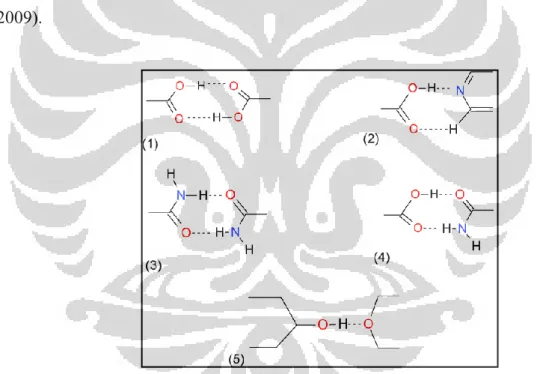
[Sumber: Qiao, Li, Schlindwein, Malek, Davies, dan Trappitt, 2011]
Gambar 2.3 Ikatan hidrogen dalam pembentukan kokristal, (1) dan (3) tipe homosinton, (2), (4) dan (5) tipe heterosinton
Ikatan hidrogen yang banyak terjadi dalam pembentukan kokristal dapat dilihat pada Gambar 2.3. Dalam Gambar 2.3(1) terlihat adanya suatu ikatan hidrogen antara C=O· · ·H–O yang berasal dari asam karboksilat membentuk formasi homosinton. Gambar 2.3(2) menggambarkan terjadinya suatu ikatan hidrogen antara asam karboksilat dengan piridin yang membentuk suatu formasi
heterosinton. Pada Gambar 2.3(3) terlihat adanya suatu ikatan hidrogen antara C=O· · ·H–N yang berasal dari amida yang membentuk formasi homosinton. Gambar 2.3(4) menggambarkan ikatan hidrogen yang terjadi antara asam karboksilat dengan amida yang membentuk formasi heterosinton, sedangkan pada Gambar 2.3(5) terlihat adanya ikatan hidrogen yang terjadi antara alkohol dan eter.
2.3.2 Metode Pembentukan Kokristal
Beberapa metode yang umum digunakan dalam pembuatan kokristal adalah sebagai berikut (Qiao, Li, Schlindwein, Malek, Davies, dan Trappitt, 2011):
2.3.2.1Metode Pelarutan
Metode pelarutan terbagi menjadi tahap pelarutan masing-masing komponen dalam pelarut yang sesuai dengan kelarutannya, kemudian dilakukan pencampuran dan pembentukan kristal sehingga didapatkan kokristal. Metode pembentukan kristal dapat dilakukan dengan beberapa cara :
a. Metode Penguapan Pelarut
Metode ini merupakan metode yang paling sering digunakan dalam pembentukan kokristal. Dua komponen yang ekuivalen terdiri dari zat aktif obat dan koformer di larutkan dalam pelarut atau campuran pelarut, kemudian dilakukan penguapan pelarut untuk mencapai keadaan lewat jenuh sehingga dihasilkan kokristal.
b. Metode reaksi kristalisasi
Metode ini dilakukan dengan menambahkan sejumlah komponen zat ke dalam larutan zat lain yang sudah jenuh atau mendekati jenuh sehingga larutan akan menjadi lewat jenuh dan terjadi proses kristalisasi yang menghasilkan kokristal. Metode ini efektif untuk larutan dengan konsentrasi komponen yang tidak ekuivalen dan ketika satu kompenen larutan menjadi lewat jenuh dengan penambahan komponen lainnya.
c. Metode pendinginan
Metode ini melibatkan suhu dalam proses kokristalisasi. Dimana sejumlah besar komponen yang merupakan zat aktif dan koformer dilarutkan dalam pelarut atau campuran pelarut yang kemudian dipanaskan untuk memastikan kedua komponen tersebut benar-benar larut. Kemudian larutan didinginkan untuk memperoleh keadaan lewat jenuh. Kokristal akan mengendap saat larutan mencapai keadaan lewat jenuh. Metode ini cocok untuk membuat kokristal dalam skala besar.
2.3.2.2 Metode grinding
Metode grinding dapat digunakan dalam pembentukan kokristal. Pada metode ini menggunakan aspek mekanik untuk membentuk kokristal antara zat aktif dengan koformer.
a. Dry grinding
Metode ini dilakukan dengan menyampurkan kedua komponen penyusun kokristal yang ekuivalen secara bersama-sama lalu menggerusnya secara manual menggunakan lumpang dan alu atau secara mekanik dengan ball mill atau
vibratory mill.
b. Solvent drop grinding
Metode ini mirip dengan metode dry grinding, perbedaanya adalah penambahan sejumlah kecil pelarut dalam proses pencampurannya. Dengan penambahan sedikit pelarut dapat meningkatkan laju pembentukan kokristal. Pelarut yang digunakan dalam metode ini harus dapat melarutkan minimal salah satu komponen dalam kokristal.
2.4 Kelarutan
Kelarutan didefinisikan dalam besaran kuantitatif sebagai konsentrasi zat terlarut dalam larutan jenuh pada suhu tertentu, dan secara kualitatif didefinisikan sebagai interaksi spontan dari dua atau lebih zat untuk membentuk dispersi molekuler homogen. Kelarutan dapat pula didefinisikan dengan jumlah obat per ml pelarut dimana akan larut 1 gram zat terlarut (Martin, Swarbick, &
Cammarata, 1990). Jika kelarutan suatu zat tidak diketahui dengan pasti, maka dapat ditujukkan dengan istilah berikut:
Tabel 2.1 Istilah kelarutan
Istilah kelarutan
Jumlah bagian pelarut yang diperlukan untuk melarutkan 1 bagian
zat Sangat mudah larut Kurang dari 1
Mudah larut 1 sampai 10
Larut 10 sampai 30
Agak sukar larut 30 sampai 100
Sukar larut 100 sampai 1000
Sangat sukar larut 1000 sampai 10.000 Praktis tidak larut Lebih dari 10.000
[Sumber: Martin, Swarbick, dan Cammarata, 1990]
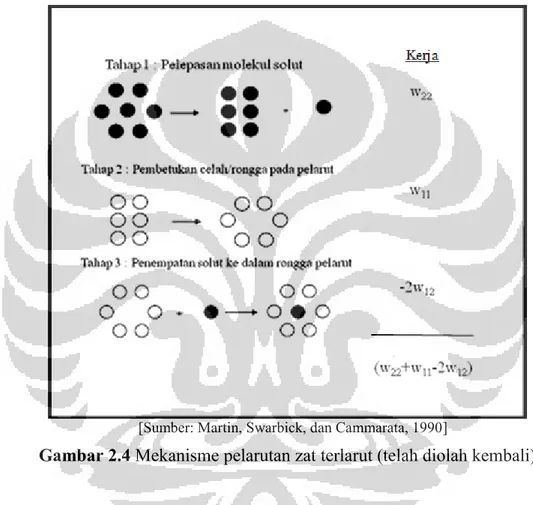
Proses pelarutan diperkirakan terjadi dalam tiga tahap, yaitu (Martin, Swarbick, dan Cammarata, 1990):
1. Tahap pertama menyangkut pemindahan satu molekul dari fase terlarut pada suhu tertentu. Kerja yang dilakukan dalam memindahkan satu molekul dari zat terlarut sehngga dapat lewat ke wujud uap membutuhkan pemecahan ikatan antara molekul-molekul yang berdekatan. Kerja pemecahan ikatan antara 2 molekul yang berdekatan adalah 2w22, dimana notasi 22 adalah interaksi antara molekul zat terlarut. Tetapi apabila molekul melepaskan diri dari fase zat terlarut, lubang yang ditinggalkannya tertutup, dan setengah dari energi yang diterima kembali. Penerimaan energi potensial atau kerja netto untuk proses ini adalah w22.
2. Tahap kedua menyangkut pembentukkan lubang dalam pelarut yang cukup besar untuk menerima molekul zat terlarut. Kerja yang dibutuhkan pada tahap ini, adalah w11, dimana angka itu adalah energi interaksi antara molekul-molekul pelarut.
3. Molekul zat terlarut akhirnya ditempatkan dalam lubang dalam pelarut, dan pertambahan kerja atau penurunan energi potensial dalam langkah ini adalah –w12. Angka 12 adalah energi interaksi antara zat terlarut dengan pelarut. Lubang dalam pelarut yang terbentuk dalam tahap 2, sekarang tertutup, dan penurunan tambahan dalam energi, -w12, terjadi, menyangkut kerja netto dalam tahap terakhir ini adalah -2w12.
[Sumber: Martin, Swarbick, dan Cammarata, 1990]
Gambar 2.4 Mekanisme pelarutan zat terlarut (telah diolah kembali)
Kelarutan merupakan suatu sifat fisika-kimia yang penting dari suatu zat, terutama kelarutan sistem dalam air. Suatu obat harus mempunyai kelarutan dalam air agar memberikan efek terapi. Agar suatu obat masuk ke sistem sirkulasi dan menghasilkan suatu efek terapeutik, pertama-tama obat harus berada dalam larutan. Senyawa-senyawa yang relatif tidak larut seringkali menunjukkan absorpsi yang tidak sempurna atau tidak menentu. Jika kelarutan obat kurang dari yang diinginkan, pertimbangan harus diberikan untuk memperbaiki kelarutnya. Metode untuk membantu kelarutan tergantung pada sifat kimia dari obat tersebut dan tipe produk obat (Ansel, 1989).
2.5 Laju Pelarutan
Pelarutan merupakan proses dimana suatu bahan kimia atau obat menjadi terlarut dalam suatu pelarut. Laju pelarutan obat-obat dengan kelarutan dalam air sangat kecil dari bentuk sediaan padat yang utuh atau terdisintegrasi dalam saluran cerna sering mengendalikan laju absorpsi sistemik obat. Pelarutan dapat dipertimbangkan sebagai tipe spesifik reaksi heterogen dimana transfer massa menghasilkan efek standar antara perpindahan dan deposisi molekul zat terlarut pada permukaan padatan. Reaksi – reaksi heterogen ini dapat diklasifikasikan menjadi tiga kategori utama yaitu:
a. Reaksi atau interaksi pada antarmuka lebih cepat dibandingkan transportasi reaktan dan produk antarmuka. Dalam hal ini kecepatan dapat dikontrol oleh proses transportasi. Untuk pelarutan, transportasi dapat berupa difusi zat terlarut dari batas antarmuka ke dalam larutan bulk.
b. Reaksi pada proses antarmuka kecepatannya lebih rendah dibandingkan dengan proses transportasi, hal ini menjadi tahapan yang mengontrol kecepatan. Pada pelarutan, hal ini dapat terjadi jika proses pembebasan dan deposisi molekul zat terlarut pada antarmuka merupakan tahapan yang menentukan kecepatan. c. Konstanta kecepatan dari kedua proses kurang lebih ekuivalen, dan dalam hal
ini, kecepatan pelarutan dapat menjadi fraksi baik laju reaksi pada antarmuka maupun laju proses transportasi.
Teori yang paling umum untuk menggambarkan proses pelarutan, yaitu teori film; juga dikenal sebagai model lapisan difusi. Teori ini mendukung dugaan bahwa pelarutan termasuk tipe pertama reaksi heterogen dimana kecepatan ditentukan oleh proses transportasi. Intinya, proses meliputi dua tahap berurutan; pertama larutan dari padatan pada antarmuka dan kedua difusi diantara bulk cairan. Tahap pertama terjadi proses pelarutan obat pada permukaan partikel padat, yang membentuk larutan jenuh di sekeliling partikel. Obat yang terlarut dalam larutan jenuh, dikenal sebagai stagnant layer, berdifusi ke pelarut dari daerah konsentrasi obaat yang tinggi ke daerah konsentrasi obat yang rendah (Abdou, 1989; Shargel dan Yu, 2005).
Laju pelarutan obat dapat dijelaskan dengan persamaan Noyes dan Whitney sebagai berikut:
𝑑𝐶 𝑑𝑡 =
𝐷𝑆
𝑉ℎ (Cs – C) (2.1)
dimana dC/dt merupakan laju pelarutan, D merupakan koefisien difusi, S
merupakan luas permukaan, h merupakan ketebalan stagnant layer, Cs adalah konsentrasi zat terlarut pada stagnant layer , C adalah konsentrasi zat terlarut pada waktu tertentu dan V merupakan volume medium.
Perubahan pada dua parameter, yaitu luas permukaan dan kelarutan, dapat menyebabkan peningkatan yang signifikan terhadap laju pelarutan obat. Namun, modifikasi pada ketebalan film h atau koefisien difusi D tidak mempengaruhi bioavailabilitasnya. Ketebalan film hanya bisa dikurangi dengan peningkatan kecepatan pengadukan, kondisi yang tidak dapat diaplikasikan untuk lingkungan in vivo. Selain itu, koefisien difusi merupakan fungsi suhu yang bersifat konstan dibawah kondisi in vivo (Abdou, 1989).
Laju pelarutan merupakan jumlah obat terlarut persatuan luas per waktu (misalnya g/cm2.menit). Dari persamaan Noyes Whitney terlihat bahwa laju pelarutan dapat dipengaruhi oleh beberapa faktor, yaitu (Shargel dan Yu, 2005) : 1. Sifat fisikokimia obat
Sifat fisika dan kimia partikel-partikel obat padat mempunyai pengaruh yang besar pada kinetika pelarutan. Luas permukaan efektif obat dapat diperbesar dengan memperkecil ukuran partikel, karena pelarutan terjadi pada permukaan partikel, maka makin besar luas permukaan makin cepat laju pelarutan. Derajat kelarutan obat dalam air juga mempengaruhi laju pelarutan.
2. Formulasi obat
Berbagai bahan tambahan dalam produk obat juga dapat mempengaruhi kinetika pelarutan obat dengan mengubah media tempat obat melarut atau bereaksi dengan obat itu sendiri. Sebagai contoh, bahan-bahan tambahan seperti bahan pensuspensi menaikkan viskositas pembawa obat dan oleh karena itu menurunkan laju pelarutan obat dari suspensi. Bahan pelincir tablet seperti magnesium stearat dapat menolak air, dan bila digunakan dalam jumlah besar dapat menurunkan pelarutan.
3. Kondisi percobaan
Kondisi percobaan juga mempengaruhi kecepatan melarut, seperti laju pengadukan, pH dan suhu medium percobaan.
2.6 Karakterisasi Kokristal
2.6.2 Analisis Gugus Fungsi
Analisis gugus fungsi dilakukukan menggunakan spektrofotometer
Fourier Transform Infra Red (FTIR). Pemilihan FTIR didasarkan atas kemampuan analisisnya yang sangat cepat dan mempunyai kepekaan tinggi sehingga dapat memantau seluruh daerah spektrum infra merah dari setiap puncak yang terelusi dengan kepekaan tinggi (Harmita, 2006).
Daerah inframerah dibagi menjadi 3 sub daerah, yaitu :
a. Sub daerah inframerah dekat ( λ = 780 nm – 2,5 µm; υ = 14290 – 4000 cm-1) b. Sub daerah inframerah sedang ( λ = 2,5 µm – 15 µm; υ = 4000 – 666 cm-1) c. Sub daerah inframerah jauh ( λ = 15 µm – 50 µm; υ = 666 – 200 cm-1)
Dari ketiga sub daerah tersebut, hanya sub daerah IR sedang yang lazim digunakan untuk elusidasi struktur senyawa organik.
Dua molekul senyawa yang berbeda struktur kimianya akan berbeda pada spektrum infra merahnya. Hal ini dapat dimengerti, karena macam ikatan yang berbeda, frekuensi vibrasinya tidak sama, serta walaupun macam ikatan sama, tetapi mereka berada dalam dua senyawa yang berbeda, frekuensi vibrasinya juga berbeda (karena kedua ikatan yang sama tersebut berada dalam lingkungan yang berbeda). Sehingga dapat dikatakan bahwa spektrum inframerah merupakan sidik jari dari suatu molekul. Dalam spektrum inframerah perlu diperhatikan letaknya (frekuensinya), bentuk (melebar atau tajam), dan intensitas pita (kuat atau lemah). (Harmita, 2006).
Adanya perubahan bentuk spektrum inframerah dapat dilihat dengan membandingkan spektrum inframerah masing-masing dari zat aktif dan koformer dengan kokristal yang terbentuk. Hal yang dapat menyebabkan perubahan spektrum inframerah adalah munculnya ikatan hidrogen pada kokristal yang sebelumnya tidak ada pada spektrum serapan baik obat dan koformer. Ikatan hidrogen pada gugus karbonil akan memperpanjang ikatan C=O. Akibatnya kekuatan ikatan C=O berkurang, sehingga pita vibrasinya muncul pada frekuensi yang lebih rendah (Harmita, 2006).
2.6.3 Uji Difraksi Sinar-X
Teknik difraksi sinar-X menjadi sangat penting dalam farmasi karena merupakan metode yang paling mudah dan cepat untuk memperoleh informasi tentang struktur kristal. Karena mayoritas senyawa obat dijumpai dalam bentuk kristal, maka pola serbuk senyawa ini sering dipakai sebagai sidik jari untuk menentukan jenis strukturnya (Soewandhi, 2006).
Difraksi merupakan fenomena penghamburan. Saat sinar X bertemu dengan padatan kristal, sinar berhamburan ke semua arah. Pada beberapa arah ini, sinar hambur berada dalam fase dan menguatkan yang lainnya untuk membentuk sinar difraksi. Hukum Bragg menjelaskan kondisi dimana hal ini mungkin terjadi. Diasumsikan bahwa sinar X monokromatik dan paralel, dengan panjang gelombang λ, merupakan saat sampel kristal berada pada sudut 𝜃. Difraksi akan terjadi jika:
nλ = 2. d sin 𝜃 (2.2)
dimana d = jarak antara bidang pada kisi – kisi kristal, dinyatakan dalam Å, dan n = orde refleksi (bilangan bulat) (Swarbrick, 2007).
Karena pola difraksi sinar-X tiap bentuk kristal dari senyawa bersifat unik, teknik ini biasanya digunakan untuk identifikasi dan karakterisasi fase padat. Difraksi sinar-X merupakan teknik pilihan untuk mengidentifikasi bentuk polimorfis yang berbeda pada suatu senyawa.
Analisis kristal tunggal sinar-X memberikan identifikasi dan uraian yang tepat dari zat kristal. Dimensi satuan sel dan sudut-sudut secara konklusif memantapkan sistem kisi kristal dan memberikan perbedaan spesifik antara bentuk-bentuk kristal dari suatu senyawa tertentu. Dengan membandingkan letak dan intensitas garis pada diagram tersebut terhadap garis pada foto sampel yang sudah diketahui, maka dapat dilakukan analisa kimia kuantitatif dan kualitatif (Martin, Swarbrick dan Cammarata, 1990).
2.6.3 Analisis Termal
Jika suatu bahan dipanaskan atau didinginkan, terdapat perbedaan pada struktur atau komposisinya. Hal ini dihubungkan dengan penukaran panas.
mengukur jumlah energi yang diabsorbsi atau dibebaskan oleh sampel saat dipanaskan, didinginkan atau dipertahankan pada suhu konstan. Energi ini dihubungkan dengan perbedaan dalam aliran panas antara sampel dengan standar (Soewandhi, 2006). Metode ini menyangkut pemanasan sampel pada kondisi yang diawasi dan mengamati perubahan fisik dan kimia yang terjadi. Dalam bidang farmasi, DSC digunakan untuk mendapatkan identitas dan kestandaran, dapat juga digunakan untuk mendapatkan kapasitas panas dan titik lebur (Martin, Swarbrick dan Cammarata, 1990).
3.1 Lokasi dan Waktu Penelitian
Penelitian ini dilakukan di Laboratorium Farmasetika dan Laboraturium Kimia Kuantitatif Departemen Farmasi Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Indonesia. Waktu Pelaksanaannya adalah dari bulan Februari hingga Mei 2012.
3.2 Alat
Peralatan yang digunakan dalam penelitian ini adalah neraca analitik (Accu-Lab), oven (Memmert, Jerman), magnetic stirrer (RT 5 Power Ika Werke), Spektrofotometer UV-VIS 1601 (Shimadzu, Jepang), Spektrofotometer Inframerah 8400S (Shimadzu, Jepang), X-Ray Diffractometer 7000 (Shimadzu, Jepang), Differential Scanning Calorimeter 60 A(Shimadzu, Jepang), mikroskop optik (Nikon model Eclipse E 200, Jepang), desikator, termometer, membran selofan 20 kDa (Wako, Jepang), lumpang, alu, kertas milipor berukuran 0,45 µm,
Terumo Syringe dan alat–alat gelas yang umum digunakan dalam laboratorium.
3.3 Bahan
Karbamazepin (Zhejiang Jiuzhou, China) , asam tartrat (Merck, Jerman), metanol (Merck, Jerman), etanol (Merck, Jerman) dan aquademineralisata (Brataco, Indonesia).
3.4 Cara Kerja
3.4.1 Pembuatan Kokristal Karbamazepin-Asam Tartrat
Kokristal karbamazepin-asam tartrat dibuat pada rasio molar 1:1 dan 2:1 sesuai bobot molekul masing-masing zat. Pembentukan kokristal dilakukan menggunakan metode penguapan pelarut dan solvent drop grinding.
Tabel 3.1 Perbandingan jumlah karbamazepin dan asam tartrat
Perbandingan Karbamazepin (mg) Asam Tartrat (mg)
1 : 0 1181,35 (5 mmol) -
1 : 1 1181,35 (5 mmol) 750,45 (5 mmol) 2 : 1 1181,35 (5 mmol) 375,23 (2,5 mmol)
3.4.1.1Metode Penguapan Pelarut
Ditimbang karbamazepin dan asam tartrat dengan perbandingan 1:0, 1:1, dan 2:1, lalu dimasukkan ke dalam beaker glass. Dilarutkan dalam 100 ml etanol suhu 70oC dengan bantuan stirrer pada kecepatan 100 rpm selama 1 jam. Kemudian suhu diturunkan 10°C setiap 30 menit hingga suhu mencapai 30°C. Larutan diuapkan pada suhu kamar (27oC±0,5°C) hingga semua etanol habis menguap dan endapan kering. Endapan yang didapat dikarakterisasi (Hickey, et al., 2007).
3.4.1.2Metode Solvent Drop Grinding
Ditimbang karbamazepin dan asam tartrat dengan perbandingan 1:0, 1:1, dan 2:1, masukkan ke dalam lumpang. Campuran digerus selama 10 menit. Campuran dipindahkan ke dalam cawan penguap, kemudian ditambah 5 ml etanol. Campuran yang didapat di keringkan kemudian dikarakterisasi (Weyna, Shattock, Vishweshwar, dan Zawarotko, 2009)
3.4.2 Pembuatan Campuran Fisik Karbamazepin-Asam Tartrat
Campuran fisik dibuat dengan perbandingan karbamazepin dan asam tartrat 1:1. Ditimbang masing-masing bahan, lalu dimasukkan ke dalam lumpang. Campuran digerus hingga homogen.
3.4.3 Pembuatan Kurva Kalibrasi Karbamazepin
Ditimbang seksama ± 50,0 mg karbamazepin, kemudian dilarutkan dengan 10 ml metanol dalam labu ukur 100,0 ml, kocok hingga larut seluruhnya.
induk, lalu dimasukkan ke dalam labu ukur 100,0 ml, dan ditambahkan aquademineralisata hingga garis batas. Kemudian pipet dan masukkan ke dalam labu ukur lalu tambahkan dengan aquademineralisata hingga diperoleh konsentrasi 4; 6; 8; 10; 12; 14 dan 16 ppm. Serapan masing – masing larutan diukur dengan spektrofotometer UV-Vis pada panjang gelombang maksimum. Panjang gelombang maksimum sampel didapatkan dari pengukuran serapan larutan 10 ppm pada daerah panjang gelombang 200 – 400 nm dengan menggunakan aquademineralisata sebagai blangkonya.
3.4.4 Penetapan Kadar Karbamazepin dalam Kokristal
Pengujian dilakukan terhadap kokristal karbamazepin-asam tartrat pada semua metode dan perbandingan serta campuran fisik karbamazepin-asam tartrat. Ditimbang seksama ± 50,0 mg sampel, kemudian dilarutkan dengan 10 ml metanol dalam labu ukur 100,0 ml, kocok hingga larut seluruhnya. Aquademineralisata ditambahkan hingga garis batas. Pipet 20,0 ml dari larutan induk, dimasukkan ke dalam labu ukur 100,0 ml, dan ditambahkan aquademineralisata hingga garis batas. Kemudian pipet 10.0 ml dan dimasukkan ke dalam labu ukur lalu ditambahkan dengan aquademineralisata hingga garis batas, diperoleh konsentrasi 10 ppm. Serapan masing – masing larutan diukur dengan spektrofotometer UV-Vis pada panjang gelombang maksimum. Kadar karbamazepin dalam kokristal dihitung menggunakan persamaan regresi linier. 3.4.5 Karakterisasi kokristal
3.4.5.1Uji Morfologi Kristal
Bentuk kristal diamati secara mikroskopis menggunakan mikroskop optik terhadap serbuk hasil kokristalisasi dengan perbandingan karbamazepin dan asam tartrat 1:0 dan 1:1. Sejumlah sampel diletakan di atas object glass dan ditutup dengan cover glass, lalu diamati di bawah mikroskop dengan perbesaran 10-40x. Hasil pengamatan di foto menggunakan kamera digital.
3.4.5.2Analisis Gugus fungsi
Analisis gugus fungsi dilakukan untuk mengetahui ada tidaknya ikatan hidrogen yang terbentuk pada pembuatan kokristal. Spektrum inframerah karbamazepin, asam tartrat, kokristal karbamazepin-asam tartrat dari semua metode dengan perbandingan 1:0, dan 1:1 serta campuran fisik karbamazepin-asam tartrat direkam menggunakan FT-IR spektrofotometer dengan metode pellet KBr. Pengukuran dilakukan pada bilangan gelombang 400 – 4000 cm-1.
3.4.5.3Uji Difraksi Sinar-X
Pola difraksi sinar-X karbamazepin, kokristal karbamazepin-asam tartrat dan campuran fisik karbamazepin-asam tartrat direkam menggunakan X-ray diffractometer dengan tuba anoda Cu, dioperasikan pada tegangan 40 kV dan arus 30 mA. Sampel dianaisis pada interval 2–50o, dengan kecepatan pemindaian 0,02o/menit (Machiste, Giunchedi, Setti dan Conte, 1995).
3.4.5.4Analisis Termal
Analisis termal dilakukan terhadap karbamazepin, kokristal karbamazepin-asam tartrat dan campuran fisik karbamazepin-karbamazepin-asam tartrat menggunakan
Differential Scanning Calorimetry (DSC). Ditimbang dengan seksama ± 4,0 mg sampel, letakkan pada silinder aluminium. Tutup silinder tersebut dengan lempeng aluminium, lalu masukkan ke dalam alat DSC. Pengukuran dilakukan dengan laju alir nitrogen 30 ml/menit, dimulai pada suhu 30oC – 250oC dengan kenaikan suhu 10oC/menit. Suhu lebur dan perubahan entalphi masing-masing sampel dicatat (Machiste, Giunchedi, Setti dan Conte, 1995; Shikhar, Bommana, Gupta dan Squillante, 2011).
3.4.5.5Uji Laju Pelarutan
Uji laju pelarutan dilakukan terhadap karbamazepin, kokristal karbamazepin-asam tartrat yang dihasilkan dari semua metode dan perbandingan serta campuran fisik karbamazepin-asam tartrat. Ditimbang dengan seksama ± 50,0 mg karbamazepin, kokristal dan campuran fisik yang setara dengan 50,0 mg karbamazepin kemudian di masukan ke dalam membran selofan. Sampel
dimasukkan ke dalam beaker glass berisi 100 ml aquademineralisata, kemudian dilarutkan dengan bantuan magnetic stirrer pada suhu 37 ± 0,5°C selama 3 jam dengan kecepatan 100 rpm. Pengambilan sampel dilakukan pada menit ke 5, 10, 15, 20, 25, 30, 35, 40, 45, 60, 90, 120 dan 180 sebanyak 5 ml dan disaring melalui filter membran 0,45 μm. Setiap pengambilan 5 ml sampel ditambahkan kembali 5 ml pelarut dengan suhu yang sama. Diukur serapannya pada panjang gelombang maksimum dengan menggunakan spektrofotometer UV-Vis (Ambrogi
4.1 Pembuatan Kokristal Karbamazepin-Asam Tartrat
Pembuatan kokristal ini bertujuan untuk meningkatkan kelarutan karbamazepin dalam air. Kokristal dibuat dengan perbandingan karbamazepin dan asam tartrat 1:1 dan 2:1. Hal ini dilakukan untuk mendapatkan kombinasi yang menunjukkan laju pelarutan paling tinggi. Karbamazepin dan asam tartrat dengan perbandingan 1:0 juga dibuat untuk melihat pengaruh proses pembentukan kokristal terhadap laju pelarutan karbamazepin tanpa adanya asam tartrat sebagai koformer. Pada penelitian ini digunakan dua metode pembentukan kokristal, yaitu metode penguapan pelarut dan metode solvent drop grinding.
Pada metode penguapan pelarut, etanol digunakan sebagai pelarut. Etanol dipilih karena pada metode ini harus dipilih pelarut dimana kedua komponen kokristal memiliki kelarutan yang sama (Qiao, Li, Schlindwein, Malek, Davies, dan Trappitt, 2011). Selain itu, pada penelitian sebelumnya etanol juga digunakan dalam pembentukan kokristal karbamazepin dengan sakarin (Hickey, et al., 2007). Karbamazepin dan asam tartrat pada semua perbandingan dilarutkan dalam 100 ml etanol pada suhu 70oC dengan bantuan stirrer pada kecepatan 100 rpm selama satu jam. Kemudian suhu diturunkan 10°C setiap 30 menit hingga suhu mencapai 30°C. Penurunan suhu ini dimaksudkan agar kondisi lewat jenuh tercapai sehingga endapan berupa kokristal mulai terbentuk (Hickey, et al., 2007). Larutan kemudian dikeringkan pada suhu kamar (27°C ± 0,5°C) hingga semua etanol menguap dan membentuk endapan kokristal.
Pada metode solvent drop grinding, karbamazepin dan asam tartrat pada semua perbandingan digerus selama 10 menit di dalam lumpang, kemudian diteteskan etanol sebanyak 5 ml ke dalam campuran hingga semua sampel terbasahi. Lalu sampel dikeringkan pada suhu kamar hingga semua etanol menguap dan membentuk kokristal.
Kehilangan bobot selama proses pembuatan dapat dilihat pada Lampiran 4. Kehilangan bobot berkisar antara 8-12%. Hal ini dikarenakan pada saat larutan dipindahkan ke dalam cawan penguap masih ada sampel yang menempel di alat-alat yang digunakan.
4.2 Pembuatan Campuran Fisik Karbamazepin-Asam Tartrat
Pembuatan campuran fisik karbamazepin-asam tartrat bertujuan melihat pengaruh adanya asam tartrat terhadap laju pelarutan karbamazepin. Campuran fisik dibuat dengan menggerus karbamazepin dan asam tartrat hingga homogen.
4.3 Pembuatan Kurva Kalibrasi
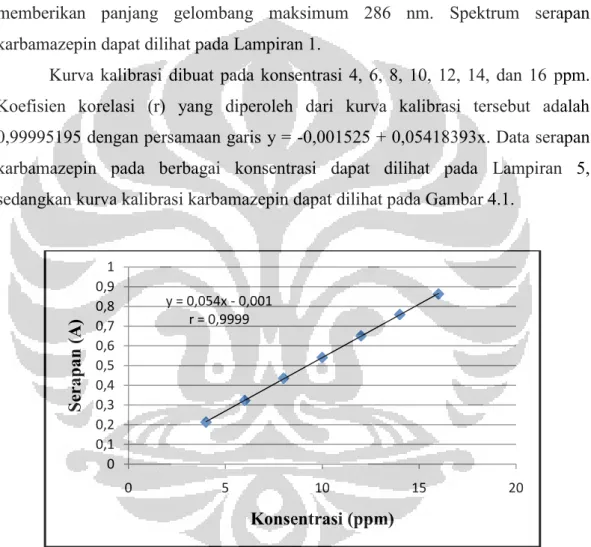
Kurva serapan karbamazepin dalam medium aquademineralisata memberikan panjang gelombang maksimum 286 nm. Spektrum serapan karbamazepin dapat dilihat pada Lampiran 1.
Kurva kalibrasi dibuat pada konsentrasi 4, 6, 8, 10, 12, 14, dan 16 ppm. Koefisien korelasi (r) yang diperoleh dari kurva kalibrasi tersebut adalah 0,99995195 dengan persamaan garis y = -0,001525 + 0,05418393x. Data serapan karbamazepin pada berbagai konsentrasi dapat dilihat pada Lampiran 5, sedangkan kurva kalibrasi karbamazepin dapat dilihat pada Gambar 4.1.
Gambar 4.1 Kurva kalibrasi karbamazepin dalam medium aquademineralisata pada panjang gelombang 286 nm
4.4 Penetapan Kadar Karbamazepin
Penetapan kadar karbamazepin dilakukan untuk mengetahui jumlah karbamazepin yang terkandung dalam kokristal dari semua perbandingan. Masing-masing sampel dibuat dalam konsentrasi 10 ppm lalu diukur serapannya menggunakan spektrofotometer UV- Vis pada panjang gelombang 286 nm. Kadar
y = 0,054x - 0,001 r = 0,9999 0 0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8 0,9 1 0 5 10 15 20 S er ap an (A ) Konsentrasi (ppm)
karbamazepin terbesar adalah 92,24% yang terdapat pada sampel yang dihasilkan dari metode solvent drop grinding dengan perbandingan 1:0, sedangkan kadar terkecil adalah 51,93% yang terdapat pada sampel yang dihasilkan dari metode penguapan pelarut dengan perbandingan 1:1.
Hasil penetapan kadar ini akan dijadikan tolak ukur untuk penimbangan pada uji laju pelarutan, agar jumlah karbamazepin yang digunakan sama. Kadar karbamazepin dari tiap perbandingan dan metode serta jumlah penimbangan sampel yang digunakan untuk laju pelarutan dapat dilihat pada Lampiran 6.
4.5 Karakterisasi Kokristal
4.5.1 Uji Morfologi Kristal
Secara makroskopik, kokristal yang diperoleh dari metode penguapan pelarut berupa kristal berwarna putih agak kekuningan dan berbentuk seperti jarum, sedangkan pada metode solvent drop grinding berupa serbuk berwarna putih. Kokristal yang diperoleh dari metode solvent drop grinding lebih kecil dibandingkan dengan kokristal yang diperoleh dari metode penguapan pelarut. Bentuk makroskopik sampel dapat dilihat pada Gambar 4.2.
Pada pengamatan mikroskopik, kokristal yang dihasilkan dari metode penguapan pelarut memiliki bentuk kristal prismatik, sedangkan kokristal yang dihasilkan dari metode solvent drop grinding memiliki bentuk tidak beraturan. Perbedaan bentuk ini diperkirakan terjadi karena pada metode solvent drop grinding terdapat proses penggerusan sehingga serbuk yang dihasilkan lebih kecil. Selain itu, proses penurunan suhu secara bertahap yang terdapat pada metode penguapan pelarut akan menghasilkan kristal besar (Soewandhi, 2006). Bentuk mikroskopik sampel dapat dilihat pada Gambar 4.3.
Keterangan: (a) metode penguapan pelarut perbandingan 1:0, (b) metode penguapan pelarut
perbandingan 1:1, (c) metode solvent drop grinding perbandingan 1:0, dan (d)
metode solvent drop grinding perbandingan 1:1.
Gambar 4.2. Bentuk makroskopik serbuk hasil kokristalisasi
(a) (b)
Keterangan: (a) metode penguapan pelarut perbandingan 1:0, (b) metode penguapan pelarut
perbandingan 1:1, (c) metode solvent drop grinding perbandingan 1:0, dan (d)
metode solvent drop grinding perbandingan 1:1.
Gambar 4.3. Bentuk mikroskopik serbuk hasil kokristalisasi
4.5.2 Analisis Gugus Fungsi
Uji spektroskopi inframerah dilakukan terhadap karbamazepin murni, asam tartrat, kokristal perbandingan 1:1 dari metode penguapan pelarut dan metode solvent drop grinding serta campuran fisik karbamazepin-asam tartrat dengan perbandingan 1:1.
Spektroskopi inframerah digunakan untuk mengetahui adanya interaksi antara obat dengan koformer pada kokristal. Dengan spektroskopi inframerah, adanya pembentukkan kokristal dapat dideteksi, yaitu dengan terbentuknya ikatan hidrogen antara obat dan koformer. Pada kokristal karbamazepin-asam tartrat, ikatan hidrogen terbentuk antara gugus karbonil pada karbamazepin dengan gugus
(a) (b)
hidroksil pada asam tartrat atau antara gugus karbonil pada asam tartrat dengan gugus amin pada karbamazepin.
Dari pengamatan terhadap spektrum inframerahnya, puncak-puncak utama karbamazepin murni terlihat pada 3466,20 cm-1, 1604,83 cm-1 dan 1595,18 cm-1 untuk NH serta 1678,13 cm-1 untuk C=O amida. Spektrum inframerah asam tartrat menunjukkan puncak pada bilangan gelombang 2771-3500 cm-1 untuk OH karboksilat dan 1770,71 cm-1 untuk C=O asam karboksilat.
Pada spektum inframerah kokristal metode penguapan pelarut perbandingan 1:1 dan metode solvent drop grinding perbandingan 1:1 terlihat pergeseran puncak gugus C=O amida dari 1678,13 cm-1 menjadi 1670,41 cm-1 akibat adanya ikatan hidrogen antara OH asam tartrat dengan C=O amida karbamazepin yang memperpanjang ikatan C=O. Akibatnya, kekuatan ikatan C=O berkurang, sehingga pita vibrasinya akan muncul pada frekuensi yang lebih rendah. Pergeseran puncak juga terlihat pada gugus C=O asam karboksilat. Puncak bergeser dari 1770,71 cm-1 menjadi 1739,85 cm-1. Pergeseran puncak ini diduga karena terbentuknya ikatan hidrogen antara C=O pada asam karboksilat dengan NH pada amida. Adanya ikatan hidrogen ini menunjukkan kokristal karbamazepin-asam tartrat telah terbentuk. Spektrum inframerah kokristal metode penguapan pelarut perbandingan 1:1 dapat dilihat pada Gambar 4.4, sedangkan spektrum inframerah kokristal metode solvent drop grinding perbandingan 1:1 dapat dilihat pada Gambar 4.5.
Pada karbamazepin yang dihasilkan dari metode solvent drop grinding
dengan perbandingan 1:0, tidak terlihat perubahan spektrum serapan inframerah yang signifikan. Puncak yang menunjukkan gugus C=O dan NH amida muncul pada bilangan gelombang yang sama dengan karbamazepin murni. Spektrum inframerah karbamazepin yang dihasilkan dari metode solvent drop grinding
dengan perbandingan 1:0 dapat dilihat pada Gambar 4.6.
Spektrum inframerah karbamazepin hasil rekristalisasi, metode penguapan pelarut dengan perbandingan 1:0, memperlihatkan puncak NH amida pada bilangan gelombang sekitar 3000 cm-1 yang lebih lebar jika dibandingkan dengan karbamazepin murni. Diduga hal ini terjadi karena terbentuknya karbamazepin dihidrat. Pada penelitian sebelumnya disebutkan bahwa terbentuknya
karbamazepin dihidrat dapat dilihat dari melebarnya puncak NH akibat ikatan hidrogen dengan air (Otsuka, Ofusa dan Matsuda, 1999). Spektrum inframerah karbamazepin hasil rekristalisasi dapat dilihat pada Gambar 4.7.
Pada spektrum inframerah campuran fisik karbamazepin-asam tartrat dengan perbandingan 1:1, tidak terlihat perbedaan jika dibandingkan dengan karbamazepin murni. Hal ini menunjukkan tidak terbentuk ikatan kimia antara karbamazepin dan asam tartrat. Spektrum inframerah campuran fisik karbamazepin-asam tartrat dapat dilihat pada Gambar 4.8.
4.5.3 Uji Difraksi Sinar-X
Karakterisasi kokristal dengan difraktometer sinar-X dilakukan untuk mengetahui adanya perbedaan bentuk kristal pada dua metode yang digunakan dalam pembentukan kokristal.
Difraktogram yang dihasilkan menunjukkan peningkatan intensitas jika dibandingkan dengan difraktogram karbamazepin murni. Peningkatan paling signifikan terlihat pada difraktogram karbamazepin hasil rekristalisasi (metode penguapan pelarut perbandingan 1:0). Peningkatan intensitas ini merupakan hasil dari peningkatan jumlah kisi kristal karbamazepin yang telah mengalami proses kristalisasi.
Gambar 4.4 Hasil overlay spektrum inframerah karbamazepin murni (hitam), asam tartrat (hijau) dan kokristal karbamazepin-asam tartrat metode penguapan pelarut perbandingan 1:1 (biru)
Bilangan Gelombang (1/cm) Tr an sm isi ( %) 450 600 750 900 1050 1200 1350 1500 1650 1800 1950 2100 2400 2700 3000 3300 3600 3900 1/cm 7.5 15 22.5 30 37.5 45 52.5 60 67.5 75 82.5 90 %T 34 77 .7 7 32 01 .9 4 17 39 .8 5 16 70 .4 1 15 93 .2 5 14 92 .9 5 14 27 .3 7 1253 .7 7 80 6. 27 77 1. 55 650.03 35 00 .9 2 27 71 .8 0 17 70 .7 1 16 95 .4 9 11 22 .6 1 34 66 .2 0 3163 .3 6 16 78 .1 3 16 04 .8 3 15 95 .1 8 14 89 .1 0 13 84 .9 4 13 07 .7 8 12 46 .0 6 76 5. 77 Pel A As CBZ A C=O amida C=O asam karboksilat C=O amida Un ive rsitas Ind o n es
Gambar 4.5 Hasil overlay spektrum inframerah karbamazepin murni (hitam), asam tartrat (hijau) dan kokristal karbamazepin-asam tartrat metode solvent drop grinding perbandingan 1:1 (biru)
450 600 750 900 1050 1200 1350 1500 1650 1800 1950 2100 2400 2700 3000 3300 3600 3900 1/cm 10 15 20 25 30 35 40 45 50 55 60 65 70 75 80 85 90 %T 34 77 .7 7 33 50 .4 6 31 98 .0 8 30 99 .7 1 17 39 .8 5 16 70 .4 1 15 91 .3 3 14 91 .0 2 14 17 .7 3 80 6. 27 76 9. 62 65 0. 03 35 00 .9 2 27 71 .8 0 17 70 .7 1 16 95 .4 9 11 22 .6 1 34 66 .2 0 3163 .3 6 16 78 .1 3 16 04 .8 3 15 95 .1 8 14 89 .1 0 13 84 .9 4 13 07 .7 8 12 46 .0 6 76 5. 77 SDG A As CBZ A Bilangan Gelombang (1/cm) Tr an sm isi ( %) C=O asam karboksilat C=O amida Un ive rsitas Ind o n
Gambar 4.6 Hasil overlay spektrum inframerah karbamazepin murni (hitam), dan karbamazepin dari metode solvent drop grinding perbandingan 1:0 (hijau) Tr an sm isi ( %) Bilangan Gelombang (1/cm) 450 600 750 900 1050 1200 1350 1500 1650 1800 1950 2100 2400 2700 3000 3300 3600 3900 1/cm 7.5 15 22.5 30 37.5 45 52.5 60 67.5 75 82.5 90 97.5 %T 34 66 .2 0 3173 .0 1 16 78 .1 3 16 04 .8 3 14 89 .1 0 13 86 .8 6 800. 49 76 3. 84 648. 10 34 66 .2 0 3163.3 6 16 78 .1 3 16 04 .8 3 15 95 .1 8 14 89 .1 0 13 84 .9 4 13 07 .7 8 12 46 .0 6 76 5. 77 SDG CBZ CBZ A C=O amida NH amida Un ive rsitas Ind o n es ia
Gambar 4.7 Hasil overlay spektrum inframerah karbamazepin murni (hitam), dan karbamazepin dari metode penguapan pelarut perbandingan 1:0 (biru) Bilangan Gelombang (1/cm) Tr an sm isi ( %) 450 600 750 900 1050 1200 1350 1500 1650 1800 1950 2100 2400 2700 3000 3300 3600 3900 1/cm 20 25 30 35 40 45 50 55 60 65 70 75 80 85 90 %T 35 66 .5 0 3192 .3 0 16 70 .4 1 15 93 .2 5 15 93 .2 5 1496.8 1 14 17 .7 3 11 61 .1 9 950.94 88 3. 43 34 66 .2 0 3163 .3 6 16 78 .1 3 16 04 .8 3 15 95 .1 8 14 89 .1 0 13 84 .9 4 13 07 .7 8 12 46 .0 6 76 5. 77 rekrist 28 mei CBZ rekrist 28 mei C=O amida NH amida Un ive rsitas Ind o n
Gambar 4.8 Hasil overlay spektrum inframerah karbamazepin murni (abu-abu), asam tartrat (hijau) dan campuran fisik karbamazepin-asam tartrat perbandingan 1:1 (biru)
Tr an sm isi ( %) Bilangan Gelombang (1/cm) 450 600 750 900 1050 1200 1350 1500 1650 1800 1950 2100 2400 2700 3000 3300 3600 3900 1/cm 10 15 20 25 30 35 40 45 50 55 60 65 70 75 80 85 90 %T 34 66 .2 0 32 75 .2 4 30 80 .4 2 16 78 .1 3 16 04 .8 3 13 86 .8 6 802. 41 76 3. 84 34 66 .2 0 3163 .3 6 16 78 .1 3 16 04 .8 3 15 95 .1 8 14 89 .1 0 13 84 .9 4 13 07 .7 8 12 46 .0 6 76 5. 77 35 00 .9 2 27 71 .8 0 17 70 .7 1 16 95 .4 9 11 22 .6 1 kiki 11 CF CBZ As kiki 1:1 CF C=O amida NH amida Un ive rsitas Ind o n es ia
Gambar 4.9 Difraktogram karbamazepin murni
Pembentukan kokristal dapat menyebabkan perubahan difraktogram yang memperlihatkan beberapa puncak baru. Difraktogram kokristal metode penguapan pelarut dan metode solvent drop grinding perbandingan 1:1 menunjukkan puncak baru pada 2θ = 6,6° yang diperkirakan muncul karena terbentuknya kokristal. Pada penelitian sebelumnya, kokristal karbamazepin memberikan puncak baru pada 2θ = 7° (Hickey, et al., 2007).
Gambar 4.10 Difraktogram kokristal karbamazepin-asam tartrat metode penguapan pelarut perbandingan 1:1
In ten sitas ( cp s) 2θ (°) 6,6 In ten sitas ( cp s) 2θ (°)
Gambar 4.11 Difraktogram kokristal karbamazepin-asam tartrat metode solvent drop grinding perbandingan 1:1
Pada difraktogram metode penguapan pelarut perbandingan 1:0, terlihat puncak baru pada 2θ = 9,02° dan 12,32°, sedangkan pada difraktogram metode
solvent drop grinding perbandingan 1:0, terlihat puncak baru pada 2θ = 8,80° dan 13,06°. Diduga puncak-puncak baru ini menunjukkan bahwa telah terbentuk karbamazepin dihidrat. Penelitian sebelumnya pada karbamazepin dihidrat memberikan puncak pada 2θ yang relatif sama. Puncak yang mengindikasikan karbamazepin dihidrat adalah pada 2θ = 8,9°, dan 12,3° (Han dan Suryanarayanan, 1997).
Gambar 4.12 Difraktogram karbamazepin dari metode penguapan pelarut dengan perbandingan 1:0 2θ (°) In ten sitas ( cp s) 9,02 12,32 2θ (°) In ten sitas ( cp s) 6,6
Gambar 4.13 Difraktogram karbamazepin dari metode solvent drop grinding
dengan perbandingan 1:0
Difraktogram campuran fisik karbamazepin dan asam tartrat dengan perbandingan 1:1 menunjukkan peningkatan intensitas jika dibandingkan dengan karbamazepin murni. Hal ini diperkirakan karena adanya asam tartrat yang berbentuk kristal.
Gambar 4.14 Difraktogram campuran fisik karbamazepin-asam tartrat perbandingan 1:1 2θ (°) In ten sitas ( cp s) 2θ (°) In ten sitas ( cp s) 8,80 13,06
4.5.4 Analisis Termal
Analisis termal digunakan untuk menentukan pembentukan kokristal dari informasi yang didapatkan berupa sifat peleburan serta fenomena polimorfisme. Analisis termal yang dilakukan pada rentang suhu 30°C hingga 250°C dengan laju pemanasan 10°C/menit menunjukkan terjadinya pergeseran puncak endotermik serta perubahan entalpi.
Termogram dari karbamazepin murni menunjukkan puncak endotermik pada suhu 175,80°C dan 190,38°C. Puncak endotermik pada suhu 175,80°C merupakan titik lebur karbamazepin bentuk III, sedangkan puncak endotermik pada suhu 190,38°C merupakan titik lebur karbamazepin bentuk I. Hal ini sesuai dengan penelitian sebelumnya yang menghasilkan puncak endotermik pada suhu yang relatif sama, yaitu 175,5°C untuk karbamazepin bentuk III dan 191,7°C untuk karbamazepin bentuk I (Ambrogi et al., 2008).
Keterangan: Analisis dilakukan pada suhu 30°C-250°C dengan kenaikan suhu 10°C/menit dan laju alir nitrogen 30 ml/menit; menunjukkan puncak endotermik pada suhu 175,80°C (ΔH = 7,90 kJ/kg) dan 190,38°C (ΔH = 54,08 kJ/kg) .
Gambar 4.15 Termogram Differential Scanning Calorimetry (DSC) karbamazepin murni.
Termogram kokristal karbamazepin-asam tartrat dari metode penguapan pelarut dan metode solvent drop grinding menunjukkan penurunan titik lebur yang signifikan. Pada kokristal metode penguapan pelarut, puncak terlihat pada
L aju Alir an Pan as ( m W ) Suhu (°C) 175,80°C ΔH = 7,90 kJ/kg 190,38°C ΔH = 54,08 kJ/kg
suhu 156,40°C. Sedangkan pada kokristal metode solvent drop grinding puncak terlihat pada suhu 143,38°C. Penurunan titik lebur ini menunjukkan adanya interaksi antara karbamazepin dan asam tartrat sehingga terbentuk kokristal. Hal ini sesuai dengan penelitian sebelumnya yang menyebutkan bahwa titik lebur kokristal berada di antara atau lebih rendah dibandingkan titik lebur zat aktif dan koformer (Qiao, Li, Schlindwein, Malek, Davies, dan Trappitt, 2011). Termogram kokristal karbamazepin-asam tartrat dari metode penguapan pelarut dapat dilihat pada Gambar 4.16, sedangkan termogram kokristal karbamazepin-asam tartrat dari metode solvent drop grinding dapat dilihat pada Gambar 4.17.
Keterangan: Analisis dilakukan pada suhu 30°C-250°C dengan kenaikan suhu 10°C/menit dan laju alir nitrogen 30 ml/menit; menunjukkan puncak endotermik pada suhu 156,40°C (ΔH = 105,55 kJ/kg).
Gambar 4.16 Termogram Differential Scanning Calorimetry (DSC) kokristal karbamazepin-asam tartrat metode penguapan pelarut perbandingan 1:1
L aju Alir an Pan as ( m W ) Suhu (°C) 156,40°C ΔH = 105,55 kJ/kg
Keterangan: Analisis dilakukan pada suhu 30°C-250°C dengan kenaikan suhu 10°C/menit dan laju alir nitrogen 30 ml/menit; menunjukkan puncak endotermik pada suhu 143,38°C (ΔH = 110,56 kJ/kg).
Gambar 4.17 Termogram Differential Scanning Calorimetry (DSC) kokristal karbamazepin-asam tartrat metode solvent drop grinding perbandingan 1:1
Termogram karbamazepin hasil rekristalisasi (metode penguapan pelarut dengan perbandingan 1:0) menunjukkan puncak-puncak endotermik pada suhu 94,57°C, 125,84°C, 134,87°C, 144,26°C, dan 190,12°C serta puncak eksotermik pada suhu 253,01°C, sedangkan termogram karbamazepin metode solvent drop grinding dengan perbandingan 1:0 menunjukkan puncak-puncak endotermik pada suhu 92,12°C, 100,33°C, 170,81°C dan 192,68°C serta puncak eksotermik pada suhu 235,17°C. Adanya puncak endotermik pada suhu 92,12°C, 94,57°C, dan 100,33°C diperkirakan karena terbentuknya karbamazepin dihidrat, sedangkan puncak-puncak endotermik yang lain menunjukkan titik lebur dari berbagai bentuk polimorf karbamazepin. Penelitian sebelumnya menyebutkan bahwa adanya puncak pada suhu 85-100°C menunjukkan terjadinya proses dehidrasi karbamazepin dihidrat (Han dan Suryanarayanan, 1997). Termogram karbamazepin dari metode penguapan pelarut dengan perbandingan 1:0 dapat dilihat pada Gambar 4.18, sedangkan termogram karbamazepin dari metode
solvent drop grinding dengan perbandingan 1:0 dapat dilihat pada Gambar 4.19.
L aju Alir an Pan as ( m W ) Suhu (°C) 143,38°C ΔH = 110,56 kJ/kg
Keterangan: Analisis dilakukan pada suhu 30°C-250°C dengan kenaikan suhu 10°C/menit dan laju alir nitrogen 30 ml/menit; menunjukkan puncak endotermik pada suhu 94,57°C (ΔH = 62,24 kJ/kg), 125,84°C (ΔH = 2,5 kJ/kg), 134,87°C (ΔH = 54,55 kJ/kg), 144,26°C (ΔH = 90,74 kJ/kg), dan 190,12°C (ΔH = 50,6 kJ/kg) serta puncak eksotermik pada suhu 253,01°C (ΔH = 15,66 kJ/kg).
Gambar 4.18 Termogram Differential Scanning Calorimetry (DSC) karbamazepin dari metode penguapan pelarut dengan perbandingan 1:0
Keterangan: Analisis dilakukan pada suhu 30°C-250°C dengan kenaikan suhu 10°C/menit dan laju alir nitrogen 30 ml/menit; menunjukkan puncak endotermik pada suhu 92,12°C (ΔH = 9,88 kJ/kg), 100,33°C (ΔH = 10,51 kJ/kg), 170,81°C (ΔH = 5,88 kJ/kg), dan 192,68°C (ΔH = 54,55 kJ/kg) serta puncak eksotermik pada suhu 235,17°C (ΔH = 8,42 kJ/kg).
Gambar 4.19 Termogram Differential Scanning Calorimetry (DSC) karbamazepin dari metode solvent drop grinding dengan perbandingan 1:0
L aju Alir an Pan as ( m W ) 192,68°C ΔH = 54,55 kJ/kg 100,33°C ΔH = 10,51 kJ/kg 92,12°C ΔH = 9,88kJ/kg Suhu (°C) 170,81°C ΔH = 5,88 kJ/kg 235,17°C ΔH = 8,42 kJ/kg L aju Alir an Pan as ( m W ) Suhu (°C) 94,57°C ΔH = 62,24 kJ/kg 190,12°C ΔH = 50,60 kJ/kg 144,26°C ΔH = 90,74 kJ/kg 134,87°C ΔH = 54,55 kJ/kg 125,84°C ΔH = 2,5 kJ/kg 253,01°C ΔH = 15,66 kJ/kg

![Gambar 2.1 Struktur kimia karbamazepin (telah diolah kembali) Nama kimia : 5H-Dibenz[b,f]azepine-5-carboxamide](https://thumb-ap.123doks.com/thumbv2/123dok/2354877.2197364/18.892.178.732.211.831/gambar-struktur-karbamazepin-diolah-kembali-dibenz-azepine-carboxamide.webp)