i
POTENSI ANTIBAKTERI EKSTRAK ETANOL TEH HIJAU TERHADAP Streptococcus mutans PENYEBAB KARIES GIGI
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Farmasi
Oleh:
Adelia Indah Pratiwi NIM: 088114119
FAKULTAS FARMASI UNIVERSITAS SANATA DHARMA
ii
POTENSI ANTIBAKTERI EKSTRAK ETANOL TEH HIJAU TERHADAP Streptococcus mutans PENYEBAB KARIES GIGI
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Farmasi
Oleh:
Adelia Indah Pratiwi NIM: 088114119
FAKULTAS FARMASI UNIVERSITAS SANATA DHARMA
v
HALAMAN PERSEMBAHAN
Kuatkan dan teguhkanlah hatimu. Janganlah kecut dan tawar hati,
sebab Tuhan, Allahmu, menyertai engkau, ke mana pun engkau pergi.
(Yosua 1:9)
Mintalah, maka akan diberikan kepadamu; carilah, maka kamu akan
mendapat; ketoklah, maka pintu akan dibukakan bagimu. Karena
setiap orang yang meminta, menerima dan setiap orang yang mencari,
mendapat dan setiap orang yang mengetok, baginya pintu dibukakan.
(Matius 7:7-8)
Jika engkau makan atau jika engkau minum, atau jika engkau
melakukan sesuatu yang lain, lakukanlah semuanya itu untuk
kemuliaan Allah. (1 kor 10:31)
Karya
ini
kupersembahkan
untuk:
Tuhan
Yesus
Kristus
yang
Maha
Pengasih
yang
selalu
menyertai
dan
membimbingku,
Mama,
papa,
ooh
Adit
dan
Samuel
tercinta,
Senpaiku
tercinta,
Dr.
Christina
Siwi
Handayani
yang
selalu
mendukungku,
Teman
‐
teman
Kenshi
Sanata
Dharma
Teman
baikku,
Yanuar
Prasetya,
vii
PRAKATA
Puji dan syukur penulis panjatkan kepada Tuhan Yang Maha Esa atas berkat, rahmat, tuntunan serta penyertaan dan kasih karunia yang telah diberikanNya sehingga penulis dapat menyelesaikan penelitian dan penyusunan skripsi yang berjudul “Potensi Antibakteri Infusa Teh Hijau terhadap
Streptococcus mutans Penyebab Karies Gigi” dengan baik sebagai salah satu syarat untuk memperoleh gelar Kesarjanaan Strata Satu (S1) Sarjana Farmasi (S.Farm) di Fakultas Farmasi Universitas Sanata Dharma Yogyakarta.
Penulis menyadari bahwa keberhasilan penulisan skripsi ini tidak terlepas dari bantuan serta dukungan dari berbagai pihak secara langsung maupun tidak langsung baik berupa moral, materiil maupun spiritual. Oleh sebab itu, penulis menghaturkan banyak terima kasih kepada:
1. Bapak Ipang Djunarko, M.Si., Apt. selaku Dekan Fakultas Farmasi Universitas Sanata Dharma.
2. Yohanes Dwiatmaka, M.Si selaku Dosen Pembimbing dan Penguji yang memberikan saran dan kritik serta dukungan kepada penulis dalam proses menyempurnakan naskah skripsi.
viii
4. Agustina Setiawati, M.Sc., Apt. selaku Dosen Penguji yang bersedia meluangkan waktu untuk menguji dan memberikan kritik dan saran kepada penulis.
5. Ibu Maria Dwi Budi Jumpowati, S.Si. yang telah bersedia meluangkan waktu untuk berdiskusi, memberi semangat serta masukan kepada penulis.
6. Teman-teman kelompok penelitian, Yanuar Prasetya, Maria Siska Triyuniar Kusumastuti, dan Irene Aninditya Putri Ahtha atas segala kerjasama dan dukungan semangat yang telah diberikan selama penelitian ini.
7. Kenshi-kenshi Universitas Sanata Dharma yang telah memberikan dukungan semangat dan kerjasama dalam mengurus UKM Kempo Sanata Dharma selama penulisan skripsi ini.
8. Teman-teman kos Amakusaku tercinta: ci Theresia Aryani, Triana Oktavia, Margaretha Ratih Vitaningrum, Berta Trifina, Herta Rinda, Tiatira Metri, Margaretha Christina Halim, kak Retha, kak Yemima Haryono atas segala kebersamaan, canda tawa, semangat dan kerjasama yang telah diberikan kepada penulis selama ini.
9. Teman-teman KKN ku tercinta: Fabiana Adi Kusumaningrum, Albertus Harimurti, Bennydiktus, Ermenilda Sehrina, Cecilia Novianti Salsinanha, Apriyani Susanti dan Paulina Ratnaningrum terimakasih untuk canda tawa dan kebersamaan kita selama ini.
ix
penulis selama penyusunan skripsi ini hingga dapat terselesaikan dengan baik.
Penulis menyadari bahwa tidak ada yang sempurna dalam kehidupan ini. Oleh karena itu, penulis sangat mengharapkan kritik dan saran agar skripsi ini dapat menjadi lebih baik. Semoga Tuhan selalu memberkati semua pihak yang telah membantu penulis dalam menyelesaikan skripsi ini.
xi
DAFTAR ISI
Halaman
HALAMAN JUDUL ... ii
HALAMAN PERSETUJUAN PEMBIMBING ... iii
HALAMAN PENGESAHAN ... iv
HALAMAN PERSEMBAHAN ... v
PERNYATAAN PERSETUJUAN PUBLIKASI ... vi
PRAKATA ... vii
PERNYATAAN KEASLIAN KARYA ... x
xii
E. Streptococcus mutans ... 18
F. Pengujian Potensi Antibakteri ... 21
1. Uji difusi ... 21
2. Uji dilusi ... 22
G. Landasan Teori ... 24
H. Hipotesis ... 25
BAB III. METODE PENELITIAN ... 26
A. Jenis dan Rancangan Penelitian ... 26
B. Variabel Penelitian dan Definisi Operasional ... 26
1. Variabel penelitian ... 26
2. Definisi operasional ... 27
C. Bahan ... 28
D. Alat ... 29
E. Tata Cara Penelitian ... 29
1. Identifikasi teh hijau ... 29
2. Pembuatan serbuk teh hijau ... 30
xiii
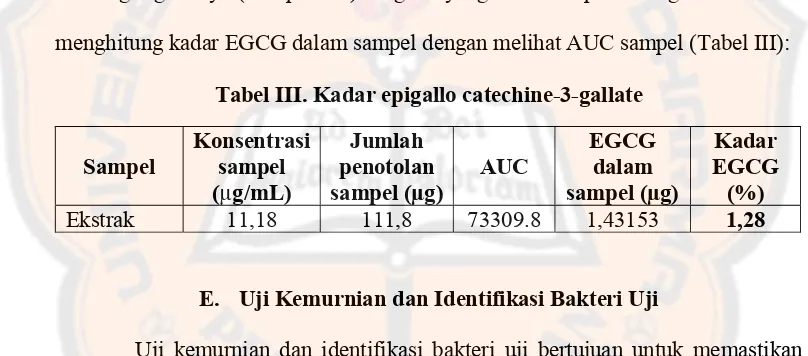
4. Verifikasi kualitatif-kuantitatif kandungan senyawa epigallocatechin gallate (EGCG) dengan Kromatografi Lapis Tipis (KLT) dan Densitometri ...
30
5. Uji kemurnian dan identifikasi bakteri uji ... 31
6. Uji potensi antibakteri ekstrak etanol teh hijau terhadap S.mutans dengan metode difusi paper disc ... 33 7. Uji penentuan nilai KHM dan KBM ekstrak etanol teh hijau terhadap S.mutans dengan metode dilusi cair ... 36 F. Tata Cara Analisis Hasil ... 37
BAB IV HASIL DAN PEMBAHASAN ... 39
A. Identifikasi Daun Teh Hijau ... 39
B. Pembuatan Serbuk Teh Hijau ... 39
C. Pembuatan Ekstrak Etanol Teh Hijau ... 40
D. Verifikasi Kualitatif-Kuantitatif Kandungan Senyawa Epigallocatechin Gallate (EGCG) dengan Kromatografi Lapis Tipis (KLT) dan Densitometri ... 41 E. Uji Kemurnian dan Identifikasi Bakteri Uji ... 42
F. Uji Potensi Antibakteri Ekstrak Etanol Teh Hijau terhadap S.mutans dengan Metode Difusi Paper Disc.. 46 1. Pembuatan variasi konsentrasi ekstrak etanol teh hijau ... 46 2. Pembuatan media Nutrient Agar ... 47
3. Pembuatan media Nutrient Broth ... 48
4. Pembuatan suspensi bakteri uji ... 49 5. Uji potensi ekstrak etanol teh hijau terhadap
S.mutans secara difusi paper disc ...
xiv
G. Uji Penentuan Nilai KHM dan KBM Ekstrak Etanol Teh Hijau terhadap S.mutans dengan Metode Dilusi Cair ...
54
1. Pembuatan variasi konsentrasi ekstrak etanol ... 55
2. Uji penentuan nilai KHM-KBM ekstrak etanol teh hijau terhadap S.mutans dengan metode dilusi cair ... 56 3. Penegasan hasil untuk penentuan nilai KHM dan KBM ... 56 4. Uji penegasan hasil dengan metode streak plate ... 58 BAB V. KESIMPULAN DAN SARAN ... 60
A. Kesimpulan …... 60
B. Saran …... 60
DAFTAR PUSTAKA ... 61
LAMPIRAN ... 64
xv
DAFTAR TABEL
Tabel I. Pengenceran ekstrak etanol teh hijau ... 34
Tabel II. Pengenceran standar EGCG ... 42
Tabel III. Kadar epigallocatechine gallate ... 42
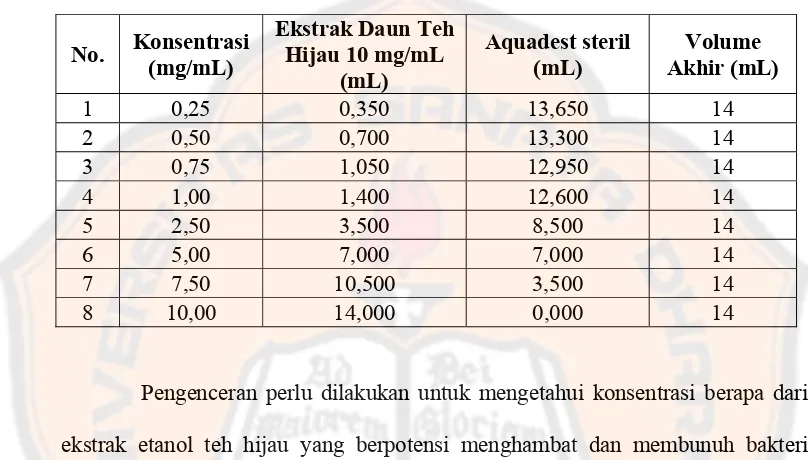
Tabel IV. Pengenceran ekstrak etanol teh hijau ... 47
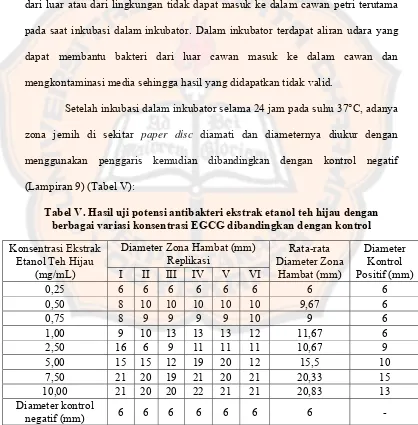
Tabel V. Hasil uji potensi antibakteri ekstrak etanol teh hijau dengan berbagai konsentrasi EGCG dibandingkan dengan kontrol ...
52
Tabel VI. Hasil pengukuran OD dengan spektrofotometer
Visible pada λmax 600 nm ...
xvi
DAFTAR LAMPIRAN
Lampiran 1. Surat keterangan identifikasi teh hijau ... 64
Lampiran 2. Certificate of Analysis Ekstrak Etanol Teh Hijau ... 65
Lampiran 3. Proses Ekstraksi Ekstrak Etanol Teh Hijau ... 66
Lampiran 4. Data Hasil Ekstraksi Ekstrak Etanol Teh Hijau ... 67
Lampiran 5. Penentuan Senyawa Identitas Ekstrak Etanol Teh Hijau Secara Kualitatif dan Kuantitatif ... 68 Lampiran 6. Profil Kromatogram Ekstrak Etanol Teh Hijau ... 69
Lampiran 7. Hasil uji kemurnian dan pembuatan stok kultur murni bakteri uji S. mutans ... 70 Lampiran 8. Dokumentasi Uji Kemurnian dan Identifikasi S. mutans .. 71
Lampiran 9. Dokumentasi Uji Potensi Ekstrak Etanol Teh Hijau ... 74
Lampiran 10. Hasil Uji Kruskal-Wallis Diameter Zona Hambat yang Dihasilkan pada Uji Potensi Antibakteri Ekstrak Etanol Teh Hijau dengan Berbagai Variasi Konsentrasi EGCG terhadap S. mutans dengan Difusi Paper Disc ...
80
Lampiran 11. Data Uji Post Hoc (Mann-Whitney)yang Dihasilkan pada Uji Potensi Antibakteri Ekstrak Etanol Teh Hijau dengan Berbagai Variasi Konsentrasi EGCG terhadap S. mutans
xvii
dengan Difusi Paper Disc ...
xviii
INTISARI
Teh hijau dibuat dari daun teh (Theae Folium) yang belum difermentasi dan telah diketahui memiliki daya antibakteri karena adanya kandungan senyawa flavonoid yaitu katekin, terutama epigalokatekin-3-galat (EGCG). Karies merupakan penyakit gigi berlubang akibat akumulasi asam laktat dari hasil fermentasi karbohidrat bakteri mulut khususnya Streptococcus mutans. Penelitian ini bertujuan untuk mengetahui potensi antibakteri berbagai variasi konsentrasi ekstrak etanol teh hijau terhadap pertumbuhan bakteri S.mutans dan menentukan Kadar Hambat Minimum (KHM) dan Kadar Bunuh Minimum (KBM) ekstrak etanol teh hijau terhadap S.mutans. Penelitian ini menggunakan teh hijau dari perkebunan teh Rumpun Sari Medini Boja Jawa Tengah karena perkebunan Medini memiliki ketinggian yang optimal untuk menanam teh.
Penelitian ini merupakan penelitian eksperimental murni untuk mengetahui potensi antibakteri ekstrak etanol teh hijau pada konsentrasi: 0,25; 0,5; 0,75; 1; 2,5; 5; 7,5; dan 10 mg/mL terhadap bakteri S. mutans berdasarkan diameter zona hambat menggunakan metode difusi paper disk, yang kemudian dianalisis secara statistik Kruskal-Wallis. Penentuan nilai Kadar Hambat Minimum (KHM) dan Kadar Bunuh Minimum (KBM) dilakukan dengan metode dilusi cair berdasarkan Optical Density (OD) dengan mengukur absorbansi, dibandingkan kontrol negatif serta uji penegasan hasil dengan metode streak plate.
Hasil penelitian menunjukkan bahwa ekstrak etanol teh hijau yang diambil dari Perkebunan Teh Rumpun Sari Medini Boja berpotensi sebagai antibakteri terhadap bakteri S.mutans dengan nilai KHM 2,0 mg/mL, sedangkan nilai KBM belum dapat ditentukan dalam penelitian ini.
xix
ABSTRACT
Green tea was made from non fermentated tea leaves (Theae Folium) that was known have antibacterial potency because of flavonoid constituent, catechine, especially epigalocatechine-3-gallate (EGCG). Caries is a dental cavities disease that caused of lactic acid acumulation from carbohydrate fermentation of oral bacteria especially Streptococcus mutans. This research was aimed to determine the antibacterial potency of variation consentration of ethanol green tea extract and Minimum Inhibitory Concentration (MIC) also Minimum Bactericidal Concentration (MBC) against S.mutans. Research material used was green tea from Rumpun Sari Medini Boja Tea Plantation because of its optimal height for tea plantation.
This research was purely experimental research to determine the antibacterial potency of ethanol green tea extract at concentration 0,25; 0,5; 0,75; 1; 2,5; 5; 7,5; and 10 mg/mL against S. mutans bacteria that showed from inhibition zone with paper disc difusion method, analyzed statistically by Kruskal-Wallis. Minimum Inhibitory Concentration (MIC) and Minimum Bactericidal Concentration (MBC) was determined with liquid dilution method based on
Optical Density (OD) with absorbance measurement, compared with negative control and confimed test by streak plate method.
The result showed that EGCG ethanol green tea extract from Rumpun Sari Medini Boja Tea Plantation potencial as antibacterial against S.mutans with MIC value 2,0 mg/mL and MBC can not be deternine in this research.
1 BAB I PENGANTAR
A. Latar Belakang
Penyakit gigi berlubang (karies) adalah salah satu penyakit dengan
prevalensi sebagian besar pada manusia (Islam, Khan, and Khan, 2007). Karies
gigi merupakan lubang-lubang kecil yang terbentuk karena adanya penumpukan
asam laktat pada email gigi sehingga gigi mengalami penurunan kadar kalsium
dan pelunakan (Cappuccino and Sherman, 2008). Plak adalah biofilm
(sekelompok mikroorganisme yang menempel pada permukaan gigi) kompleks
yang terbentuk oleh >500 spesies bakteri berbeda yang normalnya terdapat dalam
commensal harmony dengan sel inang (Matsunaga, Nakahara, Minnatul, Noiri,
Ebisu, Kato, dkk., 2010). Fermentasi karbohidrat oleh bakteri oral asidogenik
(penghasil asam) adalah faktor utama dalam perkembangan karies gigi, terutama
genus streptococcus (S.mutans, S.anginosus, S.constellatus, S.gordonii,
S.intermedius, S.mitis, S.oralis, S.salivarus dan S.sanguis). Di antara
bakteri-bakteri tersebut, S.mutans merupakan bakteri penyebab utama terjadinya karies
(Islam, dkk., 2007). Hal ini dikarenakan S.mutans memiliki sifat asidofilik, yang
memungkinkan bakteri tersebut bertahan hidup bahkan tumbuh subur dalam
kondisi asam, dan menghasilkan asam laktat (Simon, 2007) dalam jumlah yang
lebih banyak dibandingkan spesies Streptococcus lainnya (Safitri, 2004). Selain
itu S.mutans juga memiliki kemampuan untuk memproduksi glukosyltransferase
ekstraseluler (EPS). EPS merupakan glukan tidak larut air yang memediasi
perlekatan S.mutans dan spesies bakteri oral lainnya pada permukaan gigi,
sehingga terbentuk biofilm plak gigi (Xu, Zhou, and Wu, 2011).
Bakteri S.mutans bersifat gram positif, fakultatif anaerob, nonmotil, tidak
berspora yang mampu menghasilkan asam laktat, kebanyakan tinggal di mulut
dan jalur pernapasan atas. Dalam keadaan anaerob, bakteri ini memerlukan 5%
CO2 dan 95% nitrogen serta memerlukan amonia sebagai sumber nitrogen agar
dapat bertahan hidup dalam lapisan plak yang tebal (Holt, Krieg, Sneath, Staley
and Williams, 2000). Bakteri S.mutans akan menginisiasi perlekatan berbagai
macam oral microflora terhadap permukaan gigi. Selanjutnya terjadi sintesis
polisakarida ekstraseluler (EPS) oleh bakteri menghasilkan agregasi S.mutans
sehingga asam dilepaskan dan menyebabkan demineralisasi serta kavitasi
(pembentukan lubang halus) pada gigi (Islam, dkk., 2007).
Ada 3 jenis teh yang umum dikenal, yaitu green tea (teh hijau), teh
hitam, dan teh oolong. Green tea dibuat dari daun teh yang belum
difermentasikan dan mengandung antioksidan kuat dengan konsentrasi flavonoid
tertinggi (Agoes, 2010). Katekin merupakan flavonoid yang termasuk dalam kelas
flavanol (Hartoyo, 2003). Terdapat beberapa polifenol katekin dalam teh hijau,
yaitu epicatechin (EC), epicatechin-3-gallate (ECG), epigallocatechin (EGC),
epigallocatechin-3-gallate (EGCG), catechin, dan gallocatechin (GC). EGCG
adalah katekin yang jumlahnya paling banyak dalam teh hijau, sekitar 65% dari
total katekin. Secangkir teh hijau mengandung 100-200 mg EGCG. (Zaveri,
dalam teh hijau dapat menghambat pertumbuhan bakteri kariogenik (penyebab
karies gigi) dengan cara menghambat pertumbuhan bakteri penyebab plak pada
permukaan gigi (Alschuler, 1998).
Hasil penelitian sebelumnya yang dilakukan oleh Pratikno (2003)
menyimpulkan bahwa teh hijau yang mengandung katekin dengan konsentrasi 1,5
mg/mL merupakan dosis larutan pakai yang memperlihatkan hasil yang efektif
sebagai bahan antibakteri yang dapat mengurangi terbentuknya karies gigi dengan
cara menghambat aktivitas enzim glukosiltransferase yang dihasilkan oleh
S.mutans dalam mensintesa sukrosa menjadi polisakarida ekstrasel (glukan).
Penelitian oleh Zaveri (2006) menunjukkan bahwa penghambatan bakteri oleh
berbagai macam katekin disebabkan adanya interaksi spesifik antara gugus fenol
dari katekin dengan peptidoglikan bakteri.
Daun teh hijau yang digunakan berasal dari Perkebunan Teh Medini
Boja, Kabupaten Kendal karena memiliki ketinggian yang optimal untuk ditanami
tanaman teh (1500 meter di atas permukaan laut). Diharapkan dengan
menggunakan sumber daun teh hijau yang berkualitas diharapkan dapat menjadi
jaminan kualitas hasil penelitian. Semakin tinggi letak suatu tempat memiliki suhu
yang semakin rendah dan menghasilkan kandungan senyawa dalam teh yang lebih
baik dari sisi kualitas dan kuantitas dibandingkan teh yang ditanam di dataran
rendah maupun sedang (Suseno, 1977).
Data uji potensi antibakteri berupa diameter zona hambat ekstrak etanol
hasil maserasi daun teh hijau terhadap S.mutans yang dianalisis secara statistik.
pengembangan sediaan farmasetik yang dapat digunakan dengan mudah oleh
masyarakat sehingga diharapkan prevalensi karies gigi di Indonesia dapat
diturunkan.
1. Permasalahan
a. Adakah perbedaan bermakna potensi antibakteri dari berbagai variasi
konsentrasi ekstrak etanol teh hijau terhadap bakteri penyebab karies gigi
S. mutans?
b. Berapakah Kadar Hambat Minimum (KHM) dan Kadar Bunuh Minimum
(KBM) dari ekstrak etanol teh hijau?
2. Keaslian penelitian
Menurut Hardjawinata dan Oewen (cit., Pratikno, 2003), katekin sebagai
senyawa polifenol yang diperoleh dari teh hijau mempunyai daya antibakteri
dengan konsentrasi hambat minimalnya 0,5 mg/mL. Dari hasil penelitian Pratikno
(2003) disimpulkan bahwa senyawa katekin dalam teh hijau memiliki daya
antibakteri mengurangi terbentuknya plak penyebab karies gigi dengan cara
menghambat enzim glukosiltransferase yang dihasilkan S. mutans dengan
konsentrasi 1,5 mg/mL.
Penelitian ini menggunakan teh hijau dari Perkebunan Medini,
Boja-Ambarawa serta proses ekstraksi maserasi katekin, khususnya EGCG, dengan
larutan penyari etanol.
3. Manfaat penelitian
a. Manfaat teoritis: Penelitian ini diharapkan dapat memberikan informasi
etanol teh hijau terhadap pertumbuhan bakteri S. mutans, serta memberikan
informasi tentang konsentrasi yang paling efektif dari ekstrak etanol dalam
menghambat S. mutans.
b. Manfaat praktis: Penelitian ini diharapkan dapat memberikan informasi
mengenai manfaat teh hijau dalam mencegah karies gigi dan sebagai informasi
dalam pengembangan sediaan farmasetik untuk karies atau penemuan obat baru.
B. Tujuan Penelitian 1. Tujuan umum
Memberikan informasi pada masyarakat luas mengenai potensi
antibakteri ekstrak etanol teh hijau terhadap S.mutans dan sebagai acuan
dalam pengembangan ke dalam bentuk sediaan farmasetik.
2. Tujuan khusus
a. Mengetahui perbedaan potensi antibakteri berbagai variasi
konsentrasi ekstrak etanol teh hijau terhadap pertumbuhan bakteri
S. mutans.
b. Menentukan Kadar Hambat Minimum dan Kadar Bunuh
Minimum ekstrak etanol teh hijau terhadap bakteri penyebab
6
BAB II
PENELAAHAN PUSTAKA
A. Teh Hijau 1. Keterangan botani
Tanaman teh (Camellia sinensis L.) adalah spesies tanaman yang daun
dan pucuknya digunakan untuk membuat teh. Tumbuhan ini termasuk ke dalam
famili Theaceae. Teh putih, teh hijau, oolong, dan teh hitam semuanya didapatkan
dari spesies ini, tetapi diproses secara berbeda untuk memperoleh tingkat oksidasi
yang berbeda (Agoes, 2010).
Nama lain untuk tumbuhan teh ini adalah Thea bohea, Thea sinensis, dan
Thea viridis (Agoes, 2010). Nama daerah untuk teh adalah Enteh (Sunda), Pu erh
cha (China), Theler (Perancis), Teestrauch (Jerman), Te (Itali), Cha da India
(Portugis) dan Tea (Inggris) (Arisandi dan Andriani, 2006).
Ada tiga jenis teh yang umum dikenal, yaitu greentea atau teh hijau, teh
hitam, danteh oolong. Green tea dibuat dari daun teh yang belum difermentasikan
dan mengandung antioksidan kuat dengan konsentrasi tertinggi yang dinamakan
polifenol. Oolong tea dibuat dari daun yang sebagian difermentasikan, sedangkan
black tea dibuat dari daun yang difermentasikan penuh (Agoes, 2010). Pada teh
hijau, daun teh segar diuapi dan dikeringkan untuk menginaktivasi enzim
polifenol oksidase, proses ini dapat menjaga polifenol tetap pada bentuk
monomernya. Teh hitam diproduksi dengan memperpanjang proses fermentasi
theaflavins. Teh oolong adalah produk semi-fermentasi dan mengandung
campuran polifenol monomer dan theaflavin dengan bobot molekul lebih tinggi.
Ketiga jenis teh tersebut mengandung kafeina dalam jumlah yang signifikan
(3-6%) yang jumlahnya tidak dipengaruhi oleh perbedaan metode dalam proses
pembuatan teh (Zaveri, 2006).
2. Deskripsi teh hijau
Teh hijau adalah daun teh yang diolah tanpa mengalami proses
fermentasi, tidak mengalami oksidasi enzimatik untuk menjaga senyawa aktif
yang terkandung di dalamnya, sehingga diharapkan bahwa kandungan senyawa
aktif terutama katekin yang terkandung lebih banyak dibanding teh jenis lain,
tidak banyak terbuang oleh karena proses fermentasi yang dapat mengurangi
potensi teh hijau tersebut (Hartoyo, 2003).
3. Kandungan kimia teh hijau
Kandungan kimia teh hijau sangat kompleks dan belum semua diketahui.
Komponen yang paling banyak dalam teh hijau adalah polifenol, khususnya
flavonoid seperti katekin, katekin galat, dan proantosianidin. Daun segar teh hijau
mengandung kafeina (sekitar 3,5% dari total berat daun kering, atau sekitar 50
mg/cangkir), teobromina (0,15-0,2%), teofilina (0,02-0,04%) dan metilksantina,
lignin (6,5%), asam organik (1,5%), klorofil (0,5%) dan asam amino bebas
(1-5,5%) (Taylor, Hamilton-Miller, Stapleton, 2005).
Polifenol dalam teh hijau digolongkan sebagai catechins. Ada enam
senyawa catechin, yaitu catechin, gallocatechin (GC), epigallocatechin (EGC),
senyawa paling aktif. Senyawa lain yang ditemukan dalam teh hijau adalah
alkaloid yang terdiri atas kafeina, teobromina, dan teofilina yang bersifat
stimulan. Efek penenang diberikan oleh alkaloid lain, yaitu L-theanine (Agoes,
2010).
Senyawa uji yang digunakan adalah epigallocatechin gallate (EGCG)
yang merupakan senyawa polifenol paling aktif dan dengan kuantitas paling
banyak, yaitu 65% dari total katekin dalam teh hijau (Zaveri, 2006).
4. Kegunaan teh hijau
Teh hijau dan katekin yang terkandung di dalamnya telah diketahui
memiliki daya antioksidan yang dapat digunakan untuk mengobati berbagai
penyakit yang berhubungan dengan Reactive Oxygen Species (ROS), seperti
kanker, penyakit jantung dan penyakit neurodegeneratif. Beberapa penelitian
epidemiologi menunjukkan bahwa teh hijau dapat memicu perlindungan untuk
melawan kanker pada kulit, payudara, prostat, dan paru. Sebagai pencegahan
tambahan terhadap kanker, teh hijau dan EGCG bersifat anti-angiogenik
(mencegah pertumbuhan pembuluh darah tumor) dan anti-mutagenik. Teh hijau
juga bersifat hipokolesterolemik dan mencegah berkembangnya plak pada
aterosklerosis. Bagi penyakit neurodegeneratif dan penyakit patologis yang
berhubungan dengan usia, teh hijau menunjukkan perlindungan yang signifikan
terhadap penyakit Parkinson, Alzheimer dan kerusakan iskemik. Teh hijau juga
diketahui memiliki efek antidiabetes pada hewan uji yang mengalami resistensi
adalah aktivitas antibakteri, anti-HIV dan antiinflamasi yang dimilikinya (Zaveri,
2006).
B. Flavonoid
Polifenol adalah metabolit tanaman dengan ciri khas adanya gugus fenol
(misalnya cincin aromatis dengan gugus hidroksil) yang merupakan derivat dari
L-fenilalanin. Kelas polifenol yang paling penting adalah asam fenolat yang
termasuk dalam struktur polimerik, seperti tannin yang dapat terhidrolisa, lignan,
stilbenes dan flavonoid. Senyawa yang termasuk flavonoid adalah flavonol
(misalnya quercetin dan kaempferol, flavonoid yang banyak terdapat dalam
makanan), flavon, isoflavon, flavanone, antosianidin (pigmen yang
bertanggungjawab dalam warna buah), flavanol (katekin-monomer dan
proantosianidin-polimer) (Petti dan Scully, 2009).
Zat bioaktif yang terdapat dalam teh hijau, utamanya merupakan
flavonoid. Flavonoid dapat digolongkan menjadi enam kelas, yaitu flavon,
flavanon, isoflavon, flavonol, flavanol, dan antosianin. Flavonoid yang ditemukan
dalam teh hijau adalah flavanol dan flavonol. Katekin merupakan flavonoid yang
termasuk dalam kelas flavanol (Hartoyo, 2003). Katekin bersifat asam lemah
(pKa1 = 7,72 dan pKa2 = 10,22), sukar larut dalam air dan sangat tidak stabil di
udara terbuka. Bersifat mudah teroksidasi pada pH mendekati netral (pH 6,9) dan
lebih stabil pada pH lebih rendah (pH 2,8 dan 4,9). Katekin juga mudah terurai
oleh cahaya dengan laju reaksi lebih besar pada pH rendah (pH 3,45)
yang ada dalam katekin, terutama gugus hidroksi pada cincin B, menjadi faktor
utama yang menyebabkan ketidakstabilan katekin terhadap oksidasi oleh oksigen,
pH, cahaya dan antioksidan lain. Katekin teh stabil pada suhu kamar dan
terdegradasi sebesar 20% ketika dipanaskan pada suhu 98 °C selama 20 menit.
Saat dipanaskan dalam autoklaf pada suhu 120 °C terjadi epimerisasi dari (-)
EGCG menjadi (-) GCG dan degradasi sebesar 24% (Susanti, 2011).
Terdapat beberapa katekin dalam teh hijau, yaitu epicatechin (EC),
epicatechin-3-gallate (ECG), epigallocatechin (EGC), epigallocatechin-3-gallate
(EGCG), catechin, dan gallocatechin (GC). EGCG adalah katekin yang
jumlahnya paling banyak dalam teh hijau, sekitar 65% dari total katekin.
Secangkir teh hijau mengandung 100-200 mg EGCG (Zaveri, 2006). Teh hijau
memiliki kandungan katekin yang dapat menghambat efek pertumbuhan bakteri
kariogenik (menyebabkan karies) dengan cara menghambat pertumbuhan bakteri
penyebab plak pada permukaan gigi (Alschuler, 1998), dengan beberapa
mekanisme, yaitu dengan menghambat proliferasi agen-agen infeksi streptococcus
(bakteri penyebab karies gigi), mengganggu proses perlekatan bakteri pada
enamel gigi (Tahir and Moeen, 2011), menghambat metabolisme, pertumbuhan,
proses produksi asam dari bakteri, dan menghambat aktivitas enzim glucosyl
Gambar 1.Struktur berbagai polifenol katekin dalam teh hijau
(Zaveri, 2006)
Hasil penelitian yang dilakukan oleh Shimamura, Zhao, and Hu (2007),
menunjukkan bahwa peptidoglikan yang ditambahkan dalam media tumbuh
S.aureus yang diberi EGCG dapat menghambat aktivitas bakterisidal dari EGCG
terhadap S.aureus, sedangkan lipopolisakarida (LPS) dan dekstran tidak.
Peptidoglikan adalah kompleks cross-linked polisakarida dan peptida. EGCG
dapat berikatan langsung dengan peptidoglikan dan menginduksi presipitasi
peptidoglikan. Oleh karena itu, kerusakan dinding sel yang diinduksi oleh EGCG
dan terganggunya biosintesis dinding sel oleh EGCG melalui perikatan dengan
peptidoglikan merupakan alasan utama lebih rentannya bakteri gram positif
terhadap EGCG. Dibandingkan dengan gram negatif, dinding sel gram positif
memiliki satu lapis peptidoglikan yang tebal, sedangkan bakteri gram negatif
memiliki banyak lapisan peptidoglikan yang tipis. Meskipun bakteri gram negatif
memiliki beberapa lapis peptidoglikan, bakteri tersebut dilapisi oleh membran
terluar yang tersusun oleh LPS. Membran terluar merupakan barier permeabel
material antibakteri. Oleh karena itu, fungsi fisiologis dari membran terluar dan
rendahnya afinitas antara EGCG dan LPS membatasi perikatan EGCG terhadap
peptidoglikan, sehingga mengurangi kerentanan bakteri gram negatif terhadap
EGCG.
Katekin memiliki struktur karbon C6-C3-C6 dan terdapat dua cincin
aromatis, A dan B. Jumlah gugus hidroksil pada cincin B dan ada tidaknya gugus
galloyl menyebabkan perbedaan struktur. Telah dilaporkan bahwa katekin dengan
struktur pyrogallol pada cincin B, seperti EGC dan EGCG, serta katekin dengan
gugus galloyl, seperti ECG dan EGCG memiliki aktivitas antioksidan lebih kuat
dari pada yang lainnya (katekin (C) dan EC). Efek penghambatan pembentukkan
biofilm (sekelompok mikroorganisme yang menempel pada permukaan gigi) oleh
gugus galloyl membutuhkan ke tiga gugus hidroksil yang menjadi penyusunnya.
Tidak ada aktivitas bakterisidal yang ditunjukkan ketika hanya gugus galloyl saja,
namun pada senyawa katekin dengan gugus galloyl (misalnya CG, ECG, GCG
dan EGCG) terjadi penghambatan pembentukkan biofilm yang efektif. Hal ini
menunjukkan bahwa penambahan gugus galloyl pada senyawa katekin akan
mendesak efek penghambatan bakteri bersinergis dengan mekanisme
penghambatan bakteri lainnya, seperti aktivitas bakterisidal (Matsunaga, dkk.,
2010). Selain itu, ion hidroksil secara kimia menyebabkan perubahan komponen
organik dan transport nutrisi sehingga menimbulkan efek toksik terhadap sel
bakteri (Sumono dan Wulan, 2009).
Aktivitas bakterisidal katekin diperkirakan karena adanya produksi
Species (ROS) (Matsunaga, dkk., 2010). Hidrogen peroksida dibentuk di larutan
aqueous melalui disosiasi (pembebasan) proton dari gugus hidroksil. Elektron
bebas dalam cincin fenol mengurangi molekul oksigen, membentuk O22-,
sementara proton bebas akan berikatan dengan O22-, membentuk hidrogen
peroksida (Petti, Scully, 2009). Hidrogen peroksida dapat menekan transkripsi gen
yang menghasilkan polisakarida, sehingga menghambat pembentukkan biofilm
dan akhirnya terjadi kekacauan pada membran sel (Matsunaga, dkk., 2010). Pada
S.mutans, polisakarida yang ada berupa glukan tak larut air (glycocalyx) yang
berfungsi membantu perlekatan bakteri pada permukaan gigi (Simon, 2007).
Katekin, khususnya EGCG, mampu menghambat aktivitas enzim
glycosyl transferase (GTF) sehingga pembentukkan dan integritas dari oral
biofilm terganggu. EGCG dan katekin lainnya dari teh hijau juga telah dilaporkan
dapat menekan aktivitas kelenjar air ludah dan aktivitas enzim amilase yang
mengarah pada inefisiensi dari metabolisme karbohidrat. EGCG juga dapat
menghambat produksi asam dengan menghambat jalur glikolisis bakteri dan
penekanan phosphotransferase system (PTS) oleh enolase, suatu sistem untuk
memasukan gula ke dalam sel ketika kondisi kehabisan gula (Xu, dkk.,2011).
C. Karies dan Plak Gigi
Karies gigi adalah proses kerusakan yang dimulai dari enamel hingga ke
dentin. Karies gigi merupakan penyakit yang berhubungan dengan banyak faktor
yang saling mempengaruhi. Ada tiga faktor utama, yaitu gigi dan saliva,
faktor tersebut saling berinteraksi maka terjadi karies (Irhamsyah, 2003).
Terbentuknya karies gigi tidak lepas dari plak gigi yang merupakan biofilm
kompleks yang terbentuk oleh >500 spesies bakteri berbeda yang normalnya
terdapat dalam commensal harmony dengan sel inang (Matsunaga, dkk., 2010).
Terdapat tiga tahap pembentukkan plak gigi; pertama molekul saliva diadsorbsi ke
dalam enamel bersamaan dengan pembersihan gigi oleh saliva. Kemudian enamel
diselubungi oleh campuran kompleks komponen yang terdiri dari glikoprotein,
protein kaya prolin yang bersifat asam, mucins, debris sel bakteri, exoproduct, dan
asam sialin. Tahap ke dua adalah interaksi spesifik sel bakteri dengan permukaan
gigi yang akhirnya membentuk biofilm. Formasi biofilm awalnya dibentuk oleh
koloni Streptococcus sanguis dan Actinomyces viscous, dipengaruhi oleh banyak
parameter lingkungan, seperti osmolaritas, sumber karbon dan pH. Pada tahap ke
tiga, spesies bakteri lain seperti S.mutans menempel pada koloni Streptococcus
sanguis dan Actinomyces viscous dengan interaksi sel-sel. Pertumbuhan bakteri
berikutnya pada permukaan gigi akan mengarah pada pembentukan biofilm pada
gigi, yang juga dikenal sebagai plak gigi. Bakteri S.mutans dan Streptococcus
sobrinus memiliki peran utama dalam etiologi karies gigi, karena ke duanya dapat
melekat pada enamel salivary pellicle dan bakteri plak lainnya. Bakteri S.mutans
dan Laktobasilus merupakan penghasil asam kuat yang kemudian dapat
menyebabkan lingkungan menjadi asam, menimbulkan resiko terjadinya lubang
halus pada gigi (cavity). Biasanya, keberadaan S.mutans pada cavity gigi akan
diikuti dengan terbentuknya karies setelah 6-24 bulan (Forssten, Bjorklund,
Bakteri yang berperan penting dalam pembentukkan plak adalah bakteri
yang mampu memfermentasi polisakarida (karbohidrat) ekstraseluler (EPS), yaitu
bakteri dari genus Streptococcus, Staphylococcus dan Lactobacillus. Bakteri
tersebut memfermentasi karbohidrat dan menghasilkan asam organik sehingga
mengubah pH rongga mulut menjadi asam. Struktur email gigi akan terlarut pada
pH < 5,41 dan terjadi karies gigi (Indrawati, 2009). Bakteri S. mutans melakukan
perlekatan dengan permukaan email gigi dengan menggunakan glycocalyx.
Glycocalyx merupakan suatu kumpulan besar serabut dari polisakarida atau
cabang dari molekul gula yang mengelilingi suatu sel individu atau koloni sel.
Perlekatan polisakarida pada gigi akan menimbulkan plak gigi, yaitu bentuk
akumulasi dari kumpulan bermacam-macam bakteri dalam suatu matriks dextran;
kemungkinan sebanyak 500 sel tebalnya. Terbentuknya asam laktat oleh
streptococci terjadi melalui jalur fermentasi homolaktik karena produk akhir yang
terbentuk hanya asam laktat. Adanya dua molekul ADP dan dua molekul fosfat,
molekul glukosa dapat difermentasikan menjadi dua molekul asam laktat dan dua
molekul ATP. Asam laktat ini lama kelamaan akan mengikis email gigi yang
kemudian akan membentuk karies (lubang) (Atlas, 1997).
Pencegahan akumulasi plak untuk mencegah karies gigi dilakukan
dengan memperhatikan jenis makanan yang dikonsumsi dan membersihkan gigi
secara teratur dengan pasta gigi atau obat kumur yang mengandung antibakteri.
Pasta gigi yang beredar di pasaran umumnya mengandung fluor yang bersifat
antibakteri. Penggunaan pasta gigi dengan konsentrasi fluor tinggi dapat
bakteri karena lebih bersifat menghambat, selain itu bahan kimia ini relatif mahal.
Penggunaan antibiotika dalam pemberantasan plak seperti penisilin, vankomisin
dan klorheksidin secara rutin dapat menyebabkan resistensi dan efek samping
seperti diskolorisasi gigi (Indrawati, 2009). Pencegahan karies lainnya adalah
dengan menggunakan obat kumur antiseptik misalnya klorheksidin. Klorheksidin
merupakan derivat dari bis-guanid bis – fenol yang bersifat bakterisidal baik
terhadap bakteri Gram negatif maupun positif. Klorheksidin mampu mengubah
struktur permukaan sel, sehingga menyebabkan hilangnya keseimbangan osmotik,
selanjutnya terjadi penonjolan membran sitoplasma, terbentuk vesikel dan
keluarnya sitoplasma, dapat menghambat perbaikan sel dan akhirnya terjadi
kematian sel. Kerugian penggunaan klorheksidin sebagai obat kumur adalah
terjadi pewarnaan pada gigi dan lidah serta menyebabkan iritasi pada mukosa
(Sumono dkk., 2009). Xylitol adalah gula alkohol atau polyol yang secara alami
terdapat dalam metabolisme manusia, dan dapat digunakan secara aman dalam
produk dental ataupun bahan makanan. Xylitol dilaporkan dapat mempengaruhi
sintesis polisakarida S.mutans, yang mengarah pada penurunan perlekatan bakteri.
Triklosan adalah komponen organik dengan kemampuan antibakteri yang telah
digunakan dalam pasta gigi. Triklosan menghambat pertumbuhan S.mutans
dengan mensensitisasi glikolisis untuk menghambat asam dengan bekerjasama
dengan karier proton transmembran yang bersifat asam lemah, seperti fluoride.
Xylitol dapat dianggap sebagai substansi pencegah plak yang lebih aman
digunakan daripada triklosan, karena triklosan dapat bereaksi dengan klorin dalam
Penelitian yang dilakukan oleh Sumono dkk. (2009) menunjukkan bahwa
kumur dengan air rebusan daun salam dapat mengurangi jumlah koloni bakteri
Streptococcus sp., dan semakin tinggi konsentrasi rebusan daun salam maka
jumlah bakteri Streptococcus sp. akan semakin sedikit. Hal ini disebabkan adanya
kandungan kimia aktif daun salam yaitu tanin (senyawa fenol, bekerja dengan
mendenaturasi protein dan menurunkan tegangan muka, sehingga permeabilitas
bakteri meningkat, pertumbuhan sel terhambat dan akhirnya kematian sel),
flavonoid, minyak atsiri 0,05% (mempunyai efek analgesik) yang terdiri dari sitral
dan eugenol.
D. Maserasi
Maserasi merupakan cara penyarian yang sederhana dengan merendam
serbuk simplisia dalam cairan penyari. Prinsip dasar maserasi adalah cairan
penyari akan menembus dinding sel dan masuk ke dalam rongga sel yang
mengandung zat aktif. Zat aktif akan larut dan karena adanya perbedaan
konsentrasi antara larutan di dalam dan di luar sel, maka larutan yang terpekat
didesak ke luar hingga terjadi keseimbangan. Maserasi digunakan untuk penyarian
simplisia yang mengandung zat aktif yang mudah larut dalam cairan penyari,
tidak mengandung zat yang mudah mengembang dalam cairan penyari, tidak
mengandung benzoin, stirak dan lain-lain. Keuntungan cara penyarian dengan
maserasi adalah cara pengerjaan dan peralatan yang digunakan sederhana dan
mudah diusahakan, sedangkan kerugiannya adalah pengerjaan lama dan penyarian
Cairan pelarut dalam proses pembuatan ekstrak dipilih pelarut yang baik
(optimal) yang dapat melarutkan senyawa bioaktif. Kebijakan dan peraturan
pemerintah membatasi cairan pelarut yang diperbolehkan, yaitu air, etanol serta
campurannya. Metanol dihindari penggunaannya karena sifatnya yang toksik
(Sidik dan Mudahan, 2000 cit., Paribasa,2007). Air dipertimbangkan sebagai
penyari karena murah dan mudah diperoleh, stabil, tidak mudah menguap dan
tidak mudah terbakar, tidak beracun dan alamiah, tetapi sebagai penyari kerugian
air adalah tidak selektif, sari dapat ditumbuhi kapang dan bakteri, serta cepat
rusak dan untuk pengeringan dibutuhkan waktu yang lama. Sedangkan etanol
meskipun harganya cukup mahal, tetap dipertimbangkan sebagai penyari karena
lebih selektif; kapang, khamir dan bakteri lebih sulit tumbuh dalam etanol 20%
keatas; dapat bercampur dengan air pada segala perbandingan; pengeringan dalam
waktu singkat. Etanol dapat melarutkan alkaloid, glikosida, flavonoid, damar,
klorofil, lemak, tanin dan saponin (DepKes RI, 1986).
E. Streptococcus mutans
Genus Streptococcus memiliki sel berbentuk bulat (spherical) atau bulat
telur, dengan diameter 0,5-2,0 µm, berpasangan atau berbentuk rantai ketika
tumbuh pada media cair; terkadang memanjang pada aksis rantai menjadi bentuk
lanset, nonmotil, tidak berspora dan merupakan gram positif, beberapa spesies
tidak berkapsula, fakultatif anaerob, kemoorganotrof, membutuhkan media yang
kaya nutrient untuk tumbuh dan terkadang 5% CO2, metabolit dari hasil
Umumnya menyerang sel darah merah, tumbuh pada temperatur 25-45°C
(optimum 37°C), parasit bagi vertebrata, kebanyakan tinggal atau berhabitat di
mulut dan jalur pernapasan bagian atas; beberapa spesies bersifat patogen bagi
manusia dan hewan. Genus Streptococcus menunjukkan hasil positif pada uji
Voges-Proskauer (VP), serta membentuk asam dari inulin, laktosa, manitol,
raffinosa, salisin, sorbitol, dan trehalose (Holt, dkk., 2000).
Pada proses terbentuknya karies, produksi asam laktat meningkat ketika
sukrosa masuk ke dalam mulut melalui makanan berat atau ringan dan
menghasilkan penurunan pH mulut. Jadi, jika keasaman adalah prasyarat untuk
terbentuknya karies, maka hanya spesies yang dapat tumbuh subur dalam
lingkungan asam, disebut spesies asidofilik, yang dapat berperan dalam
menghasilkan karies. Spesies tersebut adalah Lactobacillus casei, Veilonella
dispar dan terutama Streptococcus mutans yang dapat mendominasi tempat yang
sebelumnya diduduki oleh spesies lain. Namun diantara semua spesies bakteri
rongga mulut tersebut, S.mutans merupakan penyebab utama terjadinya karies
gigi. Hal ini disebabkan oleh beberapa faktor, yaitu: pertama, S.mutans adalah
bakteri anaerobik yang diketahui membentuk asam laktat sebagai bagian dari
metabolismenya (Simon, 2007), dalam jumlah yang lebih banyak dibandingkan
spesies Streptococci lainnya (Safitri, 2004). S.mutans juga mampu membuat
bahan cadangan makanan intraseluler yang serupa dengan glikogen. Sintesa dari
polisakarida intraseluler ini terjadi bila ada gula dalam jumlah berlebihan. Apabila
persediaan gula yang eksogen sudah habis terpakai, maka bakteri S.mutans akan
2006), dengan demikian dapat menghasilkan asam terus menerus (Safitri, 2004).
Kemudian adanya kemampuan S.mutans dalam berikatan dengan permukaan gigi
saat terdapat sukrosa dengan membentuk glukan tak larut air, suatu polisakarida
yang membantu perikatan bakteri dengan gigi. Faktor virulensi terpenting adalah
sifat asidofilik S.mutans. Tidak seperti kebanyakan mikroorganisme mulut,
S.mutans tumbuh subur dalam kondisi asam dan menjadi bakteri yang dominan
dalam kultur dengan pengurangan pH yang tetap. Selain itu, tidak seperti spesies
lain di plak yang metabolismenya lambat pada pH rendah, metabolisme S.mutans
meningkat secara pasti, sebagai sistem penggerak proton yang digunakan untuk
transport nutrient melalui dinding selnya dalam lingkungan ber-pH rendah atau
lingkungan dengan kadar glukosa tinggi, yang dimodulasi oleh keberadaan ion
hidrogen yang meningkat seiring dengan keasaman. Bakteri S.mutans dapat
menurunkan atau menjaga pH mulut pada nilai keasaman yang tidak biasa,
menciptakan kondisi yang sesuai untuk dirinya sendiri namun tidak sesuai untuk
spesies lain yang pernah hidup bersama dengan S.mutans. Penurunan pH inilah
yang menghasilkan demineralisasi dan kavitasi (pembentukkan lubang pada gigi).
Keduanya meningkat bersamaan dengan peningkatan laju pertumbuhan S.mutans
(Simon, 2007).
S.mutans dapat membentuk polisakarida ekstraseluler/Extracellular
Polysaccharides (EPS) ketika terdapat sukrosa, fruktosa dan/atau glukosa. EPS
adalah polimer rantai panjang berbobot molekul besar yang merupakan faktor
penting dari kariogenisitas S.mutans. Energi dari glukosa dan fruktosa
Homopolisakarida glukosa yang disebut glukan diproduksi oleh
glukosiltransferase (GTF). Glukan tidak larut air menyediakan sumber substrat
yang dapat difermentasi dan mampu meningkatkan kariogenisitas EPS dengan
meningkatkan akses nutrien. Glukan berperan sebagai adesif terhadap permukaan
gigi dan merupakan senyawa pokok dalam kariogenisitas S.mutans. Sebagai
tambahan, glukan diperlukan dalam interaksi adesif antar sel dan antara sel
dengan permukaan gigi dalam plak dengan agregasi bakterial yang dimediasi
dekstran (Forssten, dkk., 2010). EPS yang dihasilkan melekat kuat pada gigi dan
membentuk plak gigi yang akan ditempati streptococci, kemudian terjadi
fermentasi fruktosa menjadi bentuk asam laktat. Selanjutnya, adanya asam laktat
ini akan menyebabkan email gigi mengalami decalcification (penurunan jumlah
kalsium) dan softening (gigi semakin melunak). Pada akhirnya akan terbentuk
lubang-lubang kecil yang disebut karies gigi (Cappuccino, dkk., 2008).
F. Pengujian Potensi Antibakteri
Antibakteri adalah senyawa pembasmi bakteri yang bersifat toksik untuk
bakteri, namun relatif tidak toksik untuk inangnya (Sulistia, 1995).
Terdapat 2 metode pengujian antibakteri, yakni:
1. Uji difusi
Prinsip metode difusi yaitu pengukuran potensi antibakteri berdasarkan
diameter zona hambat pertumbuhan bakteri karena berdifusinya obat dari titik
awal pemberian ke daerah difusi (Volk dan Wheeler, 1988). Terdapat dua macam
a. Kirby Bauwer/ paper disc. Paper disc yang berisi agen antibakteri
diletakkan pada media agar yang telah ditanami mikrobia yang akan berdifusi
pada media agar tersebut. Area jernih mengindikasikan adanya hambatan
pertumbuhan mikrobia oleh agen antibakteri pada permukaan media agar (Pratiwi,
2008).
b. Sumuran. Pada agar yang telah ditanami mikroba, dibuat sumuran
dengan garis tengah tertentu. Dan ke dalam sumuran diberi larutan uji antimikroba
dan diinkubasikan pada suhu 370C selama 18-24 jam. Parameter yang diamati
adalah diameter zona hambat yang dihasilkan larutan uji antimikroba (Edber,
1986).
2. Uji dilusi
Prinsip metode dilusi adalah pengenceran obat atau antibakteri hingga
didapatkan beberapa konsentrasi yang kemudian akan diuji untuk mendapatkan
nilai Kadar Hambat Minimum (KHM) dan nilai Kadar Bunuh Minimum (KBM)
(Sulistia, 1995).Sejumlah obat tertentu dicampurkan pada pembenihan bakteri
yang cair atau padat. Kemudian pembenihan tersebut ditanami dengan bakteri
yang diperiksa dan dieram. Keuntungn metode ini adalah memungkinkan adanya
suatu hasil kuantitatif, yang menunjukan jumlah obat yang diperlukan untuk
menghambat/mematikan mikroorganisme yang diperiksa (Jawetz, Melnick, dan
Adelberg, 2007). Metode dilusi meliputi hal sebagai berikut.
a. Dilusi padat. Pada metode dilusi padat, setiap konsentrasi antibakteri
dicampurkan dengan media agar, kemudian ditanami bakteri (Jawetz, Melnick,
b. Dilusi cair. Pada metode dilusi cair, masing-masing konsentrasi
dicampurkan langsung dengan media (Jawetz, dkk., 1991).
Parameter yang diukur pada metode dilusi cair adalah tingkat kekeruhan
yang menunjukkan nilai Optical Density (OD), yakni nilai kerapatan yang
menunjukkan pertumbuhan mikrobia uji dibandingkan dengan blanko standar
autozero. Bakteri yang bermultiplikasi pada media cair akan menyebabkan media
menjadi keruh. Alat yang digunakan untuk pengukuran adalah spektrofotometer
atau kolorimeter dengan cara membandingkan OD antara media tanpa
pertumbuhan bakteri dan media dengan pertumbuhan bakteri (Pratiwi, 2008).
Spektrofotometer dapat mengukur kepekatan sel dalam suspensi dalam %T
(transmittance) atau OD (jumlah cahaya yang diabsorpsi dan disebarkan). Dalam
mikrobiologi digunakan OD sebagai satuan hitungan, karena OD sebanding
dengan kepekatan sel dalam suspensi biakan (Lay, 1994). Pada spektrofotometer,
berkas cahaya ditransmisikan melalui suspensi bakteri lalu diteruskan ke detektor
sensitif cahaya. Jika jumlah bakteri meningkat, sedikit cahaya yang akan
diteruskan ke detektor. Perubahan intensitas cahaya akan terlihat pada skala yang
terdapat pada alat, yaitu nilai absorbans atau densitas optik (optical density)
(Radji, 2010).
Kadar Hambat Minimum (KHM) suatu antibiotik adalah konsentrasi
terendah yang masih dapat menghambat pertumbuhan mikroba tertentu. Kadar
Bunuh Minimum suatu antibiotik adalah konsentrasi antibiotik terendah yang
dapat membunuh pertumbuhan mikroba tertentu. KHM dan KBM dapat
menentukan konsentrasi antibiotik yang masih efektif untuk mencegah
pertumbuhan patogen dan mengindikasikan dosis antibiotik yang efektif dalam
mengontrol infeksi pada pasien (Radji, 2010). Penentuan nilai KHM didasarkan
pada konsentrasi terendah senyawa antibakteri dengan nilai OD yang telah
mencapai 0 pada pengukuran dengan spektrofotometer dan masih menunjukkan
pertumbuhan bakteri pada uji penegasan secara streak plate. Nilai KBM
didasarkan pada konsentrasi terendah senyawa antibakteri dengan nilai OD yang
telah mencapai 0 pada pengukuran dengan spektrofotometer dan sudah tidak
menunjukkan pertumbuhan bakteri pada uji penegasan secara streak plate
(McKane dan Kandel, 1996).
G. Landasan Teori
Teh hijau dibuat dari daun teh yang belum difermentasikan dan
mengandung antioksidan kuat terutama katekin dengan konsentrasi tertinggi.
Katekin merupakan senyawa flavonoid dari golongan flavanol yang terkandung
dalam teh hijau. Adanya kandungan katekin terutama EGCG pada teh hijau
menghasilkan daya antibakteri yang efektif dalam menghambat bakteri mulut
penyebab karies gigi, salah satunya adalah S.mutans yang merupakan bakteri
pencetus terjadinya karies. S.mutans dapat menghasilkan glucosyl transferase
(GTF) yang digunakan untuk mengubah sukrosa menjadi polisakarida
ekstraseluler (EPS). Glukan yang dihasilkan oleh bakteri membantu EPS untuk
melekat pada email gigi dan menginduksi terjadinya agregasi berbagai spesies
ini dihasilkan asam yang menyebabkan penurunan kalsium dan pelunakan pada
gigi. Plak yang dibiarkan lama kelamaan menyebabkan terbentuknya
lubang-lubang halus pada permukaan gigi yang disebut karies.
Mekanisme katekin yaitu berinteraksi dengan sel bakteri melalui proses
adsorbsi yang melibatkan ikatan hidrogen, sehingga terbentuk suatu kompleks
protein. Akan tetapi, kompleks protein yang terbentuk relatif lemah sehingga
segera terurai dan gugusan fenol terpenetrasi ke dalam sel dan menyebabkan
denaturasi protein yang pada akhirnya menyebabkan pelisisan sel bakteri (Parwata
dan Dewi, 2008). Katekin didapatkan dari ekstrak etanol hasil maserasi teh hijau.
Adanya potensi antibakteri dilihat dengan metode difusi paper disc berdasarkan
terbentuknya diameter zona jernih di sekitar paper disc.
Hasil penelitian ini dapat menjadi informasi kepada masyarakat tentang
efektifitas ekstrak etanol teh hijau dalam menghambat karies gigi dan dapat
dijadikan dasar untuk pengembangan sediaan farmasetik yang lebih efektif dan
efisien digunakan di masyarakat. Kedua hal tersebut diharapkan dapat mengurangi
prevalensi kasus karies gigi di Indonesia.
H. Hipotesis
Berbagai variasi konsentrasi ekstrak etanol teh hijau memiliki potensi
26 BAB III
METODE PENELITIAN
A. Jenis dan Rancangan Penelitian
Rancangan penelitian ini merupakan penelitian eksperimental murni
dengan rancangan acak lengkap pola satu arah. Penelitian dilakukan di
Laboratorium Penelitian dan Pengujian Terpadu (LPPT) Universitas Gadjah Mada
dan di Laboratorium Farmakognosi Fitokimia, Laboratorium Mikrobiologi, dan
Laboratorium Kimia Analisis Instrumental Fakultas Farmasi Universitas Sanata
Dharma Yogyakarta.
B. Variabel Penelitian dan Definisi Operasional 1. Variabel penelitian
a. Variabel bebas: ekstrak etanol teh hijau dengan variasi konsentrasi
EGCG 0,25 ; 0,5 ; 0,75 ; 1 ; 2,5 ; 5 ; 7,5 ; dan 10 mg/mL berdasarkan
pengembangan konsentrasi dari penelitian sebelumnya (Pratikno, 2003).
b. Variabel tergantung: diameter zona hambat ekstrak etanol teh hijau
terhadap pertumbuhan S. mutans, nilai KHM, nilai KBM.
c. Variabel pengacau terkendali: jenis bakteri uji (S.mutans), waktu
inkubasi (24 jam), suhu inkubasi (37°C), kepadatan suspensi bakteri uji
setara dengan larutan standar Mc. Farland II (6.108 CFU/mL), asal teh
Jawa Tengah), metode ekstraksi (maserasi), volume suspensi bakteri uji
(1 mL), volume senyawa uji dalam paper disc (25 µL).
2. Definisi operasional
a. Teh hijau adalah daun dari tumbuhan teh (Camellia sinensis L.) yang
diperoleh dari Perkebunan Teh Rumpun Sari Medini Boja, Kabupaten
Kendal, Jawa Tengah dengan proses pengolahan berdasarkan surat
keterangan dari PT Medini Boja.
b. Potensi antibakteri adalah kemampuan ekstrak etanol teh hijau dalam
menghambat atau membunuh bakteri uji S. mutans dibandingkan dengan
kontrol negatif yang ditunjukkan dari diameter zona hambat dan nilai
KHM dan KBM.
c. Ekstrak etanol teh hijau adalah ekstrak yang diperoleh dengan cara
mengekstraksi daun teh secara maserasi dengan cara merendam
simplisia dalam larutan penyari etanol selama tiga hari, sehingga
didapatkan ekstrak teh kental yang kemudian diencerkan sesuai variasi
konsentrasi yang telah ditentukan. Proses ekstraksi dilakukan
berdasarkan prosedur kerja dari Lembaga Penelitian dan Pengujian
Terpadu Universitas Gajah Mada.
d. Difusi paper disc, yaitu suatu metode uji potensi antibakteri dengan
didasarkan pada proses terdifusinya ekstrak etanol daun teh hijau dalam
paper disc ke media sekitar yang sudah diinokulasikan S.mutans dengan
e. Dilusi cair, yakni metode uji penentuan nilai KHM dan KBM dari
berbagai variasi konsentrasi EGCG ekstrak etanol daun teh hijau dengan
melihat nilai Optical Density (OD) menggunakan spektrofotometer
visible.
f. Zona hambat adalah zona jernih di mana terdapat pengurangan
pertumbuhan S. mutans dilihat dari kejernihan media dibandingkan
dengan kontrol negatif.
g. Kultur murni S. mutans adalah kultur yang diperoleh dari hasil reisolasi
yang telah diuji kemurnian dan identitasnya sesuai Holt, dkk. (2000).
h. Optical Density (OD) adalah nilai kerapatan optik berdasarkan kekeruhan
yang menunjukkan pertumbuhan populasi sel bakteri S. mutans
dibandingkan blanko autozero menggunakan spektrofotometer.
i. Kadar Hambat Minimum (KHM) adalah konsentrasi terendah dari
ekstrak etanol teh hijau yang dapat menghambat atau mengurangi
populasi S.mutans dalam media.
j. Kadar Bunuh Minimum (KBM) adalah konsentrasi terendah dari ekstrak
etanol teh hijau yang dapat membunuh atau menghilangkan sama sekali
populasi S.mutans dalam media.
C. Bahan
Teh hijau yang diperoleh dari Perkebunan Teh Rumpun Sari Medini
Boja, Kabupaten Kendal, Jawa Tengah, yang didapatkan dari saudari Maria Siska
Triyuniar Kusumastuti (Lampiran 1 dan 2), kultur bakteri strain S. mutans yang
Farmasi Universitas Sanata Dharma Yogyakarta, etanol, aquadest steril, media
Nutrien Broth (NB), media Nutrien Agar (NA), cairan standar Mc. Farland II
(6.108 CFU/mL), larutan pembanding epigallo catechin gallate (EGCG).
D. Alat
Alat-alat gelas: beaker glass (Pyrex), erlenmeyer (Pyrex), tabung reaksi
(Pyrex), cawan petri (Pyrex), pipet volume (Pyrex), flakon (Pyrex). Oven
(Memmert 7200 Tuttlingen, Germany), autoklaf (KT-40, ALP co, Lt, Hamurashi
Tokyo, Japan), mikro pipet (Ependorf-Netler-Hinz), vortex (Janke & Kunkel,
Ika-labotechnic, werk VF 1), bunsen, sengkelit (loop), timbangan/ neraca analitik
(Mettler PC 2000), penangas magnetik (Janke & Kunkel, IKA-Combimag RCT
tipe RCT Nr. 61801), stirer, lemari es, penggaris, pipet filler, Spektrofotometer
UV-Visible.
E. Tata Cara Penelitian 1. Identifikasi teh hijau
Daun teh diperoleh dari Perkebunan Teh Rumpun Sari Medini Boja,
Kabupaten Kendal, Jawa Tengah dan diolah tanpa mengalami proses fermentasi
untuk menjaga senyawa aktif yang terkandung di dalamnya, serta dilakukan
identifikasi daun teh berdasarkan prosedur kerja dari Laboratorium Penelitian dan
2. Pembuatan serbuk teh hijau
Daun teh kering yang diperoleh dari Perkebunan Teh Rumpun Sari Medini
Boja, Kabupaten Kendal, Jawa Tengah diserbuk sesuai Prosedur kerja di
Laboratorium Penelitian dan Pengujian Terpadu (LPPT) Universitas Gadjah Mada
menggunakan mesin penyerbuk dengan saringan berdiameter 1 mm.
3. Pembuatan ekstrak etanol teh hijau
Pembuatan ekstrak etanol teh hijau dilakukan di Laboratorium Penelitian
dan Pengujian Terpadu (LPPT) Universitas Gadjah Mada. Sebanyak 400 g serbuk
daun teh dilarutkan dalam 3000 mL etanol sedikit demi sedikit. Diaduk selama 30
menit, diamkan selama 24 jam, disaring kemudian diulang sebanyak tiga kali.
Filtrat yang didapat diuapkan menggunakan vaccum rotary evaporator dengan
suhu 70°C.
4. Verifikasi kualitatif-kuantitatif kandungan senyawa epigalokatekin-3-galat (EGCG) dengan Kromatografi Lapis Tipis (KLT) dan Spektrofotometer Densitometri
Verifikasi kualitatif dan kuantitatif EGCG dilakukan berdasarkan prosedur
kerja yang dilakukan oleh Laboratorium Penelitian dan Pengujian Terpadu
(LPPT) Universitas Gadjah Mada. Sampel ditimbang secara seksama dan
diekstraksi dengan 1 ml etanol, kemudian divortex selama 2 menit. Spoting
sampel sebanyak 10 µL pada plate silikagel F254 dan disertakan pembanding
EGCG. Masukkan hasil spoting (penotolan) ke dalam chamber yang telah
dijenuhkan dengan fase geraknya, yaitu kloroform-asam asetat-asam
hasil perambatan spot menggunakan lampu UV 254 nm dan perhitungan kadar
EGCG dengan KLT-densitometri pada panjang gelombang 305 nm.
5. Uji kemurnian dan identifikasi bakteri uji
Uji kemurnian dan identifikasi bakteri dilakukan di Laboratorium
Mikrobiologi Fakultas Farmasi Universitas Sanata Dharma Yogyakarta. Kultur
S.mutans diambil sebanyak 1 loop dengan jarum ose kemudian di inokulasikan
pada media cawan NA dengan metode streak plate. Setelah diinkubasi selama 24
jam pada suhu 37°C, koloni bakteri yang terpisah diisolasi kembali beberapa kali
pada media NA miring dan NB.
Koloni hasil isolasi kembali kemudian diidentifikasi dengan beberapa
metode, yaitu pengecatan gram dan uji biokimia yang meliputi uji Katalase,
Oksidasi-Fermentasi (O-F), Methyl Red (MR) - Voges-Proskauer (VP), dan media
Triple Sugar Iron Agar (TSIA). Uji ini disesuaikan dengan karakteristik khas
S.mutans berdasarkan buku Bergey’s Manual of Determinative Bacteriology
(Holt,dkk., 2000).
a. Pengecatan Gram. Uji identifikasi bakteri uji diawali dengan pengecatan
Gram untuk mengetahui sifat Gram dan bentuk sel bakteri uji. Pada pengecatan
Gram ini kultur dari media NA miring dioleskan dahulu pada gelas obyek lalu
ditetesi aquadest dan difiksasi dengan melewatkan gelas obyek tersebut diatas
bunsen hingga bakteri kering. Setelah proses fiksasi, gelas benda yang sudah
terdapat bakteri tersebut dicat dengan menggunakan beberapa reagen, yaitu Gram
A (Kristal violet), Gram B (Larutan iodium), Gram C (Alkohol 96%), dan Gram
b. Uji katalase. Satu sampai dua tetes 30% hidrogen peroksida diletakkan
pada gelas benda, kemudian ditambahkan 1 ose atau 2-3 tetes suspensi isolat
murni bakteri uji. Katalase positif ditandai dengan pembentukan buih seketika,
dibandingkan dengan kontrol. S. mutans bersifat katalase negatif berdasarkan
buku panduan determinasi bakteri (Holt, dkk., 2000).
c. Uji oksidasi-fermentasi (O-F). Isolat murni bakteri uji diinokulasikan
dalam empat tabung berisi media O-F yang mengandung 1% dekstrosa
(karbohidrat). Tabung 1 ditutup dengan parafin lunak, tabung 2 tidak ditutup
parafin, tabung 3 digunakan sebagai kontrol ditutup parafin, dan tabung 4
digunakan sebagai kontrol yang tidak ditutup parafin, kemudian diinkubasi selama
24 jam pada suhu 370C, dan perlakuan dibandingkan dengan kontrol. Proses
oksidasi terjadi pada bakteri aerob sedangkan proses fermentasi terjadi pada
bakteri anaerob. Hasil positif jika terjadi perubahan warna dari hijau menjadi
kuning pada tabung 1, dan tidak berubah warna pada tabung 2 yang menunjukkan
bakteri uji bersifat anaerob. S. mutans melakukan metabolisme secara fermentasi
dan bersifat fakultatif anaerob (uji O-F positif) berdasarkan buku panduan
determinasi bakteri (Holt, dkk., 2000).
d. Uji Methyl Red (MR). Isolat murni bakteri uji diinokulasikan dalam
tabung berisi media MR-VP, kemudian diinkubasi selama 24 jam pada suhu 370C.
Setelah masa inkubasi, ditambahkan beberapa tetes reagen metil merah. Larutan
dikocok dengan hati-hati. Perubahan warna dibaca setelah 30 menit. Hasil positif
Berdasarkan buku panduan determinasi bakteri (Holt, dkk., 2000), S. mutans
membentuk asam dari proses fermentasi karbohidrat (uji MR positif).
e. Uji Voges Proskauer (VP). Isolat murni bakteri uji diinokulasikan dalam
tabung berisi media MR-VP, kemudian diinkubasi selama 24 jam pada suhu 370C.
Setelah masa inkubasi, ditambahkan 0,6 mL larutan alpha-naphtol 5% dilanjutkan
0,2 mL KOH 40%. Larutan dikocok dengan hati-hati, dilonggarkan tutupnya, dan
dikocok kembali, diulangi setiap 5 menit. Perubahan warna dibaca setelah 30
menit. Hasil positif jika terjadi perubahan warna menjadi merah setelah 30 menit
penambahan reagen. Berdasarkan buku panduan determinasi bakteri (Holt, dkk.,
2000), S. mutans membentuk asam dari proses fermentasi karbohidrat (uji VP
positif).
f. Uji Triple Sugar Iron Agar (TSIA). Isolat murni bakteri diinokulasikan
dalam tabung berisi media TSIA secara tusukan menggunakan jarum inokulasi
dan streak menggunakan jarum ose. Perubahan warna media TSIA dari
merah-orange menjadi kuning menunjukkan adanya fermentasi gula, dan pembentukan
H2S dibandingkan dengan kontrol. Berdasarkan buku panduan determinasi bakteri
(Holt, dkk., 2000), S. mutans membentuk asam dari proses fermentasi karbohidrat
(uji TSIA positif).
6. Uji potensi antibakteri ekstrak etanol teh hijau terhadap S.mutans
dengan metode difusi paper disc
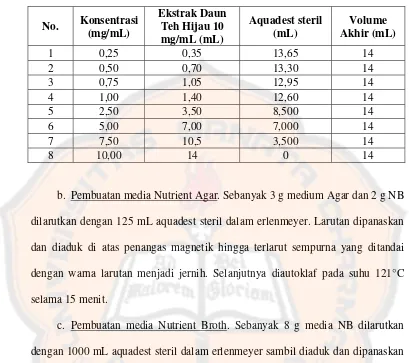
a. Pembuatan variasi konsentrasi ekstrak etanol teh hijau. Dibuat delapan
variasi konsentrasi teh hijau, yaitu 0,25; 0,5; 0,75; 1; 2,5; 5; 7,5; dan 10 mg/mL.
Konsentrasi ini berdasarkan penelitian yang dilakukan oleh Pratikno (2003)
Tabel I. Pengenceran ekstrak etanol teh hijau
b. Pembuatan media Nutrient Agar. Sebanyak 3 g medium Agar dan 2 g NB
dilarutkan dengan 125 mL aquadest steril dalam erlenmeyer. Larutan dipanaskan
dan diaduk di atas penangas magnetik hingga terlarut sempurna yang ditandai
dengan warna larutan menjadi jernih. Selanjutnya diautoklaf pada suhu 121°C
selama 15 menit.
c. Pembuatan media Nutrient Broth. Sebanyak 8 g media NB dilarutkan
dengan 1000 mL aquadest steril dalam erlenmeyer sambil diaduk dan dipanaskan
di atas penangas magnetik. Setelah seluruh NB melarut, masukkan media NB ke
dalam tabung reaksi untuk diautoklaf pada suhu 121°C selama 15 menit.
d. Pembuatan suspensi bakteri uji. Satu ose kultur murni S. mutans diambil
dan dimasukkan ke dalam media cair NB kemudian diinkubasi selama 24 jam
pada suhu 370C. Kekeruhan media NB dibandingkan dengan cairan standar Mc.
Farland II (6.108 CFU/mL). Apabila hasil dari kultur dalam NB tidak sama, maka
dapat ditambahkan NB steril hingga kekeruhannya setara dengan cairan standar
standar Mc. Farland II (6.108 CFU/mL), maka dapat diperkirakan terdapat sel
bakteri sebanyak 6 x 108 CFU/mL.
e. Uji potensi ekstrak etanol teh hijau terhadap S.mutans secara difusi paper
disc.
1) Kontrol kontaminasi media
Diambil tabung reaksi yang berisi 20 mL media NA dengan suhu
40-500C dan dituang ke dalam cawan petri dan dibiarkan memadat. Setelah memadat,
inkubasi media secara terbalik pada suhu 37°C selama 24 jam. Amati ada
tidaknya pertumbuhan mikroorganisme pada media.
2) Kontrol pertumbuhan bakteri uji
Diambil tabung reaksi yang berisi 20 mL media NA, dibiarkan agak
dingin (40-500C). Inokulasikan 1 mL suspensi bakteri S. mutans lalu divortex,
dimasukkan dalam cawan petri, dan dibiarkan memadat. Inkubasikan secara
terbalik selama 24 jam dan pada suhu 37°C. Amati pertumbuhan bakteri uji S.
mutans secara normal pada media NA.
3) Kontrol positif
Diambil 0,4 mL EGCG murni 10mg/mL dan dimasukkan ke dalam
flakon. Encerkan dengan menggunakan aquadest steril dan buat menjadi beberapa
variasi konsentrasi, yaitu 0,25; 0,5; 0,75; 1,0; 2,5; 5,0; 7,5 dan 10 mg/mL dan
masukkan dalam flakon. Autoklaf selama 1 jam dengan suhu 80°C.
4) Uji potensi
Sebanyak 1 mL suspensi bakteri uji diinokulasikan ke dalam 15-20
dibiarkan memadat. Setelah media memadat, diletakkan lima buah disc blank
dalam media cawan. Satu disc blank diisikan kontrol negatif, yaitu aquadest steril
dan empat disc blank, yang diletakkan pada empat kuadran berbeda, diisikan
variasi ekstrak (0,25 ; 0,5 ; 0,75 ; 1 ; 2,5 ; 5 ; 7,5 ; dan 10 mg/mL) masing-masing
sebanyak 25 µL. Kemudian diinkubasi selama 18-24 jam pada suhu 370C. Dibuat
replikasi sebanyak enam replikasi untuk mendapatkan data analisis statistik yang
valid.
7. Uji penentuan nilai KHM dan KBM ekstrak etanol teh hijau terhadap
S.mutans dengan metode dilusi cair
a. Pembuatan variasi konsentrasi ekstrak etanol. Dari hasil orientasi, dibuat
variasi konsentrasi teh hijau di mana pada konsentrasi tersebut memunculkan zona
hambat yang dilihat dari hasil uji potensi antibakteri. Dibuat 14 variasi konsentrasi
ekstrak etanol teh hijau (0,1; 0,2; 0,25; 0,3; 0,4; 0,5; 0,6; 0,7; 0,75; 0,8; 0,9; 1,0; 2;
2,5 mg/mL) dengan penurunan variasi konsentrasi sampai konsentrasi sekecil
mungkin yang menunjukkan potensi antibakteri dari uji difusi paper disc pada
tahap 6 yang selanjutnya menjadi acuan untuk memperoleh nilai KHM dan KBM.
b. Uji penentuan nilai KHM-KBM ekstrak etanol teh hijau terhadap
S.mutans dengan metode dilusi cair. Kontrol positif dibuat untuk 14 variasi
konsentrasi teh hijau. Ke dalam 15 mL media NB dimasukkan 1 mL ekstrak
etanol teh hijau dengan variasi konsentrasi 0,1; 0,2; 0,25; 0,3; 0,4; 0,5; 0,6; 0,7;
0,75; 0,8; 0,9; 1,0; 2; 2,5 mg/mL. Dilakukan pengukuran OD pada masing-masing
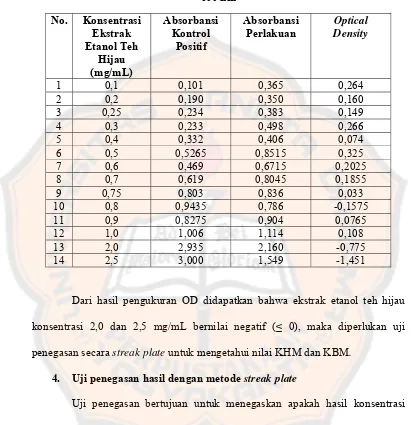
variasi konsentrasi teh hijau di jam ke-0. Pembuatan kontrol positif ini dilakukan