Perolehan Kembali Nikel Dari Limbah Baterai Ni-MH Dengan Metode
Leaching H
2SO4 Dan Ekstraksi Cair-Cair Menggunakan EkstraktanCyanex
®272 Dalam Pelarut Kerosin
Ir. Yuliusman, M.Eng dan Andhy Laksono
Departemen Teknik Gas dan Petrokimia, Fakultas Teknik Universitas Indonesia Kampus Baru UI, Depok 16424 Telp.7863515, 7863516
E-mail : usman@che.ui.edu yuliusman@yahoo.com
Abstrak
Logam berat yang terdapat pada elektroda baterai sekunder berpotensi untuk mencemari lingkungan, untuk itu dibutuhkan usaha meminimalisasi dampak limbah tersebut. Proses hidrometalurgi dikembangkan untuk mendaur ulang logam berharga seperti nikel dan kobalt yang terdapat pada baterai nickel-metal hydride bekas pakai. Setelah menghilangkan pembungkus luar, kemudian elektroda baterai dilarutkan ke dalam asam sulfat dengan konsentrasi 4 M selama 90 menit. Larutan yang diperoleh mengandung 46.820 ppm nikel serta 42.310 ppm kobalt dengan pH larutan sebesar 1. Nikel dan kobalt kemudian dipisahkan dengan metode ekstraksi cair-cair menggunakan Cyanex®272 dalam pelarut kerosin, kemudian dilanjutkan dengan proses stripping menggunakan asam sulfat. Nikel terekstrak secara optimum menggunakan Cyanex®272 dengan konsentrasi 0,018 M dan pH awal 7. Pada kondisi tersebut nikel yang terekstrak adalah sebesar 395,292 ppm dari kandungan awal larutan sebesar 455.51 ppm, sehingga persentase ekstraksi nikel adalah 86,78% berat. Proses stripping optimum ketika menggunakan asam sulfat dengan konsentrasi 2 M dan waktu kontak 30 menit. Pada kondisi tersebut nikel yang ter-stripping adalah sebesar 196,722 ppm dari kandungan awal sebesar 395,292 ppm, sehingga persentase stripping nikel sebesar 49,77% berat.
1. Pendahuluan
Baterai saat ini memegang peranan penting dalam kehidupan manusia. Jenis baterai yang saat ini sedang diminati pasar adalah baterai sekunder, hal ini disebabkan karena biaya penggunaanya yang lebih ekonomis apabila dibandingkan dengan baterai primer. Salah satu contoh baterai sekunder adalah baterai nickel-metal hydride (Ni-MH). Baterai Ni-MH menggunakan nikel hidroksida sebagai elektroda positif dan metal hydride yang berfungsi menyerap hydrogen pada elektroda
negatif. Kedua elektroda baterai tersebut dipisahkan oleh insulasi[1]. Reaksi keseluruhan yang terjadi saat proses pengisian dan pengosongan baterai Ni-MH adalah sebagai berikut[2]:
Dimana M merupakan suatu metal hydride. Penggunaan baterai Nickel-Metal Hydride (Ni-MH) mengalami peningkatan setiap tahunnya. Diperkirakan penggunaan baterai Ni-MH pada tahun 2010 adalah sebesar 1250 juta sel[1].
Untuk mengantisipasi semakin banyaknya limbah baterai yang dihasilkan, maka diperlukan suatu metode daur ulang yang menguntungkan dari segi ekonomi dan lingkungan. Dari segi ekonomi limbah baterai Ni-MH mengandung antara lain logam nikel dan kobalt yang memiliki nilai jual tinggi[2].
Pengambilan nikel dan kobalt dari limbah padat baterai Ni-MH dapat dilakukan dengan
proses leaching yang dilanjutkan dengan
melakukan beberapa metode, antara lain ekstraksi cair-cair, electrowinning, teknologi membran, dan pengendapan hidroksida. Pengambilan nikel dalam
penelitian ini dilakukan dengan melarutkan limbah baterai Ni-MH ke suatu pelarut melalui proses
leaching, kemudian melakukan metode ekstraksi
cair-cair dan selanjutnya melakukan proses
stripping. Proses-proses tersebut dilakukan dengan
tujuan mendapatkan larutan nikel dengan kemurnian tinggi.
Dalam penelitian ini digunakan H2SO4 sebagai
leachate dan stripping agent serta Cyanex®272 sebagai ekstraktan dengan pelarut kerosin.
2. Penelitian pengisian pengosongan MH NiOOH M OH Ni( )2+ + (1)
2.1. Bahan
Limbah baterai Ni-MH yang digunakan dalam penelitian ini adalah limbah baterai yang digunakan untuk telepon genggam merk nokia. Dengan elektroda positif dan elektroda negatif memiliki berat masing-masing 8,67 gr serta 8,179 gr. Kandungan komponen dalam baterai kemudian dianalisa menggunakan Energy Dispersive X-ray
Analysis (EDX). Hasil analisa menunjukkan bahwa
elektroda baterai mengandung 48,15% berat alumina, 0,49% berat karbon, 2,74% berat NaCl, 0,27% berat Mn, 18,56% berat kobalt, dan 27,35% berat.
Ekstraktan komersial yang digunakan yaitu Cyanex ®272 dengan kandungan senyawa aktif bis(2,4,4,-trimethylpenthyl) phosphinic acid.
Ekstraktan tersebut merupakan sampel Cyanex ®
272 yang diberikan oleh perusahaan Cytec Canada. Pelarut yang digunakan adalah kerosin.
2.2 Prosedur Percobaan
2.2.1 Leaching
Percobaan pertama adalah pengaruh konsentrasi leachate terhadap persentase leaching nikel dan kobalt. Leachate yang digunakan adalah H2SO4. Konsentrasi leachate divariasikan sebesar 1 – 4 M dan waktu kontak 120 menit. Setelah diperoleh konsentrasi optimum, dilanjutkan dengan percobaan pengaruh waktu kontak terhadap persentase leaching. Waktu kontak divariasikan dengan rentang 10 – 90 menit. Rasio solid liquid yang digunakan adalah sebesar 1/25 dan kecepatan pengadukan adalah konstan.
2.2.2 Ekstraksi
Percobaan ekstraksi yang pertama dilakukan adalah pengaruh pH fasa akutatik terhadap persentase ekstraksi nikel dan kobalt. pH fasa akuatik divariasikan dengan rentang 1-7, setelah diperoleh nilai pH optimum dilanjutkan dengan percobaan pengaruh konsentrasi Cyanex®272 terhadap persentase ekstraksi nikel dan kobalt. Konsentrasi Cyanex®272 divariasikan dengan rentang 0,006 – 0,03 M. Rasio akuatik organik adalah sebesar 1 dan kecepatan pengadukan yang konstan.
2.2.3 Stripping
Percobaan stripping bertujuan untuk
mengetahui pengaruh konsentrasi stripping agent terhadap persentase stripping nikel dari senyawa hasil ekstraksi. Konsentrasi stripping agent (H2SO4) divariasikan dengan rentang 0,5 – 1 M, dengan rasio fasa akuatik organik sebesar 1 dan kecepatan pengadukan konstan. Seluruh percobaan dilakukan dalam temperatur ruang.
2.2.4 Analisis
Konsentrasi logam dalam larutan di analisa menggunakan metode atomic absorption
spectroscopy (AAS), selanjutnya persentase masing-masing proses dihitung. Analisa komponen awal limbah elektroda baterai nickel-metal hydride (Ni-MH) menggunakan metode Energy Dispersive
X-ray Analysis (EDX).
3. Hasil dan Pembahasan
3.1 Leaching
3.1.1 Pengaruh konsentrasi leachate terhadap persentase leaching
Pengaruh konsentrasi H2SO4 terhadap persentase leaching logam nikel dan kobalt ditunjukkan oleh Gambar 1. Konsentrasi H2SO4 divariasikan dengan rentang 1 - 4 M.
0 20 40 60 80 100 0 1 2 3 4 5 Konsentrasi H2SO4 (M) Persentase Leaching (% ) Ni Co
Gambar 1. Pengaruh konsentrasi leachate terhadap persentase leaching nikel dan kobalt (T=27oC, t = 120 menit, L/S = 25 L/kg)
Persentase leaching dihitung terhadap larutan standar (leaching menggunakan H2SO4 5M selama 2 jam) yang mengandung 49.930 ppm nikel dan 43.320 ppm kobalt.
Reaksi yang terjadi pada saat proses leaching senyawa logam hidroksida adalah sebagai berikut [3]:
(2) dimana M adalah Ni atau Co.
Pada Gambar 1 terlihat bahwa semakin besar konsentrasi asam menyebabkan meningkatnya persentase leaching. Hal ini disebabkan semakin besar konsentrasi H2SO4,ion SO4
-2
dalam larutan
H2SO4 akan semakin besar pula. Sehingga
berdasarkan persamaan 2, apabila semakin besar ion SO4-2maka reaksi akan cenderung bergeser ke arah kanan, yang mengakibatkan semakin banyak logam bereaksi menjadi senyawa garam sulfat (MSO4).
Persentase leaching nikel maksimal yaitu sebesar 93,77% berat didapat pada konsentrasi H2SO4 4M, sedangkan persentase leaching kobalt yang diperoleh sebesar 97,67 % berat
) ( 2 ) ( 4 ) ( 4 2 ) ( 2 ) (OH s H SO aq MSO s HOaq M + ⇔ +
3.1.2 Pengaruh waktu kontak terhadap persentase
leaching
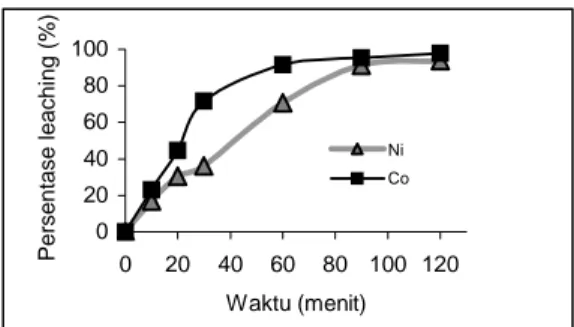
Pengaruh waktu kontak terhadap persentase
leaching logam nikel dan kobalt ditunjukkan oleh
Gambar 2. 0 20 40 60 80 100 0 20 40 60 80 100 120 Waktu (menit) Persentase leaching (% ) Ni Co
Gambar 2. Pengaruh waktu kontak terhadap persentase leaching nikel serta kobalt (T=27oC, H2SO4 4 M, L/S = 25 L/kg)
Pada Gambar 2 terlihat bahwa persentase
leaching nikel maksimal yaitu sebesar 93,77% berat
yang diperoleh pada waktu kontak selama 120 menit. Persentase leaching nikel dengan waktu kontak 120 menit lebih besar 2,54% daripada persentase leaching nikel dengan waktu 90 menit. Perbedaan persentase tersebut relatif cukup kecil apabila dibandingkan dengan selisih persentase
leaching nikel antara waktu kontak sebesar 90
menit dan 60 menit sebesar 20,49 %. Untuk meminimalkan waktu proses, disimpulkan bahwa waktu kontak optimum adalah sebesar 90 menit.
Percobaan leaching yang telah dilakukan menyimpulkan bahwa pada temperatur ruang, rasio solid liquid (wt/wt) sebesar 1/25 kondisi operasi optimum adalah dengan menggunakan H2SO4 4 M dan waktu kontak 90 menit.
3.2 Ekstraksi
3.2.1 Pengaruh pH awal fasa akuatik terhadap persentase ekstraksi.
Gambaran pengaruh pH larutan hasil leaching terhadap persentase ekstraksi nikel dan kobalt ditunjukkan oleh Gambar 3
Gambar 3. Pengaruh pH awal fasa akuatik terhadap persentase ekstraksi nikel serta kobalt (T=27oC,
Cyanex®272 0.03 M, O/A = 1, t = 60 menit,
kandungan awal fasa akuatik 455,51 ppm nikel dan 412,93 ppm kobalt)
Sesuai Gambar 3 terlihat dengan semakin besarnya pH limbah maka semakin besar pula persentase ekstraksi nikel. Persentase ekstraksi nikel maksimal yaitu sebesar 89,88% berat dan diperoleh pada pH awal fasa akuatik sebesar 7. Sementara kobalt terekstrak maksimum pada saat pH awal sebesar 5 dengan persentase ekstraksi sebesar 92,1% berat.
Kenaikan pH limbah menyebabkan kenaikan persentase ekstraksi hingga mencapai pH tertentu. Selanjutnya dengan penambahan pH persentase ekstraksi akan mengalami penurunan. pH sistem akan mempengaruhi ion logam dan ekstraktan. Pada pH rendah kemampuan ekstraksi menurun akibat efek dari pendonoran proton kepada ekstraktan. Pendonoran proton tersebut menyebabkan ekstraktan sulit terionisasi sehingga proses ekstraksi ion logam tidak berjalan sempurna[4].
Pada pH tinggi kemampuan ekstraksi menurun akibat hidrolisis pada ion logam. Reaksi hidrolisis akan menghasilkan senyawa logam hidroksida yang tak larut. Hal ini menyebabkan logam tidak berada dalam bentuk ion pada larutan akuatik, sehingga logam akan sulit terekstrak[4].
pH optimal untuk ekstraksi nikel pada percobaan ini ditetapkan yaitu saat pH awal 7 dengan persentase ekstraksi nikel sebesar 89,88% berat dan persentase ekstraksi kobalt sebesar 2,3% berat.
3.3.2 Pengaruh konsentrasi ekstraktan terhadap persentase ekstraksi
Pengaruh konsentrasi ekstraktan terhadap persentase ekstraksi logam nikel dan kobalt ditunjukkan oleh Gambar 4.
Gambar 4. Pengaruh konsentrasi ekstraktan terhadap persentase ekstraksi nikel dan kobalt (T=27oC, pH awal 7, O/A = 1, t = 60 menit, kandungan awal fasa akuatik 455,51 ppm nikel dan 412,93 ppm kobalt) 0 20 40 60 80 100 0 1 2 3 4 5 6 7 pH Awal Persentase ekstraksi (% ) Ni Co 0 10 20 30 40 50 60 70 80 90 100 0 0,01 0,02 0,03 0,04 Konsentrasi Cyanex 272 (M) Persentase ekstraksi (% ) Ni Co
Gambar 4 menunjukkan bahwa semakin besar konsentrasi larutan ekstraktan, maka semakin besar pula persentase ekstraksi nikel dan kobalt yang diperoleh. Persentase ekstraksi nikel maksimal yaitu sebesar 89,21% berat diperoleh pada konsentrasi ekstraktan terbesar, yaitu 0,03 M. Penggunaan konsentrasi sebesar 0,03 M dan 0,024 M dari segi biaya dinilai tidak ekonomis, karena kenaikan persentase ekstraksi yang dihasilkan terlalu kecil apabila dibandingkan penambahan konsentrasi ekstraktan. Sehingga ditentukan konsentrasi ekstraktan optimal ialah 0,018 M.
Mekanisme yang terjadi pada proses ekstraksi Ni2+ maupun Co2+ dapat dilihat pada Gambar 5. Dimana untuk mengikat satu ion logam, baik Ni2+ maupun Co2+ diperlukan dua molekul bis
(2,4,4,-trimethylpenthyl) phosphinic acid.
M2+ (R)2P O OH (R)2 (R)2 P O P O M O O 2H+ 2 + +
Gambar 5. Mekanisme reaksi ekstraksi
menggunakan Cyanex®272[4]
Pada percobaan ini disimpulkan kondisi optimum untuk pemisahan nikel dan kobalt adalah dengan menggunakan pH awal sebesar 7, rasio akuatik organik (v/v) sebesar 1, konsentrasi ekstraktan Cyanex®272 0,018 M dengan pelarut kerosin, dan waktu ekstraksi selama 60 menit diperoleh persentase ekstraksi nikel sebesar 86,78% berat serta kobalt sebesar 1,93% berat.
3.3 Stripping
Pengaruh konsentrasi H2SO4 terhadap
persentase stripping logam nikel dan kobalt ditunjukkan oleh Gambar 6.
0 20 40 60 80 100 0 1 2 3 H2SO4 (M) Stripping (%) Ni Co
Gambar 6. Pengaruh konsentrasi H2SO4 terhadap persentase stripping nikel dan kobalt (T=27oC, , O/A = 1, t = 30 menit, larutan awal fasa organik
mengandung 395,292 ppm nikel dan 7,969 ppm kobalt)
Gambar 6 menunjukkan proses stripping nikel mencapai nilai maksimum ketika digunakan H2SO4 dengan konsentrasi sebesar 2 M, dengan persentase
stripping nikel 49,77% berat dan kobalt 84,10%
berat.
Kecendrungan yang terjadi pada proses
stripping logam nikel dan kobalt adalah semakin
besar konsentrasi H2SO4 maka semakin besar pula persentase stripping yang dihasilkan. Reaksi yang terjadi dalam proses ekstraksi dan stripping ialah sebagai berikut:
MAn + nH
+ Ù Mn+
+ nHA (3) Dimana Mn+ adalah ion logam, nHA adalah senyawa ekstraktan, MAn adalah senyawa yang terbentuk akibat ikatan ion logam dengan ekstraktan dan H+ adalah ion hidrogen.
Penambahan ion H+ (konsentrasi asam semakin besar) akan menggeser kesetimbangan ke arah kanan sehingga mengubah senyawa MAn menjadi ion logam Mn+ dan ekstraktan HA[4]. Dengan demikian dihasilkan persentase stripping yang semakin besar.
Persentase stripping kobalt selalu lebih besar daripada persentase stripping nikel pada setiap konsentrasi H2SO4. Hal ini disebabkan karena ikatan yang terbentuk antara O dengan Ni2+ lebih kuat dibandingkan dengan ikatan antara O dengan Co2+. Ikatan yang lebih kuat antara ion Ni2+ dengan O disebabkan karena elektronegativitas Ni yang lebih besar dibandingkan dengan elektronegativitas Co. Ni memiliki nilai elektronegativitas sebesar 1,8, sedangkan untuk Co nilainya adalah 1,7[5].
Gambar 7 menunjukkan kandungan nikel dan kobalt dalam fasa akuatik.
0 50 100 150 200 250 0 0,5 1 1,5 2 2,5 Konsentrasi H2SO4 (M)
Kandungan dalam fas
a
akuatik (ppm)
Ni Co
Gambar 7 Konsentrasi nikel dan kobalt pada fasa akuatik dengan menggunakan stripping H2SO4 pada temperatur 27oC, rasio akuatik organik (v/v)1 dan waktu kontak 30 menit. Larutan awal fasa organik mengandung 395,292 ppm nikel dan 7,969 ppm kobalt.
4. Kesimpulan
Berdasarkan hasil penelitian dan analisa yang telah dilakukan, maka dapat disimpulkan:
1. Proses leaching elektroda baterai NiMH menggunakan H2SO4 leachate rasio solid liquid (wt/wt) sebesar 1:25 dan temperatur ruang mancapai nilai optimum pada konsentrasi H2SO4 4 M dan waktu kontak 90 menit. Kandungan nikel serta kobalt dalam larutan hasil proses leaching adalah masing-masing sebesar 45.551 ppm dan 41.293 ppm. Persentase leaching yang diperoleh adalah sebesar 91,23% berat untuk nikel dan 95,32% berat untuk kobalt.
2. Proses ekstraksi nikel dengan waktu kontak selama 60 menit, rasio akuatik organik (v/v) 1 serta pelarut kerosin mencapai optimum ketika dilakukan menggunakan konsentrasi Cyanex®272 0,018 M dan pH awal 7. Pada kondisi tersebut nikel yang terekstrak adalah sebesar 395,292 ppm dari kandungan awal larutan sebesar 455.51 ppm, sehingga persentase ekstraksi nikel adalah 86,78% berat. Kobalt yang terekstrak adalah sebesar 7,969 ppm dari kandungan awal sebesar 412.93 ppm, maka persentase ekstraksi kobalt adalah 1,93% berat.
3. Proses stripping nikel dengan waktu kontak selama 30 menit, rasio akuatik organik (v/v) 1, pada temperatur ruang mencapai maksimum ketika dilakukan menggunakan H2SO4 2 M. Pada kondisi tersebut nikel ter-stripping adalah sebesar 196,722 ppm dari kandungan awal sebesar 395,292 ppm, sehingga persentase
stripping nikel sebesar 49,77% berat. Kobalt
yang ter-stripping adalah sebesar 6,702 ppm dari kandungan awal sebesar 7,969 ppm, besarnya persentase stripping kobalt sebesar 84,10% berat
5. Daftar Pustaka
[1] Noréus, Dag., “Substitution of Rechargeable NiCd Batteries A Background Document to Evaluate the Possibilities of Finding Alternatives to NiCd Batteries”, Stockholm University, (2000)
[2] Zhang, Pingwei., et al. “Recovery of Metal Value from Spent Nickel-Metal Hydride Rechargeable Batteries”, Journal of Power Sources., 77, 116-122 (1999).
[3] Nogueira ,C.A., F. Margarido. “Leaching
Behaviour of Electrode Materials of Spent Nikel-Cadmium Batteries in Sulphuric Acid Media“ Hydrometallurgy (2002).
[4] Ritchey, G.M., and Ashbrook A.W. “Solvent Extraction, Principle and Application Process Metallurgy," Elsevier, New York (1984). [5] Brady, James.E., “Kimia Universitas Asas &