1 PERCOBAAN E-2
KELARUTAN TIMBAL BALIK
I. TUJUAN
a) Menentukan fraksi mol dalam tiap campuran fenol-air
b) Menentukan suhu rata-rata terjadinya perubahan jumlah fasa pada tiap campuran fenol-air
c) Menentukan kelarutan timbal balik antara dua cairan
d) Menentukan hubungan kelarutan dengan suhu dalam suatu diagram fasa
II. DASAR TEORI
Kelarutan atau solubilitas adalah kemampuan suatu zat kimia tertentu, zat terlarut (solute), untuk larut dalam suatu pelarut (solvent). Kelarutan dinyatakan dalam jumlah maksimum zat terlarut yang larut dalam suatu pelarut pada kesetimbangan. Larutan hasil disebut larutan jenuh. Zat-zat tertentu dapat larut dengan perbandingan apapun terhadap suatu pelarut. Contohnya adalah etanol di dalam air. Sifat ini lebih dalam bahasa Inggris lebih tepatnya disebut miscible. Pelarut umumnya merupakan suatu cairan yang dapat berupa zat murni ataupun campuran. Zat yang terlarut, dapat berupa gas, cairan lain, atau padat. Kelarutan bervariasi dari selalu larut seperti etanol dalam air, hingga sulit terlarut, seperti perak klorida dalam air. Istilah “tak larut” (insoluble) sering diterapkan pada senyawa yang sulit larut, walaupun sebenarnya hanya ada sangat sedikit kasus yang benar-benar tidak ada bahan yang terlarut. Dalam beberapa kondisi, titik kesetimbangan kelarutan dapat dilampaui untuk menghasilkan suatu larutan yang disebut lewat jenuh yang metastabil.
Sistem biner fenol – air merupakan sistem yang memperlihatkan sifat solubilitas timbal balik antara fenol dan air pada suhu tertentu dan tekanan tetap. Solubilitas (kelarutan) adalah kemampuan suatu zat kimia tertentu, zat terlarut (solute), untuk larut dalam suatu pelarut (solvent). Kelarutan dinyatakan dalam jumlah maksimum zat terlarut yang larut dalam suatu pelarut pada kesetimbangan. Larutan hasil disebut larutan jenuh. Zat-zat tertentu dapat larut dengan perbandingan apapun terhadap suatu pelarut. Contohnya adalah etanol di dalam air. Sifat ini lebih dalam bahasa Inggris lebih tepatnya disebut miscible. Pelarut umumnya merupakan suatu cairan yang dapat berupa zat murni ataupun campuran.
2 Campuran terdiri dari beberapa jenis. Di lihat dari fasenya, Pada system biner fenol –air, terdapat 2 jenis campuran yang dapat berupah pada kondisi tertentu. Suatu fase didefenisikan sebagai bagian system yang seragam atau homogeny diantara keadaan submakroskopiknya, tetapi benar – benar terpisah dari bagian system yang lain oleh batasan yang jelas dan baik. Campuran padatan atau dua cairan yang tidak saling bercampur dapat membentuk fase terpisah. Sedangkan campuran gas-gas adalah satu fase karena sistemnya yang homogen. Symbol umum untuk jumlah fase adalah P (Dogra SK & Dogra S, 2008 ).
Zat yang terlarut, dapat berupa gas, cairan lain, atau padat. Kelarutan bervariasi dari selalu larut seperti etanol dalam air, hingga sulit terlarut, seperti perak klorida dalam air. Istilah “tak larut” (insoluble) sering diterapkan pada senyawa yang sulit larut, walaupun sebenarnya hanya ada sangat sedikit kasus yang benar-benar tidak ada bahan yang terlarut. Dalam beberapa kondisi, titik kesetimbangan kelarutan dapat dilampaui untuk menghasilkan suatu larutan yang disebut lewat jenuh yang metastabil atau mengendap.
Kelarutan timbal balik adalah kelarutan dari suatu larutan yang bercampur sebagian bila temperaturnya di bawah temperatur kritis. Jika mencapai temperatur kritis, maka larutan tersebut dapat bercampur sempurna (homogen) dan jika temperaturnya telah melewati temperatur kritis maka sistem larutan tersebut akan kembali dalam kondisi bercampur sebagian lagi. Salah satu contoh dari temperatur timbal balik adalah kelarutan fenol dalam air yang membentuk kurva parabola yang berdasarkan pada bertambahnya % fenol dalam setiap perubahan temperatur baik di bawah temperatur kritis. Jika temperatur dari dalam kelarutan fenol aquadest dinaikkan di atas 50°C maka komposisi larutan dari sistem larutan tersebut akan berubah. Kandungan fenol dalam air untuk lapisan atas akan bertambah (lebih dari 11,8 %) dan kandungan fenol dari lapisan bawah akan berkurang (kurang dari 62,6 %). Pada saat suhu kelarutan mencapai 66°C maka komposisi sistem larutan tersebut menjadi seimbang dan keduanya dapat dicampur dengan sempurna.
Sistem biner fenol – air merupakan sistem yang memperlihatkan sifat kelarutan timbal balik antara fenol dan air pada suhu tertentu dan tekanan tetap. Disebut sistem biner karena jumlah komponen campuran terdiri dari dua zat yaitu fenol dan air. Fenol dan air kelarutanya akan berubah apabila dalam campuran itu ditambahan salah satu
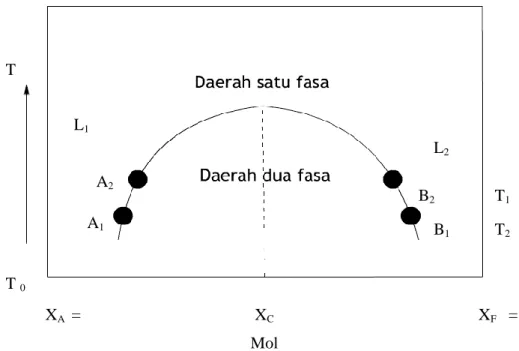
3 komponen penyusunnya yaitu fenol atau air. Jika komposisi campuran fenol air dilukiskan terhadap suhu akan diperoleh kurva yang ditunjukan pada gambar 1..
Gambar 1. Komposisi campuran fenol air
L1 adalah fenol dalam air, L2 adalah air dalam fenol, XA dan XF masing-masing adalah mol fraksi air dan mol fraksi fenol, XC adalah mol fraksi komponen pada suhu kritis (Tc). Sistem ini mempunyai suhu kritis (Tc) pada tekanan tetap, yaitu suhu minimum pada saat dua zat bercampur secara homogen dengan komposisi Cc. Pada suhu T1 dengan komposisi di antara A1 dan B1 atau pada suhu T2 dengan komposisi di antara A2 dan B2, sistem berada pada dua fase (keruh). Sedangkan di luar daerah kurva (atau diatas suhu kritisnya, Tc), sistem berada pada satu fase (jernih).
Temperatur kritis atas Tc adalah batas atas temperatur dimana nterjadi pemisahan fase.Diatas temperatur batas atas, kedua komponen benar-benar bercampur.Temperatur ini ada gerakan termal yang lebih besar menghasilkan kemampuan campur yang lebih besar pada kedua komponen, (Atkins PW, 1999).
Beberapa system memperlihatkan temperatur kritis Tc . dimana dibawah temperatur itu kedua komponen bercampur dalam segala perbandingan dan diatas temperatur itu kedua komponen membentuk dua fase. Salah satu contohnya adalah air-trietilamina. Dalam hal ini pada temperatur rendah kedua komponen lebih dapat campur karena komponen-komponen itu membentuk kompleks yang lemah, pada
T T 0 L1 L2 A2 A1 B2 B1 XA = XC Mol XF = T1 T2
4 temperatur lebih lebih tinggi kompleks itu terurai dan kedua komponen kurang dapat bercampur, ( Atkins PW ,1999).
IV. DATA PENGAMATAN
TRuangan = 26oC
Massa piknometer kosong=26,85gram Massa piknometer penuh air=51,87gram
Massa piknomet er penuh NaCl 1%=52,04gram Massa piknometer penuh metanol 1%=51,84gram
LARUTAN (mL) TBENING (OC) TKERUH (OC) AIR FENOL 4 4 66 64,5 5 4 65 63 6 4 67 65 8 4 67,5 64 10 5 68 66,5 6,5 6 65 64 8,5 7 64 62,5 10,5 8 67 66
5
FENOL + NaCl 79 74
FENOL + CH3OH 64 62
V. PENGOLAHAN DATA
1. Penentuan Volume Piknometer
VPIKNO =[ (Wpikno+air)-Wpikno kosong] / [massa jenis air pada Truang] =[51,87gram-26,85gram]/[1gram/ml]
=25,02 ml
2. Penentuan massa jenis zat a. Massa jenis NaCl
Massa jenis NaCl =[ (Wpikno+NaCl)-Wpikno kosong] / [VPIKNO] =[52,04gram-26,85gram] / 25,02ml = 1,0067 gram/ml
b. Massa jenis metanol
Massa jenis metanol =[ (Wpikno+metanol)-Wpikno kosong] / [VPIKNO] =[51,84gram-26,85gram] / 25,02 ml = 0,9988 gram/ml
c. Massa jenis air
Massa jenis air =[ (Wpikno+air)-Wpikno kosong] / [VPIKNO]
=[51,87gram-26,85gram] / 25,02 ml = 1gram/ml
3. Penentuan Trata-rata
6 LARUTAN (mL) TBENING (OC) TKERUH (OC) TRATA-RATA (OC) AIR FENOL 4 4 66 64,5 62,5 5 4 65 63 64 6 4 67 65 66 8 4 67,5 64 65,75 10 5 68 66,5 67,25 6,5 6 65 64 64,5 8,5 7 64 62,5 63,25 10,5 8 67 66 66,5 FENOL + NaCl 79 74 76,5 FENOL + CH3OH 64 62 63
4. Penentuan fraksi mol dalam sistem fenol : air Mol fenol = = 0,0425 mol Mol air = [ ] = 0,2222 mol Xf enol= = 0,1605
7 Xa ir= 1 – 0,16 = 0,8395
Dengan cara yang sama maka akan didapatkan nilai fraksi mol air dan fenol seperti dalam tabel di bawah ini:
FRAKSI MOL FENOL (Xf) AIR (Xa) 0,1605 0,8345 0,1327 0,8673 0,1130 0,8870 0,0873 0,9127 0,0872 0,9128 0,1499 0,8501 0,1361 0,8639 0,1272 0,8728
8 5. Penentuan fraksi mol fenol (sistem fenol-air-NaCl)
WNaCl=[ 1 gram / 100 ml larutan] x 6ml NaCl 1% =0,06gram
Mol NaCl= [WNaCl / Mr NaCl]
= [0,06gram / 58,44gram mol-1 ] =0,001026mol
Mol fenol = [gram/Mr fenol]
=[6gram / 94,11gram mol-1 = 0,0637
VNaCl =[WNaCl/Massa jenis NaCl] =[0,06gram / 1,0067gram/ml] =0,0596 ml
Vair=VNaCl1%-VNaCl = 6 ml – 0,0596 = 5,9404 ml Jadi, mol air adalah:
nair=[Vair x massa jenis air] / Mr air =[5,9404ml x 1g/ml] / 18gram/mol = 0,33 mol
sehingga fraksi mol fenol nya: Xfenol=[nfenol] / [nfenol+nair+nNaCl]
=[0,0637mol] / [0,0637mol+0,33mol+0,001026mol] =0,16137
Xair= 1-0,16137 = 0,83863
6. Penentuan fraksi mol fenol (sistem fenol –air-metanol) VMETANOL={[1ml metanol]/100ml larutan} x Vmetanol1%
9 Massa metanol=Vmetanol x massa jenis metanol
=0,06mlx0,9988gram/ml =0,059928gram
Mol metanol = [gram/Mr metanol]
=[0,059928gram ]/ [32gram/mol] =1,87275 x 10-3 mol
Mol fenol = [gram/Mr fenol]
=[4gram] / [94,11gram/mol] =0,0425mol
Vair = Vmetanol 1% - Vmetanol = 6ml – 0,06ml
= 5,94 ml Jadi, mol air adalah:
nair=[Vair x massa jenis air] / Mr air =[5,94ml x 1g/ml] / [18gram/mol] = 0,33 mol
sehingga fraksi fenol nya:
Xfenol=[nfenol] / [nfenol+nair+nmetanol]
=[0,0425mol] / [0,0425mol+0,33mol+0,00187275mol] =0,1135
Xair=1-0,1135 = 0,8865