1
LAPORAN PRAKTIKUM KIMIA FISIKA
KELARUTAN TIMBAL BALIK SISTEM BINER FENOL – AIR
I. TUJUAN
1. Memperoleh kurva komposisi sistem fenol-air terhadap suhu pada tekanan tetap
2. Menentukan suhu kritis kelarutan timbal balik sistem fenol-air
II. DASAR TEORI
Kelarutan adalah kemampuan suatu zat kimia tertentu, zat terlarut (solute), untuk larut dalam suatu pelarut (solvent). Kelarutan dinyatakan dalam jumlah maksimum zat terlarut yang larut dalam suatu pelarut pada kesetimbangan. Larutan hasil disebut larutan jenuh. Zat-zat tertentu dapat larut dengan perbandingan apapun terhadap suatu pelarut. Contohnya adalah etanol di dalam air. Sifat ini lebih dalam bahasa Inggris lebih tepatnya disebut miscible. Pelarut umumnya merupakan suatu cairan yang dapat berupa zat murni ataupun campuran (Darmaji, 2005).
Kelarutan timbal balik adalah kelarutan dari suatu larutan yang bercampur sebagian bila temperaturnya di bawah temperatur kritis. Jika mencapai temperatur kritis, maka larutan tersebut dapat bercampur sempurna (homogen) dan jika temperaturnya telah melewati temperatur kritis maka sistem larutan tersebut akan kembali dalam kondisi bercampur sebagian lagi. Salah satu contoh dari temperatur timbal balik adalah kelarutan fenol dalam air yang membentuk kurva parabola yang berdasarkan pada bertambahnya % fenol dalam setiap perubahan temperatur baik di bawah temperatur kritis (Sukardjo, 2003).
Jika temperatur dari dalam kelarutan fenol aquadest dinaikkan di atas 50°C maka komposisi larutan dari sistem larutan tersebut akan berubah. Kandungan fenol dalam air untuk lapisan atas akan bertambah (lebih dari 11,8 %) dan kandungan fenol dari lapisan bawah akan berkurang (kurang dari 62,6 %). Pada saat suhu kelarutan mencapai 66°C maka komposisi sistem larutan tersebut menjadi seimbang dan keduanya dapat dicampur dengan sempurna.Temperatur kritis adalah kenaikan temperatur tertentu dimana akan diperoleh komposisi larutan yang berada dalam kesetimbangan. (Karyadi,2002).
2
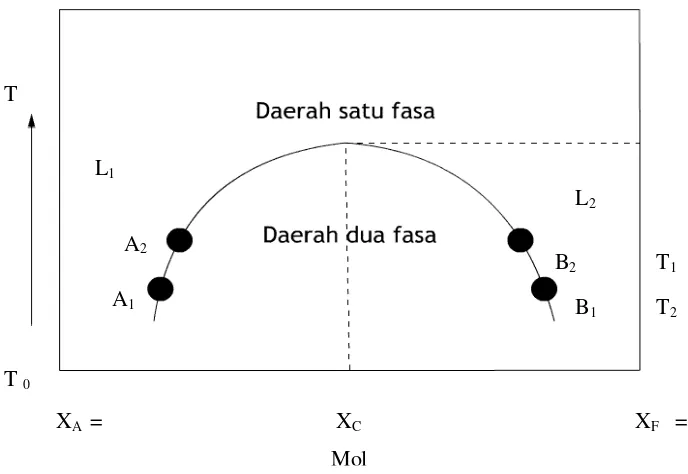
fenol dan air. Fenol dan air kelarutanya akan berubah apabila dalam campuran itu ditambahan salah satu komponen penyusunnya yaitu fenol atau air. Jika komposisi campuran fenol air dilukiskan terhadap suhu akan diperoleh kurva sebagai berikut.Gambar 1. Komposisi campuran fenol air
L1 adalah fenol dalam air, L2 adalah air dalam fenol, XA dan XF masing-masing adalah mol fraksi air dan mol fraksi fenol, XC adalah mol fraksi komponen pada suhu kritis (Tc). Sistem ini mempunyai suhu kritis (Tc) pada tekanan tetap, yaitu suhu minimum pada saat dua zat bercampur secara homogen dengan komposisi Cc. Pada suhu T1 dengan komposisi di antara A1 dan B1 atau pada suhu T2 dengan komposisi di antara A2 dan B2, sistem berada pada dua fase (keruh). Sedangkan di luar daerah kurva (atau diatas suhu kritisnya, Tc), sistem berada pada satu fase (jernih).
Temperatur kritis atas Tc adalah batas atas temperatur dimana nterjadi pemisahan fase.Diatas temperatur batas atas, kedua komponen benar-benar bercampur.Temperatur ini ada gerakan termal yang lebih besar menghasilkan kemampuan campur yang lebih besar pada kedua komponen, (Atkins PW, 1999).
T
T 0
L1
L2
A2
A1
B2
B1
XA = XC
Mol
XF = T1
3
III.
ALAT DAN BAHAN
a) Alat
1. Tabung reaksi diameter 4 cm 1 buah
2. Pemanas 1 set
3. Pengaduk 1 buah
4. Gelas kimia 1 L 1 buah 5. Buret 50 mL 1 buah 6. Statif dan klem 1 buah
7. Termometer 1 buah
b) Bahan 1. Fenol 2. Aquades
IV.
CARA KERJA
Susunan alat
Menimbang Fenol 4 gram terlebih dahulu ke dalam tabung
Mentiitrasi dengan aquades hingga keruh, catat mL
aquades yang didapat
Ulangi beberapa kali
4
Tujuan dari percobaan ini yaitu untuk menetapkan (mencari) suhu kelarutan kritis (titik konsulat) system biner air- phenol. Pada percobaan ini dilakukan beberapa perbandingan empat belas perbandingan yaitu 4:2,5 ; 4:2,8 ; 4:3,2 ; 4:3,7 ; 4:4,3 ; 4:5,1 ; 4:6,1 ; 4:7,6 ; 4:10,1 ; 4:15,1 ; 4:27,6 ; 4:43,6 ; 4:60,1 ; 4:80,1. Dari perbandingan tersebut kita dapat menentukan titik kritis (titik konsulat) dari system biner air-phenol. Temperatur kritis atas Tc adalah batas atas temperatur dimana nterjadi pemisahan fase. Diatas temperatur batas atas, kedua komponen benar-benar bercampur. Temperatur ini ada gerakan termal yang lebih besar menghasilkan kemampuan campur yang lebih besar pada kedua komponen
5
jernih. Dalam proses pemanasan campuran dilakukan pengocokan yang dimaksudkan untuk mencampurkan secara sempurna antara air dan phenol. Ketika dilakukan pengocokan tidak terbentuk campuran keruh dan tidak terbentuk dua lapisan, pemanasan dihentikan dan dicatat suhunya sebagai suhu dimana terbentuk system satu fasa. Ketika campuran kembali keruh suhunya juga dicatat sebagai suhu dimana terbentuk kembali system dua fase atau air dan phenol kembali tidak bercampur.Dalam percobaan ini, diperoleh larutan yang tidak saling bercampur, yang membentuk dua lapisan , lapisan atas air dan lapisan bawah adalah fenol, hal ini di sebabkan karena air memiliki massa jenis yang lebih rendah dari pada fenol. Setelah terjadi percampuran antara air dan fenol dalam tabung yang berbeda dengan perbandingan kompsisi yang berbeda pula, di lakukan pemanasan yang menyebabkan larutan menjadi bening yang sebelumnya keruh karena penambahan aquades kemudian dilakukan pendinginan yang menyebabkan larutan menjadi keruh kembali. Larutan keruh ini akan berubah kembali menjadi jernih (ketika dipanaskan) dan sebaliknya larutan jernih akan keruh kembali (ketika didinginkan). Hal ini menandakan kalau zat mengalami perubahan kelarutan yang dipengaruhi oleh perubahan suhu.
Pada percobaan ini komponen air selalu ditambahkan dan jumlah fenolnya tetap sehingga perubahan larutan dari jernih menjadi keruh atau sebaliknya terjadi pada suhu yang berubah-ubah. Perubahan suhu bergantung pada komposisi atau fraksi mol kedua zat. Kelarutan Fenol dan air akan berubah apabila ke dalam campuran itu ditambahkan dengan salah satu komponen penyusunnya.
Beradasarkan data percobaan, dapat dibuat grafik sistem biner fenol – air, yaitu antara fraksi mol vs suhu (T). Grafik ini berbentuk parabola dimana puncaknya merupakan suhu kritis (Tc) yang dicapai pada saat komponen mempunyai fraksi mol tertentu. Suhu kritis dalam percobaan ini adalah 56ºC dengan komposisi campurannya adalah fraksi mol fenol 0,091556 dan fraksi mol airnya 0,90844391.
6
VI.
KESIMPULAN DAN SARAN
Kesimpulan
Dari hasil pembahasan dapat disimpulkan bahwa :
a. Keadaan dimana terjadinya perubahan warna dari keruh menjadi jernih dan sebaliknya merupakan contoh kelarutan timbal balik
b. Dalam percobaan ini, temperatur berbanding lurus dengan volume air yang digunakan
c. Suhu kritis dalam percobaan kelarutan timbal balik sistem biner fenol-air yaitu 56oC dengan fraksi mol airnya 0,90844391
Saran
a. Sebelum melakukan percobaan, sebaiknya praktikan hendaknya melakukan persiapan secara matang
b. Saat melaksanakan percobaan, praktikan sebaiknya lebih teliti dalam melakukan pengamatan
c. Praktikan harus lebih hati-hati selama percobaan berlangsung, karena zat yang digunakan adalah fenol yang apabila terkena kulit dapat menyebabkan luka
VII.
DAFTAR PUSTAKA
Atkins PW. 1999. Kimia Fisika. “Ed ke-2 Kartahadiprodjo Irma I, penerjemah ; Indarto Purnomo Wahyu, editor. Jakarta : Erlangga. Terjemahan dari : Physichal Chemistry.
Darmaji.2005.Kimia Fisika I.Jambi : Universitas Jambi.
Sukardjo.2003.Dasar-Dasar Kimia Fisika.Jogjakarta : Universitas Gajah Mada. Karyadi, Beny.2002.Kimia Fisika.Jakarta : Erlangga.
Mengetahui, Semarang, 6 Oktober 2012 Dosen Pengampu Praktikan,
7
VIII.
JAWABAN PERTANYAAN
1. Tuliskan rumus kimia fenol dan hitung massa molekulnya (Mr)!
Fenol mempunyai rumus kimia C6H5OH dengan nilai Mr = 94. Rumus strukturnya sebagai berikut.
2. Jika fenol yang digunakan berkadar 95% (b/b) dan massa yang ditimbang sebesar 5,140 gram, hitung jumlah mol fenol!
Massa fenol = 95% x 5,140 = 4,883 g Mol fenol = 4,883 = 0,052 mol
94
3. Jelaskan dengan singkat apa yang dimaksud dengan fase? Adakah perbedaan dengan wujudnya?
Fase adalah bagian serba sama dari suatu zat yang dapat dipisahkan secara mekanik serta serba sama dalam sifat fisika dan kimia, sedangkan wujud merupakan bentuk zat pada suhu tertentu. Zat pada suhu yang berbeda mungkin mempunyai wujud yang berbeda. Misal air pada suhu -10ºC wujudnya padat, sedangkan pada suhu 10ºC wujudnya cair.
4. Berapa komposisi campuran fenol dan air dalam % (b/b) pada suhu kritis larutannya?
Massa fenol = 5 g Fraksi mol fenol = 0,059 Massa air = 15,1 g Fraksi mol air = 0,041 Komposisi campuran dalam %
Fenol : 5 x 100%= 24,876% air : 15,1 x 100% = 75,124% 5+15,1 5+15,1
5. Berapa komposisi campuran fenol dan air dalam satuan mol fraksi pada suhu 50ºC, dimana sistem berada pada satu fase dan dua fase?
Komposisi campuran pada suhu 50ºC (diambil dari Trata2 = 50,5oC)
Xfenol = 0,219 Xair = 1-0,219 = 0,781
8
IX.
LAMPIRAN
Data
Massa fenol yang ditimbang = 4 gram
1. Penambahan aquades, sampai terjadi kekeruhan pertama
No. Aquades (ml) Pengamatan T1 T2 Trata-rata
1. 2,3 keruh 42 29 35,5
2. Penambahan aquades, setelah terjadi kekeruhan
NO Aquades (mL)
Massa (g) Suhu (0C) % Massa Fenol Air T1 T2 T Fenol Air 1 0,2 4 2,5 42 30 36 61,54 38,46 2 0,3 4 2,8 45 33 39 58,82 41,18 3 0,4 4 3,2 47 34 40,5 69,44 30,56 4 0,5 4 3,7 52 36 44 51,95 48,05 5 0,6 4 4,3 57 40 48,5 48,19 51,81 6 0.8 4 5,1 59 43 51 43,96 56,04 7 1,0 4 6,1 61 48 54,5 39,60 60,40 8 1,5 4 7,6 62 50 56 34,48 65,12 9 2,5 4 10,1 57 49 53 28,37 71,63 10 5,0 4 15,1 56 44 50 20,94 79,06 11 12,5 4 27,6 52 42 47 12,66 87,34 12 15,0 4 43,6 48 42 44 8,58 91,52 13 17,5 4 60,1 43 41 42 6,24 93,76 14 20,5 4 80,1 40 38 39 4,76 95,24
Menghitung % massa fenol dan air
n
No % massa fenol % massa air 1
1. x 100 % = 61,54 x 100 % = 38,46 2
2. x 100 % = 58,82 x 100 % = 41,18 3
9
Menghitung Fraksi mol Fenol dan Fraksi mol Air
10
Mol air = = 0,155556XAir =
XAir = 0,785203623
Mol fenol = = 0,042553
Mol air = = 0,177778
XAir =
XAir = 0,806867654
Mol fenol = = 0,042553
Mol air = = 0,205556
XAir =
XAir = 0,828490396
Mol fenol = = 0,042553
Mol air = = 0,238889
XAir =
XAir = 0,848803601
Mol fenol = = 0,042553
Mol air = = 0,283333
XAir =
XAir = 0,869423797
Mol fenol = = 0,042553
Mol air = = 0,338889
XAir =
XAir = 0,888441723
Mol fenol = = 0,042553
Mol air = = 0,422222
XAir =
11
Mol fenol = = 0,042553Mol air = = 0,561111
XAir =
XAir = 0,929508813
Mol fenol = = 0,042553
Mol air = = 0,838889
XAir =
XAir = 0,95172342
Mol fenol = = 0,042553
Mol air = = 1,533333
XAir =
XAir = 0,972997418
Mol fenol = = 0,042553
Mol air = = 2,422222
XAir =
XAir = 0,982735545
Mol fenol = = 0,042553
Mol air = = 3,338889
XAir =
XAir = 0,987415723
Mol fenol = = 0,042553
Mol air = = 4,45
XAir =