LAPORAN PRAKTIKUM KI2142
KELARUTAN TIMBAL BALIK
Nama
: Devi Shofa
Al Fitri
NIM
: 13713044
Kelompok
: 2
Shift/Tanggal Praktikum : 2/1 Oktober
2014
Nama Asisten
: Anas Santria
NIM
: 20513034
LABORATORIUM KIMIA FISIK
PROGRAM STUDI TEKNIK MATERIAL
FAKULTAS TEKNIK MESIN DAN DIRGANTARA
INSTITUT TEKNOLOGI BANDUNG
1. Judul
Kelarutan Timbal Balik
2. Tujuan Percobaan
1. Menentukan volume piknometer
2. Menentukan berat jenis zat NaCl dan CH3OH dari perbandingan berat zat dan volume piknometer
3. Menentukan suhu rata-rata campuran fenol dan air, campuran fenol dan NaCL dan campuran fenol dan CH3OH
4. Menentukan fraksi mol fenol (sitem fenol air)
5. Menentukan fraksi mol fenol (sistem fenol air dan NaCl)
6. Menentukan fraksi mol fenol (sistem fenol air dan CH3OH)
7. Menentukan suhu kritis kelarutan timbal balik antara dua cairan. 8. Menentukan diagram fasa antara kelarutan dengan suhu.
3. Teori Dasar
Sistem biner fenol – air merupakan sistem yang memperlihatkan sifat solubilitas timbal balik antara fenol dan air pada suhu tertentu dan tekanan tetap. Solubilitas (kelarutan) adalah kemampuan suatu zat terlarut untuk larut dalam suatu pelarut. Kelarutan dinyatakan dalam jumlah maksimum zat terlarut yang larut dalam suatu pelarut pada kesetimbangan. Larutan hasil disebut larutan jenuh. Zat-zat tertentu dapat larut dengan perbandingan apapun terhadap suatu pelarut. Contohnya adalah etanol di dalam air. Pelarut umumnya merupakan suatu cairan yang dapat berupa zat murni ataupun campuran.
T
Kelarutan timbal balik adalah kelarutan dari suatu larutan yang bercampur sebagian bila temperaturnya di bawah temperatur kritis. Jika mencapai temperatur kritis, maka larutan tersebut dapat bercampur sempurna (homogen) dan jika temperaturnya telah melewati temperatur kritis maka sistem larutan tersebut akan kembali dalam kondisi bercampur sebagian lagi.
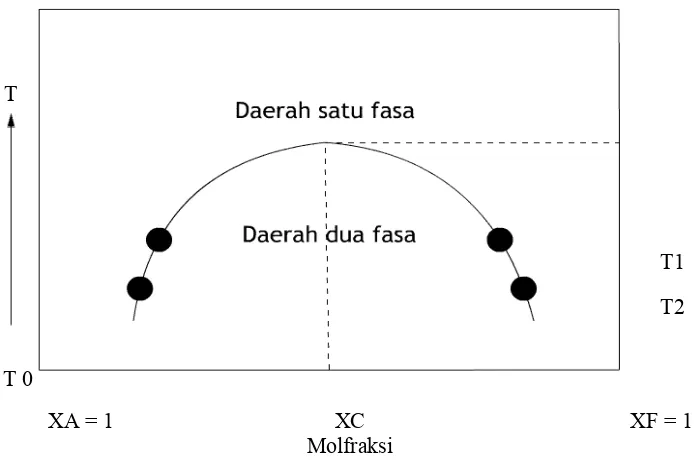
Salah satu contoh dari temperatur timbal balik adalah kelarutan fenol dalam air yang membentuk kurva parabola yang berdasarkan pada bertambahnya % fenol dalam setiap perubahan temperatur baik di bawah temperatur kritis (gambar 1). Jika temperatur dari dalam kelarutan fenol aquadest dinaikkan di atas 50°C maka komposisi larutan dari sistem larutan tersebut akan berubah. Kandungan fenol dalam air untuk lapisan atas akan bertambah (lebih dari 11,8 %) dan kandungan fenol dari lapisan bawah akan berkurang (kurang dari 62,6 %). Pada saat suhu kelarutan mencapai 66°C maka komposisi sistem larutan tersebut menjadi seimbang dan keduanya dapat dicampur dengan sempurna.
Gambar 1. Komposisi campuran fenol air
L1 adalah fenol dalam air, L2 adalah air dalam fenol, XA dan XF
masing-masing adalah mol fraksi air dan mol fraksi fenol, XC adalah mol fraksi
komponen pada suhu kritis (Tc). Sistem ini mempunyai suhu kritis (Tc) pada
homogen dengan komposisi Cc. Pada suhu T1 dengan komposisi di antara A1
dan B1 atau pada suhu T2 dengan komposisi di antara A2 dan B2, sistem
berada pada dua fase (keruh). Sedangkan di luar daerah kurva (atau diatas suhu kritisnya, Tc), sistem berada pada satu fase (jernih).
Temperatur kritis atas Tc adalah batas atas temperatur dimana nterjadi
pemisahan fase.Diatas temperatur batas atas, kedua komponen benar-benar bercampur.Temperatur ini ada gerakan termal yang lebih besar menghasilkan kemampuan campur yang lebih besar pada kedua komponen,
Beberapa system memperlihatkan temperatur kritis Tc . dimana dibawah
temperatur itu kedua komponen bercampur dalam segala perbandingan dan diatas temperatur itu kedua komponen membentuk dua fase. Salah satu contohnya adalah air-trietilamina. Dalam hal ini pada temperatur rendah kedua komponen lebih dapat campur karena komponen-komponen itu membentuk kompleks yang lemah, pada temperatur lebih lebih tinggi kompleks itu terurai dan kedua komponen kurang dapat bercampur.
4. Data Pengamatan
T ruang : 26.5 C
ρ
air pada Truang
: 0.999 gr/ml
W piknometer kosong I : 19.10 gr W piknometer I +air : 45.25 gr W piknometer I +CH3OH : 44.97 gr8 10.5 8 51 42 46.5 0.127
9 Fenol + NaCl 1% 52 40 46 0.1149
10 Fenol + CH3OH 1% 54 36 45 0.1147
5. Pengolahan Data
5.1 Penentuan volume piknometer
Vpikno I =(
Wpiknometer I
+
air
)−(Wpiknometer kosong I
)
ρ air padaTruang
=
45.25
0.999
−
19.10
= 26.18 ml
Vpikno II =(
Wpiknometer II
+
air
)−(Wpiknometer kosong II
)
ρ air pada Truang
=
46.15
0.999
−
21.54
= 24.63 ml
5.2 Penentuan
ρ
(Berat jenis) zatρzat CH
3OH =
(Wpiknometer I
+CH
3
V pikno I
OH
)−(Wpiknometer kosong I
)
=
44.97
26.18
−
19.10
= 0.998 gr/ml
ρzat
NaCl =(Wpiknometer II
+
NaCl
V pikno II
)−(Wpiknometer kosong II
)
=
46.07
24.63
−
21.54
= 0.996 gr/ml
5.3 Penentuan T rata-rata (Tabel)
T rata-rata =
Tkeru h+Tbening
2
Trata-rata 1
=
41
+
2
28
= 34.5 oC= 39.5 oC
Trata-rata 3
=
63
+
2
62
= 62.5 oCTrata-rata 4
=
65
+
2
64
= 64.5 oCTrata-rata 5
=
60
+
2
39
= 49.5 oCTrata-rata 6
=
69
+
2
42
= 55.5 oCTrata-rata 7
=
53
+
2
34
= 43.5 oCTrata-rata 8
=
51
+
2
42
= 46.5 oCTrata-rata 9
=
52
+
2
40
= 46 oCTrata-rata 10
=
54
+
2
36
= 45 oC5.4 Menentukan fraksi mol fenol (sitem fenol air)
Mol air 1 =
Mr
m
=
Vair x ρ air
MrH
2
O
=
4
x
18
0.999
= 0.222 molMol Fenol 1=
MrFenol
mFenol
= 0.043 mol
Fraksi Mol (X Fenol) 1 =
mol Fenol+
mol Fenol
mol air
=
0.043
0.043
+
0.222
= 0.163
Mol air 2 =
Mr
m
=
Vair x ρ air
MrH
2
O
=
5
x
0.999
18
= 0.278 molMol Fenol 2=
MrFenol
mFenol
=
94
4
= 0.043 mol
Fraksi Mol (X Fenol) 2 =
mol Fenol+
mol Fenol
mol air
=
0.043
0.043
+
0.278
= 0.134
Mol air 3 =
Mr
m
=
Vair x ρ air
MrH
2
O
=
6
x
0.999
18
= 0.333 molMol Fenol 3=
MrFenol
mFenol
= 0.043 mol
Fraksi Mol (X Fenol) 3 =
mol Fenol+
mol Fenol
mol air
=
0.043
0.043
+
0.333
= 0.114
Mol air 4 =
Mr
m
=
Vair x ρ air
MrH
2
O
=
8
x
0.999
18
= 0.444 molMol Fenol 4=
MrFenol
mFenol
=
94
4
= 0.043 mol
Fraksi Mol (X Fenol) 4 =
mol Fenol+
mol Fenol
mol air
=
0.043
0.043
+
0.444
= 0.088
Mol air 5 =
Mr
m
=
Vair x ρ air
MrH
2
O
=
10
x
18
0.999
= 0.555 molMol Fenol 5=
MrFenol
mFenol
= 0.053 mol
Fraksi Mol (X Fenol) 5 =
mol Fenol+
mol Fenol
mol air
=
0.053
0.053
+
0.555
= 0.087
Mol air 6 =
Mr
m
=
Vair x ρ air
MrH
2
O
=
6.5
x
18
0.999
= 0.361 molMol Fenol 6=
MrFenol
mFenol
=
94
6
= 0.064 mol
Fraksi mol (X Fenol) 6 =
mol Fenol+
mol Fenol
mol air
=
0.064
0.064
+
0.316
= 0.15
Mol air 7 =
Mr
m
=
Vair x ρ air
MrH
2
O
=
8.5
x
18
0.999
= 0.472 molMol Fenol 7=
MrFenol
mFenol
= 0.074 mol
Fraksi mol (X Fenol) 7 =
mol Fenol+
mol Fenol
mol air
=
0.074
0.074
+
0.472
= 0.136
Mol air 8 =
Mr
m
=
Vair x ρ air
MrH
2
O
=
10.5
x
18
0.999
= 0.583 molMol Fenol 8=
MrFenol
mFenol
=
94
8
= 0.085 mol
Fraksi mol (X Fenol) 8 =
mol Fenol+
mol Fenol
mol air
=
0.085
0.085
+
0.583
= 0.127
5.5 Menentukan fraksi mol fenol (sistem fenol air dan NaCl)
Massa NaCl = % x V (NaCl+air) x
ρ
NaCl= 1% x 6ml x 0.996 gr/ml
Mol NaCl
=massa NaCl
MrNaCl
=
0.0598
58.5
= 0.00102 mol
Mol air =
%
x V
(NaCl
+air
)
x ρ H
2
O
Mr
=
99 %
x
6
MrH
ml x
0.999
2
O
gr
/
ml
=
5.94
18
= 0.33 mol
Mol Fenol =
MrFenol
mFenol
=
94
4
= 0.043 mol
Fraksi mol (X Fenol) =
mol Fenol+
mol Fenol
mol air+
mol NaCl
=
0.043
+
0.33
0.043
+
0.00102
= 0.1149
5.6 Menentukan fraksi mol fenol (sistem fenol air dan CH3OH)
Massa CH3OH =% x V (CH3OH+air) x
ρ
CH3OH= 1% x 6ml x 0.998 gr/ml
= 0.0599 gram
=
0.0599
32
= 0.00187 mol
Mol air =
%
x V
(CH
3
OH
+
air
)
x ρ H
2
O
Mr H
2
O
=
99 %
x
6
ml x
18
0.999
gr
/
ml
= 0.33 mol
Mol Fenol =
MrFenol
mFenol
=
94
4
= 0.043 mol
Fraksi mol (X Fenol) =
mol Fenol+
mol air+
mol Fenol
mol CH
3
OH
=
0.043
+
0.33
0.043
+
0.00187
= 0.1147
5.7 Diagram Fasa
7. Kesimpulan
1. Volume piknometer 1 sebesar26.18 mldanpiknometer 2 sebesar24.63 ml.
2. Berat jenis zat NaCl sebesar 0.996 gr/mldan CH3OHsebesar 0.998 gr/ml.
3. -Suhu rata-rata campuran fenol dan air(dalamCelcius) sebesar 34.5 ; 39.5 ; 62.5 ; 64.5 ; 49.5 ; 55.5 ; 43.5 dan 46.5.
-Suhu rata-rata campuran fenol dan NaCL sebesar 46 oC
-Suhu rata-rata campuran fenol dan CH3OH sebesar 45oC
4. Fraksi mol fenol (sitem fenol air)sebesar0.163 ; 0.134 ; 0.114 ; 0.088 ; 0.087 ; 0.15 ; 0.136 dan 0.127.
5. Fraksi mol fenol (sistem fenol air dan NaCl) sebesar 0.1149
6. Fraksi mol fenol (sistem fenol air dan CH3OH)sebesar 0.1147
7. Kelarutan timbal balik sistem fenol – air mempunyai suhu kritis 46,09ᵒC 8. Kurva antara sistem fenol – air berbentuk parabola
8. Daftar pustaka
Atkins.Physical Chemistry.8
thedition : Oxford University Press.2006.New
York.Page :136–165
Brady, James E.Chemistry: The Moleculer Nature of Matter.6
thedition :
John Wiley &
Sons, Inc.2012.United States of America.Page : 156 – 205
http://www.scribd.com/doc/17162525/Praktikum-kelarutan-timbal-balik
Roberto Lopez Rendon and Jose Alejandre.Molecular Dynamics Simulations of The
Solubility of H
2S and CO
2in Water.Sociedad Quimica de Mexico,
9. Lampiran
9.1 Data Berat Jenis air berbagai suhu
9.2 Jawaban Pertanyaan dalam modul
1.Suhu konsolut atas atau suhu larutan kritik adalah batas atas temperatur dimana terjadinya pemisahan fasa. Di atas temperatur batas atas, komponen akan benar-benar tercampur. Derajat kebebasan sistem pada T > T konsolut atas yaitu dua.
2.Sistem yang memiliki titik konsolut bawah : sistem nikotin – air, Sistem yang memiliki dua suhu konsolut : sistem air – CO2, sistem air – H2S
selama reaksi kimia berlangsung. Sifat yang khas dari larutan penyangga ini adalah pH-nya hanya berubah sedikit dengan pemberian sedikit asam kuat atau basa kuat.
Larutan penyangga tersusun dari asam lemah dengan basa konjugatnya atau oleh basa lemah dengan asam konjugatnya. Reaksi di antara kedua komponen penyusun ini disebut sebagai reaksi asam-basa konjugasi.