di Fakultas Farmasi Universitas Padjadjaran
Oleh :
HERLINA HUSAIN, S.Si. 260112100023
PROGRAM STUDI PROFESI APOTEKER
FAKULTAS FARMASI
UNIVERSITAS PADJADJARAN
JATINANGOR
Laporan Praktek Kerja Profesi Apoteker di industri PT. Holi Pharma selama Bulan Mei 2011. Laporan ini disusun guna menempuh Ujian Profesi Apoteker di Fakultas Farmasi, Universitas Padjadjaran.
Penulis menyadari bahwa masih terdapat banyak kekurangan dan kelemahan yang disebabkan keterbatasan pengetahuan dan pengalaman yang penulis miliki. Oleh sebab itu, demi bertambahnya wawasan dan pengetahuan penulis dalam penyusunan laporan di kemudian hari, penulis dengan lapang dada menerima segala kritik dan saran yang membangun dari semua pihak.
Dengan kerendahan hati, penulis ingin menyampaikan ucapan terima kasih yang sebesar-besarnya kepada :
1. Dra. Doorthea M., Apt., dosen pembimbing kerja praktek dari PT. Holi Pharma yang telah memberikan bimbingan, arahan, dan nasehatnya.
2. Dahlia Maria, S.Farm., Apt., selaku pembimbing lapangan di PT. Holi Pharma untuk semua bimbingan yang telah diberikan selama melakukan PKPA di PT. Holi Pharma.
3. Dr. Marline Abdassah, MS., Apt., selaku dosen pembimbing kerja praktek dari Fakultas Farmasi, Universitas Padjadjaran
4. Drs. Dradjad Priambodo, Apt., selaku Koordinator kerja praktek dari Fakultas Farmasi, Universitas Padjadjaran
5. Dr. Ahmad Muhtadi, M.S., Dekan Fakultas Farmasi, Universitas Padjadjaran. 6. Drs. Sohadi Warya, MS., selaku Ketua Program Profesi Apoteker Fakultas
Farmasi, Universitas Padjadjaran.
7. Orang tua tercinta yang senantiasa berdoa, membantu, mendorong, dan melimpahkan kasih sayangnya pada penulis.
Selain itu, penulis menyampaikan permohonan maaf kepada semua pihak apabila selama kerja praktek dan pengerjaan laporan ini penulis banyak melakukan hal yang tidak berkenan. Semoga segala amal kebaikan dan bantuan yang diberikan pada penulis mendapatkan pahala yang berlipat ganda dari Allah SWT.
Akhirnya dengan segala kerendahan hati penulis berharap laporan ini dapat memberikan manfaat baik bagi penulis dan pembaca.
DAFTAR ISI
Halaman
KATA PENGANTAR... iii
DAFTAR ISI ... iv
DAFTAR GAMBAR ... vi
DAFTAR LAMPIRAN ... vii
BAB I PENDAHULUAN 1.1 Latar Belakang Praktek Kerja Profesi Apoteker ... 1
1.2 Tujuan PKPA ... 2
1.3 Tinjauan Umum PT. Holi Pharma ... 3
1.3.1 Sejarah Singkat PT. Holi Pharma ... 3
1.3.2 Visi dan Misi ... 5
1.3.3 Motto ... 5
1.3.4 Kebijakan Perusahaan... 5
1.3.5 Sarana dan Prasarana Fisik ... 6
1.3.6 Sumber Daya dan Kesejahteraan Karyawan ... 6
BAB II APOTEKER DI INDUSTRI FARMASI 2.1 Definisi dan Persyaratan Industri Farmasi ... 8
2.2 Peran Apoteker di Industri Farmasi ... 8
2.3 Tugas-tugas Pokok Seorang Apoteker di Industri Farmasi 12
2.3.1 Bagian Pemastian Mutu ... 12
2.3.2 Bagian Produksi ... 12
2.3.3 Bagian Persediaan ... 13
2.3.4 Bagian Pengawasan Mutu ... 14
2.3.5 Bagian Penelitian dan Pengembangan ... 14
BAB III KEGIATAN DAN HASIL PKPA 3.1 Kegiatan PKPA ... 21
3.2.1 Pemastian Mutu (QA) ... 21
3.2.2 Pengawasan Mutu (QC)... 22
3.2.3 Penelitian dan Pengembangan (Litbang) ... 24
3.2.4 Produksi ... 26
3.2.5 Teknik Produksi ... 31
3.2.6 PPIC (Production Planning Inventory Control) ... 32
3.2.7 Gudang... 33
3.2.8 Teknik Utilitis ... 35
3.3.9 Marketing... 39
BAB IV KESIMPULAN DAN SARAN 4.1 Kesimpulan ... 43
4.2 Saran ... 43
DAFTAR PUSTAKA ... 44
DAFTAR GAMBAR
Gambar Halaman
1.1 Tugas dan Tanggung jawab bagian Pemastian Mutu ... 22
1.2 Tugas dan Tanggung jawab bagian Pengawasan Mutu ... 23
1.3 Tugas dan Tanggung jawab bagian Litbang ... 24
1.4 Proses Trial dari skala Laboratorium sampai skala Produksi ... 25
1.5 Alur Pembuatan Batch Record ... 25
1.6 Ruang-ruang Produksi ... 28
1.7 Alur Produksi secara Umum ... 29
1.8 Alur Produksi Sediaan Tablet/Kaplet... 29
1.9 Alur Produksi Sediaan Sirup ... 30
1.10 Alur Produksi Sediaan Suspensi ... 30
1.11 Alur Produksi Sediaan Kapsul ... 30
1.12 Alur Produksi Sediaaan Luar ... 31
1.13 Alur Pemilihan Pemasok ... 33
1.14 Alur Penerimaan, Penyimpanan dan Pengeluaran Bahan Baku... 34
1.15 Alur Penerimaan, Penyimpanan dan Pengeluaran Bahan Kemas ... 35
1.16 Alur Penerimaan, Penyimpanan dan Pengeluaran Obat Jadi ... 36
1.17 Instalasi AHU (Air Handling Unit) ... 37
1.18 Proses Pengolahan Air Bersih ... 37
1.19 Proses Pengolahan Aquadem ... 38
DAFTAR LAMPIRAN
Lampiran Halaman 1. STRUKTUR ORGANISASI PT. HOLI PHARMA ... 45 2. DENAH LANTAI DASAR PT. HOLI PHARMA ... 46 3. LABEL... ... 47
BAB I PENDAHULUAN
1.1 Latar Belakang Praktek Kerja Profesi Apoteker
Industri farmasi sebagai sarana penyedia obat-obatan bagi masyarakat mempunyai peranan yang penting dalam memproduksi dan mendistribusikan obat dengan mengutamakan khasiat, keamanan, kualitas, harga terjangkau, tepat waktu penyediaan dan jumlah yang cukup bagi masyarakat. Dalam hal ini mutu obat merupakan sesuatu yang sangat penting. Pada pembuatan obat, pengawasan menyeluruh adalah sangat esensial untuk menjamin bahwa konsumen menerima obat yang bermutu tinggi. Pembuatan secara sembarangan tidak dapat dibenarkan bagi obat yang digunakan untuk menyelamatkan jiwa atau memulihkan atau memelihara kesehatan.
Salah satu komponen kesehatan yang sangat strategis adalah tersedianya obat sebagai bagian dari pelayanan kesehatan masyarakat. Tersedianya obat dalam jumlah, jenis dan kualitas yang memadai menjadi faktor penting dalam pembangunan nasional khususnya di bidang kesehatan. Industri Farmasi sebagai industri penghasil obat, memiliki peran strategis dalam usaha pelayanan kesehatan kepada masyarakat tersebut. Seiring dengan meningkatnya pendidikan dan tingkat kesadaran masyarakat akan arti pentingnya kesehatan, maka industri farmasi dituntut untuk dapat menyediakan obat dalam jenis, jumlah dan kualitas yang memadai.
Untuk meningkatkan kualitas obat, maka pemerintah mengeluarkan Surat Keputusan Menteri Kesehatan Republik Indonesia No. 43/Menkes/SK/1998 tentang Cara Pembuatan Obat yang Baik (CPOB). Pada dasarnya CPOB merupakan pedoman yang menyangkut segala aspek produksi dan pengendalian mutu yang tujuannya untuk menjamin bahwa produk obat yang dibuat senantiasa memenuhi persyaratan mutu yang telah ditentukan sesuai dengan tujuan penggunaannya. Penerapan CPOB di Industri Farmasi yang harus didukung oleh sumber daya manusia yang berkualitas dan bertanggung jawab sebagaimana juga dijelaskan dalam Undang-Undang Republik Indonesia Nomor 36 tahun 2009
tentang Kesehatan yang menyatakan bahwa tenaga kesehatan tempat diselenggarakannya kegiatan kesehatan harus sesuai dengan keahlian yang bersangkutan.
Kehandalan seorang apoteker dalam menerapkan CPOB tidak cukup hanya dengan berdasarkan pengetahuan secara teoritis semata namun perlu ada tambahan pengalaman praktek kerja langsung. Pengetahuan secara teoritis memberikan gambaran ideal cara produksi obat di suatu industri farmasi sedangkan praktek kerja langsung akan memberikan gambaran realita yang terjadi. Dalam kombinasi dua pengetahuan ini maka seorang apoteker diharapkan dapat mempunyai wawasan komprehensif tentang setiap masalah yang dihadapi dalam proses produksi obat untuk memenuhi CPOB.
Universitas Padjadjaran sebagai salah satu perguruan tinggi yang menghasilkan tenaga apoteker, mengadakan kerjasama dalam bentuk kerja praktek dengan PT. Holi Pharma. Kerja praktek ini dilaksanakan pada tanggal 2-31 Mei 2011. Dengan adanya kegiatan ini diharapkan calon apoteker dapat menambah wawasan dan pengalaman di bidang industri Farmasi.
1.2 Tujuan Praktek Kerja Profesi Apoteker
Praktek Kerja Profesi Apoteker yang dilaksanakan bertujuan untuk : 1. Meningkatkan pemahaman calon apoteker tentang peran, fungsi, posisi, dan
tanggung jawab apoteker dalam industri farmasi.
2. Membekali calon apoteker agar memiliki wawasan, pengetahuan, keterampilan, dan pengalaman praktis untuk melakukan pekerjaan kefarmasian di industri farmasi.
3. Memberi kesempatan kepada calon apoteker untuk mempelajari prinsip CPOB, Cara Pembuatan Obat Tradisional yang Baik (CPOTB), dan penerapannya dalam industri farmasi.
4. Mempersiapkan calon apoteker dalam memasuki dunia kerja sebagai tenaga farmasi yang profesional.
5. Memberi gambaran nyata tentang permasalahan pekerjaan kefarmasian di industri farmasi.
1.3 Tinjauan Umum PT. Holi Pharma 1.3.1 Sejarah Singkat PT. Holi Pharma
Berdiri Thn 1977 (PT. Ndaholi) Luas sekitar 2709 m2
Thn 1996
Pengalihan Kepemilikan dipimpin oleh Bapak Hermawan Tjahyana (Direktur)
Thn 1998
PT. NDAHOLI PT. HOLI PHARMA
Oktober Thn 2002 Pengalihan Kepemilikan
Bapak Hermawan Tjahyana Bapak Ruddy Bambang Sukmana (Direktur)
Mei Thn 2007
Perbaikan dan Perluasan menjadi 4000 m2
Agustus Thn 2007 Pengalihan Kepemilikan
Bapak Bedjo Stefanus sebagai Presiden Direktur
Seiring dinamisnya peraturan tentang industri farmasi yang harus mengikuti standar CPOB terkini, dan untuk mengimbangi serta memenuhi permintaan pelanggan akan produk, maka PT. Holi Pharma akan menambah jumlah dan jenis produk yang diproduksi dari tahun ke tahun, sehingga peningkatan fasilitas penambahan jenis sertifikat CPOB terus diupayakan. Sertifikat CPOB yang dimiliki oleh PT. Holi Pharma antara lain :
1. Tablet biasa dan tablet salut non antibiotik.
(persyaratan khusus: tidak termasuk sediaan kontrasepsi, hormon kelamin lainnya dan sitostatika)
2. Tablet biasa dan salut antibiotik (persyaratan khusus: tidak termasuk sediaan betalaktam dan turunannya)
3. Cairan oral non antibiotik. 4. Cairan oral antibiotik
(persyaratan khusus: tidak termasuk sediaan betalaktam dan turunannya) 5. Kapsul keras non antibiotik.
(persyaratan khusus: tidak termasuk sediaan kontrasepsi, hormon kelamin lainnya dan sitostatika)
6. Kapsul keras antibiotik.
(persyaratan khusus: tidak termasuk sediaan betalaktam dan turunannya) 7. Cairan obat luar non antibiotik.
8. Salep/krim non antibiotik.
Seiring dengan perkembangannya, PT. HOLI PHARMA terus memenuhi permintaan pelanggan, meningkatkan efektifitas pengelolaan lingkungan, juga melakukan audit ISO (International Organization for
Standarization). Pada bulan Maret 2011, telah dilakukan audit untuk sertifikasi
ISO 9001 tentang Managemen Mutu dan ISO 14001 tentang Managemen Lingkungang dengan hasil yang sangat memuaskan sehingga dapat mengantarkan PT. Holi Pharma mendapatkan kedua sertifikat tersebut.
1.3.2 Visi dan Misi a. Visi
Membangun PT. Holi Pharma dengan berlandaskan pada Catur Pilar, yaitu :
• Mengutamakan kualitas,
• Berwawasan nasional dan internasional,
• Memberikan nilai lebih kepada yang bernaung di bawahnya,
• Mengoptimalkan nilai ekonomis kepada pemegang saham. b. Misi
Berupaya secara berkesinambungan dan terus menerus agar visi tersebut dapat dicapai dengan komitmen:
• Secara konsisten memenuhi standar CPOB terkini
• Pemasaran dengan konsep saling menguntungkan
• Meningkatkan kecakapan dan keterampilan sumber daya manusia
• Peningkatan efisiensi 1.3.3 Motto
Perusahaan memantapkan sasaran dan mendorong semua bagian mendukung ke arah pencapaian tujuan dengan motto:
“CARES FOR YOUR HEALTH” PEDULI KESEHATAN ANDA
1.3.4 Kebijakan Perusahaan
1. Pemasaran nasional dan internasional dengan konsep saling menguntungkan baik sektor swasta maupun instansi pemerintahan.
2. Menjalin hubungan kerjasama bisnis yang harmonis dan saling menguntungkan dengan pemasok, konsumen dan pihak yang terkait lainnya. 3. Menerapkan biaya produksi yang ekonomis dengan tetap mengutamakan
standar kualitas.
1.3.5 Sarana dan Prasarana Fisik
PT. Holi Pharma menempati bangunan tiga lantai yang terdiri dari:
1. Lantai pertama terdiri dari ruang produksi, gudang bahan baku, gudang obat jadi sirup, suspensi, dan cairan luar, lobi kantor/receptionist, ruang bagian teknik utilitis dan teknik produksi, ruang pengemasan I, dan kantin.
2. Lantai kedua terdiri dari ruang tamu, ruang gudang bahan kemas suhu kamar dan suhu AC, gudang bahan baku suhu AC, gudang obat jadi tablet, kaplet, dan kapsul, ruang pengemasan II, ruang dokumentasi, ruang stabilitas, dan ruang retained sample.
3. Lantai ketiga terdiri dari kantor dan laboratorium yang meliputi: ruang Direktur, ruang Plant Manager, laboratorium Pengawasan Mutu dan ruang
Kepala Pengawasan Mutu, ruang Pemastian Mutu, laboratorium Penelitian dan Pengembangan (litbang) beserta ruang Kepala Litbang, ruang bagian Keuangan, ruang bagian Akunting, ruang bagian Marketing, ruang bagian
Purchasing dan Production Planning Inventory Control (PPIC), ruang server,
perpustakaan, ruang pertemuan, ruang sekretaris, ruang bagian penjualan, dan ruang administrasi.
1.3.6 Sumber Daya dan Kesejahteraan Karyawan
PT. Holi Pharma memiliki 154 karyawan yang terdiri dari 90 karyawan harian dan 64 karyawan tetap. Karyawan harian terdiri dari 53 pria dan 37 wanita sedangkan karyawan tetap terdiri dari 39 pria dan 25 wanita. Karyawan yang berkaitan dengan produksi bekerja pukul 06.30–15.00, sedangkan karyawan yang berkaitan dengan marketing bekerja pukul 07.30-16.00. Untuk karyawan yang bekerja yang dibagian produksi dan pengemasan dibagi menjadi 2 shift, yaitu :
• Shift I : 06.30 – 15.00
• Shift II : 14.30 – 23.00
• Shift III : 22.30 – 07.00 (shift III diberlakukan jika kebutuhan produksi melebihi kapasitas produksi yang ada)
Untuk meningkatkan kinerja para karyawan, PT. Holi Pharma memperhatikan kesejahteraan karyawan dengan berbagai hal. Hal-hal yang dilakukan antara lain ialah :
Seluruh staff :
• Memberikan susu 2 kali seminggu kepada seluruh karyawan
• Makan siang dan air minum
• Pemeriksaan kesehatan karyawan
• Rekreasi bersama setahun sekali Yang terkait dengan produksi:
• Tunjangan (insentif) operator.
• Tunjangan shift
Karyawan tetap:
• Jamsostek (Tunjangan hari tua, kecelakaan kerja, dan kematian),
• Tunjangan Hari Raya (THR),
• Tunjangan kesehatan,
BAB II
APOTEKER DI INDUSTRI FARMASI
2.1 Definisi dan Persyaratan Industri Farmasi
Industri farmasi adalah badan usaha yang memiliki izin dari Menteri Kesehatan untuk melakukan kegiatan pembuatan obat atau bahan obat dalam rangka penetapan diagnosis, pencegahan, penyembuhan dan pemulihan.
Sedangkan yang dimaksud dengan industri bahan baku adalah bahan baku yang diproduksi oleh suatu industri dimana bahan baku tersebut adalah semua bahan baik yang berkhasiat maupun yang tidak berkhasiat, yang berubah maupun tidak berubah, yang digunakan dalam proses pengolahan obat. Menurut Peraturan Menteri Kesehatan Indonesia No. 1799/MENKES/PER/XII/2010 tentang industri farmasi.
Usaha industri farmasi menurut Surat Peraturan Menteri Kesehatan Indonesia No. 1799/MENKES/PER/XII/2010 wajib memenuhi persyaratan sebagai berukut:
1. Industri farmasi dilakukan oleh Perusahaan Umum (Perum), badan hukum berbentuk Perseroan Terbatas (PT) atau koperasi
2. Memiliki rencana investasi dan kegiatan pembuatan obat 3. Memiliki Nomor Pokok Wajib Pajak (NPWP)
4. Wajib mempekerjakan secara tetap sekurang-kurangnya tiga orang apoteker Warga Negara Indonesia, masing-masing sebagai penanggung jawab produksi, penanggung jawab pemastian mutu dan penanggung jawab pengawasan mutu sesuai persyaratan CPOB
2.2 Peran apoteker di Industri farmasi
Peran farmasis dalam industri farmasi yang digariskan oleh World Health
1. Care giver
Peranan ini mengandung makna bahwa apoteker sebagai pemberi pelayanan kefarmasian berperan dalam pemberian informasi obat, efek samping obat, dan lain-lain kepada masyarakat dan profesi kesehatan lainnya. Peranan ini perlu didukung oleh suatu interaksi dengan individu dan atau kelompok di dalam industri (regulatory, QA, QC, produksi, dan sebagainya), serta individu dan atau kelompok di luar industri.
2. Decision Maker
Pengambil keputusan yang tepat untuk mengefisienkan dan mengefektifkan sumber daya yang ada di industri seperti pengendalian bahan awal dan obat jadi, alokasi dana yang sesuai dengan kebutuhan, pemanfaatan sumber daya manusia yang strategis dan tepat dalam memasarkan dan memperkenalkan obat kepada masyarakat.
3. Communicator
Mampu berhubungan dan berkomunikasi secara internal maupun eksternal, baik kepada atasan, bawahan atau rekan sejawat di industri. Oleh karena itu ia harus mempunyai kemampuan berkomunikasi yang baik, secara lisan maupun tulisan yang diwujudkan dalam bentuk leaflet/brosur.
4. Leader
Mempunyai jiwa kepemimpinan yang kuat baik dalam memimpin diri sendiri maupun orang lain serta memiliki rasa tanggung jawab yang tinggi.
5. Manager
Mampu mengelola dan mengatur seluruh sumber daya yang ada dan dapat mengakumulasikannya untuk meningkatkan kinerja industri dari waktu ke waktu.
6. Long life learner
Peran apoteker sebagai long-life learner berarti seorang apoteker harus melakukan proses pembaelajaran terus menerus sepanjang hidupnya. Hal ini harus dilakukan untuk meningkatkan pengetahuan dan kemampuan apoteker itu sendiri.
7. Teacher
Bertanggung jawab untuk memberikan pendidikan dan pelatihan mengenai hal-hal yang berhubungan dengan dunia industri kepada sejawat farmasis dalam praktek kerja lapangan, dalam seminar mengenai aspek-aspek industri, dan lain-lain.
8. Researcher
Melakukan penelitian yang berkesinambungan dalam pencarian senyawa obat baru dan pengembangan senyawa obat yang telah ada khususnya di industri farmasi dan membuktikannya sehingga dapat dipergunakan untuk kepentingan kesehatan masyarakat. Peran apoteker sebagai long-life learner berarti seorang apoteker harus melakukan proses pembaelajaran terus menerus sepanjang hidupnya. Hal ini harus dilakukan untuk meningkatkan pengetahuan dan kemampuan apoteker itu sendiri.
Peran tersebut harus diterapkan dalam fungsi-fungsi industrial yang diperlukan yaitu :
1. Manajemen mutu
Seorang farmasis praktisi industri dalam manajemen mutu harus memiliki kompetensi dan memiliki pengetahuan mengenai metode analisis, studi stabilitas, penyelidikan kegagalan, penyimpangan bets, dan prosedur pengolahan dan pengemasan ulang; rancang bangun fasilitas dan sertifikasi Cara Pembuatan Obat yang Baik (CPOB); CPOB di laboratorium; Inspeksi diri CPOB; penanganan keluhan, obat kembalian dan penarikan obat jadi; penilaian pemasok (vendor rating); kalibrasi, kualifikasi, dan validasi; pengendalian perubahan (change control); pengelolaan dan pengendalian dokumen; pelatihan CPOB, Upaya Kesehatan Kerja (UKK) dan Keselamatan dan Kesehatan Kerja (K3) di laboratorium serta lingkungan kerja; dan penyusunan data pendukung untuk registrasi.
2. Manajemen produksi
Seorang farmasis praktisi industri dalam bidang manajemen produksi harus memiliki kompetensi dan pengetahuan mengenai desain formula; penanganan bahan (material handling); proses pembuatan produk farmasi; Environment,
Health and Safety (EHS); rancang bangun fasilitas dan sertifikasi CPOB;
inspeksi diri CPOB; kalibrasi, kualifikasi dan validasi; dan pengendalian perubahan (change control).
3. Manajemen produk
Seorang farmasis praktisi industri dalam bidang pengembangan produk harus memiliki kompetensi dan pengetahuan mengenai formulasi; teknologi farmasi; pengembangan bahan pengemas; dan penyiapan data penunjang registrasi.
4. Manajemen persediaan
Seorang farmasis praktisi industri dalam bidang manajemen persediaan harus memiliki kompetensi dan pengetahuan mengenai pengadaan barang (procurement) untuk produksi obat; pergudangan; dan Production Planning
and Inventory Control (PPIC).
5. Regulasi dan informasi produk
Seorang farmasis praktisi industri dalam bidang regulasi dan informasi produk harus memiliki kompetensi dan pengetahuan mengenai registraasi; regulasi; sertifikasi; informasi produk; permohonan izin dan pelaporan hasil uji klinik; pelaporan Monitoring Efek Samping Obat (MESO); serta pelaporan penanganan keluhan dan penarikan produk jadi.
2.3 Tugas-tugas Pokok Seorang Apoteker di Industri Farmasi 2.3.1 Bagian Pemastian Mutu (Quality Assurance)
Bagian Quality Assurance (QA) dipimpin oleh seorang Apoteker yang menjabat sebagai kepala bagian. Tugas pokok kepala bagian QA antara lain :
a. Melaksanakan pengawasan dan pengaturan pada tahap kegiatan produksi sesuai ketentuan CPOB,
b. Melakukan pemantauan lingkungan kerja atau kegiatan produksi agar produk yang dihasilkan tidak terkontaminasi,
c. Melaksanakan pelatihan-pelatihan yang berkaitan dengan penerapan CPOB,
d. Mengevaluasi kembali secara rutin semua spesifikasi, metode analisa, cara kerja di bagian produksi,
e. Memprakarsai dan mengawasi audit internal atau inspeksi diri secara berkala,
f. Memprakarsai dan berpartisipasi dalam pelaksanaan audit eksternal (audit terhadap pemasok),
g. Pelulusan produk jadi, h. Pengkajian catatan bets,
i. Penanganan keluhan dan produk kembalian, j. Pengendalian dokumen dan catatan,
k. Pengendalian perubahan dan abnormal report, l. Pengkajian tahunan produk,
m. Rencana Induk Validasi (RIV) dan pelaksanaan validasi dan kualifikasi.
2.3.2 Bagian Produksi
Bagian produksi dipimpin oleh kepala bagian produksi (seorang apoteker) yang bertanggung jawab dalam melaksanakan program yang menyangkut produksi suatu obat.
Tugas pokok kepala bagian produksi di Industri Farmasi antara lain adalah : a. Memastikan bahwa obat yang diproduksi dan disimpan sesuai prosedur
agar memenuhi persyaratan mutu yang ditetapkan,
b. Memantau kegiatan pengolahan dan pengemasan produk, mulai dari penimbangan bahan baku hingga menjadi obat jadi, sesuai dengan jadwal produksi yang telah ditetapkan,
c. Menyusun rencana produksi mingguan bersama dengan bagian PPIC, gudang bahan baku dan bahan kemas, dan sales,
d. Memastikan bahwa catatan produksi telah dievaluasi dan ditandatangani oleh Kepala Bagian Produksi sebelum diserahkan kepada kepala bagian Pemastian Mutu,
e. Melaksanakan pembuatan produk baru skala produksi bersama dengan bagian Litbang,
f. Menyiapkan dan merencanakan sarana produksi beserta pengembangannya,
g. Memastikan bahwa validasi yang sesuai telah dilaksanakan, h. Melaksanakan validasi proses,
i. Melaksanakan upaya-upaya peningkatan efisiensi proses produksi, j. Menjamin penerapan CPOB di lingkungan bagian produksi.
2.3.3 Bagian Persedian
Bagian ini bertanggung jawab kepada kepala pabrik (plant manager). Bagian ini meliputi kepala gudang produk jadi/ekspedisi, kepala gudang bahan baku dan kepala gudang bahan kemas.
Bagian Persediaan mempunyai tugas sebagai berikut :
a. Bertanggung jawab terhadap tersedianya produk sesuai rencana penjualan, b. Merencanakan jadwal produksi,
c. Mengawasi persediaan bahan baku dan bahan pengemas,
d. Mengontrol pengadaan bahan baku dan bahan pengemas agar tepat waktu, e. Menjaga bahan baku dan bahan pengemas di dalam penyimpanan tetap
f. Mengatur proses distribusi,
g. Mengontrol pengadaan produk jadi oleh pihak ketiga agar selesai tepat waktu,
h. Mengontrol pengadaan produk jadi untuk pihak ketiga agar dikirim tepat waktu.
Berdasarkan rencana produksi mingguan yang telah disusun, bagian logistik akan menerbitkan PO (Purchase Order). PO tersebut bersifat spesifik untuk setiap produk yang akan diproduksi, yang berisi daftar periksa, formulir permintaan bahan awal, bahan kemas, dan permintaan untuk produksi.
2.3.4 Bagian Pengawasan Mutu (Quality Control)
Bagian Quality Control (QC) dipimpin oleh seorang Apoteker yang menjabat sebagai kepala bagian. Tugas pokok kepala bagian Pengawasan Mutu antara lain :
a. Menyetujui atau menolak bahan awal, bahan pengemas, produk antara, produk ruahan dan produk jadi,
b. Memastikan bahwa seluruh pengujian yang diperlukan terhadap sampel (bahan awal, bahan kemas, produk antara dan produk ruahan) telah dilaksanakan,
c. Memberi persetujuan terhadap spesifikasi, petunjuk kerja pengambilan contoh, metode pengujian dan prosedur pengawasan mutu lain,
d. Memberi persetujuan dan memantau semua kontrak analisis,
e. Memeriksa pemeliharaan bangunan dan fasilitas serta peralatan di bagian pengawasan mutu,
f. Memastikan bahwa validasi dan verifikasi metode analisa yang sesuai telah dilaksanakan,
g. Menyiapkan metode analisa dan melakukan validasi metode analisa, h. Memastikan bahwa pelatihan awal dan berkesinambungan yang
dibutuhkan bagi personil di departemennya terlaksana dan diterapkan sesuai kebutuhan.
2.3.5 Bagian Penelitian dan Pengembangan Produk (Product Development/Litbang)
Pengembangan produk merupakan bagian dari industri farmasi yang bertanggungjawab terhadap pengembangan produk dan penyusunan formula. Bagian pengembangan produk dipimpin oleh seorang Apoteker yang dapat menjabat sebagai kepala bagian dengan tugas sebagi berikut :
a. Menerima ide atau usulan produk baru dari bagian pemasaran,
b. Membuat desain input dari usulan produk baru berdasarkan sampel formula produk kompetitor,
c. Membuat time schedule dari rencana desain dan pengembangan produk baru,
d. Meminta sampel bahan baku dari supplier,
e. Membuat formula untuk dilakukan trial skala laboratorium,
f. Menghitung material dari komposisi formula untuk mendapatkan harga, g. Menganalisa hasil trial skala laboratorium dan melakukan uji stabilitas, h. Menyiapkan dan mengajukan registrasi ke Badan POM memberikan
suplai data keluar nomor registrasi,
i. Melakukan trial skala produksi (dilakukan 3 kali) berdasarkan desain produk, bentuk sediaan obat, proses pembuatan, faktor stabilitas dan biaya produksi
j. Menganalisa hasil trial skala produksi untuk melakukan uji stabilitas.
Kepala bagian Litbang membawahi 2 sub unit, yaitu :
1. Unit formulasi, bertugas membuat formulasi baru, melakukan reformulasi produk bermasalah, reduce cost, menyusun master batch. Penanganan formulasi, meliputi:
- Bekerjasama dengan bagian PPIC dan gudang bahan baku dalam penyediaan bahan baku untuk proses percobaan,
- Menginformasikan kepada bagian produksi untuk menyiapkan mesin dan peralatan yang berkaitan dengan produksi,
- Melakukan proses percobaan, - Membuat catatan pengolahan batch,
- Menginformasikan kepada bagian PPIC mengenai spesifikasi bahan baku yang digunakan,
- Membantu bagian PPIC dalam pengadaan bahan baku untuk kebutuhan produksi awal,
- Mengikuti pelaksanaan proses produksi bahan baru bersama-sama dengan bagian produksi minimal sebanyak 3 batch pertama.
2. Sub unit pengembangan dokumentasi dan pengemasan, bertugas mempersiapkan registrasi sediaan, melakukan pengembangan pengemasan, mendesain kemasan.
a. Registrasi
Kegiatan yang dilakukan yaitu mengevaluasi keseluruhan data yang dipersyaratkan dalam pendaftaran obat jadi yang meliputi administrasi, data kualitas dan teknologi, data praklinik dan klinik, menyusun data produk dengan sistematis sesuai dengan peraturan yang berlaku, serta menguasai teknik komunikasi yang baik dalam hubungan kerjasama antara instansi terkait dengan industri.
Penanganan registrasi, meliputi :
- Mengevaluasi kebutuhan literatur untuk keperluan pembuatan dokumen registrasi
- Bekerjasama dengan bagian lain yang terkait dalam menentukan pemerian produk, besar kemasan dan rancangan kemasan
- Menyiapkan dokumen registrasi
- Melampirkan perjanjian dengan pihak ke-3 pada dokumen registrasi, untuk produk yang diproduksi oleh pihak ke-3
- Mengirim dokumen registrasi ke PT. Meprofarma untuk diteruskan ke BPOM
- Membuat perbaikan dokumen registrasi sesuai dengan permintaan BPOM
- Menginformasikan kepada bagian lain yang terkait tentang disetujuinya nomor registrasi produk baru.
b. Regulasi
Kegiatan yang dilakukan yaitu memperoleh pengetahuan tentang peraturan yang berlaku maupun perubahan peraturan yang terkait dengan kegiatan pembuatan, distribusi, impor dan ekspor, registrasi penandaan, memperoleh pengetahuan tentang prinsip-prinsip Hak atas Kekayaaan Intelektual (HAKI) di Indonesia dan Negara lain yang terkait dengan pendaftaran produk yang antara lain meliputi perlindungan paten produk dan nama dagang, memperoleh pengetahuan tentang undang-undang perlindungan konsumen.
c. Sertifikasi
Kegiatan yang dilakukan yaitu menyusun keseluruhan data yang dipersyaratkan dalam memperoleh sertifikat sesuai dengan peraturan yang berlaku, menguasai proses permohonan sertifikasi sesuai peraturan yang berlaku dan memperoleh pengetahuan tentang informasi yang harus dicantumkan pada sertifikat.
d. Informasi produk
Kegiatan yang dilakukan yaitu menguasai setiap isi informasi suatu produk antara lain nama produk, bahan aktif, dosis dan cara pemberian, indikasi, kontraindikasi, efek samping, peringatan dan perhatian, interaksi obat, dll. memperoleh pengetahuan tentang peraturan periklanan yang berlaku, serta memperoleh pengetahuan tentang kode etik periklanan. e. Permohonan izin dan pelaporan hasil uji klinik
Kegiatan yang dilakukan yaitu memperoleh pengetahuan tentang setiap tahap yang dilakukan dalam perolehan izin uji klinis yang meliputi : izin dari suatu lembaga etik dan ilmiah yang ditunjuk (pra dan paska pemasaran) di Indonesia dan izin dari Badan POM (pra dan paska pemasaran) di Indonesia.
Berdasarkan kompetensi dasar apoteker di Indonesia yang ditetapkan oleh Asosiasi Pendidikan Tinggi Farmasi Indonesia/APTFI (Indonesian Association of
Pharmacy Higher Education) fungsi dari apoteker di industri farmasi adalah:
1. Pendaftaran obat jadi
Seorang apoteker harus mampu melaksanakan fungsi pendaftaran obat jadi secara efektif, terutama dalam hal pengisian formulir kelengkapan pendaftaran. Tugas ini dapat dilaksanakan didukung dengan pengetahuan mengenai perundang-undangan yang berkaitan dengan registrasi obat, formulasi teknologi farmasi, farmakologi dan toksikologi, farmasi fisika, dan kemampuan komunikasi.
2. Pengadaan/penciptaan senyawa/bahan aktif terapeutik atau eksipien baru yang lebik baik
Apoteker harus mampu berpartisipasi dalam mengembangkan senyawa/bahan aktif terapeutik atau eksipien baru yang lebih baik/aktif.
3. Menentukan formula dan teknik pembuatan sediaan obat
Apoteker mampu berpartisipasi dan berkontribusi dalam pengembangan formula sediaan obat, pilot plant, dan up-scaling.
4. Menentukan spesifikasi bahan/produk yang dibutuhkan dan metode analisis untuk memeriksanya
Apoteker mampu berpartisipasi dalam pengembangan spesifikasi bahan (bahan awal maupun sediaan jadi), metode analisis, prosedur pengujian untuk bahan awal, obat jadi, dan kemasan.
5. Pembuatan/produksi sediaan obat dan bahan baku dan pengendalian proses produksi
Apoteker mampu melaksanakan produksi sediaan obat sesuai dengan CPOB dan ketentuan lain dalam rangka menghasilkan produk yang baik/bermutu tinggi. Selain itu apoteker mampu melakukan pengendalian secara teknis operasi/proses manufaktur atau pembuatan sediaan obat.
6. Pengawasan mutu produk
Apoteker mampu melaksanakan fungsi pengawasan mutu bahan awal dan sediaan obat sesuai dengan cara berlaboratorium yang baik (Good Laboratory
Practice) dan CPOB untuk menjamin mutu produk yang akan dipasarkan
serta untuk menjamin kesehatan dan keselamatan kerja. 7. Pengemasan produk
Apoteker mampu melakukan pengemasan produk dengan bahan pengemas yang sesuai.
8. Menetapkan kondisi penyimpanan produk dan waktu kadaluarsa produk Apoteker mampu merancang dan melakukan uji stabilitas dan berbagai perhitungan untuk menentukan kondisi penyimpanan produk yang tepat serta waktu kadaluarsa produk.
9. Partisipasi dalam uji klinik
Apoteker mampu berpartisipasi dan berkontribusi dalam uji klinik obat baru. 10.Inspeksi diri
Apoteker mampu melaksanakan pemeriksaan/pengujian yang sesuai untuk keperluan perbaikan mutu produk dan proses yang sudah ada.
11.Validasi
Apoteker berpartisipasi dalam pelaksanaan validasi proses.
12.Promosi dan penyampaian informasi obat kepada tenaga professional kesehatan lain (dokter, perawat, bidan, dan lain-lain)
Apoteker melaksanakan promosi dan penyampaian informasi kepada tenaga professional kesehatan lain.
13.Pengelolaan barang khusunya pengelolaan bahan awal obat dan obat jadi Apoteker melaksanakan pengelolaan inventori yang efektif dan efisien untuk memenuhi kebutuhan rutin industri dan yang menjamin pemeliharaan kualitas bahan selama oenyimpanan sesuai dengan sifat bahan yang ada.
14.Promosi/kontribusi dalam menghasilkan dan diseminasi pengetahuan baru Apoteker berpartisipasi/berkontribusi dalm menghasilkan dan mendiseminasi pengetahuan baru.
BAB III
KEGIATAN DAN HASIL PRAKTEK KERJA PROFESI APOTEKER
3.1 Kegiatan Praktek Kerja Profesi Apoteker (PKPA)
Kegiatan Praktek Kerja Profesi Apoteker dilaksanakan PT. Holi Pharma Jalan Leuwigajah No.100, Cimindi, Cimahi. Kegiatan ini dilaksanakan mulai dari 1 Mei 2011 sampai dengan 31 Mei 2011.
Kegiatan yang dilakukan selama pelaksanaan Praktek Kerja Profesi Apoteker (PKPA) di PT. Holi Pharma antara lain :
- Melakukan pengamatan tentang PT. Holi Pharma
- Melakukan trial untuk pengembangan formulasi obat-obat tertentu
- Memeriksa kelengkapan dokumen yang diperlukan untuk kelengkapan registrasi variasi obat tertentu
- Mengamati pengujian stabilitas yang dilakukan untuk produk trial maupun produk yang telah beredar
- Diskusi dengan Kepala Bagian Pemastian Mutu, Pengawasan Mutu, Gudang Bahan Kemas, Produksi, Teknik produksi, PPIC/Purchasing, Gudang Bahan Baku, Penelitian dan Pengembangan, Teknik utility, Personalia, Gudang Obat Jadi dan Marketing
- Mengikuti pelatihan karyawan
3.2 Hasil Praktek Kerja Profesi Apoteker 3.2.1 Pemastian Mutu (Quality Assurance)
Pemastian Mutu merupakan bagian yang tertanggung jawab terhadap mutu obat yang diproduksi, menentukan apakah produk yang dihasilkan memenuhi kriteria mutu yang ditentukan atau tidak. CPOB 2006 mensyaratkan bagian Pemastian Mutu harus dipegang oleh seorang apoteker yang telah terdaftar dan terkualifikasi, dan di PT. Holi Pharma bagian Pemastian Mutu dipegang oleh seorang apoteker. Bagian Pemastian Mutu bertanggung jawab kepada Plant
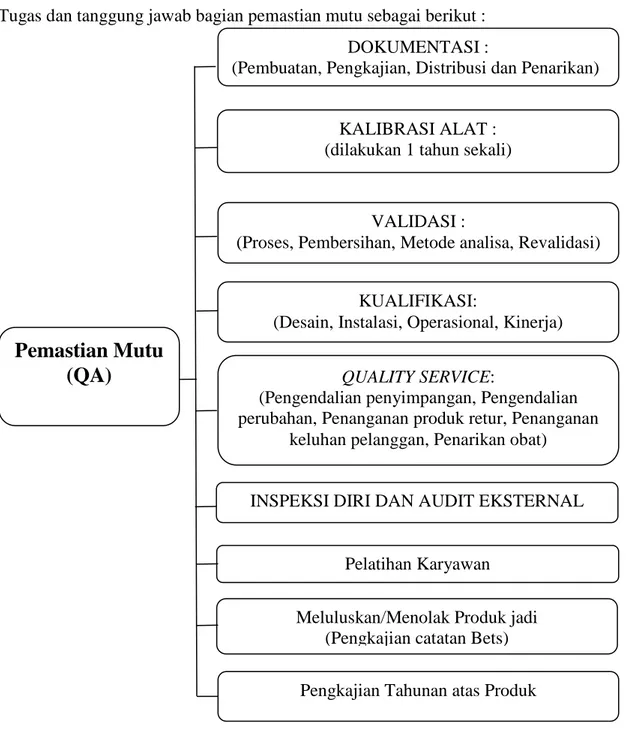
Tugas dan tanggung jawab bagian pemastian mutu sebagai berikut :
Gambar 1.1 Tugas dan Tanggung jawab bagian Pemastian Mutu
3.2.2 Pengawasan Mutu (Quality Control)
Pengawasan Mutu merupakan bagian yang esensial dari Cara Pembuatan Obat yang Baik untuk memberikan kepastian bahwa produk secara konsisten
DOKUMENTASI :
(Pembuatan, Pengkajian, Distribusi dan Penarikan)
Pemastian Mutu
(QA)
KALIBRASI ALAT : (dilakukan 1 tahun sekali)
VALIDASI :
(Proses, Pembersihan, Metode analisa, Revalidasi)
Meluluskan/Menolak Produk jadi (Pengkajian catatan Bets)
KUALIFIKASI:
(Desain, Instalasi, Operasional, Kinerja)
Pelatihan Karyawan
INSPEKSI DIRI DAN AUDIT EKSTERNAL
QUALITY SERVICE:
(Pengendalian penyimpangan, Pengendalian perubahan, Penanganan produk retur, Penanganan
keluhan pelanggan, Penarikan obat)
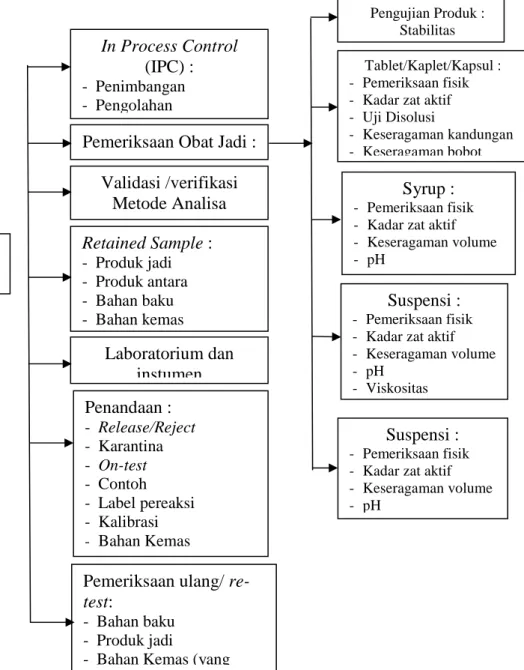
mempunyai mutu yang sesuai dengan tujuan pemakaiannya. Kegiatan pengawasan mutu dilakukan dari bahan baku hingga terbentuk produk jadi. Bagian Pengawasan mutu (QC) dipimpin oleh seorang apoteker yang bertanggung jawab kepada Plant Manager. Tugas dan tanggung jawab bagian pengawasan mutu, sebagai berikut :
Gambar 1.2 Tugas dan Tanggung jawab bagian Pengawasan Mutu
Pengawasan Mutu
(QC)
In Process Control (IPC) : - Penimbangan - Pengolahan Validasi /verifikasi Metode Analisa Pemeriksaan Obat Jadi :Retained Sample : - Produk jadi - Produk antara - Bahan baku - Bahan kemas Laboratorium dan instumen Penandaan : - Release/Reject - Karantina - On-test - Contoh - Label pereaksi - Kalibrasi - Bahan Kemas
Pemeriksaan ulang/
re-test:
- Bahan baku - Produk jadi
- Bahan Kemas (yang
Pengujian Produk : Stabilitas
Tablet/Kaplet/Kapsul : - Pemeriksaan fisik - Kadar zat aktif - Uji Disolusi
- Keseragaman kandungan - Keseragaman bobot
Suspensi :
- Pemeriksaan fisik - Kadar zat aktif - Keseragaman volume - pH
Suspensi :
- Pemeriksaan fisik - Kadar zat aktif - Keseragaman volume - pH
- Viskositas
Syrup :
- Pemeriksaan fisik - Kadar zat aktif - Keseragaman volume - pH
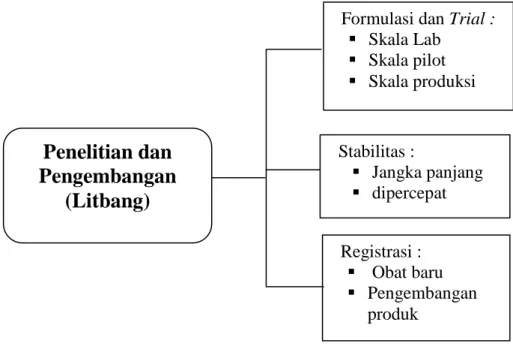
3.2.3Penelitian dan Pengembangan (Litbang)
Bagian Litbang dipimpin oleh seorang apoteker yang bertanggung jawab kepada Plant Manager. Bagian Litbang bertugas melakukan penelitian dan pengembangan terhadap produk baru, baik produk dengan zat aktif baru maupun bentuk sediaan baru. Bagian litbang akan membuat suatu formula, kemudian dilakukan trial terhadap formula tersebut hingga diperoleh produk dengan spesifikasi yang diinginkan.
Tugas dan tanggung jawab bagian Litbang, sebagai berikut :
Gambar 1.3 Tugas dan Tanggung jawab bagian Litbang
3.2.3.a. Formulasi dan Trial
Bagian litbang bertugas melakukan penelitian dan pengembangan terhadap produk baru, baik produk dengan zat aktif baru, zat tambahan baru maupun bentuk sediaan baru. Bagian litbang akan membuat formula, kemudian dilakukan
trial terhadap formula tersebut hingga diperoleh produk dengan spesifikasi yang
diinginkan.
Penelitian dan
Pengembangan
(Litbang)
Formulasi dan Trial : Skala Lab Skala pilot Skala produksi Stabilitas : Jangka panjang dipercepat Registrasi : Obat baru Pengembangan produk
Hasil uji tidak bagus, Trial ulang
Hasil uji tidak bagus, Trial ulang
Hasil uji tidak bagus, Trial ulang Material Request
Gambar 1.4 Proses trial dari skala laboratorium sampai skala produksi
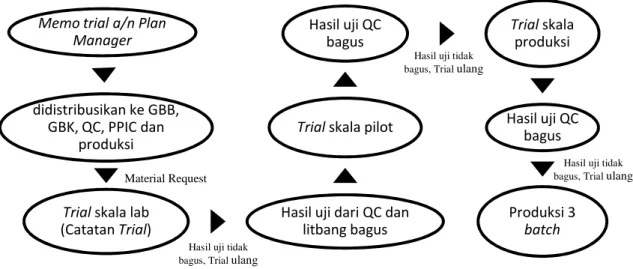
Berikut ini adalah alur pembuatan Batch Record :
Gambar 1.5 Alur pembuatan Batch Record Memo trial a/n Plan
Manager
didistribusikan ke GBB, GBK, QC, PPIC dan
produksi
Trial skala lab
(Catatan Trial)
Hasil uji dari QC dan litbang bagus
Trial skala pilot
Hasil uji QC bagus Trial skala produksi Hasil uji QC bagus Produksi 3 batch Trial sakala produksi (3 batch) Pembuatan Master Formula DPI (Dokumen Produksi Induk) PPI (Prosedur Pengolahan Induk) Batch Record
3.2.3.b. Stabilitas
Pengujian stabilitas dilakukan pada produk trial dan produk yang telah dipasarkan. Pengujian stabilitas dengan menggunakan climatic chamber dengan dua kondisi penyimpanan yaitu :
Stabilitas dipercepat (accelerated stability)
Produk obat jadi disimpan pada kondisi penyimpanan dengan suhu 40°C±2°C dan kelembaban (RH) 75 ± 5%, dengan interval pengujian 0, 1, 2, 3, 4, 5, 6 bulan.
Stabilitas jangka panjang (real time)
Produk obat jadi disimpan pada kondisi penyimpanan dengan suhu 30°C±2°C dan kelembaban (RH) 70% ± 5%, dengan interval pengujian 0, 3, 6, 9, 12, 18, 24, 36, 48, 60 bulan hingga masa kadaluarsa.
3.2.3.c. Registrasi
Registrasi ialah suatu proses pendaftaran dan evaluasi produk untuk mendapatkan izin edar. Registrasi terdiri atas :
Registrasi baru (copy product) dan NCE (New Chemical Entify)/obat baru Registrasi variasi termasuk pelaporan perubahan (formula, spesifikasi,kemasan, dll)
3.2.4 Produksi
Bagian produksi dipimpin oleh seorang Apoteker sebagai kepala produksi yang membawahi supervisor pengolahan dan pengemasan. Supervisor pengolahan bertanggung jawab atas setiap tahapan yang dilakukan selama proses produksi, dari awal sampai kemasan primer. Supervisor pengemasan bertanggung jawab terhadap pengemasan sekunder sampai obat di transfer ke gudang obat jadi.
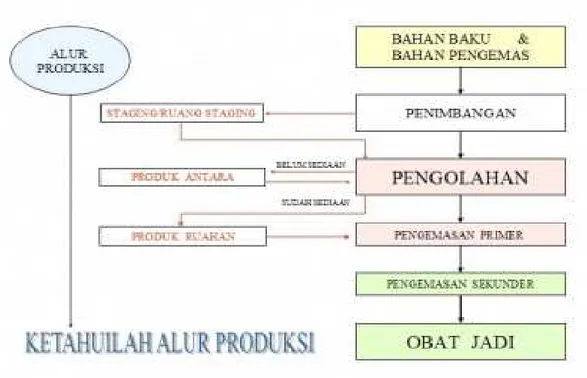
Gedung produksi terletak di lantai dasar digunakan untuk produksi tablet/kaplet, kapsul, sirup/suspensi dan cairan luar. Setiap karyawan dan tamu yang akan memasuki ruang produksi harus menggunakan pakaian khusus yang dilengkapi penutup kepala dan sepatu. Penggunaan pakaian khusus ini dilakukan di ruang antara. Begitu pula alur barang yang akan masuk ke ruang produksi harus melalui ruang antara. Ruangan produksi ini didesain secara berurutan sesuai
tahapan produksi yang bertujuan untuk mem
produksi mulai dari penimbangan bahan baku (zat aktif dan zat tambahan), proses pengolahan hingga pengemasan primer dilakukan di
sedangkan proses pengemasan sekunder dilakukan di Ruangan-ruangan dalam produksi dapat dilihat sebagai berikut :.
Ruang Timbang
Ruang Staging
Ruang Pencucian Botol
Ruang Pengisian
Penyegelan (sediaan sirup dan suspensi)
Ruang Tangki Mixing
Ruang Campur sirup
Ruang Fluid Bed Dryer Granulasi basah
Ruang mixing kering
tahapan produksi yang bertujuan untuk memudahkan proses produksi. Kegiatan produksi mulai dari penimbangan bahan baku (zat aktif dan zat tambahan), proses pengolahan hingga pengemasan primer dilakukan di Grey Area
sedangkan proses pengemasan sekunder dilakukan di Black area ruangan dalam produksi dapat dilihat sebagai berikut :.
•Ruangan yang digunakan untuk penimbangan bahan bahan yang akan digunakan dalam proses produksi Ruang Timbang
•Ruang tempat penyimpanan sementara bahan
akan diproduksi setelah mengalami proses penimbangan •Terdapat 2 ruang staging yaitu untuk sediaan padat dan
sediaan cair.
Ruang Staging
•Ruangan ini digunakan untuk pencucian botol •Diruangan ini terdapat oven, digunakan untuk
mengeringkan botol
Ruang Pencucian Botol
•Diruangan ini terdapat mesin untuk pengisian dan penyegelan botol
dan Penyegelan (sediaan sirup
dan suspensi)
•Merupakan ruang tempat dilakukan proses produksi
•Terdapat alat double jacket Ruang Tangki Mixing
•Ruang untuk mencampur bahan dalam pembuatan sirup
•Menggunakan Colloid Mill (untuk suspensi) dan
turrax (untuk sirup) Ruang Campur sirup
• Dalam ruangan ini terdapat mesin FBD (pengeringan granul), supermixer Fluid Bed Dryer dan
Granulasi basah
• untuk pencampuran akhir (proses lubrikasi) • alat Drum Hoop Mixer
Ruang mixing kering
udahkan proses produksi. Kegiatan produksi mulai dari penimbangan bahan baku (zat aktif dan zat tambahan), proses
Grey Area (Kelas E), Black area (Kelas F).
Ruangan yang digunakan untuk penimbangan bahan-bahan yang akan digunakan dalam proses produksi
Ruang tempat penyimpanan sementara bahan-bahan yang akan diproduksi setelah mengalami proses penimbangan Terdapat 2 ruang staging yaitu untuk sediaan padat dan
Ruangan ini digunakan untuk pencucian botol Diruangan ini terdapat oven, digunakan untuk
Diruangan ini terdapat mesin untuk pengisian dan
Merupakan ruang tempat dilakukan proses
Ruang untuk mencampur bahan dalam pembuatan
(untuk suspensi) dan Ultra
Dalam ruangan ini terdapat mesin FBD
dan granulator
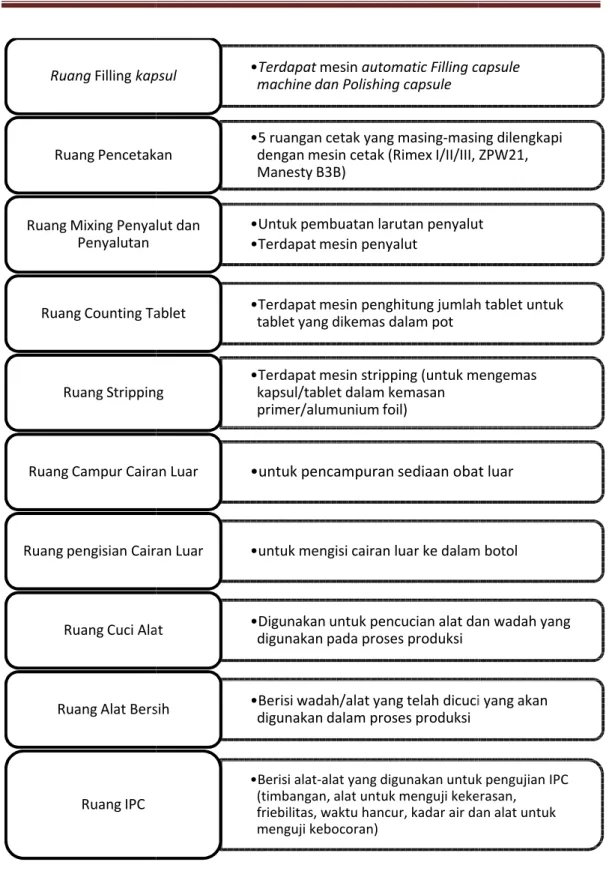
Ruang Filling kapsul
Ruang Pencetakan
Ruang Mixing Penyalut dan Penyalutan
Ruang Counting Tablet
Ruang Stripping
Ruang Campur Cairan Luar
Ruang pengisian Cairan Luar
Ruang Cuci Alat
Ruang Alat Bersih
Ruang IPC
Gambar 1.6 Ruang-ruang Produksi
•Terdapat mesin automatic Filling capsule
machine dan Polishing capsule kapsul
•5 ruangan cetak yang masing-masing dilengkapi dengan mesin cetak (Rimex I/II/III, ZPW21, Manesty B3B)
Ruang Pencetakan
•Untuk pembuatan larutan penyalut •Terdapat mesin penyalut
Ruang Mixing Penyalut dan
•Terdapat mesin penghitung jumlah tablet untuk tablet yang dikemas dalam pot
Ruang Counting Tablet
•Terdapat mesin stripping (untuk mengemas kapsul/tablet dalam kemasan
primer/alumunium foil) Ruang Stripping
•untuk pencampuran sediaan obat luar
Ruang Campur Cairan Luar
•untuk mengisi cairan luar ke dalam botol Ruang pengisian Cairan Luar
•Digunakan untuk pencucian alat dan wadah yang digunakan pada proses produksi
Ruang Cuci Alat
•Berisi wadah/alat yang telah dicuci yang akan digunakan dalam proses produksi
Ruang Alat Bersih
•Berisi alat-alat yang digunakan untuk pengujian IPC (timbangan, alat untuk menguji kekerasan,
friebilitas, waktu hancur, kadar air dan alat untuk menguji kebocoran)
automatic Filling capsule
masing dilengkapi dengan mesin cetak (Rimex I/II/III, ZPW21,
Untuk pembuatan larutan penyalut
Terdapat mesin penghitung jumlah tablet untuk
Terdapat mesin stripping (untuk mengemas
untuk pencampuran sediaan obat luar
untuk mengisi cairan luar ke dalam botol
Digunakan untuk pencucian alat dan wadah yang
Berisi wadah/alat yang telah dicuci yang akan
alat yang digunakan untuk pengujian IPC (timbangan, alat untuk menguji kekerasan,
Berikut ini merupakan tahapan-tahan yang dilakukan dalam produksi :
Gambar 1.7 Alur Produksi secara umum
a. Untuk sediaan Tablet/Kaplet
Gambar 1.8 Alur Produksi sediaan Tablet/Kaplet
Penimbangan
Pengolahan
Pencetakan
Stripping
alufoil / pot
plastik
Folding box /
pot plastik
Master box
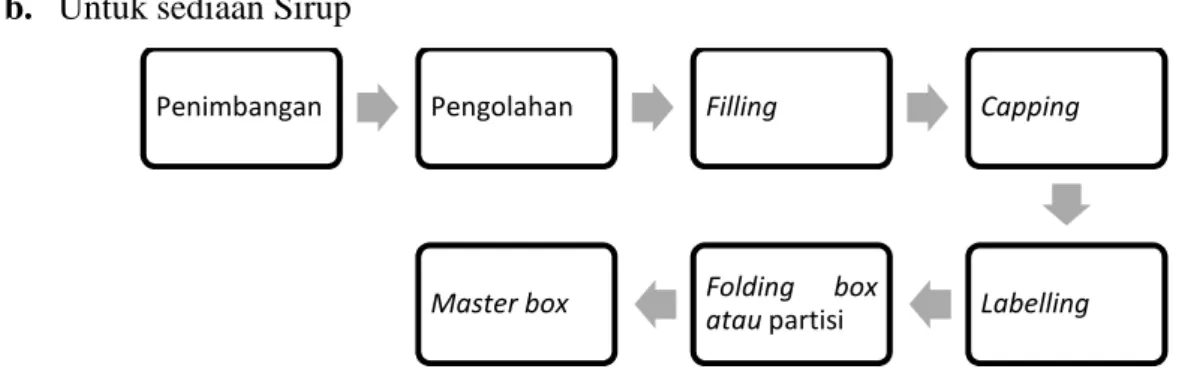
Granulasi basah : pengeringan dengan FBD Coatingb. Untuk sediaan Sirup
Gambar 1.9 Alur Produksi Sediaan Sirup
c. Untuk sediaan Suspensi
Gambar 1.10 Alur Produksi Sediaan Suspensi
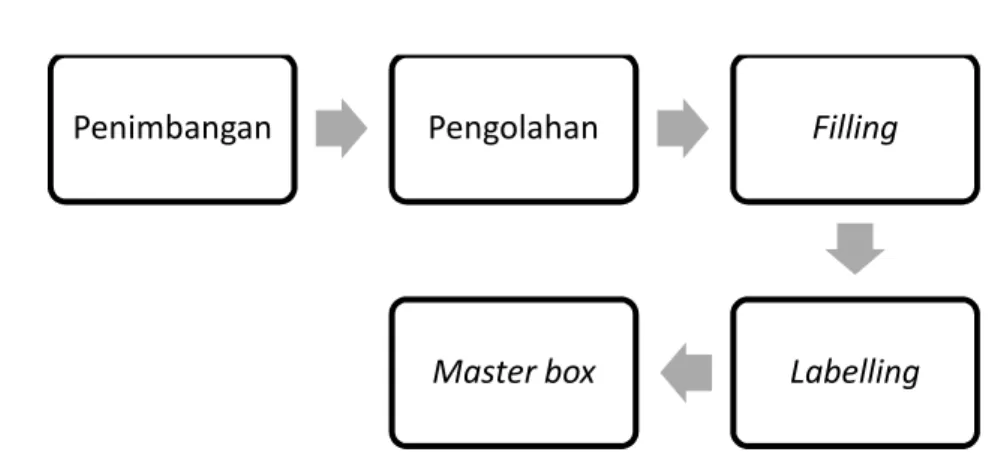
d. Untuk sediaan Kapsul
Gambar 1.11 Alur Produksi Sediaan Kapsul
Penimbangan Pengolahan Filling Capping
Labelling Folding box atau partisi Master box Penimbanga n Pengembangan suspending agent Pengolahan dalam colloid mill Filling Capping
Labelling Folding box atau partisi
Master box
Penimbangan
Pengolahan (mixing kering)/ (granulasi basah) Filling Stripping Folding box Master box Pot Labellin
e. Untuk sediaan Luar
Gambar 1.12 Alur Produksi Sediaan Luar
3.2.5 Teknik Produksi
Bagian teknik produksi dipimpin oleh kepala bagian teknik yang bertanggung jawab kepada plant manager. Tiga tugas utama bagian Teknik Produksi yaitu :
1. Perawatan alat/mesin
Perawatan alat/mesin dilakukan untuk menjaga agar alat/mesin produksi yang digunakan terawat, berfungsi dengan maksimal dan berumur panjang. Dengan adanya perawatan alat/mesin produksi, juga dapat mendeteksi tanda-tanda kerusakan sehingga dapat mengantisipasi kerusakan yang lebih berat. Perawatan alat/mesin produksi dibagi menjadi perawatan harian dan perawatan bulanan sesuai dengan jadwal yang sudah dibuat oleh kepala bagian teknik produksi. Setiap perawatan alat/mesin yang dilakukan di catat dalam
log book perawatan alat/mesin.
2. Perbaikan alat/mesin
Setiap perbaikan yang dilakukan di semua bagian, harus melalui pengisian form permohonan bantuan teknik ke bagian teknik sesuai dengan prosedur yang telah ditetapkan. Sifat dari perbaikan mesin atau alat diantaranya :
Biasa : perbaikan masih bisa ditunda contoh: perbaikan pintu
Penimbangan Pengolahan Filling
Labelling Master box
Penting : harus segera dikerjakan dan berkaitan dengan operasional contoh: mesin stripping tidak jalan
Penting sekali : harus segera dikerjakan, tidak bisa ditunda dan berkaitan dengan keselamatan kerja
contoh : kebocoran pipa steam, panel listrik bau terbakar
Setiap perbaikan yang dilakukan dicatat dalam log book perbaikan alat/mesin.
3. Pemeliharaan bangunan produksi dan pengemasan.
Pemeliharaan bangunan dilakukan untuk menjaga agar bangunan di produksi dan pengemasan terawat dan terpelihara sehingga dapat digunakan secara maksimal dan sesuai dengan ketentuan CPOB. Pemeliharaan dilakukan 2 kali dalam setahun. Bagian yang dilakukan perawatan ialah lantai, dinding dan atap (langit-langit) dengan cara pengecatan dan epoksi lantai. Setiap pemeliharaan yang dilakukan dicatat dalam log book pemeliharaan bangunan produksi/pengemasan.
3.2.6 PPIC (Production Planning Inventory Control) dan Purchasing
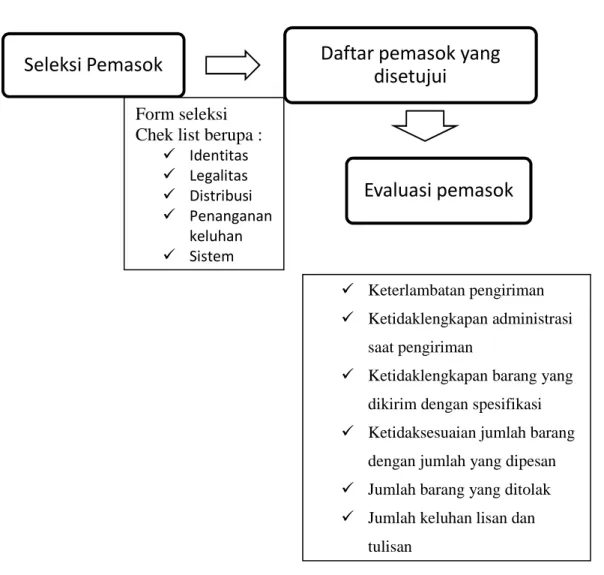
PPIC merupakan bagian dari produksi yang berfungsi untuk melaksanakan perencanaan produksi agar permintaan dari marketing dapat dipenuhi sesuai dengan waktu pemesanan, kuantitas dan kualitas produk. PPIC mengontrol persediaan barang baik berupa bahan baku, bahan kemas maupun produk jadi. Pengendalian persediaan dilakukan oleh PPIC, sedangkan pengatur masuk keluarnya barang dilakukan oleh gudang. Purchasing atau bagian pembelian berhubungan dengan supplier barang baik bahan baku maupun bahan kemas. Sebagian tugas dari purchasing ialah seleksi dan evaluasi pemasok (supplier).
Gambar 1.13 Alur Pemilihan Pemasok
3.2.7 Gudang
Terdapat tiga gudang, yaitu gudang bahan baku (GBB), gudang bahan kemas (GBK) dan gudang obat jadi (GOJ). Penyimpanan disusun berdasarkan
mapping yang telah dibuat untuk memudahkan pencarian bahan baku/bahan
kemas/obat jadi. Pengeluaran bahan baku/bahan kemas/obat jadi dilakukan berdasarkan prinsip FIFO (First in first out) dan FEFO (First expired first out).
Seleksi Pemasok
Daftar pemasok yang
disetujui
Evaluasi pemasok
Form seleksi Chek list berupa :
Identitas Legalitas Distribusi Penanganan keluhan Sistem Keterlambatan pengiriman Ketidaklengkapan administrasi saat pengiriman
Ketidaklengkapan barang yang dikirim dengan spesifikasi Ketidaksesuaian jumlah barang dengan jumlah yang dipesan Jumlah barang yang ditolak Jumlah keluhan lisan dan tulisan
Release
label karantina, on test, dan contoh
Released
1. Gudang Bahan Baku (GBB)
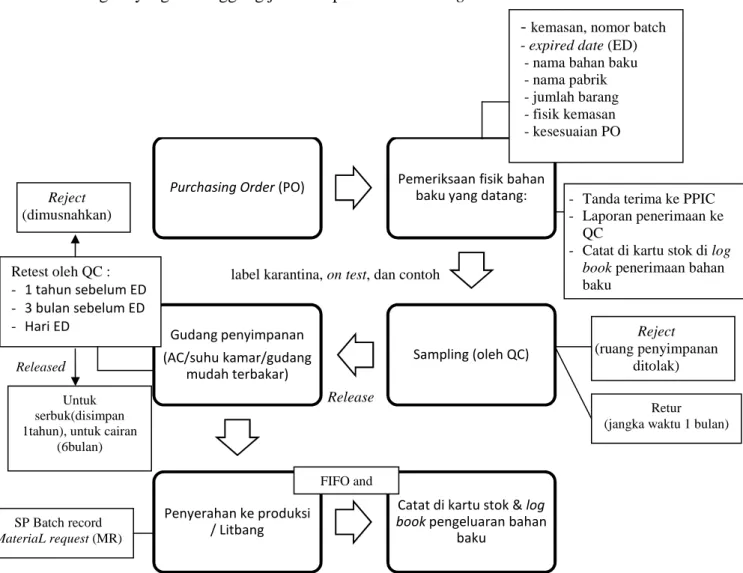
Gudang bahan baku (GBB) adalah tempat penyimpanan bahan baku baik bahan baku aktif maupun bahan baku tambahan. GBB dipimpin oleh kepala bagian yang bertanggung jawab kepada Plant Manager.
Gambar 1.14 Alur Penerimaan, penyimpanan dan pengeluaran bahan baku
2. Gudang Bahan Kemas (GBK)
Gudang bahan kemas (GBK) merupakan tempat penyimpanan bahan kemas yang terdiri dari :
• Bahan kemas primer :
- alufoil print/polos dan cangkang kapsul yang disimpan di ruang suhu AC
Purchasing Order (PO) Pemeriksaan fisik bahan
baku yang datang:
Sampling (oleh QC) Gudang penyimpanan (AC/suhu kamar/gudang mudah terbakar) Penyerahan ke produksi / Litbang
Catat di kartu stok & log
book pengeluaran bahan
baku
- kemasan, nomor batch - expired date (ED) - nama bahan baku - nama pabrik - jumlah barang - fisik kemasan - kesesuaian PO
- Tanda terima ke PPIC - Laporan penerimaan ke
QC
- Catat di kartu stok di log
book penerimaan bahan
baku Retest oleh QC : - 1 tahun sebelum ED - 3 bulan sebelum ED - Hari ED Retur (jangka waktu 1 bulan)
Reject
(ruang penyimpanan ditolak)
Untuk serbuk(disimpan 1tahun), untuk cairan
(6bulan) SP Batch record MateriaL request (MR) Reject (dimusnahkan) FIFO and
- botol dan plastik disimpan pada suhu kamar.
• Bahan kemas sekunder (contoh : master box, folding, brosur, partisi, etiket) yang disimpan pada suhu kamar.
GBK dipimpin oleh kepala bagian yang bertanggung jawab kepada plant
manager.
Gambar 1.15 Alur penerimaan, penyimpanan dan pengeluaran bahan kemas
3. Gudang Obat Jadi (GOJ)
Gudang obat jadi (GOJ) merupakan tempat penyimpanan obat jadi yang akan didistribusikan. GOJ dipimpin oleh seorang kepala bagian yang bertanggung jawab kepada Business Manager.
Pemeriksaan fisik bahan kemas yang datang:
Sampling (oleh QC) Gudang penyimpanan (AC/suhu kamar) Penyerahan ke produksi/litbang
Catat di kartu stok & log book pengeluaran bahan kemas
Purchasing Order (PO) - nomor batch - expired date - nama item bahan kemas - nama supplier - jumlah barang - fisik kemasan - Kesesuaian
- Tanda terima ke PPIC dan accounting
- Laporan penerimaan ke bagian QC
- Catat di kartu stok di log
book penerimaan bahan
kemas
label karantina, on test, dan contoh
Reject
(ruang penyimpanan ditolak)
Release d
Packaging Order (PO) Material request (MR)
Lulus dari QA
Gambar 1.16 Alur penerimaan, penyimpanan dan penyerahan Obat Jadi
3.2.8 Teknik Utilitis
Bagian teknik dipimpin oleh kepala bagian yang bertanggung jawab kepada plant manager. Bagian ini bertugas untuk melakukan perawatan serta perbaikan terhadap sarana-sarana yang mendukung proses produksi maupun sarana-sarana perkantoran seperti bangunan, peralatan, air, udara, energi serta kondisi seluruh lingkungan pabrik dan perkantoran. Kegiatan teknik mencakup pengaturan udara (Air Handling Unit System), pengolahan air bersih, pengolahan aqua DM, listrik (genset) , boiler, compressor, dan pengolahan limbah.
a. Sistem Air Handling Unit (AHU)
Sistem Air Handling Unit (AHU) mengatur kondisi udara di pabrik (ruang produksi obat) yang menyangkut suhu dan kelembaban agar temperatur ruangan nyaman, bersih dan memenuhi standar CPOB. Instalasi AHU diatur dengan sistem pembagian zona (zona 1-6), yaitu dengan mengklasifikasi masing-masing ruangan. Dengan demikian masing-masing ruangan memiliki
Sales Order (SO) dan surat permintaan obat jadi non
komersial
Gudang Obat Jadi (GOJ)
Penyiapan barang sesuai permintaan
Delivery Order (DO) dan surat jalan/permintaan obat non
komersial
Pencatatan kartu stok dan buku distribusi obat jadi
Obat yang masuk gudang, dicatat di kartu stok
pengemasan
Bukti transfer obat jadi
sistem instalasi dan sistem filtrasi yang berbeda. Pengaturan instalasi AHU sebagai berikut :
Medium/
Fresh Air prefilter
Pre-filter Pendinginan Centrifugal fan (blower)
R.I R.II R.III R.IV
Ruang produksi zona I
Gambar 1.17 Instalasi AHU (Air Handling Unit)
b. Pengolahan Potable water
Air bersih (potable water) digunakan untuk pencucian pakaian karyawan, pencucian alat non steril, pembersihan ruangan, toilet, cuci tangan, dll. Alur pengolahannya sebagai berikut :
Sumber air (sumur bor)
Distribusi ke tiap unit-unit
Gambar 1.18 Proses pengolahan air bersih c. Aquademineralisata
Tujuan dari sistem pengolahan air untuk produksi aquademineralisata (aqua DM) adalah untuk menghilangkan cemaran sesuai dengan standar kualitas air yang telah ditetapkan. Alur proses pengolahan aquademineralisata sebagai berikut : Tangki penampungan Sand filter Carbon active Penampungan air bersih Pressure tank
Lab.QC
1µ 0.2 µ 0.2 µ 1µ Catridge filter Catridge filter
pompa Distribusi ke unit-unit produksi
Climatic R.FBD R.coating R.double R.campur R.mixing R.campur R.cuci R.cuci chamber jacket cairan luar sirup salep alat botol
Gambar 1.19 Proses pengolahan aquadem d. Genset
Untuk menggantikan sumber listrik bila sumber listrik (PLN) padam/tidak berfungsi. Genset yang digunakan ialah genset yang sesuai dengan kapasitas penggunaan listrik di industri farmasi.
e. Boiler
Uap air (steam) berfungsi sebagai sumber panas (heater) pengganti panas api, karena di industri farmasi tidak diperbolehkan adanya api terbuka yang dapat menyebabkan kontaminasi produk dan bahaya kebakaran. Uap air diantaranya digunakan untuk mengeringkan granul (dengan fluid bed dryer), memasak air (pada alat double jacket), dan pengeringan botol (oven).
f. Kompressor
Udara bertekanan (compressed air) digunakan untuk menyemprotkan cairan, yaitu penyalutan (coating). Karena bersentuhan langsung dengan produk maka pada sistem udara tekan harus tidak mengandung oli, air, partikel dan dilengkapi dengan saringan udara yang sesuai.
g. Pengolahan limbah Tangki penampungan air bersih Sand filter Carbon active Anion exchange Kation exchange Mix bed Tangki penampungan aquadem a
Dari hasil proses produksi PT. Holi Pharma dihasilkan berbagai macam limbah, salah satunya adalah limbah cair. Limbah cair yang berasal dari proses produksi dan pencucian alat untuk produksi, limbah bagian Pengawasan mutu dan Litbang diolah dalam Instalasi Pengolahan Air Limbah (IPAL). Proses penanganan air limbah menggunakan sistem pengolahan secara fisika, kimia dan biologi. Proses pengolahan air limbah sebagai berikut:
Gambar 1.20 Pengolahan air limbah
3.2.9 Marketing
Bagian marketing merupakan bagian yang bekerja di bidang pemasaran produk. Ruang lingkup tugas dan tanggung jawab bagian pemasaran adalah sebagai berikut :
1. Melakukan kunjungan dan supervisi kepada pelanggan
2. Mengkoordinir dan mengevaluasi hasil pekerjaan bagian marketing, penjualan dan pengiriman.
3. Membuat rencana penjualan dan pengiriman. 4. Melakukan promosi produk
5. Memonitor kegiatan kompetitor dan melaporkan kepada atasan 6. Melakukan tugas purna jual
Pada bagian marketing terdapat Busines Manager, yang memiliki tanggung jawab sebagai berikut :
Equalisasi Sedimentasi 1 Sedimentasi 2 Bak Balance Pengolahan Biologi 1 (BIOFILTER 1) Filter Bak efluen Pengolahan Biologi 2 (BIO FILTER 2) Pengolahan biologi 3 (BIO FILTER 3) Bak Kontrol Saluran Pembuangan
1. Membuat rencana penjualan
2. Melaksanakan kunjungan kepada customer 3. Turut membantu proses penagihan
4. Evaluasi pelanggan setiap tahunnya 5. Negosiasi penjualan dengan pelanggan
6. Meneruskan dan menindaklanjuti/mengkoordinir complain dari pelanggan 7. Membuat data dan mengusulkan perbandingan harga obat dengan produk
kompetitor
8. Memberi usulan produk yang akan ditarik/dihentikan
9. Memberikan laporan dan mempertanggungjawabkan atas semua aktivitas yang dilakukan kepada marketing manager yang selanjutnya dilaporkan ke Direktur.
Segmen Pasar dari PT. Holi Pharma meliputi : a. Trading
Sifatnya langsung ke distributor, kemudian distributor menyebarkan ke apotek, rumah sakit.
b. Dispensing
Distributor menjual produk ke dokter, kemudian dokter langsung memberikan obat pada pasien (tanpa resep).
c. Tender Instansi Pemerintah
Kerjasama dengan Dinas Kesehatan, Polda, RS. Bhayangkara, RS. Angkatan Darat (RS. AD).
Kebutuhan tender instansi pemerintah dikerjakan oleh PBF yang melakukan tender di Indonesia, sebanyak 15-20 PBF pemain tender permintaan produk ke PT. Holi Pharma
Area Penyebaran nya :
1. Mempunyai distributor skala Nasional yaitu PT. Sapta Sari Tama yang terdapat di 26 cabang seluruh Indonesia.
2. Mempunyai distributor di masing-masing daerah.
Kepuasan pelanggan dilakukan dengan melakukan evaluasi ke distributor setiap bulan,meliputi :
• Pengiriman barang
• Kelengkapan stok produk
• Complain pelanggan dari daerah
Pemesanan barang dilakukan :
Sales Order
Sales Distributor
Membuat Faktur Gudang Obat Jadi
Persiapkan Barang, buat surat pengiriman Kirim
(maksimal pengiriman 4 hari)
Marketing Plan:
a. Dibuat 1 tahun sekali, dengan menggunakan sistem target,
b. Program yang diberikan untuk distributor dan pelanggan untuk menunjang sales target, contoh : program kerjasama pelanggan dan distributor jika membeli sebanyak 50 juta rupiah setiap bulannya, maka setelah 6 bulan akan mendapatkan handphone.
Keluhan pelanggan :
Keluhan Pelanggan
Distributor Membuat Laporan
Laporan Masuk ke Marketing
Disesaikan dengan kebutuhan penangan nya
Ditangani oleh marketing Dikoordinasikan dengan pemastian mutu 1. Menyangkut Harga 1. Kerusakan sediaan/zat aktif
2. Kemasan 2. Reaksi Obat Merugikan 3. Expired date
Penanganan Obat Kembalian, dilakukan berdasarkan : a. Kerusakan produk karena pabrik dan penyimpanan
b. Minimal 3 bulan sebelum expired date, maka akan diganti dengan obat baru.
c. Kerusakan produk berdasarkan ekspedisi, dilakukan penggantian oleh ekspedisi yang bersangkutan.
BAB IV
KESIMPULAN DAN SARAN
1.1 Kesimpulan
Dari hasil kegiatan dan pengamatan selama Praktek Kerja Profesi Apoteker di PT. Holi Pharma, dapat disimpulkan beberapa hal sebagai berikut :
1. Peserta PKPA dapat memahami praktek kerja langsung di PT. Holi Pharma melalui pendekatan kemampuan akademik dengan kompetensi sebagai calon apoteker.
2. Peserta PKPA dapat mengetahui dan memahami kegiatan di PT. Holi Pharma yang berhubungan dengan kompetensi sebagai apoteker.
3. Peserta PKPA dapat memahami peran dan tanggung jawab apoteker dalam pelaksanaan pelayanan kefarmasian di Industri Farmasi, khususnya PT.Holi Pharma.
4. Praktek Kerja Profesi Apoteker ini dapat memberikan gambaran nyata tentang permasalahan pekerjaan kefarmasian di Industri Farmasi.
4.2 Saran
Dari hasil pengamatan selama Praktek Kerja Profesi Apoteker di PT. Holi Pharma, dapat disarankan beberapa hal sebagai berikut :
1. Peningkatan kinerja marketing terhadap obat-obat produk PT. Holi Pharma untuk lebih meningkatkan pengenalan konsumen terhadap produk PT. Holi Pharma, terutama di tingkat end user sehingga akan meningkatkan omzet perusahaan.
2. Hendaknya hubungan kerjasama antara lembaga pendidikan dan industri farmasi perlu ditingkatkan sebagai salah satu upaya untuk membentuk Apoteker yang berkualitas.
DAFTAR PUSTAKA
Badan POM RI, 2001, Petunjuk Operasional Penerapan Cara Pembuatan Obat
yang Baik 2001, Jakarta.
Badan POM RI, 2006, Pedoman Cara Pembuatan Obat yang Baik, Jakarta.
Badan POM RI. 2006. Petunjuk Operasional Penerapan Cara Pembuatan Obat
yang Baik 2006. Jakarta.
Departemen Kesehatan RI, 1990, Surat Keputusan Menteri Kesehatan RI No. 245/Menkes/SK/V/1990 tentang Ketentuan dan Tata Cara Pelaksanaan Pemberian Izin Usaha Industri Farmasi, Jakarta.
Kementerian Kesehatan RI. 2010. Peraturan Menteri Kesehatan RI No. 1779 /Menkes/Per/XII/2010 tentang Industri Farmasi. Jakarta.
Priyambodo, B. 2007. Manajemen Farmasi Industri. Yogyakarta : Global Pustaka Utama.
LAMPIRAN 1
STRUKTUR ORGANISASI PT. HOLI PHARMA
DIREKTUR BEDJO STEFANUS AUDITOR SEKRETARIS A.F. PAULINA Plant Manager DOORTHEA M. ACCOUNTING MANAGER RUDI KA. PENGAWASAN MUTU ALDO M KA. PEMASTIAN MUTU DWI H KA. LITBANG DAHLIA M KA. PRODUKSI CLARA P PPIC LUSIA. H SPV. PRODUKSI
MITAH & IWAN
SPV. PENGEMASAN CEPPI &NOVRITA KEUANGAN ELA T. EDP EVELIN KA TEKNIK MESIN PRODUKSI SUSANTO KA UTILITIS DANIELK KA. GUDANG BAHAN BAKU LIZZA A. KA GUDANG BAHAN KEMAS BONDAN P BUSINESS MANAGER CAHYO H SALES DISTRIBUTION LISMA P. KA. GUDANG OBAT JADI MANAGER MARKETING PERSONALIA H. NURMAYA SATPAM DEDENG IT WENDI UMUM DANIEL K. PURCHASING LUSIA H
DENAH LANTAI DASAR PT. HOLI PHARMA LAMPIRAN 2
DENAH LANTAI DASAR PT. HOLI PHARMA DENAH LANTAI DASAR PT. HOLI PHARMA
LAMPIRAN 3
CONTOH LABEL KARANTINA
KARANTINA BAHAN AWAL
Nama Bahan : Nomor Batch : Tanggal Terima : Nomor Penerimaan : Lot : Dari : Bentuk Sediaan : Jumlah :
Nama Petugas : Paraf :
Pengawasan Mutu Tanggal :
KARANTINA PRODUK SETENGAH JADI
Produk : Nomor Batch : Besar Batch : Tahap : Lot : Dari : Jumlah :
Nama Petugas : Paraf :
Pengawasan Mutu Tanggal :
KARANTINA PRODUK JADI
Produk :
Nomor Batch :
Jumlah Master Box :
Tahap :
Bentuk Sediaan :
Bobot Min. : Bobot Max. :
Nama Petugas : Paraf :
LAMPIRAN 4
CONTOH LABEL DILULUSKAN/DITOLAK
DILULUSKAN UNTUK : ... Nama Bahan/Produk : No. Batch/ : No. Penerimaan Tanggal Penerimaan : Exp. Date : Lot : Dari : Jumlah :
Nama Petugas : Paraf :
Pengawasan Mutu Tanggal Diluluskan : DITOLAK UNTUK : ... Nama Bahan/Produk : No. Batch/ : No. Penerimaan Tanggal Penerimaan : Exp. Date : Lot : Dari : Jumlah :
Nama Petugas : Paraf :
Pengawasan Mutu