Panas & Hukum Pertama
Termodinamika
In this photograph of Bow Lake in Banf National Park, Alberta, we see evidence of water in all three phases. In the lake is liquid water, and solid water in the form of snow
appears on the ground. The clouds in the sky consist of liquid water droplets that have
condensed from the gaseous water vapor in the air.
Changes of a substance from one phase
to another are a result of energy transfer.
Panas dan Energi Dalam
Energi Dalam (
Internal
Energy
, U)
• Energi kinetik translasi • Rotasi molekular
• Vibrasi ikatan
• Tarikan intermolekul • Ikatan kimia
• Elektron-elektron
Energi Dalam adalah energi total
(potensial dan kinetik) di dalam sistem
yang berhubungan dengan
Panas adalah energi yang
mengalir antara sistem dan
lingkungannya karena
perbedaan temperatur antara
keduanya
.
Saat memanaskan bahan, kita memindahkan energi ke dalam bahan tersebut dengan
menempatkannya pada
lingkungan dengan temperatur lebih tinggi. Contoh: saat satu panci diletakkan di atas
kompor (kompor memiliki temperatur lebih tinggi
daripada air) maka air
memperoleh energi dalam bentuk panas.
Istilah panas juga digunakan untuk menyatakan jumlah yang dipindahkan dengan metode seperti ini.
Panas (Heat, Q)
• Panas mengalir dari kompor ke air
• Temperatur air naik
Beda antara panas dan energi dalam, analogi dengan beda antara kerja dan energi mekanik.
Kerja yang dilakukan pada suatu sistem adalah ukuran jumlah energi yang ditransfer ke sistem dari lingkungannya, sedangkan energi mekanik sistem tersebut adalah konsekuensi dari gerak dan konfigurasi sistem tersebut.
Bila seseorang melakukan kerja pada suatu sistem, energi ditransfer dari
orang tersebut ke sistem tersebut. Kerja dari suatu sistem tidak memiliki arti – orang hanya dapat mengacu hanya pada kerja yang dilakukan pada atau oleh sistem.
Panas dan kerja bukan sifat intrinsik suatu sistem.
Kita tidak dapat mengatakan suatu sistem “mengandung”
sejumlah tertentu panas atau kerja. Keduanya bukan fungsi
keadaan.
Keduanya, panas dan kerja, berhubungan dengan “proses
termodinamika”. Panas hanya dapat diacu bila energi
Sistem adalah air dalam wadah terisolasi termal. Kerja dilakukan pada air oleh roda pedal yang berputar, yang dihasilkan oleh balok yang jatuh dengan kelajuan tetap.
Temperatur air naik karena gesekan dengan pedal. Jika energi pada pemutar dan yang melewati
dinding diabaikan, maka kehilangan energi
potensial balok setara dengan kerja oleh pedal pada air. Jika kedua balok jauh sejauh jarak h, kehilngan energi potensial adalah 2mgh, dimana m adalah
massa balok; energi ini menyebabkan temperatur air naik. Joule menemukan bahwa energi mekanik
2mgh sebanding dengan kenaikan temperatur air, ΔT. Konstanta pembanding ditemukan kira-kira 4,18 J/g . °C. Disini, energi mekanik 4,18 J
menaikkan temperatur dari 1 g air sebanyak 1°C. Dari pengukuran lebih akurat ditemukan
kesebandingan tersebut adalah 4,186 J/g.°C bila temperatur air naik dari 14,5°C ke 15,5°C. Dari sini diperoleh:
J
186
,
4
cal
1
Persamaan ini dengan kesetaraan mekanis dari panas (mechanical
equivalent of heat).
• Panas setara dengan energi, sehingga satuannya adalah satuan
energi. Energi mempunyai satuan Joules, tetapi, panas mempunyai satuan khusus, yaitu calorie.
• Satu calorie adalah panas yang dibutuhkan untuk menaikkan
temperatur satu gram air sebanyak 1 Co. • 1cal = 4,186J
• 1kcal = 1000 cals
• 1Cal (kandungan energi dari makanan) = 1000 cals • 1 Btu = 252 cal =1055 J
Satuan Panas
• calorie (cal) is defined as the amount of energy transfer necessary to raise the temperature of 1 g of water from 14.5°C to 15.5°C.1
• (Note that the “Calorie,” written with a capital “C” and used in describing the energy content of foods, is actually a kilocalorie.)
Q
T
Bila suatu sistem diberi energi, dan tidak ada perubahan energi kinetik dan potensial, maka temperatur sistem akan naik (kecuali saat sistem mengalami perubahan fasa).
Jumlah energi panas (Q) yang dibutuhkan untuk menaikkan temperatur suatu zat sebanding dengan perubahan temperatur dan massa zat tersebut. Jumlah ini berbeda bila jenis zat berbeda.
Q C T
C disebut kapasitas panas zat
C didefensikan sebagai jumlah panas yang diperlukan untuk menaikkan temperatur suatu zat sebanyak satu derajat.
Kapasitas Panas dan Panas Jenis
Heat Capacity and Specific Heat
C
c
m
Panas jenis (c) adalah kapasitas panas per satuan massa.
Salah satu cara mengukur panas jenis yang terlibat dalam
memanaskan suatu sampel ke temperatur tertentu Tx, letakkan sampel tersebut ke dalam wadah berisi air yang diketahui massanya dan
temperatur Tw < Tx, dan ukur temperatur air setelah kesetimbangan tercapai.
Teknik ini disebut calorimetry, dan alatnya disebut calorimeter. Jika sistem sampel dan air
terisolasi, menurut hukum
kekekalan energi maka jumlah
energi yang meninggalkan sampel (yang panas jenisnya tidak
diketahui) sama dengan jumlah energi yang masuk ke air.
Berdasarkan hukum kekekalan energi dapat ditulis:
Q
dingin= - Q
panasAnggap mx adalah massa sampel dari bahan yang akan ditentukan
panas jenisnya. Panas jenis misalnya dinamakan adalah cx dan
temperatur awalnya Tx . Dengan cara yang sama mw, cw, dan Tw
menyatakan nilai yang berhubungan untuk air. Jika Tf adalah
temperatur kesetimbangan akhir setelah semuanya tercampur, maka
transfer energi untuk air adalah mwcw(Tf - Tw), yang bernilai positif
karena Tf > Tw , dan transfer energi untuk sampel adalah mxcx(Tf - Tx),
yang bernilai negatif.
f w
x x
f x
ww
c
T
T
m
c
T
T
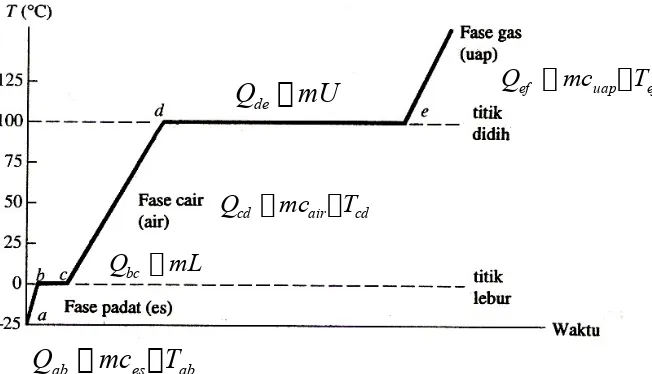
Pada saat terjadi perubahan fasa, zat menyerap sejumlah
panas tetapi tidak terjadi perubahan temperatur.
Panas yang dibutuhkan dalam perubahan fasa sebanding
dengan massa zat dan jenis bahan zat tersebut.
mL
Q
Panas Laten Peleburan
L = Panas laten peleburan atau kalor lebur (J/kg)
Panas Laten
mU
Q
U = Panas laten penguapan atau kalor uap (J/kg)
Grafik temperatur-kalor untuk es dengan temperatur di bawah 0oC
yang dipanaskan sampai temperatur di atas 100oC.
mU
Q
de
Q
ef
mc
uap
T
efcd air
cd
mc
T
Q
mL
Q
bc
ab es
ab
mc
T
Langkah-Langkah Penyelesaian Soal
tentang kalor
Perhatikan berapa jenis zat yang terlibat, catat data
masing-masing.
Buat grafik temperatur-kalor tiap zat
•
Untuk zat yang mengalami perubahan suhu,
grafiknya berbetuk garis miring
•
Untuk zat yang mengalami perubahan wujud,
grafiknya datar
•
Hitung kalor yang diterima masing-masing
•
Sistem (system) adalah sekumpulan benda
yang menjadi perhatian.
•
Lingkungan (surrounding / environment)
adalah segala sesuatu di luar sistem.
•
System + Surroundings = Universe
(sistem + lingkungan = semesta)
Kerja (W) adalah positif untuk usaha yang dilakukan
pada sistem oleh lingkungan.
Kerja adalah negatif jika usaha dilakukan pada
lingkungan.
Contoh: gas mengembang melawan piston sistem melakukan kerja (W negatif).
Panas (Q) adalah positif jika masuk ke dalam
sistem.
Panas Q adalah negatif bila ke luar dari sistem.
Dalam pendekatan makroskopik pada termodinamika,
keadaan (
state
) sistem digambarkan menggunakan variabel
•
tekanan (
pressure
,
P
),
•
volume (
V
),
•
temperatur (
T
), dan
•
energi dalam (
U
)
Besaran-besaran ini disebut
variabel keadaan
(
state
variables
). Untuk setiap konfigurasi sistem, dapat
diidentifikasi nilai variabel keadaan.
Keadaan makroskopik sistem terisolasi dapat ditentukan
hanya bila sistem tersebut dalam kesetimbangan termal.
Kategori kedua variabel dalam situasi yang melibatkan
energi adalah
variabel perpindahan
(
transfer variables
).
Variabel ini bernilai nol, kecuali suatu proses terjadi dimana
energi dipindahkan (ditransfer) melewati batas sistem.
Karena perpindahan energi melewati batas menyatakan
suatu perubahan di dalam sistem tersebut, variabel
perubahan tidak berhubungan dengan keadaan sistem, tetapi
dengan perubahan keadaan sistem.
Perhatikan suatu sistem piston dan
silinder berisi gas dengan volume V dan memberikan tekanan P pada dinding silinder dan piston. Jika luas piston adalah A, gaya oleh gas pada piston adalah F = PA. Jika piston ditekan ke arah dalam (tapi tetap setimbang
termal), kerja pada gas:
Di sini, akan dikaji variabel perpindahan yang lain yaitu kerja,
khususnya kerja pada sistem yang dapat berubah bentuk (deformable, yaitu gas.
Jika gas ditekan maka
dV
negatif, maka kerja positif.
Untuk mengetahui integral ini, maka bentuk fungsi P
harus diketahui. Secara umum, tekanan tidak konstan selama proses yang dialami oleh gas, tetapi bergantung volume dan temperatur.
Kerja total yang dilakukan pada gas jika volumenya berubah dari Vi
ke Vf dinyatakan oleh:
Jika tekanan dan volume diketahui pada setiap tahap dari proses, maka keadaan gas tersebut pada setiap tahap dapat diplot pada suatu grafik yang disebut
diagram PV. Diagram ini dapat
memvisualisasikan suatu proses yang sedang dijalani suatu gas. Kurva pada
suatu diagram PV disebut lintasan (path) yang dilalui antara posisi awal dan akhir.
Kerja
pada atau oleh gas dari keadaan awal ke
keadaan akhir
bergantung pada lintasan
yang
dilalui antara dua keadaan tersebut.
---> Gaya tekan oleh gas bukan gaya konservatif.
Perhatikan proses penekanan pada suatu gas dalam silinder, kerja yang dilakukan bergantung pada lintasan yang dilalui dari posisi awal ke posisi akhir.
Perpindahan energi oleh panas (Q) ke dalam atau ke luar sistem juga bergantung pada proses.
Perhatikan gambar di samping. Gas memiliki volume, temperatur, dan tekanan yang sama dan diasumsikan ideal. Gas terisolasi termal dari lingkungan kecuali pada bagian bawah, dimana ada kontak termal dengan reservoir energi.
Piston ditahan pada posisi awalnya dengan agen luar, misalnya tangan. Bila gaya yang menahan piston dikurangi sedikit, piston naik perlahan ke posisi akhirnya. Karena piston bergerak ke atas maka gas melakukan kerja.
Selama ekspansi ke volume akhir Vf, energi panas masuk dari reservoir ke gas untuk mempertahankan temperatur tetap Ti.
Perhatikan suatu sistem yang terisolasi termal sempurna seperti gambar di
samping. Bila membran tiba-tiba dirobek maka gas mengembang dekan cepat ke daerah vakum sampai mengisi volume Vf
dan pada tekanan Pf.
Gas tidak melakukan kerja karena tidak ada gaya padanya. Tidak ada gaya yang diperlukan untuk membuat gas
mengembang. Tidak ada energi yang dipindahkan panas melewati dinding isolasi.
Proses ini memiliki keadaan awal dan akhir sama dengan Gambar pada slide sebelumnya, tetapi lintasan berbeda.
Jadi, energi yang dipindahkan oleh panas, seperti kerja yang
Kedua mekanisme ini menyebabkan perubahan energi-dalam sistem dan menghasilkan
perubahan yang dapat diukur pada variabel makroskopik dari sistem tersebut seperti tekanan, temperatur dan volume suatu gas.
Hukum Pertama Termodinamika
Ada dua cara energi dipindahkan antara sistem dan lingkungannya.
1. kerja pada sistem (ada perpindahan
makroskopik pada titik yang dikenai gaya). 2. panas, pada level molekular bilamana
Suatu sistem berubah dari kedaan awal (Pi, Vi) ke keadaan akhir (Pf, Vf).
Selama perubahan ini, terjadi perpindahan panas (Q) ke sistem, dan
kerja (W) dilakukan pada sistem. Jika Q+W diukur diukur untuk
berbagai lintasan, hasilnya sama untuk semua lintasan. Jadi Q+W
ditentukan sepenuhnya oleh kedaan awal dan akhir, kuantitas ini disebut
perubahan energi-dalam (ΔU) sistem.
W
Q
U
Persamaan ini disebut Hukum Pertama Termodinamika (First law of thermodynamics)
Konsekuensi dari hukum ini adalah terdapatnya suatu kuantitas yang dikenal dengan energi dalam yang nilainya ditentukan oleh keadaan sistem. Jadi energi dalam adalah variabel keadaan seperti tekanan, volume, dan temperatur.
dW
dQ
Sistem tidak berinteraksi dengan lingkungan. Tidak ada perpindahan energi oleh panas (Q=0) dan tidak ada kerja yang dilakukan pada sistem (W=0). Karena
Q = W = 0, maka ΔU = 0, dan
Uakhir = Uawal
Energi dalam sistem terisolasi adalah konstan.
Sistem tidak terisolasi, proses berupa suatu siklus (proses yang dimulai dan berakhir di keadaan yang sama). Disini, perubahan energi dalam adalah nol,
karena U adalah variabel keadaan, dan jadinya energi panas Q yang ditambahkan pada sistem sama dengan kerja W pada sistem. ΔU = 0 dan Q = -W.
Kasus Khusus Hukum Pertama Termodinamika
Proses Siklus
Aplikasi Hukum Pertama Termodinamika
Tidak ada energi panas keluar atau masuk sistem (Q=0). Dinding atau batas-sistem terisolasi termal.
Jika suatu gas ditekan secara adiabatik sehingga W
positif, dan ΔU positif dan temperatur gas naik.
Sebaliknya, temperatur gas turun bila gas tersebut mengembang (berekspansi) secara adiabatik.
W
Q
U
W
U
Proses yang terjadi pada tekanan tetap disebut proses isobarik. Proses ini dapat dibuat dengan membiarkan piston bergerak bebas sehingga piston selalu dalam kesetimbangan antara gaya netto dari tekanan gas ke atas dan berat piston ditambah gaya karena tekanan atmosferik ke arah bawah.
Pada proses ini, nilai panas dan kerja biasanya tidak nol.
Proses Isobarik
Vf Vi
P
Proses yang berlangsung pada volume tetap disebut proses isovolum. Tahan piston pada posisi tetap akan menjamin terjadinya proses
isovolum. Kerja yang dilakukan adalah nol karena volume tidak berubah.
Proses
Isovolum
Bila energi ditambahkan pada sistem pada volume tetap, maka semua energi yang dipindahkan tetap di dalam sistem sehingga energi-dalam sistem naik.
Contoh: kaleng cat semprot didekatkan ke api, energi masuk ke dalam sistem (gas di dalam kaleng) oleh panas melewati dinding kaleng.
Sehingga, temperatur dan tekanan di dalam kaleng naik.
W
= 0
Proses yang berlangsung pada temperatur tetap
disebut proses isotermal. Proses ini dapat
dibuat dengan meletakkan silinder dalam
kontak termal dengan reservoir dengan
temperatur tetap. Energi-dalam gas ideal hanya
fungsi temperatur, sehingga
Proses Isotermal
Semua energi panas yang masuk sistem
dipindahkan ke luar sistem sebagai kerja,
sehingga tidak ada perubahan energi-dalam
sistem.
Δ
U
= 0
(a). Kerja pada volume konstan
0
W
PV
i
V
f
(b). Kerja pada tekanan konstan
PdV
P
dV
W
V P
i
V
V
fV
f>
V
i→ W
<
0
: kerja dilakukan oleh sistem
(gas).
V
f<
V
i→ W
>
0
: kerja dilakukan pada sistem
(gas).
V
V
P
V
P
Kurva PV adalah sebuah hiperbola. Kurva PV = konstan
disebut suatu “isotherm ”.
f
ln
i V f V iV
nRT
dV
W
PdV
dV
nRT
nRT
V
V
V
nRT
P
V
constant
PV
KERJA GAS IDEAL PADA KONDISI ADIABATIK
• Kondisi adiabatik: sistem terisolasi dari pengaruh lingkungan
(Q = 0).
• Persamaan gas ideal:
f f i
i
V
P
V
P
konst
PV
V
V
P
P
i i1 1 1
-(
)
[(
)
1]
1
1
f i V i i i i Vi i i i i
i f
f
PV
dV
W
PdV
dV
PV
V
V
PV
PV
V
V
V
V
f f iV
P
V
P
i1
(
)
1
f f i iW
P V
PV
Contoh Soal:
Panas dipindahkan secara langsung melalui sebuah material,
tanpa disertai perpindahan partikel.
• The efectiveness of a material in conducting heat is
characterized by a parameter called the thermal conductivity
• there are good thermal conductors (metals) and poor
Konvek
si
•
Panas dipindahkan dari satu tempat ke
tempat lain oleh partikel zat cair atau gas.
•
Tidak terjadi pada zat padat.
•
Ketika air direbus, air panas naik dan
bercampur dengan air yang dingin, dengan
demikian panas ditransfer ke air dingin.
•
Udara panas akan bergerak naik, proses inilah
yang terjadi pada atmosfer kita, sehingga
Konveksi di dalam rumah
Angin
Sea Breeze
•
Radiasi atau pancaran
adalah perpindahan
kalor dalam bentuk
gelombang
elektromagnetik.
•
Laju radiasi bergantung
pada luas penampang
dan pangkat empat
temperatur.
Radiasi
•
Benda gelap menyerap sebagian besar
radiasi padanya.
•
Jika sebuah benda memancarkan radiasi
lebih banyak dari yang diterimanya, akan