362
Validasi Metode Analisis α-Mangostin Dalam Plasma Darah
Manusia Secara
In Vitro
Dengan Metode Spektrofotometri
Ultraviolet
(Validation of Analitycal Method of α-Mangosteen in Plasma In Vitro by ultraviolet
spectrophotometry Method)
Roslinda Rasyid
1*; Widya Kardela
2;Wulan Widyawati
11
Fakultas Farmasi, Universitas Andalas Padang
2Sekolah Tinggi Ilmu Farmasi Padang
Corresponding email: roslindarasyid.lin@gmail.com
ABSTRAK
α-Mangostin merupakan salah satu senyawa yang memiliki aktifitas antibakteri, antijamur, antitumor, antiinflamasi dan antioksidan. Adanya ikatan antara obat dan protein dalam plasma akan berpengaruh terhadap efek terapeutik dari suatu obat. α-Mangostin yang terikat dengan protein dalam plasma harus dibebaskan. Validasi metode analisis α-mangostin dalam plasma darah manusia secara In
Vitro ini menggunakan metode spektrofotometri ultraviolet yang bertujuan untuk menganalisis dan
mengetahui kadar α-mangostin dalam plasma darah manusia. Metode pengendapan protein dengan pelarut metanol bertujuan untuk membebaskan obat yang terikat dengan protein. Pengukuran serapan dilakukan panjang gelombang 316,2 nm. Larutan standar α-mangostin pada rentang 2-10 µg/mL menghasilkan persamaan regresi y = 0,1584 + 0,0586x dengan r 0,9947. Hasil penelitian memberikan nilai akurasi dan presisi yang baik, nilai akurasi pada konsentrasi 2, 4, dan 6 µg/mL masing-masing yaitu 95,221%, 93,2593% dan 93,4584%, dan memberikan nilai presisi intra day yaitu 1,2146%, 1,8553% dan 0,8052%. Presisi inter day diperoleh 3,0838%, 4,2284% dan 1,9597%. Batas deteksi (BD) 0,0032µg/mL dan batas kuantitasi (BK) 0,0106 µg/mL. Hasil analisis kadar α-mangostin dalam plasma darah manusia secara In Vitro yaitu 3,747 % ± 93,9799%. Berdasarkan hasil penelitian, validasi metode analisis α-mangostin dalam plasma darah manusia secara In Vitro dengan metode spektrofotometri ultraviolet sudah memenuhi kriteria yang dipersyaratkan.
Kata Kunci: Spektrofotometri ultraviolet, validasi analisis, α-mangostin, In vitro
PENDAHULUAN
Obat tradisional merupakan salah satu alternatif untuk memenuhi kebutuhan obat baru. Pencarian obat baru dapat dimulai dari isolasi dan identifikasi senyawa utama dari bahan alam. Salah satu senyawa tersebut yang memberikan khasiat pada pengobatan yaitu α-mangostin. α-Mangostin merupakan salah satu senyawa turunan xanton (Yunitasari, 2011).
α-Mangostin memiliki efek kemopreventif yang efektif dalam karsinogenesis kolon sistem bioassay. Temuan mereka menunjukkan bahwa paparan lebih lama untuk α-mangostin dapat menekan perkembangan tumor. Dalam studi lain tentang efek α- mangostin pada sel leukemia manusia, hasil menunjukkan bahwa α- mangostin dapat membantu pencegahan dan pengobatan kanker
363
(Jhonson, et al., 2012). Banyak penelitian yang lain juga menunjukkan aktivitas α-mangostin sebagai antioksidan, antitumor, antiviral dan antiinflamasi (Chaverri, et al., 2008). Konsentrasi obat bebas yang berikatan dengan reseptorlah yang menentukan besarnya efek farmakologik yang diberikan oleh suatu obat, dimana reseptor sebagian besar terdapat dalam sel jaringan. Oleh karena sebagian besar sel-sel jaringan diperfusi oleh darah, maka pemeriksaan kadar obat dalam darah merupakan suatu metode yang paling akurat untuk pemantauan dan pengoptimalan manfaat terapi obat dalam pelayanan farmasi (Shargel, et al., 2005).
Adanya ikatan antara obat dan protein dalam plasma akan berpengaruh terhadap efek terapeutik dari suatu obat. α- Mangostin yang terikat 70 % pada protein harus dibebaskan, salah satu caranya dengan pengendapan protein. Pelarut organik yang digunakan bisa bercampur dengan air seperti metanol. Metanol akan menurunkan kelarutan protein sehingga protein mengendap dan obat akan terbebas dari sisi ikatan protein (Harahap, 2010). Uji sampel plasma secara in vitro dilakukan dengan tujuan sebagai langkah awal menuju analisis yang lebih bermanfaat yaitu analisis sampel plasma in vivo.
Dari penelitian sebelumnya diperoleh kadar α-mangostin dalam ekstrak kulit buah muda segar, kulit buah masak segar, kulit buah muda kering, kulit buah masak kering dan kulit batang Garcinia mangostana dengan metoda Kromatografi Cair Kinerja Tinggi (Etatutwuni, 2013), dan juga diperoleh kadar α-mangostin dalam ekstrak kulit buah muda, kulit buah matang dan kulit batang Garcinia mangostana
secara berturut - turut 4,19%, 15,85%, dan 3,88% dengan metoda TLC-Densitometri
(Agustina, 2014).
Berdasarkan hal tersebut maka penelitian ini memilih metode spektrofotometri ultraviolet sebagai metode yang digunakan untuk penetapan kadar α-mangostin dalam plasma secara in vitro, metode ini mampu menjelaskan informasi dari struktur berdasarkan panjang gelombang maksimum suatu senyawa. Hasil pemeriksaan spektrum UV senyawa α-mangostin dalam metanol memperlihatkan serapan maksimum pada panjang gelombang 243,5 nm dan 316,5 nm (Ghazali, et al., 2010).
METODE PENELITIAN
Alat dan Bahan
α-Mangostin murni, plasma darah manusia golongan AB diperoleh dari Palang Merah Indonesia (PMI) Padang, kloroform p.a (Merck), etil asetat p.a (Merck), metanol p.a (Merck), Spektrofotometer double beam (Shimadzu UV-1800), spektrofotometer infra red (Thermo Scientific), pipet volume (Iwaki), labu ukur, sentrifugator (DKC), vortex, tabung reaksi (Iwaki), rak, pipet ukur (Iwaki), erlenmeyer (Iwaki), pipet tetes, pipet mikro (Eppendorf), spatel, gelas ukur, buret, batang pengaduk, timbangan analitik.
Prosedur Penelitian
Pemeriksaan kemurnian dengan plat KLT silika gel 60
Siapkan larutan induk untuk pembanding yaitu α-mangostin 1000 µg/mL dalam metanol, sampel dengan konsentrasi 250 µg/mL dan untuk campuran pembanding dan sampel 1:1. Kemudian siapkan plat KLT 10 x 4 cm, buat masing-masing garis penotolan 1 cm dari tepi atas dan 1 cm dari dari tepi bawah. Larutan α-mangostin yang telah disiapkan ditotolkan sebanyak 2 μL pada plat KLT, lalu
364
dimasukkan ke dalam chamber yang telah dijenuhkan dengan fase gerak kloroforom : etil asetat (9:1) (Departemen Kesehatan Republik Indonesia, 2010). Tutup chamber dan biarkan sampai fase gerak mencapai garis atas pada plat. Chamber dibuka, plat KLT diambil dan dikering anginkan. Kemudian diamati di bawah lampu UV 254 nm. Tentukan nilai Rf.
Pembuatan Larutan Induk α-Mangostin 100 µg/mL
α-Mangostin ditimbang dengan seksama 10 mg, kemudian dilarutkan dalam 100 ml metanol dalam labu ukur, diperoleh larutan α-mangostin dengan konsentrasi 100 µg/mL.
Penentuan panjang gelombang maksimum α-mangostin
Dipipet 1 mL dari larutan induk(100 µg/mL) masukkan ke dalam labu ukur 10 mL, kemudian ditambahkan metanol sampai tanda batas. Ukur serapan menggunakan spektrofotometer ultraviolet pada panjang gelombang 200-400 nm dan ditentukan panjang gelombang serapan maksimumnya (Harahap, 2010).
Pembuatan kurva kalibrasi
Dipipet masing – masing 0,2 mL ; 0,4 mL ; 0,6 mL ; 0,8 mL ; 1 mL larutan induk dengan konsentrasi 100 µg/ml ke dalam labu ukur 10 ml, tambahkan metanol sampai tanda batas, sehingga diperoleh larutan α-mangostin dengan konsentrasi 2 µg/mL, 4 µg/mL, 6 µg/mL, 8 µg/mL, 10 µg/mL. Ukur serapan masing-masing konsentrasi tersebut dengan spektrofotometer ultraviolet pada panjang gelombang serapan maksimum α-mangostin. Buat kurva kalibrasi antara konsentrasi dengan
serapan, tentukan persamaan regresinya (Harahap, 2010).
Batas Deteksi dan Batas Kuantitasi
Setelah diperoleh kurva kalibrasi, konsentrasi terkecil yang masih dapat dideteksi (BD) dan terdeteksi secara kuantitasi (BK) dihitung secara statistik melalui garis linier dari kurva standar (Harahap, 2010).
Penetapan kadar dan uji akurasi dengan persen perolehan kembali α-mangostin dalam plasma in vitro
Larutan induk α-mangostin konsentrasi 100 µg/mL dipipet sebanyak 2 mL, masukkan ke dalam labu ukur 5 mL. Setelah itu, ditambahkan dengan plasma sampai tanda batas sehingga didapatkan konsentrasi 40 µg/mL. Konsentrasi tersebut dipipet masing-masing 0,5 mL, 1 mL, dan 1,5 mL ditambahkan metanol sampai tanda batas dalam labu ukur 10 mL sehingga didapatkan konsentrasi α-mangostin masing-masing 2 µg/mL, 4 µg/mL dan 6 µg/mL. Masing-masing larutan tersebut divortek selama satu menit lalu disentrifus pada kecepatan 4.000 rpm selama 35 menit. Bagian supernatannya diambil lalu serapannya diukur dengan spektrofotometer ultraviolet pada panjang gelombang maksimum α-mangostin, pengulangan dilakukan sebanyak tiga kali, kemudian nilai presisi dan akurasinya dihitung (Harmita, 2004). Presisi menggambarkan kedekatan hasil pengulangan penentuan senyawa yang dianalisa dengan suatu metode uji yang dilambangkan dengan KV (Koefisien Variasi), persyaratan nilai KV ≤ 2%.
Presisi
Larutan standar dengan berbagai konsentrasi (2 µg/mL, 4 µg/mL dan 6 µg/mL)
365
sebanyak tiga kali pengulangan diukur pada hari yang sama untuk variabel intra-day, kemudian tiga hari berturut-turut untuk variabel inter-day. Konsentrasi standar α-mangostin dari sampel dihitung dengan persamaan garis lurus yang didapat dari kurva kalibrasi. Presisi diukur sebagai Relatif Standar Deviasi (RSD) atau Koefisien Variasi (KV).
HASIL DAN DISKUSI
Hasil
Dari penelitian yang telah dilakukan diperoleh hasil sebagai berikut :
1. KLT dilakukan dengan fase diam plat silika gel 60 F254 dan fase gerak kloroform :
metanol (9:1). Dari KLT yang telah dilakukan diperoleh nilai Rf untuk standar α-mangostin adalah 0,533, nilai Rf untuk sampel adalah 0,533, dan nilai Rf untuk campuran standar dan sampel adalah 0,533.
2. Panjang gelombang maksimum α-mangostin dengan metanol 316,2 nm.
3. Hasil pengukuran serapan deretan konsentrasi larutan α-mangostin menghasilkan persamaan regresi linier y = 0,1584 + 0,0586x, nilai koefisien korelasinya (r) = 0,9947.
4. Uji batas deteksi dan batas kuantitasi
Dari hasil pengujian diperoleh batas deteksi α-mangostin yaitu 0,00312 µg/ml dan batas kuantitasi yaitu 0,01058 µg/mL.
5. Pengujian presisi
Penentuan presisi intra-day dan inter-day larutan standar α-mangostin dilakukan pada konsentrasi 2 µg/ml,4 µg/ml dan 6 µg/ml. Untuk presisi intra-day diperoleh nilai % RSD berturut-turut adalah 1,2146%,1,8553% dan 0,8052%. Sedangkan untuk presisi inter-day diperoleh nilai % RSD 3,0838%, 4,2284% dan 1,9597%.
6. Penetapan kadar dan uji akurasi dengan persen perolehan kembali
Hasil perhitungan kadar α-mangostindengan konsentrasi 2 µg/ml,4 µg/ml dan 6 µg/ml adalah 1,9044 µg/ml, 3,7303 µg/ml dan 5,6075 µg/ml dengan nilai akurasi berturut-turut 95,221%%, 93,2593% dan 93,4584% . 7. Kadar α-mangostin dalam plasma darah
manusia secara In Vitro yaitu 3,747 % ± 93,9799%.
Diskusi
KLT dilakukan dengan fase diam plat silika gel 60 F254 dan fase gerak kloroform :
metanol (9:1). Dari KLT yang telah dilakukan diperoleh nilai Rf untuk standar α-mangostin adalah 0,533, nilai Rf untuk sampel adalah 0,533, dan nilai Rf untuk campuran standar dan sampel adalah 0,533 (gambar 1).
Gambar 1. Kromatogram uji kualitatif
α-mangostin dilihat dibawah lampu UV 254 nm
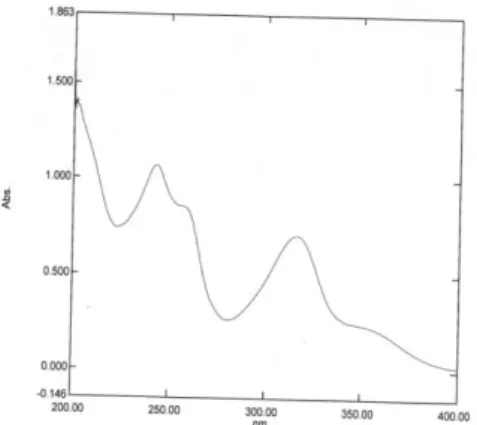
Setelah uji kemurnian α-mangostin tahap selanjutnya adalah penetapan kadar yang sebelumnya dilakukan penentuan panjang gelombang, dilakukan dengan penyiapan larutan induk α-mangostin dengan konsentrasi 100 µg/mL dan untuk penetapan panjang gelombang maksimumnya digunakan larutan dengan konsentrasi 10 µg/mL yang dibuat dari larutan induk, panjang gelombang maksimum yang
366
didapat adalah 316,2 nm. Panjang gelombang maksimum α-mangostin tersebut digunakan untuk pembuatan kurva kalibrasi dan untuk menghitung persen perolehan kembali.
Gambar 2. Spektrum absorban dengan panjang
gelombang α-mangostin murni
Pembuatan kurva kalibrasi α-mangostin dibuat dari beberapa konsentrasi yaitu pada konsentrasi 2, 4, 6, 8 dan 10 µg/mL. Pada masing-masing konsentrasi ini diukur serapannya pada panjang gelombang 316,2 nm. Hasil kurva serapan dari deretan konsentrasi tersebut menghasilkan persamaan regresi linier y = 0,1584 + 0,0586x dengan nilai koefisien (r) yaitu 0,9947. Koefisien korelasi ini menunjukkan hasil yang linier, karena memenuhi kriteria penerimaan yaitu 0,99 ≤ r < 1, sehingga penggunaan metode tersebut dapat digunakan untuk analisis α-mangostin dalam plasma secara in vitro dengan hasil yang baik (Priyambodo, 2007).
Gambar 3. Kurva Kalibrasi α-Mangostin
Standar deviasi dari kurva kalibrasi dari kurva kalibrasi tersebut yaitu 0,02203 µg/mL, batas deteksi yaitu 0,00312 µg/ml dan batas kuantitasinya 0,01058 µg/ml. Batas deteksi merupakan kadar senyawa terkecil yang dapat dianalisis yang dapat memberikan respon signifikan. Sedangkan batas kuantitasi adalah jumlah senyawa terkecil yang dapat dianalisis. Penentuan nilai batas deteksi dan kuantitasi sangat tergantung pada nilai b (kemiringan garis, dimana hubungan linier yang ideal dicapai jika nilai b = 0 dan r = -1 atau r = -1 tergantung pada arah garis). Metode analisis dikatakan kurang sensitif apabila b bernilai negatif sehingga memberikan nilai BD (batas deteksi) dan BK (batas kuantitasi) yang lebih besar. Dari data yang didapat terlihat bahwa metode ini dapat dikatakan sensitif karena memberikan nilai b > 0, dimana memberikan nilai b = 0,0586. Kadar α-mangostin dalam plasma darah manusia secara In Vitro yaitu 3,747 % ± 93,9799%, kemudian nilai presisi dan akurasinya dihitung (Harmita, 2004). Untuk penentuan penetapan kadar dan akurasi larutan sampel α-mangostin dengan konsentrasi 2 µg/mL,4 µg/mL dan 6 µg/mL, diperoleh nilai % akurasi berturut-turut 95,221%, 93,2593% dan 93,4584%. Berdasarkan kriteria di atas dan data yang diperoleh, maka dapat dikatakan bahwa metode analisis yang digunakan memenuhi kriteria akurasi dan presisi. Menurut (Harmita, 2004), akurasi adalah ukuran yang menunjukkan ketepatan hasil yang diperoleh dari suatu metode analisis dengan kadar sebenarnya. Sebagai parameter untuk akurasi menggunakan persen perolehan kembali. Pada literatur disebutkan harga persen perolehan kembali berkisar antara 80-110% (Harmita, 2004). Dari penelitian, larutan α-mangostin dengan konsentrasi 2 µg/mL,4 µg/mL dan 6
367
µg/mL diperoleh presisi intra-day dengan nilai % RSD berturut-turut adalah 1,2146%,1,8553% dan 0,8052%, sedangkan untuk presisi inter-day
diperoleh nilai % RSD 3,0838%, 4,2284% dan 1,9597%.
KESIMPULAN
1. Penetapan kadar α-mangostin yang ditambahkan dalam plasma manusia
secara in vitro dengan metode spektrofotometer ultraviolet sudah memenuhi kriteria akurasi, presisi dan linieritas.
2. Kadar α-mangostin dalam plasma darah manusia secara In Vitro yaitu 3,747 % ± 93,9799%,
DAFTAR PUSTAKA Adnan, A. Z. (1991). Penelitian Farmasi dalam
Tantangan Masa. Padang: Pusat Penelitian Universitas Andalas.
Agustina, R.(2014). Analisis α-Mangostin dari Ekstrak Kulit Buah Muda, Kulit Buah Matang dan Kulit Batang Manggis (Garcinia mangostana, L) dengan TLC Scannner. Skripsi Fakultas Farmasi Universitas Andalas, Padang
Chaverri, J. P., Rodriguez, N. C., Ibarra, M. O., & Rojas, J. M. P. (2008). Medicinal properties of mangosteen (Garcinia mangostana). Food and Chemical Toxicology, 46, 3227-3239.
Chaverri J. P., Reyes-Fermin L. M., Nolasco A. E. G., Orozco I. M., & Medina-Campos O. N. (2009), ROS scavenging capacity and neuroprotective Effect of α-mangostin against 3-nitropropionic acid in cerebellar granula neurons. Exp Toxicol Pathol, 61: 491-501.
Dachriyanus, (2004). Analisa Struktur Senyawa Organik secara Spektroskopi. Padang: PenerbitAndalas University Press.
Dachriyanus., Katrin, D. O., Oktarina, R., Ernas, O., Suhatri, dan Mukhtar, M. H. (2007). Uji efek α-mangostin terhadap kadar kolesterol total, trigliserida, kolesterol HDL, dan kolesterol LDL darah mencit putih jantan serta penentuan lethal dosis 50 (LD50). J. Sains Tek. Far., 12, (2), 64-73.
Departemen Kesehatan Republik Indonesia. (1979).
Farmakope Indonesia Edisi III, KOPRISub Unit Direktorat Jendral, Jakarta.
Departeman Kesehatan Republik Indonesia. (1995).
Farmakope Indonesia Edisi IV, Jakarta
Day, A . R & Underwood, A . L. (2002). Analisis Kimia Kuantitatif. (Edisi 6). Jakarta : Erlangga.
Etatutwuni. (2013). Analisis α-Mangostin dari Ekstrak Kulit Buah dan Kulit Batang Garcinia mangostana, L
dengan Kromatografi Cair Kinerja Tinggi.Skripsi Fakultas Farmasi Universitas Andalas, Padang. Ghazali, S.A.I.S.M., Lian, G.E.C., & Ghani, K.D.A.
(2010). Chemical Constituent from Roots of
Garcinia mangostana Linn. J. Chemistry, 2, 134-142.
Gibson, J. (1995). Anatomi dan Fisiologi Modern untuk Perawat. (Edisi V). Jakarta : EGC
Harahap, Y. 2010. Sample Preparation, Bioavailbility and Bioequivalency. Jakarta : Departement Farmasi UI. Harahap, Y., Mansur, U., & Estherina, C. (2008). Validasi
Metode Analisis Cilostazol dalam Plasma In Vitro secara Kromatografi Cair Kinerja Tinggi. Majalah Ilmu Kefarmasian, 5, (1), 9-20.
Harmita. 2004. Petunjuk Pelaksanaan Validasi Metode dan Cara Perhitungannya. Majalah Ilmu Kefarmasian. I, (3), 117-135.
Iswari, K.,& Sudaryono, T. (2007). 4 Jenis Olahan Manggis, Si Ratu Buah Dunia dari Sumbar. BPPT-Sumbar. Sumbar Barat.
Johnson, E. L., & Stevenson, R. (1991). Dasar Kromatografi Cair. Penerjemah: Kosasih Padmawinata. Bandung: Penerbit ITB.
Kenji, M., Yukihiro, A., Emi, K., Tetsuro, I., Kenji, O., Toshiyuki, T., Munekazu,I., & Yoshinori, N. (2003). Cytotoxic benzophenone derivatives from Garcinia species display a strong apoptosis-inducing effect against human leukemia celllines. Biol Pharm Bull.
26: 569-571.
Rohman, A. 2009. Kromatografi untuk Analisis Obat.
(Edisi I). Yogyakarta : Graha Ilmu.
Rohman, A. & Gandjar, I.G. 2007. Kimia Farmasi Analisis. Yogyakarta : Cetakan Pertama, Pustaka Pelajar.
Satiadarma. 2004. Azas Pengembangan Prosedur Analisis. (Edisi I). Surabaya: Universitas Airlangga.
368
Shargel, L., Wu-Pong, S., & Yu, Andrew B.C. (2005).
Biofarmasetika & Farmakokinetika Terapan, Edisi kelima. Surabaya: Universitas Airlangga.
Suksamram, S., Suwannapoch, P., Ratananukul, P., Aroonlerk, N., & Suksamram, A. (2002). Xanthones from the green fruit hulls of garcinia mangostana.
Journal of Natural Product, 65, 761-763.
Syamsudin, Tjokrosonto S., Supargiyono, Wahyuono S., and Mustofa. 2009. In vitro and in vivo
antiplasmodial activities of active constituents isolated from the stem bark of G. parvifolia
(Miq)Miq. South East Asian Journal of Trop. Med. and Pub. Health.
Watson, D.G. (1999). Pharmaceutical Analysis : A textbook for pharmacy student and pharmaceutical chemists. New York : Harcourt Publishers.
Widmann, F. K. (1995). Tinjauan Klinis Atas Hasil Pemeriksaan Laboratorium .(Edisi 9). Penerjemah: Gandasoebroto. Jakarta: EGC.
Yunitasari, L. (2011). Gempur 41 Penyakit Dengan Buah Manggis Khasiat dan Cara Pengolahan Untuk Kesehatan. Yogyakarta: Pustaka baru press.