Penyusunan dan Penelaahan Rencana Pelaksanaan Pembelajaran
Tujuan Kegiatan: Melalui diskusi kelompok peserta mampu menyusun RPP yang menerapkan pendekatan saintifik sesuai model belajar yang relevan dan menelaah RPP untuk perbaikan.
Langkah Kegiatan:
1. Pelajari prinsip-prinsip penyusunan RPP!
2. Siapkan dokumen kurikulum Permedikbud nomor 103 dan nomor 104 tahun 2014, hasil kegiatan Penjabaran KD kedalam Indikator Pencapaian Kompetensi dan Materi Pembelajaran ( LK- 1.4), Analisis Pendekatan Saintifik dalam Model pembelajaran ( LK- 3.2c) dan Perancangan Instrumen Penilaian ( LK- 3.3)!
3. Susunlah RPP sesuai dengan prinsip-prinsip pengembangannya, komponen-sistematika RPP*) dan format RPP**) yang tersedia!
4. Setelah selesai, telaah kembali RPP yang disusun menggunakan format telaah RPP untuk kesempurnaan RPP yang kelompok Anda susun!
5. Presentasikan hasil kerja kelompok Anda!
6. Perbaiki hasilkerjakelompokAndajikaadamasukkan darikelompok lain! Catatan:
*) komponen-sistematika RPP yang ada di dalam modul sesuai dengan Permedikbud nomor 103 tahun 2015.
**) format RPP dikembangkan sesuai sistematika RPP pada Permendikbud, lay out tidak harus sama tetapi diharapkan disusun dengan rapih, sistematis dengan kalimat yang singkat, jelas dan mudah difahami.
Alternatif Format RPP
RENCANA PELAKSANAAN PEMBELAJARAN
Sekolah: SMA
Mata pelajaran: KIMIA
Kelas/Semester: XII/1
Alokasi Waktu: M
A. Kompetensi Inti (KI)
KI 1 : Menghayati dan mengamalkan ajaran agama yang dianutnya.
KI 2 : Menghayati dan mengamalkan perilaku jujur, disiplin, tanggungjawab, peduli (gotong royong, kerjasama, toleran, damai), santun,responsif dan pro-aktif dan menunjukkan sikap sebagai bagian dari solusi atas berbagai permasalahan dalam
berinteraksi secara efektif dengan lingkungan sosial dan alam serta dalam menempatkan diri sebagai cerminan bangsa dalam pergaulan dunia.
KI 3 : Memahami, menerapkan, menganalisis dan mengevaluasi pengetahuan faktual, konseptual, prosedural, dan metakognitif berdasarkan rasa ingin tahunya tentang ilmu pengetahuan, teknologi, seni, budaya, dan humaniora dengan wawasan kemanusiaan, kebangsaan,kenegaraan, dan peradaban terkait penyebab fenomena dan kejadian, serta menerapkan pengetahuan prosedural pada bidang kajian yang spesifik sesuai dengan bakat dan minatnya untuk memecahkan masalah.
KI 4 : Mengolah, menalar, menyaji, dan mencipta dalam ranah konkret dan ranah abstrak terkait dengan pengembangan dari yang dipelajarinya di sekolah secara mandiri serta bertindak secara efektif dan kreatif, dan mampu menggunakan metoda sesuai kaidah keilmuan.
B. Kompetensi Dasar 1. KD pada KI-1
1.1 Menyadari adanya keteraturandalam sifat koligatif larutan, reaksi redoks, keragaman sifat unsur, senyawamakromolekul sebagai wujud kebesaran Tuhan YME dan pengetahuan tentang adanya keteraturan tersebut sebagai hasil pemikiran kreatif manusia yang kebenarannya bersifat tentatif.
2. KD pada KI-2
2.1 Menunjukkan perilaku ilmiah (memiliki rasa ingin tahu, disiplin, jujur, objektif, terbuka, mampu membedakan fakta dan opini, ulet, teliti, bertanggung jawab, kritis, kreatif, inovatif, demokratis, komunikatif) dalam merancang dan melakukan percobaan serta berdiskusi yang diwujudkan dalam sikap sehari-hari.
2.2 Menunjukkanperilaku kerjasama, santun, toleran, cinta damai dan peduli lingkungan serta hemat dalam memanfaatkan sumber daya alam.
2.3 Menunjukkan perilaku responsif dan pro-aktif serta bijaksana sebagai wujud kemampuan memecahkan masalah dan membuat keputusan.
3. KD pada KI-3
3.2 Membedakan sifat koligatif larutan elektrolit dan larutan nonelektrolit.
4. KD pada KI-4
4.2 Mengolah dan menganalisis data percobaan untuk membandingkan sifat koligatif larutan elektrolit dengan sifat koligatif larutan nonelektrolit yang konsentrasinya sama.
C. Indikator Pencapaian Kompetensi*) 1. Indikator KD pada KI-1
1.1.1 Mengagumi dan mensyukuri adanya keteraturan sifat koligatif larutan pada makhluk hidup dan fenomena dalam kehidupan sehari-hari
2. Indikator KD pada KI-2
2.1.1 Teliti dan obyektif dalam melakukan percobaan
2.1.2 Memiliki rasa ingin tahu, kritis, dan terbuka dalam diskusi 2.1.3 Tekun,ulet, jujur dan bertanggungjawab dalam mengerjakan tugas 2.2.1 Bekerjasama dan hati-hati dalam melakukan eksperimen
2.3.1 Dicapai melalui pembinaan untuk bersikap responsif, proaktif dan bijaksana dalam memecahkan masalah
3 Indikator KD pada KI-3
3.2.1
Menjelaskan perbedaan kenaikan titik didih larutan elektrolit dan nonelektrolit pada konsentrasi yang sama3.2.3
Menghitung penurunan titik beku dan kenaikan titik didih larutan elektrolit dan non elektrolit yang konsentrasinya sama3.2.4
Menghitung tekanan osmosis larutan elektrolit dan non elektrolit yang memiliki konsentrasi sama.3.2.5
Menganalisis diagram PT untuk menafsirkan penurunan tekanan uap, penurunan titik beku dan kenaikan titik didih larutan elektolit dan nonelektrolit yang konsentrasinya sama.4 Indikator KD pada KI-4
4.2.1 Mengelompokkan larutan sampel berdasarkan sifat larutan elektrolit dan larutan nonelektrolit
4.2.2 Melakukan percobaan penurunan titik beku akibat penambahan zat terlarut elektrolit dan nonelektrolit pada konsentrasi yang sama
4.2.3 Melakukan percobaan dan menyelidiki kenaikan titik didih larutan pada konsentrasi yang sama serta menganalisis hasilnya
4.2.4 Menyimpulkan perbedaan sifat koligatif larutan elektrolit dan nonelektrolit pada konsentrasi sama
4.2.5 Mengembangkan dan menyajikan laporan hasil eksperimen penurunan titik beku dan kenaikan titik didih larutan
D. Materi Pembelajaran
Sifat koligatif larutan adalah sifat yang bergantung hanya pada jumlah partikel (atom, molekul, ion) zat terlarut dalam larutan dan tidak bergantung pada jenis zat pelarut.
Sifat koligatif larutan nonelektrolit 1. Kenaikan Titik Didih (ΛTb)
Pendidihan terjadi karena panas meningkatkan gerakan atau energi kinetik, dari molekul yang menyebabkan cairan beradapada titik di mana cairan itu menguap, tidak peduli berada di permukaan teratas atau di bagian terdalam cairan tersebut
disebabkan karena zat terlarut itu mengurangi bagian atau fraksi dari pelarutsehingga kecepatan penguapan berkurang
Selisih titik didih larutan dengan titik didih pelarut disebut kenaikan titik didih ( ΔTb ).
ΔTb = titik didih larutan – titik didih pelarut)
Menurut hukum Raoult, besarnya kenaikan titik didih larutan sebanding dengan hasil kali dari molalitas larutan (m) dengan kenaikan titik didih molal (Kb). Oleh karena itu, kenaikan titik didih dapat dirumuskan seperti berikut.
ΔTb = Kb ⋅ m
Keterangan:
b ΔT = kenaikan titik didih molal Kb = tetapan kenaikan titik didih molal m = molalitas larutan
Contoh
Natrium hidroksida 1,6 gram dilarutkan dalam 500 gram air. Hitung titik didih larutan tersebut! (Kb air = 0,52 °Cm-1, Ar Na =23, Ar O = 16, Ar H = 1)
Penyelesaian:
Diketahui : m = 1,6 gram p = 500 gram Kb = 0,52 °Cm-1 Ditanya : Tb …?
Jawab : ΔTb = m⋅ Kb
= m x 1.000 Kb NaOH Mr p
×
= 0,04 × 2 × 0,52 °C = 0,0416 °C
Td = 100 °C + b ΔT = 100 °C + 0,0416 °C = 100,0416 °C
Jadi, titik didih larutan NaOH adalah 100,0416 °C.
2. Penurunan Titik Beku(ΛTf)
Penurunan titik beku pada konsepnya sama dengan kenaikan titik didih. Larutan mempunyai titik beku yang lebih rendah
dibandingkan dengan pelarut murni.
Selisih antara titik beku pelarut dengan titik beku larutan dinamakan penurunan titik beku larutan ( ΔTf = freezing point).
ΔTf = Titik beku pelarut – titik beku larutan
Menurut hukum Raoult penurunan titik beku larutan dirumuskan seperti berikut.
Keterangan:
f ΔT = penurunan titik beku, m = molalitas larutan, Kf = tetapan penurunan titik beku molal
Soal -soaL Latihan Penurunan Titik Beku (°C)
1. Untuk menaikkan titik didih 250 mL air menjadi 100,1 °C ditambahkan gula. Jika tekanan udara luar 1 atm (Kb = 0,5°Cm-1), hitung jumlah zat gula yang harus ditambahkan.
2. Larutan urea 0,1 molal dalam air mendidih pada suhu 100,05 °C. Pada volume yang sama, larutan glukosa 0,1 molal dan sukrosa 0,3 molal dicampurkan. Hitung titik didih campuran tersebut!
3. Campuran sebanyak 12,42 gram terdiri dari glukosa dan sukrosa dilarutkan dalam 100 gr air. Campuran tersebut mendidih pada suhu 100,312 °C (Kb air = 0,52 °Cm-1). Tentukan massa masing-masing zat dalam campuran jika tekanan udara pada saat itu 1 atm!
4. Hitung titik beku suatu larutan yang mengandung 1,19 gram CHI3 (Mr CHI3 = 119) yang dilarutkan dalam 50 gram benzena dengan Kf benzena = 4,9!
5. Dalam 900 gram air terlarut 30 gram suatu zat X (Mr = 40). Larutan ini membeku pada suhu -5,56 °C. Berapa gram zat X harus dilarutkan ke dalam 1,2 kilogram air agar diperoleh
larutan dengan penurunan titik beku yang sama?
Adanya zat terlarut pada suatu larutan tidak hanya memengaruhi tekanan uap saja, tetapi juga memengaruhi titik didih dan titik beku. Pada larutan dengan pelarut air, kita dapat memahami hal tersebut dengan mempelajari diagram fase air pada Gambar berikut.
Gambar 2. Diagram fase air
c. Tekanan Osmosis
Adakalanya seorang pasien di rumah sakit harus diberi cairan infus. Sebenarnya apakah cairan infus tersebut? Larutan yang dimasukkan ke dalam tubuh pasien melalui pembuluh darah haruslah memiliki tekanan yang sama dengan tekanan sel-sel darah. Apabila tekanan cairan infus lebih tinggi maka cairan infus akan keluar dari sel darah. Prinsip kerja infus ini pada dasarnya adalah tekanan osmotik. Tekanan di sini adalah tekanan yang harus diberikan pada suatu larutan untuk mencegah masuknya molekul-molekul solut melalui membran yang semipermiabel dari pelarut murni ke larutan. Sebenarnya apakah osmosis itu? Cairan murni atau larutan encer akan bergerak menembus membran atau rintangan untuk mencapai larutan yang lebih pekat. Inilah yang dinamakan osmosis. Membran atau rintangan ini disebut membran semipermiabel. Tekanan osmotik termasuk dalam sifat-sifat koligatif karena besarnya hanya tergantung pada jumlah partikel zat terlarut. J.H. Vant Hoff menemukan hubungan antara tekanan osmotik larutan-larutan encer dengan persamaan gas ideal, yang dituliskan seperti berikut:
π V = nRT
Keterangan: π = tekanan osmotik, V = volume larutan (L), n = jumlah mol zat terlarut, R = tetapan gas (0,082 L atm mol-1K-1)T = suhu mutlak (K)
Persamaan dapat juga dituliskan seperti berikut. π = n RT
V
Ingat bahwa n/V merupakan kemolaran larutan (M), sehingga persamaan dapat diubah menjadi π = MRT
Contoh Seorang pasien memerlukan larutan infus glukosa. Bilakemolaran cairan tersebut 0,3 molar pada suhu tubuh 37 °C,
tentukan tekanan osmotiknya! (R = 0,082 L atm mol-1K-1) Penyelesaian:
Diketahui : M = 0,3 mol L–1 T = 37 °C + 273 = 310 K R = 0,082 L atm mol-1K-1 Ditanya : π …?
Jawab : π = 0,3 mol L-1 × 0,082 L atm mol-1K-1 × 310 K = 7,626 L
d. Penurunan Tekanan Uap Larutan
Penurunan tekanan uap jenuh yaitu tekanan uap jenuh pelarut murni dikurangi tekanan uap jenuh larutan. Jika zat sukar menguap, maka tekanan uap jenuh larutan > tekanan uap jenuh pelarut murni (air).
∆P = P° - P Keterangan:
∆P = penurunan tekanan uap jenuh Po = tekanan uap jenuh pelarut murni P = tekanan uap jenuh larutan
Fraksi mol dirumuskan sebagai berikut: Fraksi mol zat pelarut:
Fraksi mol zat terlarut: Keterangan:
nA = mol zat pelarut nB = mol zat terlarut XA + XB = 1
Zat terlarut semakin banyak = penurunan uap makin besar. Francois M. Raoult merumuskan besarnya penurunan tekanan uap (∆P) sebagai berikut:
Keterangan:
∆P = penurunan tekanan uap jenuh P0 = tekanan uap jenuh pelarut murni P = tekanan uap jenuh larutan XA = fraksi mol zat pelarut XB = fraksi mol zat terlarut
SIFAT KOLIGATIF LARUTAN ELEKTROLIT
Tahukah kamu bahwa larutan terdiri dari larutan elektrolit dan larutan nonelektrolit. Larutan elektrolit adalah larutan yang
dapat menghantarkan arus listrik. Sifat koligatif larutan nonelektrolit telah kita pelajari di depan, bagaimana dengan sifat
koligatif dari larutan elektrolit?Larutan elektrolit memiliki sifat koligatif yang lebih besar daripada nonelektrolit.
sehingga untuk larutan elektrolit berlaku rumus:
1. ΔP = XA ×P ×i
2. ΔTb = K ×m× i
3. f ΔTf = K ×m× i
4. π = M× R×T × i
ket i = faktor van,t hoff = 1 + (n – 1)α n= jumlah ion, α = derajat ionisasi
Contoh soal;
Pada suhu 37 °C ke dalam air dilarutkan 1,71 gram Ba(OH)2 Sehingga volume 100 mL (Mr Ba(OH)2 = 171). Hitung besar
tekanan osmotiknya! (R = 0,082 L atm mol-1K-1) Penyelesaian:
Diketahui : m = 1,71 gram V = 100 mL = 0,1 L Mr Ba(OH)2 = 171
R = 0,082 L atm mol-1K-1 T = 37 °C = 310 K
Ditanya : π …?
Jawab : Ba(OH)2 merupakan elektrolit. Ba(OH)2 → Ba2+ + 2 OH¯, n = 3 mol Ba(OH)2 = gram/Mr
=1,71 gram 171
= 0,01 mol
M =n/V =0,01 mol/0,1 L = 0,1 mol ⋅ L-1 π = M × R × T × i
= 0,1 mol L-1 × 0,082 L atm mol-1K-1 × 310 K × (1 + (3 – 1)1) = 7,626 atm
E. E. Pendekatan dan Metode Pembelajaran
Pendekatan : scientific
Metode : diskusi, eksperimen, latihan dan penugasan
A. Kegiatan Pembelajaran
1. Pertemuan Pertama: (2 JP) Langkah tentang materi yang akan diajarkan.
Contoh : Guru memberikan contoh fenomena yang ada di sekitar kita kepada siswa. Contohnya adalah pembuatan es putar atau es goyang. Meminta siswa yang mempunyai pengalaman seputar es tersebut untuk menceritakannya.
Intinya adalah tentang penambahan garam pada es sebagai pendingin es putar. Mengapa zat yang ditambahkan di es adalah garam,megapa tidak zat lain, seperti gula, pasir, dsb.
Guru memberikan gambaran manfaat mempelajari materi yang akan diajarkan kepada para siswa.
Contoh : setelah selesai mempelajari materi ini kalian akan tahu rahasia dari penjual es putar mengapa menambahkan garam dalam es dan kalian akan dapat membedakan sifat koligatif larutan elektrolit dan nonelektrolit.
Guru menyampaikan tujuan pembelajaran.
10 menit
Kegiatan Inti **)
Mengamati (Observing)
Menampilkan data hasil percobaan titik didih dan titik beku larutan elektrolit dan nonelektrolit.
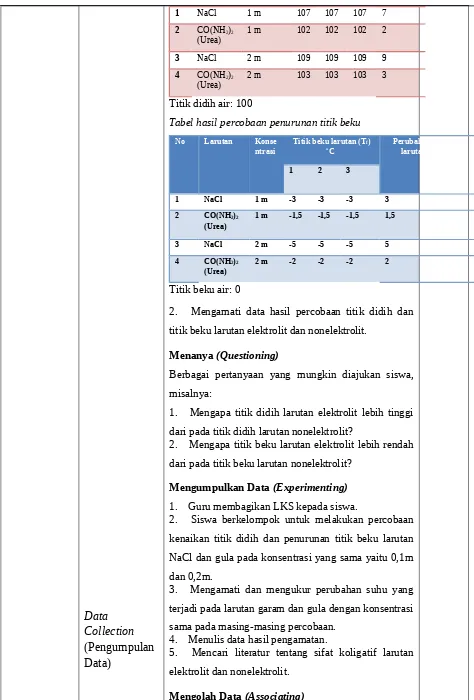
Tabel hasil percobaan kenaikan titik didih
No Larutan Konsentra
si Titik didih larutan(Tb) C Perubahantitik didih larutan (ΔTb) C
1 2 3
Data
Titik didih air: 100
Tabel hasil percobaan penurunan titik beku
No Larutan Konse
ntrasi
Titik beku larutan (Tf)
C
Titik beku air: 0
2. Mengamati data hasil percobaan titik didih dan titik beku larutan elektrolit dan nonelektrolit.
Menanya (Questioning)
Berbagai pertanyaan yang mungkin diajukan siswa, misalnya:
1. Mengapa titik didih larutan elektrolit lebih tinggi dari pada titik didih larutan nonelektrolit?
2. Mengapa titik beku larutan elektrolit lebih rendah dari pada titik beku larutan nonelektrolit?
Mengumpulkan Data (Experimenting) 1. Guru membagikan LKS kepada siswa.
2. Siswa berkelompok untuk melakukan percobaan kenaikan titik didih dan penurunan titik beku larutan NaCl dan gula pada konsentrasi yang sama yaitu 0,1m dan 0,2m.
3. Mengamati dan mengukur perubahan suhu yang terjadi pada larutan garam dan gula dengan konsentrasi sama pada masing-masing percobaan.
4. Menulis data hasil pengamatan.
5. Mencari literatur tentang sifat koligatif larutan elektrolit dan nonelektrolit.
Data
2. Mengelompokkan larutan sampel berdasarkan sifat larutan elektrolit dan larutan nonelektrolit.
3. Membandingkan perbedaan kenaikan titik didih larutan NaCl 0,1m dengan gula 0,1m.
4. Membandingkan perbedaan kenaikan titik didih larutan NaCl 0,2m dengan gula 0,2m.
5. Menyimpulkan perbedaan titik didih larutan elektrolit dan nonelektrolit dari data hasil percobaan. 6. Membandingkan perbedaan penurunan titik beku larutan NaCl 0,1m dengan gula 0,1m.
7. Membandingkan perbedaan penurunan titik beku larutan NaCl 0,2m dengan gula 0,2m.
8. Menghubungkannya konsentrasi (fraksi mol, molalitas, dan molaritas) dengan sifat koligatif larutan) elektrolit dan nonelektrolit Mengkomunikasikan (Communiting)
1. Membuat laporan hasil percobaan dan mempresentasikannya ke depan kelas.
2. Membuat rangkuman tentang poin-poin pembelajaran yang sudah diperoleh.
Kegiatan Penutup
Guru menuntun siswa untuk dapat menyimpulkan hasil yang diperoleh dari hasil pembelajaran hari ini.
Contoh:
Apa yang dapat kita simpulkan dari pembelajaran yang telah dilakukan pada hari ini? (guru meminta beberapa siswa yang bersedia menyebutkan kesimpulan):
Titik didih larutan elektrolit ternyata lebih tinggi daripada titik didih larutan nonelektrolit, hali ini dilihat dari data percobaan bahwa larutan NaCl lebih tinggi titik didihnya daripada larutan gula dengan konsentrasi yang sama.
Titik beku larutan elektrolit ternyata lebih rendah daripada titik didih larutan nonelektrolit, hali ini dilihat dari data percobaan bahwa larutan NaCl lebih rendah titik bekunya daripada larutan gula dengan konsentrasi yang sama.
Memberikan tugas tindak lanjut dengan kegiatan membaca materi selanjutnya.
Menginformasikan rencana kegiatan pembelajaran selanjutnya.
Guru menutup dengan salam 2. Pertemuan Pertama: (2 JP)
Langkah kabar siswa, mengecek kehadiran siswa. Menanyakan, siapa yang masih ingat
tentang hasil pengamatan kemarin?
Siswa, pada konsentrasi yang sama titik didih larutan elektrolit lebih tinggi daripada larutan nonelektrolit dan titik beku larutan elektrolit lebih rendah daripada larutan nonelektrolit.
Ada yang tahu mengapa bisa demikian?
Guru menyampaikan tujuan
pembelajaran.
10 menit
Kegiatan Inti **)
Mengamati (Observing)
1. Menampilkan gambar submikroskopis larutan elektrolit dan nonelektrolit. 2. Mengamati gambar tersebut. Menanya (Questioning)
Berbagai pertanyaan yang mungkin diajukan siswa, misalnya:
1. Mengapa partikel larutan elektrolit lebih banyak daripada larutan nonelektrolit? 2. Adakah pengaruh jumlah partikel
terhadap sifat koligatif larutan? Mengumpulkan data (Experimenting) 1. Mencari literatur tentang sifat koligatif
larutan elektrolit dan nonelektrolit. 2. Siswa berkelompok.
3. Guru membagikan LKS kepada siswa. 4. Menghitung banyaknya partikel pada
gambar submikroskopis larutan elektrolit dan nonelektrolit.
Data Processing
(Pengolahan Data)
5. Mengamati contoh macam-macam larutan elektrolit dan nonelektrolit. 6. Menuliskan reaksi ionisasi berbagai
larutan elektrolit.
NaCl → Na+ + Cl
-KCl → K+ + Cl
-MgCl2 → Mg2+ + 2Cl
-BaCl2 → Ba2+ + 2Cl
-CH3COOH → CH3COO- + H+ Mengolah Data (Associating)
1. Menghitung banyaknya partikel pada masing-masing sampel.
2. Menuliskan persamaan reaksi kesetimbangan asam lemah AxBy.
Misalkan, mula-mula konsentrasi AxBy
adalah m (molal) dan terurai sebesar α (derjat ionisasi), sehingga konsentrasi saat terurai adalah mα:
AxBy → x...y+ + ...B x-mula-mula: m 0 0 terurai : mα x ... ymα setimbang : ... ... ... sehingga mtotal = m – mα + ... + y mα
mtotal = m(1-α) + m(x ..+ y ..) mtotal = m[1 + α (... + y – 1)]
3. Menentukan jumlah zat dalam keadaan mula-mula, terurai, dan setimbang. 4. Menentukan persamaan molalitas total
partikel Menuliskan persamaan rumus vant Hoff
i = 1 + (n-1)α
5. Menghitung jumlah partikel (n) larutan elektrolit
6. menentukan harga i larutan elektrolit 7. menghubungkan nilai n terhadap harga imenghubungkan nilai α terhadap harga i
8. Menghubungkan harga i larutan elektrolit kuat dengan penurunan tekanan uap (∆P)
Verification
(Pembuktian)
Generalization
(Menarik Simpulan)
elektrolit kuat dengan kenaikan titik didih (∆Tb)
10. Menghubungkan harga i larutan elektrolit kuat dengan penurunan titik beku (∆Tf)
11. Menghubungkan harga i larutan elektrolit kuat dengan tekanan osmosis (π)
12. Menuliskan rumus-rumus sifat koligatif larutan elektrolit dan nonelektrolit yang nantinya siswa akan menuliskan seperti berikut ini:
13. Menghitung sifat koligatif (penurunan tekanan uap, kenaikan titik didih, penurunan titik beku dan tekanan osmosis) larutan elektrolit dan nonelektrolit pada konsentrasi sama. 14. Membandingkan hasilnya. Mengomunikasikan (Networking)
1. Mengkomunikasikan hasil yang diperoleh dan mempresentasikannya ke depan kelas.
2. Membuat rangkuman tentang poin-poin pembelajaran yang sudah diperoleh.
Kegiatan Penutup
Menyimpulkan perbedaan sifat koligatif larutan elektrolit dan nonelektrolit.
Contoh:
Apa yang dapat kita simpulkan dari pembelajaran yang telah dilakukan pada hari ini? (guru meminta beberapa siswa yang bersedia menyebutkan kesimpulan): o Sifat koligatif larutan elektrolit lebih besar
daripada larutan nonlektrolit, hal ini akibat dipengaruhi oleh jumlah partikel larutan elektrolit yang lebih banyak karena terurai menjadi ion-ionnya yang
nilainya ditentukan dengan faktor van’t
Menutup pertemuan dengan salam
Penilaian, Pembelajaran Remedial dan Pengayaan
1.Teknik penilaian
No. Aspek Mekanisme dan Prosedur Instrumen
1. Kognitif (Pengetahuan)
Ulangan mengenai Sifat Koligatif Larutan
Tugas Individu
Soal Objektif
2. Afektif
Keberanian siswa dalam menyampaikan pendapat Menghargai pendapat
yang disampaikan siswa lainnya
Penilaian Diri
Penilaian Antar Peserta Didik
Lembar Observasi
3. Psikomotor (Keterampilan)
Penilaian Praktek Penilaian Portofolio
Rubrik Penilaian
Praktek
2. Instrumen penilaian a. Pertemuan Pertama
Kognitif : soal pilihan Ganda (Terlampir), uraian dan tugas materi Sifat Koligatif Larutan
Afektif : Lembar Observasi Sikap pada Praktik “Sifat Koligatif Larutan Elektrolit dan Nonelektrolit”
Psikomotor : Lembar pengamatan keterampilan pada saat praktik “Sifat Koligatif Larutan Elektrolit dan Nonelektrolit”
b. Pertemuan Kedua
Koligatif Larutan
Afektif : Lembar Observasi diskusi “Sifat Koligatif Larutan Elektrolit dan Nonelektrolit”
Psikomotor : Format penilaian tugasportofolio laporan praktik
3. Pembelajaran Remedial dan Pengayaan
Pembelajaran remedial dilaksanakan segera setelah diadakan penilaian bagi peserta didik yang mendapat nilai di bawah 2,67.
Strategi pembelajaran remedial dilaksanakan dengan pembelajaran remedial, penugasan dan tutor sebaya berdasarkan indikator pembelajaran yang belum dicapai oleh masing-masing peserta didik.
Peserta didik yang mendapat nilai diatas 2,67 diberikan tugas mengkaji materi penerapan elektrolisis dalam kehidupan sehari-hari dan atau soal-soal higherordered
thinking.
4. Kunci dan Pedoman Penskoran pada Lampiran
Media/alat, Bahan, dan Sumber Belajar
1. Media/Alat
a. Gelas kimia 2 buah
b. Tabung reaksi 3 buah
c. Kaki tiga + kasa 1 buah d. Gelas kimia 1000 ml 1 buah
e. Termometer 1 buah
f. Pembakar spirtus 1 buah g. Batang pengaduk 1 buah
2. Bahan
a. Air suling secukupnya
b. Larutan NaCl 0,1m 100 ml c. Larutan gula 0,1m 100ml d. Larutan NaCl 0,2m 100ml e. Larutan gula 0,2m 100 ml
f. Es batu secukupnya
g. Garam dapur secukupnya
3. Sumber Belajar
Lampiran 1: Instrumen Penilaian
A. Instrumen Penilaian Sikap
1. Lembar Observasi Sikap
a. Sikap pada kegiatan Praktikum
Lembar P enilaian pada K egiatan P raktikum
Mata Pelajaran : Kimia Kelas/Semester: XII/1 Topik: Sifat Koligatif Larutan
Judul Praktikum: Mengamati Kenaikan Titik Didih dan Penurunan Titik Beku Larutan
Indikator: Peserta didikmenunjukkan perilaku ilmiah disiplin, tanggung jawab, kerjasama, teliti kreatif dan peduli lingkungan dalam melakukan percobaan kimia
No Nama Siswa Disiplin Tanggungjawab Kerjasama Teliti Kreatif
Peduli Lingku
ngan
Jumlah Skor
Nilai
1. ... 2.
...
Rubrik Penilaian Nilai observasi pada saat praktikum Skor 4 = sangat baik
Skor 3 = baik Skor 2 = cukup Skor 1 = kurang
Nilai=Jumlah Skor
24 x100
b. Sikap pada saat Diskusi
Mata Pelajaran: Kimia Kelas/Semester: XII / 1 Topik: Sifat Koligatif Larutan
Judul Praktikum: Mengamati Kenaikan Titik Didih dan Penurunan Titik Beku Larutan Elektrolit dan Nonelektrolit
Indikator : Peserta didik menunjukkan perilaku kerjasama, rasa ingin tahu, santun, dan komunikatif sebagai wujud kemampuan memecahkan masalah dan membuat keputusan.
No Nama Siswa Kerja sama Rasa ingintahu Santun Komunikatif JumlahSkor Nilai
1. ... 2. ... ...
.
Rubrik Penilaian Nilai observasi pada saat diskusi Skor 4 = sangat baik
Skor 3 = baik Skor 2 = cukup Skor 1 = kurang
Nilai=Jumlah Skor
16 x100
2. Lembar Penilaian Diri
a. Penilaian diri setelah peserta didik belajar Sifat Koligatif Larutan Elektrolit dan Nonelektrolit
Penilaian Diri
Topik:... Nama: ... Kelas: ...
Setelah mempelajari materi Sel elektrolisis, Anda dapat melakukan penilaian diri dengan cara memberikan tanda Vpada kolom yang tersedia sesuai dengan kemampuan.
N
o Pernyataan Sudah memahami Belum memahami
1. Memahami konsep sifat koligatif larutan
2. Memahami hubungan konsentrasi zat dengan sifat koligatif larutan
3. Menentukan titik didih larutan elektrolit dan nonelektrolit 4. Menentukan titik beku larutan elektrolit dan nonelektrolit 5 Membedakan titik beku dan titik dididh larutan elektrolit
dan nonelektrolit pada konsentrasi yang sama
b. Penilaian diri setelah melaksanakan tugas proyek Praktik Penyepuhan Logam.
Penilaian Diri
Tugas:... Nama:... Kelas:...
Bacalah baik-baik setiap pernyataan dan berilah tanda V pada kolom yang sesuai dengan keadaan dirimu yang sebenarnya.
No Pernyataan YA TIDAK
teman satu kelompok
2 Saya melakukan tugan sesuai jadwal
3 Saya mencatat data dengan teliti dan sesuai dengan fakta 4 Saya melakukan tugas sesuai dengan jadwal yang telah dirancang 5 Sebelum melakukantugas terlebih dahulu saya membaca literatur
yang mendukung tugas
Rubrik Penilaian Nilai Jika menjawab Ya, Skor= 2
Jika menjawab Tidak, Skor= 1 Nilai=2x jumlah pernyataanJumlah skor x100
3. Format penilaian antar peserta didik
P
enilaian antar P eserta D idik
Topik: Sel Elekrolisis.
Tanggal Penilaian: .30 -08 -2015 Nama Teman yang dinilai: AmandaNama Penilai:Bayu
- Amati perilaku temanmu dengan cermat selamat mengikuti pembelajaran Kimia
- Berikan tanda v pada kolom yang disediakan berdasarkan hasil pengamatannu.
N
o Perilaku
Dilakukan/muncul
YA TIDAK
1. Mau menerima pendapat teman
2. Memaksa teman untuk menerima pendapatnya 3. Memberi solusi terhadap pendapat yang bertentangan 4. Mau bekerjasama dengan semua teman
5. Disiplin pada saat belajar
4. Format Jurnal
B. I
Topik: Sifat Koligatif Larutan Tanggal Kuis: ...
Nama : ... Kelas : ...
Pilihlah jawaban dengan memberikan tanda silang pada yang benar
Indikator Soal 1: Disajikan rumus molekul beberapa senyawa dengan konsentrasi sama, peserta didik dapat menentukan zat yang memiliki titik didih paling tinggi secara tepat.
JURNAL
Aspek yang diamati: ………. Kejadian : ………. Tanggal: ……….
Nama Peserta Didik: ………. Nomor peserta Didik: ……….
Catatan Pengamatan Guru:
1. Di antara kelima larutan berikut ini, larutan yang memiliki titik didih paling tinggi adalah...
A. C12H22O11 0.1 m B. Mg(NO3)2 0,1 m C. Al2(SO4)3 0,1 m D. NaCl 0,1 m E. C6H5OH 0,1 m
Indikator Soal 2: disajikan rumus molekul beberapa senyawa dengan konsentrasi sama, peserta didik dapat menentukan menentukan larutan yang memiliki titik beku paling rendah
2. Larutan yang mempunyai titik beku paling rendah (diketahui molalitas larutan sama = 0,10 molal) adalah ….
A. C12H22O11 B. CuSO4 C. C6H12O6 D. NiCl2 E. NH4NO3
Indikator Soal 3 : diketahui beberapa senyawa elektrolit dan nonelektrolit dengan dengan konsentrasinya, peserta didik dapat menentukan dengan tepat larutan mana yang memiliki titik didih sama.
3. Diketahui beberapa senyawa berikut :
I. NaCl 0,2 m II. CO(NH2)2 0,3 m III. C12H22O11 0,1m IV. H2SO4 0,1 m V. Al2(SO4)3 0,1 m
Di atara kelima larutan tersebut, larutan manakah yang memiliki titik didih sama? (Kb air = 0,52 )
A. I dan II B. I dan III C. II dan IV D. III dan IV E. III dan V
Indikator Soal 4 : diketahui beberapa senyawa elektrolit dan nonelektrolit dengan dengan konsentrasinya, peserta didik dapat memilih dengan tepat larutan mana yang memiliki titik beku paling rendah?
4. Di atara kelima larutan tersebut, larutan manakah yang memiliki titik beku paling tinggi? (Kf air 1,86 m/0C)
A. C6H5OH 0,03 m B. Mg(NO3)2 0,02 m C. NaCl 0,02 m D. Na3PO4 0,03 m E. AlCl3 0,015 m
A D P
R F C Q
E B B
Suhu (0C) P (mmHg)
5. Di antara larutan 0,01 M berikut ini, larutan yang mempunyai tekanan osmotik
paling besar adalah .... A. NaCl
B. CO(NH2)2 C. C12H22O11 D. H2SO4 E. Al2(SO4)3
Indikator Soal 6 : diberikan contoh suatu larutan nonelektrolit berikut konsentrasinya, peserta didik dapat menentukan larutan mana yang isotonik dengan larutan pada contoh.
6. Larutan manakah di bawah ini yang akan isotonik dengan larutan C12H22O11 0,6
M.
A. NaNO3 0,6 M B. CO(NH2)2 0,2 M C.K2SO4 0,3 M D. AlCl3 0,15 M E. Al2(SO4)3 0,1 M
Indikator soal 7 : disajikan diagram fasa dua jenis larutan dengan konsentrasi berbeda dan pelarut murni. Peserta didik dapat menentukan titik didih larutan dengan
konsentrasi yang lebih besar.
7. Gambar di bawah adalah diagram PT air, larutan urea 0,1 m dan 0,2 m. Manakah berikut ini yang menyatakan titik beku larutan urea 0,2 m?
A. E B. D C. P D. R E. A
Indikator soal 8 : diberikan salah satu contoh larutan elektrolit dilengkapi dengan konsentrasinya, peserta didik dapat menentukan dengan tepat larutan mana yang memiliki tekanan osmotik sama.
A. larutan sukrosa 5,8% dalam air B. larutan 5,8% glukosa dalam air C. larutan 0,2 molal sukrosa D. larutan 1 molal glukosa E. larutan 4 molal glukosa Kunci Jawaban
Soal Pilihan Ganda:
No 1 2 3 4 5 6 7 8
Jawaban C D C D E D E C
Bobot soal masing-masing 1
Nilai=Jumlah Skor
6 x100
C. Instrumen Penilaian Kompetensi Keterampilan
Instrumen Penilaian Praktik
Topik : SIFAT KOLIGATIF LARUTAN
KI: Mengolah, menalar, menyaji, dan mencipta dalam ranah konkret dan ranah abstrak terkait dengan pengembangan dari yang dipelajarinya di sekolah secara mandiri serta bertindak secara efektif dan kreatif, dan mampu menggunakan metoda sesuai kaidah keilmuan.
KD:
Indikator : Merangkai alat Praktikum Sifat Koligatif Larutan dan Melakukan Percobaan dengan Benar
Lembar Pengamatan Topik: Sifat Koligatif Larutan Elektrolit dan Nonelektrolit Kelas: xii
No Nama PercobaanPersiapan PelaksanaanPercobaan Kegiatan AkhirPercobaan JumlahSkor
1. ……… 2.
Rubrik
No Keterampilanyang dinilai Skor Rubrik
1 Persiapan
Percobaan(Menyia pkan alat Bahan)
30 - Alat-alat sudah tersedia, tertata rapih sesuai dengan keperluannya
- Bahan-bahan/larutan untuk percobaan sudah disiapkan di meja praktikum
- Lembar kegiatan praktikum tersedia
- Menggunakan jas laboratorium 20 Ada 3 aspek yang terpenuhi 10 Ada 2 aspek yang terpenuhi 2 Pelaksanaan
Percobaan 30
- Membersihkan alat praktikum sebelum digunakan
- Memanaskan larutan untuk mengukur titik didih dengan benar
- Mendinginkan larutan untuk mengukur titik beku dengan benar
- Menggunakan termometer dengan tepat
20 Ada 4 aspek yang tersedia 10 Ada 2 aspek tang tersedia 3 Kegiatan akhir
praktikum 30
- Membuang larutan atau sampah ketempatnya
- Membersihkan alat dengan baik
- Membersihkan meja praktikum
- Mengembalikan alat ke tempat semula 20 Ada 3 aspek yang tersedia
10 Ada 2 aspek tang tersedia
Instrumen Penilaian Proyek Mata Pelajaran: Kimia
Nama Proyek:Praktik Sifat Koligatif Larutan
Alokasi Waktu: satu minggu
Guru Pembimbing: Nama Peserta didik: Kelas:XII B
No. ASPEK SKOR (1 - 5)
1 PERENCANAAN : a. Rancangan Alat
- Alat dan bahan
- Gambar
b. Uraian cara menggunakan alat 2 PELAKSANAAN :
a. Keakuratan Sumber Data / Informasi b. Kuantitas Sumber Data
c. Analisis Data
d. Penarikan Kesimpulan 3 LAPORAN PROYEK :
a. Sistematika Laporan b. Performans
c. Presentasi
FORMAT PENELAAHAN RENCANA PELAKSANAAN PEMBELAJARAN
Materi Pelajaran: Gugus Fungsi Senyawa Karbon Topik/Tema: Benzena
Berilah tanda cek ( V) pada kolom skor (1, 2, 3 ) sesuai dengan kriteria yang tertera pada kolom tersebut! Berikan catatan atau saran untuk perbaikan RPP sesuai penilaian Anda!
No Rencana Pelaksanaan PembelajaranKomponen 1Hasil Penelaahan dan Skor2 3 Catatan
A. Identitas Mata Pelajaran Tidak
Ada
Kurang Lengkap
Sudah Lengkap
1. Satuan pendidikan,Mata pela-jaran/tema,kelas/ semester dan Alokasi waktu.
V
B. Pemilihan Kompetensi Tidak
Ada
Kurang Lengkap
Sudah Lengkap
1. Kompetensi Inti V
2. Kompetensi Dasar V
C. Perumusan Indikator Tidak
Sesuai 2. Kesesuaian penggunaan kata kerja
opera-sional dengan kompetensi yang diukur.
V
3. Kesesuaian dengan aspek sikap, pengetahuan, dan keterampilan.
V
D. Pemilihan Materi Pembelajaran Tidak
Sesuai
Sesuai Sebagian
Sesuai Seluruhnya
1. Kesesuaian dengan KD V Ada beberapa materi yang lebih sesuai untuk KD 3.1 (Materi sebelumnya)
2. Kesesuaian dengan karakteristik peserta didik.
V
3. Kesesuaian dengan alokasi waktu. V
E. Pemilihan Sumber Belajar Tidak
Sesuai
Sesuai Sebagian
Sesuai Seluruhnya
1. Kesesuaian dengan KI dan KD. V 2. Kesesuaian dengan materi pembelajaran
dan pendekatansaintifik.
V
3. Kesesuaian dengan karakteristik peserta didik.
V
F. Kegiatan Pembelajaran Tidak
Sesuai
Sesuai Sebagian
Sesuai Seluruhnya
1. Menampilkan kegiatan pendahuluan, inti, dan penutup dengan jelas.
V
4. Kesesuaian penyajian dengan sistematika materi.
V
5. Kesesuaian alokasi waktu dengan cakupan materi.
V
G. Penilaian SesuaiTidak SebagianSesuai SeluruhnyaSesuai
1. Kesesuaian dengan teknik penilaian autentik.
No Rencana Pelaksanaan PembelajaranKomponen 1Hasil Penelaahan dan Skor2 3 Catatan
2. Kesesuaian dengan instrumen penilaian autentik
V
3. Kesesuaian soal dengan dengan indikator pencapaian kompetensi.
V
4. Kesesuaian kunci jawaban dengan soal. V Belum ada soal untuk pengayaan
5. Kesesuaian pedoman penskoran dengan soal.
V
H. Pemilihan Media Belajar Tidak
Sesuai
Sesuai Sebagian
Sesuai Seluruhnya
1. Kesesuaian dengan materi pembelajaran V 2. Kesesuaian dengan kegiatan pada
pendekatansaintifik.
V
3. Kesesuaian dengan karakteristik peserta didik.
V
I. Pemilihan Bahan Pembelajaran Tidak
Sesuai
Sesuai Sebagian
Sesuai Seluruhnya
1. Kesesuaian dengan materi pembelajaran V 2. Kesesuaian dengan kegiatan pada
pendekatansaintifik.
V
J. Pemilihan Sumber Pembelajaran Tidak
Sesuai
Sesuai Sebagian
Sesuai Seluruhnya
1. Kesesuaian dengan materi pembelajaran V 2. Kesesuaian dengan kegiatan pada
pendekatansaintifik.
V
3. Kesesuaian dengan karakteristik peserta didik.
V
Jumlah
Rubrik Penilaian Rencana Pelaksanaan Pembelajaran (RPP)
Rubrik penilaian RPP ini digunakan fasilitator untuk menilai RPP peserta yang telah dikerjakan secara berkelompok.
Langkah-langkah penilaian RPP sebagai berikut:
1. Cermati format RPP dan telaah RPP yang akan dinilai! 2. Periksalah RPP dengan seksama
3. Berikan nilai setiap komponen RPP dengan cara membubuhkan tanda cek (√) pada kolom pilihan skor (1 ), (2) dan (3) sesuai dengan penilaian Anda terhadap RPP tersebut!
4. Berikan catatan khusus atau saran perbaikan setiap komponen RPP jika diperlukan! 5. Setelah selesai penilaian, jumlahkan skor seluruh komponen!
6. Tentukan nilai RPP menggunakan rumus sbb:
Nilai=84
90 x100=93,33
Komentar/Rekomendasi terhadap RPP secara umum.
... ... ... ...
PERINGKAT NILAI Amat Baik ( A) 90 ≤ A ≤ 100