6 BAB II
KAJIAN PUSTAKA
2.1 Epidemiologi Perdarahan Saluran Cerna
Lebih dari 95-97% kasus perdarahan saluran cerna bagian bawah berasal dari kolon, sedangkan 3-5% sisanya berasal dari usus halus. LGIB terjadi ± 20% dari perdarahan gastrointestinal (Barnert, 2009). Insidensi LGIB meningkat dengan bertambahannya usia, yang berhubungan dengan lesi yang didapat pada kolon sehingga terjadi perdarahan yaitu pada divertikulosis dan angiodisplasia. Hemmoroid merupakan penyebab tersering LGIB pada pasien dengan usia < 50 tahun, tetapi perdarahan biasanya ringan. Penyebab utama LGIB adalah divertikulosis sebesar 33% kasus, diikuti dengan kanker dan polip yaitu sebesar 19% (Nguyen dan Frizelle, 2007).
2.2 Etiologi Perdarahan Saluran Cerna
Penyebab paling sering dari LGIB adalah penyakit diverticular sebesar 60%, IBD 13%, dan penyakit anorektal 11% (Lavakoli, et al., 2004).
2.2.1 Divertikulosis
Divertikulosis adalah suatu kelainan dimana terjadi herniasi mukosa atau submukosa dan hanya dilapisi oleh tunika serosa pada lokasi dinding kolon yang lemah yaitu tempat dimana vasa rekta menembus dinding kolon (Nguyen dan Frizelle, 2007).
Gambar 2.1 Gambaran kolon dengan diverticular disease (Anonim, 2013). Divertikulosis kolon merupakan penyebab yang paling umum dari perdarahan saluran cerna bagian bawah, ± 40-50% dari semua kasus perdarahan. Prevalensi menurut umur ditemukan bahwa semakin tua usia semakin tinggi angka kejadian dari penyakit ini. Laki-laki dengan usia < 50 tahun lebih banyak dibandingkan dengan perempuan. Pada usia 50-70 tahun insiden pada perempuan lebih banyak daripada laki-laki. Perdarahan dari divertikulum umumnya tidak nyeri dan terjadi pada 3% pasien divertikulosis. Tinja biasanya berwarna merah marun kadang-kadang juga bisa juga menjadi merah segar. Divertikula paling sering terletak pada kolon sigmoid dan kolon desendens. Kemunkinannya disebabkan oleh faktor traumatis lumen, termasuk fecalit yang menyebabkan abrasi dari pembuluh darah sehingga terjadi perdarahan (Barnert dan Messmann, 2009).
Perdarahan divertikular terjadi secara spontan pada 80% pasien. Meskipun divertikula kolon sebelah kiri lebih umum terjadi, namun perdarahan cenderung lebih umum terjadi pada divertikula pada kolon kanan. Perdarahan dari lesi kolon kanan dapat lebih banyak dan menghasilkan volume yang lebih besar daripada divertikula sisi sebelah kiri. Perdarahan ulang (rebleeding) mungkin terjadi kembali
pada 10% pasien pada tahun pertama, setelah itu, risiko untuk perdarahan ulang meningkat menjadi 25% setelah 4 tahun (Nguyen dan Frizelle, 2007).
2.2.2 Arteriovenous Malformation (Angiodisplasia)
Angiodisplasia menjadi penyebab 3-20% dari kasus perdarahan saluran cerna bagian bawah. Angiodisplasia, yang juga disebut sebagai malformasi arteriovenosa, adalah distensi atau dilatasi dari pembuluh darah kecil pada submukosa saluran pencernaan. Angiodisplasia dapat terjadi sepanjang saluran pencernaan dan merupakan penyebab paling umum dari perdarahan dari usus kecil pada pasien berusia diatas 50 tahun (Barbara dan Douglas, 2004).
Angiodisplasia tampak jelas pada kolonoskopi berwarna merah, lesi rata dengan diameter sekitar 2-10 mm. Lesi tampak seperti bintang, oval, tajam, atau tidak jelas. Meskipun angiografi mampu mengidentifikasikan lesi, namun kolonoskopi adalah metode yang paling sensitif untuk mengidentifikasi angiodisplasia (Barbara dan Douglas, 2004).
Angiodisplasia usus merupakan malformasi arteri yang terletak di sekum dan kolon asenden. Angiodisplasia usus merupakan lesi yang diperoleh dan mempengaruhi orang tua berusia > 60 tahun. Lesi ini terdiri dari kelompok-kelompok pembuluh darah yang berdilatasi, terutama pembuluh darah vena, pada mukosa dan submukosa kolon (Barbara dan Douglas, 2004).
Tidak seperti perdarahan divertikular, angiodisplasia cenderung menyebabkan perdarahan dengan episode lambat tetapi berulang. Oleh karena itu, pasien dengan angiodisplasia datang dengan anemia. Angiodisplasia yang menyebabkan hilangnya
darah dalam jumlah besar jarang didapat. Perdarahan lesi aktif dapat diobati dengan elektrokoagulasi koloskopi (Barbara dan Douglas, 2004).
2.2.3 Inflammatory Bowel Disease (IBD)
IBD adalah penyakit inflamasi yang melibatkan saluran cerna dengan penyebab pastinya belum diketahui. Secara garis besar IBD dibagi menjadi 3 jenis, yaitu kolitis ulseratif, penyakit chorn dan bila sulit untuk membedakan keduanya maka dimasukkan dalam kategori Indeterminate Colitis (Djojoningrat, 2007).
Gambar 2.2 Segmen usus pada penyakit IBD (Anonim, 2012).
Macam-macam kondisi peradangan dapat menyebabkan perdarahan saluran cerna bagian bawah yang akut. Perdarahan jarang muncul menjadi tanda, melainkan berkembang dalam perjalanan penyakitnya dan penyebabnya diduga berdasarkan riwayat pasien. Sampai dengan 20% kasus perdarahan saluran cerna bagian bawah akut disebabkan oleh salah satu kondisi peradangan. Kebanyakan perdarahan berhenti secara spontan atau dengan terapi spesifik pada penyebabnya (Barbara dab Douglas, 2004).
Perdarahan masif karena IBD jarang terjadi. Colitis menyebabkan diare berdarah pada beberapa kasus. Pada 50% pasien dengan colitis ulseratif, perdarahan gastrointestinal bagian bawah ringan-sedang muncul, dan sekitar 4% pasien dengan kolitis ulseratif terjadi perdarahan yang masif (Senagore, 2007).
Perdarahan saluran cerna bagian bawah pada pasien dengan penyakit Crohn’s jarang terjadi, tidak seperti pada pasien kolitis ulseratif, hanya 1-2% pasien dengan Crohn’s terjadi perdarahan yang masif. Pada sumber lain mengatakan hanya kurang dari 1% pasien saja (Senagore, 2007).
2.2.4 Benign Anorectal Disease
Penyakit anorektal jinak (misalnya hemorrhoid, fisura ani, fistula anorektal) dapat menyebabkan perdarahan rektum intermiten. 11% dari pasien dengan perdarahan saluran cerna bagian bawah terjadi dari penyakit anorektal. Pasien yang memiliki varises rektum dengan hipertensi portal dapat membuat perdarahan masif saluran cerna bagian bawah tanpa rasa sakit, sehingga pemeriksaan awal anorektum menjadi penting. Jika diketahui terjadi perdarahan aktif, mengobatinya harus agresif. Perhatikan bahwa penemuan penyakit anorektal jinak tidak mengesampingkan kemungkinan perdarahan yang lebih proksimal dari saluran cerna bagian bawah. Pada kasus-kasus ini perdarahan yang timbul berwarna merah segar dan tidak bercampur dengan feces (Barbara dan Douglas, 2004; Debas, 2004). Hemoroid merupakan pelebaran dan inflamasi pembuluh darah vena di daerah anus yang berasal dari plexus hemoroidalis. Di bawah atau di luar linea dentate pelebaran vena yang berada dibawah kulit (subkutan) disebut hemoroid eksterna. Sedangkan di atas atau di dalam linea dentate, pelebaran vena submukosa
disebut hemoroid interna. Biasanya struktur anatomis anal canal masih normal (Djojoningrat, 2007).
2.2.5 Neoplasma
Neoplasma kolorektal dapat dibagi menjadi dua kelompok, yakni polip kolon dan kanker kolon. Polip adalah tonjolan di atas permukaan mukosa. Polip kolon dapat dibagi dalam 3 tipe, yakni neoplasma epithelium, non neoplasma, dan submukosa. Makna klinis yang penting dari polip ada dua, pertama adalah kemungkinan mengalami transformasi menjadi kanker kolorektal dan kedua dengan tindakan pengangkatan polip, kanker kolorektal dapat dicegah (Abdullah, 2007; DeCosse dan Tsioulias, 2011).
Kanker kolorektal adalah penyebab kematian kedua tebanyak dari seluruh pasien kanker di Amerika. Lebih dari 150.000 kasus baru terdiagnosis setiap tahunnya di AS dengan angka kematian mendekati angka 60.000. Rata-rata pasien kanker kolorektal berusia 67 tahun dan lebih dari 50% kematian terjadi pada mereka yang berumur diatas 55 tahun. Sedangkan polip juvenile merupakan penyebab perdarahan kedua paling umum pada pasien lebih muda dari usia 20 tahun (Debas, 2004).
Neoplasma kolon dapat muncul dalam bentuk dan sifat bermacam-macam. Biasanya perdarahan dari lesi ini lambat, ditandai dengan perdarahan samar dan anemia sekunder. Neoplasma ini juga dapat berdarah dengan cepat, namun pada beberapa bentuk sampai dengan 20% dari kasus perdarahan akut pada akhirnya ditemukan muncul karena polip kolon atau kanker (Barbara dan Douglas, 2004; Branner dan Ota, 2007).
Keluhan yang paling sering dirasakan adalah perubahan buang air besar, perdarahan per anus (hematokesia dan konstipasi). Jika terjadi obstruksi maka gejala yang timbul berupa nyeri abdomen, mual, muntah dan obstipasi. Pada tumor yang telah melakukan invasi lokal maka akan timbul gejala tenesmus, hematuria, infeksi saluran kemih berulang dan obstruksi uretra bahkan perforasi abdomen (Barbara dan Douglas, 2004).
2.3 Manifestasi Klinik Perdarahan Saluran Cerna
Perdarahan saluran cerna bagian bawah dapat bermanifestasi dalam bentuk
hematoskezia, maroon stool, melena, atau perdarahan tersamar.
2.3.1 Hematoskezia
Darah segar yang keluar lewat anus/rektum. Hal ini merupakan manifestasi klinis perdarahan yang paling sering. Sumber perdarahan pada umumnya berasal dari anus, rektum, atau kolon bagian kiri (sigmoid atau kolon descendens), tetapi juga dapat berasal dari usus kecil atau saluran cerna bagian atas bila perdarahan tersebut berlangsung masif (sehingga sebagian volume darah tidak sempat kontak dengan asam lambung) dan masa transit usus yang cepat (Davila dan Rajan, 2005). 2.3.2 Maroon stool
Darah yang berwarna merah hati (kadang bercampur dengan melena) yang biasanya berasal dari perdarahan di kolon bagian kanan (ileo-caecal) atau juga dapat dari usus kecil bila waktu transit usus cepat (Davila dan Rajan, 2005).
2.3.3 Melena
Feses yang berwarna hitam seperti kopi (bubuk kopi) atau seperti aspal, berbau busuk dan hal ini disebabkan perubahan hemoglobin menjadi hematin. Perubahan ini dapat terjadi akibat kontak hemoglobin dengan asam lambung atau akibat degradasi darah oleh bakteri usus. Misalnya pada perdarahan yang bersumber di kolon bagian kanan yang disertai waktu transit usus yang lambat. Perdarahan saluran cerna bagian bawah akan tersamar bila jumlah darah sedikit sehingga tidak mengubah warna feses yang keluar. Gambaran klinis lainnya akan sesuai dengan penyebab perdarahan (misalnya pada tumor rektum, teraba massa pada pemeriksaan colok dubur) dan dampak hemodinamik yang terjadi akibat perdarahan tersebut (misalnya anemia atau adanya renjatan). Sebagian besar perdarahan berlangsung akut, berhenti spontan, dan jarang menimbulkan gangguan hemodinamik (Davila dan Rajan, 2005).
2.4 Faktor Risiko
Identifikasi faktor risiko kanker kolorektal penting untuk menetapkan program skrining pada populasi umum sedini mungkin (Bullard dan Rothenberger, 2007).
1. Usia
Lebih dari 90% kasus didiagnosis pada populasi berusia > 50 tahun. Hal ini adalah alasan memulai uji skrining pada populasi asimptomatis > 50 tahun. Individu segala usia berpotensi mengidap kanker kolorektal, sehingga gejala seperti; perubahan signifikan kebiasaan buang air besar (change in bowel habits), perdarahan rektum, melena, anemia tanpa sebab yang jelas, atau penurunan berat badan memerlukan evaluasi menyeluruh (Bullard dan Rothenberger, 2007).
Liang dkk (2006) menyatakan risiko kanker kolorektal meningkat seiring usia, pada pasien muda sering timbul < 40 tahun. Tumor kolorektal herediter [hereditary nonpolyposis colorectal cancer (HNPCC), adenomatosis coli, dan
suspected HNPCC] terjadi pada 38.4% pasien < 40 tahun dan 3.5% pada > 55
tahun. Karena itu, tumor kolorektal herediter lebih sering pada individu muda dengan faktor herediter daripada faktor diet maupun gaya hidup. Penelitian di Eropa menunjukkan, pasien usia ≤ 30 tahun, memiliki 25-30% 5-year survival rate. 60-67% pasien kanker kolorektal muda tergolong stadium III/IV, dengan poorly
differentiated atau musinosum. Pasien muda sering datang dalam stadium lanjut.
Hal ini menunjukkan kanker kolorektal usia muda memiliki prognosis buruk. 2. Faktor Risiko Herediter
Bullard (2007) menyatakan 80% kanker kolorektal terjadi sporadis, sementara 20% timbul pada pasien dengan riwayat kanker kolorektal pada keluarga.
Tabel 2.1
Risiko Herediter dan Kanker Kolon (Robert, et al., 2007)
FAMILIAL SETTING COLON CANCER LIFETIME RISK
General U.S. population 6%
1 first-degree relatif[*] with colon cancer 2- to 3-fold increased 2 first-degree relatifs[*] with colon cancer 3- to 4-fold increased First-degree relatif[*] with colon ca diagnosed ≤50 yr 3- to 4-fold increased 1 second- or third-degree relatif[†][‡] with colon cancer 1.5-fold increased 2 second- or third-degree relatifs[†][‡] with colon cancer 2- to 3-fold increased 1 first-degree relatif[*] with adenomatous polyp 2-fold increased
From Burt RW: Colon cancer screening. Gastroenterology 119:837-853, 2000, with permission. * First-degree relatifs include parents, siblings, and children.
↑ Second-degree relatifs include grandparents, aunts, and uncles. ‡ Third-degree relatifs include great-grandparents and cousins
3. Faktor Lingkungan dan Diet
Penelitian menunjukkan bahwa karsinoma kolorektal terjadi pada populasi yang mengkonsumsi diet tinggi lemak hewani dan rendah serat, hal ini menghasilkan suatu hipotesis bahwa faktor-faktor diet berkontribusi besar terhadap karsinogenesis. Diet tinggi lemak tersaturasi jenuh atau lemak tak jenuh ganda meningkatkan risiko kanker kolorektal, sedangkan diet tinggi asam oleat (minyak zaitun, minyak kelapa, dan minyak ikan) menurunkan risiko. Penelitian pada hewan menunjukkan bahwa lemak dapat bersifat racun pada mukosa usus, sehingga menyebabkan perubahan karsinogenesis awal. Sebaliknya, diet tinggi serat tampaknya bersifat protektif. Konsumsi kalsium, selenium, vitamin A, C, dan E, karotenoid, dan fenol nabati dapat menurunkan risiko kanker kolorektal. Obesitas dan gaya hidup tidak sehat secara dramatis meningkatkan mortalitas kanker,
termasuk KKR. Hal ini merupakan dasar strategi pencegahan primer untuk menurunkan angka KKR dengan mengubah diet dan gaya hidup tidak sehat.
4. Inflammatory Bowel Disease
Pasien dengan penyakit kolitis kronis (Inflammatory Bowel Disease) berisiko menderita kanker kolorektal. Hal ini akibat peradangan kronis mukosa yang menjadi predisposisi keganasan. Durasi dan luasnya kolitis berkorelasi dengan risiko. Dalam pankolitis ulseratif (ulcerative pankolitis), risiko karsinoma sekitar 2% setelah 10 tahun, 8% setelah 20 tahun, dan 18% setelah 30 tahun. Pasien dengan pankolitis Crohn (Crohn's pankolitis) berisiko yang sama. Kolitis pada kolon kiri berisiko lebih rendah. Untuk alasan diatas, skrining kolonoskopi dan biopsi mukosa dianjurkan setiap tahun setelah 8 tahun menderita pankolitis dan setelah 12 -15 tahun pada kolitis kiri.
5. Faktor Risiko Lain
Bullard dan Rothenberger (2007) mengaitkan rokok dengan peningkatan risiko adenoma kolon, terutama setelah usia 35 tahun. Pasien dengan ureterosigmoidostomi meningkatkan risiko pembentukkan adenoma dan karsinoma. Akromegali, yang berhubungan dengan peningkatan sirkulasi hormon pertumbuhan dan insulin-like growth factor-1, juga meningkatkan risiko. Radiasi daerah panggul dapat meningkatkan risiko pengembangan karsinoma rektum (akibat kerusakan radiasi atau akibat kanker rektum dan keganasan panggul).
Tabel 2.2
Faktor Risiko Kanker Kolon (Zinner dan Ashley, 2007)
RISK FACTOR COMMENT
Geographic variation Highest risk in Western countries and lowest risk in developing countries
Age Risk increase sharply after the fifth decade
Diet Increased with total and animal fat diets
Physical inactivity Increased with obesity and sedentary life style
Adenoma Risk dependent on type and size
FAP penetrance in gene carriers 100% HNPCC penetrance in gene carriers 80%
Hamartomatous syndromes Risk increased with Peutz-Jeghers syndrome and juvenile polyposis but not isolated juvenile polyps
Previous history of colon cancer Increased risk for recurrent cancer
Ulcerative colitis 10–20% after 20 years
Radiation Associated with mucinous histology and poor prognosis
Ureterosigmoidostomy 100–500 times increased risk at or adjacent to the uretero-colonic anastomosis
Reproduced, with permission, from Wu JS, Fazio VW, 2000
2.4 Test Skrining 2.5.1 Prinsip Skrining
CCI (Conference on Preventive Aspects of Chronic Disease) pada tahun 1951 mendefinisikan uji skrining sebagai identifikasi penyakit atau cacat yang tidak diakui melalui suatu tes, pemeriksaan atau prosedur lain yang dapat diterapkan dengan cepat. Menurut Wilson dan Jungner (1968), test skrining memilah orang-orang yang mungkin memiliki penyakit dari orang-orang-orang-orang yang mungkin tidak. Sebuah test skrining bukanlah suatu alat diagnostik. Berdasarkan definisi, gejala yang belum diakui serta penyakit presimptomatik termasuk
pemeriksaan fisik dianggap sebagai bagian dari prosedur skrining.WHO pada 1968 mengeluarkan pedoman alat skrining, antara lain: (Boyle, 2005).
1. Harus menjadi masalah kesehatan yang penting.
Di seluruh dunia, kanker kolorektal menempati urutan kedua sebagai kanker paling sering pada wanita dan kanker tersering ketiga pada laki-laki, dan penyakit ini tidak hanya terbatas pada negara dengan gaya hidup barat. Risiko meningkat di negara yang sebelumnya dianggap berisiko rendah.
2. Harus ada pengobatan untuk kondisi tersebut.
Five-year survival rate kanker kolorektal Duke A yang menjalani reseksi
tumor sekitar 80% dan rata-rata survival rate setelah pembedahan dan reseksi
adenomatous pedunculated polyp yang mengandung karsinoma in situ atau
mengalami displasia berat atau karsinoma intramukosal mencapai 100%. Perbedaan survival rate stadium dini dan stadium lanjut sangat besar, sehingga deteksi dini memegang peranan penting. Pengangkatan polip atau lesi prekanker berguna untuk mencegah perubahan menjadi kanker, sehingga menurunkan risiko kanker kolorektal invasif.
3. Fasilitas untuk diagnosis dan pengobatan harus tersedia.
Sangat penting untuk memandang uji skrining sebagai satu langkah awal penatalaksanaan kanker kolorektal, perlu disadari bahwa diagnosis multidisiplin dan pengobatan terintegrasi berperan sangat penting.
4. Harus ada fase laten dari penyakit tersebut.
Sebagian besar kanker invasif muncul dari polip adenomatosa dan menjadi penanda biologis terbaik untuk identifikasi risiko pasien saat pemeriksaan.
5. Harus ada tes atau pemeriksaan untuk kondisi tersebut.
FOBT, sigmoidoskopi, double-contrast barium enema dan kolonoskopi merupakan alat skrining kanker kolorektal yang efektif. Suatu penelitian acak (randomized trials) menunjukkan penurunan angka insidensi dan kematian akibat kanker kolorektal pada individu yang menjalani uji FOBT (Haemoccult). Pada suatu studi observasional didapatkan sigmoidoskopi sekali satu tahap dapat mengurangi kejadian kanker kolorektal dan kematian akibat penyakit ini. Studi observasional lainnya menunjukkan bahwa kolonoskopi juga dapat mengurangi kejadian kanker kolorektal dan kematian akibat kanker ini.
6. Tes harus dapat diterima oleh masyarakat.
Partisipasi dalam berbagai pencobaan sebelumnya menunjukkan FOBT dan sigmoidoskopi dapat diterima sebagian besar populasi, meskipun terdapat variasi individu dalam memilih tes skrining kanker kolorektal yang diminati. 7. Perjalanan alami dari penyakit harus sudah dipahami secara memadai.
Telah diketahui bahwa pemahaman mengenai kanker kolorektal lebih baik dari pada jenis kanker padat lainnya.
8. Harus ada kebijakan mengenai siapa yang berwenang mengobati.
Sangat tidak rasional bila kita mencari sukarelawan, menemukan kankernya namun, tidak memberikan pengobatan. Diperlukan suatu panduan berbagai modalitas pengobatan dan tindak lanjut setelah menegakkan diagnosis. 9. Total biaya harus ekonomis dan seimbang dengan pengeluaran medis.
Penanaman investasi dalam program kesehatan preventif didasarkan pada beberapa pertimbangan, termasuk bukti ilmiah, tekanan publik dan kemauan politik dari pemerintah. Penelitian menunjukkan uji skrining kanker kolorektal telah terbukti cost-effective. Namun, pengambilan keputusan menghabiskan sejumlah dana untuk skrining tidak bisa hanya diliat dari segi nominal saja.
10. Proses berkesinambungan, bukan hanya proyek "once and for all".
Setelah program skrining dilakukan, penting melakukan tindak lanjut hasil.
2.5.2 Test Skrining Feses (Fecal screening test)
Test skrining feses bertujuan mendeteksi darah samar pada saluran pencernaan (mulut hingga usus besar). Test positif dapat merupakan akibat pendarahan gastrointestinal atas atau bawah dan menjadi alasan kuat dilakukannya investigasi lebih lanjut. Test ini tidak secara langsung mendeteksi kanker kolorektal tetapi sering digunakan sebagai skrining untuk penyakit tersebut, juga dapat digunakan untuk mendeteksi darah samar bila timbul gejala gastrointestinal (Bardhan, et al., 2000).
Ada beberapa jenis FOBT:
1. Guaiac Fecal Occult Blood Test (gFOBT)
Mendeteksi aktivitas peroksidase heme dan tidak spesifik untuk darah manusia. Pengujian satu kali dengan uji guaiac standar ini, memiliki sensitivitas deteksi kanker 33-50%, sedangkan test guaiac sensitif (Hemoccult Sensa, Beckman
memiliki kepekaan lebih unggul, dibandingkan satu atau dua sampel (Lieberman, 2009).
Metode pemeriksaan ini, komponen heme dalam hemoglobin memiliki efek menyerupai enzim peroksidase (peroxidase-like effect), yang secara cepat akan menghancurkan hidrogen peroksida. Pada beberapa keadaan, perdarahan lambung atau saluran cerna bagian atas, tes guaiac mungkin lebih sensitif dibandingkan tes deteksi globin, hal ini dikarenakan globin dipecah di usus bagian atas lebih besar dari pada heme. Terdapat beberapa alat tes gFOBT dari yang memiliki sensitifitas rendah hingga tinggi, dan hanya yang memiliki sensitifitas tinggi sajalah yang direkomendasikan sebagai alat skrining. Hasil tes gFOBT yang optimal sangat tergantung dari persiapan diet pasien.
2. Fecal porphyrin quantification: HemoQuant
Tidak seperti gFOBT dan FIT, memungkinkan kuantifikasi hemoglobin lebih tepat dan analitis divalidasi dengan asam lambung dan urin, serta sampel tinja. Gugus heme dari hemoglobin utuh secara kimia dikonversi oleh asam oksalat dan oksalat besi atau ferro-sulfat menjadi protoporfirin, dan kandungan porfirin baik dari sampel asli dan sampel setelah konversi hemoglobin ke porfirin ditentukan besarannya oleh fluoresensi perbandingan terhadap standar acuan (referensi), sedangkan spesifisitas hemoglobin meningkat dengan mengurangi fluoresensi sampel kosong berisi asam sitrat untuk mengoreksi efek yang mengacaukan dari potensi zat non-spesifik yang ada. Pengukuran kuantifikasi yang tepat terbukti sangat berguna dalam aplikasi penelitian klinis (Schwartz, 2010).
3. Fecal Immunochemical Test (FIT)
Data terbaru menunjukkan bahwa FOBT baru yang disebut FIT lebih unggul dari gFOBT yang lebih umum digunakan (Allison, 2007; Fraser, et al., 2006).
Pada test ini menggunakan antibodi spesifik hemoglobin manusia, albumin, atau komponen darah lainnya dan lebih spesifik untuk darah manusia dibandingkan dengan gFOBT. Satu kali pemeriksaan ini memiliki sensitivitas untuk mendeteksi kanker sebesar 60-85% dengan menggunakan satu sampai tiga sampel tinja. (Schwartz, 2010; Fraser, et al., 2012).
FIT tidak bereaksi dengan globin yang bukan manusia atau dengan makanan seperti buah-buahan dan sayuran mentah yang mungkin berisi aktivitas peroksidase. Oleh karena itu pembatasan diet tidak diperlukan bila dengan tes ini. Test ini juga tidak terpengaruh oleh obat-obatan seperti obat anti-inflamasi nonsteroid atau vitamin C. Semua keunggulan ini dapat memperlihatkan bahwa FIT lebih dapat diterima bagi mereka yang diskrining dibandingkan gFOBT (Allison, 2007).
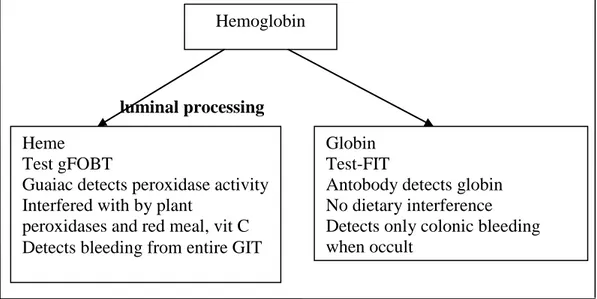
luminal processing
Gambar 2.3 Skema pemecahan hemoglobin pada feses (Young, 2004). Heme
Test gFOBT
Guaiac detects peroxidase activity Interfered with by plant
peroxidases and red meal, vit C Detects bleeding from entire GIT
Hemoglobin
Globin Test-FIT
Antobody detects globin No dietary interference Detects only colonic bleeding when occult
Keunggulan FIT dibandingkan gFOBT sebagai berikut (Allison, 2007): 1. FIT memiliki sensitifitas dan spesifisitas yang lebih baik.
2. FIT menggunakan antibodi spesifik untuk globin manusia dan tidak seperti gFOBT, khusus untuk perdarahan kolorektal dan tidak dipengaruhi oleh diet atau obat-obatan.
3. Beberapa FIT dapat dikembangkan untuk pengelolaan sejumlah besar tes dengan cara standar dengan jaminan kualitas yang baik.
4. Teknologi baru dari FIT memungkinkan mereka untuk mengukur hemoglobin tinja sehingga sensitivitas, spesifisitas dan laju positif dapat disesuaikan dalam skrining untuk neoplasia kolorektal.
5. Instrumen yang dikembangkan untuk beberapa FIT memiliki kemampuan untuk membaca kode bar pada tes. Fitur ini memastikan identifikasi akurat dari orang yang disaring dan memungkinkan untuk print-out dari hasil serta pengingat print-out untuk keperluan di masa depan.
Keterbatasan dari Uji FIT (Allison, 2007):
1. FIT hanya untuk mendeteksi adanya haemoglobin dalam feces.
2. FIT hanya digunakan untuk skrining dan tidak dimaksudkan untuk menggantikan test prosedur diagnostik.
3. Adanya darah dalam feces kemungkinan disebabkan juga oleh karena haemoroid, darah dalam urine atau iritasi lambung selain perdarahan kolorektal. Bila didapatkan hasil positif maka pemeriksaan lain perlu dilakukan untuk menentukan penyebab dan sumber dari perdarahan dalam spesimen feces.
4. Hasil negatif tidak dapat menyingkirkan adanya perdarahan karena bisa intermiten. Hasil negatif palsu bisa jadi oleh karena darah tersamar tidak terdistribusi merata dalam feces.
5. Kadang kadang adanya polip atau kanker kolorektal bisa berdarah secara intermiten atau tidak sama sekali.
Tabel 2.3
Perbandingan karakteristik gFOBT dan FIT (Young, 2004). Test and type Specificity
for neoplasia
Sensitivity for cancer
Rehydrated Hemoccult: gFOBT
90% 90% with repeated annual screnning
Hemoccult II: gFOBT 94%-98% 35%-55% with once-off testing. Up to 80% with repeated annual testing Hemoccult SENSA:
gFOBT
88%-92% 80% with once-off testing
Heme Select variants: FIT
95% 70%-82% with once-off
testing
2.5.3 Studi Radiografi
Pemeriksaan barium enema secara akurat mengidentifikasi kanker stadium lanjut, tetapi merupakan tes yang buruk untuk lesi prekanker dan jarang digunakan untuk skrining penyakit kanker kolorektal saat ini. Pemeriksaan penunjang dengan
Computed Tomografi (CT) kolonografi membuat gambaran usus dua-dimensi dan
gambar tiga-dimensi dari usus besar dan memerlukan persiapan kolon yang baik. Suatu studi klinis menunjukkan 90% dari polip berdiameter lebih dari 10 mm telah diidentifikasi dengan benar, dengan tingkat positif palsu 14%. Tingkat deteksi polip berdiameter yang > 6 mm (ambang batas merujuk pasien untuk kolonoskopi) adalah 78% (spesifisitas 88%). Dengan cut off-point 15-25% dari orang yang menjalani skrining dirujuk untuk kolonoskopi (Lieberman, 2009).
Tingkat rujukan untuk kolonoskopi merupakan elemen penting dari biaya program. CT kolonografi kurang sensitif dan spesifik untuk polip berdiameter < 6 mm. Namun, rencana perawatan pasien dengan diameter < 6 mm masih kontroversial. Pemeriksaan CT kolonografi menunjukkan < 2% pasien memiliki adenoma lanjut, dan kanker yang langka. Tidak ada satupun penelitian menunjukkan keselamatan pasien dengan CT kolonografi berulang (Lieberman, 2009).
Adanya ketidakpastian tentang apakah CT kolonografi dapat digunakan untuk mengidentifikasi polip datar (flat polyp), beberapa di antaranya mungkin tempat tumbuhnya sel ganas. Interval skrining yang tepat setelah pemeriksaan negatif atau dalam kasus pertumbuhan, yang berdiameter < 6 mm dan kemungkinan polip masih tidak pasti. Selain itu, sensitivitas dan spesifisitas CT kolonografi dalam rutinitas pengaturan praktek klinis tidak diketahui. Paparan radiasi yang berhubungan dengan CT kolonografi dapat meningkatkan risiko kanker. Meskipun rejimen dosis rendah yang digunakan, ada kekhawatiran tentang paparan radiasi kumulatif, dan beberapa negara tidak memungkinkan diakukannya pencitraan untuk
tujuan skrining. Suatu studi menunjukkan bahwa 27-69% dari orang yang menjalani pemeriksaan dengan CT kolonografi memiliki minimal satu ditemukan masa di luar usus besar, yang memerlukan evaluasi lebih lanjut pada 5-16% dari orang menjalani skrining (Lieberman, 2009).
2.5.4 Sigmoidoskopi
Suatu penelitian case-control menunjukkan secara signifikan hubungan antara kegunaan suatu uji sigmoidiskopi dengan penurunan mortalitas akibat kanker kolorektal pada lokasi kolon yang dilakukan pemeriksaan. Pada suatu studi
randomized control trial, tidak terjadi penurunan insidens kanker kolorektal
diantara individu yang setuju menjalani pemeriksaan sigmoidoskopi, dan pada suatu analisis intention-to-treat, menunjukkan penurunan mortalitas yang tidak signifikan pada individu tersebut selama 6 tahun dibandingkan dengan kontrol. Namun Lieberman, (2009), menyatakan bahwa suatu studi dengan menggunakan skrining kolonoskopi telah menunjukkan lebih dari 30% pasien dengan neoplasia stadium lanjut yang memiliki lesi neoplasia proksimal yang tidak dapat teridentifikasi dengan sigmoidoskopi, hal ini lebih sering terjadi pada wanita dibandingkan laki-laki dan pada pasien lebih dari 60 tahun dari pada pasien usia muda. Pemeriksaan ini memerlukan persiapan usus dan kunjungan pada jam kerja (office visit) dan biasanya terkait dengan ketidaknyamanan saat pemeriksaan.
Beberapa klinisi dan pasien, lebih memilih pemeriksaan kolonoskopi daripada sigmoidoskopi, hal ini dikarenakan pasien tersedasi dan menjalani pemeriksaan kolon lengkap disertai polipektomi. Semua keterbatasan ini telah menyebabkan pembatasan penggunaannya di Amerika Serikat (Lieberman, 2009).
2.5.5 Kolonoskopi
Kolonoskopi merupakan langkah penilaian final dalam setiap program skrining untuk deteksi kanker kolorektal. Beberapa penelitian kohort berskala besar telah menunjukkan kemampuan dan keamanan kolonoskopi sebagai tes skrining primer. Suatu lesi maligna/premaligna dapat terjadi pada beberapa kasus kanker yang terdeteksi melalui kolonoskopi. Lesi dengan diameter > 10 mm dapat tidak terdeteksi pada 2-12% kasus. Kolonoskopi mungkin kurang berperan dalam menurunkan risiko kanker kolon proksimal, kecuali pemeriksaan dilakukan secara lengkap dan seluruh polip diangkat. Suatu rekomendasi pemeriksaan berulang dengan interval 10 tahun setelah suatu hasil negatif kolonoskopi, telah dibuktikan melalui suatu studi case-control. Dua penelitian terbaru menunjukkan risiko yang rendah neoplasia stadium lanjut, setelah 5 tahun dengan kolonoskopi negatif (Lieberman, 2009).
Kontraindikasi kolonoskopi (Modric, 2011): 1. Kehamilan.
2. Penyakit jantung akut.
3. Perforasi usus dan obstruksi total. 4. Divertikulitis akut.
5. Kolitis fulminan, megakolon toksik, nekrosis kolon, atau peritonitis akut. 6. Aneurisma aorta abdominalis > 5-6 cm yang bergejala.
7. Kelainan koagulasi darah atau penurunan signifikan leukosit atau trombosit dalam darah.
8. Hernia Bochdalek.
9. Pasien yang tidak kooperatif atau tidak dapat diobati.
10. Sore hari sebelum dilakukan kolonoskopi, konsumsi laksatif. Dan mulailah puasa makanan padat setelahnya, dan mulailah puasa total sekitar 6-8 jam sebelum tindakan.
11. Sekitar 1 jam sebelum prosedur, dokter mungkin akan memberikan pasien enema untuk melengkapi bowel preparation.
Komplikasi Kolonoskopi (Modric, 2011):
1. Perdarahan yang mungkin terjadi selama prosedur hingga sekitar 1 minggu setelah kolonoskopi, biasanya berhenti spontan, namun dapat pula hingga memerlukan kolonoskopi ulang untuk menghentikannya.
2. Aritmia, biasanya terkait efek samping pembiusan. 3. Obstruksi usus halus.
4. Divertikulitis. 5. Perforasi kolon.
6. Sedatif dapat menyebabkan ansietas, mual, alergi atau depresi pernafasan.
Prosedur Kolonoskopi
Selama prosedur pasien diberi sedatif (fentanyl atau midazolam). Langkah pertama adalah pemeriksaan colok dubur untuk memeriksa tonus sfingter ani dan menetukan apakah persiapan cukup adekuat. Endoskop kemudian dimasukkan
melalui anus hingga rektum, kolon (sigmoid, kolon desenden, tranversum, dan kolon asenden, serta caecum), dan terakhir pada ileum terminal (Modric, 2011).
Endoskop memiliki ujung fleksibel dan saluran untuk memasukkan instrumen, udara, suction dan sumber cahaya. Lumen usus akan diinsuflasi dengan udara untuk memaksimalkan pemeriksaan. Biopsi dilakukan selama prosedur ini. Dikarenakan tikungan yang tajam dan redudansi pada kolon yang tidak terfiksir, menyebabkan bowing effect yang berakibat regangan kolon dan mesenterika yang menimbulkan ketidaknyamanan (DiPalma, 2003; Modric, 2011).
Pemeriksaan visual sering dilakukan 20-25 menit setelah penarikan endoskop. Lesi yang tampak mencurigakan akan dikauterisasi, dipotong dengan sinar laser atau dengan kawat listrik untuk keperluan biopsi atau polipektomi lengkap. Obat dapat disuntikkan selama prosedur berlangsung, misalnya untuk mengontrol perdarahan. Prosedur ini memakan waktu 20-30 menit, tergantung pada indikasi dan temuan selama prosedur. Dengan beberapa polipektomi atau biopsi, waktu prosedur dapat menjadi lebih lama. Setelah prosedur dilakukan, diperlukan waktu untuk pemulihan akibat obat penenang diperkirakan 30-60 menit (DiPalma, 2003).
Tabel 2.4
Sensitifitas Test Skrining Satu Tahap (Lieberman dan Weiss, 2001)
TEST
SENSITIVITY (%)CANCER ADVANCED
ADENOMAS* STOOL-BASED TEST
Standard guaiac fecal occult-blood test (3 samples)
Sensitive guaiac fecal occult-blood test (3 samples)
Immunochemical fecal occult-blood test (1-3 stool samples)
One stool DNA test (1 sample) New stool DNA test (1 sample)
33-50 50-75 60-85 51 ≥ 80 11 20-25 20-50 18 40 STRUCTURAL EXAMINATIONS OF THE
COLON
CT Colonography Sigmoidoscopy Colonoscopy
Uncertain; probably > 90 > 95 (in the distal colon) > 95
90 (if Ø ≥ 10mm) 70 †
88-98
* Advanced adenoma is defined as a tubular adenoma that is 10 mm or larger in diameter or an adenoma with villous histologic features or high-grade dysplasia. † If an adenoma is detected in the distal colon, the patient would undergo complete colonoscopy, which would result in the detection of some proximal advanced adenomas.
Percobaan klinis telah menunjukkan bahwa individu dengan Fecal Occult
Blood Test positif memiliki risiko kanker tiga sampai empat kali lebih tinggi
dibandingkan individu dengan tes negatif, dan kolonoskopi sebaiknya dianjurkan bagi orang dengan tes positif. Suatu penelitian uji kontrol-acak (randomized
controlled trials) dimana tes guaiac standar setiap 1 atau 2 tahun selama periode
10-13 tahun, berhasil mengurangi 15-33% kematian akibat kanker kolorektal (Anonim, 2011).
2.6 Tehnik Fecal Immunochemical Test 2.6.1 Prinsip
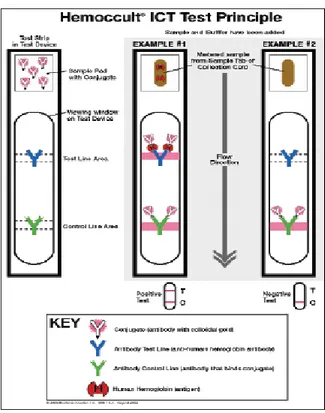
FIT ini memanfaatkan suatu kombinasi yang unik dari dua antibodi monoklonal untuk secara selektif mendeteksi adanya haemoglobin manusia didalam sampel feses. Test device terdiri dari pad yang dilapisi dengan gold colloidal dikonjugasikan dengan anti human haemoglobin antibodies, suatu membran
nitrocellulose yang dilapisi antibody manusia pada test band dan goat antimouse
antibodies pada control band area. Begitu jumlah sampel cairan feses telah cukup
jumlahnya ditambahkan kedalam test device maka dia bermigrasi sepanjang test
device secara kapiler. Bila sampel feses mengandung haemoglobin manusia 10
mg/ml atau lebih, test band nampak sebagai suatu red purple band. Bila kadar haemoglobin manusia kurang dari sampel feses yang dapat dideteksi maka tidak akan ada test band. Kontrol band akan nampak tidak tergantung dari adanya haemoglobin manusia didalam sampel.
2.6.2 Persiapan Spesimen
1. Pengumpulan spesimen hendaknya tidak dilakukan pada saat sedang menstruasi atau dalam tiga hari dari suatu periode menstruasi, begitu juga bila penderita mempunyai hemoroid yang sedang berdarah atau bila ada darah dalam urine. Bila dilakukan maka kemungkinan didapatkan hasil positif palsu.
3. Mengkonsumsi alkohol, aspirin dan obat-obatan lain dalam jumlah yang berlebihan akan dapat menyebabkan occult bleeding (pendarahan tersamar). Bahan-bahan itu hendaknya dihentikan setidaknya 48 jam sebelum test. 2.6.3 Pengumpulan spesimen
1. Dalam pemeriksaan ini hendaknya hanya digunakan spesimen feces. Feses dapat dikoleksi dari toilet paper (tissue toilet) atau diletakkan dalam suatu
clean container. Spesimen hendaknya jangan sampai terkontaminasi air
toilet (toilet water).
2. Screw pada bagian atas dari sample collection device dilepaskan dan untuk mengumpulkan sampel feses dengan cara memasukkan stick secara random kedalam tiga tempat berbeda dari sampel feses yang sama.
3. Letakkan sampel collection stick yang berisi sampel feses kembali kedalam
sampel collection device dan screw kembali dengan ketat, kocoklah dengan
baik.
4. Sampel yang terkoleksi dapat disimpan pada suhu ruangan (< 30° C) selama 5 hari atau direfrigerasi pada suhu 4 -8° C selama 7 hari.
2.6.4 Prosedur Test
1. Tempatkan sampel yang sudah diekstrak pada temperatur ruangan bila sampel itu direfrigerasi. Kemudian campur dengan baik sampel yang sudah diekstrak dengan cara mengocok sebentar sampel collection device.
2. Pindahkan test disk dari kantong foil dan tempatkan pada permukaan yang datar dan kering.
3. Peganglah sample collection device sedemikian rupa sehingga ujung device menghadap keatas, kemudian robeklah ujung dari collection device. Kemudian pencet sebanyak 2 tetes dari extracted sampel kedalam sampel dengan baik.
4. Pada saat test kit mulai bekerja, anda akan melihat purple color bergerak sepanjang result windows ditengah tengah (center) dari test disk.
5. Lakukan interprestasi dari hasil test dalam waktu 10 menit, jangan lakukan setelah 10 menit.
Catatan : waktu interpestasi diatas dilaksanakan atas pembacaan hasil test pada suhu ruangan antara 15-30°C. Bila suhu ruangan anda secara siginifikan dibawah 15°C, maka waktu interpretasi hendaknya dinaikkan dengan tepat.
2.6.5 Interpretasi dari Test
1. Suatu pita warna (color band) akan nampak pada bagian bawah dari
result window untuk menunjukkan bahwa test sedang bekerja dengan
sempurna. Pita ini adalah Control Band atau “C” band.
2. Bagian atas dari result window menunjukkan hasil test. Bila pita warna yang lain nampak pada bagian atas, pita ini adalah Test Band atau “T”
band.
Hasil positif : Adanya dua pita warna (“C” dan “T” bands) didalam result window tanpa memandang pita mana yang muncul terlebih dahulu, menunjukkan hasil positif.
Hasil negatif : Bila yang nampak hanya satu purple color (“C”) di dalam result
window, menunjukkan hasil negatif.
Hasil cacat (invalid result): apabila setelah test dikerjakan purple color band tidak kelihatan didalam result window maka test dinyatakan cacat (invalid). Kemungkinan petunjuk tidak diikuti dengan tepat atau terjadi kerusakan. Dalam hal ini spesimen direkomendasikan untuk di test ulang.