PENGOLAHAN LIMBAH Cr(VI), FENOL
dan Hg(II) DENGAN FOTOKATALIS
SERBUK TiO
2dan ZnO/TiO
2Slamet, Rita Arbianti, Wilyani
Program Studi Teknik Kimia, Departemen Teknik Gas dan Petrokimia Fakultas Teknik Universitas Indonesia
Kampus Baru UI Depok 16424 e-mail: slamet@che.ui.edu
Abstrak
Katalis ZnO/TiO2 dipreparasi dengan cara impregnasi terhadap TiO2 Degussa
P25 menggunakan larutan garam Zn-Nitrat. Loading ZnO dalam katalis divariasikan dari 0,5% hingga 33,5%. Fotokatalis tersebut kemudian dikarakterisasi DRS dan XRD. Aktivitas fotokatalis diuji dengan menggunakan sistem reaktor slurry yang bekerja secara batch dan dilengkapi dengan 6 lampu UV black light selama 5 jam, kemudian hasilnya dianalisis dengan UV-VIS Spectrophotometer. Hasil karakterisasi DRS menunjukan bahwa penambahan
ZnO dari 5% hingga 33,5% ke dalam TiO2 dapat meningkatkan pita absorpsi
katalis dari 385 hingga 420 nm dan menurunkan band gap dari 3,2 hingga 2,85 eV. Hasil karakterisasi XRD menunjukan adanya struktur kristal anatase dan
rutil dalam katalis TiO2 dan ZnO/TiO2, sementara struktur kristal ZnO muncul
pada katalis ZnO/TiO2 yang dipreparasi dengan Zn-Nitrat. Fotokatalis 0,5%
ZnO/TiO2 memiliki aktivitas optimal yang mereduksi Cr(VI) 100% dan
mendegradasi fenol 97,6%. Sementara jika kedua limbah tersebut diolah secara
simultan, katalis 0,5% ZnO/TiO2 juga memiliki aktivitas yang paling tinggi
dengan meningkatkan konversi reduksi Cr(VI) menjadi 100% dan menurunkan konversi degradasi fenol menjadi 93,4% dengan waktu reaksi 5 jam. Adapun
untuk limbah tunggal Hg(II), katalis 0,5% ZnO/TiO2 dapat mereduksi Hg(II)
hingga 4,5 ppm setelah 4 jam.
Kata kunci: fotokatalis, ZnO/TiO2, reduksi Cr(VI), degradasi fenol, reduksi
Hg(II)
Abstract
Catalyst of ZnO/TiO2 was prepared by impregnating TiO2 Degussa P25 with
Zn-nitrate solution to give Zn content that varies between 0.5% and 33.5%. The photocatalysts were characterized using DRS and XRD. The photocatalyst activity tested by using slurry batch reactor that equipped with 6 black light UV lamps (@ 10 watt). After 5 hours experiment, the result was analysed by UV-VIS Spectrophotometer. Result of DRS characterization showed that addition of ZnO
from 385 to 420 nm and reduced the band gap of the catalysts from 3.2 to 2.85 eV. Result of XRD charaterization showed the existence of structure crystal
anatase and rutil in catalyst TiO2 and ZnO/TiO2, whereas structure of crystal
ZnO emerged at catalyst ZnO/TiO2. Photocatalyst 0.5% ZnO/TiO2 had the
optimal activity that reduced Cr(VI) with conversion 100% and degraded phenol with conversion 97.6%. Whereas if both of the waste processed by
simultaneously, the catalyst of 0.5% ZnO/TiO2 also had the highest activity that
increased conversion of Cr(VI) reduction to 100% and decreased conversion of phenol degradation to 93.4% after five hours reaction. Whereas for single waste
of Hg(II), catalyst of 0.5% ZnO/TiO2 could reduce of 40 ppm Hg(II) to 4.5 ppm
after four hours.
Key-words: photocatalyst, ZnO/TiO2, reduction Cr(VI), degradation fenol,
reduction Hg(II) 1. Pendahuluan
Pesatnya perkembangan aktivitas perindustrian akhir-akhir ini telah menyebabkan permasalahan lingkungan, akibat bertambahnya limbah berbahaya yang dihasilkan industri tersebut. Beberapa limbah berbahaya yang menjadi perhatian masyarakat sekarang ini adalah limbah Cr(VI), fenol dan Hg(II).
Baik Cr(VI), fenol dan Hg(II) bersifat racun terhadap semua organisme dan menyebabkan iritasi serta korosi pada kulit manusia. Mengingat bahaya yang ditimbulkannya, maka perlu dilakukan penanganan khusus terhadap limbah Cr(VI), fenol dan Hg(II). Teknologi konvensional telah banyak dilakukan untuk mengolah limbah Cr(VI), fenol dan Hg(II), tetapi metode tersebut masih memiliki beberapa kelemahan, diantaranya efisiensi pengolahan limbah yang rendah, pemakaian energi dan bahan kimia yang cukup tinggi, serta proses pengolahan limbah yang dilakukan tersebut ternyata masih menghasilkan residu berbahaya [1,2,3].
Teknologi fotokatalisis yang sekarang ini juga banyak dikembangkan ternyata juga baik untuk mereduksi Cr(VI), fenol dan Hg(II). Bahkan, dinilai lebih ekonomis dalam pemakaian energi. Selain itu, teknologi fotokatalis juga dapat menekan pemakaian bahan kimia.
Katalis semikonduktor yang sampai saat ini terbukti memiliki aktivitas tinggi dalam reduksi limbah Cr(VI), fenol dan Hg(II) adalah TiO2. Begitu banyak cara telah dilakukan untuk meningkatkan aktivitas katalis TiO2 tersebut, salah satunya dengan penambahan dopan logam, seperti logam Pt. Logam lainnya yang dapat ditambahkan sebagai dopan adalah logam Zn dalam bentuk oksidanya, yaitu ZnO.
Penggunaan katalis TiO2 dengan penambahan dopan ZnO untuk reduksi limbah Cr(VI) dan fenol belum banyak diteliti. Oleh karena itu, pada penelitian ini akan di jelaskan mengenai pengolahan limbah Cr(VI), fenol dan Hg(II) pada sistem terpisah dan simultan secara fotokatalisis dengan katalis TiO2 dan ZnO/TiO2 yang dibagi dalam tiga tahap, yaitu preparasi, karakterisasi (DRS dan XRD) dan uji aktivitas dari katalis ZnO/TiO2.
2. Eksperimen
2.1 Preparasi katalis ZnO/TiO2
Preparasi katalis ZnO/TiO2 dilakukan dengan metode impregnasi termodifikasi menggunakan berbagai prekursor penghasil dopan ZnO, yaitu Zn(NO3)2.4H2O (Merck 99,5%). Sementara untuk bahan awal TiO2 digunakan TiO2 komersial Degussa P25. Loading ZnO divariasikan dari 0,5-33,5% (persen berat).
Preparasi dimulai dengan mencampurkan TiO2 dengan larutan prekursor ke dalam air demin sebanyak 50 mL dan diaduk hingga membentuk larutan suspensi dan diultrasonik selama 1 jam. Setelah itu, larutan suspensi dipanaskan di atas hot plate-stirrer pada suhu 90oC yang dilengkapi dengan magnetic stirrer selama ± 3 jam. Selanjutnya, dilakukan pengeringan di dalam vacuum furnace pada temperatur 150oC selama 2 jam. Kemudian dipindahkan ke dalam
atmospheric furnace dan dikalsinasi pada temperatur 500oC selama 1 jam dengan
laju kenaikan suhu diatur sebesar 5oC/menit.
2.2 Karakterisasi katalis ZnO/TiO2
Karakterisasi DRS dilakukan menggunakan spectrophotometer tipe CARY 2415 UV/vis NIR yang dilengkapi dengan sphere terintegrasi untuk merekam diffuse reflectance spectra (DRS) dan data absorbansi sampel yang diamati. Spektrum reflektan dianalisis pada kondisi ambient pada daerah panjang gelombang 340-700 nm.
Katalis ZnO/TiO2 dengan loading ZnO 0,5-33,5% dikarakterisasi dengan menggunakan XRD tipe PHILIPS PW 1710 dengan tabung anode Zn (λ=0,154184 nm). Karakterisasi X-Ray Diffraction ini bertujuan untuk mengidentifikasi struktur kristal dari katalis ZnO/TiO2 dengan loading ZnO 0,5-33,5% dari prekursor Zn-Nitrat. Ukuran kristal sampel juga diperoleh dari setengah lebar puncak maksimum dari XRD dengan persamaan Scherrer.
Tabung XRD dijalankan pada tegangan 40 kV dan arus sebesar 30 mA. Setelah itu menjalankan komputer dan memasukkan parameter operasi, step size diatur sebesar 0,01o dan time per step diatur pada 1,0 sekon, 2θ = 20-60o. Dengan karakterisasi XRD ini diharapkan dapat diketahui struktur kristal dari serbuk katalis TiO2 dan ZnO/TiO2 dengan mengetahui puncak sampel dan dibandingkan dengan puncak standar yang diperoleh dari PCPDFWIN versi 2.01. Hasil karakterisasi pola difraksi sinar-X untuk setiap sampel di-fitting terlebih dahulu dengan menggunakan PC APD versi 3.5B.
2.3 Reaksi fotokatalisis
Reaksi fotokatalisis terjadi di dalam reaktor fotokatalisis jenis slurry yang bekerja secara batch. Reaktor terdiri dari tabung yang terbuat dari pyrex dengan tinggi 5 cm, diameter 14 cm dan bagian atasnya terbuka serta berjarak 8 cm dari lampu UV sebanyak 6 buah merek TOKI Japan @ 10 watt. Intensitas enam lampu adalah 2450 µW/m2
.
Pertama kali, 300 mL limbah dibuat dengan konsentrasi awal 40 ppm dan kondisi pH yang optimal diatur untuk masing-masing limbah. Spesifikasi pH dari jenis limbah yang dibuat dapat dilihat pada Tabel 1.
Tabel 1.
Spesifikasi jenis limbah dan kondisi pH limbah
Jenis Limbah pH
Limbah Cr(VI) 40 ppm 2
Limbah Fenol 40 ppm 7
Limbah Cr(VI) + Fenol 40 ppm 2
Limbah Hg(II) 12
Fotokatalis dengan berat tertentu dilarutkan ke dalam 100 mL limbah yang kemudian diultrasonik selama 45 menit. Sementara, sisa larutan limbah dimasukan ke dalam reaktor terlebih dahulu. Lalu lampu reaktor, pengontrol pengaduk dan kipas dinyalakan sampai kondisi temperatur reaktor konstant ( + 1 jam). Hal ini dilakukan untuk analisis blank test, guna meyakinkan bahwa produk yang dihasilkan berasal dari proses fotokatalisis. Kemudian, katalis yang sudah diultrasonik dimasukkan ke dalam larutan limbah sehingga volume total menjadi 300 mL.
Reaktor dioperasikan selama 5 jam dan sampel diambil setiap jam. Kemudian sampel tersebut disentrifuge selama 1 jam dan dianalisis dengan UV-VIS Spectrophotometer buatan Labomed.Inc tipe Spectro UV-UV-VIS RS. Kondisi operasi panjang gelombang untuk analisis Cr(VI) 398 nm dan fenol 500 nm serta Hg(II) 508 nm.
3. Hasil dan Diskusi
3.1. Karakterisasi katalis ZnO/TiO2
Spektra DRS dengan fungsi kubelka munk dari masing-masing katalis yang dipreparasi berdasarkan variasi loading ZnO pada bahan prekursor yang berbeda–beda dapat dilihat pada Gambar 1.
0 0.6 1.2 1.8 2.4 3 220 290 360 430 500 570 640 710 Panjang ge lombang (nm) f( R ) TiO2 Degussa P25 1/2% ZnO/TiO2 1% ZnO/TiO2 5% ZnO/TiO2 33.5% ZnO/TiO2 ZnO
Gambar 1. Grafik Kubelka-Munk terhadap panjang gelombang
Dari spektra DRS tersebut terlihat bahwa peningkatan loading ZnO 0,5% hingga 33,5% pada katalis ZnO/TiO2 yang dipreparasi dari prekursor Zn-Nitrat menyebabkan peningkatan absorpsi katalis ZnO/TiO2. Dari pola pergeseran spektra absorpsi, dapat dilihat bahwa peningkatan loading ZnO 0,5% hingga
33,5% menyebabkan pergeseran pita absorpsi ke arah pita cahaya sinar tampak, sehingga katalis memiliki kemampuan lebih untuk menyerap cahaya pada panjang gelombang yang lebih tinggi. Melalui karakterisasi DRS juga dapat diperoleh nilai band gap dari katalis.
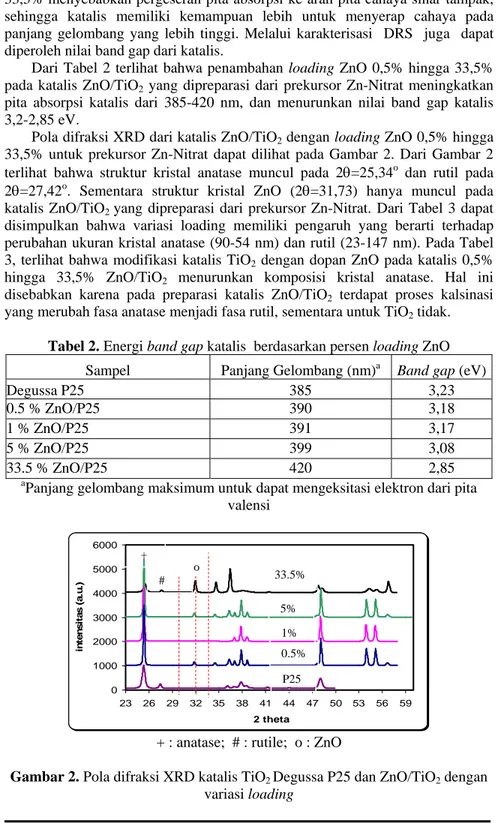
Dari Tabel 2 terlihat bahwa penambahan loading ZnO 0,5% hingga 33,5% pada katalis ZnO/TiO2 yang dipreparasi dari prekursor Zn-Nitrat meningkatkan pita absorpsi katalis dari 385-420 nm, dan menurunkan nilai band gap katalis 3,2-2,85 eV.
Pola difraksi XRD dari katalis ZnO/TiO2 dengan loading ZnO 0,5% hingga 33,5% untuk prekursor Zn-Nitrat dapat dilihat pada Gambar 2. Dari Gambar 2 terlihat bahwa struktur kristal anatase muncul pada 2θ=25,34o
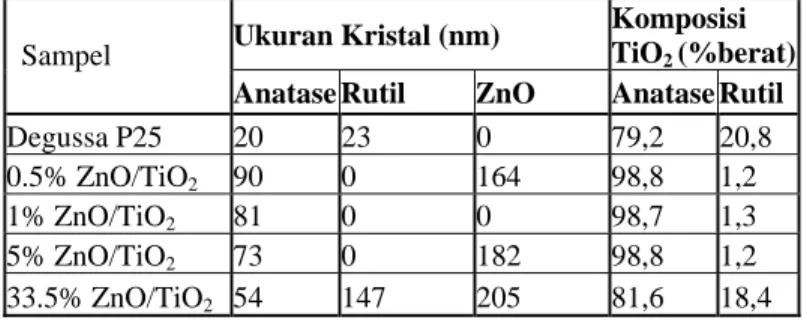
dan rutil pada 2θ=27,42o. Sementara struktur kristal ZnO (2θ=31,73) hanya muncul pada katalis ZnO/TiO2 yang dipreparasi dari prekursor Zn-Nitrat. Dari Tabel 3 dapat disimpulkan bahwa variasi loading memiliki pengaruh yang berarti terhadap perubahan ukuran kristal anatase (90-54 nm) dan rutil (23-147 nm). Pada Tabel 3, terlihat bahwa modifikasi katalis TiO2 dengan dopan ZnO pada katalis 0,5% hingga 33,5% ZnO/TiO2 menurunkan komposisi kristal anatase. Hal ini disebabkan karena pada preparasi katalis ZnO/TiO2 terdapat proses kalsinasi yang merubah fasa anatase menjadi fasa rutil, sementara untuk TiO2 tidak.
Tabel 2. Energi band gap katalis berdasarkan persen loading ZnO Sampel Panjang Gelombang (nm)a Band gap (eV)
Degussa P25 385 3,23 0.5 % ZnO/P25 390 3,18 1 % ZnO/P25 391 3,17 5 % ZnO/P25 399 3,08 33.5 % ZnO/P25 420 2,85 a
Panjang gelombang maksimum untuk dapat mengeksitasi elektron dari pita valensi 0 1000 2000 3000 4000 5000 6000 23 26 29 32 35 38 41 44 47 50 53 56 59 2 theta in te n s it a s ( a .u .)
+ : anatase; # : rutile; o : ZnO
Gambar 2. Pola difraksi XRD katalis TiO2 Degussa P25 dan ZnO/TiO2 dengan
variasi loading 0.5% + # 33.5% o 1% P25 5%
Tabel 3. Hasil Karakterisasi XRD pada katalis TiO2 Degussa P25 dan ZnO/TiO2
Ukuran Kristal (nm) Komposisi
TiO2 (%berat)
Sampel
Anatase Rutil ZnO Anatase Rutil
Degussa P25 20 23 0 79,2 20,8 0.5% ZnO/TiO2 90 0 164 98,8 1,2 1% ZnO/TiO2 81 0 0 98,7 1,3 5% ZnO/TiO2 73 0 182 98,8 1,2 33.5% ZnO/TiO2 54 147 205 81,6 18,4 3.2 Reaksi Fotokatalisis
Reaksi fotokatalisis dilakukan pada proses pengolahan limbah Cr(VI), fenol dan Hg(II). Kondisi operasi dari proses reaksi yang diatur untuk mendapatkan hasil optimal diantaranya adalah konsentrasi awal limbah dan pH larutan. Konsentrasi awal limbah yang akan diolah sebesar 40 mg/L. Hal ini berdasarkan atas penelitian yang dilakukan oleh Slamet dkk (2001) yang mendapatkan hasil bahwa konsentrasi awal limbah yang optimum sebesar 40 mg/L [4].
Pada Limbah Cr(VI), larutan diatur pada kondisi pH=2. Pada penelitian yang dilakukan oleh Ku dkk (2001) diperoleh pH=2 merupakan kondisi yang optimal [3]. Sementara untuk larutan fenol dilakukan pada kondisi netral (pH=7). Pada pengolahan limbah secara simultan kondisi larutan diatur pada pH=2. Sedangkan untuk Hg(II) dilakukan pada kondisi pH=12.
3.2.1 Pengaruh dopan ZnO pada katalis TiO2
Faktor yang dapat berpengaruh terhadap aktivitas katalis ZnO/TiO2 adalah loading ZnO yang ditambahkan pada katalis tersebut. Zn-Nitrat untuk mengolah limbah Cr(VI) dan fenol baik secara terpisah dan simultan selanjutnya diuji dengan variasi loading dan data yang diperoleh dapat dilihat pada Gambar 3 dan Gambar 4. 0 10 20 30 40 0 1 2 3 4 5 6 Waktu (Jam) K o n se n tr a si C r(V I) (p p m ) 0.5% ZnO/TiO2 1% ZnO/TiO2 5% ZnO/TiO2 33.5% ZnO/TiO2
TiO2 komersial TiO2 kalsinasi
0 10 20 30 40 0 1 2 3 4 5 6 Waktu, jam K o n s en tr asi f e n o l, m g /L
TiO2 komersial 0.5% ZnO/TiO2 1% ZnO/TiO2
5% ZnO/TiO2 33.5% ZnO/TiO2 TiO2 kalsinasi
Gambar 3. Pengaruh loading ZnO pada (a) reduksi Cr(VI) dan (b) oksidasi fenol
dalam limbah simultan berupa kurva pengaruh waktu terhadap konsentrasi
.
0 20 40 60 80 100 120
Loading ZnO pada TiO2, % berat
K o n ver si C r( V I) , %
Reduksi Cr(VI) pada limbah tunggal Reduksi Cr(VI) pada limbah simultan
0 20 40 60 80 100 120
Loading ZnO pada TiO2, % berat
K o n ver si f e n o l, %
Degradasi fenol pada limbah tunggal Degradasi fenol pada limbah simultan
Gambar 4. Grafik perbandingan pengolahan limbah tunggal dan simultan (a) reduksi Cr(VI), (b)oksidasi fenol (t = 5 jam; pH = 2; konsentrasi katalis : 3 g/L)
Fenomena pengolahan limbah secara simultan dapat dilihat pada Gambar 3, penambahan dopan ZnO dengan loading 0.5% menghasilkan reduksi limbah Cr(VI) maupun degradasi fenol yang optimal. Kehadiran fenol dapat meningkatkan terjadinya reduksi Cr(VI) pada permukaan katalis karena hole yang terbentuk pada pita valensi akan bereaksi dengan OH- membentuk OH* sehingga elektron yang seharusnya berekombinasi membentuk pasangan elektron-hole menjadi kekurangan pasangan h+ akibatnya ketersediaan elektron yang ada di permukaan menjadi lebih banyak. Hal ini mengindikasikan meningkatnya daya reduksi Cr(VI).
Jika dibandingkan antara limbah tunggal dengan simultan, terlihat bahwa proses simultan memiliki efisiensi pengolahan limbah yang lebih tinggi. Hal ini terjadi karena selain ZnO yang berfungsi sebagai donor elektron, penambahan fenol juga menghambat terjadinya rekombinasi elektron-hole karena fenol berfungsi sebagai hole scavenger atau dengan kata lain terjadi perilaku : transfer elektron dari pita konduksi ZnO ke pita konduksi TiO2 yang disinari dan kebalikannya, transfer hole dari pita valensi TiO2 ke pita valensi ZnO sehingga mengurangi laju rekombinasi pasangan tersebut untuk meningkatkan lifetime keduanya pada permukaan fotokatalis dan secara konsekuen peningkatan terjadinya proses redoks dapat diharapkan. Gambar 4 menunjukkan kurva perbandingan antara proses pengolahan limbah secara simultan dan limbah tunggal pada jam ke empat dan ke lima dengan menggunakan katalis TiO2 kalsinasi untuk loading 0% ZnO/TiO2.
0 10 20 30 40 50 0 0.5 1 1.5 2 2.5 3 3.5 4 4.5 W a kt u ( J a m)
Gambar 5. Hasil reduksi Hg(II) dengan katalis 0,5% ZnO/TiO2 (t = 4 jam; pH =
12; konsentrasi katalis = 3 g/L)
0 0,5 1 5 33.5 0 0,5 1 5 33.5
Hasil reduksi limbah Hg(II) dapat dilihat pada Gambar 5 di atas. Pada Gambar 5 terlihat bahwa terjadi penurunan dratis pada jam pertama, dimana Hg(II) terkonversi menjadi Hg(0) sebesar 70,8% (11,7 ppm), namun pada jam berikutnya penurunan yang terjadi tidak signifikan dimana katalis mampu mereduksi Hg(II) hingga terkonversi sebesar 88,8% (4,5 ppm) setelah 4 jam. Penurunan konsentrasi Hg(II) yang lebih kecil dari jam kesatu disebabkan oleh sedikitnya jumlah elektron yang mencapai permukaan katalis untuk mereduksi Hg(II) karena terjadi proses rekombinasi elektron-hole.
Kesimpulan
Dari penelitian yang dilakukan didapatkan kesimpulan, antara lain :
1. Pita serapan TiO2 bergeser ke arah sinar tampak seiring dengan peningkatan loading ZnO. Katalis dengan loading ZnO 33,5% memiliki bandgap yang terkecil yaitu 2,85 eV. Puncak anatase (25,34o) dan rutil (27,42o) muncul pada katalis ZnO/TiO2. Puncak ZnO (31,73o) muncul pada katalis dengan prekursor Zn nitrat.
2. Pada pengolahan limbah tunggal Cr(VI) dan Fenol menunjukkan bahwa katalis 0,5% ZnO/TiO2 memiliki aktivitas optimal dalam mereduksi Cr(VI) sebanyak 100% dan oksidasi fenol sebanyak 97,6%.
3. Pada pengolahan limbah simultan, katalis 0,5% ZnO/TiO2 juga memiliki aktivitas yang paling optimal, yaitu jumlah Cr(VI) yang direduksi 100% dan jumlah Fenol yang berhasil dioksidasi 93,4%.
4. Limbah Hg(II) dapat direduksi hingga 4,5 ppm (88,8%) dengan katalis 0,5% ZnO/TiO2.
5. Kehadiran senyawa organik yaitu fenol dan metanol dapat berfungsi sebagai hole scavenger dan donor elektron sehingga mampu meningkatkan keefektifan reduksi Cr(VI).
Ucapan Terima Kasih
Penulis ingin mengucapkan terima kasih kepada RUT 11 sebagai pemberi bantuan dana terhadap berlangsungnya penelitian ini.
5. Daftar Pustaka
[1] Khalil, L.B., Mourad, W.E., Rophael, M.W., Photocatalytic reduction of environmental pollutant Cr(VI) over some semiconductors under UV/visible light ilumination, Applied Catalyst B: Environtmental, 17:3:267-273, 1998. [2] Dingwangchen, Ray, A.K., Photocatalytic kinetics of phenol and its
derivatives over UV irradiated TiO2, Applied Catalyst B: Environtmental,
23:2-3:143-157, 1999.
[3] Ku, Y., Jung, I., Photocatalytic Reduction Of Cr(VI) in Aqueous Solutions By UV Irradiation with the Presence of Titanium Dioxide, Water Research, vol. 35, No.1, pp. 135-142, 2001.
[4] Riyadi Syakur, “Reduksi Limbah Logam Berat Chromium(VI) dengan