PURIFIKASI PARSIAL DAN KARAKTERISASI ENZIM KITINASE DARI CAIRAN DIGESTIVE GLANDAchatina fulica
SKRIPSI
DWI RESTI NINGRUM
DEPARTEMEN KIMIA
FAKULTAS SAINS DAN TEKNOLOGI UNIVERSITAS AIRLANGGA
ii
CAIRAN DIGESTIVE GLANDAchatina fulica
SKRIPSI
Sebagai Salah Satu Syarat Memperoleh Gelar Sarjana Sains Bidang Kimia pada Fakultas Sains Dan Teknologi
Universitas Airlangga
Disetujui Oleh :
Pembimbing I
Dr. Afaf Baktir, MS NIP. 19561014 19833 2 001
Pembimbing II
Dr. Purkan, M.Si NIP. 19721116 199702 1 001
iii
Judul : Purifikasi Parsial dan Karakterisasi Kitinase dari Cairan Dysgetive GlandAchatina fulica
Penyusun : Dwi Resti Ningrum
Nim : 080810524
Pembimbing I :Dr. Afaf Baktir, MS Pembimbing II : Dr. Purkan, M.Si Tanggal Seminar : 23 Juli 2012
Disetujui oleh :
Pembimbing I,
Dr. Afaf Baktir, MS NIP. 19561014 19833 2 001
Pembimbing II
Dr. Purkan, M.Si NIP. 19721116 199702 1 001
Mengetahui: Ketua Departemen Kimia
Fakultas Sains dan Teknologi Universitas Airlangga
iv
KATA PENGANTAR
Puji syukur kehadirat Allah SWT atas segala rahmat dan hidayah-Nya, sehingga penyusun dapat menyelesaikan skripsi dengan judul “Purifikasi Parsial dan Karakterisasi Kitinase dari Cairan Digestive Gland Achatina fulica
”.
Penyusun menyadari bahwa penulisan proposal ini tidak lepas dari bantuan berbagai pihak, untuk itu penyusun menyampaikan terima kasih kepada:
1. Ibu Dr. Afaf Baktir, MS selaku pembingbing I dan Bapak Dr. Purkan, M.Si selaku pembingbing II yang telah memberikan saran, doa dan bimbingan sampai terselesaikan proposal ini.
2. Bapak Drs. Handoko Darmokoesomo, DEA selaku Dosen Wali yang senantiasa membimbing serta memberikan banyak masukan.
3. Ibu Dr. Alfinda Novi Kristanti, DEA selaku Ketua Departemen Kimia sekaligus ketua prodi S-1 kimia yang senantiasa memberikan dukungan. 4. Bapak, ibu dan adik-adik yang memberikan kasih sayang, doa,
kepercayaan, dan dukungan baik secara moril maupun materi.
5. Teman – teman angkatan 2008 yang senantiasa menemani dalam menuntut ilmu.
Penyusun menyadari bahwa dalam penulisan skripsi ini masih banyak kekurangan, sehingga penyusun mengharapkan kritik dan saran yang membangun demi perbaikan skripsi ini selanjutnya. Penyusun berharap skripsi ini dapat bermanfaat bagi perkembangan ilmu pengetahuan khususnya ilmu biokimia.
Surabaya, Juli 2012 Penyusun
Dwi Resti Ningrum
v
Baktir, MS dan Dr. Purkan, M.Si, Departemen Kimia, Fakultas Sains dan Teknologi, Universitas Airlangga, Surabaya
ABSTRAK
Ekstrak enzim dari digestive gland Achatina fulica diketahui mengandung berbagai jenis enzim hidrolase, salah satunya kitinase. Kitinase memiliki banyak kegunaan dalam berbagai bidang industri, diantaranya makanan, medis dan pertanian.
Penelitian ini bertujuan untuk melakukan pemurnian parsial ekstrak enzim kitinase dari digestive gland Achatina fulica menggunakan aseton. Optimasi prosentase aseton dilakukan untuk mendapatkan fraksi dengan aktivitas spesifik tertinggi. Aktivitas spesifik kitinase sesudah fraksinasi dibandingkan dengan ekstrak tanpa fraksinasi. Aktivitas spesifik yang paling banyak terkumpul ada pada fraksi 45-70. Terdapat peningkatan aktivitas spesifik sebesar 6,45 kali dari ekstrak sebelum difraksinasi. Fraksi ini memiliki suhu optimum pada 37o C dan pH optimum 7.
vi
Faculty, Airlangga University, Surabaya
ABSTRACT
The Enzyme from the digestive gland extracts of Achatina fulica is known contain various types of hydrolase enzymes, one of them is chitinase. Chitinase has many benefit for various industries, they are including food, medicine and agriculture. The objective of reseach to perform a partial purification chitinase enzyme of digestive gland extract of Achatina fulica using acetone. Optimization of the percentage acetone carried out to obtain the highest specific activity from each fraction. Chitinase specific activity after fractination is compared to extracts without fractionation. Specific activity of the most collected there in 45-70 fraction. There is an increase of 6.45 times the specific activity of without fractionation. This fraction has a temperature optimum at 37oC and optimum pH 7.
Keyword : Achatina fulica, chitinase, acetone fractionation, purification enzyme
vii
2.3 Metode Pemurnian Enzim ... 13
2.3.1 Fraksinasi aseton ... 13
2.3.2 Fraksinasi Amonium sulfat ... 15
2.3.3 Kromatografi ... 16
2.3.3.1 Kromatografi penukar ion ... 16
2.3.3.2 Kromatografi afinitas ... 17
2.3.3.3 Kromatografi filtrasi... 17
2.3.3.4 Kromatografi hidrofob ... 17
2.4 Koloidal Kitin... 18
2.6 Bekicot (Achatina fulica) ... 19
viii
BAB III M ETODE PENELTIAN ... 22
3.1 Tempat dan Waktu Penelitian ... 22
3.2 Alat dan Bahan Penelitian ... 22
3.2.1 Alat-alat penelitian ... 22
3.2.2 Bahan-bahan penelitian ... 22
3.3 Diagram Alir Penelitian ... 23
3.4 Prosedur Penelitian... 23
3.4.1 Pembuatan substrat koloidal kitin ... 23
3.4.2 Karantina Achatina fulica ... 24
3.4.3Panen cairan digestive gland Achatina fulica ... 24
3.4.4 Pembuatan Kurva Progres ... 24
3.4.5 Pembuatan kurva standar koloidal kitin ... 24
3.4.6 Optimasi fraksinasi asteon ekstrak kasar enzim kitinase ... 25
3.4.7 Penentuan kadar protein ... 25
3.4.8 Uji Aktivitas setiap fraksi hasil fraksinasi aseton ... 26
3.4.9 Karakterisasi enzim kitinase ... 27
3.4.9.1 Suhu optimum ... 27
3.4.9.2 pH optimum ... 27
BAB V HASIL DAN PEMBAHASAN 4.1 Pembuatan substrat koloidal kitin ... 28
4.2 Karantina Achatina fulica ... 29
4.3 Panen cairan digestive gland Achatina fulica ... 30
4.4 Pembuatan Kurva Progres ... 31
4.5 Pembuatan kurva standar koloidal kitin ... 32
4.6 Optimasi fraksinasi asteon ekstrak kasar enzim kitinase ... 33
4.7 Penentuan kadar protein ... 35
4.8 Uji Aktivitas setiap fraksi hasil fraksinasi aseton ... 35
4.9 Karakterisasi enzim kitinase ... 40
4.9.1 Suhu optimum ... 40
ix
DAFTAR TABEL
Nomor Judul Tabel Halaman
1. Uji aktivitas kitinase hasil fraksinasi percobaan 1 ... 37
2. Uji aktivitas kitinase hasil fraksinasi percobaan 2 ... 38
3. Uji aktivitas kitinase hasil fraksinasi percobaan 3 ... 38
x
DAFTAR GAMBAR
Nomor Judul Gambar Halaman
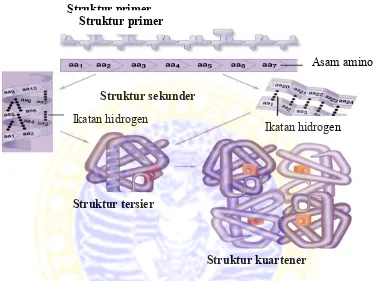
1. Struktur protein primer, sekunder, tersier dan kuartener ... 7
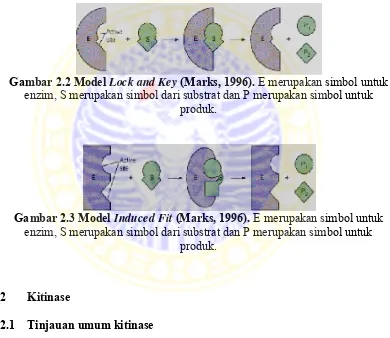
2. Model Lock and Key ... 9
3. Model Induced Fit ... 9
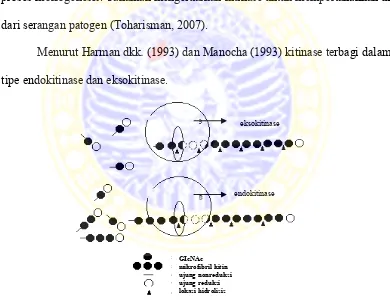
4. Mekanisme kerja enzim eksokitinase dan endokitinase ... 10
5. Struktur kitin ... 12
6. Agregasi protein akibat interaksi muatan berlawanan dari protein satu dengan protein lain ... 14
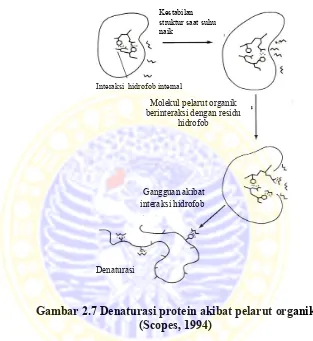
7. Denaturasi protein akibat pelarut organik ... 15
8. Molekul air di sekitar permukaan hidrofobik protein ... 16
9. Anatomi bekicot ... 19
10. Kurva progres ekstrak kitinase ... 31
11. Kurva standar koloidal kitin ... 32
12. Mekanisme kerja enzim kitinase terhadap polimer N-asetilglukosamin ... 36
13. Suhu optimum fraksi 45-70 ... 41
14. pH optimum fraksi 45-70 ... 42
1 BAB I PENDAHULUAN
1.1 Latar Belakang Masalah
Indonesia merupakan negara yang memiliki keanekaragaman flora dan fauna. Hal ini disebabkan oleh kondisi iklim Indonesia yang tropis, sehingga cocok untuk banyak jenis flora dan fauna untuk berkembang biak. Salah satu hewan yang tingkat perkembangbiakannya tinggi adalah Achatina fulica (bekicot).
Achatina fulica dianggap sebagai hama yang dapat menurunkan kualitas
produk panen. Meskipun demikian, Achatina fulica dapat dimanfaatkan untuk makanan dan obat tradisional karena khasiatnya. Namun belum banyak penelitian yang memanfaatkan cairan kelenjar saluran pencernaan (digestive gland) Achatina
fulica. Wheel (1961) menyatakan bahwa ekstrak kelenjar saluran pencernaan
(digestive gland) Achatina fulica memiliki campuran enzim karbohidrase,
meliputi enzim kitinase, xilanase, selulase, hemiselulase, amilase, maltase, dan sukrase. Namun sejauh ini, informasi tentang karakteristik tiap enzim tersebut masih belum dilaporkan, termasuk karakteristik kitinase.
karboksimetil kitin, hidroksietil kitin dan etil kitin. Dalam bidang medis, senyawa-senyawa tersebut dapat digunakan sebagai bahan dasar pembuatan benang operasi, yang mempunyai keunggulan dapat diserap dalam jaringan tubuh, tidak toksik dan dapat disimpan dengan waktu yang lama. Monomer lain dari kitin yaitu N-asetil-D-glukosamin, dapat dimanfaatkan dalam bidang farmasi, obat pengontrol kadar gula dalam darah, suplemen, anti inflamasi dan sebagainya (Herdyastuti dkk., 2009).
Dalam bidang lingkungan, kitinase dimanfaatkan untuk penanganan limbah yang mengandung kitin, seperti pabrik pembekuan udang. Apabila limbah udang dibiarkan mencemari perairan dapat meningkatkan BOD dan COD yang menyebabkan pencemaran lingkungan yang lebih luas. Kitinase menjadi perhatian besar, terutama karena peranannya dalam hidrolisis jamur patogen. Enzim kitinase banyak digunakan untuk pengendalian hayati (Sahai dan Manocha, 1993). Kitinase sering dimanfaatkan sebagai agen biokontrol, terutama tanaman yang terserang jamur patogen. Jamur memiliki komponen utama penyusun dinding sel, salah satunya adalah kitin yang dapat dihidrolisis oleh kitinase. Dalam dua dekade terahir banyak dikaji mengenai enzim kitinase sebagai antifungi. Sebagai contoh, kitinase dari Tricodema banyak digunakan sebagai antifungi yang efektif terhadap serangan Rhizoctonia solani pada tanaman kapas dan Fusarium pada tanaman strawberi (Wang dkk., 2003).
Kitinase juga berperan dalam lisisnya biofilm jamur patogen Candida
albicans. Biofilm adalah matriks polimer ekstraseluler yang terbentuk dari suatu
komunitas mikroba terstruktur dan memiliki fenotip yang berbeda dari plantonik
dan sel bebasnya (Douglas, 2006). Dinding sel Candida albicans mengandung β-1,3-glukan, β-1,6-glukan dan kitin (Marti´nez dkk., 1998). Berdasarkan penelitian yang sudah dilakukan Kamiliyah (2011), ekstrak enzim Achatina fulica memiliki daya hambat yang lebih tinggi terhadap biofilm Candida albicans jika dibandingkan dengan perlakuan ekstrak kayu manis yaitu sebesar 22,81%. Dari hasil penelitian tersebut, diketahui bahwa ekstrak enzim Achatina fulica mampu meningkatkan efektivitas daya antifungi ekstrak kayu manis terhadap Candida
albicans sebesar 75%. Hasil ini menunjukkan bahwa di dalam ekstrak enzim siput
mengandung enzim-enzim yang mampu menghidrolisis biofilm maupun dinding
sel Candida albicans.
Suatu enzim yang diambil dari alam masih bercampur dengan pengotor lain. Untuk mengurangi atau menghilangkan pengotor tersebut melalui cara pemurnian. Pemurnian dilakukan untuk meningkatkan aktivitas spesifik dari suatu enzim. Aseton merupakan salah satu pelarut organik yang biasa digunakan dalam pemurnian enzim. Di samping pelarut organik, pemurnian juga dapat dilakukan dengan fraksinasi dengan amonium sulfat. Kelebihan fraksinasi aseton dibanding dengan fraksinasi amonium sulfat adalah tidak perlu adanya perlakuan yang rumit untuk menghilangkan garam yang tersisa. Dalam hal ini, fraksinasi aseton dilakukan pada suhu -20oC (Thermo Fisher Scientific, 2009).
pH optimumnya dalam keadaan murni parsial untuk tujuan aplikasi dalam kondisi kemurnian parsial.
1.2 Rumusan Masalah
Berdasarkan latar belakang yang telah diuraikan, maka dibuat rumusan masalah sebagai berikut.
1. Pada fraksi manakah aktivitas kitinase pada ekstrak enzim dari
digestive gland Achatina fulica terkumpul pada proses fraksinasi
aseton ?
2. Berapakah peningkatan kemurnian ekstrak enzim kitinase setelah difraksinasi dengan aseton ?
3. Bagaimana karekteristik terkait dengan pH dan suhu optimum ekstrak enzim kitinase dari Achatina fulica ?
1.3 Tujuan
Tujuan dari penelitian ini adalah melakukan pemurnian parsial ekstrak enzim kitinase digestive gland Achatina fulica menggunakan aseton.
Adapun tujuan khusus dari penelitian ini adalah sebagai berikut.
1. Menentukan fraksi aseton yang optimum dari fraksinasi aseton. 2. Menghitung peningkatan kemurnian ekstrak enzim kitinase setelah
fraksinasi aseton.
3. Menentukan karakteristik terkait pH dan suhu optimum enzim kitinase dari Achatina fulica.
1.2 Manfaat
BAB II
TINJAUAN PUSTAKA
2.1 Enzim
Enzim merupakan unit fungsional yang termasuk dalam protein dari metabolisme sel yang disusun oleh rantai-rantai polipeptida. Enzim berfungsi untuk mempercepat reaksi spesifik tanpa pembentukan produk samping. Enzim tidak mengubah titik kesetimbangan reaksi yang dikatalisis. Enzim memilki berat molekul yang berkisar dari 12.000 sampai lebih dari 1 juta. Enzim memilkiki spesifitas terhadap substrat. Substrat adalah substansi yang mengalami perubahan kimia setelah bereaksi dengan enzim, sedangkan produk adalah substansi baru yang terbentuk setelah setelah reaksi (Voet dan Voet, 2004).
Enzim mengikat molekul substrat membentuk kompleks enzim-substrat yang bersifat sementara, yang terurai membentuk enzim bebas dan produknya. Enzim menyebabkan berlangsungnya reaksi kimia dengan mengarahkan subtrat ke sisi katalitik. Aktifitas enzim dipengaruhi oleh beberapa faktor yaitu pH, konsentrasi substrat dan enzim, adanya aktivator dan inhibitor (Lehninger, 1998). Reaksi enzimatis hanya bekerja pada suhu dan pH tertentu (Stryer, 2002).
2.1.1 Struktur enzim
Enzim merupakan protein globular yang memilki struktur primer, sekunder, tersier, dan kuartener. Struktur primer terbentuk dari ikatan kovalen antar residu-residu asam amino yang berurutan membentuk ikatan peptida. Struktur sekunder terbentuk dari ikatan hidrogen antara atom O dari gugus
Struktur primer
6
karbonil (C=O) dengan atom H (N-H) dalam satu rantai polipeptida. Dalam struktur sekunder, struktur protein dibagi menjadi dua yaitu β-sheet dan heliks (Bondanszky, 1998).
Gambar 2.1 Struktur protein primer, sekunder, tersier dan kuartener Struktur tersier merupakan struktur protein yang paling stabil, karena terdapat ikatan yang dapat menstabilkan protein itu sendiri. Jenis ikatan-ikatan tersebut adalah: ikatan hidrogen antara gugus R residu asam amino rantai samping yang berdekatan, ikatan ion diantara gugus R yang berlawanan, interaksi hidrofobik dari gugus R asam amino hidrofobik dan ikatan kovalen berupa ikatan disulfida dari sistein (Ottoway dan Apps, 1984)
Struktur kuartener terbentuk karena adanya interaksi beberapa rantai polipeptida yang membentuk oligomer. Oligomer berinteraksi kembali melalui ikatan ionik, van der waals dan ikatan hidrofobik (Bodanszky, 1998).
Struktur primer
Asam amino
Struktur sekunder
Ikatan hidrogen Ikatan hidrogen
Struktur tersier
2.1.2 Mekanisme kerja enzim
Proses awal katalisis enzim adalah pembentukan kompleks antara enzim dan substrat. Substrat diikat pada daerah yang dinamakan sisi aktif enzim. Reaksi kimia yang terjadi dalam kompleks enzim substrat tersebut dapat dilanjutkan dengan pelepasan produk dan enzim.
Mekanisme katalisis enzim melibatkan gugus fungsi yang terdapat pada sisi aktif enzim. Sisi aktif enzim adalah tempat pengikatan substrat yang mengandung residu asam amino yang berperan dalam pembuatan dan pemutusan ikatan selama proses katalisis. Ikatan – ikatan yang terjadi antara enzim dan substrat adalah ikatan elektrostatik, ikatan hidrogen, gaya Van Der Walls ataupun interaksi hidrofobik. Gugus yang terlibat dalam proses pengikatan substrat disebut gugus pengikat (binding group). Gugus yang terlibat dalam proses katalitik antara enzim dan substrat disebut gugus katalitik (catalytic group). Gugus katalitik terletak pada gugus samping enzim (Poedjiadi, 1994).
Terdapat dua model interaksi enzim dan substrat, yaitu :
1. Model Lock and Key : dikemukakan oleh Emil Fischer. Pada model ini, substrat memiliki daerah polar (- dan +) dan non polar (H, hidrofobik) diletakkan pada sisi aktif yang memiliki muatan komplementer dari substrat tersebut. Model Lock and Key menerangkan adanya kesesuaian ukuran atau bentuk substrat terhadap sisi aktif enzim. Substrat yang tidak cocok bentuknya dengan sisi aktif enzim, baik karena terlalu besar maupun karena terlalu kecil tidak dapat terikat pada sisi aktif (Marks, 1996).
2. Pada model Induced Fit : dikemukakan oleh Koshland. Pada model ini, senyawa-senyawa yang lebih besar atau lebih kecil dari substrat yang asli masih dapat berinteraksi dengan sisi aktif enzim. Sisi aktif yang pada awalnya belum sesuai dengan bentuk substrat, akan terinduksi dan menyesuaikan dengan bentuk substrat setelah substrat menempel pada sisi aktif. Sehingga sisi aktif bersifat fleksibel (Marks, 1996).
Gambar 2.2 Model Lock and Key (Marks, 1996). E merupakan simbol untuk
enzim, S merupakan simbol dari substrat dan P merupakan simbol untuk produk.
Gambar 2.3 Model Induced Fit (Marks, 1996). E merupakan simbol untuk
enzim, S merupakan simbol dari substrat dan P merupakan simbol untuk produk.
2.2 Kitinase
2.2.1 Tinjauan umum kitinase
Enzim kitinase dihasilkan oleh bakteri, fungi, tanaman, dan hewan (Toharisman, 2007). Kitinase juga disintesis oleh protozoa, saluran pencernaan nematode, polikhaeta dan mollusca. Kitinase juga ditemukan dalam lendir pencernaan burung-burung pemakan seranga, lendir pencernaan dan pangkreas ikan, amfibi dan reptil pemakan serangga (Yurnaliza, 2002). Bakteri mengeluarkan kitinase sebagai sarana memperoleh nutrisi dan agen parasitisme, sementara fungi, protozoa dan invertebrata mengeluarkan enzim tersebut untuk proses morfogenesis. Tanaman mengeluarkan kitinase untuk mempertahankan diri dari serangan patogen (Toharisman, 2007).
Menurut Harman dkk. (1993) dan Manocha (1993) kitinase terbagi dalam tipe endokitinase dan eksokitinase.
Gambar 2.4 Mekanisme kerja enzim eksokitinase dan endokitinase (Sahai & Manocha, 1993).
Aplikasi kitinase yang banyak digunakan adalah sebagai agen biokontrol. Telah dilaporkan Brurberg dkk. (1996), bahwa ChiA dan ChiB Serratia
marcescens yang telah ditransformasikan ke E.coli memiliki kemampuan untuk
GIcNAc
mengontrol jamur tanaman yang bersifat patogen, sebagai contoh adalah dapat mengurangi penyakit dari Rhizoctonia solani yang menyebabkan akar tebu membusuk.
Senyawa- senyawa hasil degradasi kitinase pada kitin membentuk oligomernya seperti karboksimetil kitin, hidroksietil kitin dan etil kitin. Dalam bidang medis, senyawa-senyawa tersebut digunakan sebagai bahan dasar pembuatan benang operasi yang memilki keunggulan dapat diserap dalam jaringan tubuh, tidak toksik dan dapat disimpan dengan waktu yang lama. Monomer kitin, N-asetil-D-glukosamin dapat dimanfaatkan untuk obat pengontrol darah dan suplemen anti inflamasi. Selain itu, N-asetil-D-glukosamin dapat membantu mengurangi hiperpigmentasi aktivitas enzim tirosin yang berperan dalam produksi melanin.
Gambar 2.5 Struktur kitin. Satu unit kitin terdiri dari monomer N-asetilglukosamin
Di alam, kitin banyak ditemukan pada sel jamur dan eksoskeleton dari serangga dan krustasea (Cohen-Kupiec dan Chet, 1998). Kitin pada jamur berbentuk mikrofibril yang memiliki panjang yang berbeda tergantung pada spesies dan lokasi selnya. Mikrofibril merupakan struktur utama dari struktur dinding sel jamur terdiri atas jalinan rantai-rantai polisakarida yang saling bersilangan membentuk anyaman. Jalinan ini kuat berikatan pada matriks (Cabib, 1987). Dalam hal ini kitinase berperan sebagai penghidrolisis dinding sel jamur dan matriks jamur patogen.
2.2.2 Pengukuran aktivitas kitinase
Pengukuran aktivitas kitinase dapat dilakukan dengan beberapa cara seperti yang disebutkan dalam Jeaniaux (1966) dan Cabib (1987) :
a. Berdasarkan pengurangan substrat.
1). Metode viskosimetri, yaitu aktivitas kitinase terhadap kitosan, glikol kitin atau karboksimetilkitin yang diukur berdasarkan terjadinya pengurangan viskositas substrat.
2). Metode turbidimetri, yaitu mengukur perbedaan turbiditas suspensi koloidal sebelum dan setelah kitinolisis. Pengukuran ini bersifat cepat dan akurat. Contoh pada pengukuran aktifitas enzim endokitinase.
b. Berdasarkan pembentukan produk akhir reaksi hidrolilis kitin yaitu GlcNAc. GlcNAc atau N-asetilglukosamin yang dibebaskan dari kitin ditentukan secara kolorimetrik dengan p-dimetilaminobenzaldehida. Satu unit aktivitas kitinase dinyatakan sebagai μmol GlcNAc yang dibebaskan selama 1 jam dalam kondisi yang ditetapkan.
c. Spectrometer Assay yaitu menggunakan kromogen 3,4, dinitrophenil tetra
N-asetilkhitotetraose.
2.3 Metode Pemurnian Enzim
Ekstrak enzim belum 100 % terdiri atas protein enzim yang diinginkan, sehingga perlu pemurnian untuk memisahkan dari pengotor. Pemurnian dapat dilakukan dengan beberapa cara yaitu : pengendapan protein melalui fraksinasi dengan amonium sulfat atau pelarut organik dan kromatografi (Scopes, 1994). Adapun metode kromatografi terdapat berbagai macam, diantaranya kromatografi penukar ion, afinitas, filtrasi, dan hidrofob.
2.3.1 Fraksinasi aseton
molekul pelarut organik. Pada fakta penelitian menggunakan fraksinasi dengan pelarut organik, disimpulkan bahwa aseton sesuai digunakan untuk pemurnian protein.
Gambar 2.6 Agregasi protein akibat interaksi muatan berlawanan dari molekul protein satu dengan molekul protein lain
(Scopes, 1994)
Faktor utama penyebab agregasi molekul protein oleh aseton adalah ikatan elektrostatik dan kekuatan dipolar. Keberadaan aseton dalam larutan protein menyebabkan agregasi antara muatan yang berlawanan dari permukaan molekul protein satu dan protein yang lain. Proses presipitasi dengan pelarut organik terjadi pada keadaan elektrostatik protein. Molekul protein besar akan lebih mudah beragregasi karena memiliki perbedaan muatan yang tinggi. Molekul yang besar akan segera teragregasi karena terjadi perubahan yang besar dari muatan permukaan protein satu dengan protein yang lain.
bagian hidrofob pelarut organik
Dalam fraksinasi aseton, suhu harus di bawah 0oC pada saat sampel preparasi maupun pada saat fraksinasi. Pada suhu di atas 10oC, protein mengalami denaturasi.
Gambar 2.7 Denaturasi protein akibat pelarut organik (Scopes, 1994)
Pada saat temperatur tinggi, molekul dari pelarut organik masuk ke dalam protein melalui permukaannya, kemudian berinteraksi dengan residu hidrofobik dari protein. Interaksi tersebut menyebabkan protein mengalami denaturasi.
2.3.2 Fraksinasi amonium sulfat
Fraksinasi amonium sulfat merupakan salah satu teknik pemurnian protein yang biasa dilakukan. Pemurnian dengan metode ini menggunakan prinsip agregasi protein molekul bagian permukaan hidrofobik dari protein.
Molekul pelarut organik berinteraksi dengan residu
hidrofob Interaksi hidrofob internal
Kestabilan struktur saat suhu naik
Gangguan akibat interaksi hidrofob
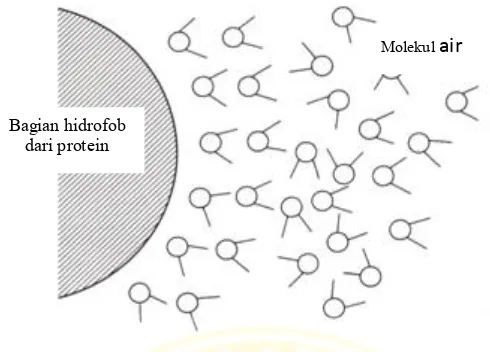
Gambar 2.8 Molekul air di sekitar permukaan hidrofobik protein (Scopes, 1994)
Pada saat ion garam terlarut, akan mengurangi pelarut air yang terdapat di antara bagian hidrofobik molekul-molekul protein, sehingga molekul air tersebut menjadi berkurang. Hal ini karena ion garam menarik molekul air yang berada di sekitar bagian hidrofobik. Bagian permukaan hidrofobik protein satu akan berikatan dengan bagian permukaan hidrofobik yang lain, kemudian saling beragregasi dan protein mengendap (Scopes, 1994).
2.3.3 Kromatografi
2.3.3.1 Kromatografi penukar ion
Berdasar muatannya, kromatografi penukar ion dibagi menjadi dua yaitu penukar kation dan penukar anion. Kromatografi penukar kation menggunakan penukar kation yang bermuatan negatif, sebagai contoh adalah
carboxymethyl-cellulose (CM-cellulose). Sedangkan penukar anion menggunakan resin penukar
anion yang bermuatan positif, sebagai contoh adalah diethylaminoethyl-cellulose
(DEAE-cellulose). Protein harus memiliki muatan yang berbeda dengan penukar
Bagian hidrofob dari protein
Molekul air
ionnya. Penambahan Tris-Cl meningkatkan kekuatan ion pada bufer yang mengalir pada kolom kromatografi (Scopes, 1994).
2.3.3.2 Kromatografi afinitas
Prinsip kromatografi afinitas adalah ligan terimobilisasi pada kolom. Sampel protein yang dilewatkan pada kolom, akan terjadi interaksi spesifik antara protein target dengan ligan, yang menyebabkan protein target dapat terpisah dari protein pengotor. Ligan berikatan kovalen dengan backbone matrix. Hanya enzim dengan afinitas spesifik yang akan terikat pada adsorben melalui interaksi dengan ligannya (Scopes, 1994).
2.3.3.3 Kromatografi filtrasi
Pemisahan dengan metode kromatografi filtrasi didasari oleh ukuran molekul protein dan perbedaan ukuran material pembatas pada matriks. Matriks yang biasa digunakan adalah selulosa dan dekstran. Molekul protein berukuran kecil akan terperangkap di dalam matiks, sedangkan molekul yang lebih besar dari ukuran matriks akan bebas dan keluar dari kolom kromatografi (Scopes, 1994).
2.3.3.4 Kromatografi hidrofob
Interaksi protein dengan adsorben hidrofobik adalah sebuah ikatan hidrogen atau ikatan elektrostatik. Kekuatan ikatan hidrogen menentukan kekuatan interaksi hidrofobik. Jika dibandingkan dengan kromatografi penukar ion, pemisahan protein menggunakan kromatografi hidrofobik akan lebih bagus. Kolom kromatografi ini terdiri dari selulosa atau dekstran. Kromatografi hidrofob memiliki kesamaan dengan presipitasi amonium sulfat, yaitu menggunakan prinsip salting-out (Scopes, 1994).
2.4 Koloidal Kitin
Koloidal kitin adalah kitin yang banyak digunakan sebagai substrat dalam medium fermentasi. Senyawa ini diperoleh dengan menghidrolisis secara parsial kitin dengan larutan asam klorida (HCl) 10 N (Chernin dkk., 1995). Untuk menetralkan kembali kitin yang sudah dihidrolisis dengan HCl 10 N, ditambahkan NaOH 10 N.
2.5 Achatina fulica
Achatina fulica merupakan bekicot asli dari Afrika Timur. Berbagai nama
sebutan untuk Achatina fulica diantaranya adalah Giant African Snail (GAS),
Agate snail, Schnecke, African snail, African giant, Kalutara, Caracol gigante
africano, Acatina africana, Gran caracol africano, Escargot géant africain,
Achatine de Madagascar (FAO, 1989).
Berikut ini merupakan klasifikasi Achatina fulica (Wallace, 2002) Kingdom : Animalia
Phylum : Mollusca Class : Gastropoda
ginjal Order : Pulmonata
Family : Achatinidae Genus : Achatina
Species : Achatina fulica
Achantina fulica merupakan hewan yang tergabung dalam kelas
gastropoda. Bagian tubuhnya terbagi atas empat bagian utama yaitu kepala, leher, kaki, serta alat-alat dalam. Kepala Achatina fulica memiliki sepasang tentakel pendek yang berfungsi sebagai indera pembau dan sepasang tentakel panjang yang berfungsi sebagai indera penglihatan. Di bawah kepalanya terdapat kelenjar muksosa yang berfungsi menghasilkan lendir. Anatomi Achatina fulica dapat dilihat pada gambar berikut :
Gambar 2.9 Anatomi Achatina fulica
Cangkang Achatina fulica berfungsi sebagai rumah atau pelindung badan untuk mempertahankan diri dari musuh (Santoso, 1989). Achatina fulica berjalan menggunakan otot perutnya. Pada saat kondisi lembab atau basah, Achatina fulica
mata
tentakel
mulut
ganglia otak tembolok tali saraf
akan aktif. Sedangkan pada kondisi lingkungan yang kering, Achatina fulica cenderung bersembunyi di bawah permukan tanah atau di dalam cangkangnya. Hasil panen berupa daun atau bunga merupakan makanan yang cocok bagi perkembangan Achatina fulica. Achatina fulica hidup di kondisi tanah yang bersih dari sampah anorganik. Achatina fulica merupakan hewan invertebrata yang hemaprodit. Achatina fulica bertelur pada saat usia satu tahun. Dalam kondisi optimum, Achatina fulica dapat bertelur hingga empat kali dalam setahun (Mead, 1979).
Ekstrak enzim merupakan gabungan beberapa enzim yang melakukan
aktivitas bersama akan tetapi masing-masing enzim yang tergabung didalamnya tetap berdiri sendiri. Achatina fulica yang berasal dari eropa timur (Helix pomatia) dilaporkan memiliki kandungan ekstrak enzim yang terdiri dari enzim β-1,3-glukanase, enzim β-1,4-glukanase dan kitinase (Gabriel dan Kopecka, 1987).
Helix pomatia dan Achatina fulica memiliki kesamaan dalam makanan yang
dikonsumsi yaitu berupa dedaunan atau batang pohon yang mengandung glukan, selulosa, dan kitin (Kay, 1986). Sehingga Achatina fulica juga memiliki enzim yang terdapat pada Helix pomatia yaitu 1,3-glukanase, 1,4-glukanase dan β-1,4-glukanhidrolase. β-1,3-glukanase. Wheel (1961) menyatakan bahwa ekstrak kelenjar saluran pencernaan (dygestive gland) Achatina fulica memiliki campuran enzim karbohidrase yaitu berupa enzim kitinase, xilase, selulase, hemiselulase, amilase, maltase, dan sukrase. Disamping itu, dygestive gland Achatina fulica mengandung enzim protease, dan polipeptidase. Enzim kitinase mampu
menghidrolisis kandungan kitin yang terdapat dalam biofilm maupun dinding sel jamur patogen.
2.7 Turbidimetri
Teknik spektroskopi dapat digunakan dalam menentukan struktur molekul suatu senyawa. Terdapat banyak teknik spektroskopi yang sering digunakan dalam pengukuran aktivitas enzim diantatanya adalah spektrofotometri UV-Vis dan turbidimetri (Eisenthal, 2002).
22
BAB III
METODE PENELITIAN
3.1 Waktu dan Tempat Penelitian
Penelitian ini dilakukan di laboratorium Biokimia Fakultas Sains dan Teknologi, Universitas Airlangga, mulai bulan Februari 2012 sampai dengan bulan Juni 2012.
3.2 Alat dan Bahan Penelitian
3.2.1 Alat-alat penelitian
Alat-alat yang digunakan dalam penelitian ini adalah seperangkat alat gelas yang biasa digunakan di laboratorium kimia, pHmeter dan termometer. Sedangkan instrumen yang digunakan adalah timbangan analitik (Ohaus), lemari pendingin (Toshiba Glasio), lemari pendingin -20oC (Royal), sentrifuga (Universal 320R Zentrifugen), dan spektrofotometer VIS (Pharmaspec UV-1700 Shimadzu).
3.2.2 Bahan-bahan penelitian
Bahan-bahan yang digunakan dalam penelitian ini adalah Achatina fulica, kitin, akuades, aseton, HCl 10N, NaOH 10N, NaH2PO4.2H2O, asam sitrat, Na2HPO4.2H2O.
3.3 Diagram Alir Penelitian Fakultas Sains dan Teknologi, Universitas Airlangga. Kitin dilarutkan dalam 100 ml HCl 10 N lalu didiamkan selama 24 jam pada suhu 4oC, kemudian larutan
Data uji aktivitas Data kadar
protein
Data uji aktivitas
Uji aktivitas Penentuan kadar protein
hingga mencapai pH 7. Kemudian disentrifugasi dengan kecepatan 6000 rpm selama 20 menit hingga berbentuk koloid. Selanjutnya, koloid diresuspensi menggunakan akuades, disentrifugasi selama 15 menit dan disimpan pada suhu 4oC (Rochima, 2006).
3.4.2 Karantina Achatina fulica
Achatina fulica dikarantina dalam kandang yang tidak terkena sinar matahari langsung. Kelembaban kandang senantiasa dijaga dengan cara memberi air ke dalam kandang namun tidak terlalu banyak. Achatina fulica diberi makanan berupa dedaunan dan sayur setiap hari minimal selama satu minggu.
3.4.3 Panen cairan disgetive gland Achatina fulica
Cangkang bagian belakang Achatina fulica dipecah, lalu cairan yang keluar ditampung. Cairan digestive glandAchatina fulica yang sudah ditampung, disentrifugasi dengan kecepaatan 4000 rpm. Jika terdapat endapan dan supernatan, maka supernatan merupakan crude enzim Achatina fulica.
3.4.4 Pembuatan kurva standar koloidal kitin
Koloidal kitin yang sudah tersedia dilarutkan ke dalam bufer fosfat 50 mM pH 7. Larutan induk dibuat dari koloidal kitin 0,25 % b/v. Untuk kadar koloidal kitin selanjutnya dibuat dari pengenceran koloidal kitin induk.
3.4.5 Pembuatan kurva progres
Disiapkan enam tabung ependorf yang bersih. Ke dalam masing-masing tabung, dimasukkan sejumlah 200 μl enzim kitinase dan 800 μl substrat kitin. Masing-masing tabung diinkubasi dengan waktu yang berbeda. Pada tabung
pertama diinkubasi selama 10 menit, ke-dua diinkubasi 20 menit dan seterusnya hingga tabung ke-enam. Setelah diinkubasi, diukur OD (Optical Density) pada masing-masing sampel.
3.4.6 Optimasi fraksinasi aseton ekstrak kasar enzim kitinase
Fraksinasi aseton dilakukan pada kisaran prosentase 50 hingga 70. Fraksinasi pertama, ekstrak enzim kitinase sebanyak 20 ml ditambahkan 50% aseton, kemudian disentrifugasi, sehingga didapatkan residu fraksi 0-50% dan supernatan. Fraksinasi ke-dua, supernatan diambil dan ditambahkan aseton hingga 70%, kemudian disentrifugasi, sehingga didapatkan residu fraksi 50-70% dan supernatan.
Setiap endapan yang terbentuk pada masing-masing fraksi selanjutnya dilakukan pengukuran aktivitas unit dan aktivitas spesifik kitinase. Apabila dalam tahap fraksinasi ini belum terjadi pemisahan kitinase secara baik, yang ditandai dengan nilai aktivitas kitinase yang masih menyebar, maka perlu dilakukan optimasi variasi prosentase aseton pada prosedur fraksinasi.
3.4.7 Penentuan kadar protein
dengan 50 ml larutan B. Sedangkan larutan D dibuat dari 10 ml reagen fenol Folin-Ciocalteu ditambah dengan 10 ml akuades.
Tahap pengukuran kadar protein dari enzim kitinase adalah, sebanyak 0,5 ml sampel enzim ditambah 2,5 ml larutan C. Hasil dari pencampuran keduanya divortex. Kemudian ditambah dengan 0,25 ml larutan D, setelah itu diinkubasi selama 20 menit, kemudian OD (Optical Density) dibaca pada λ750.
3.4.8 Uji aktivitas enzim kitinase setiap fraksi hasil fraksinasi aseton
Sejumlah 200 μl enzim kitinase ditambah dengan 800 μl substrat kitin (0,25% kolodial kitin b/v dalam 50 mM bufer fosfat pH 7). Campuran diinkubasi pada suhu 37oC selama 20 menit, kemudian dilakukan pengukuran aktivitas kitinase.
Larutan standar kitin dibuat dari larutan koloidal kitin dengan berbagai konsentrasi. Larutan standar pertama dibuat 0,25% b/v koloidal kitin yang dilarutkan dalam bufer fosfat (pH 7) di dalam labu ukur 10 ml. Larutan standar ke dua dibuat dari 0,25% b/v koloidal kitin yang ditambahkan bufer fosfat dengan volume dan pH yang sama. Larutan standar dibuat hingga medapatkan tujuh konsentrasi. Setelah itu, larutan standar diukur dengan spektrofotometer pada λ 660 nm (Kim, 2003).
Satu unit aktivitas adalah jumlah enzim yang menghidrolisis kitin 0,001% (b/v) permenit permili dalam kondisi percobaan. Aktifitas kitinase diukur berdasarkan pengukuran substrat yang dihidrolisis dari substrat awal oleh enzim kitinase. Pengukuran aktivitas menggunakan metode turbidimetri yang menggunakan alat spektrofotometer UV-Vis. OD (Optical Density) setiap sampel
diukur pada λ 660 nm (Kim, 2003) dan suhu kamar selama 20 menit. OD (Optical
Density) yang diperoleh dikonversi menjadi konsentrasi. Adapun perhitungannya
adalah,
Sisa koloidal kitin = koloidal kitin awal – koloidal kitin terhidrolisis
3.4.9 Karakterisasi enzim kitinase 3.4.9.1 Suhu optimum
Disiapkan 5 buah tabung bersih dan kering. Pada masing-masing tabung dimasukkan kitinase kasar sebanyak 200 μl, dan ditambah dengan 800 μl substrat kitin (0,25% kolodial kitin b/v dalam 50mM bufer fosfat pH 7) dengan volume 4 ml. Masing-masing tabung diinkubasi 20 menit pada suhu yang berbeda-beda, yaitu 30oC, 37oC, 40oC, dan 50oC selama 20 menit. Rentang suhu yang digunakan dalam pengukuran suhu optimum didasarkan pada penelitian dari Yong dkk.(2005), bahwa kitinase stabil pada suhu 25-50oC.
3.4.9.2 pH optimum
28
HASIL DAN PEMBAHASAN
4.1 Pembuatan Substrat Koloidal Kitin
Kitin dibangun oleh unit-unit monomer N-asetilglukosamin (GlcNAc) yang tergabung secara linier melalui ikatan β (1,4). Rantai kitin yang satu dengan yang lainnya digabungkan oleh ikatan hidrogen, yaitu antara H pada gugus NH dari satu rantai dengan O pada gugus C=O dari rantai lain yang berdekatan. Ikatan hidrogen ini menyebabkan kitin membentuk formasi serabut (fibril) dan tidak dapat larut dalam air. Kitin tidak dapat larut air, pelarut organik, alkali pekat, asam mineral encer, tetapi larut dalam asam-asam mineral yang pekat (Yurnaliza, 2002).
Substrat koloidal kitin dalam penelitian ini dibuat dari limbah kulit udang sebagai
sumber kitin. Berdasarkan metode Chernin dkk (2003), pembuatan koloidal kitin terdiri dari dua tahap yang meliputi tahap hidrolisis sebagian kitin dan penetralan. Sebanyak 5 gram kitin dilarutkan dalam 100 ml HCl 10 N. Larutan HCl 10 N termasuk asam mineral yang pekat, sehingga dapat melarutkan kitin. Larutan kitin tersebut bewarna kuning pucat, seperti wana kitin pada saat sebelum dilarutkan. Setelah larut, larutan kitin didiamkan selama 24 jam pada suhu 4oC di lemari es. Tujuan penyimpanan larutan kitin pada suhu 4oC adalah agar pada saat proses penetralan dengan NaOH 10 N tidak menimbulkan reaksi panas yang berlebih. Setelah penyimpanan, larutan disaring untuk menghilangkan pengotor yang ada pada larutan kitin. Larutan tersebut ditambah 50 ml akuades dingin. Hal ini dimaksudkan untuk mengencerkan larutan
ditambah akuades, larutan dinetralkan dengan NaOH 10 N. Penambahan NaOH dilakukan secara perlahan-lahan supaya pH koloidal kitin yang diinginkan tepat netral. Dibutuhkan sebanyak 34 ml volume NaOH untuk dapat menetralkan pH larutan kitin. Pada saat penambahan NaOH pada larutan kitin, terbentuk koloid yang berwarna putih. Setelah pH netral, koloid disentrifugasi selama 20 menit pada suhu 4oC. Tujuan koloid disentrifugasi adalah untuk mendapatkan endapan yang berupa pelet koloidal kitin. Dari 184 koloidal kitin didapatkan sebanyak 10,0227 gram pelet koloidal kitin. Pelet tersebut merupakan sediaan substrat koloidal kitin.
4.2 Karantina Achatina fulica
Achatina fulica dikarantina dalam kandang yang tidak terkena sinar matahari
langsung. Kandang dibuat bagian yang dapat dilalui udara tetapi tetap meminimalkan sinar matahari masuk kedalam. Kelembaban kandang senantiasa dijaga dengan cara memberi air ke dalam kandang namun tidak terlalu banyak. Selain itu pelepah pisang juga berfungsi sebagai hal yang sama. Karantina dilakukan selama minimum satu minggu. Achatina fulica diberi nutrisi berupa dedaunan dan sayuran seperti kubis, daun papaya, daun singkong dan lain-lain. Pemberian makanan dilakukan secara rutin agar kondisi Achatina fulica yang berada dalam kondisi yang homogen.
dikonsumsi setiap hari oleh Achatina fulica. Contoh lain enzim induktif adalah pembentukan enzim beta-galaktosidase pada Escherichia coli yang diinduksi oleh laktosa sebagai substratnya atau derivatnya.
4.3 Panen Cairan Disgetive Gland Achatina fulica
Cairan disgetive gland dari Achatina fulica merupakan ekstrak enzim yang dihasilkan oleh Achatina fulica. Produksi ekstrak enzim diperoleh dari cangkang ekor (apex) Achatina fulica yang dipecah, kemudian cairan yang keluar dari ekor ditampung dalam beker es agar enzim tidak mengalami perubahan aktivitas. Hasil ekstrak enzim berwarna biru tua yang masih tercampur dengan partikel padat dan biomassa sel. Dari 50 ekor Achatina fulica didapatkan sebanyak 30 ml cairan
digestive gland.
Ekstrak enzim disentrifugasi dengan kecepatan 4000 rpm selama 20 menit, terdapat endapan yang merupakan pengotor. Kecepatan 4000 rpm pada sentrrifuga berfungsi mengendapkan pengotor selain protein. Pengotor tersebut adalah partikel padat dan biomassa yang mempunyai masa dan kerapatan yang lebih besar daripada cairannya. Sedangkan supernatan merupakan larutan ekstrak enzim, yang selanjutnya akan dimurnikan secara parsial. Ekstrak enzim disimpan pada suhu dingin dan tertutup agar tidak mudah rusak.
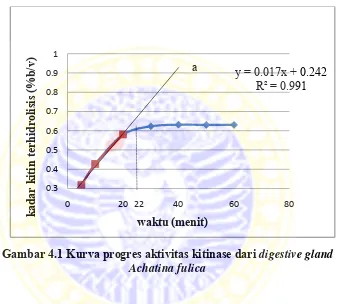
Kurva progres kitinase dibuat dengan tujuan untuk mengetahui waktu inkubasi yang sesuai untuk uji aktivitas enzim kitinase dari digestive gland Achatina
fulica.
Gambar 4.1 Kurva progres aktivitas kitinase dari digestive gland Achatina fulica
Kurva progres merupakan kurva perubahan substrat kitin terhadap waktu. Kurva pada Gambar 4.4 merupakan profil kurva progres dari enzim kitinase. Perubahan substrat terhadap waktu pada awalnya menunjukkan slope yang tinggi (garis a), kemudian slope menurun dimulai dari menit ke-22. Pada lima menit pertama masih sedikit substrat kitin yang dihidrolisis, setelah itu meningkat tajam hingga 20 menit sehingga slope pada kurva tinggi (garis a) yang berarti memilki kecepatan orde 1. Dimulai dari menit ke-22 substrat kitin terhidrolisis menurun dan menjadi nol hingga
menurun karena enzim menjadi jenuh terhadap substrat, pada akhirnya, enzim dihambat oleh produk yang terbentuk. Berdasarkan kurva progres, maka uji aktivitas enzim dilakukan selama 20 menit karena reaksi enzimatis bekerja secara optimum. 4.5 Pembuatan Kurva Standar Koloidal Kitin
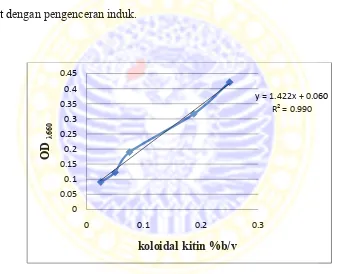
Koloidal kitin dibuat dengan berbagai kadar untuk diukur OD-nya pada λ660. Koloidal kitin induk dibuat dengan kadar 0,25%b/v. kadar koloidal kitin berikutnya dibuat dengan pengenceran induk.
Gambar 4.2 Kurva standar koloidal kitin
Semakin besar kadar koloidal kitin, maka akan semakin besar pula OD yang didapat. Persamaan kurva koloidal kitin y = 1.422x + 0.060 dibuat untuk mengkonversi OD dari setiap jumlah kitin yang terhidrolisis karena aktivitas enzim kitinase.
Pelarut organik untuk fraksinasi protein dipilih berdasarkan pertimbangan dapat larut dengan air dan memilki efek presipitasi yang bagus. Pelarut organik yang biasa digunakan adalah etanol dan aseton (Scopes,1994). Dalam penelitian ini dipilih aseton sebagai pelarut organik untuk fraksinasi, karena aseton lebih mudah untuk dipisahkan dari protein. Selain itu aseton tidak memiliki efek azeotrop sepeti etanol. Azeotrop adalah kesetimbangan uap-cair campuran etanol dengan air, sehingga etanol sulit dipisahkan sempurna, atau hanya dapat dipisahkan melalui destilasi dengan perlakuan tertentu.
Sebanyak 20 ml ekstrak enzim kitinase digestive gland dari Achatina fulica ditambahkan ke dalam aseton yang sudah bersuhu -20oC diaduk menggunakan pengaduk magnet selama 8 menit. Volume aseton yang ditambahkan bergantung pada prosentase fraksinasi yang diinginkan, sesuai dengan tabel fraksinasi Scopes. Suhu harus tetap dijaga selama proses fraksinasi agar tidak di atas 0oC. Hal tersebut dilakukan dengan cara selama proses frakasinasi gelas harus tetap berada di dalam penangas es. Adapun dry es digunakan sebagai penangas es karena dapat menjaga suhu hingga -20oC daripada es batu biasa yang hanya dapat menjaga suhu hingga 0oC dan tidak stabil.
menyesuaikan suhu, sebelum dilakukan proses sentrifugasi. Karena pengondisian suhu alat butuh waktu cukup lama. Apabila pengondisian suhu terjadi pada saat campuran ekstrak enzim dan aseton sudah dimasukkan, maka sudah dipastikan enzim akan rusak. Endapan dan supernatan kemudian dipisahkan. Pada saat aseton diaduk bersama dengan enzim, molekul air yang berada di sekitar area hidrofob pada permukaan enzim didesak oleh aseton, sehingga tetapan dielektrik air menurun. Hal tersebut menyebabkan muatan-muatan molekul enzim berada mendekati permukaan enzim sehingga terjadi gaya tarik-menarik elektrostatik muatan yang berlawanan pada permukaan enzim satu dan yang lain. Tarik-menarik muatan yang berbeda tersebut menyebabkan terjadinya agregasi molekul-molekul enzim. Molekul-molekul enzim yang mengendap merupakan enzim yang sudah dimurnikan secara parsial.
Supernatan digunakan untuk fraksinasi selanjutnya. Sedangkan endapan digunakan untuk uji aktivitas kitinase. Sebelum diuji aktivitasnya, endapan harus benar-benar terbebas dari aseton yang tersisa. Aseton yang tersisa dihilangkan dengan cara mengangin-anginkan di suhu ruangan, tetapi masih dalam lingkungan yang steril. Pada permukaan endapan masih terdapat aseton sisa. Untuk menghilangkannya, diserap dengan kertas saring yang sudah disterilkan. Penghilangan aseton dimaksudkan untuk meminimalisasi denaturasi enzim pada permukaan endapan. Endapan yang terbentuk dilarutkan dengan akuades hingga tepat larut.
Dalam penelitian ini digunakan metode Lowry., yang merupakan salah satu metode pilihan untuk mementukan kadar protein dalam suatu bahan. Dalam keadaan basa, ion tembaga divalen (Cu2+) membentuk suatu kompleks dengan ikatan peptida yang mereduksi Cu2+ menjadi tembaga monovalen Cu+ . Ion Cu+ dan gugus radikal dari tirosin, triptofan, dan sistein bereaksi dengan pereaksi Folin-Ciocalteau membentuk senyawa kompleks yang berwarna. Pembentukan warna tersebut disebabkan adanya reaksi antara basa tembaga dengan sampel protein yang diuji. Intensitas warna yang terbentuk tergantung pada jumlah asam aromatik yang berbeda untuk setiap jenis protein (Bintang,2009)
Data kadar protein diperlukan untuk menentukan besar aktivitas spesifik suatu enzim. Kadar protein dari ekstrak dan enzim hasil setiap fraksinasi diukur. Semakin besar kadar protein yang terukur, berbanding dengan jumlah protein selain enzim yang masih ikut terlarut dalam larutan enzim.
Metode pengukuran yang digunakan adalah menghitung jumlah susbtrat yang terhidrolisis berdasarkan substrat sisa. Hasil OD (Optical Density) kontrol dikurangi dengan OD kitin yang tersisa menghasilkan OD (Optical Density) yang kemudian dikonversi ke dalam persamaan garis y= 1.422x + 0.060 untuk menghitung kadar kitin.
Jumlah kitin yang terhidrolisis berbanding lurus dengan aktivitas enzim kitinase. Semakin tinggi aktivitas enzim kitinase, maka semakin banyak jumlah kitin yang terhidrolisis. Sejumlah 200 μl enzim ditambah 800 μl koloidal kitin, diinkubasi selama 20 menit pada suhu 37oC. Setelah diinkubasi, enzim dipanaskan. Tujuan pemanasan adalah untuk menghentikan reaksi enzim. Selama proses inkubasi tersebut, terjadi reaksi pengikatan sisi katalitik kitinase terhadap kitin sehingga kitin terhidrolisis. Uji aktivitas kitinase berhubungan erat dengan setiap fraksinasi karena dapat memberikan informasi seberapa murni enzim yang dihasilkan.
Ekstrak enzim terlebih dahulu diuji aktivitas spesifiknya. Data ini digunakan untuk mengetahui peningkatan aktivitas spesifik kitinase sebelum dan sesudah
Kitinbiosidase
Gambar 4.3 Mekanisme kerja enzim kitinase terhadap polimer N-asetilglukosamin
mungkin aktivitas spesifik kitinase, dilakukan beberapa percobaan fraksinasi. Percobaan pertama, fraksinasi dilakukan pada prosentase aseton 0-50 dan 50-70. Dipilih prosentase aseton 0-50 dan 50-70 untuk fraksinasi karena pada umumnya protein sitoplasma mengendap pada kisaran prosentase aseton tersebut.
Tabel 4.1 Uji aktivitas kitinase hasil fraksinasi percobaan 1
Aktivitas spesifik banyak terkumpul di fraksi 50-70, yaitu sebesar 6,68. Namun pada percobaan 1 (Tabel 4.1) aktivitas spesifik kitinase masih menyebar pada fraksi 0-50, yaitu sebesar 5,37. Dengan harapan aktivitas kitinase dapat dikumpulkan lebih banyak lagi dalam satu fraksi, Percobaan pertama aktivitas spesifik pada fraksi 0-50 ditarik ke fraksi ke-dua, yaitu dengan menambahkan aseton hingga fraksi kedua menjadi 40-75 (sesuai dengan tabel Scopes). Data percobaan fraksinasi pertama digunakan sebagai acuan fraksinasi ke-dua.
Fraksi OD λ660 terhidrolisis Kadar kitin (%b/v)
Aktivitas
(U/ml) Kadar protein (mg/ml) Aktivitas spesifik (U/mg)
0 0,0989 0,02735 2,47 4,12675x10-1 5,985
0-50 0,0999 0,0281 1,53 2,8485 x10-1 5,37
Tabel 4.2 Uji aktivitas hasil fraksinasi percobaan 2
Pada percobaan ke-dua, fraksinasi dimulai pada prosentase aseton 0-40 dan dilanjutkan prosentase aseton 40-75. Pada percobaan ini diperoleh aktivitas spesifik kitinase paling banyak berada pada fraksi 40-75, yaitu sebesar 9,6. Namun masih tampak ada penyebaran aktivitas spesifik pada fraksi lain. Maka perlu dilakukan percobaan selanjutnya untuk mencari fraksi terbaik yang dapat mengumpulkan aktivitas spesifik kitinase.
Tabel 4.3 Uji aktivitas hasil fraksinasi percobaan 3 Fraksi OD λ660 terhidrolisis Kadar kitin
(%b/v)
Aktivitas
(U/ml) Kadar protein (mg/ml) Aktivitas spesifik (U/mg)
0 0,0989 0,02735 2,47 4,12675x10-1 5,985
0-40 0,2773 0,1528 2,865 3,2642 x10-1 8,8
40-60 0,4872 0,3004 9,39 4,2594 x10-1 22
60-80 0,2926 0,1636 0,818 8,0200 x10-1 10
Fraksi OD λ660 terhidrolisis Kadar kitin (%b/v)
Aktivitas
(U/ml) Kadar protein (mg/ml) Aktivitas spesifik (U/mg)
0 0,0989 0,02735 2,47 4,12675x10-1 5,985
0-40 0,0958 0,0252 1,82 2,9435 x10-1 6,1
40-75 0,2558 0,1377 4,13 4,2918 x10-1 9,6
yaitu sebesar 8,8. Fraksinasi dilanjutkan pada fraksi 40-60, didapatkan aktivitas spesifik, yaitu sebesar 22. Kemudian, fraksinasi berakhir pada fraksi 60-80, didapatkan aktivitas spesifik, yaitu sebesar 10. Pada percobaan ini, aktivitas spesifik kitinase terkumpul paling banyak pada fraksi 40-60. Namun, masih tampak aktivitas spesifik kitinase yang tersebar pada fraksi 0-40 dan 60-80. Maka perlu dilakukan percobaan selanjutnya untuk mencari prosentase aseton untuk fraksi terbaik yang dapat mengumpulkan aktivitas spesifik kitinase.
Tabel 4.4 Uji aktivitas hasil fraksinasi percobaan 4
Percobaan ke-empat dilakukan berdasarkan hasil dari percobaan ke-tiga dengan menaikkan prosentase aseton untuk fraksi ke-dua pada percobaan ini, yaitu 45-70. Diperoleh aktivitas spesifik kitinase paling banyak terkumpul pada fraksi 45-70, yaitu sebesar 38,6. Pada fraksi 70-80 aktivitas spesifik kitinase sangat rendah.. Namun begitu, masih terdapat aktivitas spesifik yang menyebar di fraksi 0-45.
Fraksi OD λ660 terhidrolisis Kadar kitin (%b/v)
Aktivitas
(U/ml) Kadar protein (mg/ml) Aktivitas spesifik (U/mg)
0 0,0989 0,02735 2,47 4,12675x10-1 5,985
0-45 0,3114 0,1999 1,8785 1,3634 x10-1 13,7
45-70 0,5275 0,3288 9,864 2,6706x10-1 38,6
tersebar pada fraksi lain. Hasil ini diduga pada ekstrak enzim kitinase dari Achatina
fulica terdapat isozim. Isozim adalah enzim yang berbeda dalam sifat fisika, transpot
ion dan transpot asam basa dan sejumlah proses metabolisme (Tufts, 2006).
4.9 Karakterisasi Enzim Kitinase 4.9.1 Suhu optimum
Salah satu faktor yang mempengaruhi enzim, dalam hal ini enzim kitinase, adalah suhu. Pada penelitian, aktivitas enzim kitinase terhadap pengaruh suhu diamati pada suhu 30oC, 37oC, 45oC, dan 50oC. Suhu mempengaruhi energi yang diperlukan oleh enzim untuk melakukan reaksi. Peningkatan suhu, akan meningkatan energi kinetik enzim. Jika suhu rendah, maka enzim tidak memiliki cukup energi untuk melakukan reaksi, sehingga tidak dapat bekerja secara optimal. Sedangkan jika pada suhu tinggi, enzim akan terdenaturasi. Pada suhu optimumnya energi yang diperoleh untuk enzim bereaksi dengan optimal tanpa denaturasi (Champe dan Harvey, 1994).
Gambar 4.3 Suhu optimum fraksi 45-70
0
Kemudian terjadi penurunan di suhu 45, 50oC.. Hal ini berarti terjadi penurunan aktivitas dari enzim kitinase. Terjadi penurunan aktivitas karena atom-atom dalam molekul enzim memiliki energi yang besar untuk bergerak yang disebabkan oleh perubahan bentuk struktur enzim akibat meningkatnya getaran termal komponen atom-atomnya, sehingga enzim terdenaturasi (Lehninger, 1997).
Diperoleh suhu optimum enzim kitinase hasil pemurnian parsial fraksi 45-70 yaitu pada suhu 37oC. Pada suhu ini, konformasi enzim dalam keadaan paling sesuai untuk berikatan dengan substrat, sehingga enzim lebih aktif dalam mengkatalisis reaksi.
4.9.2 pH optimum
Gambar 4.4 pH optimum enzim kitinase fraksi 45-70
Nilai pH optimum pada fraksi 45-70 adalah pH 7. Sesuai dengan kurva pada Gambar 4.4, jumlah kitin terhidrolisis meningkat dari pH 5 hingga pH7. jumlah kitin terhidrolisis menurun secara signifikan dari pH7 ke pH 8. Dengan adanya perubahan pH maka akan mempengaruhi perubahan ionisasi gugus fungsi asam amino enzim ataupun substrat. Sehingga konformasi enzim dapat berubah dan dapat mengakibatkan penurunan aktivitas enzim yang disebabkan konformasi enzim tidak sama dengan konformasi substrat (Lehninger, 1997).
0.15
43
5.1 Kesimpulan
Berdasarkan hasil dan pembahasan yang telah diuraikan, dapat disimpulkan. 1. Fraksi aseton 45-70 merupakan fraksi optimum dari fraksinasi aseton,
yang memiliki aktivitas spesifik sebesar 38,6.
2. Peningkatan kemurnian enzim kitinase setelah fraksinasi aseton sebesar 6,45 kali.
3. Enzim kitinase dalam keadaan murni parsial memiliki pH optimum 7 dan suhu optimum 37 oC.
5.2 Saran
44
A.J. Esbaugh , B.L. Tufts, 2006, The Structure And Function of Carbonic Anhydrase Isozymes In The Respiratory System Of Vertebrate,Respiratory, Physiology & Neurobiology, 154, 185–198
Bartnicki-Garcia, S., 1989, The Biotcheical Cytology of Chitin and Chitosan Synthesis in Fungi, DalamG. Skjak, B. T. Anthonsen and P.A. Sanford (Eds). Procedings of the 4th International Conferenceon Chitin and Chitosan. Elsevier. Applied Science,Barking-UK
Bintang, Maria, 2010, Teknik Penelitian Biokimia, Erlangga, Bogor
Brurberg, May B., Ingolf F., Nesl dan Eijsink, Vincent G.,1996, Comparative studies of chitinases A and B from Serratia marcescens, Microbiology, 142, 1581-1 589
Bondanzsky M., 1998, Kimia Peptida, Alih bahasa prof. Dr. Kosasih Padmawinata, Penerbit ITB Bandung, hal 46-47.
Cabib, E. 1987. The Synthesis and Degradation of Chitin. Dalam A. Meister (Ed) Advances in Enzymology. Vol. An Interscience Publication John Willey and Sons Inc., New York, 59, 59 – 101
Carlile, M. J. dan S.C. Watkinson, 1994, The Fungi, Academis Press, Harcourt Brace and Company Publishers, London
Chernin, L., Z. Ismailo, S. Haran dan I. Chet, 1995, Chitinolytic Enterobacter
Agglomerans Antagonistic to Fungal Plant Pathogens. Appl. Environ.
Microbiol.,61 :1720 – 1726
Champe, P.C and Ricard, A. Harvey, 1994, Biochemistry, Second edition, Lippicott Company, Piladelphia.
Cohen-Kupiec R, Chet I., 1998, The Molecular Biology of Chitin Digestion, Curr Opinion, Biotechnol., 9, 270-277
Deputi Menegristek Bidang Pendayagunaan dan Pemasyarakatan Ilmu Pengetahuan dan Teknologi, 2000, Budidaya Bekicot (Achanita spp.), BPP Teknologi, Jakarta
Douglas, L.J., dan M.A. Al-fattani, 2006, Biofilm Matrix of Candida albicans and
Candida tropicalis: Chemical Composition and Role in Drug Resistance,
Journal of Medical Microbiology, Glasgow
FAO, 1989, Data sheet on the Giant African Snail, www.ecoport.org, 21 November 2011
Flach, J., Pilet, P. E., dan Jolles, P., 1992, What’s New in Chitinase Research?, (Reviews) Experientia, 48, 701-716
Fleuri, Luciana F., Kawaguti, Haroldo Y., Sato, Helia H., 2009, Production, Purification and Application of Extracellular Chitinase from
Cellulosimicrobium cellulans, Brazilian journal of Microbiology, Brasil
Gabriel, B., Frankowski, F., dan Bani, H., 1999, Microbiology, University of Rostock, German
Gabriel, Miroslav dan Marie Kopecka, 1987, Studies on Cell Division In Regenerating Protoplasts of the Yeast Schizosaccharomyces Japonicus,
Department of Biology, Faculty of Medicine, J . E. Purkyne' University, Czechoslovakia
Herdyastuti, Nuniek., Raharjo, Tri Joko dan Mudasir, Matsjeh., Sabirin, 2009, Chitinase and Chitinolytic Microorganism : Isolation, Characterization and Potential, Indo. J.Chem, 9 (1), 37-47
Harman, G. E., C.K. Hayes, M. Lorito, R. M. Broadway, A. Di Pietro, C. Peterbauer dan A. Tronsmo, 1993, Chitinolytic Enzymes of Trichoderma harzianum : Purification of Chitobiosidase and Endochitinase. Phytopathology, 83, 313-318
Jeaniaux, C, 1966, Chitinases, Dalam E, F. Neufeld and V. Ginburg (Eds.) Complex
Carbohydrates, Methods in Enzymology, Academic Press, New York, Vol.
VII, 644 – 650
Kamiliyah, Hikmatul, 2011, Peningkatan Daya Antifungi Ekstrak Kayu Manis
(Cinnamomum Burmannii L.) Terhadap Candida albicans dengan
Konsorsium Enzim Siput (Achatina Fulica), Skripsi, Program S-1 Kimia, Universitas Airlangga, Surabaya
Kay, Alison, 1986, The Conversation Biology of Molluscs, IUCN Publishing, Gland, Switzerland
Marks, B. Dawn, 1996, Biokimia Kedokteran Dasar :Sebuah Pendekatan Klinis, alih Bahasa: Brahm U, EGC, Jakarta
Marti´nez, Jose, P. M. Luisa Gil, Jose´ L. Lo´ Pez-Ribot, dan W. Lajean Chaffin3., 1998, Serologic Response to Cell Wall Mannoproteins and Proteins of
Candida albicans, Clinical Microbiology Reviews, American Society for
Microbiology
Mead, A.R, 1979, Economic Malacology with Particular Reference to Achatina
fulica. In V. Fretter & Peake, J. (eds.), The Pulmonates,Academic Press, New
York,Vol. 2B
Ottoway JH, Appa DK., 1984, Biochemistry, Edisi ke-4 Cambrige: ELBS.
Poedjiadi, Anna, 1994, Dasar-Daasr Biokimia, UI-Press, Jakarta
Rajarathanam, S., M. N. J. Shashirekha dan Z. Bano. 1998. Biodegradative and Biosinthetic Capacities of Mushrooms : Present and Future Strategies. Crit. Rev. in Biotechnol., 18, 91 – 236
Rochima, E., 2006, Pemurnian dan Karakterisasi Kitin Deasetilase Termostabil dari Bacillus papandayan Asal Kawah Kamojang Jawa Barat, Fakultas Perikanan dan Ilmu Kelauatan universitas Padjajaran, Jatinangor, Bandung 8, 193-209
Sahai , A. S. dan M. S. Manocha, 1993, Chitinases of Fungi and Plants : Their Involvement in Morphogenesis and Host-Parasite Interaction. FEMS
Microbiol., Rev. 11 : 317 – 338
Santoso, H.B., 1989, Budidaya Bekicot, Kanisisus,Jakarta
Scopes, R. K. 1994. Protein Purification, Principles and Practice, Third edition, Springer-Verlag, New York.
Stryer, Lubert, Berg, Jeremy M., Tymoczko, John L., 2002, Biochemistry, Fifth edition, W. H. Freeman and Company, New York
Toharisman, Aris. 2007. Peluang Pemanfaatan Enzim Kitinase di Industri Gula
Voet, Donald dan Judith G. Voet, 2004, Biochemistry Volume I, J. Wiley and Sons, Canada
Wang, Y., Kausch, A.P., Chandlee, J.M., Luo, H., dan Ruemmele, B.A., 2003, Plant Sci., 165, 497-506
Wallace, R.L., 2002, Invertebrate Zoology, Prentica Hall. Inc, United State of America
Wheel, B.P. Van, 1961, The Comparative Physiologi of Digestion in Molluscs, AM. Zoologis, Department of Zoology and Entomology, University of Hawaii, USA
Yong, Tao et al .2005. Purification and Characterization Extracellular Chitinase Produced by Bacterium C4. Annals of Microbiology, 55 (3)
Larutan stok A NaH2PO4 0,2 M dibuat dengan cara menimbang 3,12 g NaH2PO4.2H2O, kemudian dilarutkan dengan akuades. Larutan tersebut diencerkan dalam labu ukur 100 ml hingga tanda batas. Larutan stok B 0,2 M dibuat dengan cara menimbang 3,56 g Na2HPO4.2H2O, kemudian dilarutkan dengan akuades. Larutan tercebut diencerkan dalam labu ukur 100 ml hingga tanda batas. Besarnya pH bufer diukur pada pH-meter. Adapun komposisi larutan stok A dan B untuk memperoleh bufer fosfat pH 6, 7, dan 8 adalah sebagai berikut :
Larutan stok A (ml) Larutan stok B (ml) Larutan bufer fosfat pH
43,85 6,15 6
19,5 30,5 7
2,65 47,35 8
B. Pembuatan larutan bufer fosfat sitrat
Dibuat larutan stok A asam sitrat 0,1 M dengan cara menimbang 1,9121 gram asam sitrat, kemudian dilarutkan dalam akuades. Larutan tersebut diencerkan ke dalam labu ukur 100 ml, hingga tanda batas. Larutan stok B Na2HPO4.2H2O 0,2 M dibuat dengan cara menimbang 3,56 gram Na2HPO4.2H2O, kemudian dilarutkan dengan akuades. Larutan tersebut diencerkan dalam labu ukur 100 ml hingga tanda batas. Larutan bufer fosfat sitrat memiliki pH 4-7 sebanyak 100 ml. Besarnya pH bufer diukur pada pH-meter. Adapun komposisi larutan stok A dan B untuk memperoleh larutan bufer fosfat sitrat pH 4, 5, 6, dan 7 sebagai berikut :
Larutan stok A Larutan stok B pH
24,3 25,7 5
17,9 32,1 6
6,5 43,6 7
Lampiran 3. Pembuatan larutan NaOH 10 N
Larutan NaOH 10N dibuat dari 40 gram NaOH yang dilarutkan dengan akuades. Setelah itu, larutan diencerkan dalam labu ukur 100 ml.
Lampiran 4. Pembuatan larutan HCl 10 N
B. ODλ750 BSA (Bovine Serum Albumin)
Percobaan Fraksi ODλ660 kontrol ODλ660 kitin OD λ750 protein
0 0 0,6112 0,5123 1,6807