LAPORAN PRAKTIKUM
KIMIA FARMASI ORGANIK DAN FISIK (FA2212)
ASAM BENZOAT (OKSIDASI ALKIL HIDROKARBON AROMATIK)
DAN PENENTUAN TITIK LEBUR
Tanggal Praktikum : Selasa, 17 Februari 2015 Tanggal pengumpulan : Rabu, 25 Februari 2015
Shift : Selasa
Kelompok : 1
Asisten: Ahmad Fauzi Nugraha (10713033) Oleh:
Mentari Adnin Mahmudah (10713001)
LABORATORIUM KIMIA FARMASI
PROGRAM STUDI SAINS DAN TEKNOLOGI FARMASI SEKOLAH FARMASI
INSTITUT TEKNOLOGI BANDUNG 2015
I. TUJUAN
1. Menentukan jumlah rendemen pada sintesis asam benzoat dari oksidasi toluena dengan garam kalium permanganat.
2. Menentukan adanya asam benzoat secara kualitatif dengan uji warna dan uji esterifikasi.
3. Menentukan titik lebur asam benzoat. 4. Menentukan kemurnian asam benzoat.
II. TEORI DASAR
Asam benzoat adalah senyawa turunan benzena dengan rumus kimia C6H5COOH. Asam benzoat berbentuk kristal berwarna putih dan merupakan asam karboksilat aromatik yang paling sederhana. Asam benzoat memiliki sifat fisis di antaranya titik leleh 122 oC atau 252 oF dan titik didih 249 oC atau 480 oF. Asam benzoat biasa digunakan sebagai bahan pengawet dalam makanan. Berikut adalah struktur asam benzoat:
Gambar 1: Struktur kimia dari asam benzoat
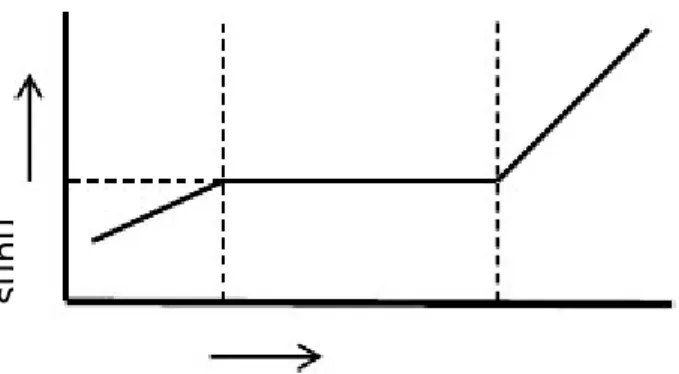
Titik lebur suatu padatan adalah suhu di saat fase padat dan fase cair berada pada keadaan seimbang di tekanan 1 atm. Biasanya senyawa kristal meleleh di suhu tertentu, sedangkan zat amorf dan zat pengotor yang menempel akan melebur dengan jarak suhu tertentu. Titik lebur bisa digunakan sebai uji kemurnian suatu zat.
waktu padat padat/cair cair su h u
Gambar 2: Diagram fase suhu terhadap waktu
III. ALAT DAN BAHAN Alat: 1. Rotary evaporator 2. Reflux condenser 3. Corong tetes 4. Corong Buchner 5. Corong pemisah 6. Labu Erlenmeyer 7. Tabung reaksi 8. Gelas kimia 9. Kertas saring 10. Pipet tetes 11. Oven
12. Labu tiga leher 13. Kaca arloji 14. Melting block 15. Thiele apparatus 16. Elektrotermal 17. Pipa kapiler 18. Termometer 19. 20. Bahan: 1. Etanol absolut 2. Aquades 3. Heksana 4. Larutan NaOH 10% 5. Larutan KMnO4 6. HCl 1 N 7. Karbon aktif 8. Na2SO4 anhidrat 9. Asam asetat 10. Larutan FeCl3 1% 11. Hidrogen peroksida 12. H2SO4 pekat
IV. V. VI.
VII. PROSEDUR
1. Pembuatan Asam Benzoat
VIII. Labu tiga leher, reflux condenser, dan corong tetes disusun. Kemudian labu dimasukkan 10 mL toluena dan ditambahkan 10 mL natrium hidroksida 10%. Setelah itu, larutan ditetesi dengan kalium permanganat sebanyak 1 tetes. Mesin reflux dinyalakan dan larutan direflux selama 45 menit. Setelah itu, dilakukan penyesuaian dengan suhu kamar agar tidak terlalu panas.
IX. Campuran disaring dengan corong Buchner. Solid yang masih terdapat pada kertas saring dibersihkan dengan aquades sekitar 30 mL agar asam benzoatnya terlarut. Filtrat dan hasil bilas tadi dimasukkan ke dalam labu Erlenmeyer. Kemudian campuran ditambahkan asam klorida 1 N agar suasananya asam.
X. Campuran dipindahkan ke dalam corong pemisah-500 mL. Setelah itu dimasukkan heksana sebanyak 100 mL. Corong pemisah ditutup kemudian dikocok pelan agar tidak tercampur dan membentuk emulsi. Lapisan organik (berada di lapisan atas) dikumpulkan ke dalam labu Erlenmeyer 500 mL. lapisan air yang masih tersisa diekstrak kembali sebanyak dua kali dengan penambahan 50 mL heksana tiap pengekstrakkan.
XI. Lapisan organik yang telah dikumpulkan ditambahkan natrium sulfat anhidrat kemudian dikocok sampai warnanya menjadi jernih. Larutan disaring dengan kertas saring. Lalu filtrat tersebut diuapkan dengan rotary evaporator. Setelah itu hasil rotary evaporator diambil dan ditambahkan kira-kira 100 mL air panas dan 2 gram karbon aktif. Campuran dipanaskan hingga mendidih. Kemudian campuran disaring dengan kertas saring. Setelah itu dibiarkan dingin sampai membentuk kristal. Lalu dikeringkan dengan oven selama 30 menit dalam suhu 60 oC.
XII.
2. Pengujian Asam Benzoat: Uji Warna
XIII. Tabung reaksi dimasukkan sampel. Sampel ditambahkan 2 mL air panas. Kemudian diteteskan 2 tetes asam asetat, 2 tetes larutan besi(III) klorida 1
%, dan 2 tetes hidrogen peroksida 5 %. Sampel akan menunjukkan warna violet pekat, setelah penambahan 1 tetes asam klorida yang telah dicairkan, jika terdapat asam benzoat.
XIV.
3. Pengujian Asam Benzoat: Uji Esterifikasi
XV. Tabung reaksi dimasukkan sampel. Sampel diteteskan 5 tetes etanol absolut dan 5 tetes asam sulfat pekat. Campuran dipanaskan secara perlahan. Sampel akan menghasilkan bau ester etil benzoat jika terdapat asam benzoat.
XVI.
4. Penentuan Titik Lebur
XVII. Perangkat untuk melakukan perccobaan penentuan titik lebur disiapkan. Sampel diletakkan di atas kaca arloji. Sampel dimasukkan ke dalam pipa kapiler dengan cara mulu pipa kapiler dimasukkan ke sampel dan bagian bawah pipa kapiler kemudian diketuk-ketuk hingga turun ke dasar pipa kapiler. Kemudian tabung ditempel ke ujung bawah termometer. Termometer tambahan ditempelkan di bagian tengah kolom raksa pada termometer utama (1/2 N).
XVIII. Termometer dan tabung kapiler dimasukkan ke dalam Thiele apparatus. Tabung dicelupkan ke dalam cairan yang dipanaskan. Tabung dimasukkan ke lubang kecil dengan melting block, sedangkan termometer utama dimasukkan ke lubang besar.
XIX. Cairan dipanaskan dengan laju kenaikan suhu 10 oC per menit hingga 10 oC di bawah titik lebur. Jika suhu sudah tercapai, laju kenaikan suhu diubah menjadi 1 oC per menit. Suhu pada saat mulai melebur dan pada saat melebur sempurna dicatat.
XX.
XXI. PERHITUNGAN DAN PENGOLAHAN DATA 1. Pembuatan asam benzoat
XXII. Massa toluena = ρ . V
XXIII. Massa toluena = 0,86 gr/mL . 10 mL = 8,6 gram XXIV. Mol toluena = bobot molekulmassa =92,148,6 =0,093 mol XXV. Massa kalium permanganat = ρ . V
XXVII. Mol kalium permanganat = massa bobot molekul= 0,1 158,03=6,328. 10 −4mol
XXVIII. C6H5COOH + 2 KMnO4 C6H5COOH + 2 MnO2 + 2 KOH
XXIX. m 0,093 mol 6,32 . 10-4 mol XXX. r 3,16 . 10-4 mol 6,32 . 10-4 mol
XXXI. s 0,093 mol - 3,16 . 10-4 mol XXXII. Massa asam benzoat = mol . Mr
XXXIII. Massa asam benzoat = 3,16 . 10-4 mol . 122,12 = 0,038 gram = 38 mg
XXXIV.
XXXV. DISKUSI DAN PEMBAHASAN
XXXVI. Asam benzoat dapat dibuat dengan mengoksidasi toluena dalam suasana basa. Toluena dioksidasi dengan KMnO4 sehingga terbentuk kalium benzoat. Setelah dilarutkan dalam HCl (pengasaman), asam benzoat akan terbentuk.
XXXVII.
XXXVIII. Reaksi yang berlangsung adalah: XXXIX.
XL. C6H5COOH + 2 KMnO4 C6H5COOH + 2 MnO2 + 2 KOH XLI.
XLII. Reaksi ini berlangsung dalam suasana basa. Suasana basa pada percobaan ini dibuat dengan cara memberikan natrium hidroksida pada toluena. Natrium hidroksida dalam reaksi juga berperan sebagai katalis. Oksidator dalam reaksi adalah Kalium permanganat. Kalium permanganat digunakan karena bersifat oksidator kuat. Selain kalium permanganat, ion kromat (CrO4-2) dan dikromat (Cr2O7 -2) juga dapat digunakan sebagai oksidator. Kalium permanganat di tambahkan sedikit-sedikit agar dapat mengoksidasi toluena dengan baik. Larutan akan berwarna ungu setelah penambahan kalium permanganat.
XLIII. Reaksi oksidasi dapat berjalan dengan cepat bila dibantu energi panas sehingga pada saat percobaan, digunakan reflux condenser. Prinsip kerja reflux condenser ada empat, yaitu:
1. Proses heating terjadi pada saat feed dipanaskan di labu didih,
2. Proses evaporating (penguapan) terjadi ketika feed mencapai titik didih dan berubah fase menjadi uap. Uap tersebut kemudian masuk ke dalam kondensor, 3. Proses cooling terjadi di dalam ember. Di dalam ember, terdapat es batu dan air, sehingga ketika kita menghidupkan pompa. Air dingin akan mengalir dari
bawah menuju kondensor luar. Air harus dialirkan dari bawah kondensor agar tidak ada turbulensi udara yang menghalangi dan air akan terisi penuh,
4. Proses kondensasi (Pengembunan) terjadi di dalam kondensor. Karena terjadi perbedaan suhu antara kondensor dalam yang berisi uap panas dengan kondensor luar yang berisikan air dingin, sehingga terjadi penurunan suhu dan perubahan fase dari steam menjadi liquid kembali.
XLIV. Metode refluks digunakan agar senyawa yang bereaksi tidak hilang karena menguap selama proses pemanasan. Refluks dilakukan selama 45 menit. Jika kurang dari 45 menit, kalium permanganat akan bersisa pada campuran. Karena sifat toluena mudah menguap, maka pendinginan yang efisien pada refluks diperlukan. Labu tiga leher harus tertutup dengan rapat agar tidak ada senyawa yang hilang karena menguap.
XLV. Setelah refluks dilakukan, larutan yang sebelumnya berwarna ungu akan berubah menjadi coklat karena terbentuk endapan MnO2. Selain terbentuk MnO2, senyawa yang terbentuk adalah kalium benzoat. Kemudian larutan disaring dengan corong Buchner. Corong Buchner merupakan alat penyaring dengan labu penampungnya dibuat vakum sehingga proses penyaringan berjalan lebih efisien. Endapan padat MnO2 akan tertinggal di kertas saring. Padatan yang tertinggal dibilas dengan kira-kira 30 ml air agar benzoat yang masih ada di padatan dapat terlarut dan menembus filter.
XLVI. Filtrat yang telah dikumpulkan kemudian diasamkan dengan penambahan HCl pekat 1 N. HCl ditambahkan sedikit demi sedikit sampai pH larutan berubah menjadi asam dengan pengujian lakmus biru. Penambahan HCl berperan dalam substitusi kalium pada kalium benzoat dengan atom hidrogen sehingga menjadi asam benzoat. Ion kalium akan terlepas dan mengikat ion Cl- menjadi KCl. Karena asam benzoat telah terbentuk maka dilakukan ekstraksi cair-cair untuk mengambil asam benzoat dalam larutan.
XLVII. Ekstraksi cair-cair adalah metode pemisahan senyawa dengan melibatkan proses pemindahan satu senyawa atau lebih dari satu fasa ke fasa lain dan didasarkan pada prinsip kelarutan. Dalam sistem ini satu atau lebih senyawa akan berada dalam salah satu pelarut dan sebagian besar lainnya berada di pelarut yang kedua. Prinsip umum ekstraksi cair-cair adalah senyawa yang diinginkan kurang larut dalam pelarut yang satu tetapi sangat larut dalam pelarut yang lain. Ekstraksi
dilakukan di dalam corong pemisah. Pada corong pemisah akan terbentuk dua fasa, yaitu fasa organik dan anorganik. Fasa organik yang digunakan adalah heksana karena asam benzoat yang merupakan senyawa non polar akan lebih larut di dalam heksana dibandingkan dalam fasa air atau fasa anorganik. Proses ekstraksi akan berhenti jika terjadi keseimbangan dalam distribusi pelarutan sehingga pengulangan diperlukan agar keseimbangan di perbarui dan asam benzoat yang didapatkan semakin maksimal.
XLVIII. Pengulangan dilakukan sebanyak 3 kali dengan volume heksana 100 ml, 50 ml dan 50 ml. Fasa organik yang telah dikumpulkan kemudian ditambahkan natrium sulfat anhidrat untuk menyerap air yang kemungkinan masih ada di fasa organik. Natrium sulfat anhidrat digunakan karena merupakan drying agent yang dapat menarik air lebih banyak daripada CuSO4 atau CaCO3. Selain itu CuSO4 berwarna biru setelah menarik air sehingga akan mengganggu pengamatan. Pegadukan natrium sulfat anhidrat tidak perlu sampai terlarut semua, tetapi sampai larutan fasa organik menjadi jernih dan tidak berwarna.
XLIX. Setelah penarikan air dari larutan fasa organik, larutan disaring dengan kertas saring untuk menyaring natrium sulfat dalam larutan. Kemudian larutan diuapkan dengan rotary evaporator untuk menghilangkan heksana yang merupakan pelarut. Prinsip utama dari rotary evaporator yaitu menggunakan prinsip vakum destilasi, sehingga tekanan akan menurun dan pelarut akan menguap dibawah titik didihnya. Oleh karena itu heksana, akan menguap dan senyawa terlarut tidak ikut menguap namun mengendap. Selain itu, dengan pemanasan dibawah titik didih pelarut, senyawa terlarut tidak akan rusak oleh suhu tinggi.
L. Hasil yang didapatkan dari proses rotary evaporator adalah padatan senyawa terlarut. Padatan yang didapatkan dari rotary evaporator mengandung asam benzoat, namun tidak murni. Sehingga perlu dilakukan pemurnian asam benzoat dengan cara kristalisasi. Prinsip pemurnian ini adalah asam benzoat yang mudah larut dalam air panas namun sukar larut dalam air dingin. Selain itu, pengotor yang terdapat pada padatan asam benzoat ada yang larut di air pada suhu mana pun atau ada yang tidak larut sama sekali di suhu mana pun. Sehingga kristalisasi dengan pelarut air dapat dilakukan untuk pemurnian asam benzoat.
LI. Padatan dilarutkan dalam 100 ml air panas dan ditambahkan karbon aktif. Karbon aktif berfungsi untuk menarik pengotor. Kemudian larutan dididihkan agar meningkatkan suhu larutan. Setelah dididihkan, larutan disaring dengan kertas saring untuk mengeliminasi karbon aktif dalam larutan. Kemudian larutan didinginkan sehingga kristal dapat terbentuk. Kristal yang terbentuk kemudian dikeringkan dengan cara menempatkannya di kaca arloji dan diletakkan di oven dengan suhu 60 oC selama 30 menit.
LII.
LIII.
Gambar 3: Larutan yang siap didinginkanLIV.
LV.Pada percobaan kali ini, kristal asam benzoat tidak terbentuk. Berikut adalah analisis tidak terbentuknya kristal:
1. Jumlah KMnO4 yang sedikit sehingga produk yang dihasilkan pun juga sedikit.
2. Pada saat mengkristalisasi dengan air, pelarut yang digunakan berlebihan sehingga hasil rendemen menjadi sedikit.
3. Penutupan wadah pada saat penyimpanan tidak menggunakan plastic wrap sehingga wadah tidak tertutup dengan rapat. Jika tidak tertutup dengan rapat, ada kemungkinan bahwa zat telah menguap pada saat penyimpanan.
LVI. Pengujian warna pada asam benzoat baku yang disediakan oleh laboratorium menghasilkan warna ungu violet. Hal ini membuktikan bahwa asam benzoat baku yang diuji merupakan asam benzoat. Sedangkan pada pengujian
esterifikasi menghasilkan aroma permen karet (aroma ester). Hal ini juga membuktikan bahwa asam benzoat baku yang diuji merupakan asam benzoat.
LVII.
LVIII. Gambar 4: Sebelum penambahan asam klorida
LIX.
LX. Gambar 5: Setelah penambahan asam klorida
LXI. Pada percobaan menentukan titik lebur digunakan alat elektrotermal. Elektrotermal merupakan alat ukur titik leleh yang modern karena pengamatan sangat mudah untuk dilakukan. Ketika mulai dan berakhirnya semua padatan mencair maka alat akan mengeluarkan bunyi alarm. Suhunya dapat diatur sesuai yang ingin dicapai dan pengamatan dilakukan dengan menggunakan kaca pembesar agar dapat melihat semua padatan telah menjadi cair.
LXII.
LXIII. Gambar 6: Pipa kapiler untuk menampung sampel
LXIV.
LXV.
Gambar 7: ElektrotermalLXVI. Titik lebur suatu zat padat dapat berubah diakibatkan beberapa faktor, yaitu tekanan di atas permukaan zat padat dan ketidakmurnian zat padat. Semakin besar tekanan di atas permukaan zat padat, maka zat padat tersebut akan lebih mudah melebur, artinya titik lebur lebih tinggi. Semakin tidak murni suatu zat, maka zat akan makin sulit membeku dan perbedaan titik lebur dengan senyawa murninya besar.
LXVIII. LXIX. KESIMPULAN
1. Rendemen yang didapatkan adalah 0 %.
2. Pengujian warna pada asam benzoat baku menghasilkan warna ungu violet sedangkan pengujian esterifikasi menghasilkan aroma permen karet.
3. Jarak lebur pada asam benzoat yang diuji adalah 121,9 – 122,4 oC.
4. Asam benzoat yang diuji pada penentuan titik lebur merupakan asam benzoat murni.
LXX.
LXXI. DAFTAR PUSTAKA
LXXII.Anonim. 1979. Farmakope Indonesia, edisi ketiga. Jakarta: Departemen Kesehatan Republik Indonesia. Halaman 49.
LXXIII. Fessenden, R.J. dan Fessenden, J.S. 1982. Kimia Organik, Edisi ketiga, Jilid 2. Jakarta: Erlangga. Halaman 82.
LXXIV. Rahayu, Iman. 2008. Praktis Belajar Kimia. Jakarta: Grafindo Media Pratama. Halaman 143.
LXXV. Svehla, G. 1990. Vogel Buku Teks Analisis Anorganik Kualitatif Makro dan