Pengaruh Serbuk Daun Kemangi (Ocimum Canum Sims.) Terhadap Siklus Estrus, Kadar Mda Serum Dan Ovarium Tikus Putih (Rattus Norvegicus) Premenopause
Teks penuh
(2) PENGARUH SERBUK DAUN KEMANGI (Ocimum canum Sims.) TERHADAP SIKLUS ESTRUS, KADAR MDA SERUM DAN OVARIUM TIKUS PUTIH (Rattus norvegicus) PREMENOPAUSE. SKRIPSI Sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains dalam Bidang Biologi. oleh RAHMA DIAN QURATU A’YUNISA 135090101111043. JURUSAN BIOLOGI FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS BRAWIJAYA MALANG 2017.
(3) HALAMAN PENGESAHAN SKRIPSI PENGARUH SERBUK DAUN KEMANGI (Ocimum canum Sims.) TERHADAP SIKLUS ESTRUS, KADAR MDA SERUM DAN OVARIUM TIKUS PUTIH (Rattus norvegicus) PREMENOPAUSE RAHMA DIAN QURATU A’YUNISA 135090101111043 Telah dipertahankan di depan Majelis Penguji pada tanggal 20 Juni 2017 dan dinyatakan memenuhi syarat untuk memperoleh gelar Sarjana Sains dalam Bidang Biologi Menyetujui Pembimbing. Dr. Sri Rahayu, M.Kes NIP. 19620528 198701 2 001. Mengetahui Ketua Program Studi S1 Biologi Fakultas MIPA Universitas Brawijaya. Rodliyati Azrianingsih, S.Si., M.Sc., P.hD NIP. 19700128 199412 2 001.
(4) HALAMAN PERNYATAAN Saya yang bertanda tangan di bawah ini: Nama : Rahma Dian Quratu A’yunisa NIM : 135090101111043 Jurusan : Biologi Penulis Skripsi berjudul : Pengaruh Serbuk Daun Kemangi (Ocimum canum Sims.) terhadap Siklus Estrus, Kadar MDA Serum dan Ovarium Tikus Putih (Rattus norvegicus) Premenopause Dengan ini menyatakan bahwa: 1. Skripsi ini adalah benar-benar karya sendiri dan bukan hasil plagiat dari karya orang lain. Karya-karya yang tercantum dalam Daftar Pustaka Skripsi ini semata-mata digunakan sebagai acuan atau referensi. 2. Apabila kemudian hari diketahui bahwa isi Skripsi saya merupakan hasil plagiat, maka saya bersedia menanggung segala resiko. Demikian pernyataan ini dibuat dengan segala kesadaran. Malang, 12 Juli 2017 Yang menyatakan,. Rahma Dian Quratu A’yunisa 135090101111043. iii.
(5) PEDOMAN PENGGUNAAN SKRIPSI Skripsi ini tidak dipublikasikan namun terbuka untuk umum dengan ketentuan bahwa hak cipta ada pada penulis. Daftar Pustaka diperkenankan untuk dicatat, tetapi pengutipan hanya dapat dilakukan seizin penulis dan harus disertai kebiasaan ilmiah untuk menyebutkannya.. iv.
(6) Pengaruh Serbuk Daun Kemangi (Ocimum canum Sims.) terhadap Siklus Estrus, Kadar MDA Serum dan Ovarium Tikus Putih (Rattus norvegicus) Premenopause Rahma Dian Quratu A’yunisa, Sri Rahayu Jurusan Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Brawijaya, Malang 2017 ABSTRAK Tujuan penelitian ini adalah untuk mengetahui pengaruh serbuk daun kemangi terhadap siklus estrus, kadar MDA serum dan ovarium tikus premenopause. Hewan coba yang digunakan dalam penelitian adalah 24 ekor tikus putih betina berusia 11 bulan, berat 180-220 g. Hewan coba dibagi menjadi 4 kelompok. Kelompok kontrol (K) adalah kelompok yang tidak diberi perlakuan serbuk daun kemangi. Kelompok P1, P2 dan P3 adalah kelompok perlakuan yang diberi serbuk daun kemangi dengan dosis 0,25 g/kg BB, 0,5 g/kg BB, dan 1 g/kg BB. Perlakuan hewan coba dimulai pada fase estrus. Serbuk daun kemangi diberikan secara oral setiap hari, selama 15 hari. Fase estrus diperiksa setiap hari selama 15 hari dengan metode apus vagina. Serum darah dikoleksi pada hari ke 1,5,10, dan 15, sedangkan ovarium dikoleksi pada hari ke 16. Kadar MDA serum dan ovarium diestimasi dengan metode TBA. Data berupa durasi siklus estrus, kadar MDA serum dan ovarium dianlisis statistik dengan ANOVA (p≤0,05) menggunakan program SPSS versi 16 for windows dilanjutkan uji Tukey. Hasil penelitian menunjukkan bahwa durasi siklus estrus menjadi lebih pendek pada tikus perlakuan (P1, P2 dan P3) dibandingkan kontrol. Fase proestrus (1 hari) dan diestrus (2,37± 0,25 hari) paling pendek terjadi pada perlakuan P3, sedangkan fase estrus paling pendek terjadi pada perlakuan P1 (1,2 ± 0,24 hari). Hasil analisis kadar MDA serum hari ke-15 dan ovarium hari ke-16 turun secara signifikan seiring dengan peningkatan dosis yang diberikan. Kadar MDA serum (57,4 ± 8,4603 µmol/mL) dan ovarium (39,4 ± 4,7610 µmol/mL) paling rendah terdapat pada perlakuan P3. Kata kunci : MDA, Ocimum canum Sims., siklus estrus. v.
(7) Effect of Basil Leaves Powder (Ocimum canum Sims.) on Estrous Cycle, Serum and Ovarian MDA Levels on White Rat (Rattus norvegicus) Premenopausal Rahma Dian Quratu A’yunisa, Sri Rahayu Department of Biology, Faculty of Mathematics and Natural Sciences, University of Brawijaya, Malang 2017 ABSTRACT The purpose of this study was to determine the effect of basil powder on estrus cycles, serum and ovarian MDA levels on premenopausal rat. The experimental animals used in the study were 24 female rat, aged 11 months, weighing 180-220 g. The animals divided into 4 groups. The control group (K) is a group not treated with basil powder. The P1, P2 and P3 groups were treated with basil powder doses of 0.25 g / kg BW, 0.5 g / kg BW, and 1 g / kg BW, respectively. Animal treatment begins in the estrus phase. Basil leaf powder is given daily by, for 15 days. The estrus cycle is examined daily for 15 days with the vaginal smear method. Blood serum was collected on 1st, 5th, 10th, and 15th day while ovaries were collected on 16th day. Serum and ovarian MDA levels were estimated by TBA method. The data were analyzed by ANOVA (p≤0,05) using SPSS version 16 for windows followed by Tukey test. The results showed that the duration of the estrous cycle was shorter in the treatment rats (P1, P2 and P3) than the control group. The proestrus phase (1 day) and diestrus (2.37 ± 0.25 days) were the shortest in the treatment of P3, while the shortest estrous phase occurred in treatment P1 (1.2 ± 0.24 days). Serum MDA levels of the 15th day and ovarian MDA levels of 16th day were significantly decrease by the increasing of the dose treatment. The lowest serum MDA (57.4 ± 8.4603 μmol / mL) and ovarian MDA (39.4 ± 4.7610 μmol / mL) levels were P3 group.. Keywords: estrus cycle, MDA, Ocimum canum Sims.. vi.
(8) HALAMAN PERNYATAAN KATA PENGANTAR Alhamdulillahi Robbil „Aalamiin. Puji syukur pada Allah Tuhan Yang Maha Esa atas limpahan rahmatNya, penulis dapat menyelesaikan penyusunan tugas akhir yang berjudul “Pengaruh Serbuk Daun Kemangi (Ocimum canum Sims.) terhadap Siklus Estrus, Kadar MDA Serum dan Ovarium Tikus Putih (Rattus norvegicus) Premenopause” yang merupakan syarat untuk memperoleh gelar Sarjana Sains dalam bidang Biologi di Fakultas Matematika dan Ilmu pengetahuan Alam, Universitas Brawijaya, Malang. Pada kesempatan ini, penulis ingin menyampaikan ucapan terimakasih kepada: 1. Dr. Sri Rahayu, M. Kes selaku dosen pembimbing yang telah mendampingi dan memberikan pengarahan serta tambahan ilmu dan saran yang berguna bagi penulis. 2. Drs. Aris Soewondo, M. Si dan Dr. Agung Pramana Warih Marhendra., M. Si selaku dosen penguji yang telah memberikan saran yang bermanfaat demi perbaikan penyusunan skripsi. 3. Orang tua serta seluruh keluarga besar penulis atas segala doa, dukungan, dan motivasi yang tak terkira sehingga penulis dapat menyelesaikan studi. 4. Maratus Saadah, Savicalista Maidacinda, Siska Nanda Widhaningrum, Syarifatunnisa, teman-teman, dan seluruh civitas akademik Jurusan Biologi Fakultas MIPA Universitas Brawijaya. Penulisan skripsi ini merupakan upaya optimal penulis sebagai bentuk pengembangan ilmu pengetahuan. Penulis sadar bahwa skripsi ini masih belum sempurna. Oleh karena itu saran dan kritik yang membangun sangat diharapkan untuk menjadikan karya ini menjadi semakin bermanfaat.. Malang, 12 Juli 2017. Penulis vii.
(9) DAFTAR ISI Halaman ABSTRAK ......................................................................................... v ABSTRACT ....................................................................................... vi KATA PENGANTAR ....................................................................... vii DAFTAR ISI ...................................................................................... viii DAFTAR TABEL ............................................................................. x DAFTAR GAMBAR ......................................................................... xi DAFTAR LAMPIRAN ..................................................................... xii DAFTAR LAMBANG DAN SINGKATAN ................................... xiii BAB I PENDAHULUAN .................................................................. 1.1. Latar Belakang .................................................................. 1.2. Rumusan Masalah ............................................................. 1.3. Tujuan Penelitian .............................................................. 1.4. Manfaat Penelitian ............................................................. 1 1 2 3 3. BAB II TINJAUAN PUSTAKA ....................................................... 2.1. Premenopause .................................................................... 2.2. Kemangi ............................................................................ 2.3. Kandungan Senyawa Kimia di dalam Kemangi ............... 2.4. Siklus Estrus ....................................................................... 2.5. ROS dan MDA .................................................................. 2.6. Antioksidan ........................................................................ 4 4 5 7 8 10 12. BAB III METODE PENELITIAN .................................................. 14 3.1. Waktu dan Tempat Penelitian ........................................... 14 3.2. Rancangan Penelitian ....................................................... 14 3.3. Variabel Penelitian ........................................................... 14 3.4. Langkah Penelitian ........................................................... 16 3.4.1. Persiapan serbuk dan kemangi .............................. 16 3.4.2. Persiapan hewan coba .......................................... 16 3.4.3. Pemeriksaan siklus estrus...................................... 16 3.4.4. Pemeriksaan kadar MDA serum ........................... 17 3.4.5. Pemeriksaan kadar MDA ovarium ........................ 18 3.4.6. Pembuatan kurva standar Tetraetoksipropan ……18 3.5.Analisis Data....................................................................... 19 viii.
(10) BAB IV HASIL DAN PEMBAHASAN ........................................... 20 4.1. Pengaruh Serbuk Daun Kemangi terhadap Siklus Estrus .. 20 4.2. Pengaruh Serbuk Daun Kemangi terhadap Kadar MDA Serum ................................................................................. 25 4.3. Pengaruh Serbuk Daun Kemangi terhadap Kadar MDA Ovarium…………………………………………………...27 4.4. Pengaruh Serbuk Daun Kemangi terhadap Kadar MDA Serum dan Ovarium ………………………………………28 4.5. Hubungan antara Siklus Estrus dengan Kadar MDA ......... .30 BAB V KESIMPULAN DAN SARAN ............................................ 32 5.1. Kesimpulan ....................................................................... 32 5.2. Saran ................................................................................. 32 DAFTAR PUSTAKA ........................................................................ 33 LAMPIRAN ....................................................................................... 39. ix.
(11) DAFTAR TABEL Nomor 1. Halaman Dilusi Bertingkat untuk Kurva Standar MDA ........................ 19. 2. Hasil Perhitungan Pengaruh Serbuk Daun Kemangi terhadap Durasi Siklus Estrus ................................................. 21. 3. Hasil Pengukuran Kadar MDA dan Fase Estrus di Hari Ke 1, 5, 10, dan 15 ....................................................................... 30. x.
(12) DAFTAR GAMBAR Nomor 1. Halaman Tanaman Kemangi ................................................................. 6. 2. Rancangan Penelitian ............................................................. 15. 3. Perubahan Sitologi Selama Siklus Estrus ............................... 17. 4. Hasil Analisa Sitologi Vagina Tikus Premenopause .............. 20. 5. Durasi Siklus Estrus Setelah Diberi Perlakuan Serbuk Daun Kemangi ........................................................................ 23. 6. Kadar MDA Serum Tikus Setelah Diberi Perlakuan Serbuk Daun Kemangi ........................................................................ 26. 7. Kadar MDA Ovarium Tikus Setelah Diberi Perlakuan Serbuk Daun Kemangi ............................................................ 27. 8. Kadar MDA Serum dan Ovarium Tikus Setelah Diberi Perlakuan Serbuk Daun Kemangi ........................................... 29. xi.
(13) DAFTAR LAMBANG DAN SINGKATAN Simbol/Singkatan ATP BB DNA FSH GnRH LH MDA PBS ROS TBA TCA TEP. Keterangan adenosine triphosphatase berat badan deoxyribonucleic acid follicle stimulating hormone gonadothrophin releasing hormone luteinizing hormone malondialdehid poshpat buffer saline reactive oxygen species thiobarbituric acid trichloroacetic acid tetraetoksipropan. Simbol/Singkatan α β cm g mg mL. Nama unit alfa beta centimeter gram miligram milliliter. viii.
(14) BAB I PENDAHULUAN 1.1 Latar Belakang Premenopause merupakan fase ketika kondisi fisiologis pada wanita atau betina telah memasuki masa penuaan. Fase ini adalah fase awal sebelum terjadi menopause. Matson (2001) menyatakan bahwa penuaan dapat disebabkan karena berbagai faktor salah satunya karena adanya pemendekan telomer seiring dengan pembelahan sel. Telomer sendiri merupakan bagian dari DNA mempunyai dua fungsi utama yaitu untuk melindungi DNA dari kerusakan dan mempertahankan kestabilan kromosom pada setiap proses pembelahan sel. Setiap kali sel membelah maka akan terjadi pemendekan telomer (Matson, 2001). Sel yang telomernya terlalu pendek akan berhenti membelah diri, sehingga sel menjadi inaktif atau menua (Opresko dkk., 2002). Pemendekan telomer akan mengakibatkan destabilisasi kromosom sehingga ujung kromosom menjadi terbuka. Hal ini mengakibatkan untai ganda DNA rusak dan kondisi sel menjadi tidak stabil (Oeseburg dkk., 2010). Apabila kondisi tersebut terjadi secara terus menerus seiring dengan pembelahan sel, maka dapat meningkatkan kerusakan DNA (Matson, 2001). Kerusakan DNA terutama di DNA mitokondria dapat disebabkan karena adanya stres oksidatif akibat ROS (Singh, 1998). Alway dkk., (2014) menyatakan bahwa penuaan berkaitan dengan kadar ROS yang berlebihan akibat adanya kerusakan mitokondria. Tingkat ROS yang berlebihan diyakini berperan sebagai mediator disfungsi di berbagai sel. ROS yang tinggi akan memediasi gangguan dalam signaling cell, metabolisme, aktivitas transkripsi, fungsi mitokondria, dan meningkatkan apoptosis serta nekrosis. Sementara Wolpert (2011) menyatakan rusaknya DNA akan berimplikasi pada terjadinya penurunan fungsi seluler di berbagai jaringan tubuh yang dapat mempengaruhi fisiologi sel. Apabila fisiologi sel menurun maka proses metabolisme dalam tubuh menjadi terganggu. Akibatnya produk metabolisme menjadi tidak terkontrol. Salah satu produk metabolisme adalah Reactive Oxygen Species (ROS) yang dihasilkan oleh mitokondria (Lemasters & Nieminen, 2007). Wickens (2001) menyatakan kadar ROS yang tinggi dapat menyebabkan tingginya peroksidasi lipid yang 1.
(15) berimplikasi pada terjadinya kerusakan seluler di berbagai jaringan tubuh. Apabila peroksidasi lipid tinggi maka akan terjadi peningkatan kadar MDA. MDA sendiri merupakan produk peroksidasi lipid yang dihasilkan karena adanya radikal bebas. Profil MDA dalam serum atau jaringan dapat berfungsi sebagai penanda kerusakan seluler akibat radikal bebas (Girotti, 1998). Selain meningkatkan kadar MDA, radikal bebas berlebih di dalam tubuh dapat menyebabkan gangguan fisiologis di berbagai jaringan dan organ salah satunya di ovarium. Gangguan di ovarium akan menyebabkan terjadinya penurunan sekresi hormon estrogen (Speroff & Fritz, 2005). Estrogen merupakan hormon yang berperan dalam memunculkan tanda tanda estrus. Penurunan hormon estrogen menyebabkan aktivitas sel goblet menurun sehingga lubrikasi serviks terganggu. Akibatnya fase birahi atau fase estrus hewan akan terganggu juga (Widiyono dkk., 2011). Efek negatif akibat akumulasi radikal bebas mengakibatkan munculnya berbagai upaya untuk menyeimbangkan radikal bebas dengan antioksidan (Winarsi, 2007). Antioksidan alami umumnya terkandung pada daun, batang, akar, biji, dan buah tanaman (Chew dkk., 2012). Andareto (2015) menyatakan bahwa salah satu tanaman yang dipercaya kaya akan antioksidan adalah kemangi. Kemangi (Ocimum canum Sims) merupakan tumbuhan tahunan yang tumbuh subur di daratan dengan iklim tropis (Sudarsono dkk., 2002). Daun kemangi mengandung berbagai senyawa aktif yang sangat bermanfaat bagi tubuh. Kandungan senyawa pada daun kemangi seperti flavonoid, antosianin, dan polifenol memiliki sifat antioksidan yang baik bagi tubuh (Charles, 2013). Berdasarkan uraian diatas maka perlu dilakukan penelitian tentang pengaruh serbuk daun kemangi (O. canum) terhadap siklus estrus, kadar MDA serum dan ovarium tikus putih (Rattus norvegicus) premenopause. 1.2 Rumusan Masalah Rumusan permasalahan dalam penelitian ini antara lain: a. apakah pemberian serbuk daun kemangi (O. canum Sims.) dapat mempengaruhi siklus estrus pada tikus premenopause? b. apakah pemberian serbuk daun kemangi (O. canum Sims.) dapat mempengaruhi kadar MDA serum dan ovarium tikus premenopause? 2.
(16) 1.3 Tujuan Penelitian Tujuan dari penelitian ini adalah untuk: a. mengetahui apakah pemberian serbuk daun kemangi (O. canum Sims.) dapat mempengaruhi siklus estrus pada tikus premenopause, b. mengetahui apakah pemberian serbuk daun kemangi (O. canum Sims.) dapat mempengaruhi kadar MDA serum dan ovarium tikus premenopause. 1.4 Manfaat Penelitian Hasil penelitian diharapkan dapat memberikan informasi tentang manfaat serbuk daun kemangi untuk mengurangi radikal bebas di dalam tubuh.. 3.
(17) BAB II TINJAUAN PUSTAKA 2.1 Premenopause Sejak lahir individu wanita memiliki sekitar 770.000 sel telur yang belum berkembang. Saat fase pubertas mulai timbul aktivitas ringan dari fungsi endokrin reproduksi. Saat individu memasuki masa menarche, organ reproduksinya akan berfungsi optimal secara bertahap. Mulai masa menarche ovarium akan mengeluarkan sel-sel telur yang siap untuk dibuahi secara periodik. Seiring bertambahnya umur, individu wanita akan memasuki masa klimakterium. Klimakterium merupakan masa peralihan dari periode reproduktif ke periode non-produktif. Masa klimakterium terdiri atas tiga fase yaitu premenopause, perimenopause, dan postmenopause (Lobo dkk., 2002; Manuaba, 1998). Premenopause merupakan fase normal dari kehidupan wanita atau betina. Pada masa premenopause fungsi reproduksi akan berangsur menurun dan berhenti pada saat memasuki fase menopause. Pada fase premenopause fungsi ovarium menurun dan produksi hormon steroid akan berangsur-angsur berkurang (Speroff & Fritz, 2005). Premenopause berkaitan dengan terjadinya penuaan sistem reproduksi (ovarian aging). Seiring dengan bertambahnya usia, jumlah folikel berkurang. Hal ini disebabkan karena individu wanita atau betina mengalami ovulasi secara periodik mulai menarche hingga akan memasuki masa menopause (Guyton, 2006; Hafez, 1993). Berkurangnya folikel akan menyebabkan terjadinya penurunan fungsi ovarium yang berimplikasi pada terganggunya sekresi hormon reproduksi (Speroff & Fritz, 2005). Premenopause pada tikus laboratorium terjadi pada usia 10 hingga 15 bulan. Tikus usia 3-10 bulan memasuki masa produktif dan memasuki masa menopause pada usia 15 hingga 18 bulan (Suckow dkk., 2005). Tikus yang mulai memasuki masa menopause ditandai dengan menurunnya kadar estrogen dan siklus reproduksinya tidak teratur (Baker dkk., 1979). Fase premenopause berkaitan dengan jumlah ROS berlebih di dalam tubuh (Sanchez-Rodriguez dkk.,2015). Dari sudut pandang seluler, beberapa peneliti menyatakan bahwa sel granulosa pada individu wanita usia lanjut mengandung DNA mitokondria (mtDNA) terdelesi yang lebih banyak dibanding pada individu usia produktif (Tatone dkk., 2008). Delesi di mtDNA akan mempengaruhi reaksi 4.
(18) fosforilasi oksidatif, biogenesis dan metabolisme. Hal ini akan mengakibatkan produksi ATP menurun dan produksi ROS meningkat (Ngili dkk., 2012). Selain karena adanya mutasi di mtDNA, peningkatan ROS pada saat masa premenopause erat kaitannya dengan penurunan kadar hormon estrogen (SanchezRodriguez dkk., 2015). Preedy (2014) menyebutkan hipotesis bahwa penurunan kadar estrogen diindikasi berkaitan dengan terjadinya peningkatan konsentrasi ROS di dalam tubuh. Sanchez-Rodriguez dkk., (2012) menyatakan bahwa menurunnya hormon estrogen (estradiol) pada individu menopause menyebabkan terjadinya peningkatan ROS. Hal ini disebabkan karena estradiol diketahui memiliki kemampuan sebagai antioksidan melalui struktur kimianya serta melalui pengaruhnya terhadap aktivitas enzim antioksidan di dalam tubuh. Estradiol yang dimediasi oleh cascade mampu meningkatkan ekspresi gen sitoprotektif. Oleh sebab itu berkurangnya estradiol berpengaruh terhadap meningkatnya ROS dalam tubuh. Kondisi premenopause akan menyebabkan terganggunya siklus reproduksi (Baker dkk., 1979). Pada fase premenopause siklus menstruasi menjadi tidak teratur. Terkadang terjadi menstruasi secara terus menerus atau dapat pula terjadi menstruasi anovulatoir (Manuaba, 1998). Sementara pada hewan mamalia non primata, kondisi premenopause akan menyebabkan kacaunya siklus estrus. Kondisi premenopause akan menyebabkan adanya transisi siklus estrus secara bertahap. Siklus estrus menjadi tidak teratur dan durasinya bertransisi menjadi lebih panjang dari siklus estrus reguler (Barnes & Sarkar, 1995). 2.2 Kemangi Kemangi merupakan tanaman tahunan yang umumnya tumbuh subur di daratan dengan iklim tropis. Tanaman kemangi (Lampiran 1) termasuk dalam keluarga Labiatae yang mampu mengeluarkan bau khas karena mengandung senyawa aromatik (Sudarsono dkk., 2002). Menurut Tjitrosoepomo (2003) klasifikasi dari tanaman kemangi adalah sebagai berikut,. 5.
(19) Kingdom Divisio Sub division Kelas Ordo Famili Genus Spesies. : Plantae : Spermatophyta : Angiospermae : Dicotyledonae : Tubiflorae : Labiatae : Ocimum : Ocimum canum Sims.. (Altervista, 2009). Gambar 1. Tanaman Kemangi. Kemangi (O. canum Sims.) merupakan tanaman herba tegak atau semak dengan percabangan yang cukup banyak. Umumnya percabangan dan batang pokok kemangi tidak memiliki batasan yang jelas. Batang kemangi berwarna hijau atau hijau keunguan dengan tinggi sekitar 0,3-1,5 m. Beberapa jenis kemangi memiliki batang yang berambut sementara yang lainnya tidak. Kemangi memiliki daun yang tersusun dari atas ke bawah dalam duduk tunggal yang saling berhadapan. Daun kemangi berwarna hijau dengan bentuk bulat telur atau oval yang ujungnya meruncing.Tepi daun kemangi bergerigi, bergelombang, atau ada juga yang rata. Ukuran daun kemangi bervariasi bergantung dari jenisnya, umumnya kisaran panjang daun kemangi antara 14-16 mm dengan lebar 3-6 mm (Sudarsono dkk., 2002). 6.
(20) Bunga kemangi termasuk dalam golongan bunga majemuk berkarang yang berbentuk tandan dan berbulu. Kelopak bunganya menyerupai bibir dengan warna hijau atau hijau keunguan. Mahkota bunganya berwarna putih keunguan dengan bentuk bulat telur. Kemangi memiliki buah berukuran kecil yang berwarna coklat kehitaman. Buahnya menyerupai kubus dengan ujung yang membentuk kaitan melingkar. Setiap satu buah kemangi, mengandung empat bakal biji. Biji kemangi berukuran kecil, teksturnya liat, serta pada umumnya berwarna coklat tua kehitaman (Mangoting dkk., 2006; Sudarsono dkk., 2002). Kemangi banyak dimanfaatkan oleh masyarakat untuk dimakan langsung sebagai lalap ataupun diolah bersama bahan makanan yang lain. Umumnya masyarakat hanya mengonsumsi kemangi sebagai makanan pendamping untuk menetralisir bau yang kurang sedap. Lebih dari itu, kemangi memiliki manfaat yang sangat beragam terutama di bagian daunnya (Andareto, 2015). Daun kemangi dapat dimanfaatkan untuk meredakan demam, mual, dan masuk angin, menjaga kesehatan mata, melancarkan produksi ASI, memperbaiki fungsi lambung, mengatasi keputihan, menunda menopause, serta membantu proses diferensiasi dan maturasi sel ovum. Biji kemangi dapat dimanfaatkan untuk melancarkan sistem pencernaan, mengatasi kram perut, serta meluruhkan keringat dan urin.Sementara bagian akar kemangi dapat dimanfaatkan untuk mengobati penyakit kulit serta melancarkan sistem peredaran darah (Andareto, 2015; Sudarsono dkk, 2002). 2.3 Kandungan Senyawa Kimia di dalam Kemangi Kemangi mengandung berbagai senyawa kimia yang dapat dimanfaatkan sebagai antioksidan, antidiabetes, antikanker, antibakteri, antifungal, antiemetic, dan antipasmodic. Selain itu senyawa kimia pada kemangi juga bermanfaat sebagai analgesik, adaptogenik, dan memiliki kemampuan diaphoretic action (Prakash & Gupta, 2005). Berdasarkan penelitian Hussain dkk, (2008z) diketahui bahwa kemangi mengandung alkaloids, flavonoids, asam amino, protein, dan saponins. Sementara menurut Krishnaiah dkk., (2009) kemangi mengandung senyawa bioaktif seperti alkaloid, flavonoid, fenolat, dan minyak esensial. Menurut Charles (2013) daun kemangi mengandung senyawa kimia yang bersifat antioksidatif seperti, flavonoid, antosianin, dan 7.
(21) polifenol. Sementara menurut Rahman dkk. (2011) kandungan utama kemangi yang bersifat antioksidatif adalah asam askorbat, tokoferol, flavonoid, beta karoten, beta sitosterol, eugenol, asam palmitat, asam ursolik, asam fenolat, serta senyawa nitrogen contohnya alkaloid, turunan klorofil, asam amino, dan amina. Permadi (2008) menyatakan bahwa kemangi mengandung senyawa beta karoten, beta sitosterol, tannin, dan flavonoid yang berperan sebagai antioksidan. Asam ursolik pada kemangi diindikasi mampu menghambat peroksidasi lipid, namun belum ada penelitian yang dapat menjelaskan bagaimana mekanisme kerjanya (Balanehru & Nagarajan, 1991). Kemangi menurut Sangi dan Katja (2001) mengandung senyawa antioksidan seperti betakaroten, vitamin E, vitamin C, serta senyawa-senyawa fenolik. Vitamin E sendiri menurut penelitian Maslachah (2008) berpotensi sebagai pemutus rantai pada membran yang dapat mencegah kerusakan sel oleh peroksidasi lipid dan menghambat pembentukan radikal bebas. 2.4 Siklus Estrus Siklus estrus merupakan siklus reproduksi hewan betina khususnya mamalia non primata. Siklus estrus dibagi menjadi empat fase berdasarkan perubahan fisiologi, morfologi, dan tingkah laku. Fase yang terjadi selama satu siklus estrus antara lain fase proestrus, estrus, metestrus, dan diestrus. Siklus estrus erat kaitannya dengan fluktuasi hormonal yang diregulasi oleh gonadotropin dan disekresi oleh hipofisa anterior (Suckow dkk, 2005). Estrus dipengaruhi oleh Gonadotropin Releasing Hormone (GnRH ) yang disintesis di hipotalamus dan disekresikan ke hipofisa anterior. GnRH akan mempengaruhi sekresi Follicle Stimulating Hormone (FSH) dan Luteinizing Hormone (LH). FSH dan LH akan merangsang ovarium untuk mensekresikan hormon estrogen dan progesteron yang akan mempengaruhi siklus estrus (Schatten & Constantinescu, 2007). Siklus estrus diawali dengan fase proestrus. Fase ini ditandai dengan terjadinya perkembangan folikel antral pada ovarium karena adanya FSH serta terjadi peningkatan konsentrasi estrogen. Konsentrasi estrogen yang meningkat merangsang pembelahan sel di rahim dan vagina serta merangsang akumulasi cairan di oviduk (Pritchett & Taft, 2007).. 8.
(22) Estrogen berperan untuk merangsang pertumbuhan epitel vagina dan folikel ovarium sehingga menjadi matang dan siap untuk ovulasi. Persiapan ovulasi menyebabkan kadar estrogen di dalam darah menjadi tinggi dan masuk ke fase estrus (Schatten & Constantinescu, 2007). Memasuki fase estrus, individu betina menjadi lebih responsif akibat pengaruh peningkatan konsentrasi estrogen (Pritchett & Taft, 2007). Meningkatnya kadar estrogen akan menyebabkan adanya rangsangan GnRH untuk memproduksi LH. Pada tahap berikutnya akan terjadi ovulasi karena adanya lonjakan LH (Schatten & Constantinescu, 2007). Terjadinya lonjakan LH dan ovulasi akan menyebabkan terjadinya penurunan konsentrasi estrogen. Hal ini mengindikasi sudah masuk ke fase metestrus (Pritchett & Taft, 2007). Selanjutnya memasuki fase diestrus. Jika tidak terjadi implantasi maka korpus luteum akan terdegenerasi dan mengecil secara bertahap (Schatten & Constantinescu, 2007). Menjelang akhir fase diestrus akan terjadi perkembangan folikel menjelang kembali ke fase proestrus (Pritchett & Taft, 2007). Tikus (Rattus norvegicus) termasuk dalam golongan hewan poliestrus yang dapat mengalami siklus estrus lebih dari satu kali selama satu tahun. Tikus remaja hingga dewasa memiliki durasi siklus estrus yang sama dengan mencit. Umumnya durasi siklus estrus tikus terjadi selama 4 sampai 6 hari. Fase fase proestrus pada tikus terjadi selama kurang lebih 12 jam, fase estrus selama kurang lebih 12 jam, fase metestrus selama kurang lebih 21 jam, dan fase diestrus selama kurang lebih 57 jam (Westwood, 2008). Tikus yang sudah memasuki masa premenopause akan mengalami perubahan siklus estrus (Suckow dkk, 2005). Perubahan siklus estrus pada tikus usia lanjut (9-12 bulan) dipengaruhi oleh perubahan steroidogenesis ovarium dan kurangnya responsivitas umpan balik positif terhadap estradiol (Barnes & Sarkar, 1995). Pada saat masa premenopause fungsi ovarium untuk memproduksi hormon estrogen dan progesteron akan menurun. Penurunan hormon estrogen ini akan menyebabkan siklus reproduksi menjadi terganggu (Sperrof & Fritz, 2005). Kandungan hormon estrogen yang menurun akan menyebabkan proliferasi dan kornifikasi sel epitel vagina menjadi terganggu. Seperti yang diketahui kornifikasi merupakan tanda terjadinya fase estrus (Westwood, 2008). 9.
(23) 2.5 Reactive Oxygen Species (ROS) dan Malondialdehide (MDA) Radikal bebas adalah senyawa kimia berupa atom atau molekul yang memiliki elektron tidak berpasangan pada lapisan luarnya (Winarsi, 2007). Elektron tidak berpasangan tersebut akan berusaha mencapai kestabilan dengan menyerang molekul terdekat untuk memperoleh pasangan elektron. Hal ini dapat menyebabkan rusaknya sel-sel makromolekul yang berakibat pada terjadinya stres oksidatif. Stres oksidatif umumnya menyerang protein, lemak atau lipid, asam nukleat, dan gliko-konjugat. Target yang paling rentan diserang oleh stress oksidatif adalah lemak tidak jenuh ganda atau Poly Unsaturated Fatty Acid (PUFA) (Sharma dkk., 2003). Grotto dkk., (2009) menyatakan bahwa radikal bebas yang ada di dalam tubuh akan membentuk ikatan ganda karbon-karbon dari PUFA. Ikatan ganda yang terbentuk akan melemahkan ikatan karbon-hidrogen sehingga memudahkan pemisahan hidrogen oleh radikal bebas. Hidrogen dari PUFA yang sudah terpisah akan mengalami oksidasi dan menghasilkan radikal lipid peroksil. Radikal lipid peroksil dapat bereaksi dengan PUFA yang lain untuk menghasilkan lipid hidroperoksida dan fragmentasi lain yang dapat memproduksi Malondialdehyde (MDA). Radikal bebas dapat menyebabkan terjadinya gangguan metabolit dan gangguan seluler yang berimplikasi pada berubahnya laju aktivitas enzim (Winarsi, 2007). Radikal bebas sering dikaitkan dengan peristiwa aging atau penuaan. Wickens (2001) menyatakan bahwa salah satu penyebab terjadinya penuaan adalah adanya akumulasi kerusakan oksidatif yang diakibatkan karena radikal bebas. Pernyataan tersebut diperkuat dengan dua bukti dari hasil penelitian tentang Free Radical Theory of Aging. Bukti pertama menyatakan bahwa peningkatan enzim antioksidan dapat memperpanjang rentang hidup bagi hewan coba usia lanjut. Bukti kedua menyatakan bahwa tingkat kerusakan sel akibat radikal bebas semakin meningkat seiring dengan bertambahnya usia. Sel yang terpapar oleh radikal bebas akan mengalami kerusakan membran sel (Winarsi 2007). Rusaknya membran sel karena radikal bebas dapat terjadi melalui beberapa mekanisme antara lain (a) radikal bebas berikatan dengan enzim dan/atau reseptor di membran, sehingga merubah komponen yang terdapat pada membran sel tersebut; (b) radikal bebas berikatan dengan komponen membran sel, sehingga merubah struktur membran dan mengakibatkan fungsinya 10.
(24) berubah; (c) radikal bebas mengganggu sistem transport membran, mengoksidasi kelompok thiol, atau dengan merubah asam lemak polyunsaturated; (d) radikal bebas menginisiasi peroksidasi lipid secara langsung terhadap asam lemak polyunsaturated (Sikka dkk., 1995). Secara fisiologis, radikal bebas (ROS-Reactive Oxygen Species) diproduksi dalam tubuh. ROS diproduksi secara normal di mitokondria, fagosit, xantin oxidase, peroksisom, iskemi, jalur pembentukan asam arakhidonat, dan lain sebagainya (Sudiana, 2008). Sementara menurut Rani & Yadav (2014) menyatakan bahwa ROS terbentuk secara normal dalam tubuh melalui serangkaian reaksi enzimatik. ROS contohnya hidrogen peroksida (H202), anion superoksida (02-), radikal hidroksil (OH), dan hipoklorit radikal (OHCl). ROS dalam jumlah tertentu dibutuhkan untuk membunuh bakteri di dalam tubuh. Namun apabila jumlahnya berlebihan dapat menyebabkan ketidakseimbangan antara prooksidan dan antioksidan (Sudiana, 2008). Produksi ROS berlebih akan menyebabkan terjadinya ketidakseimbangan antara prooksidan dan antioksidan yang dapat memicu terjadinya stres oksidatif (Inoue, 2001). Stres oksidatif dapat menghambat kerja enzim antioksidan (Rani & Yadav, 2014). Kondisi ini menyebabkan efek negatif di tingkat sel, jaringan, hingga organ tubuh (Inoue, 2001). Stres oksidatif secara jangka panjang akan menyebabkan munculnya beragam penyakit dan memicu terjadinya percepatan proses penuaan (penuaan dini) (Wickens, 2001). ROS dapat memicu terjadi peroksidasi lipid melalui tahap inisiasi dan propagasi. Inisiasi disebabkan karena radikal bebas mengekstrak foton dari rantai samping PUFA akibat adanya radikal bebas. Hal ini menyebabkan PUFA berubah menjadi karbon radikal. Selanjutnya masuk ke tahap propagasi, adanya oksigen akan mengakibatkan karbon radikal berubah menjadi radikal peroksil. Radikal peroksil mampu menyebabkan abstraksi atom hidrogen dari rantai samping PUFA. Hal ini memicu reaksi berantai yang mengarah pada perambatan peroksidasi lipid. Radikal peroksil yang telah berikatan dengan atom hidrogen berubah menjadi lipid hidroperoksida (Li, 2012). Malondialdehide (MDA) adalah salah satu produk peroksidasi Poly Unsaturated Fatty Acid (PUFA) yang mengandung setidaknya dua ikatan rangkap ganda terstruktur (Roberfroid & Calderon, 1995). 11.
(25) Sementara Sies (1985) menyatakan bahwa MDA dan aldehid lainnya merupakan produk peroksidasi lipid yang disebabkan oleh radikal bebas. Kadar MDA dalam serum atau jaringan dapat berfungsi sebagai penanda kerusakan seluler akibat radikal bebas. Kerusakan sel akibat MDA disebabkan karena adanya polimerisasi dan cross-linking pada komponen membran sel (Girotti, 1998). 2.6 Antioksidan ROS berlebih akan memicu stres oksidatif, yaitu ketidakseimbangan antara radikal bebas dan antioksidan. Kondisi ini disebabkan karena kurangnya antioksidan dan/atau berlebihnya produksi radikal bebas. Pada saat produksi ROS meningkat, maka kontrol protektif tidak mencukupi sehingga memicu stress oksidatif (Inoue, 2001). Antioksidan adalah zat pencegah terjadinya stres oksidatif akibat adanya radikal bebas (Charles, 2013). Antioksidan adalah zat, yang memecah reaksi berantai radikal bebas, sehingga mengurangi stres oksidatif. Antioksidan, secara umum bekerja dengan menekan pembentukan ROS (Rani & Yadav, 2014). Antioksidan dapat dikelompokkan menjadi dua, yaitu antioksidan sintesis dan antioksidan alami. Antioksidan sintesis contohnya Butylated Hydroxy Anisole (BHA) dan Butylated Hydroxy Toluene (BHT) apabila digunakan secara jangka panjang dapat menimbulkan efek samping yang berbahaya (Juncan & Hodisan, 2011). Antioksidan bekerja melalui mekanisme primer dan sekunder. Antioksidan primer bekerja dengan bantuan enzim untuk memutus reaksi berantai radikal bebas dan mengubahnya menjadi produk yang lebih stabil. Enzim yang digunakan dalam reaksi ini antara lain glutathione peroxidase (GSH-Px), catalase (CAT), dan superoxide dismutase (SOD) (Winarsi, 2007). Antioksidan sekunder berasal dari luar seperti flavonoid, beta karoten, vitamin C, dan masih banyak lagi (Mangoting, dkk., 2006; Charles, 2013) Antioksidan sekunder bekerja dengan cara mendonorkan atom hidrogen untuk menstabilkan elektron tidak berpasangan pada radikal bebas (Winarsi, 2007). Senyawa antioksidan dari luar dapat berfungsi sebagai inducer untuk mengaktivasi protein nuclear factor erythroid 2 related factor 2 (Nrf2). Nrf2 adalah protein di sitosol yang dalam kondisi tidak 12.
(26) terpapar radikal bebas akan berikatan dengan keap-1. Namun dalam kondisi terpapar radikal bebas, Nrf2 akan lepas dari keap-1 dan bertranslokasi ke nukleus. Nrf2 di nukleus akan berikatan dengan Antioxidant Response Element (ARE) bersama protein small Musculoaponeurotic fibrosarcoma (sMaf) untuk mengaktivasi ekspresi gen sitoprotektif. (Mann dkk., 2007). Gen sitoprotektif yang terbentuk antara lain HO-1, Prx-1, Trx-1, xCT, GST, NQO-1 (Son dkk., 2008).. 13.
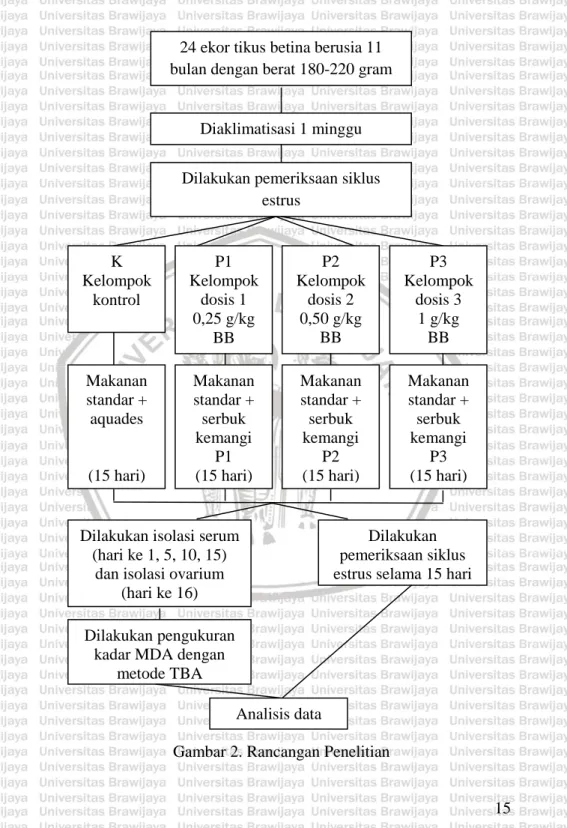
(27) BAB III METODE 3.1 Waktu dan Tempat Penelitian dilakukan pada bulan Desember 2016 sampai Mei 2017. Penelitian bertempat di Laboratorium Biologi Molekuler dan Seluler serta Laboratorium Anatomi, Struktur, dan Fisiologi Hewan, Jurusan Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Brawijaya, Malang. 3.2 Rancangan Penelitian Rancangan penelitian yang digunakan dalam penelitian ini adalah Rancangan Acak Lengkap Faktorial (RAL). Rancangan penelitian dapat dilihat pada Gambar 2. Hewan coba yang digunakan adalah 24 ekor tikus putih (Rattus norvegicus) galur wistar. Kriteria tikus yang digunakan adalah berjenis kelamin betina, berumur kurang lebih 11 bulan dengan berat badan antara 180-220 gram. Usia 11 bulan merupakan usia peralihan sebelum tikus memasuki masa menopause. Hal ini sesuai dengan Suckow dkk., (2005) yang menyatakan bahwa tikus memasuki masa produktif di usia 3-10 bulan dan memasuki masa menopause pada usia 15 hingga 18 bulan. Perlakuan dibagi menjadi empat kelompok sebagai berikut: a. Kelompok K : Diberi minum akuades b. Kelompok P1 : Diberi larutan serbuk daun kemangi dengan dosis 0,25 g/kg BB tikus. c. Kelompok P2 : Diberi larutan serbuk daun kemangi dengan dosis 0,5 g/kg BB tikus. d. Kelompok P3 : Diberi larutan serbuk daun kemangi dengan dosis 1 g/kg BB tikus. 3.3 Variabel Penelitian Variabel dalam penelitian ini antara lain: a. Variabel bebas : Serbuk daun kemangi b. Variabel terikat : Kadar MDA serum dan ovarium serta siklus estrus c. Variabel kontrol: Variasi genetik, usia, berat badan, jenis kelamin, jenis makanan dan minuman. 14.
(28) 24 ekor tikus betina berusia 11 bulan dengan berat 180-220 gram. Diaklimatisasi 1 minggu Dilakukan pemeriksaan siklus estrus. K Kelompok kontrol. P1 Kelompok dosis 1 0,25 g/kg BB. P2 Kelompok dosis 2 0,50 g/kg BB. P3 Kelompok dosis 3 1 g/kg BB. Makanan standar + aquades. Makanan standar + serbuk kemangi P1 (15 hari). Makanan standar + serbuk kemangi P2 (15 hari). Makanan standar + serbuk kemangi P3 (15 hari). (15 hari). Dilakukan isolasi serum (hari ke 1, 5, 10, 15) dan isolasi ovarium (hari ke 16). Dilakukan pemeriksaan siklus estrus selama 15 hari. Dilakukan pengukuran kadar MDA dengan metode TBA Analisis data Gambar 2. Rancangan Penelitian. 15.
(29) 3.4. Langkah Penelitian. 3.4.1 Persiapan serbuk daun kemangi Serbuk daun kemangi yang digunakan berasal dari UPT Materia Medica Jl. Lahor, Batu, Jawa Timur. Serbuk daun kemangi dilarutkan dengan aquades sesuai dengan perhitungan rumus dosis yang diberikan pada tikus (lampiran 2). 3.4.2 Perlakuan hewan coba Sebelum diberi perlakuan, hewan coba diaklimatisasi selama 7 hari. Perlakuan dilakukan pada kelompok tikus yang fase siklus estrusnya sama, yaitu pada fase estrus. Tikus betina diberi perlakuan secara sonde peroral. Perlakuan yang diberikan yaitu pemberian serbuk daun kemangi dosis 0,25 g/kg BB tikus, dosis 0,50 g/kg BB tikus, dan 1 g/kg BB tikus. Perlakuan diberikan selama 15 hari pada pagi hari. Sebelum diberi perlakuan, tikus ditimbang berat badannya terlebih dahulu. Penimbangan berat badan berfungsi untuk mengkonversi berat badan tikus dengan volume serbuk daun kemangi yang akan diberikan kepada tikus. 3.4.3 Pemeriksaan siklus estrus Pemeriksaan siklus estrus dilakukan selama 15 hari. Siklus estrus diamati melalui preparat apusan vagina.Vagina diapus dengan cotton bud yang sudah dibasahi dengan akuades.Cotton bud yang sudah dibasahi dimasukkan ke dalam vagina mencit.Selanjutnya cotton bud diputar 2-3 kali putaran hingga diperoleh sel epitel. Sel epitel diapus atau dismear ke gelas obyek yang sudah dibersihkan dengan alkohol. Proses apus dilakukan dengan cara menggulung cotton bud pada permukaan gelas obyek steril. Selanjutnya preparat sel epitel difiksasi dengan methanol selama ± 10 menit. Setelah itu preparat dikeringanginkan. Berikutnya preparat dicuci dengan PBS selama ± 5 menit. Preparat yang sudah dicuci harus dikeringanginkan hingga kering agar pewarna dapat bekerja dengan optimal. Preparat yang sudah kering ditetesi dengan pewarna giemsa. Pewarna diratakan hingga menutupi seluruh apusan sel epitel. Proses pewarnaan dengan giemsa dilakukan selama ± 5 menit. Berikutnya preparat dicuci dengan air mengalir. Preparat dikeringanginkan lalu diamati dengan mikroskop pada perbesaran 100 X dan 400 X. Pemeriksaan siklus estrus dilakukan selama 24 jam sekali. 16.
(30) Parameter yang diamati adalah perubahan sitologi sel epitel vagina. Siklus estrus terdiri dari empat fase yaitu proestrus, estrus, metestrus, dan diestrus yang masing-masing fasenya memiliki ciri sitologi yang berbeda. Fase proestrus ditandai dengan adanya sel epitel berinti dan sedikit sel epitel yang terkornifikasi (Busman, 2013). Fase esrus ditandai dengan adanya sel epitel terkornifikasi. Fase metestrus ditandai dengan adanya sedikit sel leukosit serta beberapa sel epitel yang terkonifikasi (Busman, 2013).. (a). (c). (b). (d) (Zenclussen dkk., 2014). Gambar 3. Perubahan sitologi selama siklus estrus. Keterangan : (a) fase diestrus (b) proestrus (c) fase estrus (d) fase metestrus 3.4.4 Pemeriksaan kadar MDA serum Pemeriksaan kadar MDA serum sama dengan yang dilakukan oleh Panjaitan dkk. (2012) yaitu menggunakan reagen thiobarbituric acid. Serum diisolasi pada hari ke-1, ke-5, ke-10, dan hari ke-15. 17.
(31) Langkah pertama darah tikus diisolasi dari bagian ekor lalu ditampung di tabung ependorf. Selanjutnya darah disentrifugasi dengan kecepatan 10.000 rpm selama 10 menit dengan suhu 4 ◦C untuk memisahkan pelet dengan supernatan yang mengandung serum. Supernatan hasil sentrifugasi diambil 50 µl ditambah dengan 500 µl thiobarbituric acid (TBA) dan 250 µl trichloroacetic acid (TCA) lalu dihomogenkan. Berikutnya homogenat diinkubasi dalam suhu 100 ◦C selama 5 menit. Setelah itu homogenate disentrifugasi dengan kecepatan 12.000 rpm selama 5 menit dengan suhu 25 ◦C. Langkah terakhir dibaca absorbansinya pada panjang gelombang 532 nm. 3.4.5 Pemeriksaan kadar MDA ovarium Pemeriksaan kadar MDA ovarium sama dengan yang dilakukan oleh Panjaitan dkk. (2012) yaitu menggunakan reagen thiobarbituric acid. Ovarium diisolasi pada hari ke-16. Langkah pertama ovarium diisolasi dari tubuh tikus lalu dicuci dengan poshpat buffer saline. Berikutnya ovarium dihomogenkan dengan larutan buffer potasium klorida 1,5 % dengan perbandingan 1:10. Homogenat yang diperoleh disentrifugasi dengan kecepatan 10.000 rpm selama 10 menit dengan suhu 4 ◦C. Supernatan hasil sentrifugasi diambil 50 µl ditambah dengan 500 µl thiobarbituric acid (TBA) dan 250 µl trichloroacetic acid (TCA) lalu dihomogenkan. Berikutnya homogenat diinkubasi dalam suhu 100 ◦C selama 5 menit. Setelah itu homogenate disentrifugasi dengan kecepatan 12.000 rpm selama 5 menit dengan suhu 25 ◦C. Langkah terakhir dibaca absorbansinya pada panjang gelombang 532 nm. 3.4.6 Pembuatan kurva standar Tetraetoksipropan (TEP) Kurva standar digunakan untuk mengkonversi hasil pengukuran MDA dengan metode TBA. Kurva standar dibuat dengan cara membuat larutan stock dari 9,6 µl reagen MDA kit dengan 10 ml 0,1 N HCl. Stock larutan selanjutnya diinkubasi dalam suhu 100 ◦C selama 5 menit. Berikutnya 100 µlstock MDA yang sudah dibuat dilarutkan dengan 900 µl dH2O.Larutan stock MDA dan dH2O didilusi secara bertingkat seperti yang tertera pada Tabel 1 Lampiran 3. Dilusi yang sudah dibuat diinkubasi dalam suhu 100 ◦C selama 5 menit. Setelah itu disentrifugasi dengan kecepatan 12.000 rpm 18.
(32) selama 5 menit dengan suhu 25 ◦C. Langkah terakhir dibaca absorbansinya pada panjang gelombang 532 nm. Tabel 1. Dilusi bertingkat untuk kurva standar MDA Stock MDA dH2O TBA No. (µl) (µl) (µl) 1 0 100 500 2 10 90 500 3 20 80 500 4 30 70 500 5 40 60 500 6 50 50 500 7 60 40 500 8 70 30 500 9 80 20 500 10 90 10 500 11 100 0 500. TCA (µl) 250 250 250 250 250 250 250 250 250 250 250. 3.5 Analisis Data Data hasil penelitian berupa panjang durasi siklus estrus, kadar MDA serum dan ovarium tikus premenopause dianalisis dengan ANOVA menggunakan program SPSS 16 for Windows. Apabila hasil uji ANOVA menunjukkan perbedaan yang signifikan (p<0,05), maka analisis dilanjutkan dengan uji Tukey.. 19.
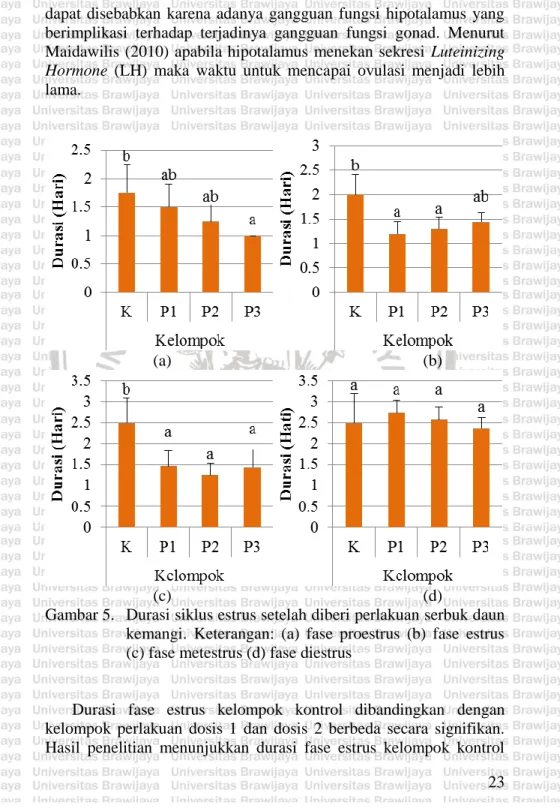
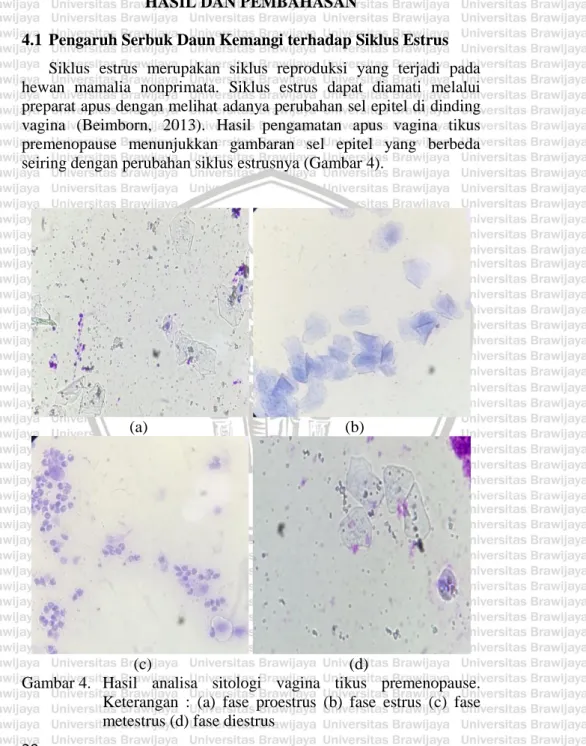
(33) BAB IV HASIL DAN PEMBAHASAN 4.1 Pengaruh Serbuk Daun Kemangi terhadap Siklus Estrus Siklus estrus merupakan siklus reproduksi yang terjadi pada hewan mamalia nonprimata. Siklus estrus dapat diamati melalui preparat apus dengan melihat adanya perubahan sel epitel di dinding vagina (Beimborn, 2013). Hasil pengamatan apus vagina tikus premenopause menunjukkan gambaran sel epitel yang berbeda seiring dengan perubahan siklus estrusnya (Gambar 4).. (a). (b). (c) (d) Gambar 4. Hasil analisa sitologi vagina tikus premenopause. Keterangan : (a) fase proestrus (b) fase estrus (c) fase metestrus (d) fase diestrus 20.
(34) Hasil pengamatan fase proestrus ditunjukkan dengan adanya dominasi sel epitel berinti dengan sedikit sel epitel yang terkornifikasi. Fase estrus ditunjukkan dengan adanya sel epitel tidak berinti yang sudah terkornifikasi. Hasil pengamatan fase metestrus didominasi dengan leukosit. Sementara hasil pengamatan sitologi fase diestrus ditandai dengan adanya sel epitel berinti dan sedikit sel leukosit. Preparat apusan yang diperoleh selama penelitian hanya mengandung sedikit sel epitel. Hal ini kemungkinan disebabkan karena tikus yang digunakan untuk penelitian sudah memasuki masa premenopause. Manuaba (1998) menyatakan bahwa kondisi premenopause menyebabkan terjadinya penipisan sel epitel vagina. Setiap fase pada siklus estrus dicirikan dengan sel epitel yang berbeda. Nalbandov (1990) menyatakan bahwa fase proestrus ditandai dengan adanya sel epitel berinti, fase estrus ditandai dengan adanya sel epitel tidak berinti yang mengalami kornifikasi, fase metestrus didominasi oleh sel leukosit dengan sedikit sel epitel berinti berinti, dan fase diestrus ditandai dengan sel epitel berinti serta sedikit leukosit. Setelah 15 hari pengamatan, diketahui bahwa terdapat pola pemendekan durasi siklus estrus dari kelompok kontrol dibandingkan dengan kelompok perlakuan. Siklus estrus pada kelompok kontrol terjadi selama kurang lebih 8 hari. Sementara siklus estrus pada kelompok perlakuan berlangsung selama 6 hingga 7 hari (Tabel 2 dan Gambar 5). Tabel 2. Hasil perhitungan pengaruh serbuk daun kemangi terhadap durasi siklus estrus Kelompok K P1 P2 P3. Proestrus 1.75±0.500 1.5±0.408 1.25±0.288 1±0. Durasi Siklus Etsrus (Hari) Estrus Metestrus Diestrus 2±0.408 2.5±0.577 2.5±0.707 1.2±0.244 1.47±0.35 2.75±0.288 1.3±0.244 1.25±0.288 2.57±0.298 1.45±0.173 1.45±0.420 2.37±0.25. 21.
(35) Panjangnya durasi siklus estrus pada kelompok kontrol dapat disebabkan karena tikus sudah memasuki masa penuaan. Barnes & Sarkar (1995) dalam bukunya menyatakan bahwa penuaan reproduktif pada tikus usia lanjut (9-12 bulan) ditandai dengan adanya transisi siklus estrus secara bertahap. Siklus reguler yang umumnya berlangsung selama 4 hingga 6 hari bertransisi menjadi lebih panjang dan siklusnya tidak teratur. Observasi yang dilakukan oleh Barnes & Sarkar (1995) menunjukkan bahwa perubahan steroidogenesis ovarium dan kurangnya responsivitas umpan balik positif terhadap estradiol, berkontribusi terhadap pemanjangan dan ketidakteraturan siklus estrus pada tikus tua. Pemendekan durasi siklus estrus pada kelompok perlakuan dapat diindikasi sebagai upaya untuk mengembalikan siklus estrus seperti tikus normal yang belum memasuki fase premenopause. Tikus yang mature memiliki durasi siklus estrus antara 4 sampai 6 hari (Craig dkk., 2006). Suckow dkk. (2005) menyatakan bahwa durasi siklus estrus pada tikus laboratorium terjadi selama 4 hingga 6 hari. Umumnya durasi fase proestrus pada tikus terjadi selama kurang lebih 14 jam, fase estrus selama kurang lebih 9-15 jam, fase metestrus selama kurang lebih 21 jam, dan fase diestrus selama kurang lebih 57 jam. Sedangkan hasil penelitian Westwood (2008) menunjukkan bahwa durasi fase proestrus pada tikus terjadi selama kurang lebih 12 jam, fase estrus selama kurang lebih 12 jam, fase metestrus selama kurang lebih 21 jam, dan fase diestrus selama kurang lebih 57 jam. Hasil analisis data (Lampiran 4) menunjukkan bahwa durasi fase diestrus antara kelompok kontrol dengan kelompok perlakuan tidak berbeda nyata (P>0,05). Sementara durasi fase proestrus, estrus, dan metestrus tikus premenopause antara kelompok kontrol dengan kelompok perlakuan berbeda nyata (P<0,05). Hal tersebut menunjukkan bahwa serbuk daun kemangi tidak berpengaruh terhadap durasi fase diestrus namun berpengaruh terhadap fase proestrus, estrus, dan metestrus tikus premenopause (Gambar 5). Durasi fase proestrus mengalami penurunan antara kelompok kontrol dengan kelompok perlakuan. Penurunan paling signifikan terjadi antara kelompok kontrol dibanding dengan kelompok perlakuan dosis 3. Fase proestrus merupakan fase ketika folikel ovarium tumbuh menjadi folikel de graaf dibawah pengaruh Follicle Stimulating Hormone (FSH). Durasi fase proestrus di kelompok kontrol lebih panjang dibanding dengan kelompok perlakuan. Hal ini 22.
(36) dapat disebabkan karena adanya gangguan fungsi hipotalamus yang berimplikasi terhadap terjadinya gangguan fungsi gonad. Menurut Maidawilis (2010) apabila hipotalamus menekan sekresi Luteinizing Hormone (LH) maka waktu untuk mencapai ovulasi menjadi lebih lama.. (a). (b). (c) (d) Gambar 5. Durasi siklus estrus setelah diberi perlakuan serbuk daun kemangi. Keterangan: (a) fase proestrus (b) fase estrus (c) fase metestrus (d) fase diestrus. Durasi fase estrus kelompok kontrol dibandingkan dengan kelompok perlakuan dosis 1 dan dosis 2 berbeda secara signifikan. Hasil penelitian menunjukkan durasi fase estrus kelompok kontrol 23.
(37) lebih panjang dibanding dengan kelompok perlakuan. Pendeknya durasi fase estrus pada kelompok perlakuan dapat diindikasi sebagai upaya mengembalikan durasi siklus estrus seperti tikus usia produktif. Tikus kelompok kontrol mengalami fase estrus lebih panjang daripada kelompok perlakuan yang diberi serbuk daun kemangi. Hal ini disebabkan karena tikus premenopause mengalami perubahan siklus estrus. Barnes & Sarkar (1995) menyatakan bahwa tikus yang sudah memasuki usia lanjut antara 9-12 bulan akan mengalami perubahan siklus estrus, salah satunya adalah terjadi pemanjangan durasi fase estrus. Hal tersebut disebabkan karena adanya peningkatan estrogen namun tidak diikuti dengan lonjakan gonadotropin preovulator. Durasi fase metestrus antara kelompok kontrol dengan seluruh kelompok perlakuan berbeda nyata (P<0,05). Hasil penelitian menunjukkan bahwa durasi fase metestrus dari seluruh kelompok perlakuan lebih pendek apabila dibandingkan dengan kelompok kontrol. Durasi fase metestrus yang paling rendah ada di kelompok perlakuan dosis 1. Durasi fase metestrus yang memendek dapat diindikasi sebagai upaya untuk mempertahankan durasi siklus estrus lebih lama (Ahmed dkk., 2002). Durasi fase metestrus kelompok kontrol lebih panjang dibandingkan dengan kelompok perlakuan. Hal ini dapat disebabkan karena pada kondisi premenopause terjadi lonjakan LH hingga 3 kali lipat daripada kondisi normal (Sherwood, 2001). Akibatnya fase metestrus menjadi lebih lama. Menurut Sherwood (2001) pada fase premenopause terjadi penurunan fungsi ovarium sehingga respon untuk menjawab rangsangan gonadotropin menurun. Hal tersebut mengakibatkan interaksi antara hipotalamus-hipofisis menjadi terganggu. Kondisi ini meningkatkan produksi Follicle Stimulating Hormone (FSH) dan Luteinizing Hormone (LH). Rerata durasi fase diestrus antara kelompok kontrol dengan kelompok perlakuan tidak berbeda secara signifikan. Durasi fase diestrus yang paling panjang terjadi pada kelompok perlakuan dosis 1 dengan rerata 2,75±0,288 hari sementara durasi fase diestrus yang paling pendek terjadi pada kelompok dosis 3 dengan rerata 2,37±0,25 hari. Wicaksono dkk., (2013) menyatakan bahwa fase diestrus merupakan fase terakhir dalam siklus estrus yang durasinya paling lama apabila dibandingkan dengan fase yang lainnya. Suckow dkk. 24.
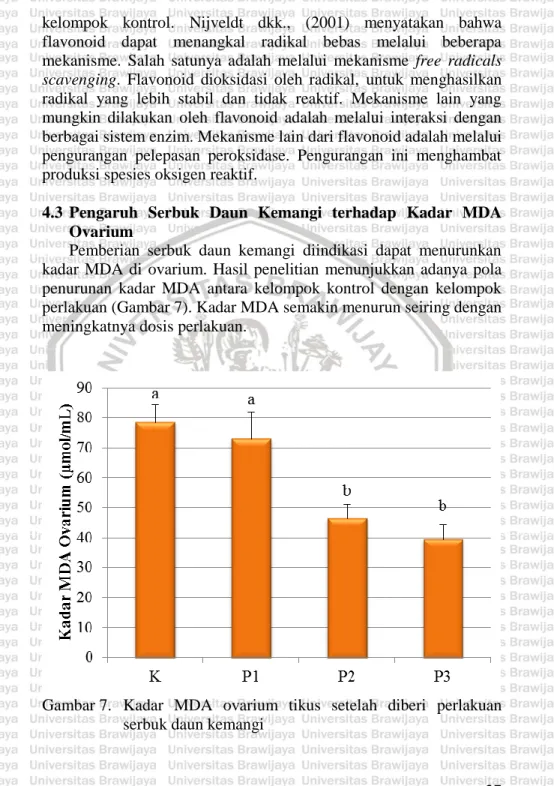
(38) (2005) dan Westwood (2008) menyatakan bahwa durasi fase diestrus pada tikus laboratorium terjadi selama kurang lebih 57 jam. 4.2 Pengaruh Serbuk Daun Kemangi terhadap Kadar MDA Serum Hasil analisa (Lampiran 5) menunjukkan bahwa rerata kadar MDA serum pada tikus kelompok kontrol lebih tinggi dibanding dengan kelompok perlakuan (Gambar 6). Hal ini disebabkan karena tikus kelompok kontrol sudah memasuki masa premenopause. Penelitian sebelumnya yang dilakukan oleh Signorelli dkk. (2006) menunjukkan bahwa kadar stress oksidatif pada golongan premenopause lebih tinggi dibanding yang golongan yang belum memasuki masa premenopause. Hasil penelitian Signorelli dkk. (2006) menunjukkan bahwa kadar malondialdehyde (MDA), 4hydroxynonenal (4-HNE), LDL teroksidasi, dan glutation peroksidase (GSH-Px) pada wanita golongan premenopause meningkat secara signifikan pada biomarker prooksidan dibanding dengan wanita yang belum memasuki masa premenopause. Hasil analisis kadar MDA serum pada perlakuan dosis 1 menunjukkan adanya penurunan dari hari ke-1 hingga hari ke-15, meskipun hasilnya tidak berbeda secara signifikan. Kadar MDA serum perlakuan dosis 2 mengalami penurunan dari hari ke-1 hingga hari ke-15. Kadar MDA serum perlakuan dosis 2 yang mengalami penurunan paling signifikan ditunjukkan dengan data kadar MDA serum hari ke-1 (78,9 ± 5,0000) dan hari ke-15 (63,4 ± 4,7610) yang berbeda nyata. Hasil analisis kadar MDA perlakuan dosis 3 dari hari ke-1 hingga hari ke-15 menunjukkan penurunan yang signifikan. Hal ini ditunjukkan dengan adanya perbedaan yang nyata antara kadar MDA di hari ke-1 (81,9 ± 7,0000 µmol/ml) dengan kadar MDA di hari ke15 (57,4 ± 8,4603 µmol/ml). Penurunan kadar MDA serum yang paling signifikan terjadi pada kelompok kontrol hari ke-15 (84,4 ± 5,8878 µmol/ml) dibandingkan dengan kelompok perlakuan dosis 3 hari ke-15 (57,4 ± 8,4603 µmol/ml). Hasil analisis statistik keduanya berbeda secara nyata. Girotti (1998), menyatakan bahwa kadar MDA pada serum dapat menggambarkan kondisi peroksidasi lipid oleh radikal bebas yang mengalir ke pembuluh darah. Semakin tinggi kadar MDA 25.
(39) maka semakin banyak konsentrasi radikal bebas di dalam tubuh, begitu pula sebaliknya. Hasil penelitian menunjukkan bahwa kelompok perlakuan dosis 3 (1 mg/g BB) memiliki kadar MDA yang paling rendah dibanding kelompok kontrol dan kelompok perlakuan dosis 1 dan dosis 2. Hal ini terjadi karena MDA yang terbentuk dapat dinetralisasi oleh kandungan antioksidan dalam serbuk daun kemangi. Akibatnya kadar MDA menjadi lebih rendah dibanding dengan kelompok yang lain.. Gambar 6. Kadar MDA serum tikus setelah diberi perlakuan serbuk daun kemangi Senyawa antioksidan yang terkandung di dalam kemangi seperti flavonoid, dapat menangkal radikal bebas sehingga tidak terjadi peroksidasi lipid (Charles, 2013) Apabila peroksidasi lipid tidak terjadi maka MDA tidak akan terbentuk (Mukholifah, 2015). Hal inilah yang menyebabkan kelompok perlakuan yang diberi serbuk daun kemangi mengalami penurunan kadar MDA dibanding dengan 26.
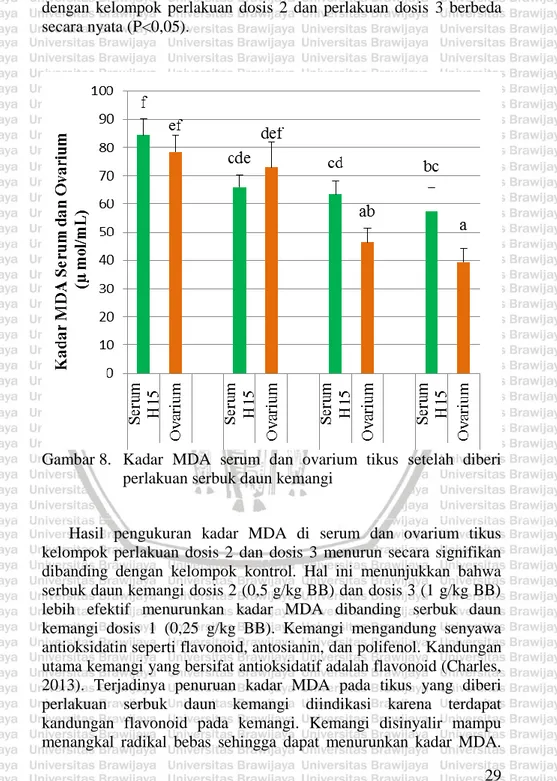
(40) kelompok kontrol. Nijveldt dkk., (2001) menyatakan bahwa flavonoid dapat menangkal radikal bebas melalui beberapa mekanisme. Salah satunya adalah melalui mekanisme free radicals scavenging. Flavonoid dioksidasi oleh radikal, untuk menghasilkan radikal yang lebih stabil dan tidak reaktif. Mekanisme lain yang mungkin dilakukan oleh flavonoid adalah melalui interaksi dengan berbagai sistem enzim. Mekanisme lain dari flavonoid adalah melalui pengurangan pelepasan peroksidase. Pengurangan ini menghambat produksi spesies oksigen reaktif. 4.3 Pengaruh Serbuk Daun Kemangi terhadap Kadar MDA Ovarium Pemberian serbuk daun kemangi diindikasi dapat menurunkan kadar MDA di ovarium. Hasil penelitian menunjukkan adanya pola penurunan kadar MDA antara kelompok kontrol dengan kelompok perlakuan (Gambar 7). Kadar MDA semakin menurun seiring dengan meningkatnya dosis perlakuan.. Gambar 7. Kadar MDA ovarium tikus setelah diberi perlakuan serbuk daun kemangi. 27.
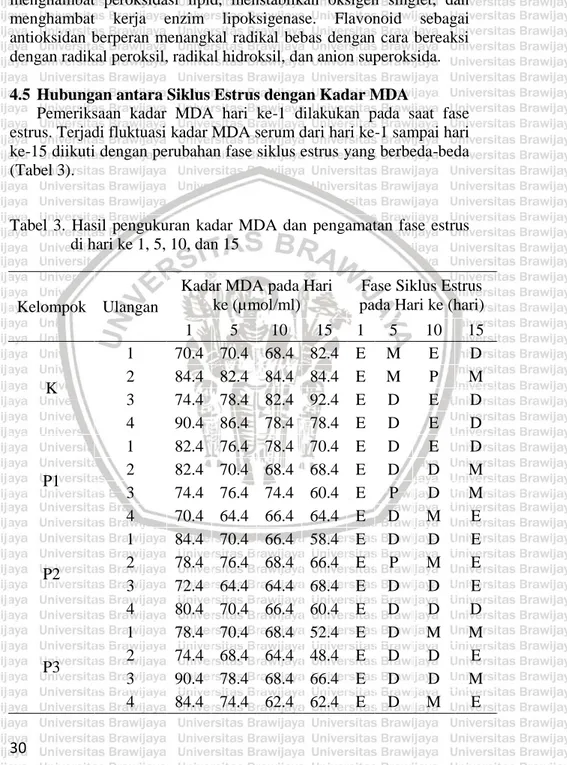
(41) Hasil analisis data (Lampiran 6) menunjukkan bahwa kadar MDA ovarium kelompok kontrol dan kelompok perlakuan dosis 1 berbeda nyata (P<0,05) dengan perlakuan kelompok 2 dan perlakuan kelompok 3. Kadar MDA perlakuan kontrol (78,4 ± 5,8788 µmol/mL) dibandingkan dengan kelompok perlakuan dosis 1 (72,9 ± 9,1469 µmol/mL) tidak berbeda nyata (P>0,05). Sementara kadar MDA ovarium antara kelompok kontrol (78,4 ± 5,8788 µmol/mL) dengan kelompok perlakuan dosis 2 (46,4 ± 4,8990 µmol/mL) dan dosis 3 (39,4 ± 4,7610 µmol/mL) berbeda nyata. Kelompok perlakuan dosis 3 (1 g/kg BB) memiliki kadar MDA paling rendah dibanding kelompok yang lain. Hal ini dapat disebabkan karena konsentrasi antioksidan dari serbuk daun kemangi kelompok perlakuan dosis 3 lebih tinggi dibanding dengan kelompok lainnya. Serbuk daun kemangi diketahui mengandung senyawa antioksidan yang berperan aktif dalam menangkal radikal bebas. Senyawa flavonoid yang terkandung dalam kemangi memiliki kekuatan 100 kali lebih efektif dibanding vitamin C dalam menangkal radikal bebas. Selain itu kemangi juga mengandung asam ursolik yang berperan penting dalam menghambat terjadinya peroksidasi lipid (Balanehru & Nagarajan, 1991). Apabila peroksidasi lipid terhambat maka produk yang dihasilkan berupa MDA menjadi menurun. 4.4 Pengaruh Serbuk Daun Kemangi terhadap Kadar MDA Serum dan Ovarium Hasil penelitian pengaruh serbuk daun kemangi terhadap kadar MDA serum hari ke-15 dan kadar MDA ovarium hari ke-16 menunjukkan adanya pola penurunan kadar MDA dari kelompok kontrol dibanding dengan kelompok perlakuan. Kadar MDA serum pada kelompok kontrol, dosis 2, dan dosis 3 lebih tinggi daripada kadar MDA ovarium (Gambar 8). Hal ini kemungkinan disebabkan karena kadar MDA di serum merupakan hasil dari keseluruhan kadar MDA di dalam tubuh yang terlarut dalam darah. Girotti (1998) menyatakan bahwa kadar MDA di serum dapat digunakan sebagai penanda kerusakan seluler di dalam tubuh akibat adanya radikal bebas. Hasil analisis statistik (Lampiran 7) menunjukkan bahwa kadar MDA serum dan ovarium kelompok kontrol dibandingkan dengan perlakuan dosis 1 tidak berbeda secara nyata (P>0,05). Sementara itu kadar MDA serum dan ovarium kelompok kontrol dibandingkan 28.
(42) dengan kelompok perlakuan dosis 2 dan perlakuan dosis 3 berbeda secara nyata (P<0,05).. Gambar 8. Kadar MDA serum dan ovarium tikus setelah diberi perlakuan serbuk daun kemangi Hasil pengukuran kadar MDA di serum dan ovarium tikus kelompok perlakuan dosis 2 dan dosis 3 menurun secara signifikan dibanding dengan kelompok kontrol. Hal ini menunjukkan bahwa serbuk daun kemangi dosis 2 (0,5 g/kg BB) dan dosis 3 (1 g/kg BB) lebih efektif menurunkan kadar MDA dibanding serbuk daun kemangi dosis 1 (0,25 g/kg BB). Kemangi mengandung senyawa antioksidatin seperti flavonoid, antosianin, dan polifenol. Kandungan utama kemangi yang bersifat antioksidatif adalah flavonoid (Charles, 2013). Terjadinya penuruan kadar MDA pada tikus yang diberi perlakuan serbuk daun kemangi diindikasi karena terdapat kandungan flavonoid pada kemangi. Kemangi disinyalir mampu menangkal radikal bebas sehingga dapat menurunkan kadar MDA. 29.
(43) Shahidi & Nackz (1995) menyatakan bahwa flavonoid dapat menghambat peroksidasi lipid, menstabilkan oksigen singlet, dan menghambat kerja enzim lipoksigenase. Flavonoid sebagai antioksidan berperan menangkal radikal bebas dengan cara bereaksi dengan radikal peroksil, radikal hidroksil, dan anion superoksida. 4.5 Hubungan antara Siklus Estrus dengan Kadar MDA Pemeriksaan kadar MDA hari ke-1 dilakukan pada saat fase estrus. Terjadi fluktuasi kadar MDA serum dari hari ke-1 sampai hari ke-15 diikuti dengan perubahan fase siklus estrus yang berbeda-beda (Tabel 3). Tabel 3. Hasil pengukuran kadar MDA dan pengamatan fase estrus di hari ke 1, 5, 10, dan 15. Kelompok Ulangan. K. P1. P2. P3. 30. 1 2 3 4 1 2 3 4 1 2 3 4 1 2 3 4. Kadar MDA pada Hari ke (µmol/ml) 1 70.4 84.4 74.4 90.4 82.4 82.4 74.4 70.4 84.4 78.4 72.4 80.4 78.4 74.4 90.4 84.4. 5 70.4 82.4 78.4 86.4 76.4 70.4 76.4 64.4 70.4 76.4 64.4 70.4 70.4 68.4 78.4 74.4. 10 68.4 84.4 82.4 78.4 78.4 68.4 74.4 66.4 66.4 68.4 64.4 66.4 68.4 64.4 68.4 62.4. 15 82.4 84.4 92.4 78.4 70.4 68.4 60.4 64.4 58.4 66.4 68.4 60.4 52.4 48.4 66.4 62.4. Fase Siklus Estrus pada Hari ke (hari) 1 E E E E E E E E E E E E E E E E. 5 M M D D D D P D D P D D D D D D. 10 E P E E E D D M D M D D M D D M. 15 D M D D D M M E E E E D M E M E.
(44) Kadar MDA serum pada hari pertama berkisar antara 70.4 µmol/ml sampai 92.4 µmol/ml. Seiring waktu penelitian, kadar MDA kelompok perlakuan berangsur turun dengan penurunan paling signifikan terjadi pada kelompok perlakuan dosis 3 (P3). Sementara itu kadar MDA kelompok kontrol berfluktuasi dengan nilai terendah yaitu 68.4 µmol/ml dan yang tertinggi 92.4 µmol/ml.. 31.
(45) BAB V KESIMPULAN DAN SARAN 5.1 Kesimpulan Pemberian serbuk daun kemangi berpengaruh terhadap durasi fase proestrus, estrus, dan metestrus tikus premenopause kelompok kontrol dibanding dengan kelompok perlakuan. Serbuk daun kemangi tidak berpengaruh secara signifikan pada fase diestrus tikus premenopause. Secara garis besar serbuk daun kemangi memperpendek durasi siklus estrus tikus premenopause yang diindikasi sebagai upaya untuk mengembalikan durasi siklus estrus seperti pada tikus usia produktif. Serbuk daun kemangi berpengaruh terhadap penurunan kadar MDA baik kadar MDA di serum maupun di ovarium. Penurunan paling signifikan terjadi pada kelompok kontrol dibanding dengan kelompok perlakuan dosis 3. 5.2 Saran Adapun saran yang dapat dilakukan untuk penelitian selanjutnya yaitu: 1. Perlu adanya penelitian lebih lanjut dengan rentang waktu pemberian serbuk daun kemangi yang lebih lama. 2. Perlu adanya penelitian lebih lanjut dengan pemberian dosis serbuk daun kemangi yang berbeda.. 32.
(46) DAFTAR PUSTAKA Ahmed M, M. Yunus, A. & A. Khan., 2002. Effects of Ocimim sanctum (Tulsi) on the reproductive system: an updated review. Biomedical Research 13 (2/3): 63-67. Altervista. 2008. Ocimum basilicum L. http://luirig.altervista.org/schedenam/fnam.php?taxon=Ocimum+ basilicum. Diakses 30 Desember 2016. Alway, S.E., Myers, M.J., & Mohamed, J.S. 2014. Reguation of satellite cell function in sarcopenia. Frontiers in Aging Neuroscience 6(3):19-33. Andareto, O. 2015. Apotik herbal di sekitar anda: Solusi pengobatan 1001 penyait secara alami dan sehat tanpa efek samping. Pustaka Ilmu Semesta. Jakarta Selatan. Baker, H. J., Lindsey, J. R., & Wesibroth, S. H. 1979. The laboratory rat: biology and diseases. Volume 1. Academic Press. New York Balanehru, S., & Nagarajan, B., 1991, Protective effect of oleanolic acid and ursolic acid against lipid peroxidation. Biochemistry International 24. 981–990 . Barnes, C. D. & Sarkar, D. K. 1995. The reproductive neuroendocrinology of aging and drug abuse. CRC Press. Florida. Beimborn, Valerie R. 2003. The canine estrous cycle: staging using vaginal cytological examination. http://www.vet.uga.edu/vpp/clerk/Beimborn/index.php. Diakses 30 Desember 2016. Busman, Hendri. 2013. Histologi ulas vagina dan waktu siklus estrus masa subur mencit betina setelah pemberian ekstrak rimpang rumput teki. Prosiding Semirata FMIPA Universitas Lampung. 371-375. Charles, Denys J. 2013. Antioxidant properties of spices, herbs and other sources. Springer Science & Business Media. New York. Chew, Ai Lan., Jessica, J., James.A., & Sasidharan, S. 2012. Antioxidant and antibacterial activity of different parts of Leucas aspera. Asian Prac Journal of Tropical Biomed. 2(3): 176-180. Craig L. F, Suckow, M. A., & Steven H. W. 2006. The laboratory rat. Second Edition. American College of Laboratory Animal Medicine Series. USA. 33.
(47) Girotti AW. 1998. Lipid hydroperoxide generation, turnover, and effector action in biological systems. J Lipid Res. 39: 1529-1542. Grotto, D., G.R. Barcelos, J.Valentini, L.M. An-tunes, J.P Angeli & S.C. Garcia 2009. Low level of methilmercury induce dna damage in rats: protective effects of selenium. Arch Toxicology 83:249-255. Guyton, A.C. 2006. Buku ajar fisiologi kedokteran. Edisi 5. Buku Kedokteran EGC. Jakarta. Hafez, E.S.E. 1993. Reproduction in farm animal. 6th Edition. Lea and Febiger. Philadelphia. Hamid, A.A., Aiyelaagbe, O.O., Usman, L.A., Ameen, O.M. & Lawal, A. 2010. Antioxidants: its medicinal and pharmacological applications. African Journal of Pure and Applied Chemistry 4(8):142–151. Hussain, A.I., Anwar, F., Sherazi, Syed.T.H., & Przybylski, R. 2008. Chemical composition, antioxidant and antimicrobial activities of basil (Ocimum basilicum) essential oils depends on seasonal variations. Food Chemistry 108(3) : 986-995 Inoue M. 2001. Protective mechanism against reactive oxygen species. L Jippincott Williams and Wilkins 4th-ed. Philadelphia. Juncan, A.M. & Hodisan, T., 2011, Determination of synthetic and natural antioxidants in cosmetic preparations by solid-phase extraction and subsequent gas and high performance liquid chromatographic analysis. J. Revistade Chimie. 62(4):415–419. Krishnaiah D, Sukla AR, Sikand K, Dhawan V. 2009. Effect of herbal polyphenols on artherogenic transcriptome. Mol. Cell Biochem. 278:177-184. Lemasters, J. J. & Nieminen, Anna-Liisa. 2007. Mitochondria in pathogenesis. Springer. New York. Li, Y, Robert. 2012. Free radical biomedicine : Principles, clinical correlation, and methodologies. Bentham Books. Virginia. Lobo, R, A., Kelsey J., & Marcus, R. 2000. Manopause: Biology and pathobiology. Academic Press. USA Maidawilis, 2010, Pengaruh pemberian monosodium glutamat terhadap kadar follicle stimulating hormone dan luteinizing hormone mencit (Mus musculus, L.) betina strain Jepang. Tesis. Universitas Andalas, Padang. Mangoting, D., Irawan, I., Abdullah, S.,2006. Tanaman lalap berkhasiat obat. Cetakan 3. Penebar Swadaya. Jakarta. 34.
(48) Mann, G. E., Niehueser-Saran, J., Watson, A., Gao, L., Ishii, T., Winter, P. de., & Siow, R. C. M. 2007. Nrf2/ARE regulated antioxidant gene expression in endothelial and smooth muscle cells in oxidative stress: implications for atherosclerosis and preeclampsia. Acta Physiologica Sinica 59 (2):117-27. Manuaba, Ida Bagus Gde. 1998. Ilmu kebidanan, penyakit kandungan, dan keluarga berencana untuk pendidikan bidan. Penerbit Buku Kedokteran IGC. Jakarta. Mardiana, L & R., Paimin, Fendy.2007. Ramuan Tradisional untuk Kesuburan Suami Istri. Cetakan 3. Penebar Swadaya. Jakarta. Maslachah, L., Sugihartuti, R., & Kurniasanti, R. 2008. Hambatan produksi reactive oxygen species radikal superoksida (o2.-) oleh antioksidan vitamin e (α- tocopherol ) pada tikus putih (Rattus norvegicus) yang menerima stressor renjatan listrik. Media Kedokteran Hewan 24(1): 21-26. Matson, Mark P. 2001. Telomerase, aging and disease. Elsevier. Amsterdam. Mukholifah. 2015. Pengaruh kombinasi ekstrak daun pegagan (Centella asiatica) dan beluntas (Plucea indica) terhadap jumlah folikel, kadar SOD, dan kadar MDA ovarium tikus putih (Rattus norvegicus). Universitas Islam Negeri Maulana Malik Ibrahim. Malang. Skripsi. Nalbandov. AN. 1990. Fisiologi reproduksi pada mamalia dan unggas. Terjemahan Keman, S. Penerbit Universitas Indonesia. Jakarta. Ngili, Y., Noer, A. S., Ahmad, A S., Syukriani, Y. F., Dessy N, & Yana M. S. 2012. Variants analysis of human mitochondrial genome mutation: study on indonesian human tissues. International Journal of ChemTech Research 4(2): 720-728. Nijveldt, R. J. van Nood, Els., van Hoorn, D.E.C., Boelens, P.G., van Norren, K., & van Leeuwen, P. 2001. Flavonoids: a review of probable mechanisms of action and potential applications1,2,3. American Society for Clinical Nutrition 74(4):418-425. Oeseburg H, de Boer RA, van Gilst WH, & van der Harst P 2010. Telomere biology in healthy aging and disease. Eur J Physiol. 459:259–26. Opresko, P.L., Kobbe, C., Laine, J.P., Harrigan, J., Hickson, I.D & Bohr, V.A. 2002. Telomere binding protein TRF2 binds to and 35.
(49) stimulates the Werner and Bloom syndrome helicases. J Biol Chem. 277: 41110–41119. Panjaitan,, Bernadetta C., Sa’adi A., & Widjiati, H.H. 2012. Comparison of ovarial malondialdehyde (MDA) level between endometriosis rat given with and without curcumine suplementation. Obstetric and Gynecology 20(1):30-34. Permadi, Adi. 2008. Membuat kebun tanaman obat. Cetakan 1. Pustaka Bunda. Jakarta. Prakash, P. & Gupta, N. 2005. Therapeutic uses of Ocimum sanctum Linn (tulsi) with a note on eugenol and its pharmacological actions: a short review. Indian Journal Physiology Pharmacology 49 (2) : 125–131 Preedy, Victor R. 2012. Aging: Oxidative stress and dietary antioxidants. 1st Published. Academic Press. USA Pritchett, K.R. & Taft, Robert. A. 2007. Reproductive biology of the laboratory mouse in the mouse in biomedical research: normative biology, husbandry, and models. 2nd Edition. Academic Press. USA. Rahman, S., Islam, R., Kamruzzaman, M., Khasrul,., & Jamal A. 2011. Ocimum sanctum L. A review of phytochemical and pharmacological profile. American Journal of Drug Discovery and Development. ISSN 2150-427x / doi:10.3923/ajdd 1-15. Rani, V., & Yadav, Umesh C.S. 2014. Free Radicals in Human Health and Disease. Springer. New Delhi. Roberfroid, M., & Calderon, P.B.. 1995. Free radicals and oxidation phenomena in biological systems. Marcel Dekker Inc. New York. Sanchez-Rodriguez, M.A., Zacarias-Flores, M., Arronte-Rosales, A., Correa-Munoz, E., & Mendoza,-Nunez, V.M. 2012. Menopause as risk factor for oxidative stress. Menopause 19(36):1-7. Sanchez-Rodriguez, M.A., Zacarias-Flores, M., & Mendoza,-Nunez, V.M. 2015. Menopause and oxidative stress. dalam Farage dkk., (Ed) Skin, mucosa and menopause: management of clinical issues. Springer. Berlin. hal 33-52. Schatten, H., & Constantinescu, G.M. 2007. Comparative reproductive biology. Blackwell Publishing. USA. Shahidi, F., dan Naczk, M. 1995. Food phenolics: sources, chemistry, effects, and applications. Technomic Publication Company Inc. Lancaster. 36.
(50) Sharma, A., S. Bansal, & R.K. Nagpal. 2003. Lipid peroxidation in bronchial asthma. Indian Journal of Pediatrics 70(9): 715-717. Sherwood, L. 2001. Fisiologi manusia. 2nd ed. Penerbit Buku Kedokteran. Jakarta. Sies, Helmut. 1985. Oxidative stress. Academic Press. USA. Signorelli SS1, Neri S, Sciacchitano S, Pino LD, Costa MP, Marchese G, Celotta G, Cassibba N, Pennisi G, & Caschetto S. 2006. Behaviour of some indicators of oxidative stress in postmenopausal and fertile women. Journal of Maturitas 10;53(1):77-82. Sikka, S.C., Rajasekaran, M., & Hellstrom, W. J. Role of oxidative stressand antioxidants in male fertility. Journal of Andrology 16:464-468. Singh, Keshav K. 1998. Mitochondrial DNA mutations in aging, disease and cancer. Springer. Verlag Berlin Heidelberg. Speroff, L. & Fritz, M.A, 2005. Menopause and the perimenopausal transition. dalam Speroff, L (Ed). Clinical gynecologic endocrinology and infertility. 7th Edition. Lippincot William & Wilkins. Philadelphia. hal 673-748. Son, T. G., Camandola, S., & Matson, M. 2008. Hormetic dietary phitochemicals. Neuromol Med. 10:236-246. Suckow M., Weisbroth, S., & Franklin, C. 2005. The laboratory rat, second edition (American College of Laboratory Animal Medicine). Academic Press. Toronto. Sudarsono., G.D., Wahyuono S., Donatus I, A., & Purnomo. 2002. Tumbuhan obat ii (hasil penelitian, sifat-sifat, dan penggunaannya). Pusat Studi Obat Tradisional Universitas Gadjah Mada.Yogyakarta. Sudiana, I Ketut. 2008. Patobiologi molekuler kanker. Penerbit Salemba Medika. Jakarta. Tatone, C., Amicarelli, F., Carbone, M.C., Monteleone, P., Caserta, D., & Marci, R. 2008. Cellular and molecular aspects of ovarian follicle ageing. Human Reproduction Update 14(1): 31-42. Tjitrosoepomo, Gembong. 2003. Morfologi tumbuhan. Gadjah Mada University Press.Yogyakarta. Westwood FR. 2008. The female rat reproductive cycle: a practical histological guide to staging. Toxicol Pathol. 36:375-384. Wicaksono, A.W.. Trilaksana, I G.N.B., Laksmi, D., & Nyoman, D.I. 2013. Pemberian ekstrak daun kemangi (Ocimum basilicum) 37.
(51) terhadap lama siklus estrus pada mencit. Indonesia Medicus Veterinus. 2(4) : 369 – 374. ISSN : 2301-7848. Wickens, Andrew P. 2001. Ageing and the free radical theory. Journal of Respiration Physiology 128:371-391. Widiyono, I., P. P. Putro, P. Astuti & C. M. Airin. 2011. Kadar estradiol dan progesteron serum, tampilan vulva dan sitologi apus vagina kambing bligon selama siklus birahi. Jurnal Veteriner 12(4): 263-268. Winarsi, H. 2007. Antioksidan alami dan radikal bebas potensi dan aplikasinya dalam kesehatan. Kanisius. Yogyakarta. Wolpert, Lewis. 2011. The miracle of cells : rahasia kehidupan dan kecerdikan sel. Cetakan 1. Terjemahan Perwira Leo. Mizan Pustaka. Bandung. Zenclussen, M.L., Casalis, P.A., Jensen., F.W, Katja., & Zenclussen, Ana C. 2014. Hormonal fluctuations during the estrous cycle modulate heme oxygenase-1 expression in the uterus. Front. Endocrinol 5:32. doi: 10.3389/fendo.2014.00032.. 38.
(52) LAMPIRAN Lampiran 1. Determinasi kemangi. 39.
(53) Lampiran 2. Perhitungan dosis serbuk daun kemangi Rumus perhitungan konsentrasi serbuk daun kemangi untuk masing-masing dosis yang dilarutkan dalam akuades, sebagai berikut: Konsentrasi. =. 1. Dosis 1 (0,25 g/kg BB) Konsentrasi =. = 12,5 g/ml. 2. Dosis 2 (0,50 g/kg BB) Konsentrasi =. = 25 g/ml. 3. Dosis 3 (1 g/kg BB) Konsentrasi =. Keterangan : Konsentrasi (g/ml). Dosis (g/kg BB) BB (g) V (ml). 40. = 50 g/ml. : Konsentrasi larutan serbuk daun kemangi yang akan dilarutkan dengan per 1 ml larutan akuades. : Dosis yang digunakan untuk perlakuan : Berat badan tikus sebagai acuan (200 g) : Volume lambung mencit acuan (4 ml).
(54) Lampiran 3. Kurva standar TEP LT 4. Rerata absorbansi kurva standar TEP Volume (µl) Absorbansi No MDA H2O TBA TCA A B 0 0 100 500 250 0.005 0.003 1 10 90 500 250 0.011 0.009 2 20 80 500 250 0.016 0.015 3 30 70 500 250 0.019 0.019 4 40 60 500 250 0.021 0.02 5 50 50 500 250 0.021 0.022 6 60 40 500 250 0.024 0.027 7 70 30 500 250 0.029 0.032 8 80 20 500 250 0.031 0.037 9 90 10 500 250 0.036 0.041 10 100 0 500 250 0.044 0.045. Rerata Absorbansi 0.0040 0.0100 0.0155 0.0190 0.0205 0.0215 0.0255 0.0305 0.0340 0.0385 0.0445. Kurva Standar TEP. 41.
(55) Lampiran 4. Analisis data siklus estrus Analisis Descriptive Siklus Estrus. Analisis Homogenitas Siklus Estrus. 42.
(56) one-way ANOVA Siklus Estrus. Tukey Proestrus. 43.
(57) Tukey Estrus. Tukey Metestrus. Tukey Diestrus. 44.
(58) Lampiran 5. Analisis data kadar MDA serum Homogentitas MDA Serum. one-way ANOVA. two-way ANOVA. 45.
(59) Tukey. 46.
(60) Lampiran 6. Analisis data kadar MDA ovarium one-way ANOVA. Tukey. 47.
Gambar


Dokumen terkait
Berdasarkan terhadap fakta tersebut diatas, dalam rangka sinkronisasi regulasi terhadap dampak / efek - efek yang akan terjadi pada lingkungan, maka Pemerintah Kota
Hasil yang diperoleh pada tabel 1 menunjukkan pada persepsi harga uji t hitung sebesar 0,267 dengan sig. 0,791 lebih besar daripada 0,05 maka variabel persepsi harga tidak
Normal 229* 68,6 Obesitas Sentral 105* 31,4 Waist to Height Ratio Normal 208* 62,3 Kelebihan adiposit sentral 126* 37,7 Hobi 2 Kategori Buruk 185 48,7 Baik 195 51,3 *n=334
築 信行氏、宮 内庁書陵 部 ・国立 公文書館内閣 文庫 ・島原市 立図書 館松平 文庫 ・東京大学国文学研究室 の各 位 に、記して深甚 の謝意を表
Siswa hendaknya bersikap kritis dalam menerima pelajaran Siswa harus memiliki dorongan dan semangat yang kuat untuk maju, memiliki sifat ingin tahu dan ingin menguasai
Bambu lamina dari bambu andong dan bambu mayan yang dibuat menggunakan perekat UF memiliki sifat mekanis yang cukup tinggi yaitu keteguhan lentur rata-rata 1.196 kg/cm dan
Oleh karena jumlah ion Ni(II) yang diadsorpsi oleh kulit buah kopi Arabika ( Coffea arabica ) maksimum pada pH 6, penelitian lebih lanjut untuk menentukan kapasitas adsorpsi
Justeru itu, bahawa individu yang bergelar pemimpin berwibawa itu merupakan seorang insan yang memiliki sifat keistimewaan yang tidak dimiliki oleh orang lain dalam sesuatu