i
PENGARUH PEMBERIAN VITAMIN C TERHADAP DIAMETER ARTERIOL PADA TIKUS WISTAR
MODEL SEPSIS
TESIS
Disusun Untuk Memenuhi Sebagian Persyaratan Mencapai Derajat Magister
Program Studi Kedokteran Keluarga
Oleh :
Radin Intan Edilla Sini
S. 501102050
PROGRAM PASCASARJANA
UNIVERSITAS SEBELAS MARET
SURAKARTA
2015
ii
PENGARUH PEMBERIAN VITAMIN C TERHADAP DIAMETER ARTERIOL PADA TIKUS WISTAR
MODEL SEPSIS
Oleh :
Radin Intan Edilla Sini
S. 501102050
Telah disetujui oleh Tim Pembimbing Pada tanggal...
Dewan Pembimbing
Jabatan Nama Tanda Tangan
Pembimbing I Dr. Hari Wujoso, dr. SpF, MM ..………. NIP. 196210221995031001
Pembimbing II dr. Mulyo Hadi Sudjito, SpAn, KNA ... NIP. 197103222010011022
Ketua Program Studi Kedokteran Keluarga Minat Utama Ilmu Biomedik
Dr. Hari Wujoso, dr. SpF, MM NIP. 196210221995031001
iii
SURAT PENGESAHAN TESIS
Oleh
RADIN INTAN EDILLA SINI NIM: S 501102050
Tim Penguji
Jabatan Nama Tanda Tangan Tanggal
Ketua Prof. Dr. Harsono Salimo, dr, SpA(K) NIP. 194412261973101001
………. ……β015
Sekretaris Dr.dr. Trisulo Wasyanto, Sp.JP(K), FIHA NIP.
………. ……β015
Anggota Dr. Hari Wujoso, dr, SpF, MM Penguji NIP. 19621021995031001
………. ……β015
Mulyo Hadi Sudjito, dr.SpAn.KNA NIP. 195109171979031001
……….. ……β015
Telah dipertahankan di depan penguji Dinyatakan telah memenuhi syarat
Pada tanggal 21 April 2015
Direktur Program Pascasarjana Ketua Program Studi Magister
Kedokteran Keluarga
Prof.Dr.Ir. Ahmad Yunus, MS Dr. Hari Wujoso, dr, MM, SpF NIP.19610717 19860 11001 NIP.19621022 19950 3100
iv
PERNYATAAN ORISINALITAS DAN PUBLIKASI ISI TESIS
Saya menyatakan dengan sebenarnya bahwa :
1. Tesis yang berjudul : “PENGARUH PEMBERIAN VITAMIN C TERHADAP DIAMETER ARTERIOL PADA TIKUS WISTAR MODEL SEPSIS” ini adalah karya penelitian saya sendiri dan bebas plagiat, serta tidak terdapat karya ilmiah yang pernah diajukan oleh orang lain untuk memperoleh gelar akademik serta tidak terdapat karya atau pendapat yang pernah ditulis atau diterbitkan oleh orang lain kecuali secara tertulis digunakan sebagai acuan dalam naskah ini dan disebutkan dalam sumber acuan serta daftar pustaka. Apabila di kemudian hari terbukti terdapat plagiat dalam karya ilmiah ini, maka saya bersedia menerima sanksi sesuai ketentuan peraturan perundang-undangan (Permendiknas No.17, tahun 2010).
2. Publikasi sebagian atau keseluruhan isi tesis pada jurnal atau forum ilmiah lain harus seijin dan menyertakan tim pembimbing sebagai author dan Program Pasca Sarjana UNS sebagai institusinya. Apabila dalam waktu sekurang-kurangnya satu semester (enam bulan sejak pengesahan tesis) saya tidak melakukan publikasi dari sebagian atau keseluruhan tesis ini, maka Prodi Kedokteran Keluarga berhak mempublikasikannya pada jurnal ilmiah yang diterbitkan oleh Prodi Kedokteran Keluarga Program Pasca Sarjana UNS. Apabila saya melakukan pelanggaran dari ketentuan publikasi ini, maka saya bersedia mendapatkan sanksi akademik yang berlaku.
Surakarta, April 2015 Mahasiswa
Radin Intan Edilla Sini S. 501102050
v
KATA PENGANTAR
Puji syukur penulis panjatkan kehadirat Allah SWT atas segala rahmat dan hidayah yang diberikan, sehingga penulis dapat menyelesaikan tesis dengan judul “Pengaruh Pemberian Vitamin C Terhadap Diameter Arteriol Pada Tikus Wistar Model Sepsis”
Penulis menyadari bahwa karya tulis ini jauh dari sempurna, maka, penulis mengharapkan kritik dan saran yang bersifat membangun. Atas kesempatan, bantuan dan bimbingan yang diberikan kepada penulis, maka pada kesempatan ini penulis ingin mengucapkan terima kasih sebesar–besarnya kepada yang terhormat :
1. Rektor Universitas Sebelas Maret Prof. Dr. Ravik Karsidi yang telah memberi kesempatan pada penulis untuk mengikuti pendidikan di UNS.
2. Direktur Program Pascasarjana Universitas Sebelas Maret Prof. Dr. Ir. Ahmad Yunus, MS, yang telah memberi kesempatan pada penulis untuk mengikuti pendidikan di Pasca Sarjana UNS.
3. Direktur RSUD Dr. Moewardi Surakarta, dr. Endang Agustinar, M.Kes , yang telah memberi kesempatan pada penulis untuk menerapkan ilmu anestesi di RSUD Dr. Moewardi Surakarta.
4. Dekan Fakultas Kedokteran UNS, Prof. Dr. dr. Zainal Arifin Adnan, Sp.PD-KR, FINASIM., yang telah memberi kesempatan pada penulis untuk mengikuti pendidikan di Fakuktas Kedokteran UNS.
5. Ketua Program Studi Magister Kedokteran Keluarga, Dr. dr. Hari Wujoso, Sp F, MM, yang telah memberi kesempatan pada penulis untuk mengikuti pendidikan dan menyelesaikan karya tulis ini.
6. Kepala Program Studi Anestesiologi dan Terapi Intensif FK UNS, Dr.M.H. Sudjito, Sp. An KNA, atas segala bimbingan dan masukan yang diberikan pada penulis dalam menyelesaikan karya tulis ini.
7. Kepala Bagian SMF Anestesiologi dan Terapi Intensif FK UNS, dr. Marthunus Judin, Sp.An-K, atas segala bimbingan dan masukan yang diberikan pada penulis dalam menyelesaikan karya tulis.
8. dr. Purwoko, SpAn,KAKV,KAO atas segala bimbingan dan masukan yang diberikan pada penulis dalam menyelesaikan karya tulis ini.
vi
11. Kedua orang tua penulis, Bapak Sutan Edilla Sini dan Ibu Sri Mulyani yang sangat penulis hormati dan sayangi yang selalu memberi dukungan, bantuan, perhatian, kasih sayang, dan tidak bosan-bosannya berdoa untuk penulis agar penulis cepat dapat menyelesaikan pendidikan.
12. Istri tercinta dan tersayang, Isnainy Sartika, yang tak pernah lelah memberi dukungan, doa, cinta, kasih sayang, pengertian, perhatian dan pengorbanan. selama penulis menjalani pendidikan.
13. Sahabat-sahabat seangkatan, dr Henri Dumas, dr Isroful Ikhsan, dr Andi Nugroho, yang selalu memberi dukungan agar penulis dapat menyelesaikan pendidikan.
14. Semua sahabat yang memberikan perhatian dan bantuan pada penulis dalam menyelesaikan karya tulis ini.
Surakarta, Maret 2015
Penulis
vii d. Manfaat Hasil Penelitian………... II. TINJAUAN PUSTAKA………...
a. Kajian Teori………... 1. LPS induced-signaling Pathway………..
1.1 NFκB……….
1.2 Redoks Regulation………
1.3 NFκB dan Sepsis………...
2. Keterkaitan Reactive Oxygen Species………
2.1 Reactive Oxygen Species………..
2.2 Mekanisme Pertahanan antioksidan endogen……… 2.3 Stress oksidatif pada syok septik……… 2.4 Disfungsi mitokondria pada syok septik……….. 3. Peranan Nitrogen Species………
4. Proteksi Antioksidan………...
4.1 Struktur dan biokimia………..
4.2 Aktivitas antioksidan………
4.3 Pelepasan NO yang dipengaruhi askorbat……….. 4.4 Reduksi nitrit menjadi NO oleh askorbat………
viii
4.5 Penguraian ROS oleh askorbat……….. 4.6 Pengaturan redoks oleh thiols……… 4.7 Pengaturan eNOS oleh askorbat………. 4.8 Askorbat sebagai salah satu kofaktor eNOS………. 4.9 Efek askorbat pada stimulasi guanylate cyclase oleh NO. 4.10 Mekanisme transport Vitamin C……….
5. Metode Induksi Sepsis……….
9
DAFTAR GAMBAR
Gambar 1. Diagram Skematik LPS-induced signaling pathway……….………..….7 Gambar 2. Bentuk asam askorbat tereduksi ……….…β5
Gambar 3.Bentuk asam askorbat teroksidasi…….. ……….….β7
Gambar 4. Efek inhibisi NO dan ONOO-….………..γ1 Gambar 5. Potensi kerja antiokksidan pada sepsis...……….γβ
Gambar 6. Kerangka berpikir………...γ5
Gambar 7. Kerangka Konsep………...γ6
Gambar 8. Alur penelitian………..41
Gambar 9. Diagram batang rerata kadar neutrophil………...47
Gambar 10. Diagram batang rerata diameter arteriol……….51
10
DAFTAR TABEL
Tabel 1. Pembagian antioksidan berdasarkan solubilitas………..17
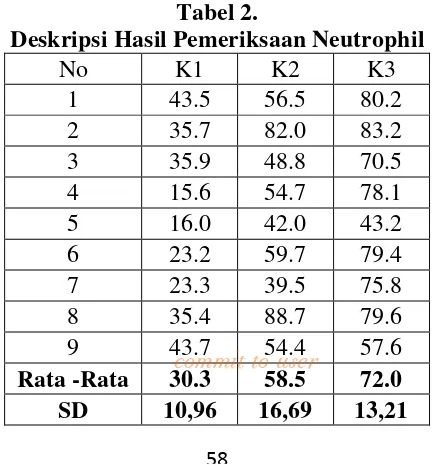
Tabel 2. Deskripsi hasil pemeriksaan neutrophil………..46
Tabel 3. Uji normalitas data neutrophil……….48
Tabel 4. Uji rata-rata kadar neutrophil………..48
Tabel 5. Perbedaan kadar neutrophil antara masing-masing kelompok perlakuan……...49
Tabel 6. Deskripsi hasil pengukuran diameter arteriol………..50
Tabel 7. Uji normalitas data diameter arteriol………...5β
Tabel 8. Uji beda rata-rata diameter arteriol………..5β
Tabel 9. Perbedaan diameter arteriol antara masing-masing kelompok perlakuan……...5γ
11
DAFTAR LAMPIRAN
Lampiran.1 Lampiran Hasil Penelitian………...59
Lampiran.2 Hasil Uji Kruskal-Wallis Test Neutrofil NPar Tests………...6γ
Lampiran.3 Hasil Uji Normalitas Diameter Arteriol………..65
Lampiran.4 Hasil Uji Kruskal-Wallis Test Diameter Arteriol NPar Tests……….…67
Lampiran.5 Ethical Clearance………69
Lampiran.6 Dokumentasi Penelitian………70
12
Radin Intan Edilla Sini, S. 501102050, 2015. Pengaruh Pemberian Vitamin C Terhadap
Diameter Arteriol Pada Tikus Wistar Model Sepsis. TESIS. Pembimbing I : Dr. Hari
Wujoso, dr. Sp.F. MM. Pembimbing II : M.H Sudjito, dr. Sp.An. KNA. Anestesiologi dan Terapi Intensif Fakultas Kedokteran, Program Pascasarjana Universitas Sebelas Maret Surakarta
ABSTRAK
Latar belakang : Sepsis dan syok septik telah lama dikenal sebagai masalah kesehatan serius di dunia, karena angka mortalitas dan morbiditasnya yang masih sangat tinggi. Produksi berlebihan mediator pro-oksidan pada sepsis menguasai sinyal anti-oksidan. Ketidak seimbangan antara mediator pro oksidan dan antioksidan akan menyebabkan perubahan pada mikrosirkulasi, sehingga mikrosirkulasi tidak dapat menjalankan fungsinya sebagai pengatur distribusi oxygen carrying blood cell pada berbagai organ, sehingga terjadi kerusakan dan kematian sel. Vitamin C merupakan golongan antioksidan larut dalam air yang dapat meredam dampak negatif oksidan, termasuk enzim-enzim dan protein-protein pengikat logam. Fungsi antioksidan adalah mencegah terbentuknya radikal hidroksil, memutus rantai reaksi oksidan, mereduksi oksidan menjadi zat lain yang kurang reaktif misalnya H2O dan O2, menghambat peroksidase lipid dan scavenger langsung dari ROS.
Tujuan : Menganalisis pengaruh pemberian vitamin C 5,1mg/kgBB/hari/ i.v (setara dengan 50 mg/kgBB/hari/ i.v pada manusia dengan berat badan 60kg) pada tahap awal sepsis terhadap diameter arteriol pada tikus wistar dengan model sepsis polimikrobial.
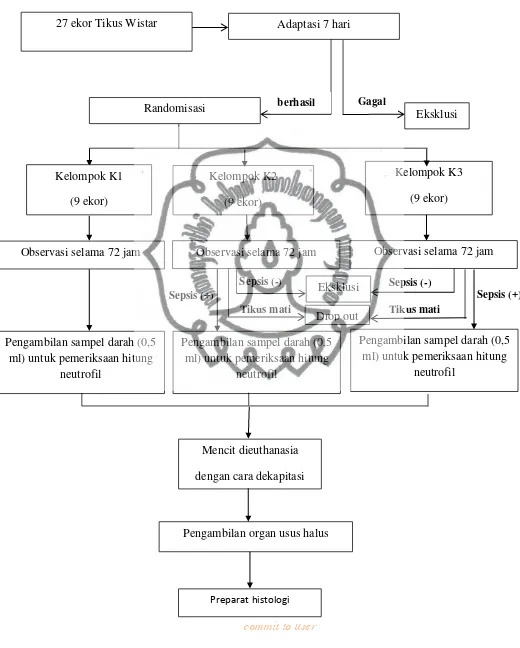
Metode : Penelitian ini termasuk eksperimental laboratorik. Sejumlah 27 ekor tikus wistar di adaptasikan selama 7 hari sebelum dibagi dalam tiga kelompok yang masing-masing kelompok terdiri dari 9 ekor tikus yang ditentukan secara acak. Untuk kelompok satu (K1) yang merupakan kelompok kontrol, tidak dikukan induksi cecal inoculum maupun pemberian vitamin c.. Untuk kelompok dua (K2) diberikan injeksi cecal inoculum 40mg/kali/hari selama 3 hari berturut turut. Untuk kelompok perlakukan tiga (K3) perlakuan sama dengan kelompok dua ditambah dengan vitamin C 5,1 mg/kg/kali/hari secara intravena selama 3 hari berturut-turut. Setelah 72 jam tikus wistar akan di euthanasia dengan cara dekapitasi. Duodenum tikus kemudian diambil untuk dilakukan pemeriksaan histopatologi yang akan mengukur diameter arteriol rata-rata pada tiap sampel. Dikarenakan ada kelompok tidak lulus uji normalitas maka pengujian statistik di uji alternatif dengan Kruskal-Wallis test dan dilanjutkan dengan Mann Whitney Test. Dianggap bermakna secara statistik apabila nilai p < 0,05.
Hasil : Nilai uji beda antara kelompok 1 dan kelompok 2 mendapatkan nilai p=0,001 p<0,05, jadi ada perbedaan yang signifikan diameter arteriol antara kelompok 1 (tanpa perlakuan) dengan dengan kelompok 2 (diberi cecal inoculum) dimana rata-rata diameter arteriol tikus kelompok 1 (tanpa perlakuan) 30,8% lebih lebar dibandingkan dengan tikus kelompok 2 (diberi cecal inoculum). Demikian juga antara kelompok 1 (tanpa perlakuan) dan kelompok 3 (diberi cecal inoculum dan Vitamin C) mendapatkan hasil nilai p=0,001 p<0,05. Jadi ada perbedaan yang signifikan diameter arteriol antara kelompok 1 dan kelompok 3. Dimana kelompok 3 menghasilkan diameter arteriol 118,2% lebih lebar daripada kelompok 1. Uji beda antara kelompok 2 (diberi cecal inoculum) dan kelompok 3 (diberi cecal inoculum dan Vitamin C) mendapatkan hasil nilai p=0,000 p<0,05. Jadi ada perbedaan yang signifikan diameter arteriol antara kelompok 2 dan kelompok 3. Dimana kelompok 3 menghasilkan diameter arteriol 185,3% lebih lebar daripada kelompok 2.
Kesimpulan : Pemberian vitamin C pada tikus sepsis mampu meningkatkan diameter arteriol dibandingkan dengan tikus sehat (normal) dan tikus sepsis.
Kata kunci : Vitamin c, sepsis, mikrosirkulasi, diameter arteriol
13
Radin Intan Edilla Sini, S. 501102050, 2015. The Effect of vitamin c on The arteriol
Diameter in Wistar Rats with Sepsis Model. THESIS Supervisor I : Dr. Hari Wujoso, dr.
Sp.F. MM. Supervisor II : M.H Sudjito, dr. Sp.An. KNA. Anesthesiology and Intensive Care Departement, Faculty of Medicine, Post Graduate Program University of Sebelas Maret, Surakarta.
ABSTRACT
Background : Sepsis and septic shock have long been recognized as serious medical
problems in the world, since the mortality and morbidity rates are still very high. Excessive production of pro-oxidant mediator in sepsis dominates the anti oxidant signal. The imbalance between pro oxidant mediator and antioxidant will cause changes in microcirculation, therefore the microcirculations cannot function as a controller of oxygen carrying blood cell distribution in various organs, that leads to damage and cell death. Vitamin C is a water soluble type that can filter the negative effects of oxidants, including enzymes and iron binding proteins. The function of antioxidant is to prevent the hydroxyl radical to be formed, to cut the oxidant reaction chain, to reduce oxidant to other matter which less reactive for instances H2O and O2, to block lipid peroxide and scavengers directly
from ROS.
Objective: To analyze the influence of vitamin C administration 5,1mg/Kg Body weight/day/
IV (equals to 50 mg/kg body weight/day/ IV in humans with 60kg bodyweight) in the initial phase of sepsis to the arteriol diameter in wistar rats with sepsis polimicrobial model.
Methods : This research is categorized as laboratoric experimental. As many as 27 wistar
rats were being adapted for 7 days before they were divided in three groups with 9 rats each which randomly selected. For group 1 (K1) which is a control group, the cecal induction and vitamin c administration were not applied. For group 2 (K2) inoculum cecal injection 40 mg/a time/day was given for 3 days in a row. For group 3 (K3) it has the same treatment as in group 2 added with 5.1 mg/kg/time/day intravenously for 3 days in a row. After 72 hours, wistar rats were euthanized by decapitation. The rats duodenum were taken and histopathologically examined to measure the diameter of the average in each sample. Since the groups did not pass the normality test so the statistic test was using alternative test with Kruskal-Wallis tes and continued with Mann Whitney Test. It was considered significant if the P value < 0.05.
Result : The different value test between group 1 and group 2 was p=0.01 p<0.05, so there
was significant different in arteriol different between group 1 (without treatment) and group 2 (with cecal inoculum administration) which the average of arteriol diameter of the group 1 rats (without treatment) was wider than in group 2 (with cecal inoculum administration). And also between group 1 (without treatment) and group 3 (with cecal inoculums and vitamin C) resulted in p value = 0.001 p <0.05. So there was significant different in arteriol diameter between group 1 and group 3. Whereas group 3 resulted arteriol diameter 118.2 % wider than group 1. Different test between group 2 (with cecal inoculum) and group 3 (Cecal inoculums and vitamin C administration) resulted in p value=0.000 p<0.05. so there was significant different of arteriol diameter between group 2 and group 3. Whereas group 3 resulted arteriol diameter 185.3% wider than group 2.
Conclusion : Vitamin C administration in sepsis rats were able to increase the arteriol
diameter wider than normal healthy rats and sepsis rats.
Keywords : Vitamin C, sepsis, microcirculation, arteriol diameter
14 BAB I
PENDAHULUAN
A. Latar Belakang Masalah
Sepsis dan syok septik telah lama dikenal sebagai masalah kesehatan serius di dunia, karena angka mortalitas dan morbiditasnnya yang masih sangat tinggi. Sepsis sering ditemui pada pasien critical illness di ruang perawatan intensif dan merupakan 40% penyebab kematian. Di Eropa ± 150.000 pasien mengalami sepsis, sepsis berat (disertai disfungsi multi organ) dan syok septik per tahun, dimana 65.000 diantaranya meninggal. Setidaknya > 50% dari kematian tersebut disebabkan syok septik dan gagal organ.
Telah disepakati bahwa bukanlah infeksi bakteri yang merupakan faktor penentu utama hasil pada sepsis, melainkan respon inflamasi terhadap infeksi tersebut (Cohen, 2002).
Respon inflamasi terhadap rangsangan septik sangat berbahaya untuk pertahanan host, karena hal tersebut mengatur mediator anti-inflamasi (misalnya, IL-1 reseptor antagonis, IL-4, IL-10) dan enzim antioksidan (misalnya, katalase, glutation peroksidase, mangan ROS dismutase). Namun, produksi berlebihan mediator pro-inflamasi pada sepsis menguasai sinyal anti-pro-inflamasi. Hal ini menyebabkan penekanan fungsi kekebalan tubuh bawaan (terutama PMN) dan menyebabkan immunoparalysis dan selanjutnya meningkatkan kerentanan terhadap infeksi (Riedemann et al., 2003 dan Cepinskas dan Wilson, 2008).
Mikrosirkulasi selama ini tidak mendapatkan perhatian yang baik pada pengobatan klinis, namun saat ini mikrosirkulasi mulai diketahui sebagai hal penting yang menyebabkan beberapa proses patofisiologi. Fungsi mikrosirkulasi yang normal akan berperan dalam oksigenasi dan fungsi suatu jaringan, namun hal ini masih kurang dipahami karena banyak sekali perbedaan struktur yang meyebabkan perbedaan fungsi pada tiap organ. Fungsi utama dari mikrosirkulasi adalah sebagai pengatur distribusi oxygen carrying blood cell pada berbagai organ. Faktor utama yang mempengaruhi oxygen delivery diantaranya adalah; regulasi aliran darah, tekanan oksigen jaringan, dan mitokondria, yang sampai dengan saat ini masih belum dipahami sepenuhnya, dan mikrosirkulasi adalah kunci untuk memahami hal tersebut. Telah jelas bahwa variabel hemodinamik sistemik tidak menggambarkan kegagalan sirkulasi pada critical illness yang tidak responsif terhadap terapi.
1
15
Kegagalan ini lebih disebabkan karena disfungsi dari mikrosirkulasi. Evaluasi dari mikrosirkulasi telah membuka ruang baru dalam monitoring fungsi hemodinamik. Identifikasi kegagalan mikrosirkulasi merupakan indikator yang paling sensitif dari kegagalan sirkulasi yang berakibat pada outcome yang buruk, dan ini merupakan target teraputik yang baru. Penelitian klinis telah dapat mengidentifikasi berbagai teraputik konvensional dan pendekatan baru yang mampu memodifikasi mikrosirkulasi.
Vitamin C merupakan golongan antioksidan larut dalam air yang dapat meredam dampak negatif oksidan, termasuk enzim-enzim dan protein-protein pengikat logam. Fungsi antioksidan adalah mencegah terbentuknya radikal hidroksil, memutus rantai reaksi oksidan, mereduksi oksidan menjadi zat lain yang kurang reaktif misalnya H2O dan O2, menghambat peroksidase lipid dan scavenger langsung dari ROS.
Regulasi serta koordinasi dari respon imuno-inflamasi oleh cytokines dan mediator lainnya akan mempengaruhi mekanisme pertahanan tubuh. Perubahan pada tingkat molekuler meliputi mekanisme yang sangat kompleks yang dalam keadaan puncak akan menyebabkan perubahan pada ekspresi gen. Sepsis akan menyebabkan gangguan regulasi pada respon ini yang akan menyebabkan pelepasan secara eksesif mediator-mediator inflamasi dan menyebabkan kerusakan pada organ maupun sel tubuh. Mekanisme yang menyebabkan kerusakan jaringan pada respon sepsis umumnya berhubungan dengan kerusakan pada endotel vaskuler yang akan secara nyata menyebabkan penurunanan perfusi oksigen maupun substrat lainnya ke jaringan sehingga terjadi perubahan pada metabolisme seluler.
Banyak kompleks sistem yang secara sekunder terstimulasi selama periode sepsis, termasuk aktivasi sistem komplemen, platelet-activating factor (PAF), metabolit asam archidonat, ROS dan NO. Faktanya yang terjadi adalah lingkaran siklus inflamasi dan koagulasi yang tidak berhenti berputar dengan iskemia, kerusakan sel yang pada akhirnya akan meyebabkan disfungsi organ serta kematian.
Saat ini didapatkan bukti dimana pada keadaan sepsis juga didapatkan stress oksidatif yang berat. Oksigen radikal bebas dan ROS lainnya sepertinya berhubungan dengan messangers pada tranduksi signal dan aktivasi gen. Dan hal ini akan memberikan dampak terhadap ekspresi maupun kontrol respon immune-inflammantory selama periode sepsis. Studi molekuler pada saat ini berbasis terhadap pengenalan monosit terhadap LPS serta regulasi dari gen inflamasi, hal ini dapat
16
membuat pendekatan baru dalam strategi teraputik.(Victor et al, 2005). Intervensi teraputik dengan menggunakan Vitamin C sebagai antioksidan diharapkan dapat mengembalikan transduksi signal dan mengembalikan produksi mediator-mediator ke nilai normal. Strategi mencegah kerusakan endotel dapat dilakukan dengan cara mencegah pelepasan ROS dan mengembalikan trasduksi signal, sehingga fungsi endotel dapat dikembalikan ke fungsi normalnya. Strategi ini pada akhirnya diharapkan dappat memperbaiki fungsi dari mikrosirkulasi dan mengurangi kejadian MOD/MOFS serta angka kematian.
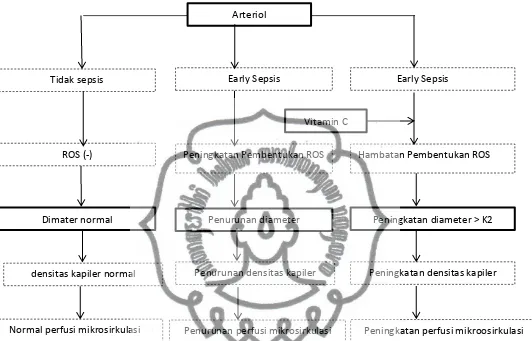
Pada penelitian ini dengan menggunakan tikus wistar model sepsis yang diberikan Vitamin C, sepsis murni dan kontrol (tanpa induksi sepsis dan pemberian Vitamin C) diharapkan dapat diteliti pengaruh pemberian Vitamin C terhadap diameter arteriol. Penulis menduga bahwa pemberian Vitamin C pada tikus wistar yang berada dalam keadaan sepsis polimikrobial dapat memperbaiki dan mengembalikan diameter arteriol seperti dalam keadaan normal.
B. Rumusan Masalah
Apakah ada pengaruh pemberian Vitamin C 5,1mg/kgBB/hari/i.v (setara dengan 50 mg/kgBB/hari/ i.v pada manusia dengan berat badan 60 kg) pada tahap awal sepsis terhadap diameter arteriol pada tikus wistar dengan model sepsis polimikrobial.
C. Tujuan Penelitian 1. Tujuan Umum
Menganalisis pengaruh pemberian Vitamin C 5,1mg/kgBB/hari/ i.v (setara dengan 50 mg/kgBB/hari/ i.v pada manusia dengan berat badan 60kg) pada tahap awal sepsis terhadap diameter arteriol pada tikus wistar dengan model sepsis polimikrobial.
2. Tujuan Khusus
a. Mengetahui pengaruh pemberian Vitamin C 5,1 mg/kgBB/hari/ i.v (setara dengan 50 mg/kgBB/hari/ i.v pada manusia dengan berat badan 60 kg) pada tahap awal sepsis terhadap diameter arteriol pada tikus wistar dengan model sepsis polimikrobial.
b. Menganalisis perbandingan antara ketiga kelompok
17 D. Manfaat Penelitian
1. Jika penelitian ini terbukti, maka pemberian Vitamin C dapat menjadi pertimbangan sebagai prosedur rutin yang dilakukan dalam tatalaksana sepsis, terutama perawatan dan penatalaksanaan sepsis di unit terapi intensif.
2. Hasil penelitian ini dapat menjadi tambahan referensi dalam menjelaskan pengaruh pemberian Vitamin C terhadap mikrosirkulasi pada pasien sepsis.
3. Penelitian ini dapat menjadi tambahan informasi bagi masyarakat mengenai pemberian Vitamin C pada pasien sepsis.
4. Landasan untuk penelitian lebih lanjut
18 BAB II
TINJAUAN PUSTAKA
A. Kajian Teori
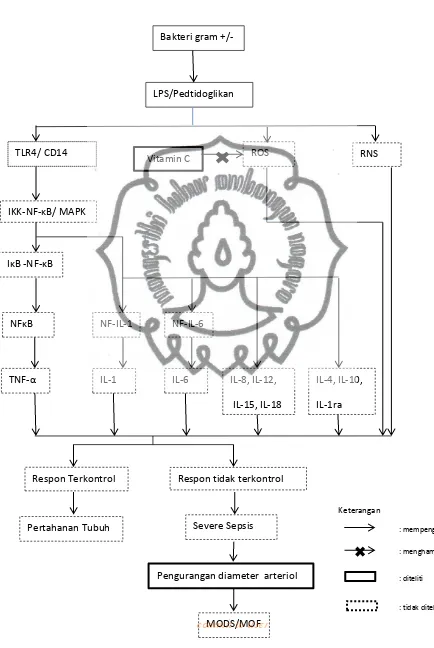
1. LPS-Induced Signaling Pathway
Aktivasi dari sistem imun dan inflamasi timbul sebagai respon baik terhadap stimuli infeksi maupun non infeksi. Bakteri gram negatif dan postif merupakan agen-agen kausatif. Infeksi akan menstimulasi respon imun pada innate, pada umumnya di mediasi melalui sel-sel inflammatori pada sirkulasi dan jaringan, seperti monosit/makrofag dan netrofil. Sel-sel ini pada keadaan normal akan ditemukan baik dalam sirkulasi maupun jaringan yang dapat secara cepat teraktivasi sebagai respon terhadap bakteria. Sel-sel ini akan menghasil mediator-mediator inflamasi sehinga dapat dengan sangat aktif melakukan fungsi fagosit,dan juga dapat berkontribusi terhadap timbulnya kerusakan pada jaringan yang disebabkan karena mediator-mediator inflamasi yang dihasilkan oleh cytokines serta kerusakan yang disebabkan karena ROS.
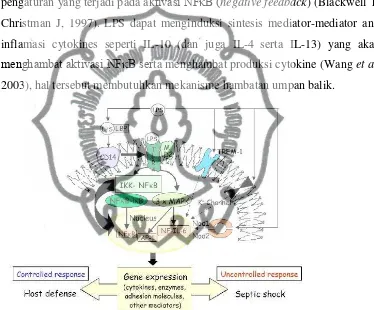
Mekanisme molekuler yang terjadi akibat pelepasan mediator inflamasi serta ekspresi gen yang dapat diinduksi oleh LPS seringkali menjadi objek penelitian akhir-akhir ini (Victor et al, 2005). Pada fase akut didalam plasma, LPS akan terikat dengan protein dalam bentuk LPS-binding protein (LBP). LBP sangat penting dalam timbulnya respon induksi inflamasi yang disebabkan oleh LPS. Saat ini telah banyak reseptor endotoksin yang teridentifikasi seperti 2 -integrin CD11/CD18, macrophage scavenger receptor for acetylated LDL, L-selectin dan CD14. Dari kesemua reseptor tersebut, CD14 dianggap sebagai yang paling penting. Dimana reseptor ini ditemukan dalam 2 bentuk: membrane bound CD14 (mCD14) dan soluble CD14 (sCD14). LPS juga dapat berinteraksi dengan transmembrane signal transduction receptor Toll-like receptor 4 (TLR4), dimana reseptor ini berada pada kompleks accessory protein MD-2. Walaupun TLR2 dianggap ikut berperan pada proses signaling LPS, diduga TLR4 memiliki peran kunci dalam respon imun terhadap bakteri gram negatif pada innate (Juan et al, 2005). LPS yang terikat pada reseptor ini akan mengaktifkan beberapa jalur signaling intraseluler, termasuk jalur IκB kinase (IKK)-nuclear factor κB (NFκB) dan berbagai jalur nitrogen-activated protein kinase (NAPK). Jalur-jalur ini akan menfosforilasi dan mengaktifkan berbagai faktor transkripsi, termasuk NFκB/Rel protein, activator protein 1 (AP-1) dan nuclear factor-interleukin 6 (NF-IL6), yang
5
19
akan meyebabkan induksi gen serta ekspresi mediator inflamasi dengan cepat, termasuk cytokines, lipid mediators, inducible nitric oxide synthase (iNOS), dan molekul adhesi. Cytokines memliki berbagai sel target, dan aksi spesifik cytokines ini tergantung dari stimulus, tipe sel serta adanya mediator inflamasi lainnya dan juga reseptor yang ada.
Walaupun telah ditemukan beberapa faktor transkripsi yang mungkin berhubungan dengan perubahan aktivasi gen pada sepsis, termasuk AP-1 dan NF-IL-6, NFκB merupakan faktor yang paling detail dijelaskan. Baik pada penelitian in vitro maupun in vivo membuktikan dugaan peran penting NFκB pada sepsis dan syok endotoksik. Representasi skematik jalur LPS/NFκB digambarkan pada gambar.1
1.1 Nuclear Factor κB
NFκB merupakan faktor transkripsi yang penting bagi fungsi normal sel imun, yang akan mengatur aktivasi dari gen-gen yang diperlukan untuk menghasilkan respon yang dibutuhkan secara cepat. Namun, peningkatan dan/atau durasi aktivasi yang memanjang dari NFκB ini akan menyebabkan ekspresi yang berlebihan dari protein mediator dan akan menghasilkan efek yang merusak selama periode sepsis.
Jalur NFκB dapat berubah-ubah, dengan perbedaan efek pada regulasi gen yang tergantung dari kombinasi spesifik yang terjadi (Abraham, 2005). NFκB berada dalam keadaan inaktif di dalam sitoplasma dan disertai dengan protein inhibitor yang berasal dari family IκB, termasuk diantaranya IκBα, IκB dan IκBε.
LPS akan menstimuli aktivasi NFκB melalui mediator-mediator inflamasi, termasuk cytokines (TNFα, IL- 1 ), ROS (terutama hydrogen peroksida) (Juan et al, 2005), protein kinase C activator, virus, sinar UV dan ionizing radiation (Barnes, 1997)
Aktivasi NFκB dicapai dengan cara fosforilasi dan degradasi dari protein penghambat IκB melalui aksi kinases yang spesifik, NFκB-inducible kinases (NIK), IKK1 dan IKK-2 (Abraham, 2003). IKKα dan IKK dapat menfosforilasi IκB pada in vitro, namun studi genetik menduga peran utama untuk IKK pada aktivasi cytokine-inducible NFκB. Degradasi dari IκB dilakukan dengan cara menambahkan ubiquitin residues dan dilanjutkan
20
dengan proses proteolisis. Setelah NFκB berada di dalam nucleus maka NFκB dapat terikat pada gen target untuk menginisisasi proses transkripsi, translasi dan sintesis protein. Kompleks IKK merupakan kunci pengaturan pada proses aktivasi NFκB oleh stimulus mediator inflamasi. Ada banyak gen yang berisikan rangkaian spesifik sebagai tempat terikatnya NFκB pada promoter regions.
Mekanisme umpan balik telah teridentifikasi, dimana hal ini dapat menjelaskan respon yang terjadi pada stimulus awal (positive feedback) atau pengaturan yang terjadi pada aktivasi NFκB (negative feedback) (Blackwell T, Christman J, 1997). LPS dapat menginduksi sintesis mediator-mediator anti inflamasi cytokines seperti IL-10 (dan juga IL-4 serta IL-13) yang akan menghambat aktivasi NFκB serta menghambat produksi cytokine (Wang et al, 2003), hal tersebut membutuhkan mekanisme hambatan umpan balik.
Gambar 1. Diagram Skematik LPS-induced signaling pathway sebagai respon inflamasi yang timbul pada monosit, makrofag dan neutrophil.
1.2 Redox Regulation of NFκB dan Stress Oksidatif
Status redoks intraseluler secara fisologis penting dalam menjaga homeostasis seluler. Regulasi NFκB meliputi kaskade fosoforilasi dan defosforilasi, namun hal ini dapat dikontrol oleh status redoks pada sel. Glutathione (GSH) merupakan regulator utama redoks homeostasis intraseluler, yang bekerja melalui proses oksidasi reversible dari grup aktif thiol.NFκB terlibat dalam pengaturan ekspresi enzim GCS dalam sintesis GSH sebagai respon
21
terhadap berbagai stimulus termasuk cytokine inflamasi (IL-1 dan TNF-α). Thioredoxin (Trx) merupakan senyawa yang mengandung thiol lainnya yang penting dalam homeostasis redoks.
1.3 NFκB dan Sepsis
NFκB memiliki peran sentral dalam modulasi ekspresi dari mediator immunoregulatory yang terlibat dalam stress oksidatif dan juga pada sepsis. Pada beberapa studi pada hewan telah mendemontrasikan hubungan antara sepsis dan aktivasi NFκB dan stress oksidatif. Pada tikus didapatkan penggunaan LPS akan menyebabkan aktivasi NFκB pada beberapa organ, hal ini berhubungan dengan peningkatan mRNA pada jaringan paru dan ekspresi protein dari berbagai NFκB -regulated cytokines termasuk diantaranya TNF- α dan IL-6 (Victor et al, 2005)
Beberapa studi telah mendemontrasikan peningkatan aktivitas NFκB pada lekosit yang telah diisolasi pada pasien dengan sepsis, dimana hal ini berhubungan dengan kematian. Bohrer dkk melaporkan peningkatan aktivitas NFκB yang dibandingkan dengan skor APACHE II (Acute Physiology and Chronic Health Evalution) sebagai prediktor hasil dan tingkat mortalitas dari sepsis. Penemuan ini dikonfirmasi oleh Arnalich dkk, dimana pada penelitian didapatkan peningkatan yang bermakna pada aktivitas NFκB pada pasien non-survivor. Namun Paterson dkk melaporkan bahwa peningkatan aktivasi NFκB sel mononuclear pada pasien yang meninggal karena critically ill dapat dihambat dengan pemberian antioksidan N-acetyl cysteine (NAC). Kadar IL-8 akan megalami penurunan pada pemberian NAC, namun hal ini tidak ditemukan pada kadar IL-6 maupun kadar inreellular adhesion molecule 1 (ICAM-1). Saat ini telah dapat dibuktikan jika IL-8 diatur pada tingkatan transkripsional oleh NFκB.
2. Keterkaitan Reactive Oxygen Spesies
22
antioksidan seperti; superoxide dismutase (SOD), Katalase, Vitamin C dan E, serta glutathione (GSH). Ketidakseimbangan ini terjadi ada keadaan sepsis.
Oleh karena itu ROS merupakan second messengers penting yang terbentuk sebagai respon terhadap berbagai macam stress lingkunan. Pada keadaan ini, perubahan ROS intraseluler dapat mengaktivasi jalur tranduksi signal yang akan mempengaruhi bagaimana sel bereaksi terhadap perubahan pada lingkungannya.
2.1 Reactive Oxygen Spesies
Intermediate ROS akan meningkat ketika molekul teroksidasi dikarenakan molekul oksigen yang berubah menjadi air selama metabolisme.
O2 O2- H2O2 HO H2O Molekul Superoxide Hydrogen Hydroxy Air Oksigen Anion Radical Peroxide radical
O2- dan HO merupakan suatu radikal bebas karena molekul ini memiliki atom dengan electron yang tidak berpasangan dan akan menyumbangkan dalam peningkatan radikal bebas yang sangat reaktif dan berpotensial menjadi toksik.
23
Pada kondisi fisiologis sebagian besar ROS dibentuk selama proses respirasi di tingkat seluler dan diaktivasi oleh sel fogositik termasuk netrofil yang terlibat pada respon inflamasi. ROS memiliki peran penting pada respirasi di tingkat mitokondria, jalur produksi prostaglandin dan mekanisme pertahanan host, dan pada saat ini telah diketahui jika ROS memiliki keuntungan vital pada kondisi fisiologis.
Pada keadaan sepsis, ada beberapa sumber potensial dari ROS, termasuk diantaranya rantai transport elektron pada pernafasan mitokondria, aktivasi xanthine oxidase (XO) sebagai hasil dari iskemia dan reperfusi, pembakaran yang berhubungan dengan aktivasi sel imun, dan juga dari metobolisme asam arachidonat. Aktivasi sel imun akan menghasilkan O2- sebagai agen sitotoksik yang merupakan hasil pembakaran respirasi melalui aksi dari NADPH oksidase pada molekul oksigen yang terikat pada membran. Pembentukan NADPH oksidase diatur oleh netrofil yang terpapar oleh LPS dari bakteri (Deleo et al, 1998). Deleo dkk., mendemostrasikan peningkatan kadar Rac2 pada pemberian LPS. Rac2 merupakan bagian kecil dari GTP-binding protein yang berhubungan dengan p47phox dan p67phox (dua sub unit yang dibutuhkan dalam fungsi NADPH) yang terletak pada membrane. Peningkatan ROS setelah pemberian LPS telah didemostrasikan pada berbagai model syok septik pada makrofag peritoneal dan limfosit Gangguan pada keseimbangan antara pro oksidan (ROS) dan antioksidan merupakan karakteristik yang sering ditemukan pada stress oksidatif pada sel imun sebagai respon terhadap endotoksin. Pada keadaan stress oksidatif didapatkan perubahan yang khas pada sel-sel imun tersebut dan berimplikasi pada perubahan pada berbagai fungsi imun, seperti peningkatan adhesi dan fagositosis serta penurunan kemotaksis.
NO juga diproduksi oleh netrofil dan makrofag, dimana NO dapat bereaksi dengan O2- dan menghasilkan peroxynitrite (ONOO-) yang merupakan pro oksidan kuat. ONOO- dapat mengalami dekomposisi dan diubah menjadi bentuk HO. Pada keadaan iskemia yang diikuti dengan reperfusi, XO akan mengkatalisis pembentukan asam urat dengan O2- sebagai koproduksi yang akan menyebabkan proses recruitment dan aktivasi dari netrofil serta proses perlekatan (adhesi) pada sel endotel yang juga akan menstimulasi pembentukan XO serta O2-.
Kerusakan yang dimediasi oleh ROS dapat timbul selama stress oksidatif. DNA dan protein dapat mengalami oksidasi bersama dengan kerusakan pada
24
membran yang disebabkan peroksidasi pada lipid yang akan menyebabkan perubahan pada permeabilitas membran, modifikasi dari struktur dan perubahan fungsi protein. Kerusakan oksidatif pada membran mitokondria juga dapat timbul dan menyebabkan depolarisasi membran serta uncoupling fosforilasi oksidatif dengan perubahan pada respirasi seluler.
2.2 Mekanisme Pertahanan Antioksidan Endogen
Antioksidan memiliki peran sentral pada keseimbangan redoks dalam tubuh manusia dan bekerja secara sinergistik. Antioksidan primer mencegah pembentukan radikal oksigen dengan cara menyingkirkan prekursor dari radikal bebas atau bisa juga dengan cara menghambat katalis seperti glutathione peroksidase dan katalase. Antioksidan sekunder akan bereaksi dengan ROS yang telah terbentuk baik dengan cara menyingkirkan maupun menghambat pembentukannya (e.g. Vitamin C dan E). Mekanisme pertahanan Antioksidan endogen didapatkan pada beberapa lokasi diataranya; intraseluler, pada dinding membrane sel dan ektraseluler.
Antioksidan Intraseluler
Enzim SOD merupakan golongan metalloenzymes yang dapat secara cepat mempromosi konversi O2- menjadi H2O2. Ada 3 bentuk dari SOD yang memiliki peran penting: copper-zinc SOD (sitoplasma), manganese SOD (mitokondria) dan SOD ekstraseluler (matriks ekstraseluler). Katalase dan glutathione peroksidase merupakan enzim yang mengandung selenium dimana enzim ini membutuhkan reduced GSH untuk dapat melakukan aksinya dalam mengkatalisis koversi dari H2O2 menjadi H2O. Pada Reduced GSH didapatkan group thiol (sulphydryl). GSH sendiri memiliki efek langsung terhadap aktivitas antioksidan dengan cara donasi ion hydrogen dan memperbaiki kerusakan pada DNA. Stress oksidatif dan modulasi pada kadar GSH/GSSG (GSSG=oxidized GSH) juga diatur oleh ekspresi gen dari beberapa protein antioksidan seperti manganese SOD, glutathione peroxidase, Trx dan methalothionein.
25 Membran Antioxidant
Dibutuhkan spektrum antioksidan yang berbeda pada bagian interior lipid hidrofobik pada membran sel. Vitamin E merupakan antioksidan yang dapat larut dalam lemak, sehingga zat ini menjadi antioksidan yang terpenting pada lingkungan ini. Β-carotene, lycopene dank o-enzim Q juga telah diketahui memiliki peran sebagai antioksidan pada membran. Antioksidan yang larut pada lemak/lipid juga memiliki arti yang penting dalam menjaga lapisan polyunsaturated fatty acid dari peroksidasi lipid yang dapat menyebabkan kerusakan dari integritas membran sel.
Antioksidan Ektraseluler
ROS juga didapatkan pada kompartemen ekstraseluler, terutama sebagai hasil dari aktivasi netrofil. Komponen plasma dan sel darah merah dapat berfungsi sebagai antioksidan; sel darah meral memiliki komponen copper-zinc SOD-dependent pathway yang dapat menginaktivasi O2-, katalase dan glutathione peroksidase dalam menghadapi H2O2. Apotranferrin, lactoferin dan ceruloplasmin merupakan protein plasma binding protein yang memiliki fugsi sebagai antioksidan. Albumin juga memiliki fungsi antioksidan melalui group thiol yang dapat teroksidasi yang dimilikinya, dimana hal ini dapat meningkatkan proses radical scavenging. Di dalam plasma juga didapatkan sejumlah molekul kecil yang memiliki arti penting sebagai antioksidan, termasuk diantaranya vitamin E, Vitamin C (asam ascorbat, AA), asam urat dan bilirubin. Vitamin C dapat berikteraksi dengan O2- untuk membentuk dehidroascorbic acid, dan akan menurunkan kadar Fe3+ dengan cara mengubahnya menjadi bentuk Fe2+ yang akan melibatkan Vitamin C baik sebagai pro mauppun antioksidan.
2.3 Stress oksidatif pada syok Septik
Sepsis dapat mengaktivasi berbagai macam sel seperti makrofag, netrofil, sel endotel maupun epithelial yang akan melepaskan sejumlah mediator, termasuk diantaranyya cytokines, chemokines, PAF, interferon- , komplemen prostanoid, leukotriene dan protease. Kejadian ini akan menyebabkan aktivasi dari sel imun yang disertai pelepasan ROS. Mediator inflamasi ini memiliki peran yang penting dalam membunuh organisme patogen., namun jika respon yang terjadi terlalu
26
eksesif, makan dapat menyebabkan infeksi sistemik pada organ dibagian distal dan dapat menyebabkan kematian,
Borelli dkk telah mendokumentasikan bahwa kadar Vitamin C pada plasma secara bermakna mengalami penurunan pada pasien di ICU yang mengalami MOFS dibandingkan dengan mereka yang tidak mengalami MOFS. Victor et al., menunjukkan bahwa kadar Vitamin C pada mencit mengalami penurunan pada lekosit di nodus aksilaris, lien dan timus setelah pemberian LPS (Victor et al, 2005). Pada populasi pasien dewasamaupun pediatrikdengan sepsis akan didapatkan peningkatan aktivitas XO.
Namun intensitas dan durasi dari proses inflamasi sangat tergantung dari keseimbangan lokal antara pro oksidan dan antioksidan, terutama pada sistem imun. Karena hal ini lah banyak sekali penelitian menggunakan antioksidan sebagai teapi pada pasien dengan sepsis.
2.4 Disfungsi mitokondria pada Syok Septik
Mitokondria merupakan pernghasil energi pada sel eukaryotic dan potensial menjadi tempat dimana ROS diproduksi. Pada pasien dengan sepsis didapatkan insufisiensi pada produksi energi pada tingkat seluler yang akan menyebabkan kurusakan jaringan/organ. Disfungsi mitokondria akan menyebabkan kegagalan pembentukan bioenergi yang merupakan mekanisme yang terjadi pada syok septik, dan hal ini sudah dikenal sejak 30 tahun yang lalu. Pada dekade terakhir fokus dari sepsis ditekankan pada masalah disfungsi endotel dan disfungsi pada kontrol vaskuler. Namun kedua efek ini telah diketahui dengan baik sebagai konsekuensi yang diakibatkan karena peningkatan kadar NO baik pada otot polos pada dinding pembuluh darah maupun pada otot rangka serta jantung (Kaymak, Basar, Sardas, 2011).
27
dari aktivitas cytochrome c oxidase. Pada penelitian in vivo juga memperlihatkan disfungsi mitokondria pada pasien dengan syok septik.
Dapat disimpulkan bahwa mitokondria memiliki peran sentral pada kejadian di tingkat intraseluler yang berhubungan dengan inflamasi dan sepsis yang pada saat bersamaan menjadi sumber penghasil energi serta target dari NO.
3. Peranan Nitrogen Spesies
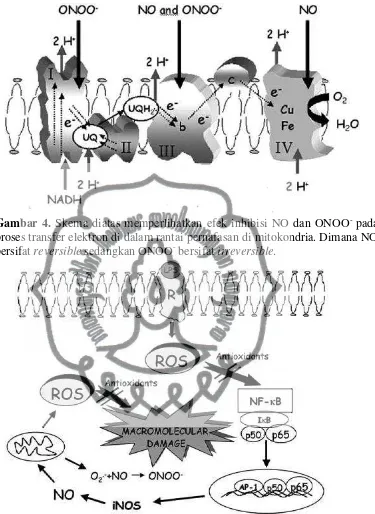
ROS dan reactive nitrogen species (RNS) memainkan peranan yang penting pada proses inflamasi sebagai mediator pada kerusakan yang terjadi. RNS merupakan nama kolektif termasuk diantaranya NO, ONOO-, nitrogen dioxide radical (NO2), nitrogen teroksidasi lainnya dan nitrogen yang timbul ketika NO bereaksi dengan O2-, RO- dan RO2-. NO beraksi cepat dengan ferrous iron, dan pada saat konsentrasinya sesuai dengan keadaan fisiologis, NO juga terikat dengan guanylate cyclase yang terlarut dan hemoprotein serta cytochrome c oxidase (COX) yang merupakan enzim terminal pada rantai pernafasan di mitokondria. Namun NO dapat mengontrol fungsi seluler melalui hambatan yang bersifat reversibel pada pernafasan ((Kaymak, Basar, Sardas, 2011)). Ada beberapa reactive NO species seperti N2O3 dan ONOO- yang dapat merubah komponen ktitikal pada sel.
Aktivasi dari monosit, makrofag, dan sel endotel yang diinduksi oleh LPS akan meningkatan ekspresi dari iNOS, dan menyebabkan peningkatan transformasi L-arginine menjadi NO. NO yang terbentuk akan mengalami reaksi dengan O2- dan membentuk ONOO- yang merupakan suatu oksidan yang sitotoksik yang dapat menyebabkan kerusakan jaringan selama periode syok, inflamasi dan reperfusi pada iskemia. NO akan menstimulasi pembentukan H2O2 dan O2- pada mitokondria, hal ini kemungkinan dilakukan dengan cara menghambat COX yang akan meyebabkan perlekatan elektron dari rantai pernafasan. H2O2 yang terbentuk juga akan mengatur dengan cara umpan balik untuk dalam menghambat ekspresi iNOS melalui aktivasi NFκB. ONOO- dapat menstimulasi pembentukan H2O2 dengan cara mengisolasi mitokondria. Namun kebalikannya, NO pada kadar yang fisiologis juga dapat menurunkan kerusakan yang dihasilkan oleh pembentukan ROS (Victor et al, 2005). Reaktivitas tinggi NO terhadap radikal merupakan keuntungan tersendiri pada in vivo, sebagai contoh denggan cara meningkatkan penghancuran radikal peroxyl dan
28
menghambat peroksidasi. Sebagai tambahan diduga bahwa ONOO- dapat menjadi signal transmisi yang dapat memediasi vasorelaksasi. RNS lainnya seperti nitrogen oksida dan nitryl clorida diyakini dapat menyebabkan beberapa kejadian patofisiologi, termasuk reaksi inflamasi.Gambaran skematik yang meperlihatkan efek inhibisi dari NO dan ONOO- pada mitokondria di iliustrasikan pada gambar.2.
Reaksi inflamasi memainkan peran yang penting pada kerusakan jaringan yang diinduksi oleh endotoksin. Kerusakan jaringan yang terjadi dimediasi oleh adhesi dan migrasi dari lekosit melalui endothelium yang akan membentuk ROS dan RNS, dan melepaskan beberapa cytokines pro inflamasi dari monosit maupun makrofag. Pembentukan RNS secara lokal akan berkontribusi terhadap kerusakan jaringan yang terjadi. Peningkatan pembentukan RNS sebagai respon terhadap endotoksin berbeda-beda sesuai dan spesifik terhadap organ (berikut urutan dari yang berkadar tinggi ke rendah: hati-jantung-serebrum-serebellum-paru-otot-darah-ileum-kidney-duodenum-jejunum).
4. Proteksi Antioksidan
Telah dilaporkan bahwa sepsis meyebabkan peningkatan penanda dari stress oksidatif pada berbagai hewan coba maupun manusia. Efek ini berkorelasi dengan ketidakseimbangan pada jumlah antioksidan. Bukti dari stress oksidatif pada sepsis dan hubungannya dengan ekspresi gen inflamasi telah memberikan dasar dalam intervensi yang dapat dilakukan baik dalam menurunkan stress oksidatif maupun dengan cara menghambat aktivasi proses transkripsi. Karena alasan ini, pengaturan antioksidan dalam melawan toksisitas endotoksin dan penggunaan secara klinis akan dibahas lebih lanjut.
4.1 Mekanisme Kerja Antioksidan Pada Endothel Pasien Sepsis
29
ditandai oleh pelepasan sitokin pro inflamasi seperti TNF-, 1L-1 , dan IL-6 dan mediator inflamasi termasuk NO, PGE2, iNOS dan COX.
Antioksidan dapat diklasifikasikan menjadi beberapa kelompok seperti tercantum di bawah ini :
1. Berdasarkan mekanisme kerjanya, anti oksidan dapat dibagi menjadi dua golongan, yaitu (Murray, 2003) :
a. Antioksidan pencegah
Pada dasarnya tujuan anti oksidan jenis ini adalah mencegah terjadinya radikal hidroksil, yaitu radikal yang paling berbahaya. Untuk membentuk radikal hidroksil diperlukan tiga komponen, yaitu : logam transisi Fe atau Cu, H2O2 dan O2. Agar reaksi Fenton tidak terjadi, maka harus dicegah keberadaan ion Fe++ atau Cu+ bebas. Untuk itu berperan beberapa protein penting, yaitu : (1). Untuk Fe: Transferin atau Feritin, (2). Untuk Cu : Seruloplasmin atau Albumin. Penimbunan O2 dicegah oleh Enzim ROS Dismutase (SOD) yang mengkatalisis reaksi dismutasi O2. Penimbunan H2O2 dicegah melalui aktifitas dua jenis enzim, yaitu : (1) Katalase, yang mengkatalisis reaksi dismutasi H2O2, (2). Peroksidase. Diantara berbagai peroksidase, yang paling penting adalah glutation peroksidase (GSPx). Apabila radikal hidroksil masih saja terbentuk, masih ada sarana lain untuk meredamnya, tanpa memberi kesempatan untuk memulai reaksi rantai dengan melibatkan senyawa-senyawa yang mengandung gugusan sulfidril seperti glutation dan sistein.
b. Antioksidan pemutus rantai
Dalam kelompok anti oksidan ini termasuk tocopherol, asam askorbat, -karoten, glutation dan sistein. Tocopherol dan -karoten bersifat lipofilik, sehingga dapat berperan pada membran sel untuk mencegah peroksidasi lipid. Sebaliknya, asam askorbat, glutation dan sistein bersifat hidrofilik, dan berperan dalam sitosol.
30
2. Berdasarkan kelarutan, antioksidan diklasifikasikan menjadi (Murray, 2003):
a. Larut dalam air (hidrofilik)
Antioksidan larut air bereaksi dengan oksidan dalam sitosol sel dan plasma darah, contohnya adalah Asam askorbat, glutation dan sistein
b. Larut dalam lipid (lipofilik)
Antioksidan yang larut lipid melindungi sel membran dari peroksidasi lipid, contohnya adalah Tocopherol dan -karoten.
Antioksidan yang berbeda-beda berada dalam cairan tubuh dan jaringan, dengan beberapa antioksidan seperti glutation atau ubiquinone sebagian besar berada di dalam sel, sementara yang lain seperti asam urat terdistribusi secara lebih merata.
Tabel 1. Pembagian antioksidan berdasarkan solubilitas (Murray, 2003)
Metabolit anti
3. Berdasarkan sifat enzimatik, antioksidan dapat dibagi menjadi (Pasupathy 2009) :
a. Enzimatik
Yang termasuk antioksidan enzimatik diantaranya adalah Glutation, ROS Dismutase dan Katalase
b. Non enzimatik
β-Karoten, Asam askorbat, Tocopherol
31
Liver adalah organ utama untuk membersihkan zat-zat toksin berasal dari bakteri maupun zat kimia seperti toksin, oksidan, dan pro-oksidan. Untuk melakukan detoksikasi dari bahan berbahaya tersebut, liver mengandung antioksidan dengan berat molekul rendah dan enzim yang merusak kelompok oksigen reaktif (ROS) yaitu glutation tereduksi (GSH), Vitamin C, vitamin E, ROS dismutase (SOD), glutation peroksidase, dan katalase.
4.2 Asam Askorbat
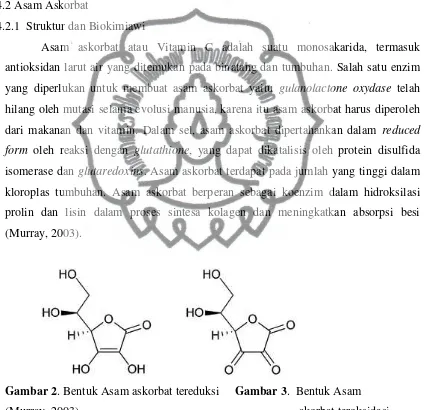
4.2.1 Struktur dan Biokimiawi
Asam askorbat atau Vitamin C adalah suatu monosakarida, termasuk antioksidan larut air yang ditemukan pada binatang dan tumbuhan. Salah satu enzim yang diperlukan untuk membuat asam askorbat yaitu gulanolactone oxydase telah hilang oleh mutasi selama evolusi manusia, karena itu asam askorbat harus diperoleh dari makanan dan vitamin. Dalam sel, asam askorbat dipertahankan dalam reduced form oleh reaksi dengan glutathione, yang dapat dikatalisis oleh protein disulfida isomerase dan glutaredoxins. Asam askorbat terdapat pada jumlah yang tinggi dalam kloroplas tumbuhan. Asam askorbat berperan sebagai koenzim dalam hidroksilasi prolin dan lisin dalam proses sintesa kolagen dan meningkatkan absorpsi besi (Murray, 2003).
Gambar 2. Bentuk Asam askorbat tereduksi Gambar 3. Bentuk Asam
(Murray, 2003) akorbat teroksidasi
(Murray, 2003)
4.2.3 Aktivitas Antioksidan
Asam askorbat adalah reducing agent dan dapat mengurangi dan menetralkan, reaktif oksigen spesies seperti hidrogen peroksida. Oksidan
32
seperti hidroksil radikal mengandung elektron tidak berpasangan dan sangat reaktif dan merusak pada tingkat molekuler. Hal ini disebabkan oleh interaksi ROS dengan asam nukleat, protein, dan lipid. Reaktif oksigen spesies mengoksidasi askorbat menjadi monodehydroascorbate dan kemudian menjadi dehydroascorbate. Reaktif Oksigen Spesies (ROS) direduksi menjadi air sementara bentuk askorbat teroksidasi relatif stabil, tidak reaktif dan tidak menyebabkan kerusakan sel. Dosis yang direkomendasikan adalah 90 mg/hari untuk laki-laki dan 75 mg/hari untuk wanita (Padayatty, 2003). Pemberian asam askorbat secara intravena aman dan dapat ditoleransi dengan baik pada pasien sepsis (Alpha et al, 2014). Dengan dosis 50-200 mg/kg/hari didapatkan kadar plasma sebesar 17,9 ± 2,4 µM (range normal 50-70µM) (Alpha et al, 2014) dan dengan kadar ini dapat menurunkan angka kejadian multiple organ failure, biomarker reaksi inflamasi serta kerusakan endotel.
Vitamin C (Asam Ascorbat/AA) merupakan donor elektron yang kuat, bereaksi baik dengan O2- maupun dengan OH-. AA memainkan peran penting dalam mekanisme pertahanan terhadap kerusakan oksidatif terutama yang disebabkan oleh lekosit. Pengaturan utama dari Vitamin C pada organisme berhubungan dengan fungsinya sebagai reduktor, namun Vitamin C juga ikut berperan dalam memodulasi jalur kompleks biokimia dimana hal ini merupakan bagian penting dalam metabolisme normal dari sel imun. Antioksidan ini menghambat aktivasi dari faktor transkripsi nuclear NF-κB yang dicetuskan oleh adanya endotoksin, dimana hal ini dapat menurunkan produksi TNFα. Penelitian Ex vivo telah menunjukkan pengaruh pemberian Vitamin C terhadap regulasi aktivitas seluler, seperti peningkatan adhesi dan produksi O2- yang dihasilkan oleh makrofag pada mencit dengan syok endotoksin yang akan berkurang dengan adanya AA (Victor et al, 2005). AA juga memperlihatkan kemampuan untuk memodulasi fungsi limfosit pada model yang sama. Studi in vitro telah memperlihatkan dimana AA dapat menghambat replikasi bakteria dan mencegah kerusakan sel endotel mikrovaskuler yang diakibatkan H2O2. Konsentrasi AA pada sirkulasi mengalami penurunan selama periode sepsis. Pada studi lainnya, Wu et al (2003) memperlihatkan dimana AA dapat menghambat ekspresi iNOS dan menurunkan kadar oksidan pada masa otot selama periode sepsis. Hasil ini
33
menimbulkan dugaan dimana pemberiacn vitamin pada early sepsis dapat menjadi terapi tambahan yang berharga.
4.2.4 Pelepasan NO yang dipengaruhi Askorbat dari S-nitrosothiols dalam plasma Askorbat dapat meningkatkan pengiriman NO dari plasma ke dinding pembuluh darah. Ketika diukur, konsentrasi NO bebas dalam plasma sekitar 3 nM, NO dapat diangkut sebagai S-nitrosothiols oleh albumin dan sistein bebas. Konsentrasi S-nitrosothiols dalam plasma antara 0,45 μM sampai tertinggi 7 μM, 82% dalam bentuk S-nitrosolabumin. Perlakuan pada hewan dengan pemberian NOS-inhibitor yaitu NG-monomethyl L-arginine (NMMA) menurunkan konsentrasi NO sampai 40%, menunjukkan bahwa NO mungkin dibentuk oleh aktivitas NOS (Spagnuolo, et al, 2006).
Vitamin C dapat melepaskan NO baik dari S-nitrosothiols dan S-nitrosoalbumin dengan berat molekul rendah. Meskipun NO yang dilepaskan ke dalam lumen pembuluh darah akan segera diuraikan oleh hemoglobin dalam eritrosit, sejumlah NO dapat mencapai sel otot polos dinding pembuluh darah. Hemoglobin sendiri dapat membawa sejumlah NO dalam bentuk S-nitrosothiols. Karena S-nitrosothiols dapat mengubah NO menjadi thiols bentuk lain melalui reaksi transnitrosation, perubahan S-nitrosohemoglobin menjadi S-nitrososistein dapat melepaskan NO dari eritrosit menuju plasma. Dukungan untuk pernyataan ini datang dari penelitian ini, eritrosit yang ditambah dengan S-nitrosohemoglobin, kemudian dicuci untuk melepaskan sisa S-nitrososistein intrasel, kemudian diinkubasikan pada beberapa segmen arteri kelinci. Ditemukan bahwa segmen arteri tersebut berdilatasi lebih dari segmen dengan eritrosit kontrol, sebagaiman disebutkan bahwa S-nitrosothiols dilepaskan dari eritrosit. Bagaimanapun tinggal ditunjukkan bahwa konsentrasi S-nitrosothiols plasma, khususnya pada eritrosit cukup untuk menghasilkan NO untuk bereaksi dengan askorbat (Xian, et al, 2000).
4.2.5 Reduksi Nitrit menjadi NO oleh Askorbat
Mekanisme lain dimana askorbat dapat mempertahankan NO di jaringan atau plasma adalah reduksi langsung nitrit (NO2-) menjadi NO. Reaksi ini mungkin diperantarai oleh protonated nitrous acid (H2NO2+) atau oleh nitrous anhydride (N2O3), dan telah diteliti berlangsung pada pH rendah.
34
Secara luas apakah terjadi secara in vivo belum diketahui. Meskipun begitu, karena nitrit merupakan hasil utama dekomposisi NO dalam larutan yang encer, reduksi nitrit oleh askorbat secara efektif akan memetabolisme dan menjaga konsentrasi lokal NO. Jalur arginin-NO merupakan sumber utama NO pada manusia yang puasa. Bagaimanapun, kadar konsentrasi nitrit dalam plasma masih menjadi perdebatan, antara tidak terdeteksi sampai 0,4 μM sampai 8,8 μM. Kemungkinan konsentrasi nitrit plasma dapat meningkat sebagai efek pelepasan NO dari endothel atau sel-sel inflamasi. Jika demikian, askorbat plasma atau intrasel cukup untuk membantu mengubah kembali nitrit menjadi NO. belum ada penelitian yang menunjukkan bahwa askorbat dapat mereduksi nitrit menjadi NO pada pH fisiologis dalam sel atau plasma. Memang, perlakuan utama untuk mekanisme ini sepertinya tidak mungkin, yaitu member pH asam yang optimal untuk mereduksi nitrit oleh askorbat.
4.2.6 Penguraian ROS Oleh Askorbat
Sel endothel menghasilkan ROS dan H2O2 sebagai hasil dari metabolisme baik di sitoplasma (prostaglandin, sitokrom P450, protein kinase C) maupun di mitokondria. Selanjutnya, produksi ROS oleh sel endothel meningkat pada segmen arteri kelinci yang dibuat hiperkolesterolemia. ROS bereaksi dengan NO membentuk peroksinitrit, yang dapat merusak sel. Lebih jauh lagi, nitrotyrosine yang merupakan “footprint” dari peroksinitrit, ditemukan pada lesi aterosklerotik. Dengan menguraikan ROS, askorbat dapat menurunkan konsumsi NO. Selanjutnya dilaporkan bahwa hanya dalam konsentrasi fisiologis yang tinggi (>1 mM), askorbat dapat menguraikan ROS secara efektif dan meningkatkan vasodilatasi yang dependen terhadap endothel pada beberapa segmen arteri kelinci. Fungsi ini sepertinya tidak mungkin terjadi pada konsentrasi Vitamin C plasma. Sepertinya juga tidak mungkin ROS yang dilepaskan oleh sel akan bereaksi dengan Vitamin C, karena konsentrasi ROS dismutase interstisial pada tunika intima arteri mungkin sudah cukup untuk menguraikan setiap ROS yang dilepaskan. Pada sisi yang lain, sebagaimana telah disebutkan sebelumnya, konsentrasi askorbat intrasel pada sel endothel berada pada rentang milimolar yang rendah. Konsentrasi askorbat intrasel ini harus cukup efektif untuk menguraikan ROS dan mencegah disfungsi endothel (Asada, 2006).
35
4.2.7 Pengaturan Reduksi-Oksidasi Tergantung Thiols Oleh eNOS : Interaksi Dengan Askorbat
Bukti menunjukkan bahwa eNOS merupakan titik utama pengaturan reduksi-oksidasi (redoks) yang melibatkan kelompok thiols pada enzim yang dibutuhkan untuk berfungsinya enzim, tetapi sensitif terhadap oksidasi. Anehnya, peran GSH dalam mengatur aktivitas eNOS masih kontroversial dan tergantung tipe sel atau spesies. Pada sel endothel arteri babi maupun sapi, penurunan kadar GSH berhubungan langsung dengan aktivitas eNOS. Pada sel endothel vena umbilikalis manusia, sintesis NO berkurang dengan penipisan GSH, dan meningkat dengan peningkatan kadar GSH karena pemberian GSH monoethyl ester. Baru-baru ini, sebuah penelitian klinis menunjukkan bahwa peningkatan GSH intrasel karena pemberian 2-oxothiazolidine oral (diubah menjadi GSH) meningkatkan vasodilatasi arteri brakhialis pada pasien dengan penyakit arteri koroner. Ada beberapa mekanisme yang masuk akal pada pengaturan redoks tergantung thiols oleh eNOS. Pertama, transport arginin pada sel endothel membutuhkan kadar GSH intrasel yang cukup. Kedua, senyawa thiols meningkatkan stimulasi brain-type NOS oleh tetrahydrobiopterin, sebuah kofaktor esensial untuk eNOS. Ketiga, S-nitrosylation pada thiols yang sensitif enzim dapat menghambat aktivitasnya sendiri. Pengaturan redoks langsung oleh eNOS melibatkan enzim Cys184 dan Cys99. Paparan NO pada sel endothel arteri pulmonalis atau pada eNOS murni, berupa S-nitrosylate, sistein ini akan menghambat aktivitas eNOS. Thiols ini juga sensitif terhadap oksidasi oleh diamida atau alkilasi oleh N-ethylmaleimide, diikuti hilangnya aktivitas enzim. Lebih jauh lagi, sistem thioredoxin/thioredoxin reductase dapat membalikkan efek dari diamida, sepertinya karena kehilangan campuran disulfide. Sebaliknya askorbat tidak dapat mengubah GSSG secara langsung atau protein disuldida menjadi sulfhidril, itu dapat melindungi thiols dengan cara (i) penguraian ROS intrasel berlebih, (ii) dekomposisi S-nitrosothiols dengan berat molekul rendah sebelum bereaksi dengan eNOS, atau (iii) pemindahan S-nitrosothiols pada eNOS (Kuzkaya, et al, 2003).
36
4.2.7 Pengaturan eNOS Oleh Askorbat Melalui Tetrahydrobiopterin
Baru-baru ini telah disebutkan bahwa suplementasi askorbat dalam jumlah yang fisiologis pada kultur sel endothel vena umbilikalis manusia meningkatkan ionomycin dan aktivitas eNOS yang distimulasi thrombin, serta produksi cyclic GMP. Efek ini berhubungan dengan perubahan transport arginin atau gen eNOS atau ekspresi protein. Karena askorbat dan redoks aktif yang berhubungan dengan derivat askorbat meningkatkan aktivitas eNOS tetrahydrobiopterin-dependent pada sel lysate dan NOS brain-type murni, telah disebutkan bahwa askorbat meningkatkan availabilitas tetrahydrobiopterin atau afinitas eNOS terhadap tetrahydrobiopterin. Telah diketahui dengan baik bahwa baik eNOS maupun NOS brain-type membutuhkan tetrahydrobiopterin. Tetrahydrobiopterin dapat menjadi faktor yang membatasi aktivitas eNOS, terutama pada sel yang dikultur. Sebagai contoh, peningkatan kadar tetrahydrobiopterin intrasel meningkatkan aktivitas eNOS dengan stimulus kalsium pada kultur sel endothel. Pada penelitian ini diamati apakah kandungan tetrahydrobiopterin intrasel meningkat oleh peningkatkan enzim-enzim untuk biosintesis tetrahydrobiopterin dengan induksi sitokin atau dengan pemberian sepiapterin, prekursor tetrahydrobiopterin sintetik. Askorbat dapat mempertahankan tetrahydrobiopterin secara langsung dengan mencegah oksidasinya, meskipun hal ini belum pernah dilakukan penelitian. Askorbat juga dapat menyimpan tetrahydrobiopterin secara tidak langsung melalui dua mekanisme. Pertama, askorbat dapat meningkatkan afinitas tetrahydrobiopterin terhadap eNOS, dengan mempertahankan thiols penting pada eNOS yang dibutuhkan untuk pengikatan kofaktor seperti telah disebutkan sebelumnya. Kedua, askorbat dapat mengurangi siklus redoks tetrahydrobiopterin dengan menurunkan konsentrasi ROS intrasel dan peroksinitrit, yang akan dibahas selanjutnya.
Hasil dari beberapa penelitian menunjkkan bahwa tetrahydrobiopterin berperan dalam metabolisme ROS intrasel.sebagai contoh, telah dilakukan penelitian bahwa pemberian tetrahydrobiopterin pada kultur sel hepar mencegah kerusakan sel yang diakibatkan oleh ROS berlebih dan hidroksi radikal yang dihasilkan oleh metabolisme paraquat. Peningkatan kadar tetrahydrobiopterin intrasel dapat melindungi sel endothel terhadap kerusakan akibat H2O2-. Selain itu, perlindungan ini dihasilkan oleh efek antioksidan
37
langsung tetrahydrobiopterin dan tidak merubah aktivitas eNOS (Matei, et al, 2006).
Pada sisi lain, metabolisme tetrahydrobiopterin dapat meningkatkan produksi ROS, paling tidak melalui 2 mekanisme. Pertama, tetrahydrobiopterin mengalami siklus redoks dengan oksigen molekuler, yang menghasilkan ROS. Kedua, paling tidak untuk NOS brain-type, tetrahydrobiopterin hilang selama katalisis. Mungkin juga karena teroksidasi menjadi 5,6-dihydrobiopterin, atau diubah menjadi produk yang belum teridentifikasi. Tidak tersedianya tetrahydrobiopterin menyebabkan NOS menghasilkan ROS dan H2O2. ROS berlebih intrasel bergabung dengan NO dari eNOS membentuk peroksinitrit. Ini akan menyebabkan penurunan NO, dan oksidasi tetrahydrobiopterin tergantung- peroksinitrit. Pada tingkat konsentrasi milimolar rendah, askorbat menguraikan supeoksida dan peroksinitrit, askorbat dapat mencegah siklus redoks tetrahydrobiopterin dan memperkuat aktivasi eNOS tergantung- tetrahydrobiopterin (Tiefenbacher, 2001).
4.2.8 Askorbat sebagai salah satu kofaktor eNOS
Tahap pertama pembentukan NO oleh nitrit oxide synthase adalah hidroksilasi satu atom amidin nitrogen dari arginin. Reaksi ini, sama seperti mekanisme yang berhubungan dengan hemoprotein P-450, membutuhkan satu molekul oksigen dan NADPH. Apakah askorbat dapat memfasilitasi reaksi ini belum diketahui. Askorbat dapat berperan sebagai kofaktor reduksi untuk reaksi hidroksilasi yang lain, termasuk prolyl-4-hydroxylase, dopamine β -monooxygenase, dan indoleamine 2,3-dioxygenase. Pada sisi lainnya, reaksi, mekanisme enzim ini berbeda dengan heme oxygenase seperti nitric oxide synthase, dimana tidak digunakan kofaktor lain selain NADPH (Huang, 2000).
4.2.9 Efek askorbat pada stimulasi guanylate cyclase oleh NO
Askorbat telah diketahui dapat meningkatkan vasodilatasi diinduksi NO pada arteri koroner dan beberapa segmen arteri mesenterika manusia. Karena degradasi cyclic GMP dan potensi cyclic GMP untuk mengaktifkan cyclase dipengaruhi oleh askorbat, maka dikemukakan bahwa efek askorbat tersebut berhubungan dengan pengaturan redoks guanylate cyclase pada sel
38
otot polos. Pengaruhnya spesifik hanya karena askorbat, karena DHA menyebabkan kontraksi, dan thiols tidak mempunyai efek. Efek askorbat dalam meningkatkan kemampuan guanilat cyclase menghasilkan cyclic GMP merupakan bukti lain bahwa askorbat meningkatkan pelepasan NO oleh sel endothel. Satu mekanisme yang mungkin dari efek tersebut adalah sebagai berikut. NO berikatan dengan 6 sisi koordinat pada kofaktor guanilat cyklase heme. Ini menggantikan posisi ligan trans-histidin, yang kemudian mengaktifkan enzim. Aktivasi enzim yang tergantung-NO hanya berlangsung ketika besi heme pada kondisi Fe2+, dimana pada kondisi tersebut NO tidak mengaktifkan enzim. Askorbat dapat memudahkani aktivasi guanylate cyclase tergantung-NO oleh cadangan NO. cadangan NO bisa berasal dari beberapa mekanisme, diantaranya pembentukan kembali nitrit menjadi NO, pelepasan NO dari penyimpanan intrasel S-nitrosothiols, atau dari penguraian ROS dan peroksinitrit. Askorbat juga memudahkan aktivasi cyclase tergantung-NO dengan mempertahankan besi heme enzim pada kondisi tereduksi, tetapi akses askorbat pada metabolisme besi yang kompleks ini masih diragukan.
Ada beberapa bukti klinis yang menunjukkan bahwa askorbat dapat meningkatkan vasodilatasi dengan pemberian NO dari luar. Meskipun askorbat tidak secara langsung memperkuat efek vasodilator pemberian NO secara in vivo, suplemen askorbat oral dapat mencegah toleransi nitrat pada pasien dengan penyakit koroner. Kemungkinan efek askorbat dalam mempertahankan aktivitas guanylate cyclase pada penelitian ex-vivo mendasari penelitian selanjutnya (Tiefenbacher, 2001).
Akhirnya, dipertimbangkan bahwa askorbat mempunyai efek pro oksidan yang berhubungan dengan metabolisme dan pembentukan NO. Meskipun askorbat dapat menghasilkan spesies oksigen reaktif melalui kemampuannya untuk mereduksi logam transisi, efek ini tidak muncul secara signifikan in vivo, dimana logam tersebut jarang dan tidak tersedia. Bagaimanapun, pada sebuah lesi aterosklerotik, dimana terjadi perdarahan, hemolisis, denaturasi hemoglobin, dan pelepasan besi, askorbat dapat meningkatkan pembentukan radikal bebas melalui reaksi tipe-Fenton. Peningkatan sintesis NO karena askorbat belum diketahui efek ke depannya. Karena sebagian besar efek toksik NO mungkin berhubungan dengan pembentukan peroksinitrit, dan karena askorbat dapat menurunkan
39
peroksinitrit dan prekursornya peroksida, sepertinya kecil resiko terjadinya efek toksik akibat interaksi askorbat dan NO (Nossaman, et al, 2012).
4.2.10 Mekanisme Transport Vitamin C
Vitamin C (asam askorbat) berdisosiasi untuk membentuk askorbat pada pH fisiologis. Askorbat berfungsi sebagai antioksidan dan kofaktor enzim, akan teroksidasi menjadi asam dehidroaskorbat (DHAA) dalam prosesnya. SIRS dan sepsis menurunkan konsentrasi askorbat plasma. Injeksi iv Vitamin C dapat meningkatkan jumlah askorbat yang dikirim ke sel-sel endothel pada tingkat yang lebih besar daripada melalui konsumsi oral.
Askorbat diangkut ke dalam sel endothel mikrovaskuler oleh transporter khusus SVCT2, sementara DHAA diambil melalui transporter yang difasilitasi glukosa (GLUT) dan kemudian bereduksi menjadi askorbat. Konsentrasi askorbat intraseluler yang dicapai adalah 4-16 mM. Askorbat intraseluler ini dapat melindungi fungsi mikrovaskuler pada dua tahap aksi: awalnya dengan menghambat aktivasi NADPH oksidase dan meningkatkan aktivitas eNOS, dan kemudian dengan menekan ekspresi NADPH oksidase, iNOS dan faktor jaringan.
Askorbat dalam sel endothel mencegah oksidasi tetrahydrobiopterin, meningkatkan kadar tetrahydrobiopterin dan meningkatkan sintesis nitric oxide oleh eNOS. Adalah penting bahwa askorbat merangsang aktivitas eNOS sementara menghambat ekspresi iNOS (Victor et al, 2005)