Pierre ex Lecomte DAN
Aquilaria microcarpa
Baill
EKA NOVRIYANTI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Dengan ini saya menyatakan bahwa tesis Peranan Zat Ekstraktif Dalam Pembentukan Gaharu PadaAquilaria crassna Pierre ex Lecomte dan Aquilaria microcarpa Baill belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Agustus 2008
Aquilaria crassna Pierre ex Lecomte and Aquilaria microcarpa Baill. Supervisors are WASRIN SYAFII and ERDY SANTOSA.
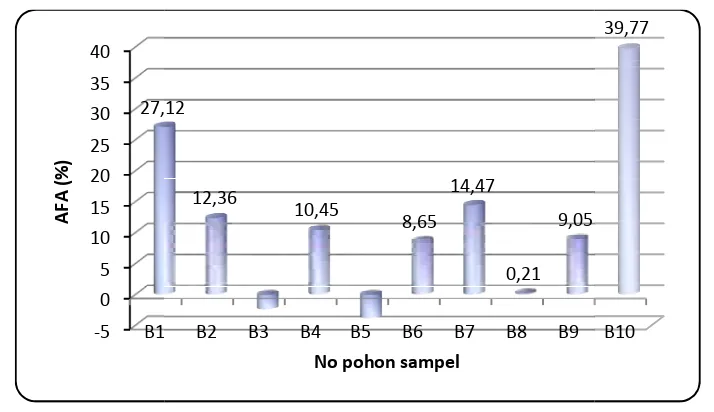
This research is aimed at investigating the anti fungal activity (AFA), the correlation of gaharu tree’s phenolics in relation with the susceptibility of the trees toFusarium bulbigenumattack in the formation of agarwood, and to observe total phenolics content and tree’s chemicals of Aquilaria crassna and Aquilaria microcarpa pre-inoculation, the reology of tree’s chemical and microorganism change along inoculation time. There were variations of anti fungal activity among trees, and the highest is at tree no. 10 that AFA was in the middle class (39,77%), but entirely agarwood trees exhibited a low anti fungal activity at lab scale. Further fractionation and bioassay showed that the most active component are likely in the ethyl acetate fraction that exhibited strong anti fungal activity at 4% concentration. Trees as many as 20 of A. microcarpa at Carita and 10 ofA. crassnaat Darmaga were inoculated with isolate ofF.bulbigenumin spiral pattern around the stem. Prior to inoculation, strips were taken from the stem for total phenolics content and chemicals analyzing. The result revealed that total phenolics content and infection area exhibited a negative correlation, which means the higher the phenolics content, the smaller the infection area. The pre-inoculation chemicals analysis showed that tree with smaller infection area had larger type of compounds and higher concentration of phenolics than tree with wider one. Some chemicals that at certain plants acted as defense system, according to some references, were found at higher concentration in the gaharu trees with smaller infection or they were not even traced in other tree. The reology analysis revealed that the largest types of compounds were noticed at three day’s old inoculation. Agarwood constituents and other aromatic compounds were detected since three days after inoculation which is indicated the agarwood formation was taken place. Meanwhile, the microbiology analysis showed there was no microbes change in the inoculation sites along 6 month inoculation time, but some small insects, such as ants and bugs, were found at the area.
Aquilaria crassnaPierre ex Lecomte danAquilaria microcarpaBaill. Dibimbing oleh WASRIN SYAFII dan ERDY SANTOSA.
Gaharu merupakan nama perdagangan dari produk yang dihasilkan oleh beberapa spesies pohon penghasil gaharu yang sebenarnya merupakan endapan resin pada jaringan kayu sebagai reaksi pohon terhadap pelukaan atau infeksi penyakit. Pemanfaatan gaharu adalah untuk pengobatan,incense, pengharum dan parfum. Sampai saat ini, gaharu masih mengandalkan produksi dari hutan alam yang semakin langka. Tingginya intensitas perburuan telah mengakibatkan dua genus utama penghasil gaharu tercantum dalam daftar Appendix II CITES.
Fenolik, merupakan metabolit sekunder yang diketahui memiliki fungsi sebagai senyawa pertahanan terhadap pengaruh lingkungan dan penyakit. Pengetahuan mengenai fungsi metabolit sekunder dalam pembentukan gaharu akan sangat berperan dalam keberhasilan produksi gaharu buatan, karena perlakuan yang diberikan pada pohon-pohon potensial tentunya akan lebih efektif dan efisien.
Penelitian ini bertujuan untuk mengetahui sifat anti jamur ekstrak pohon penghasil gaharu, mengetahui hubungan antara kandungan total fenolik dengan kerentanan pohon dalam pembentukan gaharu oleh infeksi jamur, dan untuk mengetahui komposisi senyawa pohon sebelum inokulasi dan perubahannya setelah inokulasi dilakukan, serta untuk melihat perubahan mikroba di area infeksi.
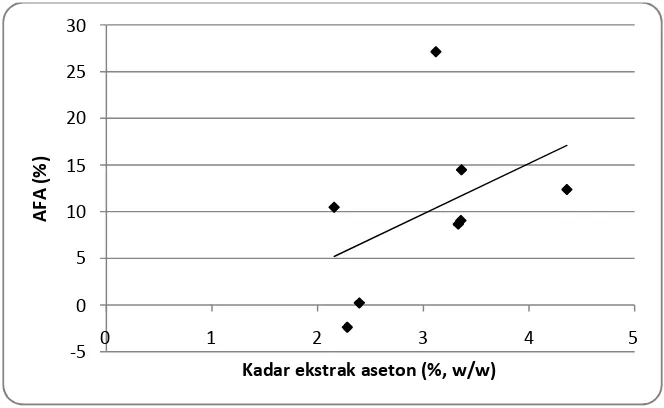
Sifat anti jamur pohon penghasil gaharu ini diteliti dengan mengekstrak serbuk dari batang menggunakan pelarut aseton. Sifat anti jamur pohon A. crassna dianalisis terhadap Fusarium bulbigenum yang diketahui merupakan jamur pemicu pembentukan gaharu. Hasil bioasai ekstrak aseton batang A. crassnaterhadap F. bulbigenum menggunakan metode cawan petri menunjukkan keragaman anti jamur pada pohon-pohon tersebut dan yang tertinggi adalah sifat anti jamur pohon nomor 10 yang termasuk dalam klasifikasi sedang (39,77%). Namun secara keseluruhan, pohon penghasil gaharu ini memiliki sifat anti jamur klasifikasi rendah pada skala laboratorium. Jika dihubungkan antara sifat anti jamur dengan kandungan ekstrak aseton ataupun kandungan total fenolik setiap pohon, terlihat kecenderungan hubungan positif dimana semakin tinggi kandungan ekstrak aseton ataupun kandungan total fenolik maka nilai aktivitas anti jamur akan semakin tinggi pula yang berarti semakin tinggi ketahanan pohon terhadap serangan jamur pemicu pembentukan gaharu ini.
kerentanan pohon yang direfleksikan dengan luasan infeksi, 20 pohon A. microcarpadi Carita dan 10 A. crassnadi Darmaga diinokulasi dengan isolat cair
F.bulbigenum dalam pola spiral mengelilingi batang. Sebelum inokulasi, strip diambil dari bagian batang untuk analisis kandungan total fenolik dan analisis senyawa kimia pra-inokulasi. Setelah di-plotting dalam bentuk grafik dua dimensi, antara hasil analisis kandungan total fenolik dan hasil pengamatan luas infeksi menunjukkan kecenderungan hubungan negatif antara keduanya. Kecenderungan ini berarti semakin tinggi kandungan total fenolik maka semakin kecil luas infeksi yang terjadi pada batang pohon. Hasil analisis GCMS untuk ekstrak batang pra-inokulasi menunjukkan pohon dengan luas infeksi yang lebih kecil mengandung lebih banyak jenis senyawa serta konsentrasi senyawa-senyawa fenolik-nya relatif lebih tinggi daripada pohon yang mengalami infeksi lebih luas. Beberapa senyawa yang pada berbagai referensi disebutkan sebagai senyawa pertahanan pada tanaman tertentu, ditemukan dalam konsentrasi yang relatif lebih tinggi pada pohon dengan infeksi yang lebih kecil atau bahkan sama sekali tidak ditemukan pada pohon yang infeksinya lebih luas.
Untuk mengetahui perubahan kimiawi yang terjadi selama inokulasi, dilakukan analasis senyawa batang dalam waktu-waktu tertentu menggunakan instrumen GCMS. Analisis dilakukan untuk ekstrak dari area nekrosis batang pada umur inokulasi 3 hari (H3), 2 bulan (B2), dan 6 bulan (B6) serta pra-inokulasi (H0). Hasilnya menunjukkan bahwa dibandingkan waktu pengamatan yang lain, jenis senyawa yang tercatat pada hari ketiga, jauh lebih besar. Beberapa senyawa fenolik yang berdasarkan beberapa rujukan berperan sebagai senyawa pertahanan pada tanaman tertentu, terdeteksi pada pohon gaharu ini mulai dari hari ketiga hingga bulan keenam setelah inokulasi. Hasil analisis ini menunjukkan adanya konstituen gaharu dan senyawa-senyawa aromatis yang terdeteksi mulai hari ketiga hingga bulan keenam, dan hal ini mengindikasikan terjadinya proses pembentukan gaharu pada pohon.
Analisis mikrobiologi dilakukan per periode 2 bulanan untuk mengetahui perubahan mikrobiologis yang terjadi pada titik luka inokulasi. Analisis dilakukan dengan mengambil bagian batang antara area nekrosis dengan area yang sehat, dimana bagian yang mengandung miroba ini kemudian dibiakkan pada media agar. Koloni-koloni mikroba yang muncul selanjutnya diisolasi dan diidentifikasi jenisnya. Dari hasil analisis mikrobiologis ini diketahui bahwa pada umur enam bulan inokulasi belum terjadi perubahan mikroorganisme yang bersifat predasi pada pohon-pohonA. microcarpadanA. crassna. F. bulbigenum
1. Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebut sumber.
a. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah.
b. Pengutipan tidak merugikan kepentingan yang wajar IPB.
Pierre ex Lecomte DAN
Aquilaria microcarpa
Baill
EKA NOVRIYANTI
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Ilmu Pengetahuan Kehutanan
SEKOLAH PASCA SARJANA
INSTITUT PERTANIAN BOGOR
Nama : Eka Novriyanti
NIM : E051060421
Disetujui
Komisi Pembimbing,
Prof. Dr. Ir. Wasrin Syafii, M.Agr Dr. Erdy Santosa, M.S.
Ketua Anggota
Diketahui,
Ketua Program Studi Dekan Sekolah Pascasarjana
Prof. Dr. Ir. Iman Wahyudi, M.S. Prof. Dr. Ir. Khairil Anwar Notodiputro, M.S.
SWT, dorongan dan dukungan pihak lain. Karena itu, puji dan syukur penulis panjatkan kepada Allah SWT atas segala karuniaNya sehingga pelaksanaan penelitian dan penulisan tesis berjudul ‘Peranan Zat Ekstraktif Dalam Pembentukan Gaharu Pada Aquilaria crassna Pierre ex Lecomte dan Aquilaria microcarpa Baill’ ini dapat diselesaikan. Terima kasih dan penghargaan penulis ucapkan kepada:
1. Prof. Dr. Ir. Wasrin Syafii, M.Agr. sebagai ketua Komisi Pembimbing dan Dr. Erdy Santosa, M.S. sebagai anggota Komisi Pembimbing yang telah banyak memberi bimbingan dan masukan serta saran dalam berbagai kesempatan diskusi yang sangat membangun untuk penelitian ini.
2. Departemen Kehutanan atas beasiswa yang diberikan sehingga penulis dapat menjalani pendidikan di program studi Ilmu Pengetahuan Kehutanan Sekolah Pascasarjana IPB.
3. Keluarga besarku tercinta, Mamak dan Bapak, Papa, Mama, Om Yok, Tante keni, Tante Ii, serta adik-adikku tersayang semuanya.
4. Peneliti dan staf di Laboratorium Mikrobiologi Puslit Hutan dan Konservasi Alam yang telah banyak membantu selama pelaksanaan penelitian, Dr. Ir. Maman Turjaman, DEA, Dr. Irnayuli Sitepu, Pak Najmulah, Pak Yanto, pak Sugeng, dan Pak Yani. Staf di Laboratorim Kimia Hasil Hutan, Mas Wawan dan Pak Atin.
5. Prof. Suminar Achmadi dan Ir. Rita Kartika Sari, M.Si atas kesempatan diskusi dan masukan yang diberikan.
6. Antie dan Bu Syahidah, teman seperjuangan dalam penelitian yang begitu banyak membantu tanpa pamrih. Tekat dan kak Ida atas dorongan dan bantuannya. Serta teman-teman angkatan 2006 di pasca sarjana IPK, Erna, Henti, Ika, Teteh Ratih, Arida, Santi, Colik, Uni Susi dan semuanya, atas kebersamaan dan semangat selama proses belajar dan penelitian.
7. Berbagai pihak yang tidak dapat disebutkan satu per satu, untuk semua dorongan dan dukungan yang diberikan.
Perjalanan panjang selama lebih dari delapan bulan penelitian yang dilakukan di Laboratorium Bagian Kimia Hasil Hutan Fahutan IPB, Laboratorium Mikrobiologi Puslit Hutan dan Konservasi Alam, Laboratorium Kimia Terpadu IPB, dan Laboratorium Terpadu Puslit Hasil Hutan, akhirnya dapat disusun dalam bentuk karya ilmiah ini yang semoga bermanfaat.
Bogor, Agustus 2008
merupakan anak pertama dari Bapak Lasiman Yan dan Ibu Tuti Riwayati. Pendidikan dasar penulis selesaikan di SD Inpres No. 76 Bukit Canggang Bukittinggi pada tahun 1989 dan SMP Negeri 1 Bukittinggi hingga tahun 1992, kemudian penulis melanjutkan ke SMA Negeri 3 Bukittinggi dan lulus tahun 1995. Pada tahun yang sama melanjutkan pendidikan di Jurusan Teknologi Hasil Hutan Fakultas Kehutanan Institut Pertanian Bogor dan lulus pada tahun 2000.
Pada tahun 2002 penulis diterima sebagai calon peneliti di Badan Penelitian dan Pengembangan Hutan Departemen Kehutanan dan ditempatkan di Loka Penelitian Hasil Hutan Bukan Kayu Kuok, Riau, yang sejak tahun 2006 telah menjadi Balai Penelitian Hutan Penghasil Serat. Pada tahun 2006 penulis berkesempatan melanjutkan pendidikan di Sekolah Pascasarjana IPB Bogor pada Program Studi Ilmu Pengetahuan Kehutanan (IPK) Program Studi Teknologi Hasil Hutan, dengan bantuan dana dari beasiswa Departemen Kehutanan.
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada Program Studi Ilmu Pengetahuan Kehutanan penulis menyusun tesis dengan judul ‘Peranan Zat Ekstraktif Dalam Pembentukan Gaharu Pada Aquilaria crassna
xi
DAFTAR TABEL ... xii
DAFTAR GAMBAR ... xiii
DAFTAR LAMPIRAN ... xiv
PENDAHULUAN ... 1
Latar Belakang ... 1
Identifikasi Masalah ... 3
Tujuan ... 4
Manfaat Penelitian ... 4
Hipotesis ... 5
TINJAUAN PUSTAKA ... 6
Gaharu... 6
Aquilariaspp ... 7
Aquilaria crassna ... 9
Aquilaria microcarpa... 9
Kandungan Kimiawi Gaharu ... 10
Budidaya dan Pembentukan Gaharu... 11
Zat Ekstraktif Kayu... 15
Fenolik dan Senyawa Pertahanan Tanaman ... 17
Analisis Senyawa Fenolik... 20
Fusariumspp ... 22
BAHAN DAN METODE ... 25
Lokasi dan waktu Penelitian ... 25
Sifat Anti Jamur Ekstrak BatangA. Crassna TerhadapF. Bulbigenum....25
Sifat Anti Jamur Ekstrak DahanA. CrassnaTerhadapF. Bulbigenum ....28
Hubungan Ekstraktif Pohon Dengan Infeksi OlehF. bulbigenum... 31
Perubahan Senyawa Pada Batang Pohon Gaharu ... 34
Analisis Mikrobiologi ... 35
HASIL DAN PEMBAHASAN... 36
Sifat Anti Jamur Ekstrak BatangA. Crassna TerhadapF. Bulbigenum....36
Sifat Anti Jamur Ekstrak DahanA. CrassnaTerhadapF. Bulbigenum .... 40
Hubungan Ekstraktif Pohon Dengan Infeksi OlehFusarium sp... 44
Perubahan Senyawa Pada Batang Pohon Gaharu ... 53
Analisis Mikrobiologi ... 60
SIMPULAN ... 63
DAFTAR PUSTAKA ... 65
xii
1 Klasifikasi kualitas gaharu ... 7
2 Jenis-jenisAquilariayang menghasilkan gaharu ... 8
3 Cendawan yang berasosiasi dengan pohon gaharu ... 14
4 Klasifikasi tingkat aktivitas anti jamur ekstrak ... 27
5 Kadar ekstraktifA. crassna... 40
6 Senyawa-senyawa pada ekstrak pra-inokulasi pohon contoh yang pada tanaman tertentu disebutkan dalam berbagai tulisan berperan sebagai senyawa pertahanan ... 48
7 Senyawa-senyawa yang berdasarkan beberapa referensi diketahui merupakan pertahanan pada tanaman tertentu dan terdeteksi pada ekstrak pohon-pohon contoh ... 49
8 Senyawa-senyawa yang hanya ditemukan pada pohon contoh ke-10... 52
xiii
1 Beberapa struktur kimia komponen gaharu ... 11
2 Skema ektraksi bertingkat serbuk dahanA. crassna... 29
3 Pola pengambilan sampel uji dan pola spiral untuk inokulasi ... 32
4 Pola titik inokulasiF. bulbigenumpada batang pohon contoh ... 34
5 Aktivitas anti jamur dari ekstrak batangA. crassnaterhadap F. bulbigenumsetelah inkubasi 10 hari ... 37
6 Hubungan kandungan ekstrak aseton batangA. crassnadengan AFA... 38
7 Pertumbuhan miseliaF. bulbigenumpada media percobaan yang diberi tambahan ekstrak batangA. crassnasetelah inkubasi 10 hari ... 39
8 Hubungan kandungan total fenolik batangA. crassnadengan nilai AFA.... 39
9 Nilai AFA masing-masing fraksi terhadapF. bulbigenumpada kelima taraf konsentrasi yang dicobakan ... 41
10 Rataan nilai AFA masing-masing fraksi terhadapF. bulbigenum... 41
11 Rataan nilai AFA (%) pada berbagai konsentrasi fraksi etil asetat... 42
12 Pertumbuhan miseliaF. bulbigenumpada media uji yang diberi ekstrak etanol dahanA. crassnadan fraksi-fraksinya ... 43
13 Kandungan total fenolik pohon-pohon contoh berdasarkan metode Folin Ciocalteu ... 44
14 Infeksi pohon contoh di Carita dan Darmaga yang diinokulasi dengan F. bulbigenumpada umur inokulasi 6 bulan ... 45
15 Hubungan total fenolik dengan luasan infeksi olehF. bulbigenumpada batang pohon contoh ... 46
16 Hubungan total fenolik dengan luas infeksi pada batangA. microcarpa di Carita ... 46
17 Hubungan total fenolik dengan luas infeksi pada batangA. crassna di Darmaga ... 47
18 Hubungan kadar ekstrak aseton batangA. crassnadengan luas infeksi ... 47
19 Kondisi luasan infeksi pada pohonA. crassnake-10 dibandingkan dengan pohon ke-6 di lokasi penelitian Darmaga... 51
20 SporaF. bulbigenumkoleksi Laboratorium mikrobiologi P3HKA yang dilihat di bawah mikroskop dengan perbesaran 40X ... 61
21 SporaF. bulbigenum yang diisolasi dari daerah infeksi padaA. microcarpa di Carita yang dilihat di bawah mikroskop dengan perbesaran 40X ... 61
22 SporaF. bulbigenum yang diisolasi dari daerah infeksi padaA. crassna di Darmaga yang dilihat di bawah mikroskop dengan perbesaran 40X... 61
23 Perbandingan dengan mata telanjang koloniF. bulbigenumantara koleksi Laboratorium Mikrobiologi P3HKA dengan hasil isolasi dari daerah nekrosis pohonA. crassna(Darmaga) danA. microdarpa(Carita)... 62
xiv
1 Kadar ekstrak aseton batang A. crassna... 72 2 Rataan diameter pertumbuhan miseliaF. bulbigenumsetelah 10 hari
inkubasi pada media uji bioasai dan nilai AFA ekstrak aseton batang
A. crassna... 72 3 Analisis sidik ragam rataan nilai AFA ekstrak aseton batangA. crassna.... 72 4 Uji lanjutan Duncan rataan nilai AFA ekstrak aseton batang A. crassna... 73 5 Uji T-berpasangan untuk pertumbuhan miseliaF. bulbigenumpada media
dengan ekstrak aseton dari pohon 3 dan 5 terhadap pertumbuhan miselia pada media kontrol ... 73 6 Nilai rataan pertumbuhan miseliaF. bulbigenumpada media PDA yang
ditambahkan ekstrak etanol dahan A. crassnadan fraksinya ... 73 7 Rataan nilai AFA ekstrak etanol dahanA. crassnadan fraksinya ... 73 8 Analisis sidik ragam rataan nilai AFA ekstrak etanol dahanA. crassna
dan fraksinya ... 74 9 Uji lanjutan Duncan rataan nilai AFA ekstrak etanol dahanA. crassna
dan fraksinya ... 74 10 Analisis sidik ragam rataan nilai AFA fraksi etil asetat dari dahan
A. crassnapada kisaran konsentrasi yang diujikan ... 74 11 Uji lanjut Duncan rataan nilai AFA fraksi etil asetatA. crassnapada
kisaran konsentrasi yang diujikan ... 74 12 Kandungan total fenolik pohon-pohon contoh berdasarkan metode
Folin Ciocalteu; dan rataan infeksi pada batang pohon contoh di Carita dan Darmaga yang diinokulasi denganF. bulbigenumpada umur
inokulasi 6 bulan ... 75 13 Kondisi pohon contoh dan nilai keliling batang di dua lokasi penelitian .... 76 14 Senyawa-senyawa hasil analisis GCMS untuk ekstrak pohon contoh
pra-inokulasi yang pada tananam lain disebutkan dalam berbagai
tulisan berperan sebagai pertahanan ... 77 15 KondisirunningGCMS pyrolysis menggunakan GCMS Pyrolysis merk
Latar Belakang
Gaharu merupakan nama perdagangan dari produk kayu (incense) yang dihasilkan oleh beberapa spesies pohon penghasil gaharu. Dalam perdagangan internasional, produk ini dikenal sebagai agarwood, aloeswood, atau oudh. Gaharu ini sebenarnya merupakan endapan resin yang terakumulasi pada jaringan kayu sebagai reaksi pohon terhadap pelukaan ataupun infeksi patogen.
Variasi mutu gaharu terjadi selama proses pembentukan gaharu yang membutuhkan waktu panjang, dimana gaharu dengan mutu paling tinggi diperoleh pada akhir proses pembentukan ini (Sumadiwangsa dan Harbagung 2000). Gaharu berbentukincense, yang akan mengeluarkan bau harum hanya jika bahan ini dibakar (Anonim 1998). Namun begitu, bentuk perdagangan gaharu beragam, mulai dari bongkahan, cip, serbuk, dan minyak gaharu (Surata dan Widnyana 2001). Di Indonesia, komoditas berbentuk minyak biasanya diperoleh dari penyulingan atau ekstraksi cip gaharu dari kelas yang bermutu rendah. Nilai ekonomi gaharu yang utama terletak pada batangnya yang mengandung akumulasi damar wangi.
bagian lain dari pohon gaharu juga dapat digunakan sebagai bahan obat, seperti ekstrak daun Aquilaria sinensis yang memiliki efek laksatif untuk mengatasi keluhan konstipasi (Hara et al. 2008). Pada industri parfum di Eropa, gaharu merupakan salah satu bahan yang paling mahal. Asap maupun minyak gaharu digunakan oleh masyarakat Timur Tengah untuk mengharumkan tubuh dan ruangan. Wangi gaharu juga dimanfaatkan untuk sabun, sampo, dan aromaterapi.
Indonesia memiliki potensi sumberdaya pohon penghasil gaharu yang tinggi, namun yang paling banyak dicari oleh para pemburu gaharu adalah dari genus Aquilaria sp. dan Gyrinops sp. karena kualitas dan harga jualnya yang relatif lebih tinggi. Intens-nya perburuan gaharu dengan kapasitas pungut yang tidak terkendali telah mengakibatkan potensi kedua genus ini semakin menurun dan tercantum dalam daftar Appendix II CITES (Blanchette 2006; Sumarna 2005a; Sumarna 2005b; CITES 2004; Suhartono dan Mardiastuti 2002).
Gaharu sampai saat ini masih mengandalkan produksi dari sumberdaya di hutan alam yang semakin langka. Di habitatnya, tidak semua tanaman gaharu menghasilkan produk ini yang hanya akan terbentuk jika tanaman merespon pelukaan atau infeksi patogen. Mekanisme pembentukan gaharu belum begitu dipahami, dan mengapa pembentukannya tidak terjadi pada semua tanaman penghasil gaharu juga masih menjadi pertanyaan yang belum terjawab tuntas. Penelitian dan usaha budidaya serta produksi gaharu secara buatan yang telah sejak lama dilakukan, belum memberi hasil yang memuaskan untuk bisa menutupi kekurangan suplai dari produksi alam. Perkembangan yang baik dalam bidang gaharu ini diharapkan akan dapat meningkatkan pendapatan masyarakat, terutama yang berada di sekitar hutan, dan lebih jauh lagi diharapkan akan berpengaruh pada kelestarian sumber daya penghasil gaharu di alam.
Kerentanan pohon penghasil terhadap pembentukan gaharu dipengaruhi oleh berbagai faktor, seperti yang disebutkan oleh Agrios (1997) bahwa terjadinya penyakit pada tanaman ditentukan oleh faktor-faktor yaitu kondisi inang, patogen, kondisi lingkungan, dan peranan manusia. Respon pohon-pohon yang potensial menghasilkan gaharu terhadap serangan pengaruh luar tidak akan sebesar pohon-pohon yang resisten, misalnya saja pohon-pohon potensial tidak akan memiliki atau memproduksi senyawa pertahanan sebanyak pohon yang resisten. Pengetahuan mengenai fungsi metabolit sekunder, terutama yang berfungsi sebagai senyawa pertahanan pada pohon penghasil dalam pembentukan gaharu akan sangat berperan dalam keberhasilan produksi gaharu buatan, karena perlakuan yang diberikan pada pohon-pohon rentan tentunya akan lebih efektif dan efisien.
Identifikasi Masalah
Beberapa permasalahan dalam kaitannya dengan kondisi gaharu saat ini adalah:
1. Produksi gaharu sebagian besar masih tergantung pada sumberdaya di hutan alam, perburuan yang intens, semakin langkanya sumberdaya gaharu alam sehingga tercantum dalam Appendix II CITES.
2. Pembentukan gaharu tidak terjadi pada semua pohon penghasilnya dan tidak ada ciri-ciri visual yang menjamin secara pasti suatu pohon mengandung gaharu dengan kualitas dan kuantitas tertentu.
3. Mekanisme terbentuknya gaharu secara alami memerlukan suatu kondisi tertentu dan masih belum begitu dipahami, serta membutuhkan waktu yang cukup panjang.
4. Usaha domestikasi dan budidaya tanaman penghasil gaharu memang telah banyak berhasil dilakukan. Namun produksi gaharu secara buatan masih belum memuaskan dari segi kualitas dan kuantitas.
tinggi terhadap pembentukan gaharu, sehingga seleksi pohon yang akan diinokulasi lebih difokuskan pada pohon-pohon dengan kandungan fenolik relatif rendah (potensialsusceptible).
Tujuan
Berdasarkan permasalahan yang telah diidentifikasi, maka penelitian ini bertujuan untuk:
1. Mengetahui sifat anti jamur ekstrak batang Aquilaria crassna terhadap
Fusarium bulbigenumpada skala laboratorium.
2. Mengetahui sifat anti jamur ekstrak dahan A. crassna dan fraksinya terhadap
F. bulbigenumpada skala laboratorium.
3. Mengetahui kandungan total fenolik dan komposisi senyawa pada pohon penghasil gaharu (A. crassnadanA. microcarpa) sebelum inokulasi.
4. Mengetahui hubungan antara kandungan fenolik dengan kerentanan A. crassna danA. microcarpadalam pembentukan gaharu.
5. Mengetahui perubahan senyawa yang terjadi pada batang pohon penghasil dalam proses pembentukan gaharu artifisial.
6. Mengetahui perubahan mikrobiologis (jenis jamur) yang terjadi selama proses pembentukan gaharu artifisial.
Manfaat Penelitian
Dari penelitian ini diharapkan diperoleh manfaat-manfaat sebagai berikut: 1. Seleksi pohon potensial penghasil gaharu dapat dilakukan berdasarkan
kandungan kimiawi ekstraktif batang.
2. Pembentukan gaharu budidaya dapat lebih efektif dan efisien karena dilakukan pada pohon-pohon yang potensial.
4. Diperolehnya informasi mengenai perubahan senyawa kimia yang terjadi pada pohon selama terjadinya proses pembentukan gaharu, dimana informasi tersebut masih jarang ditemukan.
Hipotesis
Hipotesis yang diajukan dalam penelitian ini adalah sebagai berikut: 1. Ekstrak batangA. crassnamemiliki sifat anti jamur terhadap F. bulbigenum.
2. Setidaknya salah satu fraksi dari ekstrak dahan A. crassna memiliki sifat anti jamur terhadap F. bulbigenum.
3. Terdapat keterkaitan antara kandungan senyawa fenolik pada A. crassna dan
A. microcarpa dengan kerentanan pohon dalam pembentukan gaharu.
4. Terjadi perubahan kimiawi pada komponen kimia pohon A. crassna dan A. microcarpaselama proses pembentukan gaharu.
TINJAUAN PUSTAKA
Gaharu
Gaharu merupakan produk hasil hutan non kayu yang sangat berharga. Dalam SNI 01-5009.1-1999 (BSN 1999), gaharu didefinisikan sebagai sejenis kayu yang berasal dari pohon atau bagian pohon dalam berbagai bentuk dan warna yang khas dan memiliki kandungan damar wangi, sebagai akibat dari suatu proses infeksi yang terjadi secara alami maupun buatan pada beberapa jenis pohon penghasil gaharu.
Di tingkat internasional, harga gubal gaharu kualitas double super yang ditandai warna kehitaman dapat mencapai Rp 25 juta per kilogram (GSA 2005). Produk ini dihasilkan terutama oleh pohon-pohon dari genus Aquilaria, Aetoxylon, Enkleia, Phaleria, Wilkstroemia, dan Gyrinops, family Thymeleacea. GenusAquilaria dan Gyrinopssejak tahun 2004 telah masuk dalam Appendix II CITES karena sumber dayanya yang berkurang di alam (Blanchette 2006; CITES 2004; Sumarna 2005a; Suhartono dan Mardiastuti 2002; Barden et al. 2000). Departemen Kehutanan telah menetapkan kuota ekspor gaharu sebesar 130 ton/tahun dengan perincian 30 ton/tahun untuk gaharu dari bagian barat Indonesia (genus Aquilaria) dan 100 ton/tahun untuk gaharu dari Indonesia timur (genus
Aquilaria dan Gyrinops) (Direktorat Jenderal PHKA 2007), karena adanya kekhawatiran punahnya spesies penghasilnya di Indonesia.
Gaharu ini sebenarnya merupakan endapan resin yang terakumulasi pada jaringan kayu sebagai reaksi pohon terhadap pelukaan atau infeksi patogen. Kayu gaharu yang dijuluki ‘kayu para dewa’ ini telah diperdagangkan sejak ratusan tahun lalu. Di Indonesia, perdagangan gaharu pertama kali tercatat sejak abad ke-5 masehi, dimana China merupakan pembeli utama produk ini (Suhartono dan Mardiastuti 2002).
produk berbentuk serbuk biasanya berwarna coklat terang hingga coklat (BSN 1999; Suhartono dan Mardiastuti 2002).
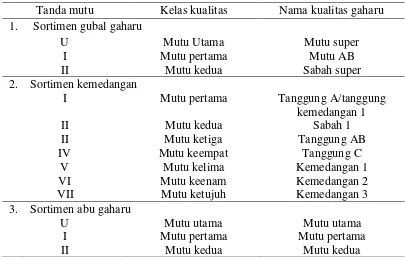
Pemerintah Indonesia membedakan kualitas gaharu ke dalam tiga belas kelas mutu yang dikelompokkan menjadi tiga sortimen (BSN 1999). Namun, dalam pasar lokal dan mungkin juga dalam perdagangan internasional, produk ini dibagi menjadi enam hingga delapan kelas kualitas tergantung daerahnya. Klasifikasi dibuat berdasarkan kandungan resin, meskipun tidak terdapat standar formal kandungan resin untuk setiap kelas (Suhartono dan Mardiatuti 2002).
Tabel 1 Klasifikasi kualitas gaharu
Tanda mutu Kelas kualitas Nama kualitas gaharu
1. Sortimen gubal gaharu U 3. Sortimen abu gaharu
U
Pegunungan Himalaya hingga di hutan hujan di Papua New Gunea, dan dapat tumbuh mulai dari ketinggian beberapa meter hingga 1.000 m dpl dengan pertumbuhan terbaik di sekitar 500 m dpl. Aquilariadapat tumbuh pada berbagai tipe tanah, bahkan pada tanah marjinal.
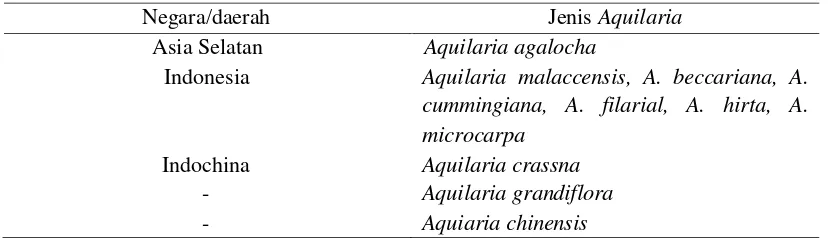
Tabel 2 Jenis-jenisAquilariayang menghasilkan gaharu
Negara/daerah JenisAquilaria
Asia Selatan Indonesia
Indochina
-Aquilaria agalocha
Aquilaria malaccensis, A. beccariana, A. cummingiana, A. filarial, A. hirta, A. microcarpa
Aquilaria crassna Aquilaria grandiflora Aquiaria chinensis
Sumber: Anonim (2002); Wiriadinata dan Sidiyasa dalam Suhartono dan Mardiastuti (2002)
Sumarna (2005b) menyebutkan Indonesia memiliki kekayaan 27 species penghasil gaharu dari 8 genus dan 3 famili, yang tersebar di di hutan dataran rendah dan tinggi di Sumatra, Kalimantan, Sulawesi, Maluku, Irian. Habitat tanaman ini biasanya tersebar di wilayah hutan primer dan sekunder 0 – 700 m dpl, dengan curah hujan 1.500-6.500 mm/tahun, suhu 22 – 34 °C, Rh : 70 – 80 %.
Aquilaria crassna
Aquilaria crassna memiliki klasifikasi dan nama ilmiah sebagai berikut (The IUCN Red List of Treatened Species 2007):
Divisio : Spermatophyta
Sub divisio : Angiospermae
Class : Dicotyledoneae
Ordo : Myrtales
Famili : Thymeleacea
Genus :Aquilaria
Species :Aquilaria crassna Pierre ex Lecomte
Penghasil gaharu ini dapat mencapai tinggi 15 – 20 m dan diameter 40 – 50 cm, dengan tajuk yang kecil dan batang yang lurus. Jenis ini dapat ditemukan di berbagai tipe hutan, hutan primer ataupun hutan sekunder, pada daerah dengan ketinggian 300 – 800 m dpl dan curah hujan 1.200 – 2.000 mm/ tahun. Tumbuhan ini tumbuh pada berbagai tipe tanah, tapi cenderung lebih baik pada tanah berbatu dengan lapisan tanahferraliticyang dangkal (Loc dan Luu 2007; Jensen 2007).
A. crassna mulai berbunga pada usia 6-8 tahun, antara bulan Maret dan April, dan berbuah antara bulan Mei – Juli. Jenis ini mengalami penyerbukan dengan bantuan serangga. Dengan sekitar 4.500 benih per kg dan tingkat perkecambahan mencapai 80-90%, maka seharusnya tidak terdapat masalah dalam pembudidayaan jenis ini. Pohon penghasil gaharu ini merupakan jenis yang membutuhkan naungan pada saat awal pertumbuhan tapi memerlukan cahaya matahari untuk pertumbuhan selanjutnya (Loc dan Luu 2007; Jensen 2007).
Aquilaria microcarpa
Aquilaria microcarpa merupakan tanaman dalam family Thymelaeaceae yang ditemukan di Indonesia dan Singapura. Seperti halnya spesies dalam genus
Klasifikasi dan nama ilmiah A. microcarpa adalah sebagai berikut (GRIN 2008):
Divisio : Spermatophyta
Sub divisio : Angiospermae
Class : Magnoliopsida
Ordo : Thymelaeales
Famili : Thymeleacea
Genus :Aquilaria
Species :Aquilaria microcarpaBaill
Kandungan Kimiawi Gaharu
Gubal gaharu sebenarnya adalah resin yang tidak dieksudasikan, melainkan terdeposit dalam jaringan kayu pada pohon. Deposit resin ini mengakibatkan kayu yang seratnya lepas dan berwarna putih berubah menjadi kompak padat berwarna hitam serta wangi. Resin ini termasuk golongan sesquiterpena yang mudah menguap (Ishiharaet al. 1991).
Sebagian besar komponen dalam gaharu teridentifikasi sebagai golongan sesquiterpenoid. Salah satu komponen wangi utama dari gaharu yang pertama diidentifikasi oleh Bhattacharyya dan Jain adalah agarol yang merupakan senyawa monohidroksi (Prema dan Bhattacharyya 1962).
Penelitian Nakanishi berhasil mengkarakterisasi jinkohol (2β-hydroxy
-(+)-prezizane) dari gaharu asal Indonesia melalui ekstraksi benzene. Tim ini juga menemukan dua sesquiterpena baru dari Aquilaria malaccensis asal Indonesia, yaitu jinkoh eremol dan jinkohol II yang disebut sebagai tipe B untuk membedakannya dengan tipe A dari A. agallocha, serta mengisolasi alpha-agarofuran dan (-)-10-epi-gamma-eudesmol, oxo-agarospirol sebagai konstituen utama pada gaharu tipe B (Burfield 2005a).
Dalam Burfield (2005a) disebutkan bahwa Yoneda telah berhasil mengidentifikasi sesquiterpena utama yang terdapat pada gaharu tipe A (padaA. agallocha) dan tipe B (padaA. malaccensis). Tipe A ditemukan mengandung β -agarofuran 0,6%, nor-ketoagarofuran 0,6%, agarospirol 4,7%, jinkoh-eremol
Sedangkan pada tipe B, teridentifikasi senyawa-senyawaα-agarofuran(-)-10-
epi-γ-eudesmol 6,2%, agarospirol 7,2%, jinkohol 5,2%, jinko-eremol 3,7%, kusunol
3,4%,jinkoholII 5,6%, dan oxo-agarospirol3,1%.
Gambar 1 Beberapa struktur kimia komponen gaharu.
Yagura et al (2003) menemukan turunan kromone baru, yaitu 5-hydroxy
-6-methoxy-2-(2-phenylethyl) chromone, 6-hydroxy-2-(2-hydroxy-2-phenylethyl)
chromone, 8-chloro-2-(2-phenylethyl)-5,6,7–trihydroxy-5,6,7,8- tetrahydro chromone, dan 6,7-dihydroxy-2-(2-phenylethyl)-5,6,7,8-tetrahydrochromone yang diisolasi dari ekstrak MeOH kayu buangan Aquilaria sinensis, disamping tujuh komponen gaharu lainnya yang telah dikenal.
Budidaya dan Pembentukan Gaharu
Sampai saat ini, gaharu masih dihasilkan dari populasi di hutan alam. Permintaan gaharu yang semakin tinggi telah menyebabkan eksploitasi yang berlebihan dan akhirnya memicu langkanya sumber daya penghasil gaharu di alam. Tercantumnya dua genus utama penghasil gaharu dalam Appendix II CITES (CITES 2004) menyebabkan ditetapkannya kuota bagi ekspor produk ini. Kuota ditetapkan Departemen Kehutanan pada tahun 2007 sebesar 130 ton/tahun (Direktorat Jenderal PHKA 2007).
Pemburu-pemburu gaharu menentukan suatu pohon mengandung akumulasi resin hanya berdasarkan pengalaman. Seringkali pohon yang telah ditebang ditinggalkan terbengkalai begitu saja karena ternyata sama sekali tidak mengandung apa yang dicari. Sampai saat ini tidak ada suatu ciri morfologi tertentu yang dengan sangat pasti menunjukan suatu pohon mengandung gaharu dalam kuantitas dan kualitas tertentu.
Beberapa penelitian budidaya dan produksi gaharu buatan telah dimulai sejak lama. Pemerintahan Indonesia melalui Departemen Kehutanan telah mewajibkan setiap eksportir gaharu membudidayakan pohon gaharu di lahan seluas minimal dua hektar. Di Indonesia tercatat terdapat 28 perusahaan di bidang gaharu ini (GSA 2005).
Budidaya tanaman penghasil gaharu telah banyak dilakukan, baik oleh perorangan, perusahaan swasta maupun lembaga penelitian dan pengembangan. Propagasi tanaman penghasil gaharu dapat dilakukan secara generatif (benih) maupun vegetatif (anakan alam, stumpatau cabutan, stek pucuk), dan dapat juga dikembangkan dalam kultur vegetatif (Sumarna 2005b). Budidaya ideal adalah pada kawasan dengan intensitas cahaya masuk sekitar 60 %, seperti pada hutan campuran, bekas tebangan, HTI daur panjang, Hutan Rakyat, atau dalam pola diversifikasi dengan kebun karet rakyat, kelapa sawit, dan lain-lain.
Konservasi ex-situsumber genetik A. malaccensis danA. microcarpa telah dilakukan pada tiga lokasi masing-masing di Pekanbaru (50 m dpl), Bogor (200 m dpl) dan Tondano (600 m dpl) dengan menanam 1.000 bibit yang berasal dari klon-klon teridentifikasi hasil mikropropagasi. Hasil percobaan seleksi 80 pohon dengan menggunakan inokulum tunggal F menunjukkan bahwa 33% pohon A. malaccensis(8 dari 24 pohon) dan 24% pohon A. microcarpa(13 dari 54 pohon) berpotensi menghasilkan gaharu (Umboh 2006).
melukai pohon dengan cara-cara tertentu dan memberi perlakuan untuk memicu respon pertahanan alami pohon. Penggunaan teknik ini akan mendukung dihasilkannya resin secara berkelanjutan dari pohon budidaya (Blanchette 2006).
Baik pada habitat alaminya di hutan tropis maupun di hutan tanaman/ budidaya, tidak semua pohon mengandung gaharu dan mekanisme pembentukan alaminya terjadi sangat lambat. Ciri-ciri visual pada pohon seperti bentuk tajuk yang tidak sehat, daun merana dan menguning, batang dan kulit mengering atau patah, tidak menjamin kandungan yang dimiliki pohon tersebut secara pasti. Di habitat alami, diperkirakan hanya satu dari sepuluh pohon dewasa dengan diameter di atas 20 cm yang menghasilkan gaharu (Giano diacu dalam Bardenet al. 2000). Disebutkan juga bahwa pohon dengan dbh di atas 20 cm yang mengandung gaharu diperkirakan menghasilkan sekitar 1 kg gaharu per pohon.
Sadgopal (Barden et al. 2000), memperkirakan hasil gaharu yang terbaik diperoleh pada pohon berumur 50 tahun atau lebih. Penelitian terbaru yang dilakukan oleh The Rain Forest Project (TRP) di Vietnam menunjukkan pembentukan gaharu dapat terjadi pada pohon budidaya berumur 3 tahun, yang telah dikonfirmasi berdasarkan analisis kimia (Bardenet al. 2000).
Mekanisme pembentukan gaharu masih menjadi pertanyaan yang belum terjawab tuntas. Interaksi ekologis antara pohon inang, pelukaan dan/atau jamur dalam pembentukan gaharu masih belum dipahami. Faktor-faktor lain seperti umur pohon, perbedaan antar pohon, pengaruh musim, variasi lingkungan, dan variasi genetik juga berperan penting dalam pembentukan gaharu. Tiga hipotesis disebutkan sebagai penyebab terbentuknya gaharu, yaitu hasil dari patologis, pelukaan yang diikuti patologis, dan proses nonpatologis. Namun begitu, penelitian yang dilakukan masih belum memberi cukup bukti untuk mendukung hipotesis tersebut (Ng et al diacu dalam Bardenet al. 2000).
Patogenesis pada tumbuhan adalah pertarungan antara inang dengan patogen yang kompatibel, yang menurut Agrios (1997) keberhasilan proses infeksi oleh suatu patogen sehingga dapat menginduksi gaharu di pengaruhi oleh:
1. Inang yang rentan, yaitu jenis pohon gaharu.
3. Lingkungan yang mendukung.
4. Peranan manusia memodifikasi lingkungan, patogen dan pohon inang. Beberapa ahli lain berpendapat pelukaan dan perlakuan mekanis pada pohon merupakan pemicu terbentuknya gaharu, yang kemudian diikuti aktivitas mikroba (Van Beek diacu dalam Barden et al. 2000; Pojanagaroon dan Kaewrak 2006), sementara yang lain berpendapat asosiasi mikroorganisme yang menstimulasi pohon merespon dengan senyawa pertahanan (Prema dan Bhattacharyya 1962; Burfield 2005a; Sumarna 2005b).
Tabel 3 Cendawan yang berasosiasi dengan pohon gaharu
Peneliti yang mengisolasi Jenis cendawan
Bose (1939)
Battcaharrya (1952)
Guangdong Institut of Botany (1976)
Jalaluddin (1977)
Subanseneeet al.(1985)
Parmanet al.(1996); Santoso (1996); Rahayuet al.(1998)
Hawksworthet al.(1976); Gibson (1977)
Tamuliet al.(1999) Tamuliet al.(2000)
Cendawan imperfekti
Epicoccum granulatum Melanotus flavolinus
Cytosphaera mangiferae, Penicillium, Aspergillus, Fusarium
Cercosporella, Chaetomium, Cladosporium, Curvularua, Diplodia, Pestalotia, popularia, Phialogeniculata, Pithomyces, Rhizopus, Spiculostillella, Trichoderma
Diplodiasp., Phytiumsp., Fusarium solani, F. lateritium, F. bulbigenum, Populariasp., Rhinocladiellasp., Rhizoctoniasp., Acremonium, Libertella, Scytalidium, Thielaviopsis, Trichoderma
Philophora parasitica
Fusariumsp.,Penicilliumsp.,Epicoccumsp.
Fusarium oxysporum, Chaetum globosum Disarikan dari Isnaini (2004) dan Burfield (2005b)
Pojanagaroon dan Kaewrak (2006) menstimulasi pembentukan gaharu pada
Zat Ekstraktif Kayu
Metabolit sekunder dalam pohon meliputi berbagai senyawa, seperti flavanoid, terpena, fenol, alkaloid, sterol, lilin, lemak, tanin, gula, gum, suberin, asam resin, dan karotenoid. Komponen ini bukan merupakan bagian struktural kayu seperti polisakarida atau lignin. Kandungan metabolit sekunder sangat bervariasi antar jaringan, antar pohon dalam spesies yang sama, antar spesies, dan antar musim ke musim. Jenis-jenis tropis dan sub-tropis umumnya mengandung jumlah ekstraktif yang lebih banyak dibanding jenis-jenis di daerah temperet. Konsentrasi metabolit ini bervariasi antar spesies, antar jaringan (konsentrasi tertinggi berada di kulit, kayu teras, akar, pangkal percabangan, dan jaringan luka), antar pohon dalam spesies yang sama, dan antar musim (Forestry Commission GIFNFC 2007).
Produksi dan akumulasi berbagai senyawa organik merupakan mekanisme utama pertahanan tanaman terhadap herbivora, serangan mikroba penyakit, dan hama. Senyawa-senyawa tersebut merupakan hasil metabolisme sekunder tanaman. Di samping berperan sebagai senyawa pertahanan tanaman, metabolit sekunder atau zat ekstraktif ini juga merupakan sinyal kimiawi untuk menarik binatang dalam membantu penyerbukan dan penyebaran benih. Misalnya, antosianin dan monoterpena jika berada di daun berperan sebagai insektisida dan antimikrobial, namun pada bunga berperan sebagai atraktan serangga untuk membantu penyerbukan (Forestry Commission GIFNFC 2007).
Metabolit sekunder pada kayu dapat disebut sebagai zat ekstraktif. Zat ekstraktif didefinisikan sebagai senyawa-senyawa yang dapat diekstrak dari kayu atau kulit kayu dengan pelarut polar dan non polar (Hills 1987). Zat ekstraktif yang terdiri dari bermacam-macam bahan ini memiliki fungsi yang penting dalam daya tahan terhadap serangan jamur dan serangga, memberi bau, rasa dan warna pada kayu.
berbagai habitat (Hills 1987). Rowell (1984) menyatakan bahwa diantara fungsi zat ekstraktif adalah sebagai bagian dari mekanisme sistem pertahanan pohon terhadap serangan mikroorganisme.
Metabolit sekunder tanaman efektif dalam melawan hama dan agen penyakit karena analog dengan komponen vital tertentu dari sistem sinyal seluler, atau dapat terlibat dengan enzim vital dan memblokir jalur metabolisme. Metabolit sekunder tanaman telah dimanfaatkan manusia sejak ribuan tahun lalu, misalnya saja untuk penyamak (indigo, sikonin), pemberi rasa (vanilin, kapsaicin), pewangi (minyak esensial), stimulan (kafein, nikotin), halusinogen (morfin, tetrahidrokanabinol), racun (strikniin), dan obat-obatan (kuinin, atropin) (Forestry Commission GIFNFC 2007).
Achmadi (1989) menggelompokkan zat ekstraktif menjadi dua yaitu fraksi lipofilik dan fraksi hidrofilik. Fraksi lipofilik adalah lemak, lilin, terpena, terpenoid dan alkohol alifatik tinggi, sedangkan yang termasuk fraksi hidrofilik adalah senyawa fenolik (tanin, lignan dan stilbena), karbohidrat terlarut, protein, vitamin, dan garam anorganik.
Sjostrom (1995) menyatakan bahwa secara kimiawi ekstraktif kayu dapat digolongkan menjadi tiga bagian, yaitu komponen alifatik, terpena dan terpenoid, serta senyawa fenolik. Komponen-komponen alifatik merupakan kelompok lemak dan lilin. Termasuk dalam kelompok ini adalah berbagai macam senyawa alifatik yang terdapat dalam resin seperti n-alkana, alkohol lemak, asam lemak, lemak (ester gliserol), lilin (ester dari alkohol), dan suberin. Kelompok alkana bersifat lipofilik dan mantap. Asam lemak umumnya terdapat sebagai ester dan merupakan komponen utama resin parenkim di dalam kayu daun jarum maupun daun lebar. Ester dan alkohol lain biasanya berupa alkohol alifatik atau terpenoid alami, yang dikenal sebagai lilin.
Terpena dalam kelompok kedua merupakan hasil kondensasi dari dua atau beberapa unit isoprena (C5H8) yang menghasilkan dimer dan oligomer yang lebih
tinggi. Rumus umum terpena adalah (C5H8)n. Menurut jumlah unit isoprena (n),
fungsi seperti hidroksil, karbonil, karboksil atau ester. Contoh dari terpenoid adalah poliprenol. Ekstraktif kayu daun jarum mengandung semua jenis terpena, dari monoterpena sampai tri dan tetraterpena, kecuali seskuiterpena yang tergolong sangat langka. Sesquiterpenoid merupakan kandungan senyawa yang teridentifikasi pada gaharu. Terpena yang paling penting adalah α-pinena dan limonena yang terdapat pada semua kayu daun jarum. Beberapa monoterpena merupakan unsur pokok oleoresin dari beberapa kayu tropika.
Fenolik dan Senyawa Pertahanan Tanaman
Kelompok ketiga dalam penggolongan ekstraktif kayu oleh Sjostrom (1995) adalah senyawa fenolik. Golongan ini sangat heterogen, penggolongannya dapat dibuat menjadi lima kelas, yaitu:
1. Stilbena (turunan-turunan dari 1,2-difeniletilena), yang mempunyai ikatan ganda terkonjugasi sehingga komponen-komponennya bersifat sangat reaktif, contohnya adalah pinosilvin.
2. Lignan, yaitu pengabungan oksidatif dua unit fenilpropana (C6C3),
contohnya konidendrin, pinoresinol, hidroksimatai-resinol, dan asam plikatat.
3. Tanin terhidrolisis: produk hidrolisisnya adalah asam galat dan elagat serta gula, biasanya glukosa merupakan produk utama
4. Flavanoid, memiliki kerangka karbon trisiklik C6C3C6, misalnya saja
krisin dan taksifolin (dihidrokuersetin).
5. Tanin terkondensasi, merupakan polimer-polimer flavanoid, contohnya adalah katekin.
kelompok dasar, fenol sederhana dan polifenol. Fenol sederhana meliputi kelompok asam fenolat atau fenol dengan grup karboksil. Sedangkan polifenol mengandung sedikitnya dua cincin fenol.
Sejumlah senyawa aktif telah didefinisikan sebagai senyawa anti jamur. Eusiderin, sejenis neo lignan dari kayu ulin (Eusideroxylon zwageri) (Syafiiet al.
1985) dan angolensin yang diekstrak dari kayuPterocarpus indicusbersifat racun terhadap jamur Coriolus versicolor dan Tyromyces polutris (Pilotti et al. 1995). Ohashi et al. (1994) melaporkan bahwa 3 jenis komponen bioaktif yaitu 8-asetoksielemol, 8-hidroksielemol dan hinociic acid yang diisolasi dari daun kayu
Juniperus chineensis var pyramidalis terbukti dapat menghambat pertumbuhan beberapa jenis jamur, dan dari kayu Cunninghamia lanceolata berhasil diidentifikasi senyawa cedrol yang bersifat anti jamur (Shieh dan Sumimoto 1992). Forestry Commission GIFNFC (2007) menyatakan bahwa lignan yang merupakan produk penggabungan oksidatif dari polifenol dengan ikatanβ-β pada sisi rantai, menunjukkan aktivitas biologis sebagai penghalang pertumbuhan jamur, racun ikan, danantifeedanserangga.
Meskipun fenolik terkondensasi terdapat dalam jumlah sedikit di dalam kayu teras, kulit dan xilem, namun fenolik ini mempunyai fungsi sebagai fungisida dan secara efektif melindungi kayu dari serangan organisme perusak kayu. Fenolik seperti tanin terkondensasi dengan berat molekul tinggi atau substansi-terikat dinding sel, secara in vitro menunjukan sifat anti jamur terhadap beberapa penyakit tertentu (Sjostrom 1995). Namun, ekstrak kasar metanol pohon norway spruce (yang diharapkan mengandung setidaknya stilbena, flavanoid, dan konjugasi fenol sederhana) memperlihatkan sedikit sekali sifat anti jamur dalam percobaan in vitro. Kemungkinan situasi in vitro berbeda, karena pada kondisi in vivo terdapat enzim aktif maupun faktor lain (Schmidtet al.2007).
tertentu. Ekspresi gen ini misalnya perbaikan atau penguatan struktur pertahanan dinding sel, biosintesis atau penambahan senyawa antimikrobial (fitoaleksin), enzim, atau protein terkait-pertahanan.
Gaharu merupakan senyawa fitoaleksin dari pohon gaharu sebagai mekanisme pertahanannya terhadap infeksi patogen. Kayu beresin ini merupakan metabolit sekunder yang dibentuk tanaman sebagai respon terhadap infeksi patogen. Pohon gaharu sehat tidak pernah memproduksi sesquiterpenoid sebagai metabolit sekunder yang beraroma harum dari pohon tersebut (Yuan diacu dalam Isnaini 2004). Tanaman dapat mensintesis dan mengakumulasi metabolit sekunder sebagai respon terhadap infeksi oleh agen tertentu, rangsangan fisiologi, maupun keadaan cekaman (Goodmanet al.diacu dalam Isnaini 2004).
Fungsi metabolit sekunder dalam sistem pertahanan tanaman, baik Fitoantisipin maupun fitoaleksin, memainkan peranan penting (Verpoorte et al.
2000). Fitoantisipin adalah senyawa aktif antimikrobial yang telah terdapat pada tanaman dan kadangkala terpicu pengaktifannya saat pelukaan. Sedangkan Fitoaleksin adalah senyawa aktif antimikrobial yang diproduksi secara de novo
setelah pelukaan atau infeksi. Biosintesis keduanya terpicu pada level gen. (Verpoorteet al.2000; Vidhyasekaran 2000).
Senyawa fenol dan sesequiterpena termasuk dalam kelompok metabolit sekunder dalam tanaman. Senyawa fenol telah diketahui bersifat racun dan merupakan substansi antibakterial (Vidyasekaran 2000). Daya racun fenol beragam pada jenis fenol yang berbeda dan daya racunnya terhadap germinasi spora, pertumbuhan miselia, dan produksi enzim juga bervariasi. Penelitian yang dilakukan Le Tourneau et al. menunjukkan daya racun fenol tergantung pada strukturnya (Vidhyasekaran 2000).
varietas bawang yang resisten, atau konsentrasi catechinyang tinggi pada anakan kapas yang resisten terhadapRhizoctonia solani. Namun, pada berbagai interaksi dengan penyakit, bukan preformed fenolik tetapi fenol yang disintesis setelah infeksi yang seringnya berkaitan dengan resistensi penyakit. Dan meskipun senyawa fenol telah diketahui merupakan substansi beracun dalam tanaman, namun dalam beberapa kasus senyawa ini mungkin saja tidak terlibat dalam resistensi penyakit, contohnya tidak adanya perbedaan signifikan antara kandungan fenol yang diamati pada tanaman gandum sehat dan yang diinokulasi patogen (Vidhyasekaran 2000).
Metabolit sekunder tanaman yang diturunkan dari terpenoid memiliki berbagai fungsi dalam tanaman, diantaranya sebagai minyak esensial (monoterpenoid); atraktan serangga; fitoaleksin (sesqui-, di-, dan triterpena) sebagai agen antimikrobial. Berdasarkan berbagai fungsi tersebut, ekspresi dari jalur biosintesis yang terlibat akan berbeda. Terdapat jalur biosintesis yang terpicu pada level gen setelah pelukaan atau infeksi, dan ada yang terjadi pada level senyawa dimana senyawa yang telah ada secara enzimatis dirubah menjadi senyawa aktif ketika pelukaan. Sebagai contoh, biosintesis sesquiterpena tertentu pada Solanaceae terpicu oleh infeksi mikroba, sedangkan pada tanaman lain biosintesis sesquiterpenoid merupakan ekspresi pembentukan yang umum, misalnya saja pada Morinda citrifolia, anthraquinonebiasa ditemukan di seluruh bagian tanaman (Verpoorte 2000).
Analisis senyawa Fenolik
Kebanyakan senyawa fenol (terutama flavanoid) dapat dideteksi pada kromatogram berdasarkan warnanya atau flourensinya dibawah lampu UV, warnanya diperkuat bila diuapi amonia. Pigmen senyawa fenol berwarna dan dapat dilihat sehingga mudah diamati selama proses isolasi dan pemurnian (Harborne 1987).
menit, larutan kemudian didinginkan dan disaring sebelum diekstraksi. Hidrolisis basa dengan NaOH 2M pada suhu kamar selama 4 jam dalam lingkungan nitrogen, dan sebelum diekstraksi harus diasamkan dulu. Fenol yang terbebaskan dari kedua cara ini diekstraksi dengan eter dan ekstrak eter ini dicuci, dikeringkan, dan diuapkan sampai kering. Sisa penguapan dilarutkan dalam eter, kemudian dikromatografi pada silika gel dengan pengembang asam asetat-kloroform dan etil asetat-benzena. Fenol menyerap di daerah UV pendek dan dapat dideteksi pada pelat silika gel yang mengandung indikator flouresensi gelombang 253 nm, terlihat sebagai bercak gelap dengan latar belakang berflouresensi. Bila digunakan pereaksi Folin-Ciocalteau, fenol yang berinti katekol (chatecol) atau hidrokuinon terlihat sebagai bercak biru. Fenol lainnya terlihat sebagai bercak biru sampai kelabu bila pelat diuapi amonia. Pereaksi vanilin-HCl (1 g vanilin dalam 10 ml HCl pekat) dan vanilin-H2SO4pekat (2:1) dengan turunan resorsinol
dan fluoroglusinol menghasilkan warna merah muda (Harborne 1987).
Brignolas et al. (1998) mengamati fenolik sebagai penduga keresistenan pohon norway spruce (Piceaabies) terhadap kumbang dan jamur. Strip kulit kayu berukuran 100 x 10 mm diambil dari area lubang inokulasi dan area steril, pada 6 dan 12 hari sejak inokulasi dilakukan. Sampel strip dari area steril juga diambil pada saat inokulasi dilakukan. Setelah sampel dihaluskan, dilakukan ekstraksi dua tahap pada suhu 40C. Pertama, ekstraksi menggunakan pelarut pentana untuk menghilangkan komponen resin, dan selanjutnya mengekstrak fenolik terlarut dengan metil alkohol 80%. Komposisi ekstrak monofenol dilakukan dengan
reverse-phase HPLC, menggunakan kolom silika C-18. Fase bergerak menggunakan campuran acetonitril dan asam asetat-air (1/99, v/v). Hasil yang diperoleh diekspresikan dalam vanilil alkohol ekuivalen per gram floem kering.
Asam-asam fenolik ditentukan berdasarkan absorbsi maksimal dan dibandingkan dengan senyawa referensi otentik.
Metode analisis fenolik menggunakan HPLC dilakukan oleh Nyman dan Julkunen-Tiitto (2000) pada sampel dari pohon willow. Sampel jaringan ditimbang 1,3 – 30,6 mg dan ditempatkan dalam tabung eppendorf, kemudian dihancurkan dengan batang gelas, lalu ditambahkan 0,45 ml metanol murni. Setelah homogenisasi, larutan ini disimpan dalam es selama 15 menit, kemudian dihomogenisasi kembali, dan selanjutnya disentrifus (3 menit, 16.000 rpm). Supernatan yang terbentuk diambil, residunya diekstrak kembali menggunakan 0,45 ml metanol (2 menit dalam es). Supernatan yang dihasilkan kemudian di evaporasi dibawah aliran nitrogen. Ekstrak selanjutnya dilarutkan kembali dalam 1 ml metanol, 0,5 ml larutan yang terbentuk digunakan untuk HPLC. Sampel yang digunakan untuk HPLC dievaporasi dengan nitrogen cair dan disimpan pada 220C. Sebelum HPLC, sampel yang disimpan tadi dilarutkan lagi dalam 0,4 ml metanol-H2O (1:1). HPLC kemudian di-run.
Metode pendugaan total fenolik dalam akar kelapa yang diinokulasi dengan
Pseudomonas flourescens, Trichoderma viridedanT. harziannumyang dilakukan oleh Karthikeyan et al. (2006) menggunakan metode Folin-Ciocalteau. 1 g sampel akar dihomogenisasi dalam 10 ml metanol 80% (v/v), kemudian diagitasi atau diputar selama 15’ pada suhu 700C. Ekstrak metanol ini diambil 1 ml dan ditambahkan 5 ml air detilasi dan 250 µl reagent Folin-Ciocalteau (1 N), larutan ini selanjutnya dsimpan pada suhu 250C. Absorban warna biru yang muncul diukur pada 725 nm. katekol digunakan sebagai standar, dan jumlah fenolik diekspresikan sebagai µg katekol/mg berat segar sampel.
Fusariumspp.
Jamur Fusarium spp. merupakan jamur penyebab penyakit pada banyak tanaman. Klasifikasi dan nama ilmiah jamur ini adalah (Doctorfungus 2007): Kingdom : Fungi
Filum : Ascomycota
Ordo : Hypocreales
Famili : Hypocreaceae
Fusarium adalah jamur saprofitik berfilamen yang tersebar luas pada tanaman dan tanah. Genus Fusarium terdiri dari lebih 20 spesies, yang paling umum adalah F. solani, F. oxysporum, dan F. chlamydosporum. Fusarium
berbeda dari Acremonium, Lecythophora, dan Phialemonium karena memiliki makrokonidia, dan berbeda juga dari Cylindrocarpon karena makrokonidianya memiliki sel kaki dan ujung yang meruncing (Doctorfungus 2007).
Fusarium spp. tumbuh dengan cepat di sabouraud dextrose agar (SDA) pada suhu 25°C dan menghasilkan penyebaran koloni seperti wol atau kapas yang datar. Satu-satunya spesies yang lambat tumbuh adalahF. dimerum. Dari depan, koloni bisa berwarna putih, krem, tan, salmon, cinamon, kuning, merah, violet, merah muda, ataupun, ungu. Dari bagian belakang, koloni ini bisa tidak berwarna, atau tan, merah, ungu gelap, dan coklat. Sclerotium adalah massa hifa yang tetap dorman pada kondisi yang tidak kondusif, yang dapat diamati secara makroskopis dan berwarna biru tua. Sedangkan sporodochium, lembar berbentuk bantal dari hifa yang mendukung konidiospora di permukaannya, biasanya tidak muncul pada kultur, namun ketika muncul dia berwarna krem, tan, atau oranye, kecuali untukF. solaniyang berwarna biru kehijauan (Doctorfungus 2007).
Pengamatan mikroskopis menunjukan hifa hyaline septate, konidiospora, fialides, makrokonidia, dan mikrokonidia. Sebagai tambahan untuk elemen-elemen dasar tadi, F. chlamydosporum, F. napiforme, F. oxysporum, F. semitectum, F. solani, and F. sporotrichoides menghasilkan klamidospora. fialides berbentuk silender, soliter atau sebagai komponen sistem percabangan yang komplek. Makrokonidia (3-8 x 11-70 µm) dibentuk dari fialides pada konidiospora yang bercabang ataupun yang tidak, terdiri dari 2 atau lebih sel berdinding tebal; halus; dan berbentuk silender. Sebaliknya, mikrokonidia (2-4 x4-8 µm), merupakan konidiospora sederhana yang panjang ataupun pendek, terdiri dari 1 sel (kadang 2 atau 3 sel), halus, berbentuk ovoid hingga silindris, tersusun dalam bentuk bola (kadang berbentuk rantai), dan berdinding tipis (Doctorfungus 2007).
Fusarium yang cenderung bermutasi dengan cepat, sehingga menyulitkan dalam mengidentifikasinya. Bentuk spesifik dari makrokonidia yang langsing berbentuk seperti pisang atau bulan sabit merupakan karakteristik identifikasi yang utama. Beberapa spesies dapat dibedakan dari sekuen mikrokonidia, dan beberapa yang lain dari keragaman pola klamidospora (Cullison 2008).
Ykema dan Stutz (1991) mengisolasiFusariumsp. dari bagian akar tanaman guayule yang nekrosis. Sampel nekrosis ditempatkan pada bagian mulut toples yang telah dilapis oleh cheesecloth, kemudian dicuci dengan air mengalir selama 10 menit. Bagian akar selanjutnya dicuci dengan air destilasi, dan disterilisasi permukaannya dengan sodium hipoklorida 1% selama 30 detik, dikeringkan, dan dicuci lagi dengan air destilasi steril. Untuk menginduksi pertumbuhan miselial, potongan akar kemudian ditempatkan pada agar-air di petri disk yang diinkubasi pada suhu kamar. Isolat spora tunggal dipindahkan ke V8juice agar danpotatoe dextrose agar(PDA) dan diidentifikasi jenisnya.
Ykema Stutz (1991) juga mengevaluasi patogenisitas Fusarium sp. pada anakan guayule. Anakan berumur 2 minggu dipindahkan ke cangkir styrofoam
yang berisi UC-soilless medium yang telah dipastuerisasi, kemudian disimpan di rumah kaca dan disiram selama 8 hari. Fusariumspp. ditumbuhkan di V8 juice-agar dibawah lampu flourescent pada suhu 250C selama 1 minggu. Suspensi yang mengandung mikro- dan makrokonidia disiapkan, konidia dihitung dengan
Lokasi dan Waktu Penelitian
Penelitian dilaksanakan di Hutan Penelitian Carita dan di plot tanaman gaharu Darmaga, Jawa Barat, Bagian Kimia Departemen Hasil Hutan Fakultas Kehutanan IPB, dan Pusat Penelitian dan Pengembangan Hutan dan Konservasi Alam Badan Litbang Kehutanan, Departemen Kehutanan. Kegiatan penelitian berlangsung dari bulan Oktober 2007 hingga bulan Mei 2008.
Sifat Anti Jamur Ekstrak BatangAquilaria crassna
TerhadapFusarium bulbigenum
Alat dan Bahan
Peralatan yang digunakan dalam tahap ini adalah gergaji, hammer mill,
mesh screen berukuran 40 – 60 mesh, stoples, spatula, erlenmeyer, cawan petri,
vacuum evaporator, laminar flow,neraca, dan oven.
Bahan yang digunakan adalah pelarut aseton dan air destilata, serta bahan lain seperti aluminium foil, kertas saring Whatman, media PDA dan media bioasai, serta isolat Fusarium bulbigenum asal Gorontalo. Karena dalam penelitian ini belum dimungkinkan untuk dilakukan penebangan pohon untuk memperoleh serbuk kayu dari bagian kayu teras sejumlah yang dibutuhkan untuk kegiatan fraksinasi, maka bahan serbuk kayu diambil dari masing-masing bagian batang di sekitar titik inokulasi berukuran ± 3 x 3 cm2dari pohon-pohon contohA. crassnadi plot Darmaga.
Ekstrasi Serbuk Bagian BatangA. crassna
Bagian penelitian ini dilakukan dalam Rancangan Acak Lengkap dengan 3 ulangan. Perlakuan adalah 10 individu pohon contohA. crassna(B1, B2, B3,…, B10). Serbuk kayu diperoleh dari strip bagian batang yang diambil dari masing-masing pohon tersebut. Karena jumlah serbuk yang diperoleh terbatas, maka untuk bagian batang ini tidak dilakukan fraksinasi bertingkat.
Bagian batang yang dikumpulkan dari pohon contoh digiling dengan
screen berukuran 40-60 mesh. Berat kering tanur serbuk didapatkan dengan menimbang serbuk yang dioven pada suhu 105 ± 30C.
BKT = B0
(ka/100) +1
Dimana: BKT = berat kering tanur serbuk (g); BO = berat awal serbuk; ka = kadar air serbuk (%).
Ekstraksi bagian batang A.crassna dilakukan dengan merendam serbuk berukuran 40 – 60 mesh sebanyak ± 10 g dalam aseton pada suhu kamar. Campuran ini diaduk sesering mungkin, dan setelah 15-20 menit campuran disaring untuk memperoleh ekstrak aseton. Kegiatan perendaman dalam aseton dan penyaringan dilakukan berulang kali hingga ekstrak yang diperoleh dari campuran telah jernih yang berarti seluruh ekstrak aseton dari serbuk kayu telah diperoleh. Kadar ekstraktif dari masing-masing pohon diperoleh dalam berat ekstrak per berat kering tanur serbuk (%, w/w). Berat ekstrak yang diperoleh diketahui dengan mengambil 10 ml larutan ekstrak aseton yang sebelumnya telah dievaporasi sehingga menjadi 100 ml. 10 ml larutan ini ditimbang, kemudian dioven 103 ± 20C selama 24 jam, sehingga diperoleh berat kering tanurnya.
KE = BKTe X (100 ml/10 ml) BKTs
Dimana: KE = kadar ekstrak aseton (%, w/w); BKTe = berat kering tanur ekstrak (g); BKTs = berat kering tanur serbuk (g).
Uji Bioasai Ekstrak Bagian Batang TerhadapF. bulbigenum
Ekstrak aseton (ekstrak B1, B2, B3,.., B10) yang diperoleh selanjutnya di-bioasai terhadap F. bulbigenum yang diisolasi dari pohon penghasil gaharu asal Gorontalo. F. bulbigenum dibiakkan lebih dulu dalam media potatoes dextrose agar (PDA) selama tujuh hari. Media pengujian bioasai adalah campuran diamonium tartrat 0,5 g/l, kalium dihidrogen fosfat (KH2PO4) 1 g/l, magnesium
sulfat terhidrat (Mg2SO4.7H2O) 0,5 g/l, maltosa (C12H22O11+H2O) 5 g/l, tepung
agar 20 g/l, glukosa (C6H12O6) 20 g/l, solution de calnieltra 1 ml/l. tepung agar
berbentuk kristal dalam larutan tersebut. Larutan ini kemudian dimasukkan ke labu berisi tepung agar dan diaduk, untuk selanjutnya di-autoclave pada kondisi 1210C tekanan 1 atm selama 20 menit. Sebanyak 10 ml larutan media ini ditempatkan dalam cawan petri percobaan dan ditambahkan 1 ml larutan ekstrak dari masing-masing pohon. Selanjutnya biakan F. bulbigenum yang telah disiapkan sebelumnya dipotong dengan loop inokulasi berdiameter 4 mm dan ditanamkan di tengah media bioasai dalam petri percobaan. Kemudian dilakukan inkubasi selama 10 hari pada suhu ruangan (27 ± 20C). Seluruh kegiatan bioasai berlangsung dalam kondisi aseptik.
Percobaan ini dilakukan dalam desain rancangan acak lengkap (RAL). Individu pohon asal ekstrak aseton merupakan perlakuan, yaitu: K0, B1, B2, B3, B4, B5, B6, B7, B8, B9, dan B10, dimana K0 adalah kontrol; B1 sampai dengan B10 adalah media dengan masing-masing penambahan 1 ml ekstrak pohon 1 sampai dengan pohon 10. Percobaan dilakukan dalam 3 (tiga) ulangan.
Setelah 10 hari atau akhir waktu inkubasi, dilakukan pengukuran terhadap pertumbuhan miselia jamur (mm). Formula Mori et al.(1997) digunakan untuk mengukur aktivitas anti jamur atauantifungal activity(AFA), sebagai berikut:
AFA(%) = GC – GT X 100% GC-A
Dimana: AFA =anti fungal activity (%); GC = growth of control (mm); GT =
growth of treatment(mm); A = ukuran miselia di awal inkubasi (mm)
Berdasarkan nilai AFA, aktivitas setiap fraksi ekstrak diklasifikasikan ke dalam kategori seperti tercantum pada Tabel 4.
Tabel 4 Klasifikasi tingkat aktivitas anti jamur ekstrak
Antifungal activity(AFA) Tingkat aktivitas AFA≥75%
75%≤AFA < 50% 50%≤AFA < 25% 25%≤AFA < 0
0
Sangat kuat (++++) kuat (+++) sedang (++)
lemah (+) tidak aktif (-)
Data yang diperoleh diolah menggunakan analisis sidik ragam dan jika terdapat pengaruh yang nyata dilakukan uji lanjutan Duncan (Steel dan Torrie 1993; Matjik dan Sumertajaya 2002).
Sifat Anti Jamur Ekstrak DahanAquilaria crassnadan Fraksinya TerhadapFusarium bulbigenum
Alat dan Bahan
Peralatan yang digunakan dalam tahap ini adalah gergaji, hammer mill,
mesh screen berukuran 40 – 60 mesh, stoples, spatula, erlenmeyer, cawan petri,
vacuum evaporator, laminar flow, funnel separator, neraca, dan oven.
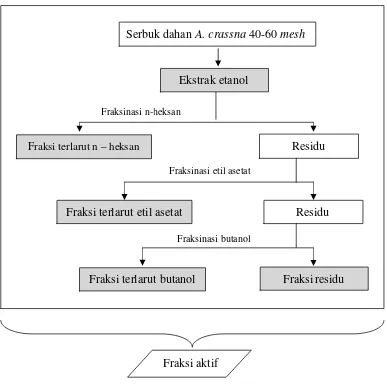
Dalam tahap ini digunakan bahan-bahan sebagai berikut: serbuk dari dahan pohon A. crassna, pelarut etanol, n-heksan, eteil asetat, butanol dan air destilata, serta bahan lain seperti aluminium foil, kertas saring Whatman, media PDA, serta isolat F. bulbigenum asal Gorontalo. Bahan serbuk diperoleh dari bagian dahan pohonA. crassna yang dikumpulkan untuk memperoleh serbuk sebanyak 2.000 g.
Ekstraksi Serbuk Dahan A. crassna
Dahan yang dikumpulkan dari pohon contoh digiling dengan hammer mill, serbuk yang diperoleh kemudian disaring menggunakan mesh screen berukuran 40-60 mesh. Berat kering tanur serbuk didapatkan dengan menimbang serbuk yang dioven pada suhu 105 ± 30C.
Ekstraksi serbuk kayu dahanA.crassna dilakukan dengan metode Wuet al.
(2005) yang dimodifikasi. Serbuk sebanyak 2.000 g direndam dalam etanol 70% pada suhu kamar. Campuran ini diaduk sesering mungkin. Setelah 48 jam campuran ini disaring dengan kertas saring untuk memperoleh ektrak kasar yang kemudian dipekatkan dengan rotary evaporator pada suhu ± 400C hingga diperoleh volume 1 liter, kemudian ekstrak ditimbang.
Ekstrak kasar (ekstrak etanol) tersebut kemudian secara suksesif difraksinasi berturut-turut menggunakan pelarut n-heksan (n-C6H14), etil asetat (EtOAc), dan
Gambar 2 Skema ektraksi bertingkat serbuk dahanA. crassna.
Untuk mendapatkan ekstrak n-heksan, 500 ml dari ekstrak etanol diambil dan dievaporasi hingga diperoleh volume sebanyak 100 ml. Larutan ekstrak etanol kental ini selanjutnya dimasukkan ke dalam funnel separator, kemudian ditambahkan air destilata sebanyak 20 ml dan pelarut n-heksan sebanyak 75 ml. Campuran ini dikocok dan dibiarkan sampai terjadi pemisahan antara pelarut etanol dengan n-heksan, selanjutnya fraksi terlarut n-heksan dipisahkan dari residu. Fraksi n-heksan yang diperoleh disimpan ke dalam botol yang tertutup rapat. Kegiatan ini diulang sampai larutan yang diperoleh jernih yang berarti seluruh ekstrak dari fraksi n-heksan telah terlarut.
Residu hasil fraksinasi dengan n-heksan yang tertinggal dalam funnel separator kemudian ditambahkan dengan pelarut etil asetat sebanyak 75 ml. Selanjutnya dikocok dan dibiarkan sampai terjadi pemisahan seperti halnya
Ekstraksi etanol 3 x 1 L
Fraksi aktif
Serbuk dahanA. crassna40-60mesh
Ekstrak etanol
Fraksi terlarut n – heksan Residu
Fraksi terlarut etil asetat Residu
Fraksi terlarut butanol Fraksi residu
Fraksinasi n-heksan
Fraksinasi etil asetat
fraksinasi dengan n-heksan. Setelah terjadi pemisahan, fraksi terlarut etil asetat dipisahkan dan disimpan pada botol yang tertutup rapat. Fraksinasi ini juga dilakukan hingga ekstrak yang diperoleh telah jernih.
Fraksi terlarut butanol diperoleh dengan menambahkan 75 ml butanol pada residu fraksi etil asetat yang tersisa difunnel separator. Setelah pengocokan dan terjadi pemisahan, fraksi terlarut butanol dan fraksi residu dipisahkan kemudian disimpan. Fraksinasi ini diulang hingga ekstrak yang diperoleh telah jernih.
Uji Bioasai TerhadapF. bulbigenum
Lima fraksi dari dahanA. crassnadiuji bioasai terhadapF. bulbigenumyang diisolasi dari pohon penghasil gaharu asal Gorontalo, yaitu ekstrak etanol, fraksi n-heksan, fraksi etil asetat, fraksi butanol dan fraksi residu. F. bulbigenum
disiapkan lebih dulu dengan dibiakkan dalam media potatoes dextrose agar
(PDA) selama tujuh hari. Sebanyak 4 ml media (PDA) dimasukkan ke dalam cawan petri percobaan dan ditambahkan masing-masing fraksi ekstrak. Setiap fraksi ekstrak dibuat dalam konsentrasi 0%, 1%, 2%, 3%, 4%, dan 5% (w/w, berat ekstrak/berat media agar). Campuran dalam petri disk ini kemudian di-autoclave
pada suhu 120oC dan tekanan 1 atm selama 10 menit. Selanjutnya biakan F. bulbigenum yang telah disiapkan sebelumnya dipotong dengan loop inokulasi berdiameter 4 mm dan ditanamkan di tengah media dalam petri percobaan. Kemudian dilakukan inkubasi selama 10 hari pada suhu ruangan (27 ± 20C).
Percobaan ini dilakukan dalam desain rancangan acak lengkap (RAL) untuk setiap fraksi. Konsentrasi ekstrak fenolik dari setiap fraksi merupakan perlakuan, yaitu: K0, K1, K2, K3, K4, dan K5. Percobaan dilakukan dalam tiga ulangan.
Setelah 10 hari atau akhir waktu inkubasi, dilakukan pengukuran terhadap pertumbuhan miselia jamur (mm). Formula Mori et al.(1997) digunakan untuk mengukur aktivitas anti jamur atauantifungal activity(AFA), sama seperti halnya dengan bioasai ekstrak dari bagian batang.
Dari hasil bioasai ini diperoleh fraksi yang paling aktif dalam menghambat pertumbuhan F. bulbigenum. Hasil yang diperoleh dari bioasai ini digunakan sebagai dasar untuk menduga hubungan kandungan fenolik dengan kerentanan pohon dalam pembentukan gaharu. Fraksi yang paling aktif dalam mengatasiF. bulbigenum, diduga sebagai fraksi yang mengandung komponen yang berpengaruh dalam keresistenan pohon dalam pembentukan gaharu.
Hubungan Ekstraktif Pohon
Dengan Infeksi OlehFusarium bulbigenum
Alat dan Bahan
Peralatan yang digunakan adalah instrumen GCMS Pirolisis, bor tangan, alat injeksi, kertas kalkir, planimeter, kertas saring whatman, kantong plastik, dan kertas label. Sedangkan bahan yang diperlukan adalah 10 pohon A. crassnadan 20 pohon A. microcarpa, isolat cair F. bulbigenum yang diisolasi dari pohon gaharu di Gorontalo.
Pohon Contoh
Pohon contoh adalah pohon penghasil gaharu, 10 pohonA. crassnadari plot Darmaga dan 20 pohon A. mirocarpa dari Hutan Penelitian Carita yang merupakan tegakan budidaya. Pemilihan pohon contoh dilakukan secara acak. Pohon-pohon contoh ini menjadi sumber sampel, baik untuk bioasai ekstraktif terhadap F. bulbigenum, pendugaan hubungan kandungan fenolik dengan kerentanan pohon, maupun untuk kegiatan inokulasi dan analisis mikrobiologi. Dari pohon contoh ini didokumentasikan kondisi pohon: kondisi daun, kondisi batang dan kulit batang (mengelupas atau tidak), serta kondisi fisik lainnya yang diperlukan (ada atau tidaknya dahan/ranting yang patah, dan lain-lain).
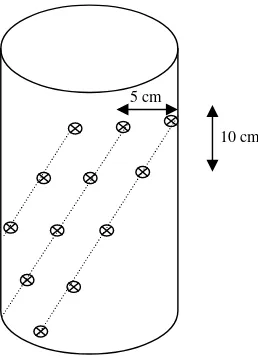
Pengambilan Contoh Pra-Inokulasi
disayat-sayat hingga
hammer mill untuk m dianalisis senyawa fen
Gambar 3 Pola p
Analisis kandungan Analisis yang d fenolik mengggunakan dari A. microcarpa
berbentuk serbuk beru ml aseton 70%. Cam disentrifus pada 3.500 disaring untuk dianali
Larutan disiapk ciocalteau 1 N sebany Na2CO3 20% sebanya
digunakan untuk
spectrophotometer pa ppm terhadap asam digunakan ini merupak
ga berukuran kecil, dikeringanginkan dan d mendapatkan serbuk kayu yang selanjutnya fenoliknya.
Dimo difikasi dari The Rain Forest Project
la pengambilan sampel uji dan pola spiral untuk
n Fenolik Pra-Inokulasi
g dilakukan pertama sekali adalah analisis ko kan metode Folin-Ciocalteau. Terdapat 30 uni
a dan 10 dari A. crassna). Masing-masing erukuran 40 – 60meshini diambil 1 g dan diek ampuran ini di-vortex setelah didiamkan sejen
00 rpm selama 10 menit. Hasil larutan ekstrak alisa.
pkan sebanyak 50 ml, kemudian ditambahkan nyak 0,5 ml, dikocok, dilanjutkan dengan pena nyak 2,5 ml. Larutan ini didiamkan selama 15 determinasi konsentrasi total fenolik pada λ 725 nm. Konsentrasi total fenolik din m tanat sebagai standar yang digunakan. pakan modifikasi dari Asami et al.(2003).
digiling dengan diekstrak untuk
tuk inokulasi.