BAB 2
TINJAUAN PUSTAKA
2.1 Diabetes Mellitus
2.1.1. Definisi dan klasifikasi
Diabetes melitus merupakan suatu kelompok penyakit metabolik
yang ditandai dengan hiperglikemia akibat defek pada sekresi insulin oleh
sel beta pankreas, resistensi insulin di hati dan di jaringan perifer, atau
keduanya. 1,2,3,15,16,17,18 Hiperglikemia kronik pada diabetes berkaitan
dengan kerusakan jangka panjang, disfungsi atau kegagalan beberapa
organ tubuh, terutama mata, ginjal, saraf, jantung dan pembuluh darah.
Tabel 2.1. Klasifikasi Etiologi Diabetes Melitus.
3,15
Klasifikasi Etiologi Diabetes Melitus
6
i. Diabetes tipe 1 (destruksi sel beta, biasanya menyebabkan defisiensi
insulin absolut)
a. Diperantarai mekanisme imunologis
b. Idiopatik
ii. Diabetes tipe 2 (mulai dari predominan resistensi insulin dengan
defisiensi insulin relatif atau predominan defek pada sekresi insulin
dengan resistensi insulin.
iii. Diabetes tipe lain
a. Defek genetik dari fungsi sel beta yang ditandai dari adanya
mutasi:
b. Defek genetik pada kerja insulin
c. Penyakit pada kelenjar eksokrin pankreas
d. Endokrinopati
e. Diinduksi oleh obat-obatan ataupun bahan kimia
f. Infeksi
obat
h. Sindroma genetik lain yang terkadang berkaitan dengan
diabetes
iv. Diabetes gestasional
Sumber : Powers AC. Diabetes mellitus. Dalam : Longo DL, Kasper DL,
Jameson JL, Fauci AS, Hauser SL, Loscalzo J. Ed. Harrison’s principles
of internal medicine. The McGraw-Hill Companies, United States. 2012 ;
344, p 2968-3003.
2.1.2. Epidemiologi1, 15
Berbagai penelitian epidemiologi menunjukkan adanya
kecenderungan peningkatan angka insidensi dan prevalensi DM tipe2 di
berbagai penjuru dunia. WHO memprediksi adanya peningkatan jumlah
penyandang diabetes yang cukup besar pada tahun-tahun mendatang.
WHO memprediksi kenaikan jumlah penyandang DM di Indonesia dari 8,4
juta pada tahun 2000 menjadi sekitar 21,3 juta pada tahun 2030. Senada
dengan WHO, International Diabetes Federation (IDF) pada tahun 2009, memprediksi kenaikan jumlah penyandang DM dari 7,0 juta pada tahun
2009 menjadi 12,0 juta pada tahun 2030. Meskipun terdapat perbedaan
angka prevalensi, laporan keduanya menunjukkan adanya peningkatan
jumlah penyandang DM sebanyak 2-3 kali lipat pada tahun 2030. Laporan
dari hasil penilitian di berbagai daerah di Indonesia yang dilakukan pada
dekade 1980-an menunjukkan sebaran prevalensi DM tipe2 antara 0,8%
di Tanah Toraja, sampai 6,1%. yang didapatkan di Manado. Hasil
prevalensi yang sangat tajam. Sebagai contoh,pada penelitian di Jakarta
(daerah urban), prevalensi DM dari 1,7% pada tahun 1982 naik menjadi
5,7% pada tahun 1993 dan meroket lagi menjadi 12,8% pada tahun 2001.
Berdasarkan data Badan Pusat Statistik Indonesia tahun 2003,
diperkirakan penduduk Indonesia yang berusia di atas 20 tahun sebanyak
133 juta jiwa. Dengan prevalensi DM sebesar 14,7% pada daerah urban
dan 7,2%, pada daerah rural, maka diperkirakan pada tahun 2003
terdapat sejumlah 8,2 juta penyandang diabetes di daerah urban dan 5,5
juta di daerah rural. Selanjutnya, berdasarkan pola pertambahan
penduduk, diperkirakan pada tahun 2030 nanti akan ada 194 juta
penduduk yang berusia di atas 20 tahun dan dengan asumsi prevalensi
DM pada urban (14,7%) dan rural (7,2%) maka diperkirakan terdapat 12
juta penyandang diabetes di daerah urban dan 8,1 juta di daerah rural.
Laporan hasil Riset Kesehatan Dasar (Riskesdas) tahun 2007 oleh
Departemen Kesehatan, menunjukkan bahwa prevalensi DM di daerah
urban Indonesia untuk usia diatas 15 tahun sebesar 5,7%. Prevalensi
terkecil terdapat di Propinsi Papua sebesar 1,7%, dan terbesar di Propinsi
Maluku Utara dan Kalimanatan Barat yang mencapai 11,1%. Sedangkan
prevalensi toleransi glukosa terganggu (TGT), berkisar antara 4,0% di
2.1.3. Diagnosis
Diagnosis DM ditegakkan atas dasar pemeriksaan kadar glukosa
darah. Diagnosis tidak dapat ditegakkan atas dasar adanya glukosuria.
Guna penentuan diagnosis DM, pemeriksaan glukosa darah yang
dianjurkan adalah pemeriksaan glukosa secara enzimatik dengan bahan
darah plasma vena. 19 Sampel darah vena dan kapiler memberikan hasil
kadar gula darah yang sama pada keadaan puasa namun pada keadaan
tidak puasa, hasil pemeriksaan gula darah kapiler memberikan hasil yang
lebih tinggi dibandingkan darah vena.20 Pemeriksaan gula darah harus
segera dilakukan beberapa menit setelah sampel diambil. Jika tidak bisa
dilakukan sedemikian, maka diperlukan inhibitor glikolitik, yaitu NaF dan
ditempatkan dalam air es. Pemisahan plasma harus segera dilakukan
dalam 30 menit.20
Berbagai keluhan dapat ditemukan pada penyandang diabetes.
Kecurigaan adanya DM perlu dipikirkan apabila terdapat keluhan klasik
DM seperti di bawah ini:1
• Keluhan klasik DM berupa: poliuria, polidipsia, polifagia, dan
penurunan berat badan yang tidak dapat dijelaskan sebabnya
• Keluhan lain dapat berupa: lemah badan, kesemutan, gatal,
mata kabur, dan disfungsi ereksi pada pria, serta pruritus vulvae
Tabel 2.2 Kriteria Diagnosis DM19
Pemeriksaan glukosa plasma puasa > 126 mg/dl. Puasa adalah kondisi
tidak ada asupan kalori minimal 8 jam
Atau
Pemeriksaan glukosa plasma > 200 mg/dl 2 jam setelah Tes Toleransi
Glukosa Oral (TTOG) dengan beban 75 gram dalam 250 cc air.
Atau
Pemeriksaan glukosa plasma sewaktu > 200 mg/dl dengan keluhan klasik
Atau
Pemeriksaan HbA1c > 6.5%
Catatan: Harus hati-hati dalam membuat interpretasi terhadap hasil
pemeriksaan HbA1c. Pada kondisi tertentu seperti : anemia,
hemoglobinopati, riwayat transfusi darah 2-3 bulan terakhir,
kondisi-kondisi yang mempengaruhi umur eritrosit dan gangguan fungsi ginjal
maka HbA1c tidak dapat dipakai sebagai alat diagnosis maupun evaluasi.
19
Hasil pemeriksaan yang tidak memenuhi kriteria normal atau
kriteria DM digolongkan ke dalam kelompok prediabetes yang meliputi :
toleransi glukosa terganggu (TGT) dan glukosa darah puasa terganggu
(GDPT). 19
• Glukosa Darah Puasa Terganggu (GDPT) : hasil pemeriksaan
glukosa plasma puasa antara 100-125 mg/dl dan pemeriksaan
• Toleransi Glukosa Terganggu (TGT) : Hasil pemeriksaan glukosa
plasma 2 jam setelah TTGO antara 140 – 199 mg/dl dan glukosa
plasma < 100 mg/dl
• Bersama-sama didapatkan GDPT dan TGT
• Diagnosis prediabetes dapat juga ditegakkan berdasarkan hasil
pemeriksaan HbA1c yang menunjukkan angka 5,7 – 6,4 %.19
Tabel 2.3. Kadar Tes Laboratorium Darah Untuk Diagnosis Diabetes dan
Prediabetes
HbA1c (%) Glukosa Darah
Puasa (mg/dl)
Glukosa Plasma
2 Jam setelah
TTGO ( mg/dl)
Diabetes >6.5 > 126 mg/dl > 200 mg/dl
Prediabetes 5,6 – 6,4 100 – 125 140 – 199
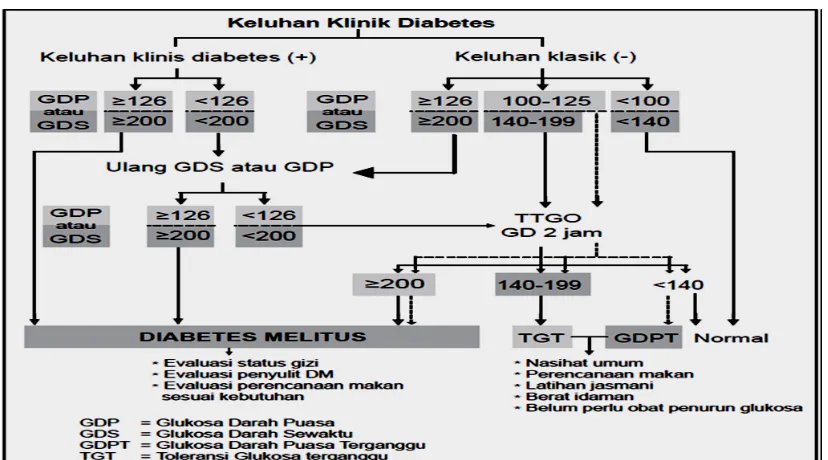
Secara umum, alur diagnosis DM dan gangguan toleransi glukosa
dapat dilihat pada gambar 2.1.
Gambar 2.1. Langkah-langkah diagnostik DM dan
gangguan toleransi glukosa.
Sumber: konsensus pengendalian dan pencegahan diabetes mellitus
tipe2 di Indonesia (PERKENI, 2011.) 1
2.1.4. Patofisiologi DM
Pada DM tipe 2, gangguan metabolisme glukosa disebabkan oleh
dua faktor utama yakni tidak adekuatnya sekresi insulin (defisiensi insulin)
dan kurang sensitifnya jaringan tubuh terhadap insulin (resistensi insulin),
disertai faktor lingkungan.19, 20,21
Gangguan metabolisme glukosa yang terjadi, diawali oleh kelainan
pada dinamika sekresi insulin yang tidak sesuai kebutuhan. Defisiensi
keseimbangan glukosa darah. Yang pertama terjadi adalah hiperglikemia
akut paska puasa, yakni peningkatan kadar glukosa darah segera (10-30
menit) setelah diberi beban glukosa. 19, 20,21
Secara klinis, perjalanan penyakit ini bersifat progresif dan
cenderung melibatkan gangguan metabolime lemak ataupun protein.
Peningkatan kadar glukosa darah oleh utilisasi yang tidak berlangsung
sempurna pada gilirannya secara klinis sering memunculkan abormalitas
lipid darah. Untuk mendapatkan kadar glukosa normal dalam darah, maka
sel beta akan semakin terangsang untuk meningkatkan eksresi insulin. 19,
20,21
Pada tahap awal belum akan menimbulkan gangguan. Pada tahap
dekompensasi, dapat terdeteksi keadaan yang dinamakan toleransi
glukosa terganggu atau prediabetic state. 19, 20,21
Resistensi insulin mulai menonjol peranannya semenjak perubahan
atau konversi toleransi glukosa terganggu menjadi DM tipe 2. Pada saat
tersebut faktor resistensi insulin mulai dominan sebagai penyebab
hiperglikemia maupun berbagai kerusakan jaringan. Kerusakan yang
terjadi terutama mikrovaskular, sedangkan kerusakan makrovaskular telah
muncul semenjak prediabetes. Semakin tinggi tingkat resistensi insulin
dapat terlihat pula dari peningkatan kadar glukosa darah puasa maupun
post prandial. 19, 20,21
Belakangan diketahui bahwa kegagalan sel beta terjadi lebih dini
dan sel beta, organ lain seperti jaringan lemak, gastrointestinal, sel alpha
pankreas, ginjal, dan otak, kesemuanya ikut berperan dalam menimbulkan
terjadinya gangguan toleransi glukosa pada DM tipe 2. 19, 20,21
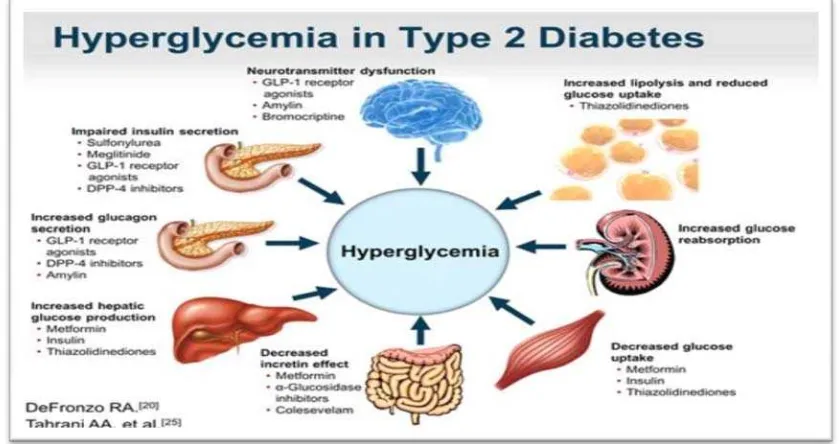
De Fronzo pada tahun 2009 menyampaikan, bahwa tidak hanya
otot, liver dan sel beta pankreas saja yang berperan sentral dalam
patogenesis penderita DM tipe 2 tetapi terdapat organ lain yang berperan
yang disebutnya sebagai the omonius octet (gambar 2.2).22
Gambar 2.2. The ominous octet, delapan organ yang berperan dalam
2.1.5. Penatalaksanaan dan evaluasi DM
Tujuan penatalaksanaan secara umum adalah meningkatkan
kualitas hidup penyandang diabetes. Tujuan jangka pendek:
menghilangkan keluhan dan tanda DM, mempertahankan rasa nyaman,
dan mencapai target pengendalian glukosa darah. Jangka panjang:
mencegah dan menghambat progresivitas penyulit mikroangiopati,
makroangiopati, dan neuropati. Tujuan akhir pengelolaan adalah turunnya
morbiditas dan mortalitas DM. Untuk mencapai tujuan tersebut perlu
dilakukan pengendalian glukosa darah, tekanan darah, berat badan, dan
profil lipid, melalui pengelolaan pasien secara holistik dengan
mengajarkan perawatan mandiri dan perubahan perilaku.1, 3,15
Monitoring pengobatan DM adalah dengan melakukan beberapa
pemeriksaan, diantaranya :21, 9
2.1.5.1 Pemeriksaan glukosa darah
Tujuan : mengetahui apakah sasaran terapi telah tercapai dan
mengetahui penyesuaian dosis obat bila sasaran belum tercapai.
2.1.5.2 Pemeriksaan HbA1c
2.1.5.2.1 Struktur
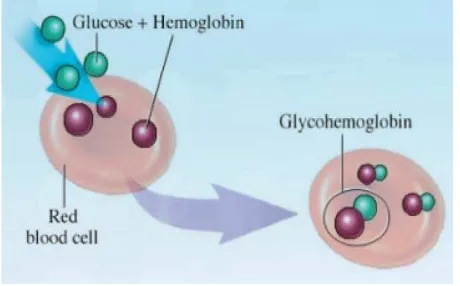
Hemoglobin (Hb) terdiri dari dua pasang rantai globin yang
masinng-masing mengikat heme. Total hemoglobin terdiri dari 97% HbA
dan HbA1c merupakan bentuk yang irreversible saat glukosa berikatan
dengan hemoglobin.23 Hemoglobin glikosilat atau HbA1 terdiri dari 3 fraksi
terpenting dan terbanyak yaitu 4-5% dari hemoglobin total.24 HbA1c inilah
yang merupakan ikatan antara glukosa dengan hemoglobin sedangkan
fraksi yang lain merupakan ikatan antara hemoglobin dengan heksosa
yang lain.25
Gambar 2.3. Glycated Hemoglobin26
Pada 60 tahunan yang lalu, Allen mendapatkan bahwa HbA terdiri
tiga komponen minor : HbA1a, HbA1b dan HbA1C atau A1c. Jumlah 1c
mengambarkan Hb yang terdeteksi dengan kromatografi. A1c merupakan
produk glikasi dari hemgloglobin rantai beta pada residu terminal valin.23,27
Pengikatan ini terjadi dalam 2 tahap. Pada tahap pertama terjadi ikatan
kovalen aldimin berupa basa Schiff yang bersifat labil. Tahap kedua terjadi
penyusunan kembali secara Amadori menjadi bentuk ketamin yang
stabil.25,28
Dari percobaan diketahui bahwa bentuk labil sudah naik dalam
jangka waktu 2 jam setelah pemberian 100 gram glukosa per oral. Apabila
kadar glukosa kembali ke rentang normal maka ikatan labil ini akan terurai
kembali. Bentuk stabil akan meningkat bila kadar glukosa melampaui
diperhitungkan bahwa kira-kira 28% dari HbA1c yang stabil mencerminkan
keadaan kadar glukosa darah selama 2 minggu terakhir, kira-kira 50% dan
86% mencerminkan keadaan 1 dan 2 bulan yang baru lewat.25
2.1.5.2.2. Sejarah HbA1c
HbA1c pertama kali dipisahkan oleh Huisman dan Meyring pada
tahun 1958 dan diidentifikasi sebagai glikoprotein oleh Bockhin dan gallop
pada tahun 1968. Namun HbA1c dikenali sebagai hemoglobin yang tidak
biasa pada pasien diabetes ilmuwan Irak “Samuel Rahbar” pada tahun
1969 yang menetapkan kejadian diabetes berhubungan dengan kenaikan
kadar HbA1c.23
2.1.5.2.3. Kegunaan HbA1c
Kegunaan HbA1c sebagai kontrol kadar gula darah pada pasien
diabetes pertama kali diajukan oleh Cerami dan Koening pada tahun
1976. Setelah beberapa kali kajian klinis pada tahun 1980-an, HbA1c
menjadi indeks yang lebih baik pada percobaan pengendalian diabetes.
Perubahan penting terjadi pada tahun 1970-an dan 1980-an, dimana
disarankannya dua metode untuk kontrol gula darah, yaitu :
self-monitoring of blood glucose (SMBG) dan pemeriksaan HbA1c. SMBG berperan dalam kontrol gula darah dalam jangka pendek sedangkan
HbA1c untuk jangka panjang.23Setelah pengolahan dan penelitian oleh
Prospective Diabetes Study), HbA1c menjadi bagian untuk monitoring
kontrol glikemik pada DM.24 ADA merekomendasikan kadar HbA1c < 7%
menjadi target pengendalian kadar gula darah.24 Mengenai penggunaan
uji ini secara rutin berbagai pedoman yang dikeluarkan oleh WHO, ADA,
EASD (European Association For The Study of Diabetes), dan IDF (
International Diabetes Federation) menganjurkan untuk memeriksanya
setiap 3 bulan dan sekurangnya 2x dalam setahun pada pemantauan
penderita diabetes mellitus.24,25
Kadar HbA1c mempunyai korelasi yang baik dengan kadar glukosa
darah rata-rata baik puasa, harian maupun puncaknya selama 12 minggu
yang telah lewat; tidak ada perbedaan antara yang tergantung insulin dan
yang tidak tergantung insulin, juga tidak dipengaruhi perbedaan jenis
kelamin. Berdasarkan penelitian A1c-AG interim, dibuktikan bahwa kadar
HbA1c berkorelasi kuat dengan kadar glukosa rerata sehingga
memungkinkan pasien diabetes mengetahui rerata kadar glukosa
darahnya selama 3 bulan sebelumnya.25
Banyak studi epidemiologis dan klinis yang berskala luas dengan
banyak pasien dan mengikutsertakan banyak pusat penelitian telah
membuktikan manfaat menggunakan pengukuran kadar HbA1c dalam
penatalaksanaan pasien diabetes mellitus. Penelitian Diabetes and
Complications Trial (DCCT) dan Epidemiology of Diabetes Interventions and Complications (EDIC) pada penderita diabetes tipe 1 dan juga
(UKPDS) pada penderita diabetes mellitus tipe 2, yang membuktikan
bahwa pengukuran kadar HbA1C disertai dengan pemantauan kadar
glukosa darah mandiri oleh pasien, mununjukkan turunnya kadari HbA1c
juga menurunkan penyulit baik makrovaskular maupun mikrovaskular
secara bermakna. Tiap peningkatan kadar HbA1c 1% , akan
meningkatkan resiko infark miokard sebanyak 14% dan kematian sebesar
28%.25
2.1.5.2.4. Keunggulan dan Keterbatasan Pemeriksaan HbA1c
Keunggulan dari HbA1c adalah lebih menyenangkan bagi pasien
karena tidak perlu puasa, kestabilan pra-analitik yang lebih tinggi dan
kurangnya fluktuasi. Sedangkan keterbatasan HbA1c untuk penapisan
adalah bias metode, keadaan medis tertentu seperti anemia,
hemoglobinopati, hipertrigliserida, konsumsi vitamin E dan C, dan
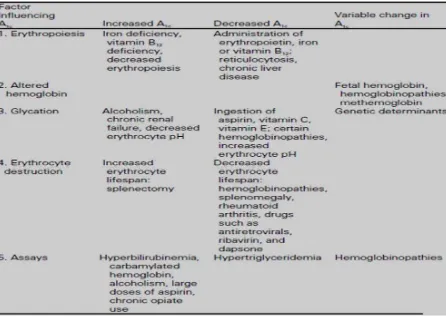
sebagainya.25,29 Berikut adalah tabel mengenai faktor-faktor yang
Tabel 2.4. Faktor-faktor yang mempengaruhi HbA1c28
2.1.5.2.5. Pre Analitik Pemeriksaan HbA1c
Sampel darah dapat diambil melalui vena pungsi atau melalui
kapiler (fingerprick capillary sampling). Tabung darah yang digunakan
harus berisi antikoagulan sebagaimana manufaktur dari metode
pemeriksan Hba1c. Kestabilan sampel tergantung dari metode yang
dipakai. Secara umum, whole blood dapat stabil sampai 7 hari pada suhu 2-8°C. Untuk penyimpanan yang lebih lama, sampel disimpan pada suhu
2.1.5.2.5. Analitik Pemeriksaan HbA1c
Sampai saat ini analisis HbA1c masih belum seragam sehingga
menyulitkan penafsiran terutama bila pasien diperiksa di laboratorium
yang berbeda dengan metode analisa yang berbeda. Pengukuran kadar
hemoglobin glikat mulai diperkenalkan pada tahun 1970-an. Semula
dinamakan henoglobin glikosilat tetapi kemudian diperbaiki menjadi
hemoglobin glikat. Saat itu yang diukur kebanyakan adalah HbA1 total.
Kelemahannya adalah ikut terukurnya HbA1c bentuk labil sehingga
dipengaruhi oleh makan dan karenanya disyaratkan pengambilan sampel
darah dalam keadaan puasa. Kemudian bahwa penambahan larutan
dapar borat dapat memecah kembali bentuk labil tersebut sehingga yang
diukur hanya bentuk stabil yang bermakna untuk mengetahui status
glikemik pasien. Karena itu setelah sekitar tahun 1986 semuat kit sudah
menggunakan dapar borat dan dapat mengukur HbA1c bentuk stabil serta
tidak perlu puasa pada pengambilan sampel darah. 29
Berdasarkan suatu penelitian di Amerika Serikat tahun 1994 oleh
Weykamp CW dkk pada 108 laboratorium, terdapat 21 metode yang
dikelompokkan dalam 5 kelompok metode pemeriksaan HbGlikat (GHb),
yaitu metode Affinity chromatographic (Pierce test, Modified Pierce Test, Isolab Test, Helena Test, Abbot Vision Test, Abbot Imx1 Test, Abbot Imx, Glib Test), Metode High-performance Liquid Chromatography (HPLC) (Bio-Rad Diamat Test, Bio-Rad Modular Test, Bio Rad Coloumn,
Atmospheric pressure ion-exchange chromatography with disposable
coloumns (Bio-Rad HbA1c test as disposable ion-exchange coloumns),
metode elektroforesis (Beckman Test, Corning Test, Sebia Test) dan
metode imunokimiawi (Bayer DCA 2000 tes, Boehringer Hemoglobin
A1’Tina-quant test, DAKO Novoclone Test)
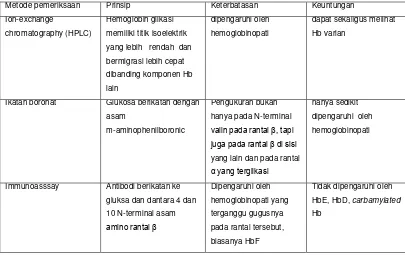
Tabel 2.5. Metode Pemeriksaan HbA1c. 29
Metode pemeriksaan Prinsip Keterbatasan Keuntungan
Ion-exchange
Ikatan boronat Glukosa berikatan dengan
asam
m-aminophenilboronic
Pengukuran bukan
hanya pada N-terminal
valin pada rantai β, tapi juga pada rantai β di sisi
yang lain dan pada rantai
α yang terglikasi
hanya sedikit
dipengaruhi oleh
hemoglobinopati
Immunoasssay Antibodi berikatan ke
gluksa dan dantara 4 dan
10 N-terminal asam
2.1.5.2.7. Standardisasi dan Harmonisasi
Mengenai pentingnya kalibrasi telah ditunjukkan oleh Weykamp
CW dkk. Pada tahun 1994 telah dilakukan suatu penelitian terhadap
pengukuran kadar hemoglobin glikat (Gb) oleh 108 laboratorium, yang
menggunakan 21 metode berbeda berdasarkan 5 prinsip berbeda.
Sebagai juri diambil 9 laboratorium yang memeriksa HbA1c menggunakan
Kalibrasi 3 tingkat kadar telah memperbaiki variasi intralaboratorium
dengan rerata dari 6,6% menjadi 3,5%. Untuk sampel dengan kadar
hemoglobin glikat rendah (5,5%) dan tinggi (14,1%) maka kalibrasi telah
menurunkan variasi antar laboratorium masing-masing (dari 10% menjadi
4% dan 6% menjadi 3%), variasi antarmode (dari 18% menjadi 4% dan
dari 16% menjadi 3%), dan variasi antar laboratorium keseluruhan (dari
25% menjadi 7% dan dari 15% menjadi 4%). Tanpa kalibrasi terdapat
71% dari laboratorium peserta yang tidak mencapai CV antar laboratorium
yang diinginkan yaitu 3,5. Dengan kalibrasi angka tersebut turun menjadi
39%. Disimpulkan bahwa kalibrasi akan menurunkan variasi hemoglobin
glikat tanpa memandang metode pengukuran yang dipergunakan.25
Ketidak seragaman metode pengukuran HbA1c tersebut
menyulitkan penafsiran terutama bila pasien diperiksa di laboratorium
yang berbeda dengan metode analisis yang berbeda dan di Eropa oleh
International Federation of Clinical Chemistry & Laboratory Medicine
(IFCC LM). Pada tahun 1995, IFCC membentuk kelompok kerja (Working
Group : IFCC WG-HbA1c) untuk mencapai standardisasi internasional
pengukuran HbA1c. Setelah bekarja selama beberapa tahun IFCC telah
mengembangkan suatu metode baru untuk mengukur kadar HbA1c
dengan lebih tepat dengan menggunakan suatu fragmen sinteti (
Suatu studi retrospeksti pola glukosa darah kapiler tujuh titik yang
diperoleh pada studi DCCT mendapatkan hubungan linear antara HbA1c
dan glukosa darah rerata (Mean Bloof Glucose =MBG). Dari studi oleh
Rohlfing dkk didapatkan hubungan : MBG = 1.84 x IFCC-HbA1c.
Perbandingan dari sampel darah kumpulan telah menunjukkan hubungan
linear antara hasil HbA1c diukur dengan metode rujukan IFCC dan skema
standardisasi yang dilakukan Amerika Serikat, Jepang, dan Swedia.
Sebagai contoh persamaan regresi yang dihitung untuk NGSP
mendapatkan NGSP-HbA1c = 0,915 (IFCC-Hba1c) x 2.15%, yang
memberikan kaitan numerik antara kedua metode. Namun perlu dicatat
bahwa hasil HbA1c yang didapat dengan cara IFCC lebih rendah
bermakna 1,3%-1,9% (sepanjang rentang HbA1c yang umum) daripada
hasil dengan cara NGSP. Hal ini menimbulkan perdebatan yang perlu
diselesaikan. 25
Pada tahun 2005, telah dikeluarkan Rekomendasi bersama
Kelompok Kerja American Diabetes Association (ADA), European
Association for Study of Diabetes (EASD), IDF agar mengadopsi IFCC
reference method sebagai standard global baru untuk kalibrasi pemeriksaan HbA1c oleh pabrik. Dari hasil penelitian selanjutnya maka
dikeluarkan pula beberapa rekomendasi yang akan mengubah
pemeriksaan dan pelaporan pemeriksaan kadar HbA1c di masa yang
tidak lama lagi. Sebagai contoh kadar HbA1c 5.0% akan setara dengan
2.1.5.2.6 Interpretasi Pemeriksaan HbA1c
Labotorium harus bekerja sama dengan klinisi dan memberikan
informasi yang tepat. Klinis juga harus mengerti metode yang digunakan,
termasuk juga nilai interfal yang digunakan. Misalnya jika metode
pemeriksaan dipengaruhi oleh hemoglobinopati atau uremia maka klinis
harus hati-hati dalam mengambil kesimpulannya.29
2.2 Ferritin
Ferritin adalah protein yang terdiri dari 24 apoferritin monomer
dengan berat molekul 450 kDa. Ferritin mengandung sekitar sekitar 23%
besi. Setiap satu kompleks ferritin bisa menyimpan kira-kira 3000-4500 ion
Fe3+. Pada manusia, terdapat dua bentuk subunit ferritin, yaitu subunit
ringan dan berat; kebanyakan molekul ferritin di jaringan merupakan
bentuk yang heterogen campuran dari kedua subunit tersebut. Sedangkan
ferritin di sirkulasi kebanyakan dalam bentuk subunit yang ringan dan tidak
membawa besi. Pada orang normal, 50-81% ferritin di sirkulasi berikatan
dengan glukosa (glycosylated ferritin). Glycosylated ferritin memiliki waktu
paruh hidup yang lebih panjang (sekitar 50 jam) dibanding
non-glycosylated ferritin.30
Ferritin adalah protein penyimpanan utama besi dalam jaringan dan
terlibat dalam penyerapannya, akumulasi dan pelepasannya dalam sel.
Besi disimpan dalam bentuk ferritin sehingga melindungi sel dari efek
Hal ini ditemukan di hampir semua sel, meskipun sebagian besar zat besi
disimpan dalam hepatosit hati, makrofag disumsum tulang dan limpa,
sehingga memberikan pasokan besi untuk sintesis hemoglobin dan hem
protein. 30,31
Hanya sedikit feritin yang didapati dalam plasma tetapi
konsentrasinya berbanding lurus dengan jumlah zat besi tubuh.
Hubungan ini membuat pengukuran serum atau plasma assay untuk feritin
menjadi uji non-invasif yang ideal. Ketika kadar besi rendah, sintesis
feritin di tingkat translasi ditekan, dan sebaliknya. Namun, ini hanya
berlaku jika hubungan langsung antara plasma feritin dan pool
penyimpanan besi tidak terganggu oleh rilis feritin dari sel-sel parenkim
misalnya hati, atau dengan perubahan dalam sintesis ferritin plasma atau
metabolismenya. Sekitar dua pertiga dari penyimpanan besi dalam tubuh
manusia terkandung dalam ferritin. Sisanya dalam bentuk terlarut yaitu
dalam bentuk hemosiderin, yang paling mungkin menggambarkan feritin
terdenaturasi. 30,31
Ferritin dapat diukur dalam serum, atau plasma menggunakan
heparin lithium atau tabung EDTA. Diperlukan sentrifugasi dan pemisahan
dalam waktu 24 jam dari sampel dan ferritin akan stabil selama 7 hari
pada 2-8 ° C. Disarankan bahwa sampel disentrifugasi untuk
menghilangkan endapan dan fibrin sebelum melakukan pengujian
Kegunaan pemeriksaan serum ferritin adalah untuk mendiagnosa
defisiensi besi, mendiagnosa differensial anemia termasuk anemia
defisiensi besi, memonitor respon terapi besi, memonitor terapi mobilisasi
besi, dan melihat kelebihan besi, termasuk kondisi genetik Hereditary
Haemochromatosis (HH). 30,31 Keterbatasan pemeriksaan ferritin antara
lain :
• Ada peningkatan yang tidak proporsional dalam plasma [ ferritin ]
dalam kaitannya dengan penyimpanan besi dalam kondisi tertentu
: peradangan ( akut dan kronis ), kerusakan jaringan yang
signifikan, penyakit hati misalnya kerusakan sel hati ( yang
membuat nilai tinggi dan sulit dalam menginterpretasi jika terjadi
hemokromatosis), penyakit hati alkoholik ( sebagai bagian dari
respon fase akut atau karena pelepasan feritin dari hepatosit yang
rusak ), keganasan misalnya leukemia akut, penyakit Hodgkin,
karsinoma paru-paru, usus besar, hati dan prostat, dan terapi
dengan suplemen zat besi.
• Konsentrasi Feritin harus diinterpretasikan dengan diagnosa klinis
yang jelas dan temuan patologis yang jelas
• Antibodi Heterophilic dalam serum manusia dapat bereaksi dengan
reagen imunoglobulin, mengganggu immunoassay. Pasien yang
secara rutin terpapar dengan hewan atau produk serum hewan
dapat rentan terhadap gangguan ini dan nilai-nilai anomali dapat
2.2.1. Metode analisa ferritin
Pengukuran ferritin dapat dilakukan dengan menggunakan
immunoassay misalnya ELISA, immunochemiluminescence dan
immunoturbidimetric-assay. 30,31
Tes immunoradiometric sekarang jarang digunakan, karena kesehatan dan risiko keamanan yang terkait dengan penggunaan zat
radioaktif berlabel. Kebanyakan immunoassays menggunakan antibodi
baik limpa atau feritin hati. Karena struktur variabelnya, antibodi yang
berbeda untuk feritin tidak mungkin bereaksi sama dengan semua bentuk,
sehingga hasil yang diperoleh dengan satu metode produsen mungkin
tidak langsung saling dibandingkan. 30,31 Beberapa metode dari produsen
tertentu: 30,31
a. Abbott Architect® assay adalah dua langkah chemiluminescent
mikropartikel immunoassay.
b. ADVIA Centaur® ferritin assay adalah chemiluminometric, dua situs
sandwich immunoassay. Dua antibodi yang digunakan, yaitu :
antibodi berlabel dengan acridinium ester dari anti-ferritin kambing
dan anatibodi anti-feritin dari tikus, yang digabungkan secara
kovalen dengan partikel paramagnetik.
c. Tinta-quant® assay feritin didasarkan pada prinsip aglutinasi
dengan peningkatan reaksi dengan latex. Antibodi anti-feritin terikat
kompleks antigen-antibodi. Aglutinasi kemudian diukur secara
turbidimetrik.
d. Roche ECLIA® electrochemiluminescence immunoassay
menggunakan dua antibodi monoklonal tikus, 4,184 dan
M-3.170, untuk membentuk kompleks sandwich dalam uji tersebut.
2.3 Besi dan Metabolisme Glukosa
Pengetahuan mengenai pengaruh besi terhadap metabolisme
glukosa belakangan ini semakin jelas dikenali. Pada berbagai populasi,
ditemukan bahwa kadar cadangan besi tubuh memiliki korelasi positif
terhadap munculnya intoleransi glukosa, diabetes melitus tipe 2, serta
diabetes gestasional. Pada populasi masyarakat usia dewasa di Amerika,
laki-laki yang baru saja terdiagnosa diabetes memiliki korelasi dengan
peningkatan konsentrasi ferritin dengn nilai odds ratio (OR) 4,94 (95%
Confidence Interval [CI] 3,05-8,01) sementara waniita memiliki OR 3,61 (2,01-6,48). Gambaran ini semakin nyata dengan adanya data yang
menunjukkan adanya peningkatan prevalensi peningkatan cadangan besi
pada populasi masyarakat usia tua yang sehat (28% laki-laki dan 12,2%
wanita ).13
Kebiasaan rutin mendonorkan darah, diketahui dapat menurunkan
cadagan besi serta terbukti dapat menurunkan hiperinsulinemia
tipe 2. Dalam suatu penelitian menunjukkan bahwa tindakan flebotomi
dapat menyebabkan penurunan nilai glukosa, kolesterol, trigliserida,
apoprotein B, perbaikan terhadap sekresi sel beta serta perbaikan
terhadap kerja insulin di perifer pada pasien-pasien DM tipe 2. Diduga
terdapat dampak yang signifikan akibat kelebihan cadangan besi di tubuh
terhadap efek sistemik diabetes, hal ini berdasarkan beberapa laporan
dimana besi tampaknya berpengaruh terhadap proses munculnya
nefropati diabetik, serta difungsi pembuluh darah. Dalam studi tersebut,
didapatkan adanya respon yang positif dari arteri koroner terhadap uji
stress dingin pada pasien diabetes setelah pemberian desferoksamin
intravena serta terdapat perbaikan fungsi endotel pada pasien penderita
penyakit jantung koroner. Seluruh studi tersebut semakin menguatkan
dugaan bahwa besi memiliki peran yang lebih besar dalam proses
patofisiologi berbagai kelainan sistemik pada manusia. Kelebihan besi
pada jaringan dapat berakibat muncul ataupun memberatnya injuri akibat
pembentukan radikal bebas serta lesi-lesi akibat proses inflamasi yang
2.4. Kaitan Cadangan Besi dengan Sensitivitas dan Sekresi Insulin serta DM Tipe 2
2.4.1. Besi dan sensitivitas insulin
Cadangan besi tubuh (ferritin serum) diduga berperan dalam
terjadinya sindroma resistensi insulin. Bahkan, dari beberapa studi,
didapatkan adanya korelasi positif antara jumlah ferritin dengan
konsentrasi lemak tubuh dan beberapa hal terkait obesitas.16 Selain itu,
terdapat pula studi yang dilakukan pada populasi umum yang relatif
terlihat sehat, dimana nilai ferritin serum berkorelasi dengan kadar glukosa
baseline dan kadar glukosa paska tes toleransi glukoa oral (TTOG). Pada pasien diabetes gestasional, nilai ferritin dan IMT (Indeks massa tubuh)
secara independen memiliki nilai prediksi terhadap kadar glukosa 2 jam
paska TTOG. Nilai ferritin juga memiliki korelasi terhadap tekanan darah
diastolik, asam urat (yang juga merupakan salah satu komponen pada
resistensi insulin), dan korelasi negatif terhadap kolesterol HDL.
Dmochowski dkk. melaporkan bahwa konsentrasi ferritin serum memiliki
korelasi negatif dengan sensitivitas insulin pada pasien hemosiderosis. 13
2.4.2. Konsentrasi besi dan fungsi sel beta
Studi yang pernah dilakukan secara in vitro memperlihatkan bahwa jumlah H-ferritin mRNA lebih tinggi 4-8x lipat pada sel-sel islet tikus yang
diberikan glukosa 20 mmol/l dibandingkan dengan sel-sel islet tikus yang
Alasan yang paling mungkin terhadap perbedaan ini adalah bahwa
ferritin memberikan suatu aktivitas antioksidan sedangkan sebagian sel
beta diketahui sensitif terhadap radikal oksigen. Tingginya jumlah ferritin
ini menjelaskan mengapa besi secara khusus banyak terlihat di sel beta.
Peningkatan massa sel beta ditemukan pada sejumlah kecil subjek
nondiabetik dan diabetes ringan dalam keadaan kelebihan besi.13,32
2.4.3. Besi dan DM tipe 2
Terdapat lima data ilmiah tambahan yang mendukung hipotesis
tentang peranan besi dalam perjalanan DM tipe 2.
a) Adanya peningkatan prevalensi kejadian hemokromasitosis pada
pasien DM tipe 2 yang dilihat secara acak. Phelps dkk. dan Conte
dkk. melaporkan bahwa diabetes dapat meningkatkan resiko
hemochromatosis yang diturunkan secara herediter sebesar 2,4%
di negara Australia dan 1,34% di negara Italia. Keadaan ini
diketahui akibat mutasi dari gen C282Y, dan mutasi ini dalam
beberapa studi disebutkan sering terjadi pada pasien-pasien
diabetes. Namun beberapa penelitian yang lain membantah hal ini,
dimana prevalensi mutasi gen C282Y ditemukan tidak berbeda
signifikan antara kelompok diabetes dan non-diabetes. Studi
lainnya memperlihatkan adanya keterlibatan mutasi gen H63D,
dimana hal ini berkaitan juga kondisi kelebihan besi, dan angka
non-diabetes di Spanyol. Hemokromatosis sendiri ternyata memberikan
sumbangsih sebesar 1% dalam perkembangan DM tipe 1 onset
lambat.13, 34
b) Kebiasaan mendonor darah secara rutin dapat menurunkan kadar
cadangan besi, dan hal ini terlihat berperan sebagai faktor protektif
terhadap progresivitas diabetes. Temuan ini cukup penting
mengingat tingginya prevalensi peningkatan kadar cadangan besi
tubuh pada populasi masyarakat di negara barat. Dalam sebuah
percobaan eksperimental yang dilakukan pada tikus, terjadi
penurunan insidensi diabetes dari 78 menjadi 22% dalam 120 hari
dengan membuang darah secara serial.13,35
c) Terdapat bukti berdasarkan sebuah penelitian yang dilakukan
secara acak dimana kadar cadangan besi ternyata berkaitan
dengan kerja insulin pada pasien DM tipe 2. Dalam studi ini,
didapatkan bahwa sensitivitas insulin dan nilai HbA1c ditemukan
lebih baik pada pasien yang di flebotomi secara serial.13,32
d) Dikenalnya suatu sindroma baru yang memiliki ciri khas berlebihnya
kadar besi di hepar dengan peningkatan serum ferritin namun
dengan nilai saturasi transferin yang normal dan hal ini tidak terkait
dengan adanya antigen HLA-A3 (suatu marker yang sering
ditemukan pada hemokromatosis herediter). Kondisi ini dikenal
dengan nama insuline resistance-associated hepatic iron overload
kelainan metabolisme besi (hiperferritinemia dengan saturasi
transferin yang normal), steatohepatitis, serta sindroma resistensi
insulin (obesitas, hiperlipidemia, gangguan metabolisme glukosa,
serta hipertensi). Pada IR-HIO, kemungkinan untuk berlanjut
menjadi fibrosis hati adalah sebesar 60%. Angka ini lebih kecil
dibandingkan fibrosis hati yang disebabkan oleh hemokromatosis
yakni sebesar 33%. Kenyataan bahwa kerusakan jaringan lebih
besar diakibatkan oleh kondisi IR-HIO ini, dan penatalaksanaannya
pun lebih sederhana dan tidak mahal (misalnya flebotomi) oleh
karenanya kesadaran untuk menemukan kelainan ini dianjurkan
untuk lebih diperhatikan.13, 36
e) Gambaran resistensis insulin sering terlihat pada pasien yang
terinfeksi virus hepatitis C. Pada keadaan ini, indeks massa tubuh
(IMT), usia tua, cadangan besi, serta riwayat keluarga diabetes
serta beratnya fibrosis hati dapat memprediksi progresivitas
diabetes.13
2.5. Jalur Interaksi Metabolisme Glukosa dan Besi 2.5.1. Pengaruh insulin terhadap metabolisme besi
Insulin merupakan hormon anabolik yang dapat merangsang sel
untuk mengambil nutrisi, termasuk heksosa, asam amino, kation serta
anion. Sementara itu, absorbsi besi non-heme lewat jalur intestinal
kebutuhan. Pada keadaan cadangan besi tubuh normal, maka
penyerapan besi non-heme akan berkurang. Namun sebaliknya
penyerapan besi heme (bersumber dari daging merah) kemungkinan tidak
bergantung pada kondisi cadangan besi tubuh. Selanjutnya besi berikatan
dengan transferrin dan nantinya akan diangkut dari darah melalui reseptor
transferrin spesifik berikatan tinggi untuk selanjutnya disimpan dan
digunakan dalam pembentukan komponen esensial sel. Peran insulin
yang telah diketahui adalah menstimulasi secara cepat sel-sel lemak
untuk mengambil besi serta mengatur distribusi/perpindahan reseptor
transferrin dari membran intraseluler ke permukaan sel. Pada suatu
percobaan terhadap tikus, ditemukan bahwa insulin juga berperan dalam
meningkatkan sintesis ferritin.13,37
2.5.2 Pengaruh besi terhadap metabolisme glukosa
Besi juga ternyata mempengaruhi kerja insulin. Besi diketahui
dapat menghambat fungsi insulin dalam menekan produksi glukosa di
hati. Ekstraksi dan metabolisme insulin di hati berkurang dengan
meningkatnya kadar simpanan besi sehingga dapat menyebabkan
hiperinsulinemia. Selain itu, kelainan yang paling sering dan muncul
pertama kali pada kondisi kelebihan besi adalah resistensi insulin hati.
Terdapat pula beberapa bukti yang menunjukkan bahwa kelebihan besi
dapat mempengaruhi otot rangka yang merupakan target utama dari kerja
2.5.3. Stres oksidatif mempengaruhi metabolisme besi dan glukosa
Stres oksidatif diketahui dapat menyebabkan resistensi insulin
(melalui hambatan proses masuknya insulin ke sel) serta peningkatan
sintesis ferritin. Besi diketahui sangat erat kaitannya dengan stres
oksidatif. Partisipasi besi melalui reaksi Fenton sehingga membentuk
radikal bebas yang sangat toksik seperti anion hidroksida dan superoksida
yang dapat menginduksi peroksidase lipid. Untuk menjadi sebuah agen
prooksidan, besi harus berubah menjadi bentuk bebasnya. Besi dapat
dirubah dari bentuk ferritin dengan cara mengurangi agen yang dapat
merubah Fe3+ menjadi Fe2+. Adanya proses glikasi dari transferin dapat
mengurangi kemampuannya untuk mengikat besi ferrous, sehingga
dengan meningkatnya kadar besi bebas, akan merangsang sintesis
ferritin. Selain itu terdapat pula holotransferin yang terglikasi, yang juga
dapat memfasilitasi terbentuknya radikal bebas .13
Hiperferitinemia terjadi pada 6,6% pasien diabetes melitus tipe 2.
Konsentrasi feritin serum biasanya meningkat pada pasien DM tipe 1 dan
DM tipe 2 yang tidak terkontrol, dan feritin telah terbukti dapat
memprediksi nilai HbA1c secara independen terhadap glukosa. Kedua hal
ini kemungkinan dapat merefleksikan adanya peningkatan stres oksidatif.
Perbaikan singkat dalam hal kontrol glikemik terbukti dapat menghasilkan
2.5.4. Pengaruh sitokin terhadap metabolisme besi dan glukosa
Seluruh sitokin-sitokin secara bersama-sama dapat menyebabkan
peningkatan reseptor transferin di permukaan sel, sehingga menyebabkan
adanya kecenderungan jaringan untuk menumpuk besi dan resistensi
insulin (gambar 2.4).5
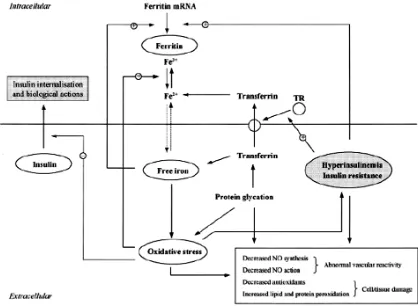
Gambar 2.4. Gambaran skematik dari interaksi besi dengan resistensi
insulin dan stress oksidatif.13
Keterangan: Insulin mempengaruhi metabolisme besi. Insulin merangsang
sintesis ferritin serta memfasilitasi uptake besi oleh sel melalui translokasi reseptor transferin, dari kompartemen intraseluler ke permukaan sel.
Sebaliknya besi dapat mempengaruhi metabolisme glukosa. Besi
oksidatif sel sehingga menyebabkan penghambatan internalisasi dan kerja
insulin, sehingga menyebabkan hiperinsulinemia dan resistensi insulin.
Besi bebas juga memberikan umpan balik positif pada sintesa feritin,
stress oksidatif meningkatkan pelepasan besi dari feritin. Peningkatan
stress oksidatif dan resistensi insulin menyebabkan kerusakan endotel
dan jaringan. Glikasi protein, seperti yang terlihat pada diabetes,
selanjutnya memperparah kelainan ini dan terus merangsang pelepasan
besi dari transferin, sehingga meningkatkan stress oksidatif sel dan secara
langsung menyebabkan kerusakan endotel dan jaringan. NO, nitrit oksida;
TR, reseptor transferin; (+), stimulasi; (-), inhibisi; garis terputus-putus,
diduga jalur besi menuju membran sel. (Dikutip dari: Real JMF, Bermezo
AL, Ricart W. Cross talk between iron metabolism and diabetes. Diabetes
2. 6. Kerangka Konseptual
Diabetes Melitus Tipe 2
Sintesis ferritin
Hiperinsulinemia (Resistensi insulin)
Resistensi Insulin Besi Bebas
Transferin
Stres oksidatif
Disfungsi Sel beta
Perburukan Kontrol Glikemik