BAB II
TINJAUAN PUSTAKA
2.1.Sepsis
2.1.1. Infeksi dan inflamasi
Infeksi adalah istilah untuk menamakan keberadaan berbagai kuman yang
masuk ke dalam tubuh manusia. Bila kuman berkembang biak dan menyebabkan
kerusakan sekitar disebut dengan penyakit infeksi. Pada penyakit infeksi terjadi
jejas sehingga timbullah reaksi inflamasi. Meskipun dasar proses inflamasi sama,
namun intensitas dan luasnya tidak sama, tergantung luas jejas dan reaksi tubuh.
Inflamasi akut dapat terbatas pada tempat jejas saja atau dapat meluas serta
menyebabkan tanda dan gejala sistemik (Guntur,2007).
Inflamasi adalah reaksi jaringan vaskuler terhadap semua bentuk jejas.
Pada dasarnya inflamasi adalah suatu reaksi pembuluh darah, saraf, cairan dan sel
tubuh ditempat jejas. Inflamasi akut merupakan respon langsung yang dini
terhadap agen penyebab jejas dan kejadian yang berhubungan dengan inflamasi
akut sebagian besar dimungkinkan oleh produksi dan pelepasan berbagai macam
mediator kimia. Meskipun jenis jaringan yang mengalami inflamasi berbeda,
mediator yang dilepas sama. Manifestasi klinik yang berupa inflamasi sistemik
disebut systemic inflammation respons syndrome (Guntur,2007).
2.1.2. Definisi Sepsis
Sepsis didefinisikan sebagai suatu infeksi disertai dengan manifestasi
sistemik. Hipotensi yang disebabkan sepsis dengan nilai tekanan darah sistolik <
90 mmHg atau dengan tekanan darah arteri rerata (MAP) < 70 mmHg atau dengan
penurunan tekanan darah sistolik 40 mmHg atau lebih dari 2 standar deviasi
dibawah normal. Syok sepsis ialah sepsis dengan hipotensi meskipun telah
oleh sepsis adalah hipotensi yang disebabkan infeksi, peningkatan laktat, atau
oligouria (Dellinger RP et al,2012).
Sepsis merupakan keadaan disfungsi organ yang mengancam jiwa dimana
terjadi disregulasi respon tubuh terhadap infeksi. Secara klinis dapat di jabarkan
bahwa disfungsi organ terdapat peningkatan skor sequential organ failure assesment (SOFA) > 2 poin atau lebih yang berhubungan dengan peningkatan resiko kematian dirumah sakit >10% (Singer M,2016)
2.1.3. Kriteria Sepsis
Berdasarkan studi dan konsesi mengenai definisi sepsis baru, yang
dilakukan oleh European Society of Intensive Care Medicine’s dan The Society of
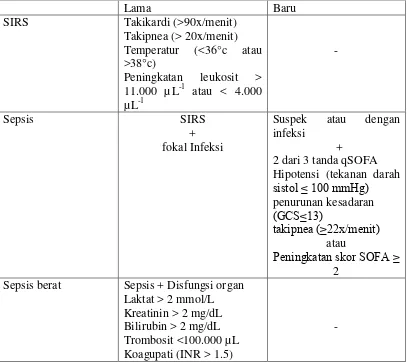
Critical Care Medicine’s pada tahun 2016. Ditetapkan kriteria sepsis yang terdapat pada tabel dibawah ini.
Tabel 2.1 Perbandingan Kriteria Diagnostik Sepsis (dikutip dari Singer M,2016)
Lama Baru Sepsis berat Sepsis + Disfungsi organ
Syok Sepsis Sepsis
Sepsis merupakan penyebab kedua tertinggi kematian di Instalasi rawatan
intensif dan merupakan 10 penyebab tertinggi kematian di seluruh dunia secara
keseluruhan. Selama dua dekade, insidensi sepsis meningkat dari 83 per 100.000
populasi pada tahun 1979 menjadi 140 per 100.000 populasi pada tahun 2000,
menunjukkan peningkatan sebesar 9% setiap tahunnya. Kegagalan fungsi organ
menjadi efek akumulasi yang berdampak langsung pada kematian. Mortalitas
pasien sepsis tanpa disfungsi organ sebesar 15%, Pasien dengan kegagalan fungsi
organ sebesar 70%, dan syok septik sebesar 45-60%. Kejadian hipoalbuminemia
dengan sepsis 60-70%. Pasien sepsis dengan hipoalbuminemia dapat
meningkatkan resiko morbiditas dan mortalitas (Martin GS, Mannino MA, Eaton
S, Moss M,2003;Hommes TJ,Wiersinga, Poll TV,2012)
2.1.5 Patofisiologi Sepsis
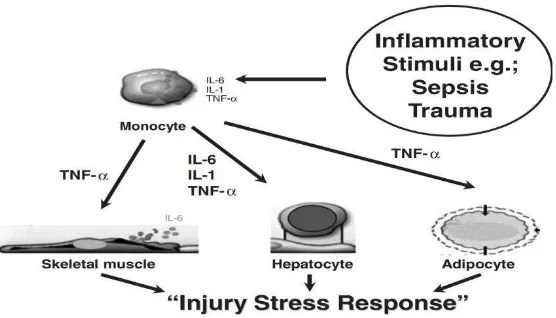
Inflamasi adalah jawaban fisiologis terhadap organisme yang merusak
integritas sel, seperti yang terjadi pada infeksi dan trauma. Pada keadaan
Inflamasi, sel akan melepaskan sitokin dan beberapa mediator, yang mempunyai
kontribusi terhadap penghancuran bakteri dan perbaikan pada jaringan. Dapat
dibedakan antara sitokin pro inflamasi seperti interleukin-1 (IL-1), interleukin-6
(IL-6), tumor necrosis factor (TNF) dan sitokin anti inflamasi seperti
interleukin-10(IL-10) dan interleukin-4(IL-4). Regulasi mekanisme lokal akibat inflamasi
merupakan gambaran terhadap pentingnya menghilangkan sumber dari kerusakan
dan mempertahankan homeostasis. Humoral maupun mediator neuronal
mempunyai kontribusi terhadap regulasi dari inflamasi. Mediator antiinflamasi
proinflamasi seperti dimana lipoxin dan resolvin berkontribusi terhadap perbaikan
jaringan. Mediator humoral mencapai sel target pada beberapa organ dengan
berdifusi melalui pembuluh darah. Substansi yang dilepaskan oleh syaraf seperti
norepinefrin, asetilkolin mencapai target organ secara cepat (Ballina M, Tracey
Kj,2009).
Sepsis merupakan proses kompleks dan inflamasi sistemik merupakan
jawaban terhadap infeksi yang pada umumnya akibat bakteri. Pada tahap awal,
terjadi disregulasi dan ketidakseimbangan terhadap sitokin proinflamasi yang
mengakibatkan kerusakan jaringan, organ, bahkan kematian. Pelepasan sitokin
proinflamasi yang berlebihan memicu pelepasan vasoaktif amine dan chemokines
maupun aktivasi sistem komplemen, koagulasi, dan pelepasan reactive oxgen spesies (ROS). Mediator-Mediator inilah yang bertanggung jawab terhadap peningkatan permeabilitas vaskular, hipotensi, dan syok septik. Pada tahap lanjut,
dilepasnya mediator seperti High Protein Group Box 1 (HMGB1), yang memungkinkan reaksi inflamasi tersebut berlanjut (Ballina M, Tracey Kj,2009).
Secara umum telah diketahui bahwa sistem imunitas dapat dipengaruhi
oleh status neurologis dan begitu juga sebaliknya, status neurologis dapat
dipengaruhi oleh sistem imunitas. Seperti pada sitokin pro inflamasi seperti
interleukin-1 (IL-1), interleukin-6 (IL-6), tumor necrosis factor (TNF) yang lepas
diperifer pada sepsis dapat menyebabkan peningkatan permeabilitas sawar darah
otak dan mencetuskan inflamasi terhadap itu sendiri yang menyebabkan
perubahan perilaku akibat sepsis. Mediator pro inflamasi dari sirkulasi perifer dan
sistem saraf otonom memegang peranan penting terhadap patogenesis neuroimun
pada sepsis (Weismuller K,Weigand MA, Hoffer S,2012)
Hubungan dua arah antara susunan syaraf pusat dan sistem imunitas dalam
meningkatkan efektifitas kedua sistem tersebut dalam konteks perbedaan
inflamasi yang diakibatkan oleh sepsis dengan penyebab lain. dua jalur yang
menghubungkan antara sistem imunitas dengan susunan syaraf pusat adalah
sistem syaraf otonom dan aksis Hypothalamo-pituitary-adrenal (HPA). Aktivasi kedua jalur tersebut mempunyai peranan penting terhadap terjadinya sepsis.
2.1.5.1 Sistem Syaraf Simpatis
Serabut eferen preganglionik yang meninggalkan susunan syaraf pusat
didalam syaraf spinal thorakal dan lumbal dinamakan sistem syaraf simpatis atau
sistem thorakolumbal. Sinaps serabut eferen preganglionik dengan serabut
postganglionik pada ganglia prevertebra. Serabut post ganglionik memiliki
inervasi ke organ melalui ganglia ini. Sistem syaraf simpatis menginervasi semua
organ limfoid dan transmitter epinefrin dan norepenefrin untuk memodulasi
sistem imun, Sitokin proinflamasi mampu mengaktifkan aksis HPA maupun
sistem syaraf simpatis. (Weismuller K,Weigand MA, Hoffer S,2012)
Berbagai macam sel dari sistem imun innate mengekspresikan reseptor α atau β adrenergik. Biasanya, reseptor-α tidak dapat ditemukan pada permukaan leukosit di darah perifer namun dapat ditemukan pada kondisi patologis.
Norepinefrin berinteraksi dengan reseptor α yang akan mestimulasi makrofag
untuk melepaskan TNF-α dan seterusnya akan berkontribusi dalam
mempertahankan keadaan sepsis. Sebaliknya, interaksi dengan reseptor β
menurunkan pelepasan IL-1 dan TNF-α dan meningkatkan sekresi IL-10 dari
makrofag yang memiliki efek antiinflamasi. (Weismuller K,Weigand MA, Hoffer
S,2012)
2.1.5.2 Aksis Hypothalamo-pituitary-adrenal (HPA)
Pelepasan sitokin sebagai hasil dari infeksi dan jejas memicu afferen
vagal. Hubungan sinaps dari medula rostroventral dan lokus coeruleus maupun
nukleus hipotalamik mengaktifkan sistem syaraf simpatis dan aksis HPA. Sitokin
proinflamasi juga mengaktifkan sel perivaskular di sawar darah otak. Sel
perivaskular akan melepaskan ekisanoid yang memberikan efek pada hipothamus.
Sitokin yang berada disirkulasi juga dapat memberikan efek pada organ
sirkumventrikular seperti area postrema dimana tidak terdapat sawar darah otak
secara langsung. Sitokin pro inflamasi menyebakan ekspresi Corticotropin Releasing Hormones (CRH) atau Arginin Vasopresin (AVP) di hipotalamus serta Adrenocorticotropic Hormones (ACTH) pada kelenjar hipofisis adrenal. ACTH dapat meningkatkan pelepasan kortisol di korteks adrenal. Kortisol memiliki efek
anti inflamasi dalam mengurangi aktivasi nuclear factor-kappa B (NF-κB) dan
prekursor peptida tidak hanya ACTH tetapi juga α-melanocyte stimulating hormones (α-MSH). α-MSH menurunkan NF-κB dan meningkatkan pelepasan IL -10 dan menghambat aktivitas pro inflamasi. Pada keadaan Syok septik sangat
relevan bahwa pelepasan α-MSH setelah stimulasi CRH terhambat berdampak kepada kematian. Reaksi antiinflamasi sistemik pentng terhadap respon imunitas
yang efektif pada pasien sepsis. Berbagai studi klinis menunjukkan sitokin
proinflamasi secara langsung mengaktifkan aksis HPA dan mengakibatkan
pelepasan kortisol. (Weismuller K,Weigand MA, Hoffer S,2012)
2.1.5.3 Kontrol Kolinergik Inflamasi
Beberapa tahun terakhir, jalur antiinflamasi kolinergik telah digambarkan
sebagai mekanisme kontrol inflamasi neuronal melalui syaraf eferen. Secara in
vitro, asetilkolin menghambat pelepasan sitokin pro inflamasi melalui makrofag.
Secara in vivo, stimulasi elektrik syaraf vagal menurunkan pelepasan HMGB1
dan meningkatkan angka kelangsungan hidup. Selanjutnya, asetilkolin
menghambat pelepasan TNF-α dengan berikatan dengan reseptor α7-subunit
asetilkolin. Sebagai tambahan, splenektomi yang dilakukan pada percobaan sepsis
menurunkan pelepasan HMGB1 serta meningkatkan angka kelangsungan hidup.
Sistem imun mendapat informasi dari organ perifer dan berperilaku sebagai organ
sensori yang menyediakan informasi proses inflamasi untuk otak. Reseptor IL-1
pada syaraf aferen vagal terlibat pada proses ini (Weismuller K,Weigand MA,
Hoffer S,2012)
2.1.5.4 Aktifasi komplemen
Aktifasi komplemen akan menghasilkan suatu bentukan protein yang akan
melarutkan sel patogen. Lebih penting lagi, aktivasi kaskade oleh inflamasi akan
menghasilkan produk yang berperan penting dalam fungsi vasoaktif, aktivasi
protein koagulasi, platelet, sel mast dan secara tidak langsung memproduksi
bradikinin. Dengan demikian dapat terlihat bahwa ativasi dari salah satu inisiator
akan mengaktivasi inisiator yang lain. Efek yang dihasilkan adalah peningkatan
permeabilitas mikrovaskular, peningkatan aliran mikrovaskuler, penurunan
kecepatan aliran dan pembentukan edema di jaringan. (Weismuller K,Weigand
Patogenesis sepsis adalah kompleks, meskipun kemajuan ilmu kedokteran
semakin maju namun patogenesis sepsis masih tetap tidak dimengerti. Utamanya,
sepsis adalah hasil dari interaksi antara mikroorganisme dan respon tuan rumah
akibat dikeluarkan sitokin dan mediator lainnya. Komponen terpenting dari respon
tuan rumah adalah berkembangnya mekanisme alami awal untuk memproteksi
organisme dari kerusakan. Akan tetapi pada sepsis, respon imun itu sendiri yang
menimbulkan respon kaskade sekunder dimana mencetuskan disfungsi organ
bahkan kematian, selain eradikasi dari invasi mikroorganisme. Konsep awal dari
sepsis adalah respon proinflamasi tak terkontrol juga gabungan dari disregulasi
dari anti-inflamasi, koagulasi dan jalur penyembuhan luka (Annane et al., 2005).
2.1.6 Stres Metabolik Pada Sepsis
Pada pasien sepsis mempunyai karakter variasi yang lebar terhadap
metabolisme karbohidrat, lemak dan protein. Variasi tersebut dapat memicu
peningkatan kebutuhan energi dengan akselarasi katabolisme protein dan
menyebabkan menurunnya sistem kekebalan tubuh. Pada orang yang sehat
normal, respon metabolik terhadap sepsis dapat meningkatkan kebutuhan kalori
dan protein. Hasilnya, substrat endogen digunakan sebagai sumber bahan bakar
dan sebagai prekursor terhadap sintesis protein. Respon ini melalui counter regulatory hormones (CRHs) seperti epinefrin, glukagon, kortisol dan hormon
pertumbuhan,yang meregulasi substrat endogen di berbagai organ dan jaringan.
Sebagai tambahan, tumor necrosis factor-α dan interleukin-1β mempunyai peranan penting terhadap respon sistemik yang menimbulkan hiperglikemia. Stres
yang memicu hiperglikemi ini mempunyai dampak buruk seperti peningkatan
infeksi dan memperlambat penyembuhan luka. Pada pasien nondiabetik,
hiperglikemia akan berlangsung selama 24 jam setelah trauma atau paska
pembedahan serta menggambar keadaan konsentrasi CRHs di plasma. Lebih
lanjut akan terjadi pengurangan massa tubuh (otot) dan lemak , dimana keadaan
ini dijuluki dengan otokanibalisme. Strategi nutrisi konvensional dengan
mencukupkan nutrisi sesuai dengan kebutuhan manusia sehat, namun
pengurangan massa otot dan jaringan lemak masih tampak terjadi (Elamin M,
Gambar 2.1 Variasi kondisi yang dapat menimbulkan CRHs di plasma meningkat.(Elamin M, Camporessi E, 2009).
Respon metabolik terhadap stres memiliki dampak yang besar terhadap
gangguan metabolisme karbohidrat. Peningkatan sekresi CRH menimbulkan
peningkatan produksi karbohidrat endogen sebagai akibat akselarasi hepatik
glukoneogenesis. Sumber substrat endogen untuk mendukung glukoneogenesis
hepatik berasal gliserol (lipolisis), alanin (proteolisis) dan laktat (glikolisis
anaerob). Peningkatan produksi karbohidrat ini dibarengi dengan resisten terhadap
insulin yang menyebabkan hiperglikemia. Kadar insulin dalam batas normal atau
diatas ambang normal, namun tidak cukup untuk mencegah hiperglikemia.
Hiperglikemia dapat juga terjadi akibat penurunan aktivitas sintesa glikogen
diotot. (Chiolero R, Revelly JP, Tappy L, 1997).
Asam lemak bebas merupakan salah satu sumber energi selain laktat dan
asam amino setelah mengalami sepsis. Trigliserida menyediakan 50-80% dari
energi yang dibutuhkan. Energi sangat dibutuhkan untuk proses glukoneogenesis
hepatik. Lipolisis adalah percepatan metabolisme lemak yang terjadi pada periode
awal akibat stimulasi CRH. Energi dilepaskan melalui proses oksidasi lemak yang
merupakan sumber energi sel hati. Hanya sebagian glukosa mengalami oksidasi
dan 80-90% energi yang dibutuhkan untuk proses glukoneogesis hepatik berasal
Gambar 2.2 Glukoneogenesis hepatik (Chiolero R, Revelly JP, Tappy L, 1997)
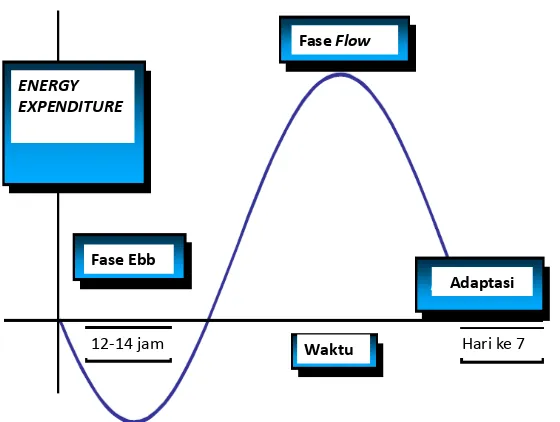
Respon metabolik tubuh terhadap stres terjadi melalui dua fase, yaitu fase
ebb dan fase flow (Preiser JC et al ,2014).
1. Fase Ebb
Fase ebb dimulai segera setelah terjadi stres, baik akibat trauma atau sepsis
dan berlangsung selama 12-24 jam. Namun, fase ini dapat berlangsung
lebih lama, tergantung pada keparahan trauma dan kecukupan resusitasi.
Fase ebb disamakan juga dengan periode syok yang memanjang dan tidak
teratasi, yang ditandai dengan hipoperfusi jaringan dan penurunan
aktivitas metabolik secara keseluruhan. Sebagai upaya kompensasi tubuh
terhadap keadaan ini, hormon katekolamin akan dikeluarkan, dimana
norepinefrin menjadi mediator utama pada fase ebb. Norepinefrin
dikeluarkan dari saraf perifer dan berikatan dengan reseptor beta 1 di
jantung dan reseptor beta 2 di perifer dan dasar vaskular splanknik. Efek
paling penting adalah pada sistem kardiovaskular, karena norepinefrin
merupakan stimulan kuat jantung, menyebabkan peningkatan
kontraktilitas dan denyut jantung dan vasokonstriksi. Hal ini merupakan
usaha dalam mengembalikan tekanan darah, meningkatkan perfoma
jantung dan maksimalisasi venous return. Hiperglikemia mungkin terjadi
merupakan efek sekunder dari katekolamin dan akibat stimulasi simpatik
langsung dari pemecahan glikogen. Hiperglikemia yang terjadi setelah
trauma merupakan masalah yang sangat penting untuk segera diatasi
karena dapat menempatkan pasien pada kondisi berisiko tinggi terhadap
berbagai komplikasi, masa penyembuhan yang lebih lama, peningkatan
waktu lama rawat, bahkan dapat menyebabkan kematian.
2. Fase Flow
Permulaan fase flow, yang meliputi fase anabolik dan katabolik, ditandai dengan curah jantung (CO) yang tinggi dengan restorasi oxygen delivery dan substrat metabolik. Durasi fase flow tergantung pada keparahan trauma
atau adanya infeksi dan perkembangan menjadi komplikasi. Secara khas,
puncak fase ini adalah sekitar 3-5 hari, dan akan turun pada 7-10 hari, dan
akan melebur ke dalam fase anabolik selama beberapa minggu. Selama
terjadi fase hipermetabolik, insulin akan meningkat, namun peningkatan
level katekolamin, glukagon, dan kortisol akan menetralkan hampir semua
efek metabolik dari insulin. Peningkatan mobilisasi asam amino dan free fatty acids dari simpanan otot perifer dan jaringan adiposa merupakan akibat dari ketidak seimbangan hormon-hormon tersebut. Beberapa
hormon akan mengeluarkan substrat yang digunakan untuk produksi
energi salah satunya secara langsung sebagai glukosa atau melalui liver
sebagai trigliserid. Substrat lainnya akan berkontribusi terhadap sintesis
protein di liver, dimana mediator humoral akan meningkatkan produksi
reaktan fase akut. Sintesis protein yang serupa juga terjadi pada sistem
imun guna menyembuhkan kerusakan jaringan. Fase hipermetabolik ini
melibatkan proses katabolik dan anabolik, hasilnya adalah kehilangan
protein secara signifikan, yang ditandai dengan keseimbangan nitrogen
negatif dan penurunan simpanan lemak. Hal ini akan menuju pada
modifikasi komposisi tubuh secara keseluruhan, ditandai dengan
kehilangan protein, karbohidrat, dan simpanan lemak, disertai dengan
12-14 jam
Fase Ebb
FaseFlow
ENERGY EXPENDITURE
Adaptasi
Waktu Hari ke 7
Gambar 2.3 Fase ebb dan fase flow (Preiser JC et al.,2014).
2.1.7 Keadaan hiperkatabolik pada sepsis
Salah satu tanda penting dari respon metabolik adalah keadaan
hiperkatabolik dimana terjadi balans nitrogen negatif. Hiperkatabolik adalah
percepatan proteolisis pada otot skelet, guna memenuhi substrat endogen yang
diperlukan pada proses glukoneogenesis hepatik. Balans nitrogen artinya
selisih antara nitogen yang dikonsumsi dengan nitrogen yang dikeluarkan.
Balans nitrogen negatif adalah suatu kondisi dimana hilangnya nitrogen lebih
besar daripada asupan nitrogen, begitu juga sebaliknya pada balans nitrogen
positif berarti kondisi yang optimal untuk pertumbuhan dimana asupan protein
lebih besar daripada nitrogen yang dikeluarkan (Heindorff H, Schulze S,
Mogensen T, 1992).
Mengurangi laju glukoneogenesis hepatik dengan somastatin tidak
menimbulkan efek pengurangan yang berarti pada pemecahan otot di perifer.
Studi menunjukkan bahwa percepatan pembentukan glukosa tidak
kehilangan nitrogen sebanding dengan tingkat stress dan akan kembali normal
jika pasien telah sehat kembali. Peningkatan pemecahan protein tidak hanya
dimodulasi oleh CRH, namun beberapa mediator seperti sitokin proinflamasi
seperti TNF-α, IL-1, IL-6 dan interferon mempunyai andil dalam memodulasi
aktivitas katabolik. Keseimbangan antara hormon katabolik dan hormon
anabolik seperti insulin dan insulin-like growth factors mencerminkan derajat proses katabolik itu sendiri. Beberapa jalur yang bertanggung jawab terhadap
proteolisis pada sel otot termasuk aktivasi lisosomal kalsium dan ubiquitin.
Selain itu, terjadi peningkatan enzim glutamin sintase yang menyebabkan
pengeluaran asam amino beserta glutamin dari sel otot. Hati juga
berkontribusi didalam katabolik melalui peningkatan kliren urea. (Heindorff
H, Schulze S, Mogensen T, 1992; Heindorff H, Billesbolle P, Pedersen SL,
Hansen R, Vistrup H, 1995)
Selama stres metabolik tersebut berlangsung, organ hati akan
meningkatkan sintesa protein fase akut seperti fibrinogen, komplemen,
imunoglobulin, dan CRP. Peningkatan protein sebagai respon kemampuan
tubuh dalam melawan infeksi. Secara simultan akan terjadi pengurangan
sintesa protein plasma seperti albumin, prealbumin, transferin dan retinol binding protein (Brown JA, Gore DC, Jahoor F,1994)
TRAUMA, SEPSIS, PEMBEDAHAN
Epinefrin Norepinefrin
HIPERKATABOLIK ANABOLIK ↓
SUBSTRAT
ENDOGEN ↓ TUBUH↓MASSA
Sitokin dan Mediator
inflamasi Adipokines Saluran Cerna
Derajat perubahan katabolik berhubungan dengan durasi dan jenis jejas
yang terjadi. Pada keadaan stres metabolik akibat trauma, proteolisis sistemik
terjadi akibat stimulasi oleh hormo glukokortikoid. Terjadi peningkatan katabolik
dan peningkatan nitrogen di urin mencapai 30 gram/hari. Berdasarkan perhitungan
ini, pasien yang mengalami trauma tanpa pemberian nutrisi akan kehilangan 15%
massa tubuhnya dalam kurun waktu 10 hari. Begitu juga pada stres metabolik
pada jenis jejas yang lain, pada keadaan sepsis akan terjadi hiperkatabolik dan
peningkatan nitrogen di urin mencapai 20-30 gram/hari. Pada luka bakar yang
luas akan terjadi peningkatan nitrogen 30-40 gram/hari dan paska pembedahan
<15 gram/hari (Jan BV, Lowry ST, 2004).
Pada keadaan sepsis, katabolik yang terjadi mencapai 260 gram setiap
hari. Itu artinya pemecahan sel otot yang terjadi lebih dari 1 kg setiap hari. Pada
kasus ini, pasien sepsis yang tidak mendapatkan nutrisi yang tepat akan lebih
mudah kehilangan sel otot, sulit untuk melakukan penyapihan pada mesin
ventilator dan berkaitan dengan masa pemulihan. Asam amino yang berasal dari
katabolik sel otot tidak dapat digunakan kembali untuk sintesa protein. Namun
digunakan menurut skala prioritasnya, dengan komponen sistem imunitas selular
dan anti peradangan sebagai prioritas tertinggi. Misalnya, penyerapan asam amino
oleh hati untuk membentuk protein fase akut, seperti glutamin yang berfungsi
sebagai sumber energi bagi sel sistem kekebalan yang membelah dengan cepat
dan sebagai donor protein untuk pembentukan purin. Pembentukan protein plasma
seperti albumin akan menurun. Peningkatan ketersediaan asam amino dan
peningkatan kadar kortisol juga akan merangsang glukoneogenesis. Cepatnya
pemecahan asam amino akan menyebabkan peningkatan pembetukan urea. Oleh
karena itu terjadi balans nitrogen negatif. Peningkatan laju katabolik seiring
dengan peningkatan uptake oksigen dan laju jantung pada fase flow (Sobotka L, Soeters PB,2004).
2.1.8 Disfungsi Saluran Cerna Pada Sepsis
Seperti yang telah diuraikan pada materi diatas bahwa sepsis
menyebabkan metabolisme meningkat atau sering disebut dengan keadaan
substrat protein dan energi secara cepat, disfungsi sistem imunitas, serta
penurunan fungsi organ. Perubahan ini berakibat pada berbagai organ seperti hati,
ginjal, jantung, paru-paru, dan saluran cerna (Rowlands BJ,Soong CV, Gardiner
KR, 1999).
Saluran cerna merupakan organ yang mempunyai fungsi pencernaan dan
penyerapan nutrien yang diperlukan oleh tubuh. Selain itu, saluran cerna juga
mempunyai fungsi proteksi tubuh terhadap mikroorganisme patogen. Struktur
epitel mukosa saluran cerna yang normal mempertahankan dan mencegah migrasi
mikroorganisme maupun antigen bermolekul besar. Sekresi asam yang dihasilkan
oleh lambung, sekresi alkali dari usus halus, dan sekresi mukus dari saluran cerna
dapat membantu fungsi proteksi saluran cerna. Pada keadaan sepsis, terjadi
penurunan darah splanknik yang menyebabkan struktur saluran cerna berubah
menjadi atropi. Hal ini dapat mengurangi absorpsi nutrien dan memperburuk
keadaan sepsis akibat translokasi bakteri (Rowlands BJ,Soong CV, Gardiner KR,
1999).
Hal ini dibuktikan pada studi dengan melihat fungsi absorpsi saluran cerna
pada tikus yang distimulasi menjadi sepsis. Endotoksemia yang membuat
perubahan pada saluran cerna mengakibatkan peningkatan absorpsi kalium dan
penurunan absorpsi karbohidrat dan protein (Khalil et al.,2014)
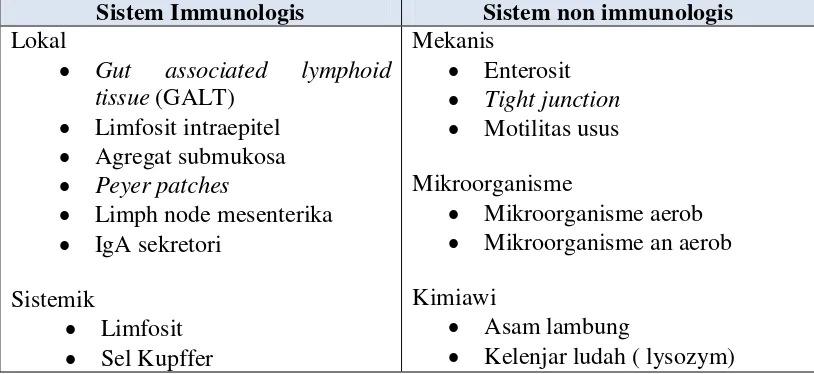
Tabel 2.2 Komponen pertahanan mukosa saluran cerna (Rowlands BJ,Soong CV, Gardiner KR, 1999)
Sistem Immunologis Sistem non immunologis Lokal
Laktoferin
Sekresi Mukus dan garam empedu
2.2 Albumin
Albumin merupakan salah satu kelompok utama protein plasma yang
terdapat dalam konsentrasi massa paling tinggi. Albumin juga mempunyai berat
molekul paling rendah dibandingkan molekul-molekul protein lain dalam plasma.
Jadi, albumin merupakan kontributor terbesar untuk tekanan osmotik koloid
intravaskuler. Albumin disintesis di dalam hati dan terdiri atas suatu rantai tunggal
dari 610 asam amino. Beberapa tempat pengikatan ligandanya sangat spesifik dan
jenuh, sedang yang lain jauh lebih sedikit. Protein yang larut dalam air dan
mengendap pada pemanasan ini merupakan salah satu konstituen utama tubuh.
Karena albumin disintesis oleh hati, maka albumin dipakai sebagai parameter
pembantu dalam penilaian fungsi ginjal dan saluran cerna. Kadar normal albumin
dalam darah antara 3,5-4,5 g/dl, dengan jumlah total 300 g. Sintesis terjadi hanya
di sel hati dengan produksi sekitar 9-14 g/ hari pada orang sehat, tetapi jumlah
yang dihasilkan bervariasi signifikan pada berbagai tipe stress fisiologis. Waktu
paruh albumin sekitar 18 hari, dengan kecepatan degradasi 4-5 % per hari.
(Vincent J, 2014).
Albumin merupakan protein plasma yang paling tinggi jumlahnya sekitar
60% dan memiliki berbagai fungsi yang sangat penting bagi kesehatan yaitu
pembentukan jaringan sel baru, mempercepat pemulihan jaringan sel tubuh yang
rusak serta memelihara keseimbangan cairan di dalam pembuluh darah dengan
cairan di rongga interstitial dalam batas-batas normal, kadar albumin dalam darah
3,5-5 g/dl (Rusli et al., 2011).
Beberapa protein dalam plasma darah yang menunjukkan adanya
polimorfisme adalah prealbumin, albumin, dan transferin, ketiga protein tersebut
mudah ditemukan dalam jumlah besar. Albumin adalah protein utama yang
di dalam darah dan bertanggung jawab pada sekitar 80% dari tekanan osmotik
potensial dari plasma (Oktarianti, 2010).
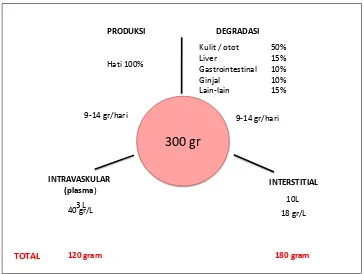
300 gr
PRODUKSI DEGRADASI
INTERSTITIAL INTRAVASKULAR
(plasma)
Kulit / otot 50%
Liver 15%
Gastrointestinal 10%
Ginjal 10%
Lain-lain 15% Hati 100%
9-14 gr/hari 9-14 gr/hari
TOTAL
10L 3 L
40 gr/L 18 gr/L
120 gram 180 gram
Gambar 2.5 Ilustrasi skematis metabolisme albumin pada orang dewasa sehat (Vincent J, 2014).
2.2.1 Sintesis Albumin
Sintesis albumin hanya berlangsung di hati. Seorang manusia yang sehat
dengan berat sekitar 70 kg menghasilkan kurang lebih 14 g albumin sehari.
Artinya, sintesis albumin di hati terdiri dari sekitar 200 mg / kg berat badan / hari.
Albumin memiliki waktu paruh sekitar 18 hari, dengan degradasi 4% setiap
harinya. Setelah disintesis di dalam hati dari asam-asam amino yang berasal dari
katabolisme protein otot atau penyerapan usus, albumin disekresi ke dalam aliran
darah dan terdistribusi ke seluruh jaringan tubuh. (Vincent J, 2014).
Albumin manusia awalnya disusun oleh gen albumin, yang diperlukan
menjadi proalbumin,yang merupakan bentuk intraseluler utama dari albumin.
Setelah disintesis, aparatus Golgi dari hepatosit manusia menghilangkan urutan 6
asam amino dari rantai peptida proalbumin, untuk menyelesaikan sintesis
albumin, yang kemudian disekresikan. Albumin tidak disimpan di hati tetapi
langsung disekresikan melalui sirkulasi portal segera setelah albumin dihasilkan.
Pada orang muda yang sehat, kecepatan sintesis albumin adalah 194±37
mg/kg/hari. Kecepatan ini beragam menurut kondisi nutrisi dan penyakit individu.
(Vincent J, 2014).
Albumin hanya dapat disintesa pada keadaan nutrisi, hormonal, dan
lingkungan osmotik yang sesuai. Tekanan osmotik koloid dari cairan interstitial
hepatosit adalah regulator sintesis albumin yang paling penting. Pada keadaan
nutrisi yang cukup, produksi dan sintesa albumin dapat meningkat 2-2.7 kali dari
normal. Selain itu sintesis albumin juga memerlukan mRNA untuk translasi,
pasokan asam amino yang adekuat, diaktivasi dengan mengikat pada tRNA,
ribosom sebagai tempat membentuk, energi dalam bentuk ATP dan GTP(Vincent
J, 2014).
Konsentrasi mRNA tersedia dalam ribosom merupakan faktor penting
dalam mengatur laju sintesis albumin. Trauma dan proses penyakit mempengaruhi
jumlah mRNA. Pengurangan konsentrasi mRNA yang diakibatkan pengurangan
transkripsi gen terlihat pada saat reaksi fase akut yang dimediasi oleh sitokin,
terutama interleukin-6 (IL-6) dan tumor necrosis factor α (TNF-α). Asupan
makanan telah dibuktikan mempengaruhi laju sintesis albumin. Puasa mengurangi
produksi albumin, dan menghindari protein dari makanan menyebabkan
pengurangan sintesis yang lebih besar. Kekurangan protein dalam waktu lama
menyebabkan penurunan aktivitas dan konsentrasi mRNA. Ini bisa terjadi karena
meningkatnya pemecahan bukan karena melambatnya transkripsi gen (Brenner
DA,Buck M, Feitelberg SP, Chojkier M.1990).
Keadaan hormonal dapat mempengaruhi konsentrasi mRNA. Insulin
diperlukan untuk sintesis yang adekuat karena pada sebuah studi pada pasien
diabetes, laju kecepatan sintesis albumin yang menurun kembali meningkat
sintesis albumin dikombinasi dengan insulin atau asam-asam amino, tetapi juga
meningkatkan katabolisme albumin (Rusli et al., 2011).
2.2.2 Metabolisme Albumin
Konsentrasi albumin serum merupakan nilai selisih antara sintesis dengan
degradasi albumin yang terdistribusi antara kompartemen intravaskuler dan
ekstravaskuler. Beberapa studi telah menunjukkan bahwa serum albumin dalam
keadaan normal akan melintasi dinding pembuluh darah dan terdistribusi ke ruang
ekstravaskuler di seluruh tubuh, terutama kulit. Pertukaran rata-rata jumlah
volume intra-dan ekstravaskuler (transkapiler) adalah sekitar 5% per jam dari
jumlah albumin intravaskuler. Sejauh distribusi albumin disekresikan, setelah 2
jam sebagian besar (sekitar 90%) masih berada dalam ruang intravaskular, dengan
waktu paruh 15-16 jam. Hampir 10% dari albumin hilang dari kompartemen ini
setiap hari (Vincent J, 2014).
Pada keadaan patologis seperti sepsis dan trauma atau paska pembedahan
mayor, level albumin dapat turun menjadi 1.0-1.5 gr/dL dalam kurun waktu 3-7
hari. Alasan ini dapat disebakan oleh penurunan sintesa albumin dihati,
peningkatan katabolisme, dan peningkatan laju transcapillary escape dimana terjadi kobocoran menuju rongga interstitial. Studi lain menyebutkan waktu paruh
albumin menjadi lebih pendek dibandingkan yang tidak sepsis (8.2±1.4 vs
12.5±1.7). Bahkan pada keadaan syok sepsis dan paska pembedahan jantung, laju
transcapillary escape dapat meningkat 300 % (Margarson MP, Soni N,1998;Gatta
A, Verardo A, Bolognesi M, 2012;Azab BN, Bhatt VR, Vronfolio S, 2013).
2.2.3 Distribusi Albumin
Distribusi albumin dapat dijelaskan dengan dua kompartemen : 40% (120
g) terletak di sistem pembuluh darah dan 60% (180 g) di ruang ekstravaskuler.
Albumin memasuki intravaskular dalam dua cara: (1) dari ruang ekstravaskuler,
melalui drainase limfatik, (2) dari hepatosit, melalui ruang sinusoid. Mekanisme
degradasi albumin belum dapat dijelaskan secara utuh. Sepertinya, mekanisme ini
adalah sebuah proses acak yang seimbang mempengaruhi neosintesis dan molekul
tubuh manusia memiliki pembuluh kapiler yang berkelanjutan, dan pada beberapa
organ lain terdapat rongga-ronga sinus yang terbuka dengan lebar (hati, sumsum
tulang) dan fenestrated capillaries (usus halus, pankreas, kelenjar adrenal). Menurut teori Starling, kecepatan lintasannya tergantung pada permabilitas
dinding dengan tekanan hidrostatik dan onkotik pada kedua dinding yang akan
dilewati. Mekanisme transport aktif juga berperan dalam lintasan ini (Vincent J,
2014).
Pergerakan albumin yang normal dari intravaskular menuju interstitial 10
kali dari jumlah albumin diproduksi atau 5% dari jumlah albumin berpindah
menuju interstisial. Oleh karena itu transcapillary rate memegang peranan penting terhadap perubahan akut pada konsentrasi serum albumin (Gatta A,
Verardo A, Bolognesi M, 2012)
2.2.4 Ekskresi Albumin
Beberapa penelitian mengemukakan bahwa pemecahan albumin dapat
terjadi pada sebagian besar organ tubuh: kulit dan otot (40-60%), hati (<15%),
sumsum tulang dan endotelium. Degradasi albumin ini juga terjadi di ginjal
sekitar 10%, dan selebihnya melalui saluran pencernaan.Pada orang normal,
jumlah albumin yang terbuang melalui urin sangat minimal(Vincent J, 2014).
2.2.5 Fungsi Albumin
Albumin merupakan protein plasma yang memiliki beberapa fungsi penting
diantaranya: (Kratz F,2014; Vincent J, 2014)
a. Menjaga tekanan onkotik
Albumin plasma sebesar 75-80 % dan merupakan 50% dari seluruh protein
tubuh. Dalam fungsinya sebagai pemelihara tekanan onkotik, albumin
menahan cairan di plasma terutama pada kapiler arteri dengan
mempertahankan tekanan filtrasi. Sebaliknya pada kapiler vena yang
tekanan hidrostatiknya lebih rendah dari arteri. Apabila terjadi suatu hal,
albumin menurun maka tekanan onkotik akan menurun dan akan
albumin itu sendiri akan lebih banyak berdifusi ke luar sirkulasi, sehingga
menambah berat keadaan.
b. Sebagai transport
Albumin dapat mengikat berbagai macam substansi termasuk bilirubin,
asam lemak, logam, ion, hormon, dan obat-obatan. Salah satu konsekuensi
dari hipoalbumin adalah obat yang seharusnya berikatan dengan protein
akan berkurang, di lain pihak obat yang tidak berikatan akan meningkat,
hal ini akan meningkatkan kadar obat bebas di dalam darah
c. Keseimbangan asam basa
Albumin dapat bertindak sebagai buffer dengan adanya banyak residu yang bermuatan. Albumin bertanggung jawab terhadap hampir setengah
dari anion gap normal. Pengurangan konsentrasi protein menyebabkan alkalosis metabolik. Pengurangan serum albumin tiap 1 g/dL dapat
meningkatkan bikarbonat 3,4 mmol/liter, menghasilkan base excess 3,7 mmol/liter dan pengurangan anion gap 3 mmol/liter
d. Antioksidan
Albumin dapat mengikat oksigen radikal bebas leukosit
polymorphonuclear pada keadaan inflamasi. Hal ini mempunyai implikasi bahwa pasien-pasien dengan hipoalbumin terjadi pengurangan pengikat
oksigen radikal bebas.
e. Mempertahankan integritas mikrovaskular
Albumin memegang peranan dalam membatasi kebocoran kapiler dengan
mengubah distribusi glikoprotein di dinding pembuluh darah. Dari
pengamatan kultur endotel, albumin juga mempunyai fungsi protektif
langsung untuk mencegah terjadinya apoptosis sel endotel. Proteksi
tertinggi didapati pada konsentrasi fisiologis albumin sehingga dapat
mencegah masuknya kuman-kuman usus kedalam pembuluh darah,
sehingga tidak terjadi peritonitis bakterialis spontan.
f. Memiliki efek antikoagulan
Albumin mempunyai efek antikogulan dalam kapasitas kecil seperti
struktur dua molekulnya. Heparin mempunyai grup sulfat negatif yang
berikatan dengan grup bermuatan positif pada antitrombin II.
2.3. Hipoalbuminemia
Hipoalbuminemia merupakan masalah yang sering dihadapi pada orang
dengan kondisi medis akut atau kronik. Pada saat masuk rumah sakit sekitar
20% pasien sudah menderita. Kadar albumin darah yang rendah menjadi
prediktor penting berhubungan dengan mortalitas dan morbiditas. Dikatakan
hipoalbuminemia jika kadar albumin plasma < 3.5 gr/dL. Pada penelitian
meta-analisis didapatkan setiap penurunan albumin darah sebesar 1,0 gr/dL,
angka mortalitas meningkat 137% dan morbiditas 89% . Hipoalbuminemia
dapat disebabkan oleh penurunan produksi albumin, sintesis yang tidak
efektif karena kerusakan sel hati, kekurangan intake protein, peningkatan
pengeluaran albumin karena penyakit lainnya, dan inflamasi akut maupun
kronis. Faktor-faktor yang mempengaruhi kadar albumin (Suriyani, 2009).
1. Malnutrisi protein
Asam amino diperlukan dalam sintesis albumin, akibat dari defesiensi
asupan protein terjadi kerusakan pada retikulum endoplasma sel yang
berpengaruh pada sintesis albumin dalam sel hati.
2. Sintesis yang tidak efektif
Pada pasien dengan sirosis hepatis terjadi penurunan sintesis albumin
karena berkurangnya jumlah sel hati. Selain itu terjadi penurunan aliran
darah portal ke hati yang menyebabkan maldistribusi nutrisi dan oksigen
ke hati.
3. Kehilangan protein ekstravaskular
Kehilangan protein masif pada penderita sindrom nefrotik dapat terjadi
kebocoran protein 3,5 gram dalam 24 jam. Kehilangan albumin juga
dapat terjadi pasien dengan luka bakar yang luas.
4. Hemodilusi
pada pasien asites, terjadi peningkatan cairan tubuh mengakibatkan
penurunan kadar albumin walaupun sintesis albumin normal atau
5. Inflamasi akut dan kronis
Kadar albumin rendah karena inflamasi akut dan akan menjadi normal
dalam beberapa minggu setelah inflamasi hilang. Pada inflamasi terjadi
pelepasan sitokin (TBF, IL-6) sebagai akibat respon inflamasi pada stress
fisiologis (infeksi, bedah, trauma) mengakibatkan penurunan kadar
albumin melalui mekanisme berikut:
a. Peningkatan permeabilitas vaskular (albumin berdifusi ke ruang
ekstravaskular).
b. Peningkatan degradasi albumin
c. Penurunan sintesis albumin (TNF-α yang berperan dalam
penurunan trankripsi gen albumin)
Sangat penting bagi klinisi untuk mengetahui bahwa banyak faktor yang
dapat mencetuskan hipoalbuminemia disamping masalah diet nutrisi. Dari
beberapa faktor diatas dapat kita kelompokkan menjadi beberapa kelompok
(Crook MA,2009)
1. Berkurangnya sintesis albumin
Analbuminemia
Kondisi yang sangat jarang dimana terdapat defisiensi sintesis
albumin
Fungsi hati terganggu
Penyakit sirosis dimana laju sintesa asam amino tidak adekuat
untuk mengganti asam amino yang di metabolisme.
Malabsorpsi
Terganggunya fungsi absorpsi saluran cerna yang menyebabkan
gangguan penyerapan asam amino
2. Redistribusi albumin dari plasma menuju rongga interstitial Peningkatan permeabilitas membran kapiler
Terjadi pada keadaan sepsis dan trauma dimana albumin pindah ke
rongga interstitial
3. Hipoalbuminemia dilusional
Pemberian cairan albumin intravena
4. Kehilangan albumin dari tubuh Sindroma nefrotik
Protein loosing enteropathy Luka bakar yang luas
5. Peningkatan katabolisme protein yang sering terjadi pada sepsis dan
hipertiroid
Tabel 2.3 Klasifikasi Penyebab Hipoalbuminemia Berdasarkan Kriteria Mekanisme Patogenesis Utama
Mekanisme utama Penurunan Sintesis
Abnormalitas genetik (analbuminemia) Sirosis
Gagal hati akut
Hepatitis akut dan kronis
Defisiensi nutrisi (diet rendah protein) Diabetes
Asidosis metabolik kronis Peningkatan katabolisme
Sepsis dan Infeksi Kanker
Perubahan distribusi albumin Hemodilusi ( kehamilan ) Paska pembedahan mayor Trauma
Gagal jantung Infeksi dan Sepsis Hipotiroid
Luka bakar yang luas Penyakit kulit yang luas Diabetes
peningkatan protein plasma melalui ginjal Sindroma nefrotik
Luka bakar luas dan penyakit kulit yang luas Protein loosing enteropathy
2.4 Albumin pada keadaan sepsis
Respon albumin plasma sudah diketahui akan turun terhadap inflamasi.
Stres (trauma, infeksi, atau radiasi) selalu mempunyai hubungan dengan
hipoalbuminemia baik itu pada hewan dan manusia. Pengurangan konsentrasi
albumin plasma dapat merupakan konsekuensi dari berbagai faktor, termasuk
perubahan laju sintesis, meningkatnya laju katabolik dan redistribusi albumin dari
plasma ke kompartemen interstisial (Filho, 2010).
Infeksi menginduksi penurunan kadar mRNA albumin hati dan sintesa
albumin relatif terhadap sintesa total protein hati. Sebuah penelitian yang
dilakukan oleh Ruot et al mengenai perbandingan sintesis albumin di hati dan
intravaskuler pada tikus menyatakan bahwa penurunan level mRNA albumin
sebagai respons infeksi setara dengan penurunan sintesis albumin intrahepatik.
Sebuah studi mengenai mRNA albumin hati tentang kegiatan translasi pada tikus
secara in vitro, menunjukkan bahwa ketika terjadi reaksi inflamasi setelah adanya
cedera jaringan, penurunan level serum albumin berhubungan dengan
berkurangnya konsentrasi dari mRNA albumin di hati. Respon yang terjadi pada
fase akut apabila terjadi trauma, inflamasi atau sepsis, akan terdapat peningkatan
laju transkripsi gen sebagai bentuk positif protein-protein fase-akut, seperti C-reactive protein, dan penurunan laju transkripsi albumin mRNA serta sintesis
albumin. IL-6 dan TNF-α keduanya berperan dalam mengurangi transkripsi gen.
Peradangan yang terjadi pada tikus menurunkan konsentrasi mRNA albumin dan
laju sintesis albumin. Nilai minimum tercapai setelah 36 jam dan kemudian akan
naik kembali. Respon inflamasi yang berkelanjutan pada sepsis dapat
menyebabkan penghambatan sintesis albumin yang berkepanjangan (Castell JV,
Buck M, Feitelberg SP, Chojker M,1990)
Pada keadaan sepsis, katabolisme albumin juga terganggu. Seiring dengan
penurunan konsentarsi serum albumin, laju pemecahan fraksi albumin (fractional
degradation rate) juga akan meningkat. Beberapa penelitian menunjukkan keadaan dimana terjadi peningkatan flux plasma antar kapiler didapati juga peningkatan laju pemecahan albumin. Endothel vaskuler juga diduga memiliki
bahwa jaringan yang terlibat aktif dalam katabolisme albumin adalah organ-organ
dengan kapiler yang bersifat fenestrated dan discontinuous. Penelitian lain juga menduga semakin banyak jaringan yang terpapar dengan keadaan peningkatan
permeabilitas kapiler, katabolisme juga meningkat. Akan tetapi, hal ini
bertentangan pada penelitian tentang extravasasi albumin pada myxoedema yang menjelaskan terjadinya peningkatan pool albumin di jaringan extravaskuler, maka
akan terdapat penurunan katabolisme albumin. Ini mengindikasikan jika albumin
terperangkap dalsm suatu jaringan, maka albumin yang ada di jaringan tersebut
terlindung dari proses degradasi (Castell JV, Buck M, Feitelberg SP, Chojker
M,1990).
Perubahan distribusi pada pasien kritis berhubungan dengan meningkatnya
kebocoran kapiler. Peningkatan kebocoran kapiler pada keadaan sepsis melibatkan
barrier endothel yang mengalami disfungsi yang mengakibatkan hilangnya protein dari kapiler, munculnya sel-sel inflamasi, perpindahan albumin dari
pembuluh darah ke interstisial kompartemen. Perburukan ini terjadi bahkan 13
kali lipat dibandingkan keadaan normal sehingga penurunan serum albumin
sangat besar. Meningkatnya pertukaran posisi antara albumin dan cairan ke ruang
interstitial mengakibatkan dilusi protein yang bersifat relatif di dalam kapiler,
terjadi penurunan tekanan cairan onkotik koloid, dengan demikian terjadilah
penurunan pertukaran cairan dari jaringan (Ruot B, Breille D, Rambourdin F,
Bayle G, 2000).
Mediator dari kebocoran kapiler ini telah ditemukan pada beberapa
literatur seperti:
• Endotoxin dari bakteri gram negatif.
• Sitokin TNF-α dan IL-6.
• Metabolit asam arakidonat, leukotrien dan prostaglandin.
• Komponen komplemen C3a dan C5a.
• Peptida vasoaktif lain: Bradykinin dan histamine.
2.5 Dukungan Nutrisi Pada Pasien Sepsis
Dampak dukungan nutrisi pada pasien kritis dengan sepsis telah mendapat
banyak perhatian selama beberapa tahun terakhir ini. Banyak hasil penelitian yang
menunjukkan hasil yang berlawanan. Seperti pada semua pasien kritis, dukungan
nutrisi enteral harus segera dimulai ketika resusitasi dan tekanan perfusi adekuat
telah tercapai. Ketika rute enteral menjadi kontraindikasi, nutrisi parenteral
menjadi pilihan. Hampir setiap penelitian menunjukkan hasil yang positif
terhadap hubungan dukungan nutrisi dengan pencegahan sepsis. Pemberian
nutrisi dengan komposisi yang telah ditetapkan pada 24 jam pertama dapat
menurunkan angka kejadian pneumonia. Suplemen arginin dan glutamin dapat
menurunkan angka kejadian infeksi (Cohen J,Opal S,Calandra T, 2012).
Tujuan utama terapi diet hipoalbuminemia adalah meningkatkan dan
mempertahankan status gizi dalam hal ini kadar serum albumin serta seminimal
mungkin penurunan kadar albumin untuk mencegah komplikasi. Kebutuhan
energi pada hipoalbuminemia diupayakan terpenuhi karena apabila asupan energi
kurang dari kebutuhan maka terjadi pembongkaran protein tubuh untuk diubah
menjadi sumber energi sehingga beresiko memperburuk kondisi hipoalbuminemia
( Hasan dkk, 2008).
2.5.1 Nutrisi pada pasien sepsis
Nutrisi dan infeksi mempunyai interaksi satu sama lain dalam satu
rangkaian sinergis yang nyata, memicu perubahan status nutrisi dan penigkatan
resiko terjadi infeksi rekuren. Episode infeksi menimbulkan keadaan
hipermetabolik dan balans nitrogen negatif yang dimodulasi oleh hormon, sitokin,
dan mediator proinflamasi serta diperburuk dengan berkurangnya asupan nutrisi.
Mobilisasi cadangan protein dan lemak pada keadaan sepsis diperantarai oleh
mediator. Pada manusia dewasa normal, kebutuhan energi dan protein dicukupkan
dengan adanya glukosa, asam amino, dan asam lemak (Kurpad AV, 2006)
Pada pasien sepsis, total energy expenditure (TEE) pada hari pertama kurang lebih 25 kkal/kg/ hari, tetapi pada hari kedua TEE akan meningkat secara
kebutuhan kalori, proporsi serta kuantitas zat nutrisi yang digunakan. Pemberian
glukosa sebagai sumber energi utama dapat mencapai 4 - 5 mg/kg/menit dan
memenuhi 50 - 60% dari kebutuhan kalori total atau 60 - 70% dari kalori non
protein. Pemberian glukosa yang berlebihan dapat mengakibatkan
hipertrigliseridemia, hiperglikemia, diuresis osmotik, dehidrasi, peningkatan
produksi CO2 yang dapat memperburuk insufisiensi pernafasan dan
ketergantungan terhadap ventilator, steatosis hepatis, dan kolestasis. Pemberian
lemak sebaiknya memenuhi 25 - 30% dari kebutuhan total kalori dan 30 - 40%
dari kalori non protein. Kelebihan lemak dapat mengakibatkan disfungsi neutrofil
dan limfosit, menghalangi sistem fagositik mononuklear, merangsang hipoksemia
yang dikarenakan oleh gangguan perfusi-ventilasi dan cedera membran
alveolokapiler, merangsang steatosis hepatik, dan meningkatkan sintesis PGE2.
Dalam keadaan katabolik, protein otot dan viseral dipergunakan sebagai energi di
dalam otot dan untuk glukoneogenesis hepatik (alanin dan glutamin). Kebutuhan
protein melebihi kebutuhan protein normal yaitu 1,2 g/kg/protein/hari .Kuantitas
protein sebaiknya memenuhi 15 - 20% dari kebutuhan kalori total dengan rasio
kalori non protein/ nitrogen adalah 80:1 sampai dengan 110:1 ( Iqbal M, Xavier
ML,2005).
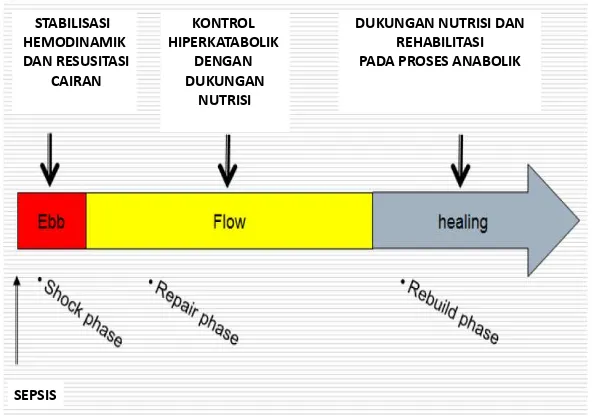
SEPSIS STABILISASI HEMODINAMIK DAN RESUSITASI
CAIRAN
KONTROL HIPERKATABOLIK
DENGAN DUKUNGAN
NUTRISI
DUKUNGAN NUTRISI DAN REHABILITASI PADA PROSES ANABOLIK
Tujuan pemberian nutrisi adalah menjamin kecukupan energi dan
nitrogen, tapi menghindari masalah-masalah yang disebabkan overfeeding atau refeeding syndrome seperti uremia, dehidrasi hipertonik, steatosis hati, gagal napas hiperkarbia, hiperglisemia, koma non-ketotik hiperosmolar dan
hiperlipidemia. Level yang terbaik untuk memulai pemberian nutrisi pada pasien
sakit kritis adalah 25 kkal/kgbb dari berat badan ideal per hari. Harus diperhatikan
bahwa pemberian nutrisi yang kurang atau lebih dari kebutuhan, akan merugikan
buat pasien. REE dapat bervariasi antara meningkat sampai 40% dan menurun
sampai 30%, tergantung dari kondisi pasien ( Leonard R, 2005).
Pemberian protein yang adekuat adalah penting untuk membantu proses
penyembuhan luka, sintesis protein, sel kekebalan aktif, dan paracrine messenger.
Disamping itu, serum glukosa dijaga antara 100-200 mg/dL. Hiperglikemi tak
terkontrol dapat menyebabkan koma hiperosmolar non ketotik dan resiko
terjadinya sepsis, yang mempunyai angka mortalitas sebesar 40%. Hipofosfatemia
merupakan satu dari kebanyakan komplikasi metabolik yang serius akibat
refeeding syndrome. Hipofosfatemia yang berat dihubungkan dengan komplikasi yang mengancam nyawa, termasuk insufisiensi respirasi, abnormalitas jantung,
disfungsi SSP, disfungsi eritrosit, disfungsi leukosit dan kesulitan untuk
menghentikan penggunaan ventilator (Higgins PA et al.,2006).
Jenis nutrisi enteral yang digunakan instalasi gizi RSUP Haji Adam Malik
Medan adalah nutren optimum. Nutren optimum adalah makanan bergizi lengkap
dan seimbang yang mengandung mengandung formula seperti yang ada ditabel
dibawah ini untuk memenuhi kebutuhan nutrisi. Cara menggunakan susu ini
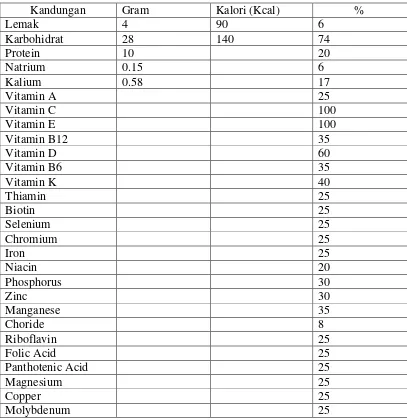
Tabel 2.4 Kandungan nutrisi pada susu formula nutren optimum setiap 237 ml.
Sumber: bagian gizi RSUP Haji Adam Malik Medan
2.5.2 Makro Dan Mikro Nutrien Dalam Nutrisi
2.5.2.1. Karbohidrat
Karbohidrat merupakan sumber energi yang penting. Setiap gram
karbohidrat menghasilkan kurang lebih 4 kalori. Asupan karbohidrat di
dalam diet sebaiknya berkisar 50% - 60% dari kebutuhan kalori. Dalam
diet, karbohidrat tersedia dalam 2 bentuk: pertama karbohidrat yang dapat
dicerna, diabsorbsi dan digunakan oleh tubuh (monosakarida seperti
polisakarida seperti tepung, dekstrin, glikogen) dan yang kedua
karbohidrat yang tidak dapat dicerna seperti serat. Glukosa digunakan oleh
sebagian besar sel tubuh termasuk susunan saraf pusat, saraf tepi dan
sel-sel darah. Glukosa disimpan di hati dan otot skeletal sebagai glikogen.
Cadangan hati terbatas dan habis dalam 24-36 jam melakukan puasa. Saat
cadangan glikogen hati habis, glukosa diproduksi lewat glukoneogenesis
dari asam amino (terutama alanin), gliserol dan laktat. Oksidasi glukosa
berhubungan dengan produksi CO2 yang lebih tinggi, yang ditunjukkan
oleh RQ (respiratory quotient) glukosa lebih besar dari pada asam lemak
rantai panjang. Sebagian besar glukosa didaur ulang setelah mengalami
glikolisis anaerob menjadi laktat kemudian digunakan untuk
glukoneogenesis hati. Kelebihan glukosa pada pasien keadaan
hipermetabolik menyebabkan akumulasi glukosa di hati berupa glikogen
dan lemak. Meskipun turnover glukosa meningkat pada kondisi stres, metabolisme oksidatif tidak meningkat dalam proporsi yang sama. Oleh
karena itu kecepatan pemberian glukosa pada pasien dewasa maksimal 5
mg/kgBB/menit ( Iqbal M, Xavier ML,2005).
2.5.2.2.Lemak
Komponen lemak dapat diberikan dalam bentuk nutrisi enteral
ataupun parenteral sebagai emulsi lemak. Pemberian lemak dapat
mencapai 30%- 50% dari total kebutuhan. Satu gram lemak menghasilkan
9 kalori. Lemak memiliki fungsi antara lain sebagai sumber energi,
membantu absorbsi vitamin yang larut dalam lemak, menyediakan asam
lemak esensial, membantu dan melindungi organ-organ internal,
membantu regulasi suhu tubuh dan melumasi jaringan-jaringan tubuh.
Pemberian kalori dalam bentuk lemak akan memberikan keseimbangan
energi dan menurunkan insiden dan beratnya efek samping akibat
pemberian glukosa dalam jumlah besar. Penting juga bagi kita untuk
memperkirakan komposisi pemberian lemak yang berhubungan dengan
proporsi dari asam lemak jenuh (SFA), asam lemak tidak jenuh tunggal
lemak esensial omega 6 dan omega 3 dan komponen antioksidan. Selama
hari-hari pertama pemberian emulsi lemak khususnya pada pasien yang
mengalami stres, dianjurkan pemberian infus selambat mungkin, yaitu
untuk pemberian emulsi Long Chain Triglyseride (LCT) kurang dari 0,1
gram/kgbb/jam dan emulsi campuran Medium Chain Triglyseride
(MCT)/Long Chain Triglyseride (LCT) kecepatan pemberiannya kurang
dari 0,15 gram/kgbb/jam. Kadar trigliserida plasma sebaiknya dimonitor
dan kecepatan infus selalu disesuaikan dengan hasil pengukuran ( Iqbal M,
Xavier ML,2005).
2.5.2.3. Protein
Protein adalah senyawa organik kompleks berbobot molekul tinggi
yang merupakan polimer dan monomer-monomer asam amino yang
dihubungkan satu sama lain dengan ikatan peptida. Molekul protein
mengandung karbon, Hidrogen, Oksigen, Nitrogen. Kebutuhan protein
bisa diperoleh dari 2 sumber bahan pangan yaitu protein hewani dan
protein nabati. Sumber terbaik protein hewani adalah daging dari mamalia,
unggas, dan ikan laut. Sumber terbaik dari protein nabati adalah dari
kacang-kacangan (Leonard R,2004)
a. Sifat Protein
Protein di alam ditemukan dalam bentuk koloid, kelarutan
protein di dalam air berbeda-beda, dari yang tidak larut (keratin)
sampai yang mempunyai kelarutan tinggi (albumin). Protein dapat
didenaturasi oleh panas, asam kuat, alkali, alkohol, aseton, urea,
garam dan logam berat. Denaturasi adalah proses yang mengubah
struktur molekul tanpa memutuskan ikatan kovalen. Denaturasi dapat
pula didefinisi sebagai perubahan yang besar dalam struktur alami
yang tidak melibatkan perubahan dalam urutan asam-amino.
Denaturasi biasanya diiringi dengan hilangnya aktivitas biologi dan
perubahan yang berarti pada beberapa sifat fisika dan fungsi. Jika
karena itu sifat sifat kimia, fisik dan biologi yang dimilikinya akan
berubah. (Leonard R,2004)
b. Peranan Protein
Sebagai zat pembangun, protein berfungsi untuk memperbaiki
kerusakan jaringan (pemeliharaan jaringan) dan untuk
membangun jaringan baru (pertumbuhan dan pembentukan
protein).
Protein dapat dikatabolisasi menjadi sumber energi atau
sebagai substrat penyusun jaringan karbohidrat dan lemak. Protein diperlukan dalam tubuh untuk penyusun hormon dan
enzim.
Sebagai alat pengangkut dan penyimpan. Banyak molekul dengan BM kecil serta beberapa ion dapat diangkut atau
dipindahkan oleh protein-protein tertentu. Misalnya
hemoglobin mengangkut oksigen dalam eritrosit, sedangkan
mioglobin mengangkut oksigen dalam otot.
Penunjang mekanis. Kekuatan dan daya tahan robek kulit dan
tulang disebabkan adanya kolagen, suatu protein berbentuk
bulat panjang dan mudah membentuk serabut.
Imunitas. Pertahanan tubuh biasanya dalam bentuk antibodi. Yaitu suatu protein khusus yang dapat mengenal dan
menempel atau mengikat benda-benda asing yang masuk ke
dalam tubuh seperti virus, bakteri, dan sel-sel asing lain.
c. Asam Amino
Protein tersusun dan sejumlah asam amino. Dari keseluruhan
asam amino yang terdapat di alam hanya 20 asam amino yang yang
biasa dijumpai pada protein. Asam amino yang membentuk protein
pada dasamya dapat digolongkan menjadi 2 golongan yaitu asam
amino esensial (tidak dapat dibentuk oleh tubuh) dan asam amino non
esensial (dapat dibentuk oleh tubuh). Asam amino yang termasuk
triptophan, valin, leusin, isoleusin, dan histidin. Sedangkan asam
amino penting dari kelompok non-esensial adalah taurin, karnitin,
sistein, sistin, asam 1-glutamat, GABA (Gama Amino-Butyric Acid),
dan glutation. Glutation juga merupakan suatu antioksidan. Ada pula
yang disebut sebagai asam amino detoksifikasi yang bekerja mengikat
dan menetralkan ksenobiotik, yaitu arginin, glisin, taurin, glutamin,
dan ornitin. Beberapa asam amino lainnya bekerja pada pengendalian
sistem saraf pusat, misalnya asam L-glutamat dan GABA (Leonard
R,2004)
d. Asam Amino Rantai Cabang (Branched Chain Amino Acids / BCAA)
Asam amino rantai cabang atau BCAA adalah asam-asam amino
yang tidak mempunyai ikatan kuntinu dari rantai karbonnya sehingga
asam amino ini mempunyai rantai karbon yang tidak linear sehingga
membentuk rantai cabang. Yang termasuk dalam BCAA ini adalah:
Leucine (Leu), Isoluecin (Ile) dan Valin (Val). Dari penelitian Buse
pada tahun 1975 diketahui bahwa Leucine yang paling berpengaruh
dalam memodulasi status nutrisi. Hal ini didukung oleh penelitian oleh
Mori et all dan penelitian-penelitian lain yang dikhususkan pada
pasien-pasien sepsis oleh Bower dan pasien-pasien dengan penyakit
kritis oleh Gore dan Wolfe. Kebanyakan asam amino didegradasikan
secara efektif oleh hati, kecuali BCAA. Hati mengoksidasi bentuk
konversi BCAA dalam bentuk oxo-ketoacid. Oksidasi yang terbanyak
dari BCAA ini terjadi dalam otot dan jaringan adiposa (Leonard
R,2004)
e. Suplementasi BCAA pada pasien sepsis
Kemampuan leusin dan ketoisocaproic acid untuk memodulasi metabolisme protein pada keadaan sepsis. Dalam penelitian ini
didapati bahwa diperlukan konsentrasi leusin dua kali lipat untuk
menstimulasi sintesa protein pada pasien sepsis dibandingkan pada
multisenter, prospektif dan acak pada 69 pasien sepsis ICU yang tidak
dapat menerima nutrisi enteral. Penelitian dilakukan dengan pemberian
TPN isokalori dan didapati adanya perbaikan dalam hal mortalitas
pada pasien yang mendapatkan suplementasi BCAA (Leonard
R,2004).
Recommended Dietary Allowance (RDA) untuk protein adalah 0,8 gram/kgBB/hari atau kurang lebih 10% dari total kebutuhan kalori.
Para ahli merekomendasikan pemberian 150 kkal untuk setiap gram
nitrogen (6,25 gram protein setara dengan 1 gram nitrogen).
Kebutuhan ini didasarkan pada kebutuhan minimal yang dibutuhkan
untuk mempertahankan keseimbangan nitrogen. Dalam sehari
kebutuhan nitrogen untuk kebanyakan populasi pasien di IRI
direkomendasikan sebesar 0,15 - 0,2 gram/ kgbb/hari. Ini sebanding
dengan 1 - 1,25 gram protein/ kgbb/hari. Beratnya gradasi
hiperkatabolik yang dialami pasien seperti luka bakar luas, dapat
diberikan nitrogen sampai dengan 0,3 gram/kgbb/hari. studi lain
menyebutkan rata-rata kebutuhan protein pada dewasa muda sebesar
0,75 gram protein/kgbb/hari. Namun selama sakit kritis kebutuhan
protein meningkat menjadi 1,2 - 1,5 gram/kgbb/hari. Pada beberapa
penyakit tertentu, asupan protein harus dikontrol, misalnya kegagalan
hati akut dan pasien uremia, asupan protein dibatasi sebesar 0,5
gram/kgbb/hari.15 Kebutuhan protein pada pasien sakit kritis bisa
mencapai 1,5 - 2 gram protein/kgbb/hari, seperti pada keadaan
kehilangan protein dari fistula pencernaan, luka bakar, dan inflamasi
yang tidak terkontrol. Hal ini sesuai dengan hasil penelitian Elwyn
yang hanya menggunakan dekstrosa 5% nutrisi, menunjukkan bahwa
perbedaan kecepatan kehilangan nitrogen berhubungan dengan tingkat
keparahan penyakit. Disamping itu, keseimbangan nitrogen negatif
lebih tinggi kali pada pasien dengan luka bakar, dan 3 kali lipat pada
sepsis berat apabila dibandingkan dengan individu normal. Data ini
mencoba untuk mengembalikan keseimbangan nitrogen. (Kreymann et al,2006; Khalid I, Doshi P, Digiovine B,2010).
2.5.2.4 Mikronutrien
Pasien sakit kritis membutuhkan vitamin-vitamin A, E, K, B1
(tiamin), B3 (niasin), B6 (piridoksin), vitamin C, asam pantotenat dan
asam folat yang lebih banyak dibandingkan kebutuhan normal
sehari-harinya. Khusus tiamin, asam folat dan vitamin K mudah terjadi
defisiensi pada TPN. Dialisis ginjal bisa menyebabkan kehilangan
vitamin-vitamin yang larut dalam air. Selain defisiensi besi yang
sering terjadi pada pasien sakit kritis dapat juga terjadi defisiensi
selenium, zinc, mangan dan copper (Leonard R,2004).
2.5.2.5 Nutrisi Tambahan
Nutrisi tambahan adalah beberapa komponen sebagai tambahan pada
larutan nutrisi untuk memodulasi respon metabolik dan sistim imun, walaupun
signifikansinya belum bisa disimpulkan. Komponen tersebut termasuk growth
hormone, glutamine,branched chain amino acids (asam amino rantai panjang),
novel lipids, omega-3 fatty acids, arginine, nucleotides. Namun perlu di waspadai
khususnya L-arginine yang sering disebut sebagai immune-enhancing diets, dapat
memperburuk sepsis, karena L-arginine akan meningkatkan NO yang dapat
meningkatkan reaksi inflamasi, vasodilatasi, gangguan motilitas usus dan
gangguan integritas mukosa, serta gangguan respirasi. Dapat disimpulkan bahwa
imunonutrisi dapat menurunkan komplikasi infeksi, tapi tidak berhubungan
dengan mortalitas secara umum (Heyland DK et al., 2001).
2.6. Metode Freeze Dryer
Freeze Driyer merupakan suatu alat pengeringan yang termasuk kedalam Conduction Dryer/ Indirect Dryer karena proses perpindahan terjadi secara tidak langsung yaitu antara bahan yang akan dikeringkan (bahan basah) dan media
pemanas terdapat dinding pembatas sehingga air dalam bahan basah / lembab
bahwa perpindahan panas terjadi secara hantaran (konduksi), sehingga disebut
juga Conduction Dryer/ Indirect Dryer ( Liapis et al., 1994).
Pengeringan beku adalah salah satu metode pengeringan yang mempunyai
keunggulan dalam mempertahankan mutu hasil pengeringan, khususnya untuk
produk-produk yang sensitif terhadap panas. Keunggulan pengeringan beku,
dibandingkan metoda lainnya, antara lain adalah:
a. Dapat mempertahankan stabilitas produk (menghindari perubahan aroma,
warna, dan unsur organoleptik lain).
b. Dapat mempertahankan stabilitas struktur bahan (pengkerutan dan
perubahan bentuk setelah pengeringan sangat kecil)
c. Dapat meningkatkan daya rehidrasi (hasil pengeringan sangat berongga
dan lyophile sehingga daya rehidrasi sangat tinggi dan dapat kembali ke sifat fisiologis, organoleptik dan bentuk fisik yang hampir sama dengan
sebelum pengeringan).
Keunggulan tersebut tentu saja dapat diperoleh jika prosedur dan proses
pengeringan beku yang diterapkan tepat dan sesuai dengan karakteristik bahan
yang dikeringkan. Kondisi operasional tertentu yang sesuai dengan suatu jenis
produk tidak menjamin akan sesuai dengan produk jenis lain. Pada prinsipnya
pengeringan beku terdiri atas dua urutan proses, yaitu pembekuan yang
dilanjutkan dengan pengeringan. Dalam hal ini, proses pengeringan berlangsung
pada saat bahan dalam keadaan beku, sehingga proses perubahan fase yang terjadi
adalah sublimasi. Sublimasi dapat terjadi jika suhu dan tekanan ruang sangat
rendah, yaitu dibawah titik tripel air. (Chang BS, Patro SY,2014).
Menurut Liapis et al mengatakan bahwa proses pengeringan beku terdiri atas tiga tahap yaitu:
a. Tahap pembekuan, pada tahap ini bahan pangan atau larutan didinginkan
hingga suhu dimana seluruh bahan baku menjadi beku.
b. Tahap pengeringan utama, disini air dan pelarut dalam keadaan beku
dikeluarkan secara sublimasi. Dalam hal ini tekanan ruangan harus kurang
atau mendekati tekanan uap kesetimbangan air di bahan beku. Karena
bahan pangan atau larutan bukan air murni tapi merupakan campuran
dan biasanya dibawah -10 °C atau lebih rendah, untuk tekanan kira-kira 2
mm Hg atau lebih kecil. Tahap pengeringan ini berakhir bila semua air
telah tersublim.
c. Tahap pengeringan sekunder, tahap ini mencakup pengeluaran air hasil
sublimasi atau air terikat yang ada dilapisan kering. Tahap pengeringan
sekunder dimulai segera setelah tahap pengeringan utama berakhir.
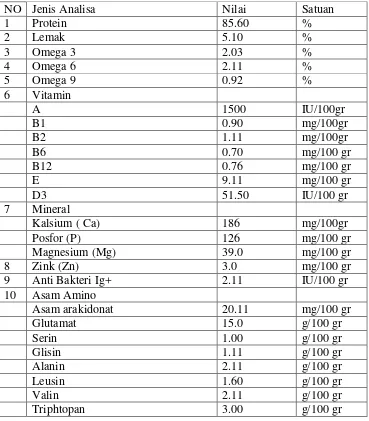
Ikan gabus diketahui mempunyai senyawa-senyawa penting bagi tubuh
manusia, di antaranya protein yang tinggi, lemak, air dan mineral, sehingga bisa
menjadi alternatif suplemen yang dapat meningkatkan status gizi. Ikan gabus
(Ophiocephalus striatus) sudah dikenal luas di masyarakat mampu mengobati luka
bakar, terinspirasi dari orang-orang Cina yang mengobati luka bakar dengan
mengkonsumsi ikan gabus. Keunggulan ikan gabus dibandingkan dengan produk
lainnya adalah pada kelengkapan komposisi asam amino dan kemudahannya
untuk dicerna . Penelitian lain menyebutkan bahwa albumin ikan gabus secara
nyata dapat meningkatkan albumin serum dan penutupan luka pada tikus
percobaan. (Brotowijoyo, 1995; Siswono, 2003; Taslim NA, 2005)
Berbeda dengan preparat ektrak ikan gabus yang lain yang diproduksi
melalui proses pemanasan atau pasteurisasi. Prinsip produksi preparat ekstrak ikan
gabus yang dipakai dalam penelitian ini adalah dengan metode freezy dry. Sehingga preparat asam amino yang terkandung didalamnya stabil. Dibuat dengan
campuran ekstrak buah untuk memudahkan pasien yang tidak toleransi terhadap
kapsul dan anak-anak. Ekstrak ikan gabus metode freezy dryer ini berbentuk granul-granul yang sangat kecil (partikel nano) dengan ukuran diameter antara 1
nanometer sampai dengan 100 nanometer, yang mampu terserap dalam sistem
vaskular akibat adanya perbedaan tekanan antara pembuluh darah kapiler dan
mukosa. Proses pengolahan albumin dengan metode freezy dryer bertujuan untuk
meningkatkan stabilitas protein albumin, mempertahankan mutu serta
meningkatkan kemampuan penyerapan. Teknologi nano adalah penerapan ilmu
pengetahuan dan teknologi dalam penciptaan material, struktur fungsional
maupun piranti dalam ukuran antara 1 dan 100 nanometer. Satu nanometer adalah
seper seribu mikrometer, atau seper sejuta milimeter atau seper semilyar meter.