SEBAGAI AGENS PENGENDALI LARVA BOKTOR
Dorysthenes sp. (COLEOPTERA: CERAMBYCIDAE)
PADA TANAMAN TEBU
DENDI JULIADI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
DAN SUMBER INFORMASINYA
Dengan ini saya menyatakan bahwa tesis Eksplorasi Bakteri Kitinolitik
Sebagai Agens Pengendali Larva Boktor Dorysthenes sp. (Coleoptera:
Ceramby-cidae) pada Tanaman Tebu adalah karya saya dengan arahan dari komisi
pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi
mana pun. Sumber informasi yang berasal atau dikutip dari karya yang
diterbit-kan maupun tidak diterbitditerbit-kan dari penulis lain telah disebutditerbit-kan dalam teks dan
dicantumkan dalam Daftar Pustaka pada akhir bagian tesis ini.
Bogor, Februari 2010
Dendi Juliadi
DENDI JULIADI. Exploration of Chitinolytic Bacteria as Biocontrol Agent Against Sugarcane Borer Dorysthenes sp. (Coleoptera: Cerambycidae). Under direction of TEGUH SANTOSO, ENDANG SRI RATNA, and GIYANTO.
Dorysthenes sp. (Coleoptera: Cerambycidae) was reported as a main pest on sugarcane plantation. The larvae bored inside the base of sugarcane stem and could reduce the yield production. Some chitinolytic bacteria are often found as a source of a potent biological agent that are useful in contributing on an IPM techniques. The aims of this research were to explore the chitinolytic bacteria and to asses their potential in controlling this pest. Chitinolytic bacteria were iso-lated from sugarcane rhizosphere, extracted boktor larvae, and fresh water that were collected from Subang sugarcane plantation and Cikabayan farm plot. The bacteria were selected using CCA and NA media plus milk. Chitinolytic and pro-teolytic activity, morphological characters, LOPAT test, and bioassay against larvae were studied. The results showed that 105 different colonies of bacteria were isolated from 14 samples. Twenty two colonies of these bacterias had chiti-nolytic and proteolytic activities. Four isolates coded JANr-09, JANr-15, CKBr-06, and CDBw-05 were chosen as candidate bacterias based on their highest acitivities. The colony of CDBw-05 was capable to kill up to 48,75% tested larvae and was not pathogenic to plant bacteria. Chitynolytic bacteria also altered the structure and rigidity of integument, and degraded fat body of larvae. Moreover, the isolated bacteria CDBw-05 produced potent chitinase and protease to control
Dorysthenes larvae and was recomended as potential biocontrol agent.
RINGKASAN
DENDI JULIADI. Eksplorasi Bakteri Kitinolitik Sebagai Agens Pengendali Larva Boktor Dorysthenes sp. (Coleoptera: Cerambycidae) pada Tanaman Tebu. Dibimbing oleh TEGUH SANTOSO, ENDANG SRI RATNA, dan GIYANTO.
Kebutuhan gula nasional meningkat setiap tahun dengan laju konsumsi sekitar 3,3% per tahun. Produksi gula nasional dilaporkan belum mampu meme-nuhi kebutuhan tersebut sehingga diperlukan impor dengan laju sekitar 11,94% per tahun.
Tanaman utama penghasil gula di Indonesia adalah tebu. Serangan hama merupakan salah satu penyebab produktivitas tebu menurun. Dorysthenes sp. (Coleoptera: Cerambycidae) dikenal sebagai hama boktor merupakan hama baru pada perkebunan tebu yang berpotensi menurunkan produksi gula. Saat ini pe-ngendalian boktor telah dilakukan secara terpadu (PHT), namun masih terdapat kendala dalam penerapan komponen-komponen PHT tersebut di lapangan. Oleh sebab itu, komponen PHT hama boktor masih perlu diperkaya dengan menggu-nakan teknik lain yang lebih sesuai agar lebih efektif dan efisien. Salah satu kiat pengendalian yang dapat dilakukan adalah memanfaatkan bakteri kitinolitik yang memiliki kemampuan proteolitik. Bakteri tersebut dilaporkan potensial untuk me-ngendalikan beberapa serangga hama.
Penelitian ini bertujuan mengeksplorasi isolat bakteri kitinolitik (IBK) dari rhizosfer tebu, larva boktor, dan air lebung, serta menguji potensi IBK kandidat (IBKK) dalam menghidrolisis integumen dan mematikan larva boktor. Percobaan ini juga bertujuan mengobservasi karakter morfologi dan fisiologi IBKK, serta me-neliti pengaruh kitinase dan protease yang diproduksi oleh bakteri kitinolitik tersebut pada integumen dan jaringan di dalam tubuh larva boktor. Percobaan ini dilaksanakan mulai bulan Desember 2008 sampai dengan Oktober 2009.
Rhizosfer tebu dan air lebung contoh diambil dari areal perkebunan tebu pabrik gula (PG) Subang dan Kebun Cikabayan IPB, sedangkan larva boktor di-kumpulkan dari PG Subang. Bakteri dari ketiga bahan contoh tersebut diisolasi melalui teknik pengenceran berseri, lalu diseleksi sifat kitinolitik dengan menggu-nakan media coloidal chitin agar (CCA) dan proteolitik dengan nutrient agar yang mengandung susu bubuk skim (NA+susu). Pengukuran aktivitas kedua sifat ter-sebut pada IBK dilakukan secara kualitatif dengan menggunakan media tumbuh yang sama. Diameter koloni serta zona kitinolisis dan proteolisis diamati dan diu-kur setiap hari berturut-turut mulai 1–14 hari setelah inokulasi (HSI) dan 1–7 HSI. Indeks kitinolitik (IK) dan indeks proteolitik (IP) ditentukan berdasarkan hasil pe-ngurangan diameter zona hidrolisis dengan diameter koloni, lalu dibagi dengan diameter koloni bakteri. Isolat bakteri kitinolitik kandidat terpilih jika memiliki nilai kedua indeks tersebut lebih dari satu dan cenderung naik selama inkubasi.
Potensi IBKK dalam menghidrolisis integumen larva dilakukan pada media
mati yang telah dipasteurisasi dalam kultur cair IBKK selama 16 hari. Pengama-tan dilakukan interval 4 hari terhadap perubahan warna dan bau media; warna, struktur, dan rigiditas integumen, serta degradasi jaringan di dalam tubuh larva. Isolat bakteri kitinolitik kandidat dikarakterisasi secara morfologi meliputi bentuk, warna, elevasi, dan tepian koloni; bentuk dan tipe Gram sel; serta secara fisiologi melalui uji LOPAT (levan formation, oxidase activity, potato soft rot, arginine hy-drolysis, tobacco hypersensitivity).
Pada penelitian eksplorasi dan seleksi bakteri kitinolitik diperoleh 23 IBK dari ketiga kelompok bahan contoh yang sebagian besar berasal dari rhizosfer tebu. Dua puluh dua isolat dari IBK tersebut juga memiliki aktivitas proteolitik. Empat IBK yaitu isolat JANr-09, JANr-15, CKBr-06, dan CDBw-05 ditetapkan sebagai IBKK karena memiliki nilai IK dan IP lebih dari satu, serta aktivitas kitino-litik dan proteokitino-litik IBKK tersebut cenderung naik selama inkubasi.
Hasil uji potensi IBKK dalam menghidrolisis integumen larva boktor menun-jukkan bahwa isolat CKBr-06 konsisten memiliki nilai IH paling tinggi setiap hari (1,21–2,70) dibandingkan ketiga IBKK lainnya. Nilai IH isolat CDBw-05 (0,82) pada hari pertama lebih tinggi daripada JANr-09 (0,14) dan JANr-15 (0,00). Pa-da hari kedua, nilai IH isolat CDBw-05 (1,14) tiPa-dak berbePa-da nyata dengan JANr-09 (0,96), kemudian pada hari ketiga nilai IH isolat ini (1,22) tidak berbeda nyata baik dengan JANr-09 (1,43) maupun JANr-15 (1,35). Nilai IH isolat CDBw-05 pada 4–7 HSI (1,19–1,44) lebih rendah daripada 15 (1,67–2,06) dan JANr-09 (1,58–1,98). Nilai IH tertinggi pada hari ketujuh berturut-turut terjadi pada iso-lat CKBr-06 sebesar 2,70; JANr-15 (2,06), JANr-15 (1,98), dan CDBw-05 (1,44).
Jumlah larva boktor mati pada semua perlakuan IBKK kurang 50% dari larva uji. Larva boktor mengalami kematian paling banyak pada perlakuan CKBr-06 (46,25%) ketika 7 HSA. Pada waktu 14 HSA, kematian tertinggi larva terjadi pada perlakuan CDBw-05 (48,75%) namun tidak berbeda nyata dengan CKBr-06 (46,25%). Larva boktor yang tidak aktif makan banyak terdapat pada perlakuan JANr-15 saat 7 HSA (63,75%). Pada waktu 14 HSA, larva seperti ini banyak ter-jadi pada perlakuan 09 (60,00%) tetapi tidak berbeda nyata dengan JANr-15 (48,75%) dan CDBw-05 (47,50%). Perlakuan isolat JANr-JANr-15 mampu mene-kan kehilangan bobot batang tebu paling rendah pada waktu 7 HSA (19,06 g) dan 14 HSA (41,94 g) tetapi tidak berbeda nyata dengan CDBw-05 (20,81 & 44,09 g) dan CKBr-06 (21,49 & 44,20 g). Integumen larva boktor yang mati pada perlakuan isolat JANr-09, CKBr-06, dan CDBw-05 menjadi hitam, berbeda de-ngan warna integumen pada perlakuan isolat JANr-15, kontrol, dan larva hidup.
Berdasarkan hasil pengamatan preparat makrokospis sediaan utuh nunjukkan bahwa media uji serta integumen dan jaringan tubuh larva boktor me-ngalami perubahan akibat aktivitas kitinolitik dan proteolitik isolat CKBr-06 dan CDBw-05 yang terjadi antara 8–16 HSA. Media uji dan integumen larva menjadi hitam dan mengeluarkan bau busuk menyengat. Integumen tersebut menjadi hancur dan lunak, serta jaringan lemak dan jaringan lain di dalam tubuh larva boktor terdegradasi.
Hasil karakterisiasi koloni bakteri menunjukkan bahwa isolat 09, JANr-15, dan CKBr-06 terindikasi sebagai patogen tanaman, sedangkan CDBw-05 konsisten bukan patogen tanaman berdasarkan lima sub uji pada LOPAT. De-ngan demikian, isolat CDBw-05 merupakan isolat potensial untuk dikaji lebih mendalam sebagai agens pengendali larva boktor.
© Hak cipta milik IPB, tahun 2010
Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tin-jauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB
SEBAGAI AGENS PENGENDALI LARVA BOKTOR
Dorysthenes sp. (COLEOPTERA: CERAMBYCIDAE)
PADA TANAMAN TEBU
DENDI JULIADI
Tesis
sebagai salah satu syarat untuk memperoleh
gelar Magister Sains pada
Program Studi Entomologi-Fitopatologi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Boktor Dorysthenes sp. (Coleoptera: Cerambycidae) pada Tanaman Tebu
Nama Mahasiwa : Dendi Juliadi
NIM : A351070091
Disetujui
Komisi Pembimbing
Dr. Ir. Teguh Santoso, DEA. Ketua
Dr. Endang Sri Ratna Dr. Ir. Giyanto, M.Si.
Anggota Anggota
Diketahui
Ketua Mayor Dekan
Entomologi Sekolah Pascasarjana
Dr. Ir. Pudjianto, M.S. Prof. Dr. Ir. Khairil A. Notodiputro, M.S.
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan dengan baik. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Desember 2008 ini ialah hama boktor, dengan judul Eksplorasi Bakteri Kitinolitik sebagai Agens Pengen-dali Larva Dorysthenes sp. (Coleoptera: Cerambycidae) pada Tanaman Tebu.
Terima kasih penulis ucapkan kepada Dr. Ir. Teguh Santoso, DEA, Dr. En-dang Sri Ratna, dan Dr. Ir. Giyanto, M.Si, selaku pembimbing; Dr. Ir. Ruly Anwar, M.Si. sebagai Penguji Luar Komisi, serta Dr. Ir. Aris Toharisman, M.Sc., dan Ir. Djoko Pramono, M.S. yang telah banyak memberi saran. Disamping itu, peng-hargaan penulis sampaikan kepada Badan Penelitian dan Pengembangan Perta-nian yang telah mendanai tugas belajar ini. Ungkapan terima kasih juga disam-paikan kepada Pusat Penelitian Perkebunan Gula Indonesia (P3GI) Pasuruan, PT PG Rajawali II Cirebon, dan PG Subang yang telah memberi kesempatan kepada penulis untuk menempuh pendidikan dan melakukan penelitian di instan-si tersebut. Demikian pula rasa terima kainstan-sih penulis tujukan kepada Bapak Moel-jani (Alm) dan Ibu Metha (Almh); Bapak H. Santoso Martodirjo, SKM. dan Ibu Hj. Asiah Ma’in; serta Mama Dian Nugrahaningsih dan anak-anak kami atas segala doa dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat.
Bogor, Februari 2010
Penulis dilahirkan di Tulungagung pada tanggal 25 Juli 1972 dari Bapak Moeljani (Alm) dan Ibu Metha (Almh). Penulis merupakan putra kedelapan dari sembilan bersaudara. Pada tahun 2001, penulis menikah dengan Dian Nugra-haningsih dan saat ini telah dikaruniai tiga orang anak, yaitu Aziizah Diandi Putri (28-5-2002), Muhammad Rizqi Diandi Putra (30-10-2006), dan Zahra Agustine Diandi Putri (15-8-2008).
Tahun 1991 penulis lulus dari SMA Negeri I Tuban dan pada tahun yang sama diterima masuk IPB melalui jalur USMI (Undangan Seleksi Masuk IPB). Pendidikan sarjana di Jurusan Hama dan Penyakit Tumbuhan diselesaikan oleh penulis pada tahun 1996. Penulis melanjutkan S2 di tempat yang sama pada ta-hun 2007 yang didanai dari beasiswa Badan Penelitian dan Pengembangan Per-tanian. Mayor yang dipilih oleh penulis adalah Entomologi.
Halaman
DAFTAR TABEL ... x
DAFTAR GAMBAR ... xi
DAFTAR LAMPIRAN ... xii
PENDAHULUAN ... 1
Latar Belakang ... 1
Tujuan Penelitian ……….... 3
Manfaat Penelitian ... . 3
Hipotesis ... . 3
TINJAUAN PUSTAKA ... 4
Hama Boktor ... ... 4
Kitin dan Kitinase . ... 6
Bakteri Kitinolitik ... 7
BAHAN DAN METODE ... 9
Waktu dan Tempat ... 9
Persiapan penelitian ... 9
Penanaman Tebu ... 9
Pengumpulan, Pemeliharaan, dan Karantina Larva Boktor .. 9
Pembuatan Media Tumbuh Bakteri ... 10
Metode Penelitian ... 11
Eksplorasi dan Seleksi Bakteri Kitinolitik dan Proteolitik... 11
Eksplorasi Bakteri Kitinolitik ... 11
Seleksi Sifat Kitinolitik dan Proteolitik ... 12
Pengukuran Aktivitas Kitinolitik dan Proteolitik ... 12
Uji Potensi IBKK pada Integumen dan Larva Boktor ... 13
Uji Potensi IBKK dalam Menghidrolisis Integumen Larva Boktor ... 13
Uji Potensi IBKK dalam Mematikan Larva Boktor ... 13
Pengamatan Makroskospis Preparat Sediaan Utuh Larva Boktor... 15
Karakterisasi Morfologi dan Fisiologi IBKK ... 15
Karakterisasi Morfologi ... 15
Halaman
HASIL DAN PEMBAHASAN ... 17
Hasil ... 17
Eksplorasi dan Seleksi IBK ... 17
Potensi IBKK dalam Menghidrolis dan Mematikan Larva Boktor ... 21
Potensi IBKK dalam Menghidrolisis Integumen Larva Boktor ... 21
Potensi IBKK dalam Mematikan Larva Boktor ... 22
Pengaruh Kultur IBKK pada Integumen dan Jaringan Larva Boktor ... 24
Karakter IBKK ... 26
Pembahasan ... 27
KESIMPULAN DAN SARAN ... 37
Kesimpulan ... 37
Saran ... 37
DAFTAR PUSTAKA ... 38
DAFTAR TABEL
Halaman
1 Derajat keasaman dan kepadatan bakteri dalam bahan contoh ... 17
2 Komposisi jumlah koloni bakteri dari bahan contoh berdasarkan aktivitas hidrolisisnya ... 18
3 Aktivitas hidrolisis IBKK pada integumen larva boktor ... 23
4 Kondisi larva boktor yang dipaparkan pada pasta IBKK dalam batang tebu ... 23
5 Pengaruh aktivitas makan larva boktor pada bobot batang tebu ... 24
6 Karakter morfologi IBKK ... 26
DAFTAR GAMBAR
Halaman
1 Siklus hidup hama boktor ... 5
2 Aktivitas kitinolitik IBK rhizosfer, air lebung dan kadaver larva
boktor ... 19
3 Aktivitas proteolitik IBK rhizosfer, air lebung dan kadaver larva
boktor ... 20
4 Aktivitas kitinolitik koloni isolat JANr-09, CDBw-05, CKBr-06, JANr-15,
dan kontrol pada CCA saat 7 HSI ... 21
5 Pengaruh perlakuan isolat JANr-09, JANr-15, CKBr-06, CDBw-05 dan kontrol, terhadap perubahan warna tubuh larva boktor yang mati
saat 14 HSA ... 24
6 Pengaruh kultur IBKK pada larva boktor saat 12 HSA . ... 25
DAFTAR LAMPIRAN
Halaman
1 Bagan alir pembuatan media CIJA larva boktor ... 43
2 Bagan alir uji potensi IBKK dalam mematikan larva boktor ... 44 3 Bagan alir pengamatan makroskopis preparat sediaan utuh larva
boktor ... 45
4 Karakter morfologi serta kemampuan kitinolitik dan proteolitik IB
yang diisolasi dari rhizosfer, kadaver larva boktor, dan air lebung ... 46
5 Perubahan struktur integumen larva boktor pada uji whole mount ... 48
6 Perubahan rigiditas integumen larva boktor pada uji whole mount ... 49
7 Perubahan jaringan dalam tubuh larva boktor pada uji whole mount . 50
8 Aktivitas hidrolisis IBK dari rhizosfer, kadaver larva boktor, dan
Latar Belakang
Kebutuhan gula nasional meningkat setiap tahun akibat pertambahan
pen-duduk, perbaikan pendapatan masyarakat, serta perkembangan industri
maka-nan dan minuman. Laju peningkatan konsumsi gula diperkirakan sekitar 3,3%
per tahun (Mardianto et al. 2005). Pada tahun 2009, produksi gula mencapai
se-kitar 3 juta ton (P3GI 2007; BPS 2008), padahal kebutuhan gula nasional
diperki-rakan lebih dari 4 juta ton sehingga diperlukan impor dengan laju 11,94% per
tahun (Hartono 2002).
Tebu merupakan bahan baku utama pembuatan gula. Salah satu
penye-bab produktivitas tebu menurun adalah serangan hama. Dorysthenes sp.
(Co-leoptera: Cerambycidae) dikenal sebagai hama boktor, dilaporkan sebagai hama
baru yang berpotensi menurunkan kuantitas dan kualitas batang tebu (Pramono
et al. 2000b; 2001a). Kehilangan bobot batang akibat gerekan larva hama ini
mencapai 14%–16% pada saat panen. Batang tebu yang dipanen dapat
tercam-pur bagian pangkal terserang, serbuk gerek, dan tanah sehingga menghambat
proses konversi nira tebu menjadi gula (Pramono et al. 2000a; 2001a).
Hama boktor juga berpotensi menyebar cepat ke perkebunan tebu lain.
Hama ini bersifat polifag dengan preferensi tinggi pada tebu. Larva mampu
hi-dup dalam batang tebu yang ditanam di berbagai jenis lahan. Kedua hal tersebut
menyebabkan larva boktor dapat terbawa ke tempat lain melalui persebaran
batang tebu yang dijadikan bibit (Pramono & Rifal 2001). Serangan hama ini
telah meluas dari delapan hektar pada tahun 1989 (Rifal 1997) menjadi sekitar
6000 hektar tahun 1999 di perkebunan tebu pabrik gula (PG) Subang (Pramono
et al. 2000b) dan menyebar ke tanaman tebu di PG Jatitujuh Cirebon seluas 24
hektar pada tahun 2000 (Pramono 2005).
Usaha pengendalian hama boktor telah dilakukan melalui penerapan paket
pengendalian hama terpadu (PHT) sejak tahun 2000 di PG Subang. Paket
terse-but meliputi pengolahan tanah intensif, pengumpulan larva, penangkapan imago,
sanitasi tunggul tebu, dan aplikasi cendawan entomopatogen Metarrhizium
flavo-viridae Sorokin. Aplikasi insektisida pernah dicoba tetapi mengalami beberapa
hambatan di lapangan. Butiran insektisida dapat ditaburkan di lubang tanam
te-tapi keefektifannya rendah karena persistensi insektisida tersebut pendek.
lebih dari dua bulan. Ragam insektisida sistemik yang tersedia juga sangat
batas (Pramono & Purwantara 2000). Hasil evaluasi penerapan paket PHT
ter-sebut menunjukkan terjadi penekanan 73%–89% populasi larva boktor dan 20%–
31% bobot batang yang hilang (Pramono et al. 2001b; Pramono et al. 2002).
Namun keberhasilan paket PHT ini lebih didominasi oleh peranan pengolahan
tanah intensif, pengambilan larva, dan sanitasi tunggul tebu (Pramono & Rifal
2001).
Saat ini beberapa teknik pengendalian terhadap hama boktor telah
diupa-yakan. Sanitasi tunggul tebu dan pengolahan tanah dilakukan secara intensif,
namun pada akhirnya ditiadakan karena masalah hambatan teknis dan biaya,
se-baliknya aplikasi M. flavoviridae dan penangkapan imago masih dilakukan
mes-kipun memerlukan biaya tinggi serta pengawasan yang lebih ketat. Oleh sebab
itu, komponen PHT hama ini masih perlu diperkaya dengan menggunakan teknik
lain yang lebih sesuai agar pengendalian yang dilakukan lebih efektif dan efisien.
Salah satu kiat yang dapat dilakukan adalah memanfaatkan bakteri kitinolitik
yang memiliki kemampuan proteolitik untuk menekan populasi larva boktor.
Bakteri kitinolitik dan proteolitik banyak terdapat di alam. Bakteri ini
mem-produksi kitinase dan protease yang dapat menghidrolisis kitin dan protein,
pe-nyusun sebagian besar kutikula serangga. Kitin dan protein ini tidak hanya
di-jumpai pada integumen, tetapi juga terdapat pada membran peritrofik yang
memiliki peran vital bagi kehidupan serangga (Mordue & Goldsworthy 1980;
Hepburn 1985; Chapman 1998; Nation 2002; Merzendorfer & Zimoch 2003).
Bakteri tersebut dapat dijumpai di rhizosfer (Kamil et al. 2007), larva serangga
(El-Tarabily et al. 2005; Meca et al. 2009), dan air (Suryanto & Munir 2006;
Pujiyanto et al. 2008).
Kultur bakteri kitinolitik dilaporkan berpotensi mengendalikan serangga
hama. Menurut El-Tarabily et al. (2005), bakteri genus Bacillus dan
Pseudomo-nas dilaporkan dapat mematikan telur dan larva Rhynchophorus ferruginesus
(Coleoptera: Curculionidae) pada tanaman palem di Uni Emirat Arab. Kombinasi
Actinoplanes philippinensis, A. missouriensis, dan Streptomyces clavuligerus
di-laporkan menghambat pembentukan pupa Drosophila melanogaster (Diptera:
Drosophilidae) di Mesir (Galdehak et al. 2005). Meca et al. (2009) melaporkan
bahwa bakteri Serratia sp., Pseudomonas sp., dan Enterobacter aerogenes
tana-man jeruk di Peru. Di Indonesia, isolat bakteri kitinolitik yang berasal dari air
dilaporkan mampu mematikan 86% larva Aedes aegypti Linnaeus (Diptera:
Culicidae) dalam waktu 7 hari (Pujiyanto et al. 2008), sedangkan isolat bakteri
yang berasal dari rhizosfer tanaman cabai dapat mendegradasi integumen imago
Bemisia tabaci (Homoptera: Aleyrodidae) (Mahagiani 2008). Pengujian
peman-faatan bakteri kitinolitik dan proteolitik untuk mengendalikan serangga hama
be-lum banyak dilakukan di Indonesia, khususnya dari famili Cerambycidae pada
tanaman tebu.
Tujuan Penelitian
Tujuan penelitian ini adalah mengeksplorasi bakteri kitinolitik (IBK) dari
rhi-zosfer tebu, larva boktor, dan air lebung di sekitar pertanaman tebu, serta
me-nguji potensi IBK kandidat (IBKK) dalam menghidrolisis integumen dan
memati-kan larva boktor. Percobaan ini juga bertujuan mengobservasi karakter morfologi
dan fisiologi IBKK, serta mempelajari pengaruh kitinase dan protease yang
dipro-duksi oleh bakteri kitinolitik tersebut pada integumen dan jaringan di dalam tubuh
larva boktor.
Manfaat Penelitian
Dari hasil penelitian ini diharapkan dapat diperoleh IBK unggulan yang
te-lah ditetapkan karakter morfologi, fisiologi, dan potensinya dalam mematikan
lar-va boktor, serta diketahui dampak kitinase dan protease yang diproduksi oleh
IBK tersebut pada integumen dan jaringan di dalam tubuh larva boktor. Isolat
bakteri potensial ini diharapkan dapat diteliti lebih mendalam sebagai agens
pengendali hama boktor pada tanaman tebu.
Hipotesis
Hipotesis penelitian ini adalah bakteri kitinolitik banyak terdapat di rhizosfer
tebu, larva boktor, dan air lebung, serta terdapat IBK yang berpotensi sebagai
Hama Boktor
Hama boktor pertama kali ditemukan hanya menyerang delapan hektar
ta-naman tebu di PG Subang pada tahun 1989. Namun pada tahun 1995,
serang-an hama ini meningkat hingga 100 hektar (Rifal 1997), bahkserang-an pada tahun 1999
mencapai 6000 hektar (Pramono et al. 2000b). Setahun kemudian, hama boktor
telah menyebar ke PG Jatitujuh Cirebon (Pramono 2005).
Hama boktor telah ditetapkan sebagai genus Dorysthenes berdasarkan
ha-sil identifikasi dari International Institute of Entomology (Brown 1997). Boktor
me-rupakan serangga polifag dengan preferensi tinggi pada tebu. Dua tipe
kerusak-an tkerusak-anamkerusak-an tebu ykerusak-ang diakibatkkerusak-an oleh larva boktor yaitu kerusakkerusak-an primer
berupa lubang gerek pada pangkal batang dan kerusakan sekunder berupa
bekas gerekan awal oleh larva yang diikuti serangan rayap dan infeksi patogen
(Pramono et al. 2000a; 2001a). Serangan hama ini dapat menyebabkan
keru-sakan berat sehingga mengakibatkan bobot tebu menurun 16% saat panen,
kandungan nira dalam batang sedikit, dan kontaminan bahan baku gula berupa
kotoran larva yang terbawa batang meningkat (Pramono 1997; Pramono et al.
2000b).
Tanaman tebu yang diserang hama boktor menunjukkan gejala seperti
da-un mengda-uning lalu mengering, batang pendek dan roboh, kemudian tanaman
mati. Seringkali dijumpai banyak larva atau kokon di sekitar tanaman bergejala
yang digali serta dalam batang dan tunggul tebu yang dibelah (Pramono 1997;
Pramono et al. 2000a).
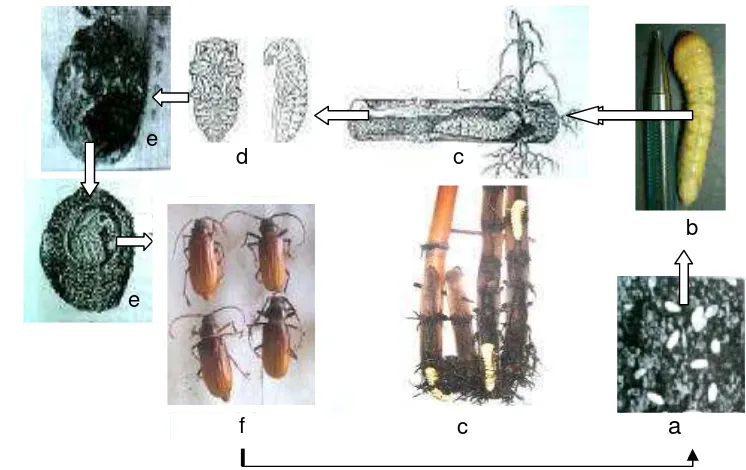
Siklus hidup hama boktor terdiri atas telur, larva, pupa, dan imago (Gambar
1). Imago betina meletakkan telur di sekitar perakaran tanaman tebu dalam
wak-tu 3–4 hari. Telur berbenwak-tuk oval dan pipih, kedua ujungnya meruncing, dan
pan-jang telur sekitar 4–5 mm (Gambar 1a). Rata-rata stadia telur adalah 20 hari.
Telur menetas menjadi larva (boktor) yang merusak tanaman tebu. Bentuk larva
silindris, tanpa tungkai, dan terdiri atas 12 ruas tubuh (Gambar 1b) (Pramono et
al. 2001a). Daur hidup larva antara 20–21 bulan, terbagi dalam 10 instar. Larva
yang berada di dalam tanah menggerek pangkal batang tebu memanjang menuju
ke atas hingga jarak 20–30 cm dari permukaan tanah, kemudian berbalik arah
menuju ke tanah kembali melalui lubang gerek yang sama untuk menggerek
hui mampu hidup pada pangkal batang tebu yang ditanam di berbagai tipe tanah
(Pramono & Rifal 2001). Larva selanjutnya berubah menjadi pupa berbentuk
eksarata (Gambar 1d) dan dilindungi oleh kokon yang terbuat dari campuran
serasah dan tanah (Gambar 1e). Lama hidup pupa rata-rata 20,32 hari.
Kum-bang keluar dari kokon pada awal musim penghujan. KumKum-bang jantan dan
betina memiliki panjang dan lebar tubuh berturut-turut 37,6 mm dan 14,6 mm,
serta 39,4 mm dan 15,6 mm. Antena kumbang jantan dan betina berbentuk
benang dengan panjang melebihi setengah ukuran tubuhnya (Gambar 1f).
Rata-rata lama hidup imago mencapai 53,3 hari (Pramono 2005).
Gambar 1 Siklus hidup hama boktor. Telur (a), larva (b), larva menggerek bibit dan pangkal batang tebu (c), pupa (d), kokon (e), dan imago (f) (Pramo-no et al. 2001; Pramono 2005)
Beberapa teknik pengendalian dalam bentuk paket PHT telah diterapkan
untuk mengendalikan hama boktor. Menurut Pramono & Purwantara (2000)
paket tersebut meliputi pengolahan tanah secara intensif, sanitasi tunggul,
re-planting, pengumpulan larva dan imago, serta aplikasi cendawan entomopatogen
M. flavoviridae Sorokin isolat Subang. Replanting adalah pembongkaran bekas
rumpun tebu yang dilanjutkan dengan pengolahan tanah dan penanaman tebu
kembali. Aplikasi insektisida pernah dicoba tetapi mengalami beberapa hambat-d
c c e
e
b
keefektifannya rendah karena persistensi insektisida tersebut pendek. Butiran
insektisida sulit diaplikasikan di rhizosfer jika tanaman tebu telah berumur lebih
dari dua bulan. Ragam insektisida sistemik yang tersedia untuk mengendalikan
larva boktor juga sangat terbatas. Aplikasi paket PHT berhasil mengendalikan
larva boktor, namun keberhasilan ini lebih didominasi oleh peranan pengolahan
tanah secara intensif, pengambilan larva boktor, dan sanitasi tunggul tebu
(Pramono & Rifal 2001). Hasil evaluasi penerapan paket PHT tersebut
menun-jukkan terjadi peningkatan 8% larva terinfeksi M. flavoviridae, penekanan 73%–
89% populasi larva boktor, dan penurunan 20%–31% bobot batang tebu yang
hilang (Pramono et al. 2001b; Pramono et al.2002).
Kitin dan Kitinase
Kitin merupakan polimer kedua terbanyak di alam setelah selulosa. Bahan
ini disusun oleh monomer N-asetilglukosamin dan dapat didegradasi oleh
kom-plek enzim. Kitin merupakan komponen penyusun tubuh serangga, udang,
kepiting, dan hewan arthropoda lainnya (Skjak-Braek & Sanford 1989). Kitin
menyusun 20%–50% prokutikula yaitu komponen utama kutikula serangga. Di
bagian prokutikula juga mengandung 50% molekul protein yang terletak di antara
serabut kitin. Kitin tidak hanya dijumpai pada integumen, tetapi juga terdapat
pada membran peritrofik yang terletak di saluran pencernaan bagian tengah
(mesenteron) serangga. Bahan ini memiliki peran yang sangat vital bagi
keber-langsungan kehidupan serangga. Fungsi kitin pada integumen antara lain adalah
sebagai kulit pembungkus tubuh serangga, penyangga dan kerangka tubuh;
perlindungan dari penguapan, lingkungan ekstrim, serta serangan patogen dan
predator; sebagai tempat alat indera dan sel kelenjar; serta berperan dalam
proses ganti kulit. Kitin pada membran peritrofik berperan melindungi mikrovili
dari abrasi, infeksi patogen, dan hidrolisis enzim pencernaan (Mordue &
Gold-sworthy 1980; Chapman 1998; Nation 2002; Merzendorfer & Zimoch 2003).
Kitinase merupakan enzim yang mampu menghidrolisis polimer kitin
men-jadi kitin oligosakarida dan N-asetilglukosamin (Chernin et. al. 1996), sedangkan
protease memecah ikatan peptida pada protein (Akhdiya 2003). Kedua enzim ini
diproduksi oleh serangga pada waktu ganti kulit untuk mendegradasi kitin pada
Fenomena ini mengindikasikan kitinase dan protease dapat bersifat mematikan
(detrimental) terhadap serangga itu sendiri sehingga membuka peluang
diguna-kan sebagai agens pengendali hama (Osman et al. 2003; Toharisman 2007).
Bakteri Kitinolitik
Tanah merupakan habitat yang baik bagi kehidupan bakteri sehingga
popu-lasi bakteri tanah cukup berlimpah. Jumlah bakteri berkisar antara 107–1010 sel
per gram berat kering tanah (van Elsas et al. 2003). Sebagian besar mikrob
tanah merupakan pengurai kitin yang baik dan dilaporkan mengandung sekitar
106 mikrob kitinolitik per gram tanah. Bakteri kitinolitik biasanya juga memiliki
kemampuan proteolitik sehingga memproduksi enzim ganda yaitu kitinase dan
protease. Genus bakteri kitinolitik yang sudah banyak dilaporkan antara lain
adalah Aeromonas (Brzezinska & Donderski 2001), Alteromonas,
Chromo-bacterium, Enterobacter, Ewingella, Psudoalteromonas, Pseudomonas, Serratia,
Vibrio (Chernin et al. 1995 & 1996), Bacillus, Stenotrophomonas (Kamil et al.
2007), dan Pyrococcus (Gao et al. 2003).
Kitinase dan protease yang diproduksi oleh bakteri dapat dimanfaatkan
untuk mengendalikan hama melalui teknik kloning, aplikasi ekstrak enzim, atau
penggunaan kultur bakteri. Kajian pemanfaatan kultur bakteri kitinolitik pada
hama menunjukkan hasil yang prospektif. Doust & Gunner 1979 dalam Tanada
& Kaya (1993) pernah mengisolasi bakteri kitinolitik dari larva Limantria dispar
(Lepidoptera: Limantriidae) yang sehat. Kombinasi antara bakteri kitinolitik
tersebut dan bakteri non patogenik dilaporkan mampu meningkatkan kematian
larva serangga tersebut. El-Tarabily et al. (2005) melaporkan bahwa kitinase
yang dihasilkan oleh genus Bacillus dan Pseudomonas dapat mematikan telur,
larva, dan imago Rhynchophorus ferrugineus secara in vitro dan in vivo. Tiga
bakteri kitinolitik dari kelompok aktinomiset, yaitu Actinoplanes philippinensis, A.
missouriensis, atau Streptomyces clavuligerus, dilaporkan mempengaruhi
pembentukan pupa Drosophila melanogaster baik secara aplikasi tunggal atau
kombinasi (Galdehak et al. 2005). Pujiyanto et al. (2008) juga melaporkan
bah-wa isolat bakteri kitinolitik LMB1-5 mampu mematikan 86% larva nyamuk Aedes
aegypty dalam waktu 7 hari. Bakteri kitinolitik yang diisolasi dari rhizosfer
laboratorium (Mahagiani 2008). Bakteri Serratia sp., Pseudomonas sp., dan
Enterobacter aerogenes mampu mematikan 74,1% larva hama jeruk Phyllocnistis
citrella (Meca et al. 2009).
Karakter morfologi dan fisiologi bakteri kitinolitik yang berpotensi sebagai
agens pengendali hama perlu diobservasi untuk menelusuri hubungan dengan
aktivitas kitinolitik dan patogenisitas terhadap tanaman. Karakterisasi morfologi
meliputi tipe Gram dan bentuk sel, serta bentuk, warna, tepian, dan elevasi
kolo-ni. Uji LOPAT terhadap koloni bakteri kitinolitik dilakukan untuk membuktikan
ketiadaan sifat patogenisitas bakteri pada tanaman (Lelliot & Stead 1987)
Waktu dan Tempat
Penelitian ini dilaksanakan mulai bulan Desember 2008 sampai dengan
Oktober 2009. Penelitian dilakukan di Laboratorium Patologi Serangga dan
Laboratorium Bakteri Tumbuhan, Departemen Proteksi Tanaman, Fakultas
Per-tanian, Institut Pertanian Bogor.
Persiapan Penelitian
Penanaman Tebu
Tebu varietas PA 177 yang dominan di PG Subang ditanam di kebun
Cikabayan pada lahan seluas 200 m2, menggunakan metode teknik budidaya
tebu lahan kering (Arsana 1997) pada bulan Desember 2008. Pemeliharaan
tanaman terutama penyiraman dan pengendalian gulma dilakukan secara rutin.
Perbanyakan tanaman tebu ini digunakan sebagai pakan boktor harian dan
bahan pendukung dalam uji berikutnya di laboratorium.
Pengumpulan, Pemeliharaan, dan Karantina Larva Boktor
Pengumpulan larva boktor dilakukan di areal perkebunan tebu PG Subang
dalam dua tahap, yaitu sebelum dan saat replanting tanaman tebu. Sebelum
re-planting (Maret–Juni), larva dikoleksi dari pangkal batang yang terserang dan
bekas tunggul tebu. Pangkal batang dan bekas tunggul tebu dibelah, kemudian
larva hidup yang ditemukan dimasukkan dalam kotak koleksi (Pramono & Rifal
2001). Pada saat replanting (Juli–September), larva boktor yang terangkat ke
permukaan tanah sewaktu pengolahan lahan dikumpulkan dalam kotak koleksi.
Intensitas pengumpulan larva boktor ini dilaksanakan sesuai dengan kebutuhan
kegiatan di laboratorium.
Larva boktor hasil pengambilan dari lapang dipelihara dan dikarantina di
laboratorium minimal satu bulan dengan mengacu pada metode Pramono et al.
(2001a). Larva dipelihara per individu di dalam wadah plastik berdiameter 5–10
cm yang berisi tanah steril dan batang tebu. Kelembaban tanah dijaga dengan
cara menyemprotkan air steril secara periodik, sedangkan pakan diganti secara
rutin. Larva boktor yang dipelihara dan dikarantina di laboratoirum didominasi
Pembuatan Media Tumbuh Bakteri.
Penelitian ini menggunakan beberapa kelompok media tumbuh bakteri,
yai-tu media isolasi, seleksi, induksi, dan produksi (MP). Media isolasi digunakan
untuk menumbuhkan bakteri dari bahan contoh yang terdiri atas nutrient agar
(NA) (3,0 g beef extract; 5,0 g peptone; 2,5 g glucose; 15,0 g agar; 1000,0 ml
akuades), trypticase soy agar (TSA) (15,0 g pancreatic digest of casein; 5,0 g
pancreatic digest of soybean meal; 5,0 g NaCl; 15,0 g agar; 1000,0 ml akuades),
dan Kings’B (20,0 g protease peptone no. 3; 1,5 g K2HPO4; 1,5 gMgSO47H2O,
15,0 ml Glycerol, 15,0 g agar, 1000,0 ml akuades) (Atlas 2005). Media seleksi
dipakai untuk mendeteksi kemampuan kitinolitik dan proteolitik bakteri yang
ter-isolasi yang meliputi coloidal chitin agar (CCA) (5,0 g coloidal chitin; 2,0 g
(NH4)2SO4; 1,1 g Na2HPO4; 0,7 g KH2PO4; 0,2 MgSO47H2O; 1,0 g FeSO4; 1,0 g
MnSO4; 1000,0 ml akuades), crude integumen juice agar (CIJA) (70,0 g jus
integumen; 2,0 g (NH4)2SO4; 1,1 g Na2HPO4; 0,7 g KH2PO4; 0,2 MgSO47H2O; 1,0
g FeSO4; 1,0 g MnSO4; 1000,0 ml akuades), dan NA+susu (NA dicampur 10,0 g
susu bubuk skim) (Akhdiya 2003). Media induksi digunakan untuk
menumbuh-kan dan menstimulasi bakteri kitinolitik memproduksi kitinase sebelum
diinoku-lasikan ke MP yaitu media LB pada konsentrasi 10% diberi 1% crab chitin.
Me-dia produksi dipakai untuk memperbanyak sel bakteri kitinolitik yang terdiri atas
MP (1,0 MgSO47H2O; 10,0 KH2PO4; 10,0 NaCl; 70,0 yeast extract; 30,0 g
coloidal chitin; 1000,0 akuades) (Mahagiani 2008) dan water yeast extract (WYE)
(0,25 g yeast extract; 0,5 g KH2PO4; 1000,0 ml akuades) (Crawford et al. 1992).
Media produksi yang pertama digunakan untuk bakteri yang diduga selain dari
kelompok aktinomiset, sedangkan media produksi yang kedua digunakan untuk
bakteri dari yang diduga dari kelompok aktinomiset.
Media CIJA dibuat dengan menggunakan bahan-bahan dengan komposisi
yang sama dengan media CCA tetapi koloidal kitin diganti dengan jus integumen
larva boktor (Lampiran 1). Bahan integumen diperoleh dengan cara membuang
bagian kapsul kepala larva boktor secara melintang, lalu sisa tubuhnya dibedah
dengan arah membujur di bagian ventral mulai dari anterior menuju posterior.
Integumen larva selanjutnya dibentang di atas alas parafin atau spon dengan
bantuan jarum, lalu isi abdomen dibuang dan jaringan yang menempel pada
integumen larva yang tersisa digunakan sebagai sumber media uji pada uji
potensi IBKK dalam proses hidrolisis integumen larva boktor.
Tujuh puluh gram (sekitar 10 lembar) integumen larva boktor dicuci dengan
larutan Ringer (Osman et al. 2005), kemudian dimasukkan dalam homogenizer
dan diputar pada kecepatan 20.000 rpm selama 5 menit. Jus integumen disaring
dengan menggunakan saringan plastik dan dicampur dengan bahan-bahan lain
pembentuk media CIJA, kemudian dipanaskan dan diaduk di atas stir hot plate
hingga homogen.
Metode Penelitian
Eksplorasi dan Seleksi Bakteri Kitinolitik
Eksplorasi Bakteri Kitinolitik. Pengumpulan rhizosfer tebu, larva boktor, dan air lebung contoh dilakukan di tujuh areal perkebunan tebu PG Subang dan
satu areal kebun Cikabayan Bogor. Lebung merupakan kolam buatan untuk
me-nampung air hujan. Rhizosfer dimasukkan dalam kantong plastik, larva
dikum-pulkan dalam kotak koleksi, dan air lebung contoh ditampung dalam botol plastik,
lalu dibawa ke laboratorium. Semua bahan contoh tersebut diukur pH-nya
de-ngan menggunakan kertas lakmus pH universal.
Ketiga bahan contoh dipersiapkan di laboratorium sebelum pelaksanaan
isolasi. Setiap rhizosfer contoh dicampur merata dan dibersihkan dari kotoran
yang terbawa (El-Tarabily et al. 2005), kemudian dimasukkan kembali dalam
kantong plastik dan disimpan dalam lemari es. Larva boktor dipelihara per
individu dalam toples plastik. Satu ekor larva sehat dan bugar dimatikan, lalu
dibenamkan pada rhizosfer contoh dan dibiarkan selama 2–4 minggu (larva
umpan). Suspensi tanah contoh dan larva umpan dibuat dengan cara
mencam-pur 10 gram rhizosfer atau kadaver larva boktor dalam 100 ml phospat buffer
salin (PBS), sedangkan air lebung contoh diambil 100 ml dan dimasukkan dalam
labu erlemneyer steril. Semua larutan dikocok dengan menggunakan rotary
shaker pada kecepatan 150 rpm dan suhu kamar selama 120 menit.
Isolasi bakteri dilakukan pada setiap bahan contoh dengan menggunakan
teknik pengenceran berseri (Sunatmo 2007). Setiap suspensi pada
masing-masing seri pengenceran disebar pada ketiga media NA, TSA, dan King’s B
yang tumbuh di setiap seri pengenceran dilakukan setiap hari. Kepadatan
bak-teri pada setiap bahan contoh ditentukan dengan menggunakan metode total
plate count.
Semua koloni bakteri yang yang telah diidentifikasi berdasarkan pembeda
karakter morfologi (bentuk, warna, elevasi, dan tepian koloni), serta asal bahan
contoh diisolasi dan dimurnikan pada media NA dengan teknik totol dan gores
kuadran. Setiap koloni bakteri yang telah murni tersebut diberi kode yang
mere-presentasikan habitat, lokasi pengambilan bahan contoh, dan urutan isolasi.
Setiap koloni bakteri yang telah berkode selanjutnya diremajakan pada
me-dia NA secara berkala sebagai koleksi kerja dan me-diawetkan pada cryotube yang
berisi larutan gliserol 20%, lalu disimpan pada suhu -20 ºC sebagai koleksi
jangka panjang (Lacey 1997).
Seleksi Sifat Kitinolitik dan Proteolitik. Seleksi sifat kitinolitik dan proteo-litik semua isolat bakteri (IB) di atas dilakukan pada media selektif. Seleksi
kitinolitik menggunakan metode El-Tarabily et al. (2004) dan Mahagiani (2008)
pada media CCA, sedangkan seleksi proteolitik menggunakan metode Akhdiya
(2003) pada media NA+susu.
Setiap IB diinokulasikan pada media 10% LB dan LB, lalu dikocok dengan
menggunakan rotary shaker pada kecepatan 150 rpm dan suhu kamar selama
24 jam. Selanjutnya, 5 µl kultur cair pada media 10% LB diinokulasikan pada
media CCA dan diinkubasi selama 21 hari, sedangkan pada LB diinokulasikan
pada media NA+susu dan diinkubasi hingga 7 hari. Isolat bakteri yang bersifat
kitinolitik dan proteolitik akan membentuk zona bening (zona hidrolisis) di sekitar
koloni yang tumbuh pada kedua media selektif tersebut. Semua koloni yang
membentuk zona bening tersebut ditetapkan sebagai IBK dan IBP, kemudian
isolat bakteri kitinolitik dan proteolitik ini dimurnikan dan diawetkan kembali pada
media NA.
Pengukuran Aktivitas Kitinolitik dan Proteolitik IBK. Isolat bakteri kiti-nolitik dan IBP diukur aktivitas kitikiti-nolitik dan proteolitik secara kualitatif. Tingkat
kedua aktivitas tersebut diketahui melalui nilai indeks kitinolitik (IK) dan proteolitik
(IP) dengan menggunakan rumus sebagai berikut: Mahagiani (2008)
Diameter zona hidrolisis – diameter koloni bakteri IK atau IP =
Cara kerja pengukuran aktivitas kitinolitik dan proteolitik seperti pada
kegi-atan seleksi sifat kitinolitik dan proteolitik, namun masa inkubasi pada media
CCA hanya 14 hari. Pengamatan dilakukan setiap hari terhadap diameter zona
hidrolisis dan koloni yang yang dibentuk oleh IBK atau IBP secara duplo. Koloni
bakteri yang memiliki nilai IK dan IP lebih dari satu dan aktivitas kitinolitik dan
proteolitik cenderung naik selama inkubasi ditetapkan sebagai IBKK.
Uji Potensi IBKK pada Integumen dan Larva Boktor
Uji Potensi IBKK dalam Menghidrolis Integumen Larva Boktor. Pengu-jian ini dimaksudkan untuk meneliti kemampuan IBKK dalam menghidrolisis
inte-gumen larva boktor yang terdapat pada media CIJA. Satu lup setiap kultur padat
IBKK yang berumur 24–48 jam diinokulasikan dalam 10 ml LB atau WYE. Kultur
cair ini kemudian dikocok dengan menggunakan rotary shaker pada kecepatan
150 rpm dan suhu kamar selama 24 jam. Setiap 5 µl kultur cair IBKK tersebut
diinokulasikan ke 20 titik pada media CIJA.
Rancangan acak lengkap (RAL) digunakan dalam percobaan ini dengan
lima perlakuan yang diulang empat kali. Perlakuan tersebut adalah 1) kultur
isolat JANr-09 diinokulasikan ke media CIJA, 2) kultur isolat JANr-15
diinokulasi-kan ke media CIJA, 3) kultur isolat CKBr-06 diinokulasidiinokulasi-kan ke media CIJA, 4)
kultur isolat CDBw-05 diinokulasikan ke media CIJA, dan 5) kultur isolat KPCr-06
diinokulasikan ke media CIJA (kontrol).
Pengamatan dilakukan setiap hari sampai dengan 7 hari setelah inokulasi
(HSI) terhadap diameter koloni dan zona hidrolisis yang terbentuk. Berdasarkan
kedua diemeter ini selanjutnya dilakukan penghitungan indeks hidrolisis (IH)
seti-ap perlakuan dengan menggunakan rumus seperti pada pengukuran aktivitas
kitinolitik dan proteolitik. Data dianalisis dengan sidik ragam yang dilanjutkan
dengan uji Duncan’S Multiple Range Test (DMRT) pada taraf nyata 5% (SAS
1996).
Uji Potensi IBKK dalam Mematikan Larva Boktor. Pengujian ini me-nggunakan metode El-Tarabily et al. (2005) yang dimodifikasi (Lampiran 2).
Batang tebu dan kultur bakteri perlakuan dipersiapkan terlebih dahulu sebelum
pengujian tersebut dilakukan. Batang tebu yang digunakan dalam percobaan
diberi alkohol 70%. Batang tebu kemudian dibelah secara membujur,
selanjut-nya kedua sisiselanjut-nya dibuat lubang gerek buatan dengan mengorek bagian dalam
batang pada kedalaman 1,00–1,25 cm dari permukaan batang dan panjang
10,00 cm. Bila kedua belahan batang tebu disatukan maka akan terbentuk
lu-bang gerek buatan dengan panjang 10,00 cm dengan diameter 2,00–2,50 cm
yang terletak 10,00 cm dari pangkal batang. Dua lup koloni setiap IBKK
diino-kulasikan dalam 200 ml MP atau WYE steril dan dikocok dengan menggunakan
rotary shaker pada kecepatan 150 rpm dan suhu kamar selama 24 jam. Sel
hidup bakteri uji dihitung kepadatannya dengan menggunakan metode total plate
count. Kepadatan bakteri yang digunakan dalam percobaan ini di atas 1010 CFU
per ml suspensi kultur.
Pelaksanaan setiap perlakuan diawali dengan membuat pasta kultur
bakte-ri uji. Pasta IBKK dibuat dengan cara mencampurkan setiap kultur cair IBKK
dengan 30 g tepung crystalin methyl cellulose (CMC) steril, lalu diaduk hingga
homogen (El-Tarabily et al. 2005). Pasta tersebut selanjutnya dimasukkan dalam
syringe steril tanpa jarum, 10 ml pasta diinokulasikan pada setiap ujung dan
pangkal lubang gerek pada kedua belah batang tebu. Pasta diratakan dengan
menggunakan skalpel steril. Larva boktor ditempatkan di tengah lubang gerek,
lalu kedua belah batang tebu tersebut disatukan kembali. Batang tebu ini
ditim-bang bobot awalnya lalu ditancapkan pada paku yang terdapat di papan kayu.
Papan tersebut ditempatkan pada bak plastik dan direndam air setinggi 1–2 cm.
Air pada bak dimaksudkan untuk menjaga kesegaran batang tebu dan mencegah
larva keluar dari bagian bawah pangkal batang.
Rancangan penelitian yang digunakan adalah RAL dengan lima perlakuan
yang diulang empat kali. Setiap perlakuan diaplikasikan pada 20 ekor larva
bok-tor. Perlakuan-perlakuan tersebut adalah 1) larva dipelihara dalam lubang gerek
berisi pasta isolat JANr-09, 2) larva dipelihara dalam lubang gerek berisi pasta
isolat JANr-15, 3) larva dipelihara dalam lubang gerek berisi pasta isolat
CKBr-06, 4) larva dipelihara dalam lubang gerek berisi pasta isolat CDBw-05, dan 5)
larva dipelihara dalam lubang gerek berisi pasta tanpa bakteri (kontrol).
Pengamatan dilakukan saat 7 dan 14 hari setelah aplikasi (HSA). Peubah
yang diamati adalah bobot batang tebu setelah serbuk gerek dibersihkan dan
jumlah larva yang mati, tidak aktif makan, dan aktif makan. Konfirmasi ulang
IBKK yang terdapat pada larva mati (Meca et al. 2009), selanjutnya dilakukan uji
postulat Koch. Data dianalisis dengan sidik ragam yang dilanjutkan dengan uji
DMRT pada taraf nyata 5% (SAS 1996).
Pengamatan Makroskospis Preparat Sediaan Utuh Larva Boktor. Ke-giatan ini bertujuan untuk meneliti pengaruh kitinase dan protease yang
diproduk-si oleh IBKK pada integumen dan jaringan tubuh larva boktor. Pengamatan
preparat sediaan utuh larva boktor mengacu pada Mahagiani (2008) yang
dimo-difikasi (Lampiran 3). Persiapan kultur IBKK dan pasteurisasi larva boktor
dila-kukan sebelum dipaparkan ke kultur cair setiap bakteri perlakuan. Satu lup kultur
IBKK padat yang berumur 24–48 jam diinokulasikan ke dalam 20 ml MP atau
WYE di gelas kaca, lalu dikocok dengan menggunakan rotary shaker pada
kecepatan 150 rpm dan suhu kamar selama 24 jam. Lima puluh ekor larva
bok-tor instar kelima dimasukkan dalam freezer hingga mati. Kemudian larva
terse-but dikeluarkan dan diaklimatisasi sampai mencapai suhu kamar. Larva boktor
selanjutnya dimasukkan dalam gelas kaca steril yang berisi akuades steril, lalu
ditutup alumunium foil. Larva ini dipasteurisasi tiga kali pada suhu 61 ºC selama
30 menit dalam bak pemanas untuk mengeliminasi mikrob yang berasosiasi
dengan larva.
Pelaksanaan percobaan dilakukan dengan cara memasukkan satu ekor
larva yang telah dipasteurisasi dalam MP yang telah ditumbuhi oleh bakteri
kitinolitik perlakuan, lalu diinkubasi selama 16 hari pada suhu kamar. Larva juga
dipaparkan pada media tanpa IBKK sebagai kontrol. Percobaaan ini dilakukan
secara duplo.
Pengamatan dilakukan interval empat hari sampai dengan 16 HSA secara
destruktif (Juliadi et al. 2005). Dua larva boktor pada setiap perlakuan
dikeluar-kan dari MP, kemudian diamati dan dibedah. Peubah yang diamati adalah
peru-bahan warna serta bau media dan larva, struktur dan rigiditas integumen, serta
degradasi jaringan tubuh larva boktor. Larva dan media tumbuh yang telah
di-amati dibuang. Pengamatan berikutnya dilakukan empat hari kemudian dengan
membongkar media tumbuh dan larva lainnya.
Karakterisasi Morfologi dan Fisiologi IBKK
terba-NA dengan teknik gores kuadran, lalu diinkubasi selama 24–48 jam. Bakteri
tersebut kemudian dikarakterisasi bentuk, warna, tepian, dan elevasi koloninya
(Poinar & Thomas 1978; Sunatmo 2007). Uji Gram pada setiap IBKK
menggu-nakan larutan KOH 3% dan dikonfirmasi ulang dengan pewarnaan Gram. Koloni
bakteri Gram positif akan terpisah dari larutan KOH bila jarum ose diangkat dan
selnya berwarna biru pada uji pewarnaan Gram (Lacey 1997).
Karakterisasi Fisiologi. Karakterisasi fisiologi dilakukan dengan menggu-nakan uji LOPAT untuk mengetahui sifat patogenisitas IBKK pada tanaman. Uji
ini terdiri atas lima sub uji, yaitu pembentukan levan, aktivitas oksidase, aktivitas
pembusukan pada kentang, hidrolisis arginin, dan tembakau hipersensitif (Lelliot
& Stead 1987).
Setiap IBKK ditumbuhkan pada media Levan, digoreskan pada larutan
p-aminodimetilanilin oksalat, ditusukkan ke media arginin, diinfiltrasikan pada irisan
kentang, dan disuntikkan pada daun tembakau. Bakteri tersebut terindikasi
sebagai patogen tanaman bila membentuk koloni dengan elevasi cembung dan
berlendir pada media Levan, warna koloni menjadi ungu gelap dalam waktu
kurang dari 60 detik pada larutan p-aminodimetilanilin oksalat, merubah warna
media arginin menjadi pink, menyebabkan busuk pada kentang dan nekrosis
Hasil Eksplorasi dan Seleksi IBK
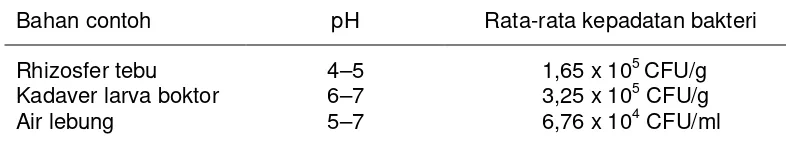
Bakteri diisolasi dari bahan contoh yang terdiri atas enam rhizosfer, empat
kadaver larva boktor, dan empat air lebung. Setiap bahan contoh ini memiliki
de-rajat keasaman dan kepadatan bakteri yang berbeda. Nilai pH pada kadaver
larva boktor relatif mendekati netral dengan kepadatan bakteri paling tinggi,
se-dangkan rhizosfer memiliki nilai pH relatif asam dengan populasi bakteri lebih
rendah daripada kadaver larva boktor. Air lebung bersifat asam hingga netral.
Air lebung yang diambil dari areal perkebunan tebu PG Subang bersifat netral,
sedangkan air lebung dari areal kebun Cikabayan bersifat asam. Kepadatan
[image:34.595.111.504.363.435.2]bakteri yang terkandung di dalam air lebung relatif paling rendah (Tabel 1).
Tabel 1 Derajat keasaman dan kepadatan bakteri dalam bahan contoh
Bahan contoh pH Rata-rata kepadatan bakteri
Rhizosfer tebu 4–5 1,65 x 105 CFU/g Kadaver larva boktor 6–7 3,25 x 105 CFU/g
Air lebung 5–7 6,76 x 104 CFU/ml
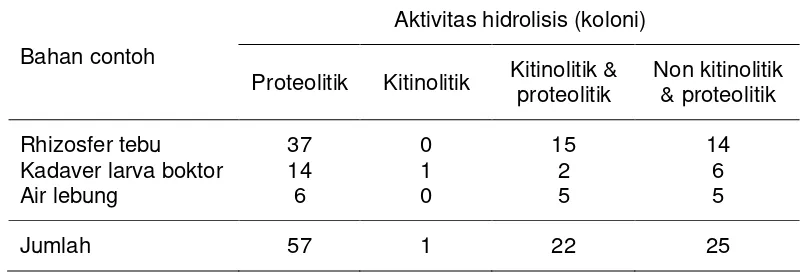
Bakteri yang tumbuh pada media NA, TSA, dan King’s B pada tahap isolasi
memiliki perbedaan morfologi koloni. Bakteri tersebut juga mempunyai
perbe-daan aktivitas hidrolisis terhadap koloidal kitin yang terdapat pada media CCA
atau protein pada media NA+susu. Dari 14 bahan contoh di atas diperoleh 105
koloni bakteri yang berbeda berdasarkan bentuk, warna, tepian, dan elevasi
koloni, serta lokasi dan jenis bahan contoh. Sebagian besar bakteri yang
teriso-lasi tersebut merupakan IBP yang mampu menghidrolisis protein yang terdapat
pada media NA+susu pada waktu 1–7 HSI dan sebagian kecil adalah IBK yang
mampu menghidrolisis koloidal kitin pada media CCA dalam masa inkubasi 1–21
hari. Dua puluh dua koloni dari kelompok IBK tersebut juga memiliki kemampuan
proteolitik. Bakteri proteolitik dan kitinolitik relatif banyak berasal dari rhizosfer.
Koloni yang tidak membentuk zona hidrolisis pada kedua media selektif tersebut
tidak termasuk kelompok bakteri proteolitik maupun kitinolitik (Tabel 2) (Lampiran
4).
kitinoli-Tabel 2 Komposisi jumlah koloni bakteri dari bahan contoh berdasarkan aktivitas hidrolisisnya
Aktivitas hidrolisis (koloni)
Bahan contoh
Proteolitik Kitinolitik Kitinolitik & proteolitik
Non kitinolitik & proteolitik
Rhizosfer tebu 37 0 15 14
Kadaver larva boktor 14 1 2 6
Air lebung 6 0 5 5
Jumlah 57 1 22 25
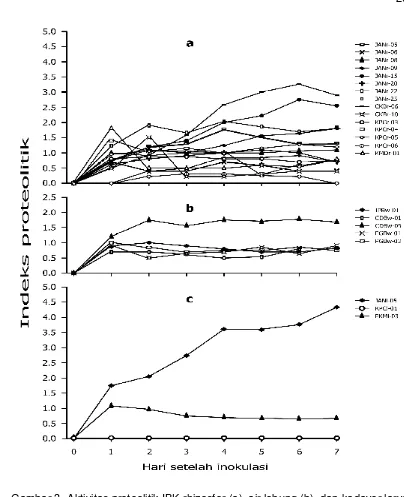
menghidrolis koloidal kitin saat 1–14 HSI, seperti isolat KPCr-06 dan JANl-05
(Gambar 2). Satu IBK dari rhizosfer yaitu isolat CKBr-06 dan satu IBK dari air
lebung yaitu CDBw-05 merupakan IBK unggulan dengan nilai IK di atas satu dan
aktivitas kitinolitiknya cenderung naik selama inkubasi. Isolat CKBr-06 memiliki
nilai IK paling tinggi dan dapat mencapai nilai 6,96 pada 14 HSI. Nilai indeks
kiti-nolitik isolat CDBw-05 adalah 2,56 pada 7 HSI, kemudian aktivitas kitikiti-nolitik isolat
ini tidak dapat diukur sejak 8 HSI karena zona hidrolisis yang terbentuk telah
mencapai tepi cawan petri. Dua IBK lain dari rhizosfer yaitu isolat JANr-09 dan
JANr-15 memiliki nilai IK lebih tinggi dari satu sejak 8 HSI dan aktivitas
kitinolitik-nya cenderung naik selama inkubasi. Nilai IK kedua IBK ini adalah 2,50 dan 1,30
saat 14 HSI (Gambar 2a & 2b). Semua IBK dari kadaver larva boktor memiliki
ni-lai IK di bawah satu dengan kecenderungan aktivitas kitinolitik yang naik sejak 8
HSI (Gambar 2c).
Aktivitas proteolitik semua IBK cenderung berfluktuasi selama inkubasi
de-ngan nilai IP kurang dari 5,00 dan sebagian besar IBK mempunyai nilai IP
ber-kisar 0,00–1,00 (Gambar 3). Isolat CKBr-06 dan JANr-15 memiliki nilai IP di atas
satu saat 3–6 HSI dan masing-masing aktivitas proteolitiknya cenderung naik
berturut-turut hingga mencapai nilai IP 3,27 dan 2,79 saat 6 HSI. Nilai IP isolat
JANr-22 di atas satu pada waktu 2–4 HSI tetapi aktivitasnya cenderung turun
sejak 5 HSI, sedangkan nilai IP isolat JANr-09 lebih tinggi dari satu terjadi sejak 3
HSI dan cenderung naik sampai dengan 7 HSI (Gambar 3a). Isolat CDBw-05
merupakan IBK yang memiliki nilai IP paling tinggi diantara semua IBK dari air
lebung. Isolat ini mempunyai aktivitas proteolitik yang stabil di kisaran 1,50–2,00
[image:35.595.109.509.148.285.2]Gambar 2 Aktivitas kitinolitik IBK rhizosfer (a), air lebung (b), dan kadaver larva boktor (c)
yang berasal dari kadaver larva boktor dan kedua bahan contoh lainnya.
Aktivi-tas proteolitik isolat ini cenderung naik sejak 1–7 HSI dan dapat mencapai nilai IP
Gambar 3 Aktivitas proteolitik IBK rhizosfer (a), air lebung (b), dan kadaver larva boktor (c)
Berdasarkan hasil pengukuran aktivitas kitinolitik dan proteolitik di atas
dite-tapkan empat IBK, yaitu isolat JANr-09, JANr-15, CKBr-06, dan CDBw-05
seba-gai IBKK karena memiliki nilai IK dan IP di atas satu serta aktivitas kitinolitik dan
proteolitiknya cenderung naik selama inkubasi (Gambar 4). Empat IBKK tersebut
terdiri atas tiga isolat bakteri kitinolitik berasal dari rhizosfer tebu dan satu isolat
dari air lebung. Isolat JANr-09 dan JANr-15 diisolasi dari rhizosfer tebu kebun
Cikaba-yan Bogor. Isolat CDBw-05 berasal dari air lebung Cidangdeur Barat PG
Su-bang. Keempat isolat tersebut kemudian diuji potensinya dalam menghidrolisis
integumen dan mematikan larva boktor.
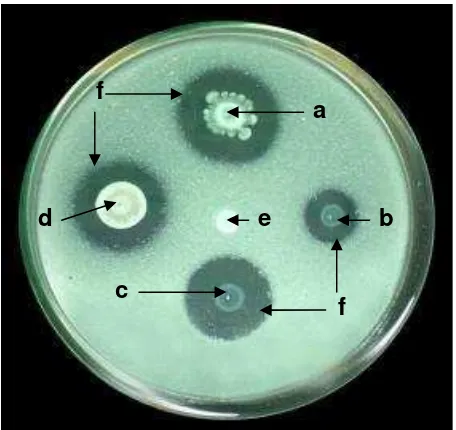
Gambar 4 Aktivitas kitinolitik koloni isolat JANr-09 (a), CDBw-05 (b), CKBr-06 (c), JANr-15 (d), dan kontrol (e) pada CCA saat 7 HSI. Zona bening (f) di sekitar koloni bakteri menunjukkan tingkat aktivitas bakteri dalam menghidrolisis koloidal kitin
Potensi IBKK dalam Menghidrolis Integumen dan Mematikan Larva Boktor Potensi IBKK dalam Menghidrolis Integumen Larva Boktor. Semua IBKK memiliki nilai IH berbeda nyata dengan kontrol sejak 2–7 HSI. Nilai indeks
hidrolisis semua IBKK tersebut mengalami peningkatan setiap hari selama
inku-basi kecuali pada isolat CKBr-06 saat 7 HSI dan CDBw-05 ketika 4 HSI. Isolat
CKBr-06 konsisten memiliki nilai IH paling tinggi setiap hari dibandingkan ketiga
IBKK lainnya (1,21–2,70). Pada hari pertama, nilai IH isolat CDBw-05 (0,82)
lebih tinggi daripada JANr-09 (0,14) dan JANr-15 (0,00). Namun pada hari kedua
nilai IH isolat CDBw-05 (1,14) tidak berbeda nyata dengan JANr-09 (0,96), serta
pada hari ketiga nilai IH isolat ini (1,22) juga tidak berbeda nyata dengan JANr-15
(1,35) dan JANr-09 (1,43). Kemudian nilai IH isolat ini lebih rendah daripada
JANr-09 dan JANr-15 pada hari-hari berikutnya. Nilai IH tertinggi pada hari
ketu-juh berturut-turut terjadi pada isolat CKBr-06 (2,70), JANr-15 (2,06), JANr-15
(1,98), dan CDBw-05 (1,44) (Tabel 3).
a
b
c
d
e
f
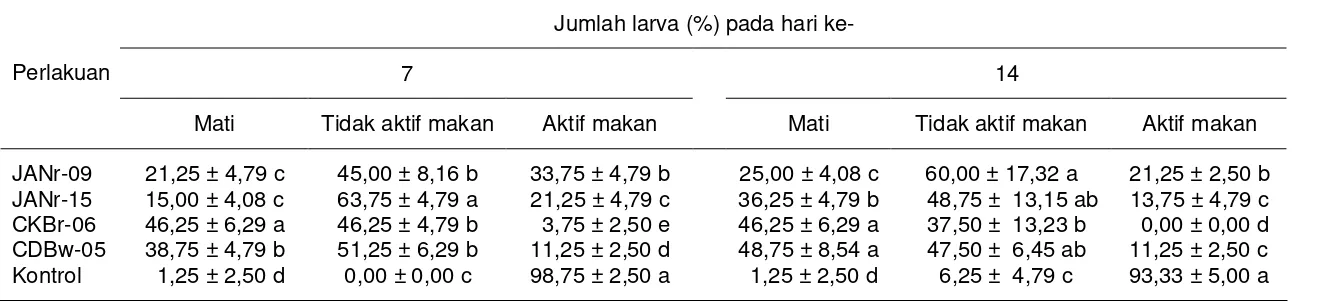
[image:38.595.198.426.181.396.2]Potensi IBKK dalam Mematikan Larva Boktor. Semua IBKK menga-kibatkan larva boktor mati dan tidak aktif makan lebih banyak daripada kontrol
ketika 7 dan 14 HSI. Sebaliknya, jumlah larva yang masih aktif makan pada
kontrol lebih banyak daripada IBKK. Jumlah larva boktor mati pada semua IBKK
kurang 50% dari larva uji. Larva boktor mengalami kematian paling banyak pada
perlakuan isolat CKBr-06 (46,25%) ketika 7 HSA. Pada waktu 14 HSA, kematian
larva tertinggi terjadi pada perlakuan isolat CDBw-05 (48,75%) namun tidak
ber-beda nyata dengan CKBr-06 (46,25%). Larva boktor yang tidak aktif makan
ba-nyak terdapat pada perlakuan isolat JANr-15 saat 7 HSA. Pada waktu 14 HSA,
larva dalam kondisi seperti ini banyak terjadi pada perlakuan isolat JANr-09
(60,00%) tetapi tidak berbeda nyata dengan JANr-15 (48,75%) dan CDBw-05
(48,75%) (Tabel 4).
Semua perlakuan IBKK mampu menekan kehilangan bobot batang tebu
lebih rendah daripada kontrol kecuali pada isolat JANr-09 pada waktu 7 dan 14
HSA. Perlakuan isolat JANr-15 mampu menekan kehilangan bobot batang tebu
paling rendah pada waktu 7 HSA (19,06 g) dan 14 HSA (41,94 g) tetapi tidak
berbeda nyata dengan CDBw-05 (20,81 & 44,09 g) dan CKBr-06 (21,49 & 44,20
g) (Tabel 5).
Tubuh larva boktor yang mati pada semua perlakuan mengalami
peruba-han warna yang relatif berbeda dengan larva yang masih hidup. Perubaperuba-han
war-na tubuh larva tersebut terlihat lebih mencolok pada 14 HSA. Seluruh bagian
tu-buh larva boktor yang mati pada perlakuan isolat JANr-09, CKBr-06, dan
CDBw-05 berwarna hitam, sedangkan bagian posterior tubuh larva boktor yang mati
pada perlakuan JANr-15 berwarna lebih gelap. Tubuh larva boktor yang mati
pa-da kontrol berwarna kusam, sepa-dangkan tubuh larva boktor yang masih hidup
ber-warna cerah (Gambar 5).
Isolasi ulang bakteri kitinolitik perlakuan dari larva boktor yang mati
dipero-leh bakteri dengan karakter koloni yang sama dengan IBKK. Koloni bakteri hasil
Tabel 3 Aktivitas hidrolisis IBKK pada integumen larva boktor
Nilai indeks hidrolisis pada hari ke- Perlakuan
1 2 3 4 5 6 7
JANr-09 0,14 ± 0,19 c 0,96 ± 0,19 cb 1,43 ± 0,17 b 1,58 ± 0,09 b 1,66 ± 0,14 b 1,89 ± 0,48 c 1,98 ± 1,71 b JANr-15 0,00 ± 0,00 c 0,91 ± 0,13 c 1,35 ± 0,11 b 1,67 ± 0,22 b 1,88 ± 0,20 b 1,90 ± 0,09 b 2,06 ± 2,01 b CKBr-06 1,21 ± 0,12 a 1,89 ± 0,17 a 2,48 ± 0,52 a 2,55 ± 0,16 a 2,73 ± 0,20 a 2,87 ± 0,27 a 2,70 ± 2,92 a CDBw-05 0,82 ± 0,14 b 1,14 ± 0,10 b 1,22 ± 0,07 b 1,19 ± 0,07 c 1,25 ± 0,14 c 1,28 ± 0,2 d 1,44 ± 1,23 c Kontrol 0,00 ± 0,00 c 0,00 ± 0,00 d 0,00 ± 0,00 c 0,00 ± 0,00 d 0,00 ± 0,00 d 0,00 ± 0,00 e 0,00 ± 0,00 d
Ket: Rata-rata selajur yang diikuti oleh huruf yang sama tidak berbeda nyata berdasarkan uji DMRT (α=0,05)
Tabel 4 Kondisi larva boktor yang dipaparkan pada pasta IBKK dalam batang tebu
Jumlah larva (%) pada hari ke-
7 14
Perlakuan
Mati Tidak aktif makan Aktif makan Mati Tidak aktif makan Aktif makan
JANr-09 21,25 ± 4,79 c 45,00 ± 8,16 b 33,75 ± 4,79 b 25,00 ± 4,08 c 60,00 ± 17,32 a 21,25 ± 2,50 b JANr-15 15,00 ± 4,08 c 63,75 ± 4,79 a 21,25 ± 4,79 c 36,25 ± 4,79 b 48,75 ± 13,15 ab 13,75 ± 4,79 c CKBr-06 46,25 ± 6,29 a 46,25 ± 4,79 b 3,75 ± 2,50 e 46,25 ± 6,29 a 37,50 ± 13,23 b 0,00 ± 0,00 d CDBw-05 38,75 ± 4,79 b 51,25 ± 6,29 b 11,25 ± 2,50 d 48,75 ± 8,54 a 47,50 ± 6,45 ab 11,25 ± 2,50 c Kontrol 1,25 ± 2,50 d 0,00 ± 0,00 c 98,75 ± 2,50 a 1,25 ± 2,50 d 6,25 ± 4,79 c 93,33 ± 5,00 a
Ket: Rata-rata selajur yang diikuti oleh huruf yang sama tidak berbeda nyata berdasarkan uji DMRT (α=0,05)
[image:40.842.113.782.308.459.2]Tabel 5 Pengaruh aktivitas makan larva boktor terhadap bobot batang tebu
Bobot batang tebu yang hilang (g) pada hari ke- Perlakuan
7 14
JANr-09 24,49 ± 3,30 ab 46,07 ± 0,56 ab JANr-15 19,06 ± 3,11 c 41,94 ± 2,25 b CKBr-06 21,49 ± 2,64 bc 44,20 ± 3,32 b CDBw-05 20,81 ± 0,98 bc 44,09 ± 3,15 b Kontrol 25,95 ± 3,09 a 50,32 ± 6,14 a
Ket: Rata-rata selajur yang diikuti oleh huruf yang sama tidak berbeda nyata berdasarkan uji DMRT (α=0,05)
Gambar 5 Pengaruh perlakuan isolat JANr-09 (a), JANr-15 (b), CKBr-06 (c), CDBw-05 (d), dan kontrol (e) terhadap perubahan warna tubuh larva boktor yang mati saat 14 HSA. Tubuh larva boktor yang masih hidup berwarna cerah (f)
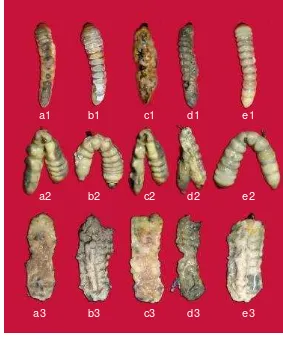
Pengaruh Kultur IBKK pada Integumen dan Jaringan Larva Boktor.
Dua kultur IBKK mempengaruhi struktur dan rigiditas integumen, serta jaringan
tubuh larva boktor. Kultur isolat CKBr-06 dan CDBw-05 menyebabkan
integu-men larva boktor integu-menjadi hancur sejak 12 HSA, sedangkan kultur isolat JANr-09,
JANr-15, dan kontrol tidak berpengaruh terhadap integumen tersebut. Kultur
iso-lat CDBw-05 mengakibatkan integumen larva boktor menjadi lunak sejak 8 HSA,
sedangkan kultur JANr-09 dan CKBr-06 dapat melunakkan integumen mulai 12
HSA. Baik kultur isolat JANr-15 dan kontrol tidak dapat melunakkan integumen
10
mm
[image:41.595.101.509.311.521.2]larva boktor selama inkubasi. Kultur isolat CDBw-05 mampu mendegradasi
tubuh lemak dan jaringan lain dalam tubuh larva sejak 12 HSA, sedangkan kultur
CKBr-06 menghancurkan tubuh lemak dan jaringan tersebut sejak 16 HSA
[image:42.595.170.453.195.534.2](Gambar 6 & Lampiran 5–7).
Gambar 6 Pengaruh kultur IBKK pada larva boktor saat 12 HSA. Larva boktor dipaparkan pada kultur isolat JANr-09 (a1–a3), JANr-15 (b1–b3), CKBr-06 (c1–c3), CDBw-05 (d1–d3), dan kontrol (e1–e3). Struktur in-tegumen (gambar baris atas), rigiditas inin-tegumen (gambar baris te-ngah), dan tubuh larva dibedah secara membujur (gambar baris ba-wah). Integumen hancur (c1 & d1) dan lunak (c2 & d2), serta jaringan tubuh larva terdegradasi (c3 & d3)
Berdasarkan tingkat aktivitas hidrolisis terhadap integumen, kemampuan
dalam mematikan larva, serta pengaruh kultur IBKK pada larva boktor maka
isolat CKBr-06 dan CDBw-05 merupakan IBKK unggulan. Kedua bakteri ini
mampu menghidrolisis dan menghancurkan integumen, jaringan dalam tubuh
lar-va, serta mematikan hampir 50% larva boktor uji.
a1
d2 c2
b2 a2
e1 d1
c1 b1
c3 b3
a3
e2
Karakter IBKK
Semua IBKK memiliki morfologi koloni yang berbeda dan merupakan
bak-teri Gram positif atau negatif. Dua bakbak-teri dari rhizosfer memiliki bentuk sel
ba-tang dan merupakan bakteri Gram positif, sedangkan satu bakteri dari rhizosfer
lainnya merupakan bakteri Gram negatif yang mempunyai bentuk sel batang.
Satu IBKK dari air merupakan bakteri Gram negatif, sedangkan bentuk sel
bakteri ini cenderung batang. Koloni semua IBKK berbentuk sirkular atau
iregu-lar dengan warna putih yang bervariasi; tepian berlekuk (undulate), berfilamen
(filamentus) atau rata (entire); serta elevasi datar (raised) atau cembung (convex)
(Tabel 6 & Gambar 7).
Tabel 6 Karakter morfologi IBKK
Koloni Kode isolat Tipe Gram Bentuk sel
Bentuk Warna Tepian Elevasi
JANr-09 + Batang Iregular Putih susu Undulate Raised
JANr-15 + Batang Sirkular Putih susu Filamentus Raised
CKBr-06 - Batang Sirkular Putih kusam Undulate Raised
CDBw-05 - Cenderung
batang Sirkular kekuningan Putih Entire Convex
Uji LOPAT pada semua IBKK menunjukkan hasil yang bervariasi antar sub
uji yang dilakukan. Tiga IBKK, yaitu JANr-09, JANr-15, dan CKBr-06 terindikasi
menyebabkan penyakit pada tanaman, sedangkan CDBw-05 konsisten bereaksi
negatif pada semua sub uji (Tabel 7). Isolat CDBw-05 bukan sebagai bakteri
patogen tanaman berdasarkan uji tersebut.
Tabel 7 Karakter LOPAT IBKK
LOPAT Kode
isolat Levan
formation Oxydase activity Potato soft rot Arginin hydrolisis Tobacco hypersensitivity
JANr-09 + + + - +
JANr-15 - + + - -
CKBr-06 - + + + +
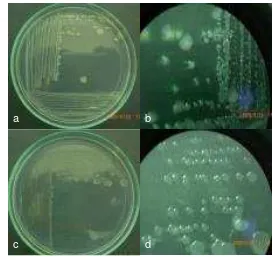
Gambar 7 Karakter morfologi isolat CDBw-05 (gambar baris atas) dan CKBr-06 (gambar baris bawah). Pertumbuhan koloni pada NA (a & c) dan koloni terlihat pada perbesaran 40 kali (b & d) saat 4 HSI.
Pembahasan
Kepadatan bakteri berbeda antara setiap kelompok bahan contoh.
Kepa-datan bakteri dari yang paling tinggi berturut-turut dijumpai pada kadaver larva
boktor, rhizosfer, dan air lebung. Kadaver larva boktor merupakan subtrat yang
dapat dimanfaatkan sebagai sumber nutrisi dan energi bagi pertumbuhan bakteri
yang mengkolonisasi larva tersebut. Pertumbuhan bakteri pada larva juga
didu-kung oleh kondisi kadaver yang memiliki pH mendekati netral dan proses
degra-dasi berlangsung dalam rhizosfer. Paul (2007) menyatakan bahwa bakteri
mam-pu tumbuh pada kisaran pH 4,0–9,0 dan pertumbuhannya optimum pada pH 6,5–
7,5. Bakteri mendominasi daerah rhizosfer karena pertumbuhannya didukung
oleh nutrisi yang dilepaskan jaringan tanaman. Sebagian besar bakteri yang
ber-asal dari perairan sulit ditumbuhkan pada media umum yang ada di laboratorium
(Lay & Hastowo 1992). Hasil yang relatif sama untuk bakteri dari air juga
dilapor-kan oleh Pujiyanto et al. (2008).
Seratus lima IB yang berbeda karakter morfologi koloninya berhasil
diisola-si dari 14 bahan contoh. Hadiisola-sil isoladiisola-si tersebut diduga belum merepresentadiisola-sikan
a
c
b
ragam bakteri yang ada dalam bahan contoh. Hal ini disebabkan variasi media
isolasi yang digunakan terbatas dan diduga banyak bakte