SELECTION OF INDIGENOUS LACTIC ACID BACTERIA
FROM INDONESIA FOR CHEESE STARTER
ViskaAwalia Susanti1, Nurheni Sri Palupi1, Yopi2
1
Department of Food Science and Technology, Faculty of Agricultural Technology, Bogor Agricultural University, IPB Darmaga Campus, PO Box 220, Bogor, West Java, Indonesia
2
Indonesian Science Institute, Raya Bogor KM 46, Cibinong 16911, Bogor, West Java, Indonesia
Phone: +6285731348465, ema
ABSTRACT
Indonesia was a tropical country which high of an organism biodiversity, include to their microorganism such like the Lactic Acid Bacteria that familiar to food spontaneous fermentation. However, the exploration to Indonesia’s LAB was rarely. In the other hand, cheese and their derivatives was a famous food product in Indonesia. The LAB can being indigenous commercial starter for the exploration. Therefore, the objects of this research were (1) to screen LIPI Cibinong’s LAB isolates which have high potential to make coagulum; and (2) to get the selected cheese starter from the high potential isolates. The research methods which will used to get the high potential isolates were screening acid potential, screening protease potential, and screening coagulant potential; and to get the selected cheese starter were making a high potential isolates growth curve and assaying to cheese laboratory made with parameters: measurement of pH, rennet activity assays,yield calculations and sensory test. The result of this research were (1) from the 39 LIPI Cibinong’s isolates, DR 1-7-1 was the high acid potential isolate with Lactic Acid Index 3.25, DSB 4-2 was the high protease potential isolate with Protease Index 3.82, DR 2-2-3 and DSB 4-2 were the high coagulant potential with form coagulum time on 24 hours; and (2)the optimum growth of DR 2-2-3 and DSB 4-2 were 24 hours and the selected cheese starter was DR 2-2-3 isolate 6% with rennet 0.01% because thatconcentration combination of starter and rennet, can make the forming time of coagulum to be faster than control. That was 6 minutes (control) to be 3 minutes (DR 2-2-3 6% with rennet 0.01%)
Viska Awalia Susanti. F24080045.Seleksi Bakteri Asam Laktat Indigenous Indonesia untuk Starter Keju. Dibawah Bimbingan Nurheni Sri Palupi dan Yopi. 2012.
RINGKASAN
Indonesia merupakan negara yang terkenal dengan keragaman hayati yang tinggi,termasuk di dalamnya bakteri asam laktat (BAL) yang banyak berperan pada proses fermentasi spontan produk pangan. Peranan BAL pada produk pangan fermentasi dapat menambah keragaman potensi mikroba lokal khususnya sebagai starter indigenous Indonesia komersial.Namun,pemanfaatan BAL di Indonesia masih tergolong rendah (Fratiwi et al. 2008) sedangkan keju merupakan produk olahan susu yang sudah tidak asing lagi di Indonesia. Oleh karena itu, pada penelitian ini dilakukan pemilihan Bakteri Asam Laktat indigenous Indonesia untuk starter keju skala laboratorium dengan rennet sebagai koagulan.
Tahapan penelitian yang dilakukan dalam penelitian ini terdiri atas skrining, pembuatan kurva pertumbuhan dan pengujian dalam pembuatan keju. Skriningdapat dilakukan untuk pemilihan isolat berpotensi tinggi dalam pembentukan koagulum. Skriningyang dilakukan terdiri atasskrining potensi asam,skriningpotensi protease dan skriningpotensi koagulasi dengan medium berturut-turut adalah MRSA+CaCO3 0.5%, SMAdan susu pasteurisasi. Starter terpilih didapat
dengan cara pembuatan kurva pertumbuhan dengan medium MRSB dan menggunakan alat spektrofotometer λ 660 dan pengujian dalam pembuatan keju skala laboratorium dengan koagulan rennet Fromase® 50. Parameter yang diujikan dalam penentuan starter terpilih terdiri atas pengukuran pH, pengujian aktivitas rennet, penghitungan rendemen dan penilaian sensori.
I. PENDAHULUAN
1.1
LATAR BELAKANG
Indonesia merupakan negara yang terkenal dengan keragaman hayati yang tinggi. Berbagai jenis tumbuhan, hewan, hingga mikroorganisme, semua tersedia melimpah di Indonesia (Machmud 2001). Begitu juga pada Bakteri Asam Laktat yang banyak berperan pada proses fermentasi spontan produk pangan. Peranan BAL pada produk pangan ini, dapat menambah keragaman potensi mikroba lokal khususnya sebagai starter indigenous Indonesia komersial. Fratiwi et al. (2008) menyatakan bahwa pemanfaatan BAL dan khamir yang banyak terdapat di alam Indonesia perlu dilakukan untuk menambah atau memperkaya koleksi mikroba, sehingga dapat dimanfaatkan sebagai starter dalam berbagai industri.
Keju adalah produk turunan susu yang digumpalkan dengan enzim penggumpal atau asam(Ditjen PPHP Deptan 2012) dansudah tidak asing lagi di Indonesia. Beberapa jenis produk keju yang berada di Indonesia yaitu keju lokal maupun impor, keju olahan, serta produk-produk pangan berisi dan bertabur keju.
Pemanfaatan BAL Indonesia dalam proses pembuatan keju yang sudah tidak asing lagi di Indonesiadapat dilakukan berdasarkan perannya sebagai pembuat suasana asam yang berpengaruh pada kecepatan proses koagulasi dan pembentuk citarasakeju (Daulay 1991). Oleh karena itu, dilakukan penelitian skala laboratorium tentang pemilihan Bakteri Asam Laktat indigenous Indonesia untuk starter keju dengan rennet komersial sebagai koagulan.
1.2
TUJUAN
Tujuan penelitian ini adalah (1) memilih isolat BAL indigenous koleksi LIPI-Cibinong yang berpotensi dalam pembentukan koagulum, dan (2) menentukan isolat BAL yang berpotensi tersebut menjadi starterkeju terpilih.
1.3
MANFAAT
II. TINJAUAN PUSTAKA
2.1
PENGOLAHAN KEJU
Food and agriculture organization (FAO) dari Perserikatan Bangsa-Bangsa menyusun suatu Pedoman Umum yang memberikan definisi sebagai berikut: keju adalah produk segar atau peram yang dihasilkan dengan pemisahan cairan (whey) dari koagulan setelah penggumpalan susu, krim, skim, susu mentega atau kombinasi diantaranya. Namun, definisi ini tidak berlaku untuk keju whey dan keju yang dibuat dengan proses-proses baru. Oleh karena itu, disusun definisi kedua untuk keju whey sebagai berikut: keju whey adalah produk yang dihasilkan dengan penggumpalan whey dengan atau tanpa penambahan susu atau lemak susu. Dengan demikian, definisi ini berlaku untuk keju Ziger (Jerman), keju Mysost dan Gjetost (Skandinavia), serta keju Urda (Romawi) (Daulay 1991).
Keju adalah salah satu produk turunan susu yang mengandung protein, vitamin, mineral, lemak jenuh dan kolesterol. Keju juga merupakan salah satu sumber terbaik kalsium dan juga mungkin mengandung tinggi sodium dan lemak jenuh. Satu setengah ons penyajian keju segar memiliki jumlah kalsium yang sama dengan satu cup susu atau yoghurt, yaitu sebesar 12 hingga 14 gram total lemak, 9 gram asam lemak jenuh, 44 mg kolesterol, dan 173 kalori. Sedangkan untuk kandungan sodium, satu cup susu memiliki kandungan sebesar 120 mg dan satu setengah ons keju segar memiliki kandungan sebesar 110 – 450 mg (Agricultural Marketing Service 1995).
Kualitas keju bergantung pada kualitas susu segar dan umur starter yang digunakan. Starter dapat diperoleh secara langsung dari suplier atau secara tidak langsung dari yoghurt atau buttermilk. Tekstur dan citarasa keju selain bergantung pada jenis starteryang digunakan, juga bergantung pada kandungan lemak susu, dan banyak sedikitnya kandungan air di keju. Susu memiliki kontribusi dalam penentuan kadar lemak dan air keju (Flores 2008).
Beberapa jenis keju, bau busuk atau off-flavours yang dihasilkan berasal dari jenis starter yang digunakan, ketidakcocokan strain atau campuran strain yang tidak seimbang dalam produksi asamnya, dan keberadaan antibiotik atau senyawa penghambat pertumbuhan lainnya. Hal ini dapat menyebabkan kegagalan keju, tingginya pH, dan tingginya kelembaban curd (Rose 1983).
Terdapat empat patogen yang harus diwaspadai dalam keamanan pangan keju khususnya keju segar yaituSalmonella spp., Escherichia coli, Listeria monocytogenes, dan Staphylococcus aureus. Namun keempat patogen tersebut dapat dikontrol dari sanitasi peralatan, pekerja, ruangan,
3
dan udara, kebersihan bahan baku keju serta mencegah adanya kemungkinan kontaminasi silang hingga keju siap konsumsi (Flores 2008).
Susu sapi mengandung 88% air dengan 3,7% lemak, 3,4% protein, 4,8% laktosa, dan 0,7% vitamin dan mineral (USDA 2005 dalam Flores 2008). Proses pembuatan keju menjadikan pembentukan curd dari padatan susu seperti lemak, protein dan mineral yang dipisahkan dan dikonsentrasikan. Sedangkan whey mengandung laktosa, air, protein sederhana, vitamin dan mineral (Hill 2006 dalam Flores 2008).
Pembuatan keju sangat dinamis prosesnya tergantung dari waktu, suhu, Bakteri Asam Laktat yang digunakan, dan enzim penggumpal (rennet) yang digunakan untuk mengonsentrasi dan memisahkan kasein susu dan lemak dari whey. Pengecualian untuk keju Queso Fresco atau Queso Blanco dari Amerika Latin dan Paneer dari India, keju tersebut dibuat tanpa menggunakan starter BAL dan rennet. Keju itu dibuat dari susu pasteurisasi yang ditambahkan asam seperti vinegar dari jus buah sehingga kasein susu mengendap. Tipe keju segar ini sangat mudah dibuat dan memiliki hasil yang banyak karena semua whey protein secara normal akan ikut terperangkap dalam curd yang terbentuk seperti gel. Jika gel sudah cukup kuat, lalu dipotong kecil-kecil dan dimasak hingga whey terpisah. Penghilangan whey mungkin akan menyebabkan curd menjadi kering sehingga curd dicuci dengan air untuk menambah kelembabannya. Suhu pemasakan dan penanganan curd akan berefek pada tekstur curd dan produk akhir yang dihasilkan. Jika curd tinggi kelembaban dan asamnya, garam dapat ditambahkan untuk menurunkan kelembaban dan memberi citarasa. Setelah penggaraman, curd dicuci lagi dengan air untuk menambah kelembabannya kembali. Lalu dimasukkan dalam alat pengepres sekaligus pencetak untuk memberi bentuk akhir produk. Sebelumnya, curd dibungkus terlebih dahulu dengan kain kasa. Saat pengepresan ini dapat ditambahkan kapang atau bakteri lain untuk proses pemeraman lanjut (Flores 2008).IDF (International Dairy Federation) (1981) dalam Daulay (1991) telah membuat katalog keju berdasarkan karakteristik-karakteristiknya yang tercantum pada Tabel 1.
2.2
BAKTERI ASAM LAKTAT
Bakteri Asam Laktat adalah bakteri yang mampu memfermentasikan gula atau karbohidrat untuk memproduksi asam laktat dalam jumlah besar. Ciri-ciri Bakteri Asam Laktat secara umum adalah selnya bereaksi positif terhadap pewarnaan Gram, bereaksi negatif terhadap katalase dan tidak membentuk spora. Sejauh ini diketahui bahwa Bakteri Asam Laktat tidak bersifat patogen dan aman untuk dikonsumsi sehingga dapat dipakai untuk meningkatkan kesehatan baik manusia maupun ternak (Widyastuti dan Eva 1999).
4
genus Streptococcus dan Leuconostoc dari famili Streptoccaceae dan genus Lactobacillus dari famili Lactobacillaceae (Daulay 1991).
Bakteri Asam Laktat tersebar luas dalam beberapa habitat. Mereka mampu hidup dalam lingkungan berkadar karbohidrat tinggi, produk hancuran protein, vitamin dan rendah oksigen. Energi ATPnya didapat dari proses fermentasi dengan produk akhir fermentasi adalah sebagian besar asam laktat dan beberapa produk lain tergantung dari jenis fermentasi spesies BAL.
Tabel 1. Metode IDF untuk pengelompokan keju
Karakteristik
Macam (berdasarkan urutan konsumen)
Bahan baku Susu sapi, susu domba, susu kambing,
susu kerbau, kasein, albumin dan globulin
Konsistensi Keju sangat keras, keju keras, keju semi keras dan semi lunak, keju lunak, keju segar, keju dadih asam
Penampakan internal Berlubang bulat besar, berlubang bulat medium, berlubang bulat kecil, berlubang irregular, tanpa lubang, berlurik kapang hijau biru, berlutik kapang putih,
penambahan rempah-rempah, penambahan herbal
Penampakan eksternal Berkulit kering dan keras, berkulit keras dengan permukaan lengket, berkulit kering dan lunak, berkulit lunak dengan
permukaan lengket, berkulit lunak dengan kapang putih, berkulit lunak dengan kapang hijau, berkulit lunak dengan lapisan parafin, tanpa kulit
Lemak dalam bahan kering Keju dari susu skim, keju dari susu berlemak
Kandungan air Standar perdagangan, standar
diundangkan, nilai rataan
Homofermentasi menghasilkan lebih dari 80% asam laktat, sedangkan heterofermentasi menghasilkan 50% atau lebih asam laktat dan sisanya berupa asam asetat, format, karbon dioksida, dan etanol.
5
asam laktat dalam konsentrasi tinggi, kemampuannya dalam menekan pertumbuhan mikroorganisme lain, adalah keunggulannya dalam mempertahankan hidup di lingkungan yang berbeda-beda (Rose 1983).
Dalam pembuatan keju, BAL berperan dalam pembentukancurd karena BAL akan mengubah laktosa menjadi asam laktat sehingga pH susu akan turun. Dengan penurunan pH ini (menuju pH isoelektris), kasein susu sebagai protein akan mengendap dengan memerangkap beberapa padatan susu lainnya sehingga akan terpisah antara padatan (curd) dan cairan (whey) susu (Hill 2006 dalam Flores 2008). Selain itu, nilai pH rendah pada keju segar (5,0-5,2) membantu menekan pertumbuhan bakteri patogen dan bakteri pembusuk sehingga produk menjadi lebih awet. Bakteri Asam Laktat juga menghasilkan sekelumit aktivitas proteolitik dan lipolitik. Pada tingkatan yang lebih kecil, bakteri ini membantu proses pematangan keju. Karakteristik BAL yang dipilih untuk starter keju adalah yang memiliki kecepatan pertumbuhan tinggi, mampu meningkatkan keasaman, tahan terhadap bakteriofag dan antibiotik, menghasilkan senyawa-senyawa citarasa yang diharapkan, serta keseragaman produk akhir tiap kali produksi.
Suhu yang biasanya digunakan untuk inkubasi kultur starter keju adalah 21,1-22,2 °C. Suhu sangat baik untuk pertumbuhan mikroorganisme kultur, tetapi mikroorganisme kontaminan pada susu pasteurisasi tidak dapat tumbuh. Suhu diatas 23,9 °C memungkinkan tumbuhnya mikroorganisme lain. Lama inkubasi tidak tergantung dari tinggi rendahnya suhu inkubasi yang digunakan. Namun, bergantung pada jumlah inokulum yang diinokulasi dan karakteristik inokulum tersebut. Lama inkubasi tidak selalu sama untuk setiap kali periode pembiakan. Untuk memperoleh hasil akhir starter yang berkualitas baik, jumlah inokulum biasanya 1% (v/v) dari susu medium dan diinkubasi selama 14-16 jam pada suhu 22,2 °C (Daulay 1991).
2.3
SKRINING BAL UNTUK PEMBUATAN KEJU
Menurut arti katanya, skriningadalah suatu tindakan atau tes yang dilakukan terhadap suatu objek untuk mengetahui karakteristik dari objek itu sehingga bisa diseleksi dan diidentifikasi untuk tujuan tertentu. Jadi, dapat diartikan bahwa skriningpada Bakteri Asam Laktat adalah suatu tindakan atau tes untuk mengetahui karakter dari BAL tersebut sehingga dapat diseleksi maupun diidentifikasi untuk keperluan tertentu. Contohnya adalahskriningpada BAL untuk seleksi starterpada keju,skriningaktivitas proteolitik, skrining aktivitas antibiotik,skriningaktivitas probiotik, skriningeksopoli-sakarida (EPS), dan sebagainya (Kivanc et al. 2011).
2.4
KURVA PERTUMBUHAN MIKROORGANISME
6
1. Fasepermulaan atau fase penyesuaian yang merupakan fase pengaturan suatu aktivitas dalam lingkungan baru. Oleh karena itu, selama fase ini pertambahan massa atau pertambahan jumlah sel belum begitu terjadi sehingga kurva fase ini umumnya mendatar.
2. Fase akselerasiatau pertumbuhan yang dipercepat merupakan fase sel bakteri mulai membelah diri, tetapi waktu generasinya masih panjang sehingga jumlah selnya bertambah dengan kecepatan yang masih rendah. Fase permulaan dan fase akselerasi sering disebut lag phase.
3. Fase eksponensial atau logaritmik merupakan fase penambahan jumlah mencapai kecepatan maksimum, waktu generasinya pendek dan konstan sehingga kurvanya dalam bentuk eksponensial. Selama fase ini, metabolisme terjadi paling pesat sehingga sintesis bahan sel juga terjadi sangat cepat dan konstan. Keadaan ini berlangsung terus hingga salah satu nutrien habis atau terjadi penimbunan hasil metabolit yang bersifat racun sehingga menghabat pertumbuhan.
4. Fase retardasi atau pengurangan merupakan fase dimana penambahan aktivitas sudah mulai berkurang atau menurun yang diakibatkan karena beberapa faktor, misalnya berkurangnya sumber hara, terbentuknya senyawa penghambat, dan lain sebagainya.
5.
Fase stasioner merupakan fase terjadinya keseimbangan penambahan dan penurunan aktivitas atau dalam pertumbuhan koloni terjadi keseimbangan antara jumlah bakteri yang dihasilkan dan yang mati. Oleh karena itu, fase ini membentuk kurva datar. Fase ini juga diakibatkan karena sumber hara yang semakin berkurang, terbentuknya senyawa penghambat dan faktor lingkungan yang mulai tidak menguntungkan.Gambar 2. Kurva pertumbuhan mikroorganisme
6.Fase kematian merupakan fase mulai terhentinya aktivitas atau dalam pertumbuhan koloni terjadi kematian yang mulai melebihi bertambahnya individu.
7.Fase kematian logaritmik merupakan fase peningkatan kematian yang semakin meningkat mencapai maksimal dan kecepatan pembelahan menjadi nol sehingga kurva menunjukan garis menurun (Hidayat et al., 2006).
Waktu Fase stasioner
L
og j
um
la
h
sel h
id
u
p
Fase adaptasi
Fase akselerasi Fase eksponensial
Fase retardasi
Fase kematian
7
8
III. METODOLOGI PENELITIAN
3.1
BAHAN DAN ALAT PENELITIAN
Alat-alat yang digunakan saat skrining adalah cawan petri, tabung reaksi, tips dan kotak tips, mikropipet 5 mL dan 1 mL, bunsen, botol semprot, rak tabung reaksi, plastik tahan panas, tusuk gigi, ose sekali pakai, otoklaf, laminar, label, pipet pasteur, bumbung pipet, inkubator, spektrofotometer HITACHI U-3900H,shaker ROSI 1000, plastik seal wrap, timbangan analitik, kertas timbang, sudip, vorteks, erlenmeyer 1000 mL, 500 mL, 300 mL dan 250 mL, kapas, gelas ukur 500 mL dan 100 mL, tisu, isolasi, karet gelang, spidol marker, micro tube dan raknya. Bahan-bahan yang dibutuhkan saat skriningadalah MRS, agar, CaCO3, gliserol, alkohol 70%, aquades, 39
isolat remaja BAL LIPI-Cibinong, spirtus, susu skim, aquades, dan susu sapi pasteurisasi.
Alat-alat yang digunakan saat produksi keju adalah pengaduk, water bath, botol selai, kain kasa, gelas ukur, kertas pH indikator, tabung reaksi, kapas. Bahan-bahan yang digunakan dalam pembuatan keju adalah susu sapi pasteurisasi, isolat BAL berpotensi tinggiLIPI-Cibinong, dan rennet Rhyzomucor miehikomersialCuajo Holandes, Fromase® 50 DSM Food Specialities.
3.2
METODE PENELITIAN
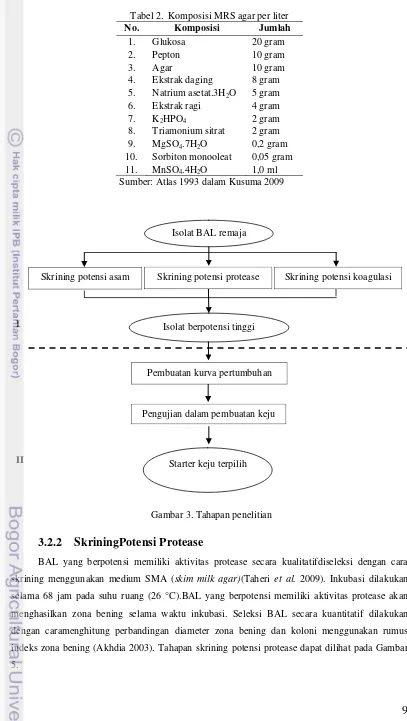
Penelitian ini terdiri ataslima tahap penelitian (lihat Gambar 3) yaitu skrining potensi asam, skrining potensi protease, skrining potensi koagulasi, pembuatan kurva pertumbuhan dan pengujian dalam pembuatan keju.
3.2.1
SkriningPotensi Asam
BAL yang memiliki potensi dalam menghasilkan asam secara kualitatif, diseleksi dengancara skrining menggunakan medium MRSA + CaCO3 0.5% (Khunajakr et al. 2008).
Komposisi MRS dapat dilihat pada Tabel 2. Inkubasi dilakukan selama 68 jam pada suhu mesofilik (26 °C).BAL yang memiliki potensi asam akan menghasilkan zona bening selama waktu inkubasi..Fardiaz (1989) menyatakan bahwa mikroorganisme mesofilik merupakan kelompok mikroorganisme yang hidup pada kisaran suhu 10 °C sampai 45 °C dengan kisaran suhu optimum pertumbuhan 20 °C sampai 40 °C dan minimum 10 °C sampai 20 °C.
Seleksi potensi asam BAL secara kuantitatif dilakukan dengan cara menghitung perbandingan diameter zona bening dan koloni menggunakan rumus indeks zona bening. Tahapan skrining potensi asam dapat dilihat pada Gambar 4.
9
Gambar 3. Tahapan penelitian Tabel 2. Komposisi MRS agar per liter No. Komposisi Jumlah
1. Glukosa 20 gram
2. Pepton 10 gram
3. Agar 10 gram
4. Ekstrak daging 8 gram 5. Natrium asetat.3H2O 5 gram
6. Ekstrak ragi 4 gram
7. K2HPO4 2 gram
8. Triamonium sitrat 2 gram 9. MgSO4.7H2O 0,2 gram
10. Sorbiton monooleat 0,05 gram 11. MnSO4.4H2O 1,0 ml
Sumber: Atlas 1993 dalam Kusuma 2009
3.2.2
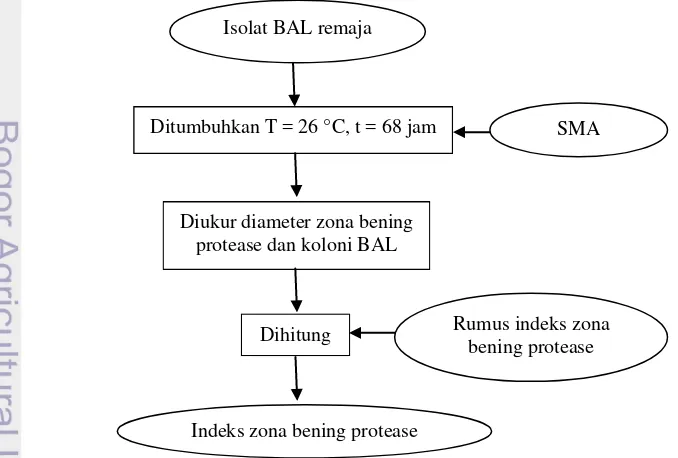
SkriningPotensi Protease
BAL yang berpotensi memiliki aktivitas protease secara kualitatifdiseleksi dengan cara skrining menggunakan medium SMA (skim milk agar)(Taheri et al. 2009). Inkubasi dilakukan selama 68 jam pada suhu ruang (26 °C).BAL yang berpotensi memiliki aktivitas protease akan menghasilkan zona bening selama waktu inkubasi. Seleksi BAL secara kuantitatif dilakukan dengan caramenghitung perbandingan diameter zona bening dan koloni menggunakan rumus indeks zona bening (Akhdia 2003). Tahapan skrining potensi protease dapat dilihat pada Gambar 5.
Isolat BAL remaja
Skrining potensi asam Skrining potensi protease Skrining potensi koagulasi
Isolat berpotensi tinggi
Pembuatan kurva pertumbuhan
Pengujian dalam pembuatan keju
Starter keju terpilih I
10
Indeks zona bening protease =
3.2.3
SkriningPotensi Koagulasi
BAL yang memiliki potensi koagulasidiseleksi dengan cara skrining menggunakan medium susu sapi pasteurisasi. Inkubasi dilakukan selama 24 jam pada suhu ruang (26 °C).BAL yang berpotensi mengoagulasi susu akan menghasilkan curd selama waktu inkubasi (lihat Gambar 6). Metode ini merupakan prinsip sederhana dari proses pembuatan keju sekaligus penentu atas terpilihnya beberapa isolat yang akan diujikan dalam pembuatan keju.
Gambar 4. Tahapan skrining potensi asam
Gambar 5. Tahapan skrining potensi protease Isolat BAL remaja
Ditumbuhkan T = 26 °C, t = 68 jam MRSA+CaCO3 0.5%
Diukur diameter zona bening asam dan koloni BAL
Dihitung Rumus indeks zona bening asam
Indeks zona bening asam
Isolat BAL remaja
Ditumbuhkan T = 26 °C, t = 68 jam SMA
Diukur diameter zona bening protease dan koloni BAL
Dihitung Rumus indeks zona bening protease
11
3.2.4
Pembuatan Kurva Pertumbuhan
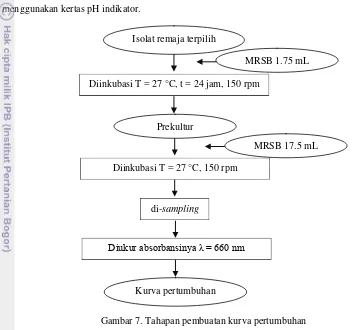
Hasil dariskriningmerupakanisolat berpotensi untuk diujikan pembuatan keju. Sebelumnya, untuk mengetahui waktu optimum pertumbuhan isolat terpilih tersebut, dilakukan pembuatan prekultur 10% dari kultur yang nantinya akan dilakukan sampling untuk pembuatan kurva pertumbuhan. Waktu optimum pertumbuhan, juga dapat mengetahui waktu optimum produksi asam atau enzim sebab asam atau enzim termasuk dalam metabolit primer yang dapat dipanen dengan memperpanjang fase logaritmik (Nurcahyo 2011).Bila fase logaritmik mencapai optimum, maka produksi metabolit primer juga optimum. Tujuan pembuatan prekultur adalah untuk masa adaptasi isolat sebelum memasuki medium yang lebih besar (kultur). Prekultur diinkubasi dengan medium MRSB pada suhu ruang (27 °C) dan dihomogenisasidengan kecepatan 150 rpm. Setelah 24 jam,1.75 mL prekultur dipindahkan ke kultur dengan perlakuan yang sama. Lalu dilakukan samplingtiap sampel sebanyak 1 mL secara aseptis dalam waktusehari 3-4 kali dengan jeda waktu tiap dua jam sekali. Hasil sampling lalu diukur absorbansinya dengan panjang gelombang 660 nm (Widyastuti et al., 1997). Kegiatan dari awal pembuatan prekultur hingga pengukuran absorbansi dilakukan sebanyak dua kali ulangan.Tahapan pembuatan kurva pertumbuhan dapat dilihat pada Gambar 7.
3.2.5
Pengujian dalam Pembuatan Keju
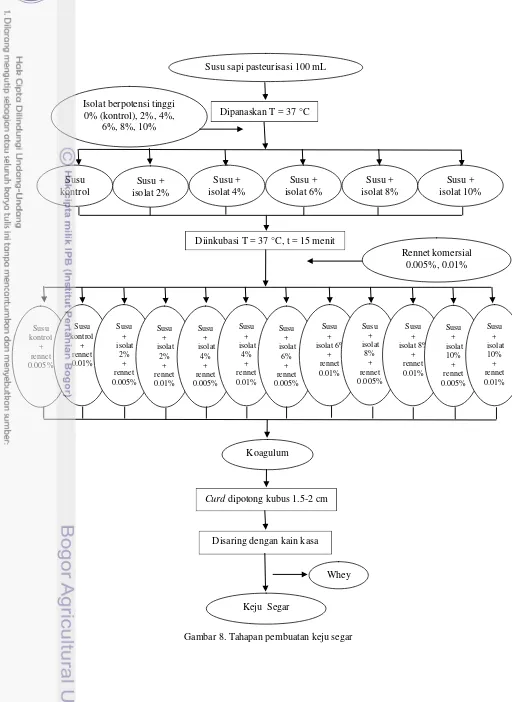
Setelah mengetahui waktu optimum pertumbuhan isolat potensial, maka dilakukan pengujian dalam pembuatan keju segar skala laboratorium. Proses pembuatan keju diawali dengan pembuatan starter induk yaitu satu ose isolat potensial diinokulasikan dalam susu steril dengan variasi konsentrasi 0% (kontrol), 2%, 4%, 6%, 8%, dan 10%. Selanjutnya, starter induk diinkubasi selama 24 jam pada suhu 37 °C dengan kecepatan agitasi 150 rpm. Setelah itu, starter induk dicampurkan pada susu pasteurisasi suhu 37 °C dan didiamkan selama 15 menit. Selanjutnya, ditambahkan rennet komersial dengan variasi konsentrasi 0.005% dan 0.01% sehingga akan terbentuk koagulum. Hasil curd yang terbentuk dipotong berbentuk kubus dengan ukuran 1.5-2 cm dan disaring dengan kain kasa. Kegiatan dari awal pembuatan starter induk hingga penghitungan rendemen dilakukan sebanyak dua kali ulangan. Gambaran tahapan dapat dilihat pada Gambar 8.
Gambar 6. Tahapan skrining potensi koagulasi Isolat BAL remaja
Ditumbuhkan T = 26 °C, t = 24 jam Susu pasteurisasi 3 mL
12
Parameter yang diujikan dalam pembuatan keju adalah pengukuran pH, pengujian aktivitas rennet, penghitungan rendemen keju yang dihasilkan dan penilaian sensori.
3.2.5.1
Pengukuran pH
Pengukuran pH dilakukan tiga kali, yaitu (1) pada susu bahan baku yang akan diolah menjadi keju; (2) pada starter yang telah diinkubasi selama 24 jam dengan suhu 37 °C; dan (3) pada susu bahan baku yang telah dicampur seketika dengan starter. Pengukuran dilakukan dengan menggunakan kertas pH indikator.
3.2.5.2 Pengujian Aktivitas Rennet
Pengujian kemampuan rennet dalam mengoagulasi susu dilakukan dengan menggunakan metode Scott (1981). Penggunaan konsentrasi rennet disesuaikan dengan resep komersialnya yaitu 0.01% dan dilakukan tambahan perlakuan dengan konsentrasi 0.005% (lihat Lampiran 3). Sebanyak100 ml susu dengan suhu 37 °C ditambahkan starter dengan beberapa perlakuan sehingga terjadi variasi penurunan pH awal susu. Setelah penambahan starter,dilakukan penambahan rennet. Campuran tersebut kemudian diaduk beberapa saat hingga homogendan didiamkan sambil diamati sampai terjadi koagulasi susu. Terjadinya koagulasi ditandai dengan meningkatnya viskositas susu membentuk curd sehingga terasa berat dalam pengadukan.
Isolat remaja terpilih
MRSB 1.75 mL
Diinkubasi T = 27 °C, t = 24 jam, 150 rpm
Prekultur
Diinkubasi T = 27 °C, 150 rpm
MRSB 17.5 mL
di-sampling
Diukur absorbansinya λ = 660 nm
Kurva pertumbuhan
13
Susu sapi pasteurisasi 100 mL
Dipanaskan T = 37 °C
Diinkubasi T = 37 °C, t = 15 menit Isolat berpotensi tinggi
0% (kontrol), 2%, 4%, 6%, 8%, 10%
Koagulum
Rennet komersial 0.005%, 0.01%
Whey Curd dipotong kubus 1.5-2 cm
Disaring dengan kain kasa
Keju Segar Susu + isolat 2% Susu + isolat 6% Susu + isolat 4% Susu + isolat 8% Susu + isolat 10% Susu kontrol Susu kontrol + rennet 0.005% Susu kontrol + rennet 0.01% Susu + isolat 2% + rennet 0.005% Susu + isolat 2% + rennet 0.01% Susu + isolat 4% + rennet 0.005% Susu + isolat 4% + rennet 0.01% Susu + isolat 6% + rennet 0.005% Susu + isolat 6% + rennet 0.01% Susu + isolat 8% + rennet 0.005% Susu + isolat 8% + rennet 0.01% Susu + isolat 10% + rennet 0.005% Susu + isolat 10% + rennet 0.01%
14
3.2.5.3
Penghitungan Rendemen
Beberapa sampel keju yang telah dihasilkan, dihitung rendemennya untuk mengetahui adanya pengaruh variasi konsentrasi isolat berpotensi tinggidan rennet komersial yang digunakan terhadap berat keju yang dihasilkan. Penghitungan ini menggunakan metode gravimetri seperti pada persamaan.
Rendemen keju (%) =
3.2.5.4Penilaian Sensori
IV. HASIL DAN PEMBAHASAN
4.1
SELEKSI ISOLAT BERPOTENSI TINGGI
Isolat berpotensi tinggi didapat dari beberapa tahap skrining, yaitu skriningpotensi asam, skrining potensi protease, dan skrining potensi koagulasi.
4.1.1
Skrining Potensi Asam
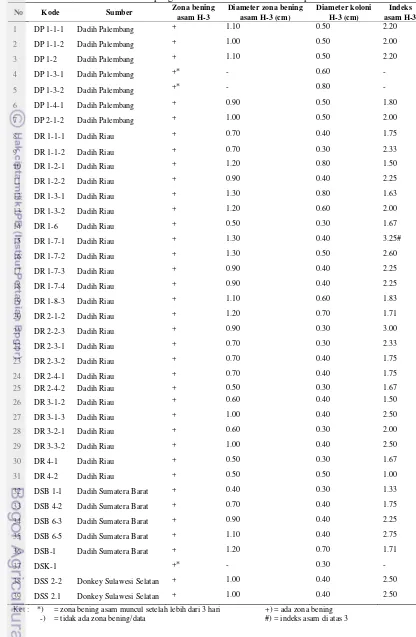
Hasil yang didapat dari penelitian tahap pertama adalah isolat yang digunakan, diisolasi dari produk lokal turunan susu seperti dadih Pulau Sumatera dan donkey Pulau Sulawesi (lihat Tabel 3).Tujuan penggunaan isolat tersebut untukpemanfaatan BALIndonesia yanglayak dikonsumsi secara etika sebagai starter keju karena sumber BAL yang digunakanberasal dari sesama produk pangan. Flores (2008) menyatakan bahwa dalam yoghurt dan dadih terdapat bakteri hidup yang dapat digunakan sebagai kultur keju. Selain itu, didapat juga data keberadaan zona bening asam serta indeks asam dari ke-39 isolat. Tabel 3menunjukkan bahwa semua isolat positif menghasilkan zona bening asam pada medium MRSA+CaCO3 0.5% (Gambar 9) dengan waktu dan indeks yang
tidak sama. Terbentuknya zona bening tersebut terjadi karena penurunan suasana asam dari CaCO3
terhadap asam yang dihasilkan oleh BAL.
Perbedaan waktu dan jumlah produksi asam yang dihasilkan oleh tiap isolatdisebabkan olehadanya perbedaan sifat dan karakter pada setiapBAL.Rose (1983) menyatakan bahwa jenis fermentasi spesies BAL berbeda-beda sehingga produk akhir yang dihasilkannya juga berbeda. Tujuan dari penghitungan indeks adalah untuk mendapatkan nilai rasio antara diameter zona bening dan koloni. Semakin besar diameter zona bening asam, semakin besar pula kemampuan isolat dalam memproduksi asam.
Semakin besar diameter koloni, semakin cepat koloni tersebut tumbuh, namun belum tentu produksi asam juga besar (diameter zona bening asam besar). Oleh karena itu, penilaian kualitatif isolat yang berpotensi dalam pembentukan asam dilihat dari indeks asam laktatnya. Semakin besar indeks asam, semakin besar juga potensi isolat untuk menghasilkan asam sebagai penurun pH susu menuju pH isoelektrik protein sehingga dapat digunakan dalam proses koagulasi protein. Hal ini terjadi sebab pada titik isoelektrik protein mempunyai muatan positif dan negatif yang sama
16
Tabel 3. Hasil pengamatan kualitatif dan kuantitatif potensi asam No Kode Sumber Zona bening
asam H-3
Diameter zona bening asam H-3 (cm)
Diameter koloni H-3 (cm)
Indeks asam H-3
1 DP 1-1-1 Dadih Palembang + 1.10 0.50 2.20
2 DP 1-1-2 Dadih Palembang + 1.00 0.50 2.00
3 DP 1-2 Dadih Palembang + 1.10 0.50 2.20
4 DP 1-3-1 Dadih Palembang +* - 0.60 -
5 DP 1-3-2 Dadih Palembang +* - 0.80 -
6 DP 1-4-1 Dadih Palembang + 0.90 0.50 1.80
7 DP 2-1-2 Dadih Palembang + 1.00 0.50 2.00
8 DR 1-1-1 Dadih Riau + 0.70 0.40 1.75
9 DR 1-1-2 Dadih Riau + 0.70 0.30 2.33
10 DR 1-2-1 Dadih Riau + 1.20 0.80 1.50
11 DR 1-2-2 Dadih Riau + 0.90 0.40 2.25
12 DR 1-3-1 Dadih Riau + 1.30 0.80 1.63
13 DR 1-3-2 Dadih Riau + 1.20 0.60 2.00
14 DR 1-6 Dadih Riau + 0.50 0.30 1.67
15 DR 1-7-1 Dadih Riau + 1.30 0.40 3.25#
16 DR 1-7-2 Dadih Riau + 1.30 0.50 2.60
17 DR 1-7-3 Dadih Riau + 0.90 0.40 2.25
18 DR 1-7-4 Dadih Riau + 0.90 0.40 2.25
19 DR 1-8-3 Dadih Riau + 1.10 0.60 1.83
20 DR 2-1-2 Dadih Riau + 1.20 0.70 1.71
21 DR 2-2-3 Dadih Riau + 0.90 0.30 3.00
22 DR 2-3-1 Dadih Riau + 0.70 0.30 2.33
23 DR 2-3-2 Dadih Riau + 0.70 0.40 1.75
24 DR 2-4-1 Dadih Riau + 0.70 0.40 1.75
25 DR 2-4-2 Dadih Riau + 0.50 0.30 1.67
26 DR 3-1-2 Dadih Riau + 0.60 0.40 1.50
27 DR 3-1-3 Dadih Riau + 1.00 0.40 2.50
28 DR 3-2-1 Dadih Riau + 0.60 0.30 2.00
29 DR 3-3-2 Dadih Riau + 1.00 0.40 2.50
30 DR 4-1 Dadih Riau + 0.50 0.30 1.67
31 DR 4-2 Dadih Riau + 0.50 0.50 1.00
32 DSB 1-1 Dadih Sumatera Barat + 0.40 0.30 1.33
33 DSB 4-2 Dadih Sumatera Barat + 0.70 0.40 1.75
34 DSB 6-3 Dadih Sumatera Barat + 0.90 0.40 2.25
35 DSB 6-5 Dadih Sumatera Barat + 1.10 0.40 2.75
36 DSB-1 Dadih Sumatera Barat + 1.20 0.70 1.71
37 DSK-1 +* - 0.30 -
38 DSS 2-2 Donkey Sulawesi Selatan + 1.00 0.40 2.50
39 DSS 2.1 Donkey Sulawesi Selatan + 1.00 0.40 2.50
17
sehingga tidak bergerak ke arah elektroda positif maupun negatif apabila ditempatkan di antara kedua elektroda tersebut (Poedjiadi dan Supriyanti 2007).
Nilai indeks asam berturut-turut dari yang berpotensi tinggi hingga rendah adalah indeks di atas 3, indeks 2-3 dan indeks dibawah 2 (Said dan Ningrum 2009). Pada skrining potensi asam ini, isolat yang dipilih adalah isolat yang memiliki indeks di atas 3, yaitu isolat DR 1-7-1 dengan indeks asam sebesar 3.25.
4.1.2
Skrining Potensi Protease
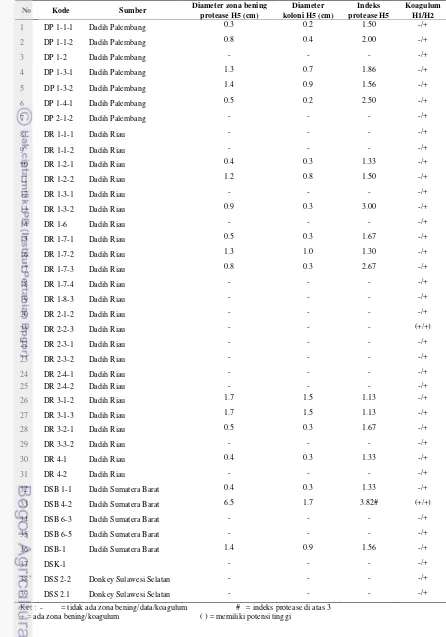
Hasil yang didapat dari penelitian tahap kedua adalah data keberadaan zona bening protease serta indeks protease dari ke-39 isolat. Tabel 4menunjukkan bahwa ada 18 isolat positif menghasilkan zona bening protease pada medium Skim Milk Agar (Gambar 10) dengan waktu dan indeks yang tidak sama. Terbentuknya zona bening tersebut terjadi karena adanya enzim protease yang dihasilkan oleh BAL dan bereaksi memecah substrat kasein yang terkandung dalam medium.
Seperti pada skrining potensi asam, ]perbedaan waktu dan jumlah produksi protease yang dihasilkan oleh tiap isolat disebabkan oleh adanya perbedaan sifat dan karakter pada setiap BAL. Rose (1983) menyatakan bahwa jenis fermentasi spesies BAL berbeda-beda sehingga produk akhir yang dihasilkannya juga berbeda. Skrining potensi protease ini juga memilih isolat yang memiliki nilai indeks di atas 3, yaitu isolat DSB 4-2 dengan indeks protease sebesar 3.82.
Tujuan penghitungan indeks protease hampir sama dengan tujuan penghitungan indeks asam, yaitu untuk mendapatkan nilai rasio antara diameter zona bening dan koloni. Semakin besar diameter zona bening protease, semakin besar pula kemampuan isolat dalam memproduksi protease. Semakin besar diameter koloni, semakin cepat koloni tersebut tumbuh, namun belum tentu produksi protease juga besar (diameter zona bening protease besar). Oleh karena itu, penilaian kualitatif isolat yang berpotensi dalam pembentukan protease dilihat dari indeks proteasenya. Semakin besar indeks protease, semakin besar juga potensi isolat untuk menghasilkan protease sebagai pemecah protein susu. Jika protein susu telah terpotong-potong, dibantu juga oleh ion Ca dalam susu, potongan-potongan protein susu tersebut akan mengendap membentuk curd.
Winarno(2010) menyatakan bahwa koagulasi terjadi karena terbentuknya endapan kalsium kaseinat, yaitu dengan cara renin mempengaruhi konfigurasi dari calcium insentive ĸ -casein menjadi lebih sensitif terhadap ion-ion kalsium. Dengan demikian, para-kasein bereaksi dengan
18
Tabel 4. Hasil pengamatan kualitatif dan kuantitatif potensi protease sertakualitatif koagulasi No Kode Sumber Diameter zona bening
protease H5 (cm)
Diameter koloni H5 (cm)
Indeks protease H5
Koagulum H1/H2
1 DP 1-1-1 Dadih Palembang 0.3 0.2 1.50 -/+
2 DP 1-1-2 Dadih Palembang 0.8 0.4 2.00 -/+
3 DP 1-2 Dadih Palembang - - - -/+
4 DP 1-3-1 Dadih Palembang 1.3 0.7 1.86 -/+
5 DP 1-3-2 Dadih Palembang 1.4 0.9 1.56 -/+
6 DP 1-4-1 Dadih Palembang 0.5 0.2 2.50 -/+
7 DP 2-1-2 Dadih Palembang - - - -/+
8 DR 1-1-1 Dadih Riau - - - -/+
9 DR 1-1-2 Dadih Riau - - - -/+
10 DR 1-2-1 Dadih Riau 0.4 0.3 1.33 -/+
11 DR 1-2-2 Dadih Riau 1.2 0.8 1.50 -/+
12 DR 1-3-1 Dadih Riau - - - -/+
13 DR 1-3-2 Dadih Riau 0.9 0.3 3.00 -/+
14 DR 1-6 Dadih Riau - - - -/+
15 DR 1-7-1 Dadih Riau 0.5 0.3 1.67 -/+
16 DR 1-7-2 Dadih Riau 1.3 1.0 1.30 -/+
17 DR 1-7-3 Dadih Riau 0.8 0.3 2.67 -/+
18 DR 1-7-4 Dadih Riau - - - -/+
19 DR 1-8-3 Dadih Riau - - - -/+
20 DR 2-1-2 Dadih Riau - - - -/+
21 DR 2-2-3 Dadih Riau - - - (+/+)
22 DR 2-3-1 Dadih Riau - - - -/+
23 DR 2-3-2 Dadih Riau - - - -/+
24 DR 2-4-1 Dadih Riau - - - -/+
25 DR 2-4-2 Dadih Riau - - - -/+
26 DR 3-1-2 Dadih Riau 1.7 1.5 1.13 -/+
27 DR 3-1-3 Dadih Riau 1.7 1.5 1.13 -/+
28 DR 3-2-1 Dadih Riau 0.5 0.3 1.67 -/+
29 DR 3-3-2 Dadih Riau - - - -/+
30 DR 4-1 Dadih Riau 0.4 0.3 1.33 -/+
31 DR 4-2 Dadih Riau - - - -/+
32 DSB 1-1 Dadih Sumatera Barat 0.4 0.3 1.33 -/+
33 DSB 4-2 Dadih Sumatera Barat 6.5 1.7 3.82# (+/+)
34 DSB 6-3 Dadih Sumatera Barat - - - -/+
35 DSB 6-5 Dadih Sumatera Barat - - - -/+
36 DSB-1 Dadih Sumatera Barat 1.4 0.9 1.56 -/+
37 DSK-1 - - - -/+
38 DSS 2-2 Donkey Sulawesi Selatan - - - -/+
39 DSS 2.1 Donkey Sulawesi Selatan - - - -/+
19
ion kalsium membentuk formasi tiga dimensi yang mengikat lemak dan air menjadi multi komponen gel (curd).
4.1.3
Skrining Potensi Koagulasi
Hasil yang didapat dari penelitian tahap ketiga adalah data keberadaan koagulum dari ke-39 isolat. Tabel 3 menunjukkan bahwa ada 2 isolat (DSB 4-2 dan DR 2-2-3) positif dapat membentuk koagulum pada hari pertama setelah inokulasi pada medium susu pasteurisasi (Gambar 11). Pada hari kedua inkubasi semua susu telah membentuk koagulum. Terbentuknya koagulum (curd) tersebut bisa disebabkan oleh asam laktat dan aktivitas enzim protease yang dihasilkan dari BAL tersebut, sebagaimana telah dijelaskan pada tahap skriningpotensi asam dan protease.
Tujuan dari skriningkoagulasi adalah mendapatkan isolat-isolat terpilih yang diujikan dalam pembuatan keju.Hal ini dikarenakan isolat terpilih benar-benar berada dalam medium yang nantinya akan digunakan dalam pembuatan keju, yaitu susu pasteurisasi. Dari dua tahap skrining sebelumnya, isolat terpilih yang diujikan dalam proses pembuatan keju adalah DR 2-2-3 dan DSB 4-2. Alasan dari pemilihan kedua isolat tersebut yaituDSB 4-2 dapat membentuk koagulum karena potensi proteasenya yang tinggi dan DR 2-2-3memilikikemampuan sedang dalam menghasilkan asam dengan indeks asam 3.
Meskipun DR 1-7-1 memiliki potensi asam tinggi, namun tidak terpilih dalam skriningkoagulasi karena saat di medium susu, DR 1-7-1 dapat membentuk koagulum pada hari kedua. Alasan koagulum baru terbentuk pada hari kedua dimungkinkan karena pada medium susu, komponen penyusunnya lebih besar dibandingkan dengan medium MRS yang telah terstandarisasi untuk penggunaan medium di laboratorium. Oleh karena itu, glukosa dapat lebih mudah tercerna oleh bakteri dibandingkan dengan produk pangan aslinya (susu). Kedua isolat terpilih dapat membentuk koagulum pada hari pertama, karena besarnya kemampuan adaptasi dengan medium baru sehingga dapatlebih cepat melakukan proses metabolisme.
20
4.2
PENENTUAN STARTER KEJU TERPILIH
Setelah mendapatkan dua isolat berpotensi tinggi, selanjutnya dipilih isolat mana yang akan digunakan sebagai starter keju. Pemilihan isolat dilakukan melalui dua tahap yaitu pembuatan kurva pertumbuhan dan pengujian dalam pembuatan keju.
4.2.1
Pembuatan Kurva Pertumbuhan
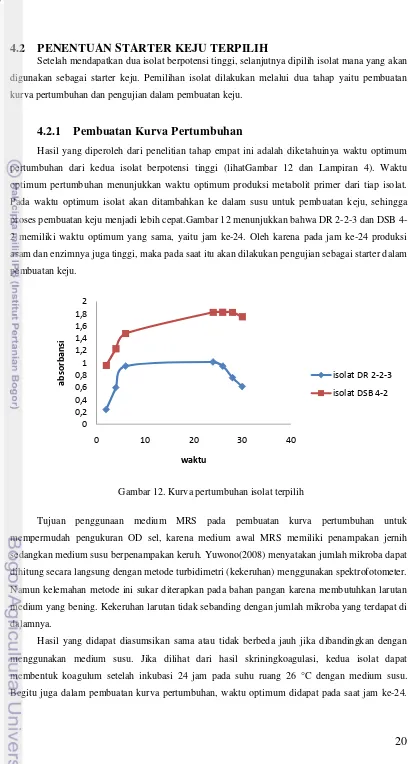
Hasil yang diperoleh dari penelitian tahap empat ini adalah diketahuinya waktu optimum pertumbuhan dari kedua isolat berpotensi tinggi (lihatGambar 12 dan Lampiran 4). Waktu optimum pertumbuhan menunjukkan waktu optimum produksi metabolit primer dari tiap isolat. Pada waktu optimum isolat akan ditambahkan ke dalam susu untuk pembuatan keju, sehingga proses pembuatan keju menjadi lebih cepat.Gambar 12 menunjukkan bahwa DR 2-2-3 dan DSB 4-2 memiliki waktu optimum yang sama, yaitu jam ke-4-24. Oleh karena pada jam ke-4-24 produksi asam dan enzimnya juga tinggi, maka pada saat itu akan dilakukan pengujian sebagai starter dalam pembuatan keju.
Gambar 12. Kurva pertumbuhan isolat terpilih
Tujuan penggunaan medium MRS pada pembuatan kurva pertumbuhan untuk mempermudah pengukuran OD sel, karena medium awal MRS memiliki penampakan jernih sedangkan medium susu berpenampakan keruh. Yuwono(2008) menyatakan jumlah mikroba dapat dihitung secara langsung dengan metode turbidimetri (kekeruhan) menggunakan spektrofotometer. Namun kelemahan metode ini sukar diterapkan pada bahan pangan karena membutuhkan larutan medium yang bening. Kekeruhan larutan tidak sebanding dengan jumlah mikroba yang terdapat di dalamnya.
Hasil yang didapat diasumsikan sama atau tidak berbeda jauh jika dibandingkan dengan menggunakan medium susu. Jika dilihat dari hasil skriningkoagulasi, kedua isolat dapat membentuk koagulum setelah inkubasi 24 jam pada suhu ruang 26 °C dengan medium susu. Begitu juga dalam pembuatan kurva pertumbuhan, waktu optimum didapat pada saat jam ke-24.
0 0,2 0,4 0,6 0,8 1 1,2 1,4 1,6 1,8 2
0 10 20 30 40
a
bso
r
ba
nsi
waktu
isolat DR 2-2-3
21
Oleh karena itu,kemungkinan medium yang berbeda tidak memberi perbedaan yang jauh untuk hasil yang diharapkan dengan kemampuan mudahnya kedua isolat terpilih dalam beradaptasi.Kesamaan waktu optimum ini juga dapat mempermudah variasi perlakuan sebagai starter campuran karena keduanya dapat dipanen atau dicampur pada jam yang sama.
4.2.2
Pengujian dalam Pembuatan Keju
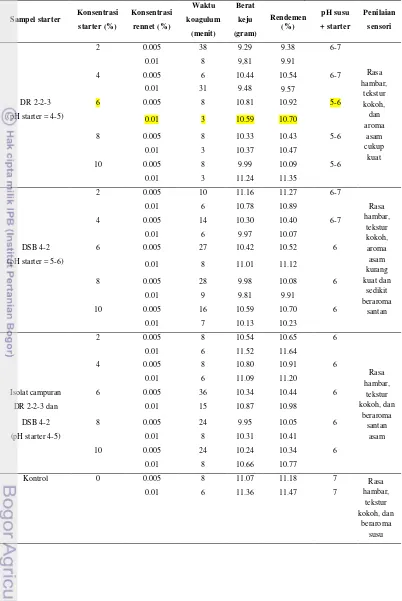
Hasil yang diperoleh dari penelitian akhir ini adalah diketahuinya starter terpilih yang akan digunakan sebagai starter keju (lihat Tabel 5). Starter yang digunakan pada pengujian pembuatan keju adalah DR 2-2-3, DSB 4-2, serta campuran DR 2-2-3 dan DSB 4-2 dengan variasi konsentrasi 0%, 2%, 4%, 6%, 8%, dan 10%. Parameter yang diujikan untuk menentukan starter terpilih adalah pH campuran starter dan susu, aktivitas rennet, rendemen yang dihasilkan dan penilaian sensori.
Berdasarkanpengukuran parameter pH, diperoleh bahwasemakin besar konsentrasi starter yang diberikan, nilai pH campuran starter dan susu cenderung semakin turun hingga batas tertentu. Pengukuran pH dijadikan parameter utama dalam penentuan starter terpilih untuk pembuatan keju skala laboratorium dengan menggunakan rennetkomersial sebagai koagulan, sebab fungsi utama starter terhadap rennet adalah sebagai penurun pH susu mencapai pH optimum rennet (sekitar pH (5-6))sehingga rennet dapat mengoagulasi susu lebih cepat.
Murti dan Ciptadi (1988) menyatakan bahwa pengendapan kasein terjadi karena penurunan pH susu oleh pengaruh laktosa yang berubah menjadi asam laktat. Selain itu, pengendapan kasein juga disebabkan oleh adanya enzim protease yang bekerja memecah susu pada pH 5.5. Preetha dan Boopathy (1997) juga menyatakan bahwa enzim protease milk clotting Rhizomucor miehie (komposisi rennet komersial yang digunakan dalam penelitian ini; lihat Lampiran 5) yang telah dipurifikasi memiliki aktivitas optimum pada pH 5.6. Jadi, semakin mendekati pH optimum rennet, semakin cepat koagulum (lihat Gambar 13) terbentuk.
Gambar 13. Terbentuk koagulum Gambar 14. Keju segar
22
reaksi bertambah dengan bertambahnya konsentrasi enzim. Hasil yang diharapkan adalah cepatnya waktu terbentuknya koagulum, sehingga produksi keju segarmenjadi lebih cepat. Namun parameter ini tidak dapat dijadikan parameter utama dalam penentuan starter terpilih untuk pembuatan keju skala laboratorium dengan rennet komersial sebagai koagulan sebab cepat lambatnya aktivitas rennet lebih dipengaruhi oleh pH susu yang ada.
Setelah terbentuk keju segar, selanjutnya dilakukan proses penimbangan. Sebelumnya, berat bahan baku 100 mL susu ditimbang, yaitu seberat 99 gram dan pH nya adalah pH 7. Pada penelitian ini diketahuitidak ada pengaruh antara perlakuan peningkatan variasi konsentrasi starter dan rennet terhadap rendemen koagulum yang dihasilkan sebab berat akhir keju yang ada, memiliki rendemen ±10%. Ditjen PPHP Deptan (2012) juga menyatakan bahwa hasil perubahan susu menjadi keju sangat tergantung pada jumlah kasein, lemak dan air pada susu, umumnya maksimum dari 10 kg susu kualitas baik dapat diperoleh sekitar 1 kg keju. Dengan demikian, parameter ini juga tidak dapat dijadikan parameter utama dalam penentuan starter terpilih untuk pembuatan keju skala laboratorium dengan rennet komersial sebagai koagulan.
Penilaian sensori setiap individu tidak sama, khususnya terhadap keju. Setiap golongan memiliki selera yang berbeda pada jenis keju tertentu. Hasil yang didapat dari penilaian sensori keju skala laboratorium dengan starter dan rennet komersial sebagai koagulan, adalah semua keju segar yang dihasilkan tergolong memiliki sensori yang masih bisa diterima oleh etika orang Indonesia, meskipun penerimaan kadar setiap individu pasti berbeda. Oleh karena itu, parameter ini tidak bisa dijadikan parameter utama untuk penetapan starter terpilih.
23
Rasa hambar, tekstur kokoh, dan beraroma susuTabel 5. Data pengujian dalam pembuatan keju
Sampel starter Konsentrasi starter (%) Konsentrasi rennet (%) Waktu koagulum (menit) Berat keju (gram) Rendemen (%) pH susu + starter Penilaian sensori
2 0.005 38 9.29 9.38 6-7
0.01 8 9,81 9.91
4 0.005 6 10.44 10.54 6-7
0.01 31 9.48 9.57
DR 2-2-3
(pH starter = 4-5)
6 0.005 8 10.81 10.92 5-6
0.01 3 10.59 10.70
8 0.005 8 10.33 10.43 5-6
0.01 3 10.37 10.47
10 0.005 8 9.99 10.09 5-6
0.01 3 11.24 11.35
2 0.005 10 11.16 11.27 6-7
0.01 6 10.78 10.89
4 0.005 14 10.30 10.40 6-7
0.01 6 9.97 10.07
DSB 4-2
(pH starter = 5-6)
6 0.005 27 10.42 10.52 6
0.01 8 11.01 11.12
8 0.005 28 9.98 10.08 6
0.01 9 9.81 9.91
10 0.005 16 10.59 10.70 6
0.01 7 10.13 10.23
2 0.005 8 10.54 10.65 6
0.01 6 11.52 11.64
4 0.005 8 10.80 10.91 6
0.01 6 11.09 11.20
Isolat campuran
DR 2-2-3 dan
6 0.005 36 10.34 10.44 6
0.01 15 10.87 10.98
DSB 4-2
(pH starter 4-5)
8 0.005 24 9.95 10.05 6
0.01 8 10.31 10.41
10 0.005 24 10.24 10.34 6
0.01 8 10.66 10.77
Kontrol 0 0.005 8 11.07 11.18 7
0.01 6 11.36 11.47 7
V.
SIMPULAN DAN SARAN
5.1
SIMPULAN
Isolat BAL LIPI yang berpotensi tinggi dalam pembentukan koagulum adalah isolat DR 2-2-3 dalam produksi asam dengan indeks asam sebesar 3, dan isolat DSB 4-2 dalam produksi protease dengan indeks protease sebesar 3.82. Semakin tinggi nilai indeks, maka semakin tinggi juga produksi asam atau protease yang dihasilkan dari bakteri tersebut.
Starter terpilih untuk pembuatan keju adalah starter DR 2-2-3 6% dengan konsentrasi rennet 0.01%. Kedua kombinasiperlakuan tersebut dapat membantu rennet mencapai pH optimum rennet(pH 5-6) sertadapat membentuk koagulum lebih cepat dibanding kontrol yaitu dari 6 menit (kontrol) menjadi 3 menit (starter DR 2-2-3 6% dan rennet 0.01%).
5.2
SARAN
SELEKSI BAKTERI ASAM LAKTAT
INDIGENOUS
INDONESIA
UNTUK STARTER KEJU
SKRIPSI
VISKA AWALIA SUSANTI
F24080045
FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR
25
DAFTAR PUSTAKA
Agricultural Marketing Service. 1995. How to buy cheese. Home and Garden Bulletin (193), United States Department of Agriculture.
Akhdia A. 2003. Isolasi bakteri penghasil enzim protease alkalin termostabil. Buletin Plasma Nutfah Vol. 9 No. 2.
Choliq A. 2008. Produksi rennet Mucor pusillus yang ditumbuhkan pada limbah padat tapioca (onggok). Biota Vol. 13 (3): 191-197.
Daulay D. 1991. Fermentasi Keju. Departemen Pendidikan dan Kebudayaan, Direktorat Jenderal Pendidikan Tinggi, Pusat Antar Universitas Pangan dan Gizi, Institut Pertanian Bogor.
[Ditjen PPHP Deptan] Direktorat Jenderal Pengolahan dan Pemasaran Hasil Pertanian Kementerian Pertanian Republik Indonesia. 2012. Teknologi Pengolahan Keju. Arsip Pengolahan Peternakan September 2012.
Fardiaz S. 1989. Petunjuk Laboratorium Analisis Mikrobiologi Pangan.Departemen Pendidikan dan Kebudayaan, Direktorat Jenderal Pendidikan Tinggi, Pusat Antar Universitas Pangan dan Gizi, Institut Pertanian Bogor.
Flores NC. 2008. Making homemade cheese. Cooperative Extension Service, College of Agriculture and Home Economics, NM State University.
Fratiwi, Yulneriwarni, Noverita. 2008. Fermentasi kefir dari susu kacang-kacangan. Vis vitalis Vol. 1 (2).
Hidayat N, Padaga MC, Suhartini S. 2006. Mikrobiologi Industri. Yogyakarta: ANDI.
Khunajakr N, Wongwicharn A dan Moonmangmee D. 2008. Screening and identification of lactic acid bacteria producing antimikrobial compounds from pig gastrointestinal tracts. KMITL Sci. Tech. J. Vol. 8 (1).
Kivanc M, M Yilmaz dan E Cakir. 2011. Isolation and Identification of Lactic acid Bacteria from Boza, and Their Microbial Activity Against Several Reporter Strains. Turk J Biol 35: 313-324.
Kusuma SAF. 2009. Bakteri asam laktat [Karya Ilmiah]. Fakultas Farmasi, Universitas Padjadjaran.
Machmud M. 2001. Teknik penyimpanan dan pemeliharaan mikroba. Buletin AgroBio 4 (1): 24-32.
Murti TW dan Ciptadi G. 1988. Kerbau Perah dan Kerbau Kerja, Tatalaksana dan Pengetahuan Dasar Pasca Panen. Jakarta: PT Mediyatama Sarana Perkasa.
Nofiani R. 2008. Urgensi dan mekanisme biosintesis metabolit sekunder mikroba laut. Jurnal Natur Indonesia 10 (2): 120-125.
Nurcahyo H. 2011. Diktat Bioteknologi. Yogyakarta: Jurusan Pendidikan Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Negeri Yogyakarta.
Poedjiadi A dan Supriyanti FMT. 2007. Dasar-Dasar Biokimia. Jakarta: UI Press.
26
Rose AH. 1983. Food Microbiology-Economic Microbiology Vol. 8. London : Academic Press Inc.
Said IM dan Ningrum EM. 2009. Karakterisasi dan purifikasi protease bakteri Bacillus sp. dan jamur Aspergillus sp. serta aplikasinya sebagai soaking agent pada proses penyamakan kulit kambing [Abstrak]. In: Irfan (ed). Hibah Penelitian Kerjasama (Hibah Pekerti). Makassar: LP2M UNHAS.
Scott R. 1981. Cheese Making Practice. London: Applied Science Publisher Ltd.
Taheri HR, Moravej H, Tabandeh F, Zaghari M dan Shivazad M. 2009. Screening of lactic acid bacteria toward their selection as a source of chicken probiotic. Poultry Science 88: 1586-1593.
Widyastuti, Ratnakomala YS, Sofarianawati E, Yusnira, Sari NYA, Rachmat J, Kurniawan, Kamaruddin, Atu M, Yahya M, Suparman, Udin, dan Diman. 1997. Penelitian Sumberdaya Pertanian dan Pangan. Pengembangan Teknologi Produksi Probiotik. Laporan Proyek Penelitian Bioteknologi. Puslitbang Bioteknologi LIPI Bogor.
Winarno FG. 2010. Enzim Pangan. Bogor: M-Brio press.
SELEKSI BAKTERI ASAM LAKTAT
INDIGENOUS
INDONESIA
UNTUK STARTER KEJU
SKRIPSI
VISKA AWALIA SUSANTI
F24080045
FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR
SELEKSI BAKTERI ASAM LAKTAT
INDIGENOUS
INDONESIA UNTUK STARTER KEJU
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar
SARJANA TEKNOLOGI PERTANIAN
pada Departemen Ilmu dan Teknologi Pangan
Fakultas Teknologi Pertanian
Institut Pertanian Bogor
Oleh
VISKA AWALIA SUSANTI
F24080045
FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR
”Karena hidup adalah pengabdian
SELECTION OF INDIGENOUS LACTIC ACID BACTERIA
FROM INDONESIA FOR CHEESE STARTER
ViskaAwalia Susanti1, Nurheni Sri Palupi1, Yopi2
1
Department of Food Science and Technology, Faculty of Agricultural Technology, Bogor Agricultural University, IPB Darmaga Campus, PO Box 220, Bogor, West Java, Indonesia
2
Indonesian Science Institute, Raya Bogor KM 46, Cibinong 16911, Bogor, West Java, Indonesia
Phone: +6285731348465, ema
ABSTRACT
Indonesia was a tropical country which high of an organism biodiversity, include to their microorganism such like the Lactic Acid Bacteria that familiar to food spontaneous fermentation. However, the exploration to Indonesia’s LAB was rarely. In the other hand, cheese and their derivatives was a famous food product in Indonesia. The LAB can being indigenous commercial starter for the exploration. Therefore, the objects of this research were (1) to screen LIPI Cibinong’s LAB isolates which have high potential to make coagulum; and (2) to get the selected cheese starter from the high potential isolates. The research methods which will used to get the high potential isolates were screening acid potential, screening protease potential, and screening coagulant potential; and to get the selected cheese starter were making a high potential isolates growth curve and assaying to cheese laboratory made with parameters: measurement of pH, rennet activity assays,yield calculations and sensory test. The result of this research were (1) from the 39 LIPI Cibinong’s isolates, DR 1-7-1 was the high acid potential isolate with Lactic Acid Index 3.25, DSB 4-2 was the high protease potential isolate with Protease Index 3.82, DR 2-2-3 and DSB 4-2 were the high coagulant potential with form coagulum time on 24 hours; and (2)the optimum growth of DR 2-2-3 and DSB 4-2 were 24 hours and the selected cheese starter was DR 2-2-3 isolate 6% with rennet 0.01% because thatconcentration combination of starter and rennet, can make the forming time of coagulum to be faster than control. That was 6 minutes (control) to be 3 minutes (DR 2-2-3 6% with rennet 0.01%)
Viska Awalia Susanti. F24080045.Seleksi Bakteri Asam Laktat Indigenous Indonesia untuk Starter Keju. Dibawah Bimbingan Nurheni Sri Palupi dan Yopi. 2012.
RINGKASAN
Indonesia merupakan negara yang terkenal dengan keragaman hayati yang tinggi,termasuk di dalamnya bakteri asam laktat (BAL) yang banyak berperan pada proses fermentasi spontan produk pangan. Peranan BAL pada produk pangan fermentasi dapat menambah keragaman potensi mikroba lokal khususnya sebagai starter indigenous Indonesia komersial.Namun,pemanfaatan BAL di Indonesia masih tergolong rendah (Fratiwi et al. 2008) sedangkan keju merupakan produk olahan susu yang sudah tidak asing lagi di Indonesia. Oleh karena itu, pada penelitian ini dilakukan pemilihan Bakteri Asam Laktat indigenous Indonesia untuk starter keju skala laboratorium dengan rennet sebagai koagulan.
Tahapan penelitian yang dilakukan dalam penelitian ini terdiri atas skrining, pembuatan kurva pertumbuhan dan pengujian dalam pembuatan keju. Skriningdapat dilakukan untuk pemilihan isolat berpotensi tinggi dalam pembentukan koagulum. Skriningyang dilakukan terdiri atasskrining potensi asam,skriningpotensi protease dan skriningpotensi koagulasi dengan medium berturut-turut adalah MRSA+CaCO3 0.5%, SMAdan susu pasteurisasi. Starter terpilih didapat
dengan cara pembuatan kurva pertumbuhan dengan medium MRSB dan menggunakan alat spektrofotometer λ 660 dan pengujian dalam pembuatan keju skala laboratorium dengan koagulan rennet Fromase® 50. Parameter yang diujikan dalam penentuan starter terpilih terdiri atas pengukuran pH, pengujian aktivitas rennet, penghitungan rendemen dan penilaian sensori.
Judul Skripsi : Seleksi Bakteri Asam Laktat Indigenous Indonesia untuk Starter Keju
Nama : Viska Awalia Susanti
NRP : F24080045
Menyetujui:
Mengetahui:
Ketua Departemen Ilmu dan Teknologi Pangan,
NIP. 19680526 199303 1 004 Dr. Ir. Feri Kusnandar, M.Sc
Tanggal Lulus :
Pembimbing I,
Dr. Ir. Nurheni Sri Palupi, M.Si NIP. 19610802 198703 2 002
Pembimbing II,
Dr. Yopi
BIODATA PENULIS
Viska Awalia Susanti. Lahir di Pamekasan pada tanggal 16 Mei 1990 dan merupakan anak pertama dari tiga bersaudara, pasangan Akhmad Biyanto dan R. Susmiyati. Penulis menyelesaikan pendidikan dasar pada tahun 2002 di SDN Barurambat Kota III, kemudian melanjutkan pendidikan menengah pertama di SMPN 2Pamekasan, hingga tahun 2005. Penulis menamatkan pendidikan menengah atas di SMA Negeri 1 Pamekasan pada tahun 2008, lalu melanjutkan pendidikan tinggi di Institut Pertanian Bogor (IPB) pada Departemen Ilmu dan Teknologi Pangan, Fakultas Teknologi Pertanian melalui jalur USMI (Undangan Seleksi Masuk IPB) pada tahun 2008.
vi
KATA PENGANTAR
Puji dan syukur penulis panjatkan kehadirat Allah SWT yang telah melimpahkan rahmat dan karunia-Nya sehingga skripsi yang berjudul “Seleksi Bakteri Asam Laktat Indigenous Indonesia sebagai Starter Keju”ini dapat diselesaikan. Penulisan skripsi ini didasarkan pada penelitian yang telah dilaksanakan sejak Februari 2012 sampai Juni 2012 di Laboratorium Biokatalis dan Fermentasi, Bioteknologi Lembaga Ilmu Pengetahuan Indonesia, Cibinong-Bogor.
Oleh karena itu, penghargaan dan ucapan terima kasih penulis sampaikan kepada:
1. Dr. Ir. Nurheni Sri Palupi, M.Si selaku dosen pembimbing pertama atas waktu, arahan, dan masukan yang diberikan kepada penulis.
2. Dr. Yopi selaku Ketua Laboratorium sekaligus pembimbing kedua yang dengan senang hati menerima dan mempercayakan mahasiswa untuk melakukan penelitian tugas akhir di Laboratorium Biokatalis dan Fermentasi LIPI, serta atas semua masukan, nasihat, dan arahan yang diberikan.
3. Ayahanda Akhmad Biyanto dan Ibunda R. Susmiyati atas asuhan, didikan dan kasih sayang, doa restu yang tulus, dorongan semangat dan motivasi agar ananda selalu tabah dan tegar menghadapi segala tantangan selama menempuh pendidikan di IPB.
4. Apridah Camelia Djohan dan Ade Andriani selaku asisten LBF-LIPI yang telah ikhlas menemani dan mengarahkan selama proses penelitian berjalan.
5. Saudara-saudaraku Virnanda Dwi Susanti dan Vabansa Triayatullah Ibrahim yang telah memberikan motivasi kepada penulis untuk menjadi manusia yang bermanfaat dan lebih baik lagi.
6. Teman-teman seperjuangan di LIPI:Yana Nuritasari, Rohanah, Yufi Sara Anggraini, Sri Megawati, Fitria Dewi, dan Widio Putranto atas kerjasama, kebersamaan dan bantuan yang diberikan selama melakukan penelitian.
7. Seluruh pihak yang secara tidak langsung menciptakan terealisasinya skripsi ini: teman-teman ITP 45, Keluarga Mahasiswa Madura, para karyawan LIPI, dan para karyawan Unit Pelayanan Terpadu.
Akhirnya kepada semua pihak yang telah membantu dalam melaksanakan pendidikan dan penelitian ini penulis menyampaikan terima kasih yang tidak terhingga. Semoga Allah SWT memberikan balasan yang setimpal.
Bogor, Juli 2012
vii
DAFTAR ISI
Halaman
KATA PENGANTAR……… vi
DAFTAR ISI……...………...………... vii
DAFTAR TABEL………...……….. ix
DAFTAR GAMBAR…….……… x
DAFTAR LAMPIRAN………….……… xi
I. PENDAHULUAN
1.1 LATAR BELAKANG………. 1
1.2 TUJUAN……….……….. 1
1.3 MANFAAT………….……… 1
II. TINJAUAN PUSTAKA
2.1 PENGOLAHAN KEJU………... 2 2.2 BAKTERI ASAM LAKTAT………. 3 2.3 SKRINING BAL UNTUK PEMBUATAN KEJU... 5
2.4 KURVA PERTUMBUHAN MIKROORGANISME………. 5
III. METODOLOGI PENELITIAN
3.1 BAHAN DAN ALAT PENELITIAN…...………. 8 3.2 METODE PENELITIAN……….. 8 3.2.1 SkriningPotensi Asam..……….………...………. 8 3.2.2 SkriningPotensi Protease…...……… 9 3.2.3 Skrining Potensi Koagulasi……….……… 10 3.2.4 Pembuatan Kurva Pertumbuhan……… 11 3.2.5 Pengujian dalam Pembuatan Keju……… 11
3.2.5.1 Pengukuran pH……… 12
3.2.5.2 Pengujian Aktivitas Rennet……… 12
3.2.5.3 Penghitungan Rendemen……… 14
3.2.5.4 Penilaian Sensori………. 14
IV. HASIL DAN PEMBAHASAN
viii
V. SIMPULAN DAN SARAN
5.1 SIMPULAN……….. 24 5.2 SARAN………. 24
DAFTAR PUSTAKA………. 25
ix
DAFTAR TABEL
[image:40.595.106.513.103.804.2]Halaman
Tabel 1. Metode IDF untuk pengelompokan keju……….. 4 Tabel 2. Komposisi MRS agar per liter... 9 Tabel 3. Hasil pengamatan kualitatif dan kuantitatif potensi asam... 16
Tabel 4. Hasil pengamatan kualitatif dan kuantitatif potensi protease serta kualitatif
koagulasi………...……… 18
x
DAFTAR GAMBAR
[image:41.595.85.519.92.812.2]Halaman
Gambar 1. Keju... 2 Gambar 2. Kurva pertumbuhan mikroorganisme... 6
Gambar 3. Tahapan penelitian……… 9
Gambar 4. Tahapan Skriningpotensi asam... 10 Gambar 5. Tahapan Skriningpotensi protease... 10 Gambar 6. Tahapan Skriningpotensi koagulasi…... 11 Gambar 7. Tahapan pembuatan kurva pertumbuhan.……… 12 Gambar 8. Tahapan pembuatan keju segar... 13 Gambar 9. Skriningasam (MRSA+CaCO3 0.5%)……… 15
Gambar 10. Skriningprotease (SMA)………... 17 Gambar 11. Skriningkoagulasi (susu pasteurisasi)………...………. 19 Gambar 12. Kurva pertumbuhan isolat terpilih……….……….. 20
Gambar 13. Terbentuk koagulum……… 21
xi
DAFTAR LAMPIRAN
Halaman Lampiran 1. Data pengulangan pembuatan kurva pertumbuhan……... 28 Lampiran 2. Data Ulangan Pengujian dalam Pembuatan Keju……... 29 Lampiran 3. Perhitungan resep rennet komersial Fromase® 50... 30 Lampiran 4. Data pembuatan kurva pertumbuhan... 30 Lampiran 5. Kemasan luar Fromase® 50……… 31
I. PENDAHULUAN
1.1
LATAR BELAKANG
Indonesia merupakan negara yang terkenal dengan keragaman hayati yang tinggi. Berbagai jenis tumbuhan, hewan, hingga mikroorganisme, semua tersedia melimpah di Indonesia (Machmud 2001). Begitu juga pada Bakteri Asam Laktat yang banyak berperan pada proses fermentasi spontan produk pangan. Peranan BAL pada produk pangan ini, dapat menambah keragaman potensi mikroba lokal khususnya sebagai starter indigenous Indonesia komersial. Fratiwi et al. (2008) menyatakan bahwa pemanfaatan BAL dan khamir yang banyak terdapat di alam Indonesia perlu dilakukan untuk menambah atau memperkaya koleksi mikroba, sehingga dapat dimanfaatkan sebagai starter dalam berbagai industri.
Keju adalah produk turunan susu yang digumpalkan dengan enzim penggumpal atau asam(Ditjen PPHP Deptan 2012) dansudah tidak asing lagi di Indonesia. Beberapa jenis produk keju yang berada di Indonesia yaitu keju lokal maupun impor, keju olahan, serta produk-produk pangan berisi dan bertabur keju.
Pemanfaatan BAL Indonesia dalam proses pembuatan keju yang sudah tidak asing lagi di Indonesiadapat dilakukan berdasarkan perannya sebagai pembuat suasana asam yang berpengaruh pada kecepatan proses koagulasi dan pembentuk citarasakeju (Daulay 1991). Oleh karena itu, dilakukan penelitian skala laboratorium tentang pemilihan Bakteri Asam Laktat indigenous Indonesia untuk starter keju dengan rennet komersial sebagai koagulan.
1.2
TUJUAN
Tujuan penelitian ini adalah (1) memilih isolat BAL indigenous koleksi LIPI-Cibinong yang berpotensi dalam pembentukan koagulum, dan (2) menentukan isolat BAL yang berpotensi tersebut menjadi starterkeju terpilih.
1.3
MANFAAT
II. TINJAUAN PUSTAKA
2.1
PENGOLAHAN KEJU
Food and agriculture organization (FAO) dari Perserikatan Bangsa-Bangsa menyusun suatu Pedoman Umum yang memberikan definisi sebagai berikut: keju adalah produk segar atau peram yang dihasilkan dengan pemisahan cairan (whey) dari koagulan setelah penggumpalan susu, krim, skim, susu mentega atau kombinasi diantaranya. Namun, definisi ini tidak berlaku untuk keju whey dan keju yang dibuat dengan proses-proses baru. Oleh karena itu, disusun definisi kedua untuk keju whey sebagai berikut: keju whey adalah produk yang dihasilkan dengan penggumpalan whey dengan atau tanpa penambahan susu atau lemak susu. Dengan demikian, definisi ini berlaku untuk keju Ziger (Jerman), keju Mysost dan Gjetost (Skandinavia), serta keju Urda (Romawi) (Daulay 1991).
Keju adalah salah satu produk turunan susu yang mengandung protein, vitamin, mineral, lemak jenuh dan kolesterol. Keju juga merupakan salah satu sumber terbaik kalsium dan juga mungkin mengandung tinggi sodium dan lemak jenuh. Satu setengah ons penyajian keju segar memiliki jumlah kalsium yang sama dengan satu cup susu atau yoghurt, yaitu sebesar 12 hingga 14 gram total lemak, 9 gram asam lemak jenuh, 44 mg kolesterol, dan 173 kalori. Sedangkan untuk kandungan sodium, satu cup susu memiliki kandungan sebesar 120 mg dan satu setengah ons keju segar memiliki kandungan sebesar 110 – 450 mg (Agricultural Marketing Service 1995).
Kualitas keju bergantung pada kualitas susu segar dan umur starter yang digunakan. Starter dapat diperoleh secara langsung dari suplier atau secara tidak langsung dari yoghurt atau buttermilk. Tekstur dan citarasa keju selain bergantung pada jenis starteryang digunakan, juga bergantung pada kandungan lemak susu, dan banyak sedikitnya kandungan air di keju. Susu memiliki kontribusi dalam penentuan kadar lemak dan air keju (Flores 2008).
Beberapa jenis keju, bau busuk atau off-flavours yang dihasilkan berasal dari jenis starter yang digunakan, ketidakcocokan strain atau campuran strain yang tidak seimbang dalam produksi asamnya, dan keberadaan antibiotik atau senyawa penghambat pertumbuhan lainnya. Hal ini dapat menyebabkan kegagalan keju, tingginya pH, dan tingginya kelembaban curd (Rose 1983).
Terdapat empat patogen yang harus diwaspadai dalam keamanan pangan keju khususnya keju segar yaituSalmonella spp., Escherichia coli, Listeria monocytogenes, dan Staphylococcus aureus. Namun keempat patogen tersebut dapat dikontrol dari sanitasi peralatan, pekerja, ruangan,
3
dan udara, kebersihan bahan baku keju serta mencegah adanya kemungkinan kontaminasi silang hingga keju siap konsumsi (Flores 2008).
Susu sapi mengandung 88% air dengan 3,7% lemak, 3,4% protein, 4,8% laktosa, dan 0,7% vitamin dan mineral (USDA 2005 dalam Flores 2008). Proses pembuatan keju menjadikan pembentukan curd dari padatan susu seperti lemak, protein dan mineral yang dipisahkan dan dikonsentrasikan. Sedangkan whey mengandung laktosa, air, protein sederhana, vitamin dan mineral (Hill 2006 dalam Flores 2008).
Pembuatan keju sangat dinamis prosesnya tergantung dari waktu, suhu, Bakteri Asam Laktat yang digunakan, dan enzim penggumpal (rennet) yang digunakan untuk mengonsentrasi dan memisahkan kasein susu dan lemak dari whey. Pengecualian untuk keju Queso Fresco atau Queso Blanco dari Amerika Latin dan Paneer dari India, keju tersebut dibuat tanpa menggunakan starter BAL dan rennet. Keju itu dibuat dari susu pasteurisasi yang ditambahkan asam seperti vinegar dari jus buah sehingga kasein susu mengendap. Tipe keju segar ini sangat mudah dibuat dan memiliki hasil yang banyak karena semua whey protein secara normal akan ikut terperangkap dalam curd yang terbentuk seperti gel. Jika gel sudah cukup kuat, lalu dipotong kecil-kecil dan dimasak hingga whey terpisah. Penghilangan whey mungkin akan menyebabkan curd menjadi kering sehingga curd dicuci dengan air untuk menambah kelembabannya. Suhu pemasakan dan penanganan curd akan berefek pada tekstur curd dan produk akhir yang dihasilkan. Jika curd tinggi kelembaban dan asamnya, garam dapat ditambahkan untuk menurunkan kelembaban dan memberi citarasa. Setelah penggaraman, curd dicuci lagi dengan air untuk menambah kelembabannya kembali. Lalu dimasukkan dalam alat pengepres sekaligus pencetak untuk memberi bentuk akhir produk. Sebelumnya, curd dibungkus terlebih dahulu dengan kain kasa. Saat pengepresan ini dapat ditambahkan kapang atau bakteri lain untuk proses pemeraman lanjut (Flores 2008).IDF (International Dairy Federation) (1981) dalam Daulay (1991) telah membuat katalog keju berdasarkan karakteristik-karakteristiknya yang tercantum pada Tabel 1.
2.2
BAKTERI ASAM LAKTAT
Bakteri Asam Laktat adalah bakteri yang mampu memfermentasikan gula atau karbohidrat untuk memproduksi asam laktat dalam jumlah besar. Ciri-ciri Bakteri Asam Laktat secara umum adalah selnya bereaksi positif terhadap pewarnaan Gram, bereaksi negatif terhadap katalase dan tidak membentuk spora. Sejauh ini diketahui bahwa Bakteri Asam Laktat tidak bersifat patogen dan aman untuk dikonsumsi sehingga dapat dipakai untuk meningkatkan kesehatan baik manusia maupun ternak (Widyastuti dan Eva 1999).
4
genus Streptococcus dan Leuconostoc dari famili Streptoccaceae dan genus Lactobacillus dari famili Lactobacillaceae (Daulay 1991).
[image:46.595.103.489.166.818.2]Bakteri Asam Laktat tersebar luas dalam beberapa habitat. Mereka mampu hidup dalam lingkungan berkadar karbohidrat tinggi, produk hancuran protein, vitamin dan rendah oksigen. Energi ATPnya didapat dari proses fermentasi dengan produk akhir fermentasi adalah sebagian besar asam laktat dan beberapa produk lain tergantung dari jenis fermentasi spesies BAL.
Tabel 1. Metode IDF untuk pengelompokan keju
Karakteristik
Macam (berdasarkan urutan konsumen)
Bahan baku Susu sapi, susu domba, susu kambing,
susu kerbau, kasein, albumin dan globulin
Konsistensi Keju sangat keras, keju keras, keju semi keras dan semi lunak, keju lunak, keju segar, keju dadih asam
Penampakan internal Berlubang bulat besar, berlubang bulat medium, berlubang bulat kecil, berlubang irregular, tanpa lubang, berlurik kapang hijau biru, berlutik kapang putih,
penambahan rempah-rempah, penambahan herbal
Penampakan eksternal Berkulit kering dan keras, berkulit keras dengan permukaan lengket, berkulit kering dan lunak, berkulit lunak dengan
permukaan lengket, berkulit lunak dengan kapang putih, berkulit lunak dengan kapang hijau, berkulit lunak dengan lapisan parafin, tanpa kulit
Lemak dalam bahan kering Keju dari susu skim, keju dari susu berlemak
Kandungan air Standar perdagangan, standar
diundangkan, nilai rataan
Homofermentasi menghasilkan lebih dari 80% asam laktat, sedangkan heterofermentasi menghasilkan 50% atau lebih asam laktat dan sisanya berupa asam asetat, format, karbon dioksida, dan etanol.
5
asam laktat dalam konsentrasi tinggi, kemampuannya dalam menekan pertumbuhan mikroorganisme lain, adalah keunggulannya dalam mempertahankan hidup di lingkungan yang berbeda-beda (Rose 1983).
Dalam pembuatan keju, BAL berperan dalam pembentukancurd karena BAL akan mengubah laktosa menjadi asam laktat sehingga pH susu akan turun. Dengan penurunan pH ini (menuju pH isoelektris), kasein susu sebagai protein akan mengendap dengan memerangkap beberapa padatan susu lainnya sehingga akan terpisah antara padatan (curd) dan cairan (whey) susu (Hill 2006 dalam Flores 2008). Selain itu, nilai pH rendah pada keju segar (5,0-5,2) membantu menekan pertumbuhan bakteri patogen dan bakteri pembusuk sehingga produk menjadi lebih awet. Bakteri Asam Laktat juga menghasilkan sekelumit aktivitas proteolitik dan lipolitik. Pada tingkatan yang lebih kecil, bakteri ini membantu pro