Dianur Pawe
ABSTRACT
ISOLATION AND IDENTIFICATION OF PROBIOTIC CANDIDATE BACTERIA FROM INDONESIAN SHRIMP PASTE (Mysis relicta)
By
DIANUR PAWE
Lactic acid bacteria (LAB) many found in fermented product and has been
reported to function as probiotic. Indonesian shrimp paste (terasi) is a
fermentation product of shrimp which wellknown as food flavour for Indonesian.
The objectives of this research was to isolate and identify probiotic candidate
bacteria of terasi origin Labuhan Maringgai, Lampung Timur. Starting with sampling the terasi from Desa Margasari Kecamatan Labuhan Maringgai Lampung Timur, following by isolating fermentative bacteria from terasi and selecting LAB on MRSA medium. Probiotic candidate bacteria acquired
Dianur Pawe and biochemical identification indicate T1a2 Isolate has nearly characteristic as
Corynebacterium sp.
Dianur Pawe
ABSTRAK
ISOLASI DAN IDENTIFIKASI KANDIDAT BAKTERI PROBIOTIK DARI TERASI UDANG REBON (Mysis relicta)
Oleh
DIANUR PAWE
Bakteri asam laktat (BAL) banyak ditemukan pada produk fermentasi dan telah dilaporkan banyak berfungsi sebagai probiotik. Terasi merupakan salah satu produk fermentasi dari udang yang digunakan sebagai bahan penyedap makanan oleh masyarakat Indonesia. Penelitian ini bertujuan untuk mengisolasi dan mengidentifikasi kandidat bakteri probiotik dari terasi udang asal Labuhan Maringgai, Lampung Timur. Diawali dengan sampling terasi udang dari Desa Margasari Kecamatan Labuhan Maringgai Lampung Timur, selanjutnya isolasi bakteri dilakukan menggunakan metode pengenceran bertingkat diikuti dengan seleksi BAL pada media MRS Agar. Kandidat bakteri probiotik yang diperoleh diuji daya hambatnya terhadap bakteri patogen yang meliputi: Staphylococus aureus, Salmonella enteritidis, Salmonella pullorum, dan Escheria coli. Hasil penelitian menunjukkan isolat dengan kode T1a2 merupakan BAL yang mampu menghambat Staphylococus aureus, Salmonella enteritidis, Salmonella pullorum,
Dianur Pawe
12,74cm2, 7,15cm2 dan 9,16cm2. Hasil identifikasi secara fisiologi, morfologi dan biokimiawi menunjukkan bahwa isolat T1a2 memiliki kesamaan sifat dengan genus Corynebacterium sp.
ISOLASI DAN IDENTIFIKASI KANDIDAT BAKTERI PROBIOTIK DARI TERASI UDANG REBON (Mysis relicta)
Oleh
DIANUR PAWE
Skripsi
Sebagai Salah Satu Syarat Untuk Mencapai Gelar SARJANA TEKNOLOGI PERTANIAN
pada
Jurusan Teknologi Hasil Pertanian Fakultas Pertanian Universitas Lampung
FAKULTAS PERTANIAN UNIVERSITAS LAMPUNG
ISOLASI DAN IDENTIFIKASI KANDIDAT BAKTERI PROBIOTIK DARI TERASI UDANG REBON (Mysis relicta)
(Skripsi)
Oleh
DIANUR PAWE
FAKULTAS PERTANIAN UNIVERSITAS LAMPUNG
DAFTAR GAMBAR
Gambar Halaman
1. Udang rebon (Mysis relicta) ... ... 8
2. Tingkat asam glutamate bebas (mg/100g) dalam produk udang fermentasi di berbagai Negara ... 14
3. Skema Pelaksanaan Penelitian ... 21
4. Skema produksi terasi udang rebon pada IRT milik Ibu Marni Desa Margasari Kecamatan Labuhan Maringgai, Lampung Timur ... 54
5. Pertumbuhan bakteri pada isolasi di media Nutrient Agar ... 55
6. Penyimpanan stok isolat murni pada media SIM .... ... 55
7. Bakteri Asam Laktat (BAL) pada media MRS agar ... 56
8. Skema isolasi bakteri dari terasi udang rebon asal Desa Margasari Kecamatan Labuhan Maringgai, Lampung Timur ... 57
9. Zona Jernih yang terbentuk dalam pengujian aktifitas Penghambatan bakteri patogen (Escherichia coli) ... ... 58
10. Zona Jernih yang terbentuk dalam pengujian aktifitas Penghambatan bakteri patogen (Staphylococus aureus) ... ... 58
11. Zona Jernih yang terbentuk dalam pengujian aktifitas Penghambatan bakteri patogen (Salmonella enteritidis) ... ... 58
12. Zona Jernih yang terbentuk dalam pengujian aktifitas Penghambatan bakteri patogen (Salmonella pullorum) ... ... 59
13. Uji pewarnaan gram + bentuk basil (T1a2) ... 59
14. Uji MR VP (Methyl Red/Voges Proskauer) ... 59
v
16. Uji katalase ... 60
17. Uji TSIA (Triple Sugar Iron Agar) ... 61
18. Uji MIO (Motility Indol Ornithyn)... ... 61
19. Uji LIA (Lysine Iron Agar) ... 62
20. Uji SCA (Simmons Citrate Agar) ... 62
DAFTAR ISI
Halaman
DAFTAR TABEL ... iv
DAFTAR GAMBAR ... v
I. PENDAHULUAN ... 1
1.1. Latar Belakang ... 1
1.2. Tujuan Penelitian ... 3
1.3. Kerangka Pemikiran ... 4
II. TINJAUAN PUSTAKA ... 7
2.1. Udang Rebon (Mysis relicta) ... 7
2.2. Terasi Udang Rebon (Mysis relicta) ... 9
2.3. Bakteri Asam Laktat ... 14
2.4. Bakteri Probiotik ... 16
III. METODE PENELITIAN ... 19
3.1. Tempat dan Waktu Penelitian ... 19
3.2. Bahan dan Alat ... 19
3.3. Metode Penelitian ... 20
3.4. Pelaksanaan Penelitian ... 20
1. Pengambilan Sampel Terasi ... 22
2. Isolasi Bakteri Terasi Udang ... 22
3. Tahap Pemurnian Kultur Bakteri ... 23
4. Seleksi Isolat Bakteri Asam Laktat ... 24
ii
6. Identifikasi Isolat Terpilih ... 26
a. Uji Pewarnaan Gram ... 26
b. Uji Motilitas ... 26
c. Uji Katalase ... 27
d. Uji TSIA (Triple Sugar Iron Agar) ... 27
e. Uji MIO (Motility Indol Ornithin) ... 28
f. Uji SCA (Simmons Citrate Agar) ... 29
g. Uji MR (Methyl Red) ... 29
h. Uji VP (Voges Proskauer) ... 30
i. Uji O/F (Oksidative/Fermentative) ... 30
j. Uji LIA (Lysine Iron Agar) ... 31
IV. HASIL DAN PEMBAHASAN ... 32
4.1. Pengambilan Sampel Terasi Udang Rebon (Mysis relicta) ... 32
4.2. Isolasi Bakteri Terasi Udang Rebon (Mysis relicta) ... 33
4.3. Seleksi Bakteri Asam Laktat (BAL) ... 35
4.4. Uji Aktifitas Penghambatan Bakteri Patogen ... 37
4.5. Identifikasi Isolat Kandidat Probiotik ... 41
V. KESIMPULAN DAN SARAN ... 45
5.1. Kesimpulan ... 45
5.2. Saran ... 45
DAFTAR PUSTAKA ... 46
LAMPIRAN ... 52
Tabel 8 – 10 ... 53
DAFTAR TABEL
Tabel Halaman
1. Kandungan gizi udang rebon per 100 gram ... 9
2. Kandungan gizi terasi udang ... 10
3. Sifat – sifat morfologi koloni hasil isolasi ... 34
4. Isolat bakteri asam laktat dengan media MRS agar ... 37
5. Pengujian aktifitas antibakteri isolat BAL terhadap bakteri patogen ... 39
6. Luas zona hambat kandidat bakteri probiotik terhadap bakteri patogen ... .. 40
7. Identifikasi isolat kandidat bakteri probiotik ... ... 41
8. Perhitungan luas sumuran pada pengujian aktifitas penghambatan bakteri patogen ... 53
9. Perhitungan luas zona jernih dengan luas sumuran kandidat bakteri probiotik (Isolat T1a2) terhadap bakteri patogen ... 53
Dengan rasa syukur kehadirat Allah SWT
Ku Persembahkan Karya Sederhana ini Kepada:
Mama dan Papa tercinta,
Kakak dan Adikku tersayang
,
keponakan-keponakanku tersayang,
Keluarga besarku
Sahabatku
Serta
Para Pendidikku dan
RIWAYAT HIDUP
Penulis dilahirkan di Panjang, pada tanggal 30 Oktober 1993 sebagai anak kedua dari empat bersaudara dari Bapak Abd Jumar Pawe dan Ibu Mariana.
Penulis menyelesaikan Taman Kanak-kanak di TK Setia Kawan Panjang pada tahun 1999, Sekolah Dasar (SD) di SD Negeri 1 Panjang Selatan pada tahun 2005, Sekolah Lanjutan Tingkat Pertama (SLTP) di SLTP Negeri 23 Bandar Lampung pada tahun 2008 dan Sekolah Menengah Atas di SMA Taman Siswa Teluk Betung, Bandar Lampung pada tahun 2011. Pada tahun 2011, penulis diterima sebagai mahasiswa Jurusan Teknologi Hasil Pertanian Fakultas Pertanian Universitas Lampung melalui jalur Seleksi Nasional Masuk Perguruan Tinggi Negeri Tertulis (SNMPTN Tertulis).
SANWACANA
Puji Syukur kehadirat Allah SWT, yang telah memberikan rahmat dan
hidayah Nya sehingga skripsi ini dapat diselesaikan.
Skripsi dengan judul “Isolasi dan Identifikasi Kandidat Bakteri Probiotik
dari Terasi Udang Rebon (Mysis relicta)” adalah syarat untuk memperoleh gelar Sarjana Teknologi Pertanian di Universitas Lampung. Pada kesempatan ini
penulis ingin menyampaikan ucapan terima kasih kepada:
1. Bapak Prof. Dr. Ir. Wan Abbas Zakaria, M.S., selaku Dekan Fakultas
Pertanian.
2. Ibu Ir. Susilawati, M.Si., selaku Ketua Jurusan Teknologi Hasil Pertanian.
3. Ibu Dyah Koesoemawardani, S.Pi.,M.P selaku pembimbing Akademik dan
Pembimbing Utama atas kesediaanya memberikan bimbingan, pengarahan,
bantuan, nasihat saran kepada penulis sampai selesainya skripsi ini.
4. Bapak Mahrus Ali S.Pi.,M.P.,selaku pembimbing kedua atas segala
bimbingan, pengarahan, saran, dukungan, serta bantuannya kepada penulis
sehingga penulis dapat menyelesaikan skripsi ini.
5. Bapak Ir. Samsul Rizal, M.Si., selaku Penguji atas saran, dan pengetahuan
6. Para staf di Laboratorium Bakteriologi Balai Veteriner Lampung drh. Ari, Ibu
Ima, Ibu Ngatini, Pak Ujang dan Pak Kamso dan seluruh staf dan karyawan
Balai Veteriner Lampung atas bantuan yang telah diberikan kepada Penulis.
7. Papa (Jumar Pawe), Mama (Mariana), Abang (Firman) dan Adikku (Tri dan
Tika) tercinta atas segala dukungan, dorongan, kasih sayang, serta doa yang
selalu terucap ditiap sujudnya untukku.
8. Mamak, Gunes SP, Nunuk Amd, Bu Desi, Jao, Dio dan saudara – saudaraku
tercinta atas bantuannya selama ini.
9. Abi Sutriono atas bantuan, semangat, kepedulian, kasih sayang dan doanya
untuk membantu menyelesaikan skripsi ini.
10. Sahabatku tercinta Ani, Artha, Fida, Neri dan Via terima kasih atas bantuan,
canda tawa, motivasi dan pengalaman yang telah diberikan kepada penulis.
11.Tim penelitian Kakak Putra dan Devi atas bantuan dan kerjasama dalam
menyelesaikan penelitian.
12. Keluargaku THP 11 “Janji Gerhana”, atas semangat yang kalian tularkan
serta rasa kekeluargaan yang sangat berkesan.
13. Seluruh keluarga besar THP FP UNILA terima kasih atas kebersamaannya.
Penulis berharap semoga karya sederhana ini dapat bermanfaat bagi kita
semua dan diridhoi oleh Allah SWT. Amin
Bandar Lampung, 19 Agustus 2015 Penulis
I. PENDAHULUAN
1.1.Latar Belakang
Salah satu komoditas yang cukup besar di perairan Indonesia atara lain udang
rebon (Mysis relicta). Kandungan gizi dalam 100 gram udang rebon segar adalah protein 16,2 gram dan mengandung kalsium 757 mg (Direktorat Gizi Depkes,
1992). Udang rebon (Mysis relicta) tergolong dalam perishable product, memiliki masa simpan pendek dan sifat yang mudah busuk jika tidak diberikan
perlakuan untuk mengawetkan yaitu dengan cara fermentasi. Hasil studi pada
produk fermentasi udang asin, ikan asin, gatot, growol, tape, tempe, asinan buah
dan asinan sayuran mengandung bakteri asam laktat Lactobacillus plantarum, Streptococcus thermophilus dan Pediococcus pentosaleus yang mampu mengawetkan produk (Rahayu, 2000). Produk fermentasi udang rebon yang
banyak beredar dipasaran yaitu terasi. Salah satu produsen terasi yang cukup
besar di Provinsi Lampung yaitu Kecamatan Labuhan Maringgai kabupaten
Lampung Timur.
Berdasarkan SNI (1992), terasi adalah jenis penyedap makanan yang memiliki
bentuk padat dengan bau yang khas hasil fermentasi udang/ikan atau campuran
keduanya dengan garam atau bahan tambahan lainnya. Bahan baku pembuatan
2 sehingga memungkinkan untuk dihancurkan secara sempurna (Suprapti, 2002).
Selama proses fermentasi umumnya menggunakan kadar garam yang cukup tinggi
(20% sampai 30%), untuk menyeleksi mikroba yang dapat menghasilkan racun
(Reed, 1982). Selain penambahan garam, pada proses fermentasi juga diperlukan
sumber karbohidrat yang merupakan sumber energi bagi mikroba yang berperan
dalam fermentasi tersebut. Bahan yang ditambahkan dalam pembuatan terasi
adalah tepung tapioka, tepung beras, atau tepung lainnya. Bahan-bahan inilah
yang selanjutnya menentukan mutu dan cita rasa terasi yang dihasilkan. Fungsi
tapioka pada produksi terasi adalah sebagai substrat bagi pertumbuhan
mikroorganisme dan penambah volume terasi (Astawan dan Astawan, 1989).
Pembuatan produk-produk fermentasi ikan/udang lainnya juga ditambahkan
garam dalam jumlah yang optimum untuk merangsang pertumbuhan bakteri asam
laktat misal pada rusip dengan penambahan garam dan beras sangrai terdapat
bakteri asam laktat yaitu Streptococcus dan Lactobacillus, sedangkan pada rusip dengan penambahan garam dan gula merah yaitu Streptococcus dan Leuconostoc (Dessi, 1999). Lactobacillus sp dan Streptococcus sp merupakan isolat BAL yang berhasil diisolasi dari cincalok alamiah (Widhyastuti, 2011). Proses fementasi
selama produksi terasi berlangsung karena ada aktivitas enzim yang berasal dari
tubuh udang itu sendiri atau berasal dari mikroorganisme dan berlangsung dalam
kondisi lingkungan terkontrol. Proses penguraian ini dapat berlangsung dengan
atau tanpa aktivitas mikroorganisme, terutama dari golongan jamur dan ragi
3 Pada fermentasi pembuatan terasi udang rebon (Mysis relicta) terjadi proses autolisis atau enzimatis dengan adanya aktivitas bakteri, dalam hal ini halofilik atau halotoleran. Proses fermentasi berlangsung secara anaerobik oleh mikrobia
anaerob atau obligat anaerob. Fermentasi ini dapat menghasilkan
bakteri/metabolit bakteri asam laktat yang dapat membunuh bakteri patogen
(bersifat probiotik). Bakteri probiotik merupakan mikroorganisme yang bukan
golongan patogen, jika dikonsumsi memberikan pengaruh positif terhadap
fisiologi dan kesehatan inangnya (Schrezenmeir dan de Vrese, 2001). Manfaat
bakteri probiotik sangat baik sehingga perlu dilakukan isolasi dan identifikasi dari
produk hasil pertanian yang banyak ditemukan di pasaran salah satunya yaitu
produk terasi udang. Mengingat informasi mengenai identifikasi dari bakteri yang
berpotensi sebagai probiotik dari produk terasi udang masih sangat terbatas, maka
perlu dilakukan isolasi kandidat bakteri probiotik yang terdapat pada terasi udang.
1.2.Tujuan Penelitian
Penelitian ini bertujuan sebagai berikut:
1. Mengisolasi kandidat bakteri probiotik dari terasi udang rebon asal Lampung
Timur.
2. Mengidentifikasi kandidat bakteri probiotik dari terasi udang rebon asal
4 1.3.Kerangka Pemikiran
Terasi (Indonesian shrimp paste) merupakan produk awetan ikan–ikan kecil atau rebon yang telah diolah melalui proses pemeraman atau fermentasi, penggilingan
atau penumbukan, dan penjemuran (Sharif et al, 2008). Pembuatan terasi di Desa Margasari, Kecamatan Labuan Maringgai Kabupaten Lampung Timur masih
dilakukan secara tradisional yaitu bahan mentah berupa rebon atau udang dicuci
terlebih dahulu dengan menggunakan air laut hingga bersih dengan menyeleksi
ikan dan kotoran yang ada. Penggunaan air laut pada saat pencucian agar rebon
tidak rusak karena jika diberi air tawar maka akan berbau busuk saat dilakukan
pengolahan. Setelah bersih rebon diberikan garam dengan perbandingan udang
rebon dan garam sebesar ± 10:1. Selanjutnya dilakukan penyimpanan selama
semalam dalam keadaan tertutup rapat sehingga tidak terkontaminasi. Rebon
yang sudah difermentasi dilakukan penjemuran di atas para-para hingga kering
dan ditumbuk halus dengan menggunakan lesung. Setelah halus dibuat menjadi
bongkahan–bongkahan dan dilakukan penjemuran hingga kering.
Rahayu et al (1992) menduga bahwa pada terasi terdapat mikroba jenis Micrococcus, Corynebachterium, Cytophaga, Bacillus, HaloBacterium, dan Acinobacter. Saisthi (1967), menemukan bahwa bakteri Gram positif batang yang menghasilkan aroma asam organik yang khas, Gram negatif oval batang nonmotil
yang memproduksi bau khas daging yang merangsang, dan Gram positif
berbentuk batang panjang, memproduksi aroma yang berasal dari degradasi asam
amino. Pada awal proses fermentasi setiap mikroorganisme dapat tumbuh karena
5 terjadi penurunan pH akibat penambahan garam dan perombakan karbohidrat oleh
bakteri asam laktat. Semakin lama waktu fermentasi akan menyebabkan pH
semakin turun yang disebabkan perombakan karbohidrat oleh bakteri asam laktat
menjadi asam laktat.
Setiap mikroorganisme memiliki kisaran pH yang masing–masing mempunyai pH
optimum. Pada produk fermentasi yang ditambahkan garam terdapat dua jenis
mikroba yaitu bakteri obligat halofilik dan bakteri halofilik. Bakteri obligat
halofilik tumbuh pada suhu 5-50oC dan tumbuh optimum pada suhu 35-40oC, pH antara 6-10. Pada konsentrasi garam yang tinggi menghasilkan gas H2S dan indol dengan warna koloni merah muda (Sjafi, 1988). Selain itu dilaporkan bahwa
beberapa produk fermentasi juga menghasilkan bakteri asam laktat yang berfungsi
sebagai probiotik karena sifat biokimia dari senyawa-senyawa sederhana yang
terbentuk akibat fermentasi.
Pada produk bekasang (makanan fermentasi ikan dari wilayah timur Indonesia)
adalah Staphylococcus dan Lactobacillus sp (Ijong dan Otha, 1996), sedangkan pada fermentasi saus ikan dengan penambahan 25% garam dan disimpan suhu
500C, bakteri asam laktat yang berkembang yaitu Staphylococcus, Micrococcus dan Bacillus (Lopetcharat dan Park, 2002) dan saus ikan dari Thailand yang ditambahkan garam sebanyak 30%, dengan penambahan nasi panggang, padi atau
kulit padi panggang dengan ikan air tawar dilaporkan berkembang bakteri
Streptococcus, Staphylococcus, Micrococcus dan Bacillus sp (Adams et al,1985). Produk Tempoyak terdapat bakteri asam laktat yang berkembang yaitu genus
6 fermentasi tradisional dari Turki) merupakan genus Lactobacillus, Lactococcus dan Leuconoctoc (Sahingil et al, 2009). Selain itu, BAL Lactobacillus casei juga berhasil diisolasi dari Filzetta (makanan fermentasi tradisional dari Itali) (Conter
et al, 2005). Setiap BAL tersebut memiliki karakter yang berbeda-beda. Studi formulasi cincalok skala laboratorium telah dilakukan oleh Dyastuti (2012)
melaporkan BAL dari cincalok formulasi merupakan genus Lactobacillus, Lactococcus, Streptococcus dan Enterococcus.
Bakteri probiotik merupakan mikroorganisme non patogen, jika dikonsumsi
memberikan pengaruh positif terhadap fisiologi dan kesehatan inangnya
(Schrezenmeir dan de Vrese, 2001). Syarat probiotik adalah tidak patogen,
toleran terhadap asam dan garam empedu, mempunyai kemampuan bertahan pada
proses pengawetan dan dapat bertahan pada penyimpanannnya serta memiliki
kemampuan memberi efek kesehatan yang sudah terbukti (Shortt, 1999). Pada
penelitian ini akan dilakukan isolasi bakteri probiotik yang termasuk dalam
golongan bakteri asam laktat pada produk fermentasi udang yaitu terasi. Melihat
kurangnya informasi mengenai identifikasi bakteri yang berpotensi sebagai
probiotik dalam produk terasi udang asal Lampung, maka perlu dilakukan
penelitian untuk pelaporan bakteri probiotik golongan BAL yang terdapat pada
II. TINJAUAN PUSTAKA
2.1.Udang Rebon (Mysis relicta)
Udang rebon merupakan salah satu hasil laut dari jenis udang-udangan dengan ukuran kecil yang mana bila dibandingkan dengan udang jenis lain. Ukuran yang kecil membuat jenis udang ini disebut “rebon”. Gambar udang rebon dapat dilihat pada Gambar 1. Mancanegara lebih terkenal dengan namashrimp paste. Udang rebon merupakan zooplankton dengan ukuran panjang 1-1,5cm yang terdiri dari kelompok Crustacea yaitu Mysidocea acetes dan larva peraedae yang ditemukan disekitar muara (Nontji, 1986). Udang ini adalah salah satu bahan baku yang digunakan untuk pembuatan terasi. Udang jenis ini lebih mudah ditemukan dalam bentuk terasi ataupun dikeringkan dibandingkan dalam bentuk segar.
8
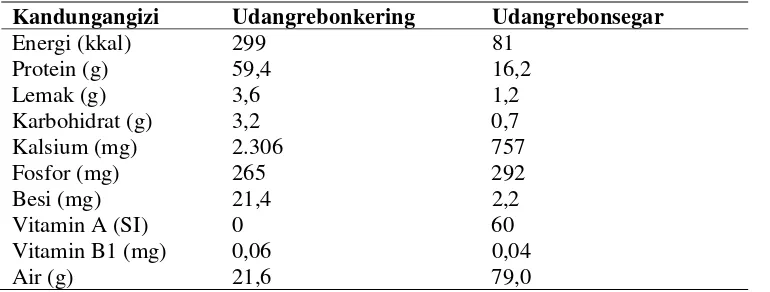
sebesar 21,4g atau setara dengan 8 kali kandungan gizi 100g daging sapi (Persagi, 2009).Kandungan gizi 100g rebon segar dapat dilihat pada Tabel 1.
Klasifikasi udang rebon yaitu: kingdom : Animalia filum : Crustaceae class : Arthropoda ordo : Malacostraca famili : Penaeidae
genus : Penaeus
species : Mysis relicta
Gambar 1. Udang rebon (Mysis relicta)
9
bermanfaat dalam mengikat kolesterol sehingga sangat bermanfaat mengingat memakan seafood seringkali terdapat dampak negatif berupa kenaikan kolesterol darah. Kitosan mulai bekerja saat bercampur dengan asam lambung.
Pencampuran ini akan menjadikan gel sehingga mengikat kolesterol dan lemak dari makanan. Sehingga LDL menurun dan perubahan perbandingan HDL terhadap LDL. Kandungan gizi udang rebon per 100g dapat dilihat pada Tabel 1.
Tabel 1.Kandungan gizi udang rebon per 100 g.
Kandungangizi Udangrebonkering Udangrebonsegar
Sumber: Direktorat Gizi Depkes (1992).
2.2.Terasi Udang Rebon (Mysis Relicta)
10
sertapenambahangaram yang kemudiandilanjutkandenganfermentasi.Proses fermentasi dalam pembuatan terasi berlangsung karena adanya aktivitas enzim yang berasal dari tubuh ikan (atau udang) itu sendiri. Kandungan gizi terasi udang dapat dilihat pada Tabel 2.
Tabel2.Kandungangiziterasiudang rebon
Cara pengolahan terasi secara tradisional yaitu bahan mentah berupa rebon atau udang dicuci terlebih dahulu kemudian dilakukan proses penjemuran. Setelah kering, ditumbuk halus, untuk hasil yang baik dapat ditambah garam selama ditumbuk. Garam ditambahkan sedikit saja agar tidak terlalu asin, tetapi cukup memberi rasa (Hadiwiyoto, 1993). Prinsip proses fermentasi adalah adanya enzim proteolitik pada tubuh ikan dan mikroba karena penggunaan konsentrasi garam yang tinggi. Hasil penguraian protein ini adalah peptida asam amino dan komponen cita rasa.
11
dan amin menyebabkan bau anyir. Senyawa belerang sederhana seperti sulfida, merkaptan, dan disulfida menyebabkan bau yang merangsang pada terasi. Senyawa-senyawa karbonil besar sekali kemungkinannya dapat memberikan bau khusus yang terdapat pada hasil-hasil perairan yang diawetkan dengan cara pengeringan, penggaraman, ataudengan cara fermentasi. Senyawa-senyawa volatil yang terdapat dalamterasiberasal dari lemakmelalui proses oksidasi dan karena adanyaaktivitas mikroba. Kandungan karbonil volatil merupakan kandungan senyawa volatil yang terbesar diantara komponen volatil lainnya. Senyawa tersebut merupakan senyawa yang sangat menentukan citarasa dari terasi.
Terasi dihasilkan dari proses fermentasi dengan menggunakan garam sebagai pengawet dan penyelaksian mikroba yang tumbuh. Pembuatan terasi dapat berlangsung karena adanya aktifitas enzim yang berasal dari tubuh udang itu sendiri dan mikroorganisme yang tumbuh selama proses fermentasi. Fermentasi adalah suatu proses penguraian menjadi senyawa – senyawa yang lebih sederhana oleh enzim yang berasal dari mikroorganisme dalam kondisi tertentu. Fermentasi yang berlangsung secara spontan yaitu fermentasi yang dilakukan tanpa
penambahan mikrooganisme tertentu. Mikroorganisme tertentu dari lingkungan tetap bisa berkembang biak dalam media yang terseleksi.Selama proses
fermentasi, terasi mengalami perubahan-perubahan meliputi hidrolisis protein, perubahan pH, perubahan warna, dan pembentukan cita rasa.
1. Hidrolisis Protein
12
hidrolisis. Protein dihidrolisis oleh enzim proteinase ekstraseluler menjadi turunannya yaitu pepton, peptida dan asam amino. Kandungan nitrogen pada cairan mula-mula rendah tapi setelah disimpan beberapa hari, yaitu selama proses fermentasi menyebabkan terjadinya proses hidrolisis protein sehingga kandungan nitrogen terlarut naik. Pada suhu fermentasi yang tinggi 55ºC dapat mempercepat proses hidrolisis. Tetapi setelah 1 minggu fermentasi kandungan protein terlarut dalam cairan lebih tinggi bila fermentasinya dilakukan pada suhu 45ºC (Rahayu et al, 1992).
2. Perubahan pH
Campuran garam, rebon dan bahan lain pada awalnya mempunyai pH 6 dan selama proses fermentasi pH terasi naik menjadi 6,5 dan pada tahap akhir turun menjadi 4,5. Bila fermentasi dilanjutkan akan terjadi peningkatan pH dan produksi ammonia.
3. Perubahan warna dan tekstur
Terasi yang dibuat dari udang memiliki warna khas coklat kemerahan. Warna merah dipengaruhi oleh pigmen apstaxanthin pada cangkang udang. Menurut Shahidi dan Botta (1994), warna kemerahan pada terasi udang berasal dari pigmen
astaxanthin pada cangkang udang sehingga pigmen tersebut membentuk warna merah. Suzuki (1981), berpendapat sebagian besar tubuh udang mengandung
astaxanthin. Kandungan astaxanthin dalam udang utuh beku sebesar 3,12 mg/ 100 g berat basah.
Warna kecoklatan pada terasi udang disebabkan karena adanya enzim
13
penggelapan warna pada terasi udang. Penambahan garam (NaCl) bertujuan untuk menghambat kerja enzim bersebut. Menurut Ozdemir (1997) dan Garcia dan Barrett (2002), sodium klorida atau NaCl dapat menghambat kerja PPO sehingga reaksi pencokelatan dapat dihalangi. Proses penghambatannya meningkat ketika pH menurun.
Perubahan lain yang diharapkan selama fermentasi yang diharapkan adalahliquid fiksi. Setelah proses penggaraman, cairan dari dalam ikan (udang) terekstrak keluar. Penurunan kadar air ini akan membentuk tekstur yang diinginkan. Nooryantinietal, (2010), menambahkan bahwa pembentukan tekstur terasi ditentukan oleh penjemuran dan penumbukan.
4. Pembentukan Cita Rasa
Proses fermentasi akan menghasilkan cita rasa yang khas pada terasi. Aroma khas pada terasi disebabkan oleh senyawa volatil yang dihasilkan oleh hidrolisis protein selama fermentasi. Saisthi (1967), menemukan bahwa bakteri gram positif batang yang menghasilkan aroma asam organik yang khas, gram negatif oval batang nonmotil yang memproduksi bau khas daging yang merangsang, dan gram positif berbentuk batang panjang, memproduksi aroma yang berasal dari degradasi asam amino.
2-14
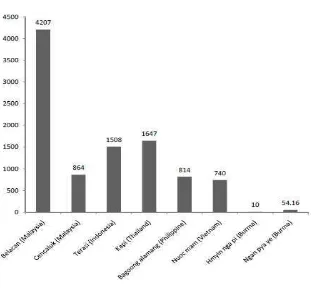
okso-glutarat (2-oxopentanedioic acid) oleh reduktif amonia fiksasi yang
menggunakan enzim dehidrogenase glutamat selama proses fermentasi (Hajep dan Jinap, 2012). Rasa umami produk fermentasi tergantung pada konsentrasi
glutamat didalamnya.
Gambar 2. Tingkat asam glutamate bebas (mg/100g) dalam produk udang fermentasi Di berbagai Negara(Hajep dan Jinap, 2012).
2.3. Bakteri Asam Laktat
15
Melissococcus, Oenococcus, Pediococcus, Streptococcus, Tetragenococcus, Vagococcus dan Weissella (Jay, 1992). Kelompok bakteri ini termasuk bakteri Gram positif, tidak berspora, tidak berpigmen mesofil, serta berbentuk kokus dan batang. Bakteri ini dapat hidup pada temperatur antara5 – 50 ºC dan bersifat katalase negatif (Perry et al, 1997).Bakteri asam laktat diperoleh dari
kemampuannya dalam memfermentasi gula menjadi asam laktat. Bakteri asam laktat juga terdapat dalam tubuh manusia sebagai flora normal tubuh (Prescott et al, 2002).Media selektif untuk pertumbuhan spesies bakteri asam laktat adalah deMan-Rogosa-Sharpe Agar (MRS Agar).Berdasarkan jalur metabolisme
saccharolytic, bakteri asam laktat dapat dibedakan menjadi dua kelompok yaitu
(Prescott et al, 2002) :
1. Homofermentatif : Bakteri dalam kelompok ini akan mengubah heksosa menjadi asam laktat dalam jalur Embden-Meyerhof (EM), dan tidak dapat memfermentasikan pentosa atau glukonat.
2. Heterofermentatif : Heksosa difermentasikan menjadi asam laktat, karbon dioksida, dan etanol (atau asam asetat sebagai akseptor elektron alternatif). Pentosa lalu diubah menjadi laktat dan asam asetat.
Beberapakeunggulan yang dimiliki BAL yaitu:
1. BAL mampu menghasilkan senyawa-senyawa yang dapat memberikan rasa dan aroma spesifikpada makanan fermentasi (Rahayu, 2001).
16
3. BAL menghasilkan senyawa antimikroba yang mampu menghambat
pertumbuhan mikroba patogen dan pembusuk pada bahan makanan sehingga dapat memperpanjang masa simpan produk tersebut.
Bakteri asam laktat merupakan kelompok bakteri yang paling banyak
menghasilkan bakteriosin. Secara umum, bakteriosin yang disekresikan oleh BAL merupakan peptida kationik kecil dengan 30 sampai 60 residu asam amino dan tahan terhadap pemanasan (Balasubramanyam et al, 1995).Berdasarkan penelitian yang telah dilakukan, ditemukan sebanyak lebih dari 50 jenis bakteriosin berbeda yang dihasilkan oleh BAL. Beberapa bakteriosin dari BAL yang telah
dikarakterisasi adalah Nisin yang dihasilkan dari beberapa strain Lactococcus lactis, Lactococcus A dan B dari Lactococcus lactissubsp.cremoris, Pediocin dari
Pediococcus acidilactici, Lactacin dari Lactobacillus jhonsonii, Lactostrepsin dari
Streptococcus cremoris, dan Curvacin dari Lactobacillus curvatus (Neetles et al, 1993).Senyawa-senyawaantimikroba yang dihasilkan BAL antaralain:asamlaktat, hidrogenperoksida, CO2, danbakteriosin (Holzapfel et al, 1995).
Produkutamanyayaituasamlaktat yang dapatterakumulasipadalingkungan di sekitarnyasehingga pH dapatmenurunhingga pH 4,0-4,8. Hal
inimenyebabkanmikrobapatogendanpembusuk yang umumnyahiduppada pH 6,0-8,0tidakdapattumbuh.
2.4.Bakteri Probiotik
17
mikrobiota usus dapat menguntungkan kesehatan konsumen kita dan dapat dipengaruhi oleh konsumsi probiotik setiap hari. Pada saat ini ilmu pengetahuan dan teknologi dalam ilmu fisiologi human maupun mikroorganisme
memungkinkan dengan tepat penentuan kriteria seleksi mikroorganisme dan yang secara ilmiah membuktikan aktivitasnya bagi promosi kesehatan. Kemampuan probiotik ini tidak terikat pada spesies, melainkan pada strain tertentu dalam suatu spesies. Karakterisitik probiotik yang diinginkan dari satu strain spesifik,
misalnya:
1. Mempunyai kapasitas untuk bertahan hidup (survive), untuk melakukan
kolonisasi (colonize), serta melakukan metabolisme (metabolize) dalam saluran cerna.
2. Mampu mempertahankan suatu keseimbangan mikroflora usus yang sehat melalui kompetisi dan inhibisi kuman-kuman patogen.
3. Dapat menstimulasi bangkitnya pertahanan imunitas, bersifat non-patogenik, dan non-toksik.
4. Harus mempunyai karakteristik teknologik yang baik, yaitu mampu bertahan hidup secara optimal dan stabil selama penyimpanan (storage) dan penggunaan (use) dalam bentuk preparat makanan yang didinginkan dan dikeringkan, agar dapat disediakan secara massal dalam industri.
Mekanisme probiotik melindungi atau memperbaiki kondisi inangnya antara lain dengan menghambat pertumbuhan bakteri patogen melalui beberapa cara antara lain dengan (Simadibrata, 2010):
1. Memproduksi substansi-substansi penghambat. Probiotik mampu
18
negatif. Zat-zat ini termasuk asam organik, hidrogen peroksida (H2O2), bakteriosin, reuterin yang mampu menghambat tidak hanya bakteri hidup namun juga produksi toksin.
2. Menghambat perlekatan bakteri patogen dengan berkompetisi di tempat perlekatan permukaan mukosa saluran cerna diduga juga merupakan salah satu cara probiotik menghambat invasi dari bakteri patogen.
III. METODE PENELITIAN
3.1. Tempat dan Waktu Penelitian
Penelitian ini dilaksanakan di Laboratorium Bakteriologi Balai Penyelidik dan
Pengujian Veteriner Regional III Bandar Lampung. Penelitian ini dilaksanakan
pada bulan Januari 2015 sampai dengan Juni 2015.
3.2. Bahan dan Alat
Sampel yang digunakan dalam penelitian ini adalah terasi yang telah siap
dipasarkan (produksi dari Desa Margasari, Kecamatan Labuhan Maringgai,
Lampung Timur). Bahan yang digunakan terdiri dari Isolat bakteri patogen
20 Alat-alat yang digunakan adalah mortal, pastel, autoklaf, labu erlenmeyer, cawan
petri, hot plate stirrer, pipet volume, kapas, kain kasa, alumunium foil, sprayer, gelas ukur, cuvet, gelas objek, vortex, inkubator, bunsen, mikropipet, pipet tip,
gelas preparat, jarum ose, tabung reaksi, rak tabung reaksi, timbangan digital,
oven, jangka sorong, pH meter dan alat non gelas lain.
3.3. Metode Penelitian
Penelitian ini akan dilakukan isolasi dan identifikasi kandidat bakteri probiotik
terasi udang asal Desa Margasari, Kecamatan Labuhan Maringgai, Kabupaten
Lampung Timur. Penelitian ini dilakukan dengan menggunakan tiga tahap
metode yaitu isolasi bakteri terasi udang rebon asal Desa Margasari, Kecamatan
Labuhan Maringgai, Kabupaten Lampung Timur , Pengujian isolat kandidat
bakteri probiotik terhadap aktifitas penghambatan pertumbuhan bakteri patogen
dengan metode difusi sumur agar dan Identifikasi isolat terpilih dengan pengujian
secara biokimiawi. Data yang diperoleh disajikan dalam bentuk tabel yang
dianalisis dengan metode deskriptif.
3.4. Pelaksanaan Penelitian
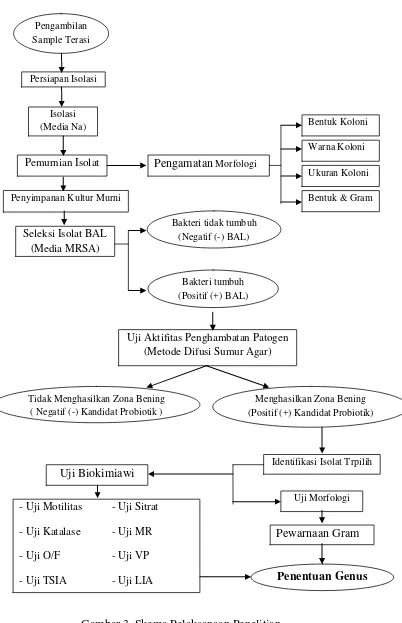
Pelaksanaan penelitian ini dilakukan dalam lima langkah yang meliputi (1)
pengambilan sampel terasi, (2) Isolasi bakteri terasi udang, (3) Tahap pemurnian
kultur bakteri, (4) Uji aktifitas penghambatan bakteri patogen dengan metode
difusi sumur agar, dan (5) Identifikasi isolat terpilih dengan melihat morfologi dan
21 ( Negatif (-) Kandidat Probiotik )
Menghasilkan Zona Bening
22 1. Pengambilan Sampel Terasi
Sampel terasi yang digunakan diambil dari industri rumah tangga terasi sekaligus
sebagai penjual di Desa Margasari, Kecamatan Labuhan Maringgai, Kabupaten
Lampung Timur. Pengambilan sampel diambil dari produk jadi yang siap
dipasarkan dalam bentuk bongkahan. Pengambilan sampel dilakukan dengan cara
mengambil sebanyak lima bongkahan terasi secara acak dari satuan produksi.
Diambil sebagian dari beberapa bongkahan tersebut dan dimasukkan ke dalam
wadah steril secara aseptis. Wadah yang telah diisi dengan sampel diberikan
label. Sampel yang terlah dikemas tersebut diletakkan didalam sterofoam
kemudian disimpan dalam coolbox dengan penambahan es di sekelilingnya sehingga suhu dalam sterofoam tetap terjaga. Sampel dibawa menuju
laboratorium untuk dilakukan pengujian lebih lanjut.
2. Isolasi Bakteri Terasi Udang
Sampel yang masih dalam bentuk bongkahan selanjutnya dihaluskan dengan
menggunakan mortal dan pastel di laboratorium secara aseptis. Sampel yang telah
halus dimasukkan kedalam tabung reaksi steril sebanyak 1 gram dan diencerkan
dengan larutan NaCl fisiologis steril dengan pengenceran 10-1– 10-5. Tujuan dilakukan pengenceran bertingkat yaitu memperkecil atau mengurangi jumlah
mikroba yang tersuspensi dalam cairan. Selanjutnya dilakukan pengujian lebih
lanjut dengan mengisolasi bakteri terasi udang yang merupakan kandidat bakteri
23 Penelitian ini dilakukan isolasi kandidat bakteri probiotik. Tahap isolasi bakteri
kandidat probiotik ini digunakan media isolasi yang nonselektif yaitu Nutrien agar (NA). Media nonselektif ini digunakan untuk menumbuhkan dan memelihara bakteri. Media NA steril dalam erlenmeyer steril dituangkan ke
dalam cawan petri steril. Isolasi bakteri terasi udang dilakukan di dalam 3 cawan
petri. Hal ini dilakukan untuk memastikan bahwa dalam masing-masing 3
ulangan ini didapatkan hasil yang sama. Sampel dalam tabung reaksi pada
pengenceran 10-1 hingga pengenceran 10-5 diambil sebanyak 1 ml dengan menggunakan pipet volume 1 ml steril, kemudian dituangkan ke dalam
masing-masing cawan petri yang telah dituangkan media Nutrien Agar steril. Selanjutnya
masing-masing cawan petri dibungkus dan dimasukkan ke dalam inkubator
dengan suhu 37o C selama 2–3 x 24 jam (Hardiningsing et al, 2006). Seleksi awal dilakukan dengan memilih bakteri yang memiliki kenampakan koloni, bentuk,
ukuran, dan warna yang berbeda. Bakteri yang memiliki karakter berbeda
selanjutnya dimurnikan kembali di media yang sama.
3. Tahap Pemurnian Kultur Bakteri
Pada tahap pemurnian dimulai dengan memilih koloni-koloni yang berbeda
sehingga didapatkan koloni tunggal (isolat murni). Mensterilkan jarum ose bulat,
lalu disentuhkan pada permukaan koloni bakteri kemudian diinokulasikan pada
permukaan medium NA dengan metode gores untuk mendapatkan koloni yang
terpisah, ini dilakukan beberapa kali sehingga didapatkan koloni yang benar-benar
24 koloni yang terbentuk benar-benar murni atau tidak (Oxoid, 1982). Setiap koloni
tunggal yang berbeda baik bentuk coloni, warna hingga bentuk dan gram setelah
pemurnian kemudian ditanam pada medium SIM untuk persiapan pengujian
selanjutnya.
4. Seleksi Isolat Bakteri Asam Laktat (BAL)
Penelitian ini dilakukan isolasi kandidat bakteri probiotik yang merupakan
golongan bakteri asam laktat (BAL). Sehingga perlu dilakukan seleksi pada
media seleksi agar untuk mengidentifikasi bahwa isolat merupakan bakteri asam
laktat (BAL) untuk mendapatkan kandidat probiotik. Pada seleksi BAL ini
digunakan media isolasi yang spesifik yang sering disebut sebagai media selektif.
Media selektif ini digunakan untuk menumbuhkan dan memelihara bakteri
tertentu. Dengan sifat kekhususannya maka akan menyeleksi BAL secara
langsung. Pada media ini hanya bakteri tertentu yang dapat tumbuh. Pada isolasi
BAL, media yang digunakan ialah media de Man Rogosa Sharpe Agar / MRS agar (Oxoid, 1982). Seleksi dilakukan dengan cara menginokulasi isolat murni ke
dalam media MRS agar dengan metode gores. Selanjutnya jika isolat positif BAL
maka akan tumbuh pada media MRS agar namun jika tidak maka tidak tumbuh
pada media MRS agar.
5. Uji Aktifitas Penghambatan Bakteri Patogen
Koloni murni (Isolat tunggal) yang telah didapat dilakukan pengujian terhadap
terhadap daya hambat aktifitas bakteri patogen. Pengujian ini berfungsi untuk
25 mempunyai potensi sebagai kandidat bakteri probiotik. Penelitian ini melakukan
uji aktifitas penghambatan bakteri patogen dengan menggunakan metode difusi
sumur(Garriga et al, 1993). Metode ini memungkinkan senyawa antimikroba yang dihasilkan dapat berfungsi dengan baik pada media semipadat sehingga
didapat zona bening yang terlihat jelas. Bakteri patogen yang digunakan adalah
Staphylococcus aureus (bakteri gram positif), Escherichia coli (bakteri gram negatif) , Pasteurella multocida type B (bakteri gram negatif), Salmonella
pullorum (bakteri gram negatif) dan Salmonella enteritidis (bakteri gram negatif). Media pertumbuhan yang digunakan untuk masing-masing bakteri uji adalah
Nutrien Agar yang merupakan media non selektif.
Media yang telah diinokulasi kultur bakteri uji tersebut dituang ke dalam cawan -
cawan dan dibiarkan hingga membeku. Kemudian dibuat empat lubang (sumur)
secara aseptis dengan diameter 4,20 mm dengan menggunakan tip pipet steril
yang dibelah dua. Sebanyak 65μL kultur kandidat bakteri probiotik masing –
masing diteteskaan kedalam lubang sumur yang berbeda dalam satu cawan
kemudian dengan posisi cawan tidak terbalik pada suhu 37oC selama 2 hari (48 jam). Pada setiap cawan tersebut dibuat sebuah lubang kontrol yang berisi MRSB
(kontrol negatif) dan isolat bakteri yakult (kontrol positif) . Zona bening disekitar
sumur sebagai zona penghambat terhadap bakteri patogen (Scheved et al, 1993). Diameter zona hambat (mm) merupakan parameter yang digunakan untuk
menentukan resistensi bakteri. Menurut Pratiwi (2008), Area jernih
mengindikasikan adanya hambatan pertumbuhan mikroorganisme oleh agen
26 6. Identifikasi Isolat Terpilih
Identifikasi bakteri dilakukan dengan menggunakan serangkaian uji morfologi dan
biokimiawi, yaitu uji pewarnaan gram, uji Motilitas, uji katalase, uji oksidative fermentative (O/F), uji Triple Sugar Iron Agar (TSIA), uji Sitrat, uji Methyl Red (MR), uji Voges Proskauer (VP), uji lysine Iron Agar (LIA) dan uji Motility Indol Ornithyn (MIO). Identifikasi isolat terpilih mengacu pada Cowan and Steels
“Manual for the Identification of medical Bacteria” (1974). Berikut ini cara kerja
dari indentifikasi isolat terpilih dengan uji biokimia menurut Gani (2003).
a. Uji Pewarnaan Gram
Pengamatan morfologi koloni dilakukan dengan teknik pewarnaan gram.
Pertama-tama ulasan bakteri dibuat pada gelas objek dan dilakukan fiksasi.
Sebanyak 2-3 tetes gram A (kristal violet) diteteskan pada koloni bakteri, diamkan
selama 60 detik. Kemudian preparat dicuci dengan menggunakan air mengalir
lalu dikeringanginkan. Sebanyak 2-3 tetes gram B (larutan lugol) diteteskan di
atas preparat dan dibiarkan selama 60 detik. Preparat dicuci dengan air mengalir
lalu dikeringanginkan. Preparat kemudian ditetesi 2-3 tetes larutan alkohol-aseton
dan dibiarkan selama 60 detik lalu dicuci kembali dan dikeringanginkan.
Selanjutnya preparat ditetesi dengan larutan safranin sebanyak 2-3 tetes dan
didiamkan selama 60 detik, lalu dicuci dan dikeringanginkan. Setelah itu diamati
di bawah mikroskop.
b. Uji Motilitas
Menurut Cowan (1974), uji motil digunakan untuk mengetahui kemampuan
27 diinokulasikan dengan cara ditusuk pada medium SIM tegak, lalu diinkubasi pada
suhu 37oC selama 2 x 24 jam. Hasil positif (motil) apabila terdapat rambatan-rambatan di sekitar bekas tusukan jarum pada medium dan hasil negatif (non
motil) bila tidak terdapat rambatan-rambatan disekitar bekas tusukan jarum ose
pada medium.
c. Uji Katalase
Uji ini dilakukan untuk melihat kemampuan bakteri dalam menghasilkan enzim
katalase, maka dilakukan uji katalase. Uji katalase merupakan uji untuk
mengidentifikasi mikroba yang mampu menghasilkan enzim katalase, digunakan
untuk memecah hidrogen peroksida yang terbentuk dari proses respirasi aerob dan
bersifat toksik terhadap bakteri, menjadi dihidrogen oksida (H2O) dan oksigen (O2). Isolat bakteri diambil sebanyak 1 ose (ose bulat) dari masing-masing stok kultur kemudian dicelupkan ke dalam reagen H2O2 yang telah diisi ke dalam tabung reaksi. Hasil positif apabila terbentuk gelembung gas pada ose, dan hasil
negatif apabila tidak terbentuk gelembung gas.
d. Uji TSIA (Triple Sugar Iron Agar)
Uji TSIA merupakan uji biokimiawi untuk mengetahui kemampuan mikrob dalam
memfermentasi glukosa, sukrosa dan laktosa yang terkadung pada medium.
Proses fermentasi pada medium TSIA akan dihasilkan Asam format yang
kemudian dioksidasi sempurna menjadi gas hidrogen (H2) dan karbondioksida (CO2) dengan bantuan enzim Formate Hydrogenase. Gas H2 bersifat tidak larut dalam media sehingga terakumulasi dalam bentuk gelembung udara di sepanjang
28 tersebut menyebabkan media agar menjadi terangkat atau pecah. Berbeda dengan
gas CO2 yang bersifat lebih mudah larut dalam media sehingga tidak terbentuk gelembung udara di jalur inokulasi.
Isolat bakteri diambil sebanyak 1 ose (ose lurus) dari masing-masing stok kultur
kemudian diinokulasikan dengan cara ditusukkan pada medium TSIA. Kemudian
diambil lagi 1 ose (ose bulat) isolat bakteri dari masing-masing stok kultur dan
digores pada permukaan medium. Selanjutnya diinkubasi selama 2 sampai 3x24
jam pada suhu 37oC. Perubahan yang diamati setelah inkubasi adalah warna medium menjadi kuning menandakan asam, warna medium menjadi lebih merah
menandakan medium menjadi basa, warna menjadi hitam menandakan
terbentuknya H2S dan bila medium terangkat menandakan bahwa mikroba tersebut mampu untuk memproduksi gas.
e. Uji MIO
Uji Indolbertujuan untuk mendeteksi kemampuan mikroba mendegradasi asam
amino triptofan (Cappucino dan Sherman, 1996). Koloni yang akan diidentifikasi
diambil menggunakan ose. Koloni diinokulasi pada satu media uji motil indol
urea yang berupa agar semisolid dengan cara ditusuk. Media diinkubasikan pada
suhu kamar selama 18-24 jam. Pergerakan bakteri ditunjukan dengan adanya
penyebaran koloni di sekitar tusukan. Reaksi urea positif ditunjukkan perubahan
warna media menjadi merah muda. Reaksi indol positif ditunjukkan dengan
penambahan pereaksi kovac yang kemudian akan menghasilkan cincin merah di atas permukaan, dan menunjukan negatif jika menghasilkan cincin jingga di atas
29 f. Uji Sitrat
Uji ini untuk mengetahui jenis bakteri yang mengutilisasi sitrat. Bakteri yang
bermanfaat sitrat sebagai sumber karbon akan menghasilkan Natrium Karbonat
yang bersifat alkali, sehingga dengan adanya indikator Brom Thymol Blue menyebabkan warna biru pada media. Koloni yang akan diidentifikasi diambil
menggunakan ose. Koloni ditanamkan secara gores zig-zag pada media
perbenihan simmons citrate yang berupa agar miring. Kemudian media diinkubasikan pada suhu 37oC selama 18-24 jam. Koloni berwarna biru
menunjukkan hasil positif sedangkan koloni berwarna hijau menunjukkan reaksi
negatif.
g. Uji MR (Methyl Red)
Uji ini bertujuan untuk menentukan adanya fermentasi asam campuran. Beberapa
bakteri memfermentasikan glukosa dan menghasilkan berbagai produk yang
bersifat asam sehingga akan menurunkan pH media pertumbuhan menjadi 5,0
atau lebih rendah. Penambahan indikator pH “methyl red” dapat menunjukkan adanya perubahan pH menjadi asam. Sebanyak 1 ose (ose bulat) isolat bakteri
diambil dari stok kultur dan diinokulasikan pada medium MR-VP cair dalam
tabung reaksi. Selanjutnya diinkubasi selama 18 - 24 jam pada suhu 37oC. Sebanyak 5 tetes methyl-red ditambahkan di atas preparat isolat bakteri. Hasil positif apabila terbentuk kompleks berwarna merah muda sampai merah yang
30 h. Uji VP (Voges Proskauer)
Tujuan uji ini adalah untuk mendeteksi adanya acethyl methyl carbinol yang diproduksi oleh bakteri tertentu dalam pembenihan VP. Adanya bakteri tertentu
yang dapat memproduksi acethyl methyl carbinol dapat diketahui dengan penambahan reagen 5% alpha naftol dan ml KOH 40%. Koloni sebanyak 1 ose
(ose bulat) isolat bakteri diambil dari stok kultur dan diinokulasi pada medium
MR-VP cair dalam tabung reaksi. Selanjutnya diinkubasi selama 18-24 jam pada
suhu 37oC. Kemudian ditambahkan reagen alpha naftol 0,6 ml dan 0,2 ml KOH 40%. Suspensi tersebut dikocok selama 20-30 detik. Reaksi VP positif, bila terjadi pembentukan asam yang ditandai berubahnya warna medium menjadi
merah muda setelah penambahan pereaksi.
i. Uji O/F
Tujuan uji oksidative fermentative adalah untuk mengetahu sifat oksidasi dan fermentasi suatu bakteri terhadap glukosa. Uji ini dilakukan untuk mengetahui
kemampuan mikroorganisme untuk menggunakan karbohidrat dengan cara
fermentasi atau oksidasi (Cowan and Steel’s, 1974). Dua medium O/F dalam
tabung reaksi disediakan selanjutnya dilakukan inokulasi bakteri ke medium.
Pada medium yang telah diinokulasikan bakteri ditambahkan paraffin cair steril setebal 1 cm pada salah satu tabung reaksi. Inkubasi dilakukan pada suhu kamar
selama 18-24 jam. Pengamatan dilakukan dengan melihat perubahan warna yang
terjadi dalam medium. Bakteri bersifat fermentative jika kedua medium yang diinokulasi berubah warna menjadi kuning. Bakteri bersifat oksidatif jika tabung
31 j. Uji Lysine Iron Agar (LIA)
Uji LIA dilakukan untuk mengetahui jika bakteri hanya memfermentasi dekstrosa
maka dasarnya akan berwarna kuning, tetapi bakteri yang memfermentasi
dekstros serta memotong ikatan karboksil asam amino lysine, maka pH kembali menjadil alkali sehingga akan terlihat medium secara keseluruhan bewarna ungu
dengan adanya indikator Brom crose purple. Terjadinya warna ungu pada seluruh bagian media uji berarti tes positif. Jika tidak ada perubahan warna atau dasarnya
berwarna kuning maka tes dinyatakan negatif. Bakteri yang telah didapatkan
diinokulasi ke media LIA, Kemudian diinkubasi pada inkubator selama 18-24
jam. Pengamatan stelah inkubasi dengan mengamati perubahan reaksi yang
terjadi, bakteri dikatakan memiliki enzim Lysin decarboxilase ditandai dengan perubahan warna yang makin merah, sebaliknya jika medium semakin pudar
V. KESIMPULAN DAN SARAN
5.1. Kesimpulan
1. Isolat T1a2 berhasil diisolasi dari terasi udang asal Lampung Timur dan
diidentifikasi sebagai kandidat bakteri probiotik karena memiliki kemampuan
dalam menghambat pertumbukan bakteri patogen dengan melihat dari zona
jernih yang dibentuk selama proses pengujian aktifitas antibakterinya.
2. Isolat T1a2 telah diidentifikasi melalui uji fisiologis, morfologi dan uji
biokimia sederhana sebagai genus Corynebacterium sp.
5.2. Saran
Penelitian ini hanya mengisolasi bakteri yang bersifat sebagai kandidat probiotik.
Sehingga diperlukan penelitian dan identifikasi lebih lanjut guna mengetahui
spesies dari isolat dan mengetahui klasifikasi bakteri probiotik dengan memenuhi
syarat sebagai bakteri probiotik seperti : Uji Toksisitas, Uji Ketahanan terhadap
Asam Lambung (pH), Uji Ketahanan Garam Empedu dan Uji Ketahanan
DAFTAR PUSTAKA
Adam, M.R., Cooke, R.D and Rattagool, P. 1985. Fermented Fish Products of S.E Asia. Trop. Sci. 25 : 61 -73.
Adawyah, R. 2008. Pengolahan dan Pengawetan Ikan. Penerbit Bumi Aksara. Jakarta. 137 hlm.
Alfianto dan liviawaty. 2005. Pembuatan Terasi. Available from URL : http://khadik-astro.com. Diakses tanggal 05 Oktober 2014.
Anihouvi, V.B., Dawson, E.S., Ayenor, G.S and Hounhouigan, J.D. 2007. Microbiological Changes in Naturally Fermented Cassava Fish (Pseudotolithus sp) for Lanhouin Production. Journal of Food Microbiology. 116; 287-291.
Astawan, M.W dan Astawan, M. 1989. Teknologi Pengolahan Pangan Hewani Tepat Guna. Akademika Pressindo. Bogor. 120 hlm.
Balasubramanyam, B.V and Varadaraj, M.J. 1995. Antibacterial Effect of Lactobacillusspp. On Foodborne Pathogenic Bacteria in an Indian Milk Based Fermeted Culinary Food Item. Cultured Dairy Product J. 30 : 22-24.
Burkovski, A. 2008. Corynebacteria: Genomics and MolecularBiology.http:// www. horizonpress.com. Diakses tanggal 1 Juni 2015.
Cappuccino, J.G and N. Sherman. 1996. Microbiology: A Laboratory Manual. 4th edition. California : The Benjamin.Cumming Publishing Company. 464 hlm.
Cardici, B.H and S. Citak. 2005. A Comparison of Two Methods Used for Measuring Antagonistics Activity of Lactic Acid Bacteria. Pakistan Journal of Nutrition. 4 (4): 237-241.
47
Cowan, S.T. 1974. Cowan and Steel’s. Manual for the Identification of Medical Bacteria. 2nd ed. Cambridge University Press Cambridge. London. 238 hlm.
Dessi. 1999. Sifat Kimia dan Ciri – Ciri Bakteri Pada Rusip yang Dibuat dengan Berbagai Sumber Karbon. (Skripsi). Program Studi Teknologi Hasil Pertanian. Fakultas Pertanian. Universitas Sriwijaya. Indralaya.
Direktotat Gizi Depkes. 1992. Produk Fermentasi Ikan Garam. Balai Besar Riset Pengolahan Produk dan Bioteknologi Kelautan dan Perikanan.
Dyastuti, E.A. 2012. Pengaruh Penambahan Serbuk Bawang Putih (Allium sativum) dan Serbuk Cabai (Capsium Annuum L.) terhadap Karakteristik Cincalok. (Skripsi). Jurusan Kimia. Fakultas MIPA. Universitas Tanjungpura. Pontianak.
FAO/WHO. 2001. Joint FAO/WHO Expert Consultation on Evaluation of Health and Nutritional Properties of Probiotics in Food Including Powder Milk with Live Lactic Acid Bacteria. Amerian Córdoba Park Hotel. Córdoba. Argentina. 34 hlm.
Gani, A. 2003. Metode Bakteriologi Diaknoktik. Balai Besar Laboratorium Kesehatan (BBLK). Makasar. Hlm 98 – 99.
Garcia, E and Barrett D.M. 2002. Fresh-cut Fruits and Vegetables: Science, Technology, and Market – Preservative Treatments for Fresh-cut Fruits and Vegetables, Edited by Olusola Lamikanra. CRC Press.Florida. 452 hlm.
Garriga, M, M. Hugas, T. Aymerich and J. M. Monfort. 1993. Bacteriocinogenic Activity of Lactobacilli from Fermenter Sausages. J. Appl. Bact. 75 : 142 – 148.
Guerra, N.P., Bernardez, P.F., Mendez, J., Cachaldora, P andCastro, L.P. 2006. Production of Four Potentially Probiotic Lactic Acid Bacteria and Their Evaluation as Feed Additives for Weaned Piglets. Animal Feed Science and Technology. 134 : 89-107.
Hadiwiyoto, S. 1993. Teknologi Pengolahan Hasil Perikanan. Fakultas Teknologi Pertanian. UGM. Liberty. Yogyakarta. 275 hlm.
Hajeb dan Jinap. 2012. Fermented Shrimp Products as Source of Umami in Southeast Asia. Journal Nutrition & Food Science. Sci Saf 10 : 006. ISSN: 2155-9600.
48
Hasanah, Ratifah. 2013. Isolasi dan Identifikasi Bakteri dari Produk Fermentasi Telur Ikan Tambakan (Helostoma temminckii C.V). Jurnal Ilmu
Perikanan Tropis. Vol. 19. No. 1, Oktober 2013 – ISSN 1402-2006 44. Holzapfel, W.H., Haberer, P., Geisen, R., Bjorkroth, J and Schillinger, U. 2001. Taxonomy and Important Features of Probiotic Microorganisms in Food and Nutrition. American Journal of Clinical Nutrition. 73 (2) : 365S – 373S.
Ibrahim, S.M and Desouky, S.G. 2009. Effect of Antimicrobial Metabolites Produced by Lactic Acid Bacteria on Quality Aspect of Frozen Tilapia (Oreochromis niloticus) Filets. World Journal of Fish and Marine Scienes. 1 (1) : 40-45.
Ijong, F.G. and Otha, Y. 1996. Pysicochemical and Microbiological Changes Associated with Bakasang Processing a Traditional Indonesian Fermented Sauce. Journal of the Science of Food an Agrikulture. 71 (1) : 69 – 74. Jay, J.M. 1992. Modern Food Microbiology. 4th edition. hapman and Hall. New
York. Hlm : 268 – 277, 371 – 403.
Kanmani, P., Kumar, R. S., Yuvaraj, N., Paari, K. A., Pattukumar, V and Arul, V. 2010. Comparison of Antimicrobial Activity of Probiotic Bacterium Streptococcus phocae P180, Enterococcus faeciumMC13 and
Carnobacterium divergensAgainst Fish Pathogen. World Journal of Dairy and Food Sciences. 5(2): 145-151.
Lopetcharat, L and Park, J.W. 2002. Characteristik of Fish Sauce Made From Pacific Whiting and Surimi By-Product During Fermentation Stage. Journal of Food Science. Vol. 67 No. 2.
Marliana. 1992. Pengaruh Perbedaan Konsentrasi Gula Merah dan Garam
Terhadap Mutu Efisiensi Terasi Udang. (Skripsi). Jurusan hasil perikanan IPB. Bogor. 132 hlm.
Melia, Sri dan Juliyarsi, Indri. 2007. Potensi Dadih Susu Sapi Mutan Lactococus lactis dengan Kandungan Bakteriosin terhadap Bakteri Patogen. Artikel Penelitian. Fakultas Peternakan. Universitas Andalas. 17 hlm.
Murray, P.R., Rosenthal, K.S and flaller, M.A. 2005. Medical Microbiology. Publisher : Elsevier Mosby. Philadelphia. hlm 221 – 258.
Neetles, C.G and Barefoot, S.F. 1993. Biochemical and Genetic Characteristics of Bacteriocin of Food-Associated Lactic Acid Bakteria. Journal Food Prot. Vol. 56 : 338-356.
49
Noor, Wahud. 2012. Identifikasi Molekuler dan Pengaruh Pemberian Probiotik Bakteri Asam Laktat (BAL) Asal Dadih dari Kabupaten Sijunjung
terhadap Kadar Kolesterol Daging pada Itik Pitalah Sumber Daya Genetik Sumatera Barat. Artikel Penelitian. Program Pascasarjana Universitas Andalas. Padang. 32 hlm.
Nooryantini, S, Yuspihana, F, dan Rita, K. 2010. Kualitas Terasi Udang dengan Suplementasi Pediococcus Halophilus (FNCC-0033). Jurnal Hasil Perikanan. 1 : 55-56.
Nurainy, F. 1991. Aspek Kimia dan Mikrobiologi Fermentasi Tempoyak. (Skripsi). Fakultas Teknologi Pertanian UGM. Yogyakarta.
O. Tsuzukibashi, S. Uchibori, N. Kuwahara, T. Kobayashi, K. Takada and M. Hirasawa. 2014. A Selective Medium for The Isolation of
Corynebacterium Species in Oral Cavities. Journal of Microbiological Methods Vol. Xxx : xxx – xxx.
Oxoid. 1982. The Oxoid Manual of Culture Media, Ingredients and Other Laboratory Services. Fifth Edition. Published by Oxoid Limited, Wade Road. Basingtoke. Hampshire. England. 371 hlm.
Ozdemir, M. 1997. Food Browning and Its Control. Muhendislik Gida Ticaret Ltd. http://www.okyanusbilgiambari.com. Diakses tanggal 1 Oktober 2014.
Perry, J.J. and Stanley, J.T. 1997. Microbiology, Dynamics and Diversity. USA : Saunders College Publishing. Hlm : 480 – 490, 864 – 869.
Persagi. 2009. Tabel Komposisi Pangan Indonesia. PT Elex Media Komputindo. Jakarta. 27 hlm.
Prado, F. C., J. L. Parada, A. Pandey, and C. R. Soccol. 2008. Trends in Non-Dairy Probiotic Beverages. Food Res. Int. 41:111-123.
Pratiwi, S.T. 2008. Mikrobiologi Farmasi. Erlangga. Jakarta. 237 hlm. Prescott, L.M., Harley, J.P. and Aklein, D. 2002. Microbiology. Fifth edition.
McGraw-Hill Companies Inc. New York. Hlm 529 – 532.
Purwati, E., S. Syukur, dan Z. Hidayat. 2005. Lactobacillus sp. Isolasi dari Biovicophitomega sebagai Probiotik. Di dalam Proceeding Lembaga Ilmu Pengetahuan Indonesia. Jakarta 24 -25 Januari 2005.
50
Rahayu, S.E. 2000. Bakteri Asam Laktat dalam Fermentasi dan Pengawetan Makanan. Prosiding Seminar Nasional Industri Pangan. PATPI. Surabaya. 10 – 11 Oktober. Hlm 298 – 307.
Rahayu, E. 2001. Potensi Bakteri Asam Laktat di Bidang Industri Pangan. Prosiding Seminar Ilmiah Tahunan Perhimpunan Mikrobiologi Indonesia. Kalimantan Selatan. 30 Agustus – 1 September. Hlm : 349 – 356.
Rahman. 1992. Teknologi Fermentasi. Penerbit Arcan. Pusat Antar Universitas Pangan dan Gizi. IPB-Bogor.
Reed, G. 1982. Economic Microbiology Fermentation Food. Vol 7. Academic Press. New York.
Sahingil, D., Isleroglu, H., Yildirim, Z., Akcelik, M and Yildirim, M. 2009. Characterization of Lactococcin BZ Produced by Lactococcus lactis subsp. Lactis BZ Isolated from Boza. TUBITAK. Turk Journal Biol. 35 : 21-33. Saitshi, P. 1967. Traditional Fermented Fish Product with Special Reference to
Thai Products. Asean food journal. Vol 3 : 3-10.
Schved, F, Lalazar, A. and Hens, Y. 1993. Purification, Partial, Characterization, and Plasmids Linkage of Pediococcins SJ-1, a Bacteriocins Prodused by Pediococcus acidilactici. Journal of Applied Environmental Microbiology. 76 (1): 67-77.
Schrezenmeir, J and M. de Vrese. 2001. Probiotics, Prebiotics and Symbiotics-Approaching a Definition. American Journal of Clinical Nutrition. 73 (suppl) : 361S-364S.
Shahidi, F and Botta, J.R. 1994. Seafoods: Chemistry, Processing Technology and Quality. Blackie Academic and Professional. Wester Cleddens Road, Bishopbriggs. Glasgow G64 2NZ. United Kingdom. London. hlm 3 – 9.
Sharif, R., Ghazali, A. R., Rajab, N. F., Haron, H., & Osman, F. 2008.
Toxicological evaluation of some Malaysian locally processed raw food products. Food and Chemical Toxicology. 46 : 368-374.
Shortt, C. 1999. Probiotic Century : Historical and Current Perspectives Trends . Food Science Tecnologi. 10 : 411-417.
Simadibrata, M. 2010. Probiotik-Peranannya dalam Dunia Medis. Cermin Dunia Kedokteran (CDK) Januari – Februari 2010. Vol 38 no 1 : 65-68. ISSN: 0125 – 913XI 182.
51
Stamer, J.R. 1979. The Lactic Acid Bacteria. Microbes of Diversity. Food Technol. Vol (1): 60 – 65.
Standar Nasional Indonesia. 1992. Terasi Udang. Badan Standardisasi Nasional. SNI 01.2716.1992.
Sujaya, I N., Y. Ramona, N.P. Widarini, N.P. Suariani, N.M.U. Dwipayanti, K.A. Nocianitri dan N.W. Nursini. 2008.Isolasi dan Karakteristik Bakteri Asam Laktat dari Susu Kuda Sumbawa . J. Vet. 9 (2) : 52 – 59.
Suprapti, L. 2002. Membuat Terasi. Kanisius. Yogyakarta. 43 hlm.
Susanto, T. 1993. Pengantar Pengolahan Hasil Pertanian. Fakultas Pertanian, Universitas Brawijaya. Malang.
Suzuki, T. 1981. Fish and Krill Protein Processing Technology. Applied Science Publishers Ltd. London. ISBN 0-85334-954-1. 260 hlm
Verschuere.L, Rombaut, G. Sorgeloos,P dan Verstraete,W. 2000. Probiotic Bacteria as Biological Control Agents in Aquaculture. Microbiolgical and Molecular Biologi Review. 64: 655-671.
Vine, N.G, W.D. Leukes, H. Kaiser, S. Daya, J. Baxter & T. Hecht. 2004. Competition for Attachment of Aquaculture Candidate Probiotic and Pathogenic Bacteria on Fish Intestinal Mucus. J. Fish Dis. 27: 319–326. Waluyo, L. 2008. Teknik dan Metode Dasar dalam Mikrobiologi. Universitas
Muhammadiyah Malang Press. Malang. 366 hlm.