BAKTERI ASAM LAKTAT ASAL BEKASAM
SEBAGAI KANDIDAT PROBIOTIK
NUR SYAFIQOH
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER
INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul Bakteri Asam Laktat Asal Bekasam sebagai Kandidat Probiotik adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, 31 Januari 2014
Nur Syafiqoh
ABSTRAK
NUR SYAFIQOH. Bakteri Asam Laktat Asal Bekasam sebagai Kandidat Probiotik. Dibimbing oleh DESNIAR dan IRIANI SETYANINGSIH.
Penelitian eksplorasi bakteri asam laktat (BAL) yang mempunyai potensi sebagai probiotik terus dilakukan. Salah satu sumber BAL yang berpotensi sebagai kandidat probiotik adalah bekasam. Tujuan penelitian ini untuk menyeleksi dan mengevaluasi BAL asal bekasam sebagai kandidat probiotik. Tiga isolat BAL asal bekasam diseleksi dan dievaluasi sifat probiotiknya secara in
vitro, kemudian dikarakterisasi, dan diidentifikasi dengan API KIT CHL 50. Hasil
penelitian menunjukkan bahwa semua isolat memiliki ketahanan hidup yang tinggi pada pH lambung dan pH usus dengan 0,5% garam empedu (ketahanan hidup ≥50%). Ketiga isolat memiliki aktivitas antimikrob terhadap
Enteropathogenic Escherichia coli, Staphylococcus aureus, dan Salmonella typhimurium ATCC 14028. Karakteristik ketiga isolat BAL adalah Gram-positif
berbentuk batang, tidak motil, katalase negatif, dan homofermentatif. Hasil identifikasi diperoleh bahwa isolat SK(5) dan NS(9) adalah Lactobacillus
plantarum 1 dengan kemiripan 99,9% dan 99,5%, sedangkan BP(10) adalah Lactobacillus pentosus dengan kemiripan 99,9%.
Kata kunci: bakteri asam laktat, bekasam, in vitro, kandidat probiotik
ABSTRACT
NUR SYAFIQOH. Lactic Acid Bacteria of Bekasam Origin as Probiotic Candidate. Supervised by DESNIAR dan IRIANI SETYANINGSIH.
Explotary studies of lactic acid bacteria (LAB) that have the potential as probiotic are continously conducted. One source of LAB which has potential as probiotic candidate is bekasam. The aims of this study were to select and evaluate LAB of bekasam origin as probiotic candidate. Three isolates of LAB of bekasam origin have isolated, selected, and evaluated their probiotic properties by in vitro method, then characterized, and identified with API 50 CHL. The result showed that all isolates well grown in gastric juice pH and small intestines pH with 0.5% bile salt (SR ≥50%). Three isolates showed antimicrobial activity to
Enteropathogenic Escherichia coli, Staphylococcus aureus, and Salmonella typhimurium ATCC 14028. Characteristics of three LAB isolates candidate as
probiotic were Gram-positive rod shaped, non motile, negative catalase, and homofermentative. The results of the identification found that SK(5) and NS(9) were Lactobacillus plantarum 1 with 99.9% and 99.5% similarities, while BP(10) was Lactobacillus pentosus with 99.9% similarities.
© Hak Cipta Milik IPB, Tahun 2014
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Dilarang mengumumkan dan memperbanyak sebagian atau seluruh karya tulis ini dalam bentuk apa pun tanpa izin IPB
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada
Departemen Teknologi Hasil Perairan
BAKTERI ASAM LAKTAT ASAL BEKASAM
SEBAGAI KANDIDAT PROBIOTIK
NUR SYAFIQOH
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
Judul Skripsi : Bakteri Asam Laktat Asal Bekasam sebagai Kandidat Probiotik
Kode : Nur Syafiqoh
NIM : C34090054
Program Studi : Teknologi Hasil Perairan
Disetujui oleh
Dr Desniar, SPi, MSi Pembimbing I
Dr Ir Iriani Setyaningsih, MS Pembimbing II
Diketahui oleh
Dr Ir Joko Santoso, MSi Ketua Departemen
KATA PENGANTAR
Puji dan syukur penulis panjatkan kepada Tuhan Yang Maha Esa atas segala karunia-Nya sehingga penulis dapat menyelesaikan skripsi dengan judul Bakteri Asam Laktat Asal Bekasam sebagai Kandidat Probiotik. Skripsi ini merupakan salah satu syarat untuk memperoleh gelar sarjana pada Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Pada kesempatan ini, dengan segala kerendahan hati penulis ingin mengucapkan terima kasih kepada semua pihak yang telah memberikan bantuan dan dorongan hingga penulis dapat menyelesaikan skripsi ini, yaitu:
1 Dr Desniar, SPi, MSi dan Dr Ir Iriani Setyaningsih, MS selaku dosen pembimbing yang telah memberikan pengarahan dalam penyusunan skripsi ini,
2 Dr rer nat Kustiariyah Tarman, SPi, MSi selaku dosen penguji yang telah memberikan saran dan kritik untuk perbaikan skripsi ini,
3 Dr Eng Uju, SPi, MSi selaku wakil ketua program studi yang telah mewakili departemen pada saat ujian dan saran perbaikan.
4 Dr Ir Joko Santoso, MSi selaku ketua Departemen Teknologi Hasil Perairan, 5 Ibu Ema Masruroh, SSi; Dini Indriani, AMd; Saeful Bahri, AMd; Ibu Ari; dan Ibu Butet yang telah membantu penulis selama penelitian di Laboratorium,
6 Ayah, Ibu, dan Adik, serta seluruh keluarga yang telah memberikan motivasi kepada penulis,
7 Teman seperjuangan THP 46 (alto), khususnya Annisa Saskia, atas kebersamaan dan suka duka selama penelitian serta penyusunan skripsi ini, 8 Serta adik-adik THP 47, 48, dan kakak S2 THP, atas segala doa dan kerja
samanya.
Penulis menyadari bahwa penulisan skripsi ini masih jauh dari sempurna. Oleh karena itu kritik dan saran yang bersifat membangun dari semua pihak sangat diharapkan. Semoga skripsi ini dapat memberikan manfaat bagi semua pihak yang memerlukannya.
Bogor, 31 Januari 2014
DAFTAR ISI
DAFTAR TABEL ... viii
DAFTAR GAMBAR ... viii
DAFTAR LAMPIRAN ... viii
PENDAHULUAN ... 1
Latar Belakang ... 1
Perumusan Masalah ... 2
Tujuan Penelitian ... 2
Manfaat Penelitian ... 3
Ruang Lingkup Penelitian ... 3
METODE PENELITIAN ... 3
Waktu dan Tempat ... 3
Bahan ... 3
Alat ... 4
Prosedur Penelitian ... 4
Ketahanan Hidup Isolat BAL pada pH Lambung (pH 2,0) dan pH Usus (pH 7,2) (Lin et al. 2006) ... 4
Ketahanan Hidup Isolat BAL pada pH Usus (pH 7,2) dengan Garam Empedu 0,5% (Argyri et al. 2013) ... 5
Uji Aktivitas Antimikrob Isolat BAL (Modifikasi Savadogo et al. 2004) ... 6
Karakterisasi Isolat BAL SK(5), BP(10), dan NS(9) ... 6
Uji motilitas (Tiwari et al. 2009) ... 7
Uji fermentasi glukosa (Hayward 1957) ... 7
Uji katalase (Cappucino dan Sherman 1983) ... 7
Uji perwarnaan Gram (Tiwari et al. 2009) ... 7
Identifikasi Isolat Bakteri Asam Laktat ... 7
HASIL DAN PEMBAHASAN ... 8
Ketahanan Hidup Isolat BAL pada pH Lambung (pH 2,0) dan pH Usus (pH 7,2) ... 8
Ketahanan Hidup Isolat BAL pada pH Usus (pH 7,2) dengan Garam Empedu 0,5% ... 11
Aktivitas Antimikrob ... 13
Karakterisasi Isolat Bakteri Asam Laktat (BAL) dari Bekasam (SK(5), BP(10), dan NS(9)) ... 15
Identifikasi Isolat Bakteri Asam Laktat (BAL) dari Bekasam dengan API KIT 50 CHL ... 16
KESIMPULAN DAN SARAN ... 19
Kesimpulan ... 19
Saran ... 20
DAFTAR PUSTAKA ... 21
LAMPIRAN ... 25
DAFTAR TABEL
1
Ketahanan hidup isolat BAL asal bekasam pada pH lambung(pH 2,0) dan pH usus (pH 7,2) selama 3 jam ... 9
2
Ketahanan hidup isolat BAL asal bekasam pada pH usus (pH 7,2) dengan garam empedu 0,5% selama 4 jam ... 113
Hasil pengujian aktivitas antimikrob isolat BAL asal bekasam SK(5), BP(10), dan NS(9) ... 134 Hasil uji karakterisasi isolat BAL SK(5), BP(10), dan NS(9) ... 16
5 Hasil fermentasi gula isolat BAL asal bekasam... 18
6 Hasil identifikasi API 50 CHL ... 19
DAFTAR GAMBAR
1 Diagram alir prosedur penelitian... 52 API KIT 50 CHL sebelum dan sesudah diinkubasi ... 17
DAFTAR LAMPIRAN
1 Hasil pengujian antimikrob terhadap S. aureus ... 252 Hasil pengujian antimikrob terhadap S. typhimurium ... 25
3 Hasil pengujian antimikrob terhadap EPEC ... 25
4 Hasil uji aktivitas antimikrob terhadap bakteri patogen makanan ... 25
5 APIWEB Biomerieux identifikasi NS(9) ... 26
PENDAHULUAN
Latar Belakang
Bekasam merupakan produk fermentasi ikan Indonesia yang memiliki rasa asam, banyak dikenal di daerah Jawa Tengah, Sumatera Selatan dan Kalimantan Selatan. Proses pembuatan bekasam umumnya masih menggunakan proses fermentasi secara spontan dengan bahan baku ikan air tawar, garam, dan sumber karbohidrat seperti nasi atau tape dengan lama fermentasi sekitar 4-10 hari (Desniar 2012). Bekasam merupakan salah satu sumber bakteri asam laktat (BAL). Menurut Ostergaard et al. (1998), bakteri asam laktat (BAL) merupakan mikroorganisme dominan yang ditemukan dalam produk fermentasi ikan.
Bakteri asam laktat (BAL) berperan penting di dalam fermentasi makanan yang menyebabkan perubahan aroma dan tekstur bersamaan dengan pengaruh pengawetan dengan hasil peningkatan daya awet pada produk akhir (Hugas 1998). Bakteri asam laktat ini memiliki potensi besar dalam menghasilkan senyawa antimikrob. Ross et al. (2002), Diop et al. (2007), dan Galvez et al. (2007) melaporkan bahwa BAL dapat memproduksi beberapa metabolit yang mempunyai aktivitas sebagai antimikrob seperti asam organik (asam laktat dan asetat), hidrogen peroksida, diasetil, dan bakteriosin.
Potensi bakteri asam laktat asal bekasam sebagai antimikrob telah dilaporkan oleh Desniar (2012), bahwa 62 bakteri asam laktat yang diisolasi dari bekasam yang berasal dari pengolah lokal di Indralaya, Kayu Agung, Desa Sungai Pasir (Sumatera Selatan), dan Indramayu (Jawa Barat) mempunyai potensi sebagai antimikrob terhadap bakteri patogen asal makanan. Hasil yang diperoleh sesuai dengan penelitian Hamza et al. (2009) pada traditional Sudanese sour milk (roab), Argyri et al. (2013) pada fermented olives, Hwanlem et al. (2011) pada plaasom, dan Kim et al. (2006) pada raw milk, bahwa bakteri asam laktat dominan ditemukan pada produk fermentasi dan bakteri tersebut memiliki aktivitas antimikrob serta potensi sebagai kandidat probiotik. Berdasarkan hal tersebut dapat diduga bahwa bakteri asam laktat asal bekasam berpotensi sebagai probiotik, akan tetapi informasi aspek potensi kandidat probiotik dari bakteri asam laktat asal bekasam masih terbatas. Hal ini karena belum dipelajari secara terperinci dan hampir tidak ada laporan ilmiah yang behubungan dengan potensi BAL asal bekasam, khususnya bekasam hasil olahan dari pengolah lokal yang ada di Indonesia sebagai kandidat probiotik. Fakta tersebut mendorong perlunya dilakukan penelitian untuk menentukan dan menyeleksi isolat BAL dari bekasam dan menggali potensinya sebagai kandidat probiotik.
Probiotik didefinisikan sebagai mikroorganisme hidup yang apabila dikonsumsi oleh manusia atau hewan dalam jumlah cukup, mampu memberikan manfaat kesehatan bagi inangnya (FAO dan WHO 2006). Beberapa peneliti mengemukakan jaminan kriteria untuk bakteri probiotik. Probiotik harus dapat bertahan melewati lambung dan usus halus, sehingga probiotik harus toleran terhadap suasana asam dan adanya garam empedu (Tuomola et al. 2001, Bourlioux et al. 2003, Roberfroid 2000, Sunny-Roberts dan Knoor 2008). Probiotik harus mempunyai kemampuan dalam melakukan penempelan ke usus (Nitisinprasert et al. 2006, Tuomola et al. 2001, Bourlioux et al. 2003), karena
2
sangat berkaitan dengan beberapa efek kesehatan antara lain mempersingkat
durasi diare, efek imunologik dan eksklusi kompetitif dengan mikroba patogen (Tuomola et al. 2001, Herich dan Levkut 2002, Bourlioux et al. 2003).
Penelitian eksplorasi BAL yang mempunyai potensi sebagai probiotik terus dilakukan oleh peneliti di berbagai negara hingga saat ini, seiring dengan peningkatan konsumsi pangan probiotik. Pangan probiotik juga semakin berkembang dan diminati masyarakat di Indonesia, namun sebagian besar probiotik yang digunakan masih berasal dari luar negeri. Pasar global untuk probiotik secara keseluruhan (sebagai ingredient, suplemen, atau makanan) adalah sebesar US $ 14,9 milyar pada tahun 2007 dan mencapai US $ 16 milyar pada tahun 2008. Target penjualan pada tahun 2013 diperkirakan mencapai US$ 19,6 milyar dengan tingkat pertumbuhan tahunan sebesar 4,3% (Food Processing 2009 diacu dalam Rahayu 2011). Suplai probiotik dalam negri yang belum tersedia mengakibatkan produk pangan probiotik di Indonesia sangat tergantung pada ketersediaan dan suplai probiotik dari luar negeri sehingga sangat diperlukan probiotik asal Indonesia agar ketersediaan probiotik sebagai bahan baku berbagai produk pangan probiotik dapat semakin berkembang dan dikonsumsi oleh masyarakat Indonesia (Rahayu 2011). Penelitian mengenai sumber probiotik di Indonesia hingga saat ini masih dilakukan pada produk susu dan turunannya (Budiman 2004), susu ibu (Nuraida et al. 2012), daging sapi (Arief et al. 2006), tempoyak (Djaafar 1997), namun baru sebatas penelitian di Laboratorium dan belum diaplikasikan secara komersial serta belum dilakukan pada produk fermentasi ikan, khususnya produk fermentasi ikan asli Indonesia. Hal itulah yang melatarbelakangi pentingnya adanya penelitian bakteri probiotik yang bersumber dari produk fermentasi ikan asli Indonesia, yaitu bekasam.
Perumusan Masalah
Bakteri asam laktat (BAL) merupakan mikroorganisme dominan yang ditemukan dalam produk fermentasi ikan, salah satunya adalah produk fermentasi ikan dari Indonesia, yaitu bekasam. Pangan probiotik juga semakin berkembang dan diminati masyarakat di Indonesia, namun sebagian besar probiotik yang digunakan masih berasal dari luar negeri. Probiotik asal Indonesia sangat diperlukan agar ketersediaan probiotik sebagai bahan baku berbagai produk pangan probiotik dapat semakin berkembang dan dikonsumsi oleh masyarakat Indonesia. Kemampuan BAL asal bekasam sebagai antimikrob telah dilaporkan, namun belum diteliti mengenai potensi isolat BAL ini sebagai kandidat probiotik.
Tujuan Penelitian
Tujuan penelitian ini adalah:
1 Mendapatkan BAL asal bekasam (isolat SK(5), BP(10), dan NS(9)) sebagai kandidat isolat probiotik terbaik dengan karakteristik pertumbuhan terbaik
3 dalam kondisi lingkungan pH lambung (pH 2,0) dan pH usus (pH 7,2) dengan garam empedu 0,5%,
2 Menentukan aktivitas antimikrob BAL terhadap bakteri patogen,
3 Karakterisasi dan identifikasi isolat BAL terpilih secara morfologis dan fisiologis.
Manfaat Penelitian
Isolat BAL yang diperoleh sebagai kandidat probiotik dapat diaplikasikan lebih lanjut pada industri pangan, pakan hewan, dan farmasi sebagai probiotik dalam bentuk suplemen, makanan, maupun obat sebagai pengganti probiotik impor yang selama ini digunakan.
Ruang Lingkup Penelitian
Ruang lingkup penelitian ini adalah isolat bakteri asam laktat bekasam (SK(5), BP(10), dan NS(9)), ketahanan pH lambung (pH 2,0) dan pH usus (pH 7,2) dengan garam empedu 0,5%, aktivitas antimikrob terhadap bakteri patogen yang berhubungan dengan makanan, karakteristik bakteri asam laktat, dan spesies hasil identifikasi isolat BAL terpilih secara morfologis dan fisiologis.
METODE PENELITIAN
Waktu dan Tempat
Penelitian Isolat Bakteri Asam Laktat Bekasam (SK(5), BP(10), dan NS(9)) sebagai Kandidat Probiotik dilaksanakan pada bulan Juni sampai dengan Desember 2013. Penelitian ini dilaksanakan di Laboratorium Mikrobiologi Hasil Perairan, Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor dan Laboratorium Terpadu Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Bahan
Bahan utama yang digunakan untuk penelitian ini adalah isolat bakteri asam laktat asal bekasam (SK(5), BP(10), dan NS(9)) yang diperoleh dari hasil isolasi Desniar (2012) dari pengolah lokal di Indralaya, Kayu Agung dan Desa Sungai Pasir (Sumatera Selatan). Bakteri uji yang digunakan untuk pengujian aktivitas antimikrob meliputi EPEC, S. aureus, dan Salmonella typhimurium ATCC 14028.
4
Bahan yang digunakan untuk pengujian ketahanan pH lambung (pH 2,0) dan pH usus (pH 7,2) dengan garam empedu 0,5% serta uji aktivitas antimikrob meliputi buffer pepton water (BPW), posphat buffer salin (PBS), de man rogosa
sharp broth (MRSB), de man rogosa sharp agar (MRSA), garam empedu, HCl
0,1N, NaOH 0,1N, alkohol, nutrient agar (NA), nutrient broth (NB), Mueller
Hinton Agar (MHA), sulfid indol motility (SIM) dan akuades. Bahan kimia yang
digunakan untuk analisis adalah lugol, kristal ungu, alkohol 96%, safranin, dan H2O2. Bahan yang digunakan untuk pengidentifikasian spesies isolat bakteri
adalah media API 50 CHL (carbohydrate, Lactobacillus).
Alat
Alat-alat yang digunakan dalam penelitian ini meliputi mikroskop, oven, inkubator (Thermolyne type 42000 Incubator), tabung reaksi, rak tabung reaksi,
sentrifuse (Centrutium Scientific Ltd.) , autoklaf (Yamato SM 52 Autoclave),
spektrofotometer (UV Vis RS 2500), wadah tertutup, vortex mixer, pH meter,
clean bench, laminaran air flow (Thermo Scientific 1300 Series A2), milipore, syringe, pipet tetes, bunsen, pipet volumetrik, API Kit, software API system
(Bio-Mereux, France), botol scott, timbangan analitik, penggaris, lilin, korek api, cling
wrap, gelas ukur, labu Erlenmeyer, alumunium foil, sudip, cawan petri, mikro
pipet, ose, lemari pendingin, plastik tahan panas, tabung Eppendorf, kompor listrik, dan kapas.
Prosedur Penelitian
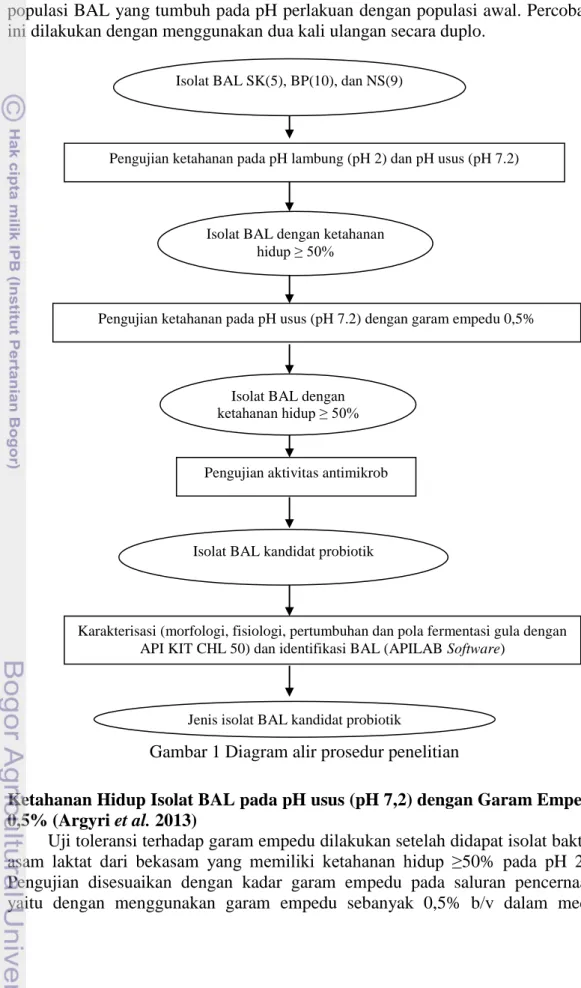
Penelitian ini dilakukan melalui beberapa tahapan, yaitu tahapan ketahanan pertumbuhan pada pH lambung (pH 2,0) dan pH usus (pH 7,2) dengan garam empedu 0,5%, pengujian aktivitas antimikrob terhadap bakteri patogen makanan, serta karakterisasi dan identifikasi isolat BAL. Diagram alir prosedur penelitian dapat dilihat pada Gambar 1.
Ketahanan Hidup Isolat BAL pada pH lambung (pH 2,0) dan pH Usus (pH 7,2) (Lin et al. 2006)
Isolat yang disimpan pada gliserol disegarkan pada agar MRS miring dan selanjutnya diinkubasi dalam wadah tertutup yang disimpan dalam inkubator pada suhu 37oC selama 48 jam. Isolat yang telah disegarkan pada media MRSA
kemudian diambil satu ose dan dimasukkan ke dalam media MRS broth sebagai kultur kerja. Kultur kerja diinkubasi dalam wadah tertutup yang disimpan dalam inkubator pada suhu 37oC selama 24 jam untuk selanjutnya digunakan dalam proses uji.
Sebanyak 1 mL kultur BAL umur 24 jam dicampurkan secara homogen ke dalam 9 mL PBS yang telah diatur nilai pH-nya pada pH 2,0 (sesuai dengan pH lambung) dan pH 7,2 (sesuai dengan pH usus) dengan penambahan HCl 0,1 N atau NaOH 0,1 N selanjutnya diinkubasi pada suhu 37°C selama 3 jam. Setelah
5 inkubasi pada kondisi pH selama 3 jam, populasi BAL yang tumbuh dihitung dengan pengenceran pada BPW dan media pemupukan pada media MRS agar pada suhu 37°C selama 48 jam. Populasi awal BAL umur 24 jam juga dihitung. Ketahanan hidup BAL terhadap pH rendah dihitung berdasarkan perbandingan populasi BAL yang tumbuh pada pH perlakuan dengan populasi awal. Percobaan ini dilakukan dengan menggunakan dua kali ulangan secara duplo.
Gambar 1 Diagram alir prosedur penelitian
Ketahanan Hidup Isolat BAL pada pH usus (pH 7,2) dengan Garam Empedu 0,5% (Argyri et al. 2013)
Uji toleransi terhadap garam empedu dilakukan setelah didapat isolat bakteri asam laktat dari bekasam yang memiliki ketahanan hidup ≥50% pada pH 2,0. Pengujian disesuaikan dengan kadar garam empedu pada saluran pencernaan, yaitu dengan menggunakan garam empedu sebanyak 0,5% b/v dalam media
Isolat BAL SK(5), BP(10), dan NS(9)
Pengujian ketahanan pada pH lambung (pH 2) dan pH usus (pH 7.2)
Isolat BAL dengan ketahanan hidup ≥ 50%
Pengujian ketahanan pada pH usus (pH 7.2) dengan garam empedu 0,5%
Isolat BAL dengan ketahanan hidup ≥ 50%
Pengujian aktivitas antimikrob
Isolat BAL kandidat probiotik
Karakterisasi (morfologi, fisiologi, pertumbuhan dan pola fermentasi gula dengan API KIT CHL 50) dan identifikasi BAL (APILAB Software)
6
MRSB dengan pH 7,2 selama 4 jam (merefleksikan dengan waktu saat makanan di usus kecil). Pengujian dilakukan pada konsentrasi garam empedu 0,5% mengacu pada Argyri et al. (2013).
Sebanyak satu mL kultur BAL umur 24 jam dimasukkan ke dalam sembilan ml MRS broth yang mengandung 0,5% garam empedu, lalu diinkubasikan pada suhu 37°C selama 4 jam. Populasi awal BAL yang berumur 24 jam sebelum diinokulasikan ke media MRSB yang mengandung garam empedu dihitung. Jumlah BAL dihitung pada media MRSA dengan metode pencawanan dengan inkubasi suhu 37°C selama 48 jam. Nilai ketahanan hidup ditunjukkan dengan persentase populasi yang tumbuh pada media garam empedu 0,5% dibandingkan dengan populasi awal. Percobaan ini dilakukan dengan dua kali ulangan secara duplo.
Uji Aktivitas Antimikrob Isolat BAL (modifikasi Savadogo et al. 2004)
Tahap uji aktivitas antimikrob dilakukan dengan metode sumur agar (agar
well difusion). Isolat indigenus BAL diinokulasikan ke dalam MRS broth dan
diinkubasikan pada suhu 37°C selama 20 jam. Supernatan bebas sel dipanen melalui sentrifugasi 10.000 rpm pada suhu 4°C selama 10 menit. Selanjutnya supernatan bebas sel yang merupakan substrat antimikrob tersebut siap untuk diuji aktivitas antimikrobnya dengan menggunakan metode difusi agar.
Bakteri uji yang digunakan adalah beberapa bakteri patogen makanan, yaitu
EPEC, S. aureus, dan S. typhimurium ATCC 14028. Bakteri uji dibiakkan pada
media NA selama 24 jam pada suhu 37°C. Setelah itu diambil dua ose kultur kerja tersebut lalu dibiakkan ke dalam tabung berisi media NB. Setelah 24 jam inkubasi, kultur bakteri uji diukur kekeruhannya secara turbidimetri dengan menggunakan spektrofotometer UV-Vis pada panjang gelombang 600 nm hingga mencapai OD 0,5-0,8. Kemudian dilakukan pencampuran media MHA steril pada suhu ±50oC dan NB berisi bakteri uji dengan perbandingan antara 20 μL NB bakteri uji untuk 20 mL MHA steril. Setelah itu dilanjutkan dengan menuangkan media tersebut ke dalam cawan petri. Setelah mengeras dibuat lubang sumur berdiameter 5 mm dengan menggunakan ujung pipet Pasteur steril. Sebanyak 20 μL supernatan bebas sel hasil sentrifugasi disaring dengan milipore dan dimasukkan ke dalam setiap lubang sumur dengan pipet. Seluruh cawan diinkubasi pada suhu 37°C selama 24 jam. Zona hambat yang terbentuk di sekitar sumur diamati dan diukur diameternya dengan memakai penggaris. Percobaan ini dilakukan sebanyak dua kali ulangan secara duplo.
Karakterisasi Isolat BAL SK(5), BP(10), dan NS(9)
Tahap karakterisasi isolat SK(5), BP(10), dan NS(9) bertujuan untuk mengetahui karakter isolat-isolat BAL yang telah terindikasi merupakan kandidat probiotik. Menurut Vamanu et al. (2006), pengklasifikasian isolat kedalam genus dan spesies didasarkan pada sifat-sifat antara lain: morfologi sel dan sifat Gram sel, sifat hetero atau homofermentatif metabolisme glukosa, dan jenis gula yang dapat digunakan sebagai sumber karbon untuk pertumbuhan sel. Identifikasi isolat yang termasuk BAL juga dapat dikerjakan menurut sifat pola fermentasi karbohidrat, toleransi terhadap suhu dan pH pertumbuhan serta pembentukan gas dari glukosa. Tahap karakterisasi isolat BAL pada penelitian ini dilakukan dengan
7 menguji isolat-isolat tersebut dengan beberapa uji seperti uji motilitas, uji fermentasi glukosa, uji katalase, dan pewarnaan Gram.
1) Uji motilitas (Tiwari et al. 2009)
Uji motilitas dilakukan dengan mengambil 1 ose isolat bakteri asam laktat yang sudah disegarkan, kemudian menusukkannya ke dalam agar SIM pada tabung reaksi. Hasil uji isolat yang motil ditunjukkan dengan pertumbuhan bakteri di permukaan agar SIM.
2) Uji fermentasi glukosa (Hayward 1957)
Pendeteksian produksi gas dari isolat SK(5), BP(10), dan NS(9) dilakukan dengan metode fermentasi glukosa dalam tabung Durham. Uji fermentasi glukosa dilakukan dengan menginokulasikan isolat pada media MRSB steril yang sudah dicampur glukosa 10% hingga larut. Isolat NS(9) diinokulasikan secara aseptik ke dalam media MRSB yang ditambahkan glukosa 10% dan diinkubasi selama 24 jam pada suhu 37 oC. Hasil uji heterofermentatif ditunjukkan dengan adanya gas yang terbentuk dalam tabung Durham.
3) Uji katalase (Cappucino dan Sherman 1983)
Uji katalase dilakukan pada biakan isolat SK(5), BP(10), dan NS(9). Satu ose koloni bakteri dioleskan pada kaca objek kering dan diteteskan 2-3 tetes H2O2.
Bila terbentuk gelembung udara, maka bakteri dinyatakan katalase positif. Bakteri aerob memberikan reaksi positif, dan bakteri anaerob memberikan reaksi negatif.
4) Uji perwarnaan Gram (Tiwari et al. 2009)
Uji pewarnaan Gram dilakukan dengan mewarnai biakan isolat SK(5), BP(10), dan NS(9) dengan pewarna kristal ungu dan safranin. Isolat digores diatas kaca preparat untuk difiksasi. Isolat yang telah difiksasi diteteskan kristal ungu dan ditunggu selama satu menit. Setelah itu isolat dicuci dengan akuades dan diteteskan lugol. Isolat dicuci kembali dengan akuades dan dilakukan pemucatan dengan alkohol 96%. Setelah dicuci kembali dengan akuades, isolat diberi pewarna tandingan safranin selama 30 detik. Isolat dibilas kembali dengan air dan diamati dibawah mikroskop dengan perbesaran 10x100 setelah ditetesi dengan minyak imersi. Gram positif berwarna biru gelap atau ungu sedangkan Gram negatif berwarna merah.
Identifikasi Isolat Bakteri Asam Laktat
Pola fermentasi gula ditentukan menggunakan uji kit API 50 CHL (API
system, Bio-Mereux, France). Isolat bakteri SK(5), BP(10), dan NS(9) yang telah
disegarkan dan ditumbuhkan dari agar miring ke cawan gores MRSA diambil dengan menggunakan ose ke dalam media API 50 CHL, kemudian dimasukkan ke dalam kit dengan menggunakan mikropipet steril dan bagian atasnya ditutup dengan mineral oil. Kemudian kit diinkubasi dalam inkubator 37ºC selama 24 jam dan diamati perubahan warnanya. Kit ini merupakan sistem standar terkait dengan 49 jenis pengujian biokimia untuk mempelajari metabolisme karbohidrat oleh mikroba. API 50 CH digunakan bersamaan dengan media API 50 CHL untuk mengidentifikasi spesies BAL dari genus Lactobacillus dan genus-genus terkait. Untuk setiap kotak dari API 50 CH berisi 10 strip untuk 10 kali pengujian dan API 50 CHL berisi 10 ampul (masing-masing ampul berisi 10 ml). API 50 CH terdiri dari 50 microtube yang digunakan untuk mempelajari fermentasi dari golongan gula dan turunannya. Pengujian fermentasi dilakukan dengan menambahkan media API 50 CHL. Selama inkubasi, fermentasi ditandai dengan
8
perubahan warna di dalam tube. Tube 0 tidak mengandung bahan aktif dan digunakan sebagai kontrol negatif. Tube nomor 1 – 49 berisi gula dan turunannya.
Selama inkubasi (24 – 48 jam) gula akan difermentasi menjadi asam yang akan menurunkan pH, hal ini dideteksi dengan melihat perubahan warna dari indikator. Hasil uji dikatakan positif apabila pada 49 jenis gula tersebut terjadi perubahan warna dari purple (merah keunguan) menjadi kuning dan khusus untuk uji Esculin Ferric Citrate (tube nomor 25) terjadi perubahan warna dari merah keunguan menjadi hitam. Hasilnya merupakan profil biokimia yang digunakan untuk mengidentifikasi spesies BAL menggunakan tabel yang ada pada produk kit atau menggunakan software identifikasi dari BioMerieux, Marcy l, Etoile, France, yaitu APIWEB.
HASIL DAN PEMBAHASAN
Bakteri asam laktat memiliki peranan yang penting pada kehidupan manusia, karena kemampuannya untuk menghasilkan makanan fermentasi
maupun kemampuannya untuk hidup di dalam saluran pencernaan (Kim et al. 2006). Penelitian bakteri asam laktat yang memiliki sifat probiotik
untuk kesehatan telah banyak dilakukan, contohnya adalah penelitian Hatakka et al. (2001) mengenai manfaat probiotik pada penyakit gangguan
saluran pencernaan.
Persyaratan BAL bersifat probiotik (FAO dan WHO 2006) adalah sebagai berikut: 1) tahan terhadap asam, terutama asam lambung yang memiliki pH antar 1,5-2,0 sewaktu tidak makan dan pH 4,0-5,0 sehabis makan, sehingga mampu bertahan dan hidup lama ketika melalui lambung dan usus, 2) stabil terhadap garam empedu dan mampu bertahan hidup selama berada pada bagian usus kecil. Empedu disekresikan ke dalam usus untuk membantu absorbsi lemak dan asam empedu yang terkonjugasi dan diserap dari usus kecil, 3) memproduksi senyawa antimikrob seperti asam laktat, hidrogen peroksida dan bakteriosin, 4) mampu menempel pada sel usus manusia, faktor penempelan oleh probiotik merupakan syarat untuk pengkolonisasian, aktivitas antagonis terhadap patogen, pengaturan sistem daya tahan tubuh dan mempercepat penyembuhan infeksi, 5) tumbuh baik dan berkembang dalam saluran pencernaan, 6) koagregasi membentuk lingkungan mikroflora normal dan seimbang, koagregasi juga mencerminkan kemampuan interaksi antar kultur untuk saling menempel dan 7) aman digunakan oleh manusia.
Ketahanan Hidup Isolat BAL pada pH Lambung (pH 2,0) dan pH Usus (pH 7,2)
Toleransi terhadap asam lambung merupakan syarat penting suatu isolat untuk dapat menjadi probiotik. Hal ini disebabkan bila isolat tersebut masuk ke dalam saluran pencernaan manusia, salah satu kondisi yang yang akan
9 mengganggu ketahanan hidupnya adalah pada saat di lambung, yang memiliki pH
1,5-2,0 sehingga bakteri asam laktat harus mampu bertahan hidup (FAO dan WHO 2006). Hasil sekresi dari lambung dikenal dengan istilah getah
lambung, yaitu cairan jernih berwarna kuning pucat yang mengandung HCl 0,2-0,5% dengan pH sekitar 1,5 (bila lambung dalam kondisi benar-benar kosong). Getah lambung terdiri atas air (97-99%), musin (lendir) serta garam anorganik, enzim pencernaan (pepsin serta renin) dan lipase. Guerra et al. (2012) menyatakan bahwa waktu yang diperlukan mulai saat bakteri masuk sampai keluar dari lambung adalah 15 menit hingga 3 jam sehingga isolat yang diseleksi untuk digunakan sebagai probiotik harus mampu bertahan dalam keadaan asam lambung selama 3 jam. Hasil uji ketahanan ketiga isolat BAL pada kondisi pH lambung (pH 2,0) dan pH usus (pH 7,2) dapat dilihat pada Tabel 1.
Tabel 1 Ketahanan hidup isolat BAL asal bekasam pada pH lambung (pH 2,0) dan pH usus (pH 7,2) selama 3 jam
Kode isolat pH 2,0 pH 7,2 Populasi awal (log cfu/mL) Populasi akhir (log cfu/mL) Ketahanan hidup (%) Populasi awal (log cfu/mL) Populasi akhir (log cfu/mL) Ketahanan hidup (%) SK(5) 10,39 8,49 81,66±0,05 10,39 9,17 88,25±0,02 BP(10) 9,56 9,47 99,02±0,02 9,39 8,32 88,55±0,02 NS(9) 9,29 7,40 71,97±0,02 9,33 8,40 90,09±0,02
Hasil pada Tabel 1 menunjukkan bahwa ketiga isolat BAL yang diuji mampu bertahan hidup dengan baik pada pH 2,0. Hal ini ditandai dengan pertumbuhan bakteri awal berkisar pada 109-1010 cfu/ml dan ketiga BAL setelah pengujian pH 2,0 mampu mempertahankan populasinya berkisar antara 107 cfu/ml hingga 109 cfu/mL. Svensson (1999) menyatakan bahwa efek probiotik dapat dipertahankan jika makanan pembawa mengandung minimal organisme probiotik 106-108 cfu/mL. Hasil penelitian diperoleh jumlah bakteri awal memenuhi persyaratan tersebut. Mitsuoka (1990) menyatakan bahwa pemilihan isolat bakteri asam laktat kandidat probiotik didasarkan pada kemampuan tumbuhnya pada pH 2,0 dan kemampuan mempertahankan populasinya minimal 105 cfu/mL selama 3 jam. Waktu inkubasi selama 3 jam disesuaikan dengan waktu transit makanan dalam lambung manusia sesuai Guerra et al. (2012), yaitu berkisar antara 15 menit hingga 3 jam. Hasil penelitian diperoleh bahwa ketahanan hidup ketiga BAL telah memenuhi persyaratan sesuai Mitsuoka (1990).
Sebagian besar mikroorganisme akan mati dan rusak dengan adanya pengaruh pH yang rendah dan kondisi asam klorida di dalam lambung. Waktu transit dari makanan masuk ke mulut sampai lambung pada manusia, minimal sekitar 90 menit dan efek bakterisidal asam akan terjadi pada pH rendah (asam) (Kimoto-Nira et al. 2007). Bakteri yang terpapar asam kuat mengakibatkan membran sel bakteri tersebut akan rusak sehingga beberapa komponen intraseluler akan keluar dari sel, di antaranya ion Mg, Ca, K, asam nukleat dan protein sehingga sel bakteri akan mengalami kematian. Hal inilah yang menyebabkan terjadinya penurunan populasi isolat BAL yang ditumbuhkan pada kondisi pH 2,0 (Hutkins dan Nannen 1993).
Menurut Hutkins dan Nannen (1993), BAL yang tahan terhadap kondisi asam disebabkan oleh kemampuan BAL tersebut untuk mempertahankan pH
10
sitoplasma lebih basa daripada pH ekstraseluler. Mekanisme pengaturan pH sitoplasma agar lebih basa adalah sel harus memiliki pertahanan terhadap aliran proton, yaitu melalui membran sitoplasma. Membran sitoplasma bakteri terdiri dari 2 fosfolipid (lipid bilayer) yang masing-masing permukaannya melekat protein dan glikoprotein. Lipid bilayer bersifat semipermiabel yang akan membatasi pergerakan senyawa yang keluar masuk antara sitoplasma dengan lingkungan luar. Karakteristik dan permeabilitas membran sitoplasma dipengaruhi oleh keragaman komposisi asam lemak penyusun membran sitoplasma dan hal ini sangat beragam di antara spesies bakteri, selain itu komposisi dan struktur protein yang berbeda pada membran sitoplasma juga berpengaruh terhadap karakteristik dan permeabilitasnya. Keragaman asam lemak dan protein pada membran sitoplasma ini diduga mempengaruhi keragaman ketahanan bakteri terhadap pH rendah.
Mekanisme bakteri untuk mengatur pH internalnya adalah melalui translokasi proton oleh enzim ATP-ase. Enzim yang terikat pada membran sel bertindak sebagai pompa yang akan memindahkan ion dan reaksinya bersifat
reversible. Enzim tersebut juga akan mengkatalisis gerakan proton menyeberangi
membran sel sebagai akibat dari hidrolisis dan sintesis ATP (Hutkins dan Nannen 1993). Hasil Tabel 1 menunjukkan bahwa ketiga isolat BAL
yang diuji dapat melewati saluran lambung yang bersifat asam.
Chou dan Weimer (1999) menyatakan bahwa enzim dapat mempengaruhi pertumbuhan dari bakteri asam laktat pada pH rendah. Enzim yang mempengaruhi ketahanan bakteri asam laktat pada pH rendah adalah enzim protease. Enzim protease yang semakin tinggi dalam suatu isolat dapat meningkatkan ketahanannya pada kondisi asam. Salah satu enzim protease, yaitu aminopeptidase dapat mempengaruhi adaptasi dan pertumbuhan dari isolat bakteri asam laktat pada kondisi asam. De Angelis et al. (2001) melaporkan bahwa enzim protease dibutuhkan oleh bakteri asam laktat untuk pertumbuhan dan menghasilkan asam dalam proses pembuatan produk fermentasi.
Mekanisme lain untuk pengaturan pH internal BAL agar dapat bertahan hidup pada pH rendah adalah arginin deiminasi (ADI). Arginin deiminasi (ADI) merupakan suatu mekanisme homeostatis terhadap kondisi pH rendah yang dimiliki beberapa BAL seperti L. casei dan L. sanfranciscensis. Kedua bakteri tersebut dapat mengkatabolisme arginin menjadi ornithin, amonia, dan CO2.
Amonia (NH4) akan meningkatkan pH internal sitoplasma. Hal ini menjadikan
kedua bakteri tersebut dapat menyesuaikan hidupnya pada kondisi pH yang rendah. Sistem ADI ini dikendalikan oleh gen arcA, arcB, arcC, dan arcT, sehingga BAL yang tidak mempunyai gen tersebut, tidak memiliki mekanisme homeostatis sistem arginin deiminasi untuk bertahan pada pH rendah. Gen arc pada setiap spesies BAL berbeda (Cotter dan Hill 2003). Hal tersebut diduga yang mempengaruhi perbedaan hasil pengujian ketahanan BAL pada pH 2,0. BP(10) memiliki ketahanan hidup yang paling tinggi dibandingkan dengan SK(5) dan NS(9). Hal ini diduga karena BP(10) memiliki gen arc yang lebih beragam dibandingkan dua isolat lainnya.
Pengujian pada pH 7,2 selama 3 jam juga dilakukan untuk melihat ketahanan isolat bakteri asam laktat asal bekasam dalam usus halus yang memiliki pH hampir mendekati netral. Keseluruhan isolat dapat tumbuh dengan tingkat kematian kurang dari 2 log cfu/mL sehingga dapat dikatakan bahwa seluruh isolat
11 merupakan isolat yang tahan pada kondisi usus (pH 7,2). Hal ini terjadi karena menurut Yang et al.(2001), sifat bakteri asam laktat cenderung tumbuh pada kisaran pH mendekati netral.
Hasil pengujian ketahanan bakteri asam laktat dalam media dengan pH 2,0 dan 7,2 selama 3 jam menunjukkan bahwa ketiga isolat bakteri asam laktat asal bekasam (SK(5), BP(10), dan NS(9)) memiliki ketahanan hidup yang tinggi (≥50%) terhadap pH lambung dan pH usus. Ketahanan hidup BAL yang tinggi tersebut menjadi landasan untuk dilakukannya pengujian selanjutnya, yaitu pengujian ketahanan hidup isolat BAL terhadap kondisi usus pada pH 7,2 dengan kandungan garam empedu 0,5% selama 4 jam sesuai Argyri et al. (2013).
Ketahanan Hidup Isolat BAL pada pH Usus (pH 7,2) dengan garam empedu 0,5%
Bakteri asam laktat sebagai isolat probiotik untuk dapat bertahan dan tumbuh pada saluran pencernaan harus mampu melewati berbagai kondisi lingkungan yang akan mengganggu ketahanan hidupnya, salah satunya adalah pada saat bakteri memasuki bagian atas saluran usus yang merupakan tempat empedu disekresikan ke dalam usus. Cairan empedu merupakan campuran dari asam empedu, kolesterol, asam lemak, fosfolipid, pigmen empedu, dan sejumlah xenobiotik terdetoksifikasi. Sekresi pankreas juga mengandung serangkaian enzim pencernaan, yaitu tempat enzim yang bersifat lipolitik diaktifkan oleh karakteristik aktif dari empedu. Kombinasi tersebut bersifat bakterisidal bagi mikroorganisme komensal dalam tubuh manusia kecuali bagi beberapa genus penghuni usus yang tahan garam empedu (Hill 1995).
Ketiga isolat BAL yang diuji pada pH 2,0 memiliki ketahanan hidup lebih dari 50%, yaitu antara 71,97%-99,02% sehingga dilakukan penyeleksian lanjutan menggunakan garam empedu 0,5% selama 4 jam. Menurut Argyri et al. (2013), waktu inkubasi terpapar garam empedu 0,5% selama 4 jam tersebut dilakukan karena merefleksikan dengan penyerapan makanan di usus kecil. Hasil pengujian ketahanan isolat bakteri asam laktat terhadap garam empedu 0,5% dapat dilihat pada Tabel 2.
Tabel 2 Ketahanan hidup isolat BAL asal bekasam pada pH usus (pH 7,2) dengan garam empedu 0,5% selama 4 jam
Kode isolat Populasi awal (log cfu/mL) Populasi pada garam empedu 0,5% (log cfu/mL) Ketahanan hidup (%) SK(5) 10,39 9,18 88,25±0,04 BP(10) 9,56 8,37 87,69±0,01 NS(9) 9,29 8,28 80,54±0,00
Hasil yang diperoleh pada pengujian garam empedu pada Tabel 2 menunjukkan bahwa ketahanan ketiga isolat bakteri tersebut dikatakan tinggi, yaitu lebih dari 50% (80,54%-88,25%) dengan penurunan koloni tidak lebih dari 2
12
log cfu/mL. Hal ini sesuai dengan hasil penelitian Mitsuoka (1990) bahwa ketahanan hidup bakteri kandidat probiotik dikatakan tinggi bila penurunannya tidak lebih dari 2 log cfu/mL.
Mekanisme penghambatan garam empedu terhadap pertumbuhan bakteri disebabkan karena garam empedu memiliki struktuk amphipatic sehingga mampu melarutkan atau memecah semua substansi sel yang mengandung lipid. Dinding sel bakteri dan membran sel bakteri mengandung lipid sehingga masuknya garam empedu ke dalam dinding sel dan membran sel akan menyebabkan dinding sel dan membran sel menjadi rusak dan kehilangan fungsinya sebagai pelindung bakteri dan filter. Apabila bakteri mengalami kerusakan atau kehilangan fungsi pada dinding selnya, maka akan mengakibatkan bakteri cenderung tidak mampu bertahan terhadap tekanan osmotik sehingga menyebabkan terjadinya lisis atau pengeluaran isi sel yang berakibat kematian sel (Hill 1995).
Bakteri asam laktat (BAL) mempunyai ketahanan hidup pada kondisi garam empedu disebabkan oleh beberapa spesies BAL mampu mendekonjugasi garam empedu dengan menggunakan asam amino taurin sebagai akseptor elektron atau selain itu juga sebagian besar galur BAL mempunyai enzim Bile Salt Hydrolase (BSH) yang diatur oleh gen bsh (Vinderola dan Reinheimer 2003). Begley et al. (2006) melaporkan bahwa enzim BSH menguraikan asam empedu terkonjugasi menjadi asam empedu tidak terkonjugasi dan melepaskan asam amino glisin atau taurin.
Proses dekonjugasi ini terjadi karena bakteri memproduksi enzim Bile Salt
Hydrolase (BSH) yang dapat menghidrolisis atau memutuskan ikatan C-24 N-acyl
amida yang terbentuk diantara asam empedu dan asam amino pada garam empedu terkonjugasi. Proses dari dekonjugasi menghasilkan garam empedu terdekonjugasi (unconjugated bile salt) yang memiliki tingkat solubilitas atau kelarutannya di dalam pH fisiologis lebih rendah, sehingga garam empedu terdekonjugasi lebih hidrofobik, kurang ionik, dan secara pasif dapat langsung diabsorpsi oleh mukosa usus kembali ke hati melalui peredaran darah. Garam empedu terdekonjugasi memiliki kemampuan antimikroba yang rendah, sehingga tidak terlalu membahayakan kehidupan bakteri asam laktat (Begley et al. 2006). Chou dan Weimer (1999) juga melakukan eksperimen mengenai ketahanan hidup BAL terhadap garam empedu. Hasilnya menunjukkan bahwa variasi spesies dan galur berpengaruh terhadap kemampuannya untuk bertahan hidup pada kondisi media yang mengandung garam empedu.
Argyri et al. (2013) menguji fermented olives yang mengandung
Lactobacillus pentosus B281, L. pentosus E97, L. pentosus E104, L. pentosus
E108, L. plantarum B282, L. plantarum E10, L. plantarum E69, L. paracasei subsp. paracasei E93, dan L. paracasei subsp. paracasei E94 yang sebelumnya memiliki ketahanan hidup lebih dari 50% terhadap pH 2,0 ternyata mampu bertahan hidup pada kondisi garam empedu 0,5% selama 4 jam dengan ketahanan hidup dari 94%-100%. Hal ini menunjukkan bahwa ketahanan hidup setiap bakteri berbeda-beda pada kondisi garam empedu.
Lin et al. (2006) menguji yoghurt yang mengandung L. acidophilus dan
Bifidobacteria yang sebelumnya tahan terhadap pH 2,0 ternyata mampu bertahan
hidup pada kondisi garam empedu 0,3%. Populasi awal pengujian, yaitu sebesar 108 cfu/mL dan hasil akhir penurunan populasinya, yaitu sebesar 1-2 log cfu/mL serta mencapai populasi akhir pada media garam empedu 0,3% sebesar 106-107
13 cfu/mL. Hal ini sesuai dengan hasil penelitian yang diperoleh, yaitu populasi bakteri akhir setelah terpapar garam empedu mengalami penurunan sebesar 1 log cfu/mL.
Charteris et al. (1998) menyatakan bahwa ketahanan atau toleransi terhadap garam empedu dianggap sebagai karakteristik penting dari strain bakteri probiotik yang memungkinkan mereka untuk bertahan hidup, tumbuh, dan mengerahkan aksi mereka dalam perjalanan gastrointestinal. Hasil ketahanan terhadap pH rendah (pH 2,0) dan garam empedu 0,5% menunjukkan bahwa ketiga isolat bakteri asal bekasam yang diuji, yaitu SK(5), BP(10), dan NS(9) memiliki kemampuan sebagai kandidat probiotik, namun harus dilakukan uji pendukung, meliputi uji koagregasi, uji penempelan di usus, dan uji in vivo.
Aktivitas Antimikrob
Havenaar dan Huis (1992) menyataka bahwa dalam pengembangan galur probiotik baru, perlu dilakukan seleksi secara in vitro yang meliputi sensitivitas terhadap pH rendah, cairan lambung, asam empedu, pankreas dan kemampuannya yang akan mengganggu ketahanan hidup pertumbuhan mikroba patogen lain. Berdasarkan fungsinya sebagai probiotik, kemampuan aktivitas antimikrob terhadap bakteri patogen menjadi sangat penting. Hal ini karena BAL yang mempunyai aktivitas antimikrob terhadap bakteri patogen, khususnya bakteri enteropatogen, bermanfaat bagi kesehatan manusia. Hasil pengujian aktivitas antimikrob ketiga isolat BAL (Lampiran 1-3) menunjukkan bahwa semua isolat BAL tersebut mempunyai aktivitas antimikrob yang dapat menghambat pertumbuhan bakteri patogen, Gram-negatif maupun Gram-positif. Hasil pengujian aktivitas antimikrob isolat BAL asal bekasam SK(5), BP(10), dan NS(9) dapat dilihat pada Tabel 3.
Tabel 3 Hasil pengujian aktivitas antimikrob isolat BAL asal bekasam SK(5), BP(10), dan NS(9)
Bakteri uji Rataan diameter zona hambat (mm) SK(5) BP(10) NS(9)
EPEC 7,00±0,71 7,00±0,71 6,00±0,71
S. aureus 9,00±0,00 9,00±0,00 7,00±0,71
S. typhimurium ATCC 14028 8,00±0,71 6,00±0,00 6,00±0,00
Semua isolat BAL yang diuji, yaitu SK(5), BP(10), dan NS(9) memiliki aktivitas antimikrob yang dapat menghambat pertumbuhan EPEC, S. aureus, dan
S. typhimurium ATCC 14028. Aktivitas antimikrob ditunjukkan dengan
terbentuknya zona hambat (Lampiran 4) melalui pengujian dengan metode difusi agar. Besaran diameter zona hambat dikategorikan oleh Pan et al. (2009), yaitu aktivitas antimikrob rendah bila diameter zona hambat 0-3 mm, aktivitas antimikrob sedang bila diameter zona hambat lebih dari 3-6 mm, dan aktivitas antimikrob tinggi bila diameter zona hambat lebih dari 6 mm. Ketiga isolat BAL memiliki aktivitas antimikrob yang tinggi terhadap bakteri patogen makanan yang
14
diuji, kecuali BP(10) dan NS(9) terhadap S. typhimurium ATCC 14028 (aktivitas antimikrob sedang) serta NS(9) terhadap EPEC (aktivitas antimikrob sedang).
Aktivitas antimikrob setiap isolat BAL yang berbeda terhadap spesies bakteri patogen yang berbeda disebabkan oleh komponen antimikrob yang dihasilkan oleh setiap isolat yang juga berbeda, jenis mikroorganisme uji, jenis dan konsentrasi asam, dan waku kontak (Vinderola dan Reinheimer 2003). Hasil pengujian (Tabel 3) menunjukkan bahwa penghambatan supernatan BAL terhadap bakteri Gram-positif lebih tinggi dibandingkan bakteri Gram-negatif. Hal tersebut disebabkan adanya komponen lipopolisakarida yang mengelilingi membran sel bakteri Gram-negatif dan dapat berfungsi sebagai barier mekanis serta mencegah masuknya asam ke dalam sel. Bakteri Gram-negatif juga mampu secara cepat melakukan metabolisme asam dan mencegah akumulasinya dalam sel (Doores 1983).
Aktivitas antimikrob setiap isolat BAL yang berbeda terhadap spesies bakteri patogen yang berbeda disebabkan oleh komponen antimikrob yang dihasilkan oleh setiap isolat yang juga berbeda (Vinderola dan Reinheimer 2003). Hasil penelitian Desniar (2012) melaporkan bahwa zat antimikrob yang diproduksi oleh SK(5) adalah bakteriosin, H2O2, dan asam-asam organik.
Asam-asam organik yang mendominasi adalah Asam-asam laktat dan Asam-asam asetat.
Terbentuknya asam laktat dan asam organik oleh BAL dapat menyebabkan penurunan pH, akibatnya mikroba yang tidak tahan terhadap kondisi pH yang relatif rendah akan terhambat. Akumulasi produk akhir asam yang rendah pH-nya menghasilkan penghambatan yang luas terhadap positif maupun Gram-negatif. Efek penghambatan dari asam organik terutama berhubungan dengan jumlah asam yang tidak terdisosiasi. Asam yang tidak terdisosiasi dapat berdifusi secara pasif ke dalam membran sel. Asam tersebut di dalam sel terdisosiasi menjadi proton dan anion lalu mempengaruhi pH di dalamnya (Theron dan Lues 2011).
Mekanisme penghambatan asam laktat terhadap sel bakteri karena asam laktat mempunyai sifat hidrofobik, sehingga memudahkan difusi dalam bentuk proton ke dalam sel melalui membran sel. Akibatnya pH intraseluler lebih tinggi dibandingkan dengan pH ekstraseluler. Selanjutnya, di dalam sel, asam laktat terdisosiasi dan menurunkan pH intraseluler dengan melepaskan proton. Pelepasan proton atau ion hidrogen dapat mengganggu fungsi metabolik seperti translokasi substrat dan fosforilasi oksidatif, sehingga menyebabkan sel bakteri tersebut terhambat pertumbuhannya (Bogaert dan Naidu 2000).
Supernatan bebas sel yang mengandung senyawa antimikrob yang digunakan dalam pengujian ini sebagian besar terdiri atas asam laktat hasil fermentasi gula yang diproduksi oleh isolat asal BAL. Hal tersebut berdasarkan hasil identifikasi biokimiawi awal diketahui bahwa semua isolat asal BAL yang digunakan dalam penelitian ini (Tabel 4) tidak menghasilkan gas dari fermentasi glukosa atau bersifat homofermentatif. Theron dan Lues (2011) menyatakan bahwa produk akhir fermentasinya diduga adalah asam laktat. Supernatan bebas sel yang digunakan untuk pengujian aktivitas atimikrob berasal dari kultur kerja yang diinkubasi selama 20 jam. Menurut Desniar (2012), produksi asam laktat dari BAL asal bekasam meningkat dengan tajam dari awal pertumbuhan sampai jam ke-16 dan jam ke-20 inkubasi. Produksi metabolit penghasil antimikrob (asam laktat) inilah yang berperan untuk menghasilkan aktivitas antimikrob.
15 Jumlah dari asam laktat yang dihasilkan berpengaruh terhadap aktivitas antimkirob yang dihasilkan.
Ketiga isolat BAL memiliki aktivitas penghambatan yang berbeda-beda terhadap bakteri patogen. Hal ini sesuai dengan hasil peneliti lainnya yang menyatakan bahwa penghambatan BAL terhadap bakteri patogen bersifat spesifik tergantung dari spesies dan galur BAL tersebut. Kemampuan BAL dalam menghasilkan senyawa antimikrob juga dilaporkan oleh beberapa peneliti. Pan et
al. (2009) melaporkan bahwa L. acidophilus NIT mampu menghambat E. coli
CTCCAB 206316 dan S. typhimurium CTCCM90030 lebih baik dibandingkan dengan Clostridium difficile DSM 1296. Bao et al. (2010) melaporkan juga bahwa walaupun termasuk dalam satu spesies, galur L. fermentum IMAU60092 dan
L. fermentum FG mampu menghambat bakteri patogen Gram-positif seperti S. aureus AC12465, dan L. monocytogenes C53-3, serta Gram-negatif seperti S. typhimurium S50333 dan E. coli O157 882364, namun galur L. fermentum
IMAU60145 hanya mampu menghambat bakteri patogen Gram-positif S. aureus AC12465.
Karakterisasi Isolat Bakteri Asam Laktat (BAL) dari Bekasam (SK(5), BP(10), dan NS(9))
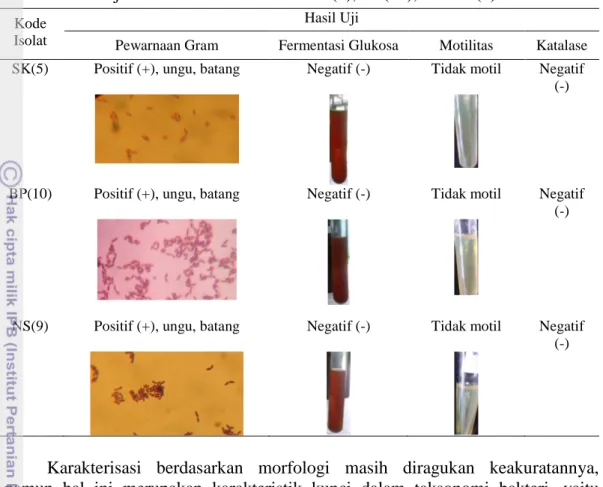
Karakterisasi isolat BAL SK(5), BP(10), dan NS(9) bertujuan untuk mengetahui karakter dari isolat BAL yang memiliki sifat sebagai kandidat probiotik. Uji karakterisasi yang dilakukan antara lain uji pewarnaan Gram, uji fermentasi glukosa, uji katalase, dan uji motilitas. Hasil uji karakterisasi tersebut dapat dilihat pada Tabel 4.
Isolat BAL SK(5), BP(10), dan NS(9) (Tabel 4) memiliki karakter Gram-positif berbentuk batang, homofermentatif, tidak motil, dan katalase negatif. Hasil ini sesuai dengan Mozzi et al. (2010) dan Klaenhammer et al. (2011) yang menyatakan bahwa bakteri asam laktat adalah kelompok bakteri Gram positif, tidak membentuk spora, katalase negatif, dan tidak motil. Mozzi et al. (2010) menyatakan bahwa bakteri asam laktat termasuk di dalamnya bakteri homofermentatif yang memproduksi sebagian besar utamanya adalah asam laktat, dan heterofermentatif yang selain memproduksi asam laktat juga memproduksi variasi yang luas dari produk fermentasi seperti asam asetat, etanol, gas karbon dioksida, dan asam format. Ketiadaan gelembung gas pada uji fermentasi glukosa menunjukkan bahwa ketiga isolat BAL tidak menghasilkan gas karbon dioksida dalam jumlah yang besar. Menurut Hayward (1957), ketiadaan gas yang terbentuk pada ketiga isolat BAL menunjukkan bahwa isolat tersebut diduga merupakan bakteri homofermentatif.
Ketiga isolat BAL tidak memiliki katalase (Tabel 4). Hal ini sesuai Klaenhammer et al. (2011) bahwa BAL tidak memiliki enzim katalase untuk memecah peroksida (H2O2). Peroksida pada BAL merupakan salah satu metabolit
yang berfungsi sebagai penghasil antimikrob. Ketiga isolat BAL yang diuji menunjukkan tidak motil (Tabel 4). Hasil tersebut sesuai Klaenhammer et al. (2011) bahwa BAL tidak memiliki alat gerak untuk bergerak.
16
Tabel 4 Hasil uji karakterisasi isolat BAL SK(5), BP(10), dan NS(9) Kode
Isolat
Hasil Uji
Pewarnaan Gram Fermentasi Glukosa Motilitas Katalase
SK(5) Positif (+), ungu, batang Negatif (-) Tidak motil Negatif
(-)
BP(10) Positif (+), ungu, batang Negatif (-) Tidak motil Negatif
(-)
NS(9) Positif (+), ungu, batang Negatif (-) Tidak motil Negatif
(-)
Karakterisasi berdasarkan morfologi masih diragukan keakuratannya, namun hal ini merupakan karakteristik kunci dalam taksonomi bakteri, yaitu dalam hal pendeskripsian genus BAL. Bakteri asam laktat (BAL) dapat dibagi menjadi sel berbentuk batang (Lactobacillus dan Carnobacterium) dan kokus (semua genus yang lain). Satu pengecualian, yaitu Weissella yang merupakan genus pertama dalam grup BAL dengan definisi dapat meliputi kokus dan batang. Lebih jauh pembelahan sel dalam dua bagian tegak lurus dalam satu plane, yang menimbulkan bentuk tetrat, dan ini digunakan dalam pembedaan kokus. Genus pembentuk tetrat adalah Aerococcus, Pediococcus, dan Tetragenococcus (Axelsson 2004 diacu dalam Desniar 2012).
Identifikasi Isolat Bakteri Asam Laktat (BAL) dari Bekasam dengan API KIT 50 CHL
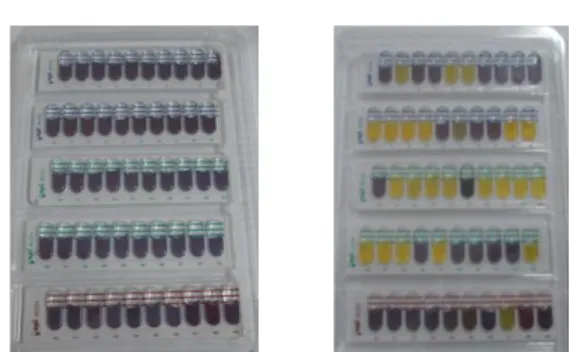
Identifikasi isolat dilanjutkan dengan melihat sifat fisiologinya dalam menfermentasi berbagai macam sumber karbohidrat dengan menggunakan API KIT 50 CHL (Gambar 2). Jenis isolat ditentukan berdasarkan uji fermentasi gula (Tabel 5) dan identifikasi menggunakan API 50 CHL (API system, Bio-Mereux, France) (Tabel 6 serta Lampiran 5 dan 6) sehingga dapat disimpulkan bahwa isolat SK(5) dan NS(9) dengan bentuk batang adalah Lactobacillus plantarum 1 dengan kemiripan sebesar 99,9% (Desniar 2012) dan 99,5%, sedangkan BP(10) dengan bentuk batang adalah Lactobacillus pentosus dengan kemiripan sebesar 99,9%.
17
Gambar 2 API KIT 50 CHL sebelum dan sesudah diinkubasi
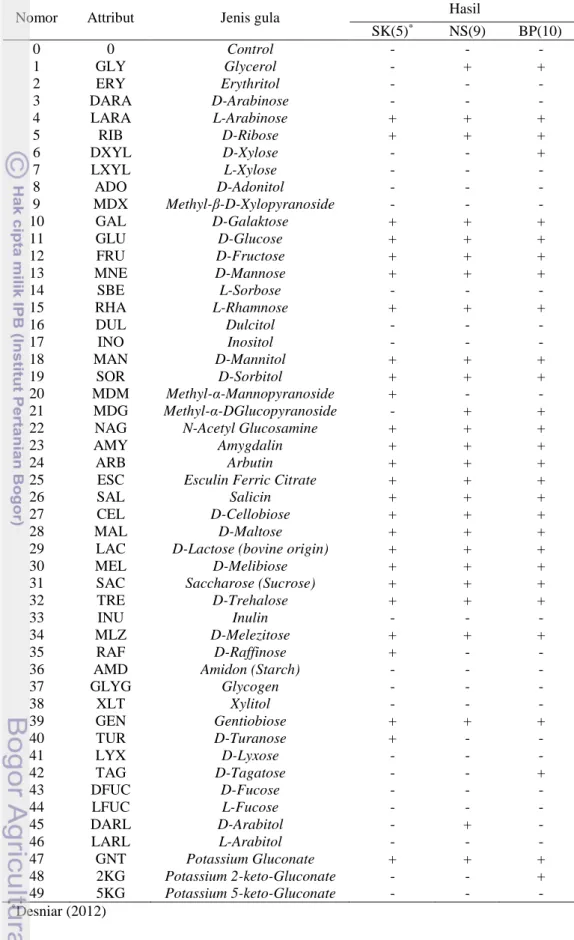
Gambar 2 menunjukkan adanya perubahan dari API KIT 50 CHL setelah penginkubasian selama 24 jam. Setelah diinkubasi selama 24 jam, terlihat adanya gula-gula yang dapat difermentasi oleh isolat BAL yang ditunjukkan dengan perubahan warna. Untuk mengidentifikasi BAL secara fenotifik pada tingkat spesies digunakan Kit Mikrobiologi Standard Analytical Profile Index (API) 50 CH. Hasil fermentasi gula dapat dilihat pada Tabel 5.
Hasil yang diperoleh (Tabel 5) menunjukkan bahwa isolat BAL SK(5), NS(9), dan BP(10) dapat menfermentasi beberapa jenis gula. SK(5) dan NS(9) dapat menfermetasi 26 jenis gula, sedangkan BP(10) dapat menfermentasi 28 jenis gula. SK(5) dan NS(9) memiliki perbedaan jenis gula yang dapat difermentasi, meskipun keduanya merupakan Lactobacillus plantarum 1. Gula yang berbeda, yaitu gula nomor 1, 20, 21, 35, 40, dan 45. Hal tersebut menyebabkan hasil % id pembacaan oleh software pun berbeda (Tabel 6).
Isolat SK(5) dan BP(10) maupun NS(9) dan BP(10) memiliki perbedaan pula dalam menfermentasi gula (Tabel 5). SK(5) dan BP(10) berbeda dalam menfermentasi jenis gula nomor 1, 6, 20, 21, 35, 40, 42, dan 48. NS(9) dan BP(10) berbeda dalam menfermentasi jenis gula nomor 6, 42, 45, dan 48. Hal tersebut menyebabkan hasil jenis spesies pembacaan oleh software pun berbeda (Tabel 6) Hasil ini ditandai dengan adanya perubahan warna dari ungu ke kuning
dan perubahan warna dari ungu ke hitam untuk gula nomor 25 (Esculin Ferric Citrate) setelah inkubasi 24 jam (Gambar 2).
Prinsip pengujian identifikasi dengan API KIT 50 CHL menurut panduan Biomerieux Industry adalah identifikasi bakteri berdasarkan pada perbandingan profil terhadap database takson pada software. Perbandingan memperhitungkan profil yang diperoleh dengan cara mencari kesamaan dari berbagai takson yang berbeda dari database, mencari kesamaan dari typical profile dari setiap takson, dan menunjukkan bahwa isolat bakteri benar-benar terkait dengan takson tersebut dengan melihat kepada % id dan % index T (Lampiran 5 dan 6).
Test kit API 50 CHL digunakan untuk mengidentifikasi genus Lactobacillus
hingga ke tingkat spesies. Test kit tersusun atas 49 jenis gula (49 tube) yang selanjutnya akan difermentasi oleh isolat yang akan diidentifikasi. Apabila isolat yang diuji mampu memfermentasi sumber gula dan menghasilkan asam, maka indikator bromkresol ungu akan mengubah warna larutan gula dari ungu menjadi kuning. Pembacaan hasil identifikasi menggunakan API WEB software (API bioMerieux).
18
Tabel 5 Hasil fermentasi gula isolat BAL asal bekasam
Nomor Attribut Jenis gula Hasil
SK(5)* NS(9) BP(10) 0 0 Control - - - 1 GLY Glycerol - + + 2 ERY Erythritol - - - 3 DARA D-Arabinose - - - 4 LARA L-Arabinose + + + 5 RIB D-Ribose + + + 6 DXYL D-Xylose - - + 7 LXYL L-Xylose - - - 8 ADO D-Adonitol - - - 9 MDX Methyl-β-D-Xylopyranoside - - - 10 GAL D-Galaktose + + + 11 GLU D-Glucose + + + 12 FRU D-Fructose + + + 13 MNE D-Mannose + + + 14 SBE L-Sorbose - - - 15 RHA L-Rhamnose + + + 16 DUL Dulcitol - - - 17 INO Inositol - - - 18 MAN D-Mannitol + + + 19 SOR D-Sorbitol + + + 20 MDM Methyl-α-Mannopyranoside + - - 21 MDG Methyl-α-DGlucopyranoside - + +
22 NAG N-Acetyl Glucosamine + + +
23 AMY Amygdalin + + +
24 ARB Arbutin + + +
25 ESC Esculin Ferric Citrate + + +
26 SAL Salicin + + +
27 CEL D-Cellobiose + + +
28 MAL D-Maltose + + +
29 LAC D-Lactose (bovine origin) + + +
30 MEL D-Melibiose + + +
31 SAC Saccharose (Sucrose) + + +
32 TRE D-Trehalose + + +
33 INU Inulin - - -
34 MLZ D-Melezitose + + +
35 RAF D-Raffinose + - -
36 AMD Amidon (Starch) - - -
37 GLYG Glycogen - - - 38 XLT Xylitol - - - 39 GEN Gentiobiose + + + 40 TUR D-Turanose + - - 41 LYX D-Lyxose - - - 42 TAG D-Tagatose - - + 43 DFUC D-Fucose - - - 44 LFUC L-Fucose - - - 45 DARL D-Arabitol - + - 46 LARL L-Arabitol - - - 47 GNT Potassium Gluconate + + + 48 2KG Potassium 2-keto-Gluconate - - + 49 5KG Potassium 5-keto-Gluconate - - - *Desniar (2012)
19 Isolat SK(5) dan NS(9) yang berbentuk batang adalah Lactobacillus
plantarum 1 dengan kemiripan sebesar 99,9% dan 99,5%, sedangkan BP(10) yang
berbentuk batang adalah Lactobacillus pentosus dengan kemiripan 99,9% (Tabel 6). Hal ini menunjukkan bahwa pengujian yang dilakukan tergolong ke dalam kategori very good identification sesuai ketentuan panduan Biomerieux Industry, yaitu nilai % id > 99.
Hasil yang diperoleh sesuai dengan penelitian Hamza et al. (2009) pada
traditional Sudanese sour milk (roab) dan Argyri et al. (2013) pada fermented olives bahwa bakteri asam laktat yang dominan pada produk fermentasi yaitu L. pentosus dan L. plantarum. Bakteri yang ditemukan tersebut memiliki
karakteristik yang sama dengan bakteri yang diteliti pada bekasam kali ini, yaitu berbentuk batang, katalase negatif, tidak motil, dan homofermentatif, serta memiliki aktivitas antimikrob yang tinggi terhadap bakteri patogen makanan. Hal yang sama diperoleh dari penelitian Kim et al. (2006) bahwa L. pentosus yang diisolasi dari raw milk memiliki ketahanan hidup pada pH lambung (pH 2) yang tinggi dibanding bakteri uji yang lain, yaitu sebesar 98% dan memiliki ketahanan hidup pada pH usus dengan garam empedu 0,1% sebesar 93%. Hal ini didukung pula oleh Argyri et al. (2013) bahwa L. pentosus dan L. plantarum yang diisolasi dari fermented olives memiliki ketahanan hidup yang tinggi >90% pada pH lambung dan pH usus dengan garam empedu, tetapi ketahanan hidup
Lactobacillus pentosus lebih tinggi dibanding L. plantarum. Hasil ini sesuai
dengan hasil yang diperoleh pada penelitian ini. Tabel 6 Hasil identifikasi API 50 CHL
Kode isolat Hasil identifikasi API Kemiripan (%) SK(5)* Lactobacillus plantarum 1 99,9
BP(10) Lactobacillus pentosus 99,9
NS(9) Lactobacillus plantarum 1 99,5
*Desniar (2012)
Identifikasi dengan metode klasik diperlukan untuk mengetahui sifat fisiologis dan biokimiawi dari BAL. Metode seleksi BAL untuk mengetahui sampai tingkat genus umumnya menggunakan metode klasik, penentuan dugaan awal sampai tingkat spesies juga digunakan metode klasik, namun untuk mengkonfirmasi spesies BAL tersebut perlu dilakukan identifikasi secara molekuler (Vamanu et al. 2006).
KESIMPULAN DAN SARAN
Kesimpulan
Bakteri asam laktat asal bekasam (SK(5), BP(10), dan NS(9)) memiliki sifat sebagai kandidat probiotik, yaitu memiliki ketahanan hidup yang tinggi (>50%) pada pH lambung (pH 2,0), pH usus (pH 7,2), dan pH usus (pH 7,2) dengan
20
garam empedu 0,5%, serta memiliki aktivitas antimikrob terhadap bakteri patogen makanan (EPEC, Staphylococcus aureus, dan Salmonella typhimurium ATCC
14028). Isolat BAL kandidat probiotik termasuk Gram-positif dengan bentuk
batang, tidak motil, katalase negatif, dan homofermentatif. Isolat SK(5) dan NS(9) adalah Lactobacillus plantarum 1 dengan kemiripan 99,9% dan 99,5%, sedangkan BP(10) adalah Lactobacillus pentosus dengan kemiripan 99,9%.
Saran
Karakteristik probiotik asal bekasam dalam saluran pencernaan manusia perlu dilakukan, meliputi uji kemampuan penempelan bakteri asam laktat terpilih pada sel epitel usus dan uji koagregasi. Pengujian keamanan secara in vivo dari bakteri asam laktat asal bekasam perlu dilakukan untuk membuktikan bahwa bakteri asam laktat asal bekasam yang telah diperoleh aman dikonsumsi oleh manusia.
21
DAFTAR PUSTAKA
Arief II, Maheswari RRA, Suryati T, Hidayati . 2006. Karakteristik Lactobacillus spesies yang diisolasi dari daing sapi. Seminar Nasional Teknologi
Peternakan dan Veteriner 2006. 861-865.
Argyri AA, Zoumpopoulou G, Karatzas GKA, Tsakalidou E, Nychas EGJ, Panagou EZ, Tassou CC. 2013. Selection of potential probiotic lactic acid bacteria from fermented olives by in vitro tests. Food Microbiology. 33(2013):282-291.
Bao Y, Zhang Y, Liu Y, Wang S, Dong X, Wang Y, Zhang H. 2010. Screening of potential probiotics properties of Lactobacillus fermentum isolated from traditional dairy products. Food Control. 21 : 695-708.
Begley M, Hill C, Grahan CGM. 2006. Bile salt hydrolase activity in probiotics.
Applied and Environmental Microbiology. 72(3):1729-1738.
Bogaert JC, Naidu AS. 2000. Lactic Acid, Natural Food Antimicrobial System. Florida (US): CRC Press.
Bourlioux P, Koletzko B, Guarner F, Braesco V. 2003. The intestine and its microflora are partners for the protection of the host : report on the Danone symposium ‘ The Intelligent Intestine’, held in Paris, June 14, 2002.
American Journal of Clinical Nutrition. 78:675-683.
Budiman C. 2004. Karakteristik kimiawi dadih susu sapi hasil fermentasi bakteri probiotik yang disimpan pada suhu berbeda. [skripsi]. Bogor (ID): Program Studi Teknologi Hasil Ternak, Departemen Ilmu Produksi Terak, Fakultas Peternakan, Institut Pertanian Bogor.
Cappuccino JG, Sherman N. 1983. Microbiology A Laboratory Manual. New York (US): State University of New York. Hlm: 123.
Charteris WP, Kelly PM, Morelli L, Collins JK. 1998. Ingredient selection criteria for probiotic microorganisms in functional dairy foods. International
Journal Dairy Technology. 51(4):123-135.
Chou LS, Weimer B. 1999. Isolation and characterization of acid and bile tolerant isolates from strains of Lactobacillus acidophilus. Journal Dairy Science. 62:23-31.
Cotter PD, Hill C. 2003. Surviving the acid test : responses of Gram-positive bacteria to low pH. Microbiology and Molecular Biology Reviews. 67:429-453.
Counter M et al. 2005. Characterization of lactic acid bacteria isolated from Italian dry fermented sausage. Annual Faculty Medicine and Veterinay. 27:167-174.
De Angelis MA, Corsetti N, Tosti J, Rossi MR, Corbo, Gobbetti M. 2001. Characterization of non-starter lactic acid bacteria from Italian ewe cheeses based on phenotypic, genotypic, and cell wall protein analyses. Applied
Environmental Microbiology. 67:2011-2020.
Desniar. 2012. Karakterisasi bakteri asam laktat dari produk fermentasi ikan (bekasam). [disertasi]. Bogor (ID): Sekolah Pascasarjana, Institut Pertanian Bogor.