4. SELEKSI DAN KARAKTERISASI BAKTERI ASAM
LAKTAT INDIGENUS ASAL DAGING SAPI SEBAGAI
KANDIDAT PROBIOTIK SECARA IN VITRO
ABSTRAK
Sebanyak 28 isolat BAL indigenus asal daging sapi lokal Indonesia diseleksi dan dievaluasi sifat probiotiknya secara in vitro. Isolat BAL indigenus mempunyai ketahanan yang berbeda terhadap pH 2.0, 2.5, 3.2 dan 7.2 sesuai pH lambung dan usus. Hanya 10 isolat (2B4, 1B1, 1A5, 2C2, 2D1, 2B2, 1C4, 2B1, 1A32 dan 2C12) yang mampu bertahan dengan baik pada pH 2.0 dengan ketahanan hidup lebih dari 50%. Kesepuluh isolat tersebut juga menunjukkan ketahanan terhadap garam empedu 0.5% yang tinggi yaitu diatas 70%. Isolat 2B4 mempunyai ketahanan hidup terhadap garam empedu tertinggi yaitu sebanyak 90.93%. Selain itu, kesepuluh isolat mempunyai aktivitas antimikroba yang tinggi dan mampu melakukan koagregasi terhadap bakteri patogen E. coli ATCC 25922,
S. Typhimurium ATCC 14028, EPEC serta S. aureus ATCC 25923 (diameter
penghambatan lebih dari 6 mm, kecuali isolat 2B1 terhadap EPEC; koagregasi lebih dari 20% kecuali isolat 1A5 terhadap EPEC), serta mampu menempel pada permukaan usus sebesar 15.90-31.57%. Isolat 2C12 memiliki kemampuan penempelan tertinggi yaitu sebesar 31.57%. Berdasarkan hasil tersebut, maka disimpulkan bahwa sebanyak 10 isolat BAL indigenus asal daging sapi Indonesia memiliki sifat sebagai kandidat probiotik.
PENDAHULUAN
Pengembangan bakteri asam laktat (BAL) sebagai salah satu bahan pangan fungsional yaitu probiotik, menjadi tren teknologi pengolahan pangan akhir-akhir ini. BAL sering ditemukan secara alamiah dalam bahan pangan. Bakteri ini hidup pada susu, daging segar, dan sayur-sayuran. Pada proses fermentasi daging spontan, BAL yang berasal dari bahan mentah atau lingkungan menyebabkan terbentuknya asam laktat dari penggunaan karbohidrat, dan menurunkan nilai pH (5.9 – 4.6). Lactobacillus spp. merupakan genus terbesar dari kelompok BAL (Axelsson 1993). Genus Lactobacillus bersifat Gram-positif dan tidak membentuk spora, bersifat anaerob fakultatif, tumbuh optimum pada kisaran suhu 30-40°C tetapi dapat tumbuh pada kisaran 5-35°C. Lactobacillus tumbuh optimum pada pH 5.5-5.8, namun secara umum dapat tumbuh pada pH kurang dari 5.
Lactobacillus banyak terdapat pada produk makanan fermentasi seperti
sosis fermentasi, serta produk fermentasi sayuran seperti pikel dan sauerkraut.
Lactobacillus berkontribusi untuk pengawetan, ketersediaan nutrisi, dan flavor
pada produk fermentasi tersebut (Salminen & Wright 2004).
BAL mendapat perhatian besar karena banyak galur yang bermanfaat bagi kesehatan yang disebut sebagai probiotik. Probiotik didefinisikan sebagai mikroorganisme hidup yang apabila dikonsumsi oleh manusia atau hewan dalam jumlah cukup, mampu memberikan manfaat kesehatan bagi inangnya (FAO/WHO 2002). FAO/WHO (2002) telah mengeluarkan panduan untuk mengevaluasi probiotik dalam makanan. Working Group yang dibentuk oleh FAO/WHO menetapkan secara detil panduan dan kriteria rekomendasi serta metodologi yang digunakan untuk evaluasi probiotik, mengidentifikasi serta menentukan data-data yang dibutuhkan untuk mengklaim kesehatan probiotik. Kriteria pertama yang harus dipenuhi adalah bahwa isolat yang diperoleh harus diketahui identifikasinya, baik secara fenotipik maupun genotipik, mulai dari genus sampai spesies bahkan sampai tingkatan galur. Kriteria selanjutnya adalah karakterisasi sifat probiotik, baik secara in vitro maupun studi hewan, kemudian dilanjutkan dengan pengujian keamanan secara in vitro dan in vivo, serta studi fase satu di manusia untuk produk pangan probiotik (FAO/WHO 2002).
Beberapa peneliti mengemukakan jaminan kriteria untuk bakteri probiotik. Probiotik harus dapat bertahan melewati lambung dan usus halus, sehingga probiotik harus toleran terhadap suasana asam dan adanya asam empedu (Tuomola et al. 2001, Bourlioux et al. 2003, Roberfroid 2001, Sunny-Roberts & Knoor 2008). Probiotik harus mempunyai kemampuan dalam melakukan penempelan ke usus (Nitisinprasert et al. 2006, Tuomola et al. 2001, Bourlioux et
al. 2003), karena sangat berkaitan dengan beberapa efek kesehatan antara lain
mempersingkat durasi diare, efek imunologik dan eksklusi kompetitif dengan mikroba patogen (Tuomola et al. 2001; Herick & Levkut 2002; Bourlioux et al. 2003).
Sampai saat ini, penelitian eksplorasi BAL yang mempunyai potensi sebagai probiotik terus dilakukan oleh peneliti di berbagai negara, seiring dengan peningkatan konsumsi pangan probiotik. Di Indonesia, pangan probiotik juga semakin berkembang dan diminati masyarakat. Namun demikian, sebagian besar
probiotik yang digunakan masih berasal dari luar negeri. Hal ini mengakibatkan produk pangan probiotik di Indonesia sangat tergantung pada ketersediaan dan suplai probiotik dari luar negeri, yang akhirnya berdampak pada tingginya harga produk tersebut. Oleh karenanya, sangat diperlukan probiotik indigenus Indonesia agar ketersediaan probiotik sebagai bahan baku berbagai produk pangan probiotik dapat semakin berkembang dikonsumsi oleh masyarakat Indonesia. Sebanyak 28 isolat indigenus BAL telah diisolasi dari daging sapi lokal dari berbagai pasar tradisional di daerah Bogor oleh Arief et al (2007).
Penelitian ini bertujuan untuk menseleksi dan mengkarakterisasi isolat indigenus BAL asal daging lokal sebagai kandidat probiotik secara in vitro untuk memenuhi syarat studi awal probiotik isolat bakteri baru menurut FAO/WHO (2002). Karakteristik sifat probiotik meliputi ketahanan terhadap pH sesuai kondisi saluran pencernaan (lambung dan usus), garam empedu, aktivitas antimikroba terhadap bakteri patogen, koagregasi dengan bakteri patogen serta penempelan pada permukaan usus.
BAHAN DAN METODE
Bahan
Bahan utama yang digunakan dalam penelitian ini adalah 28 buah isolat BAL yang telah diisolasi dari daging sapi segar bangsa Peranakan Ongole di pasar tradisional wilayah Bogor (Arief et al. 2007). Isolat diawetkan dalam bentuk liofil dan disimpan pada suhu -30°C. Peremajaan kultur dilakukan dengan menumbuhkannya pada media MRS broth dan kemudian disegarkan dan disimpan pada media MRS agar sebagai kultur stok. Asal isolasi BAL tersebut ditunjukkan pada Tabel 4.1 dan semuanya bersifat Gram positif, katalase negatif dan non motil.
Tabel 4.1 Isolat BAL indigenus asal daging sapi lokal (Arief et al. 2007)
No Kode isolat Asal pasar (Bogor) Umur daging setelah
penyembelihan (jam)
1. 1A1, 1A2, 1A4,1A5, 1A6, 1A32
Anyar 9 jam (Tk)
2. 2A1,2A2, 2A3 Anyar 21 (9 jam Tk + 12 jam Tr)
3. 1B1, 1B2 Cibereum 9 jam (Tk)
4. 2B1, 2B2, 2B3, 2B4 Cibereum 21 (9 jam Tk + 12 jam Tr)
5. 1C1, 1C3, 1C4, 1C6 Ciampea 9 jam (Tk)
6. 2C12, 2C22 Ciampea 21 (9 jam Tk + 12 jam Tr)
7. 1D1, 1D2, 1D3, Gunung Batu 9 jam (Tk) 8. 2D1, 2D2, 2D41,
2D42
Gunung Batu 21 (9 jam Tk + 12 jam Tr)
Tk = suhu kamar Tr = suhu refrigerator
Metode
Ketahanan Terhadap pH Rendah sesuai Kondisi Saluran Pencernaan (Lin et
al . 2006)
Sebanyak 1 ml kultur BAL umur 24 jam dicampurkan secara homogen ke dalam 9 ml PBS (Phosphate Buffer Saline) yang telah diatur nilai pH-nya pada pH 2.0, 2.5, dan 3.2 (sesuai dengan pH lambung) dan pH 7.2 (sesuai dengan pH usus) dengan penambahan HCl 0.1 N atau NaOH 0.1 N selanjutnya diinkubasi pada suhu 37°C selama tiga jam. Setelah inkubasi, populasi BAL yang tumbuh dihitung dengan pengenceran pada BPW (Buffer Pepton Water) dan media pemupukan pada media MRS agar (Oxoid) pada suhu 37°C selama 48 jam. Populasi awal BAL umur 24 jam juga dihitung. Ketahanan terhadap pH rendah dihitung berdasarkan perbandingan populasi BAL yang tumbuh pada pH perlakuan dengan populasi awal. Percobaan ini dilakukan dengan menggunakan rancangan acak lengkap (RAL), tiga kali ulangan.
Ketahanan terhadap Garam Empedu (Lin et al. 2006)
Uji ketahanan terhadap garam empedu dilakukan dengan menumbuhkan BAL yang tahan hidup pada pH 2.0 selama tiga jam inkubasi (ketahanan hidup ≥ 50%) pada media MRS broth yang mengandung garam empedu 0.5%. Sebanyak satu ml kultur BAL umur 24 jam dimasukkan ke dalam sembilan ml MRS broth yang mengandung 0.5% garam empedu (Bile salt, Pronadisa) lalu diinkubasikan pada suhu 37°C selama enam jam sesuai dengan lamanya waktu transit makanan di usus halus sebelum ke usus besar (Bourlioux et al. 2003). Populasi awal BAL yang berumur 24 jam sebelum diinokulasikan ke media MRS yang mengandung garam empedu dihitung. Jumlah BAL dihitung pada media MRSA dengan metode tuang dengan inkubasi suhu 37°C selama 48 jam. Nilai ketahanan hidup ditunjukkan dengan persentase populasi yang tumbuh pada media garam empedu 0.5% dibandingkan dengan populasi awal. Percobaan ini dilakukan dengan RAL, tiga kali ulangan.
Uji Aktivitas Antimikroba BAL (Savadogo et al. 2004)
Isolat indigenus BAL diinokulasikan ke dalam MRS broth dan diinkubasikan pada suhu 37°C selama 20 jam. Supernatan bebas sel dipanen melalui sentrifugasi 10.000 rpm pada suhu 4 °C selama 20 menit, lalu disaring dengan menggunakan 0.22 µm membran filter (Sartorius). Selanjutnya supernatan bebas sel yang merupakan substrat antimikroba tersebut siap untuk diuji aktivitas antimikrobanya dengan menggunakan metode difusi agar.
Bakteri uji yang digunakan adalah beberapa bakteri patogen yaitu
Escherichia coli ATCC 25922, Salmonella Typhimurium ATCC 14028 Staphylococcus aureus ATCC 25923 serta Escherichia coli enteropatogen
(EPEC). Bakteri uji dibiakkan pada media Nutrien Agar (Difco) selama 24 jam pada suhu 37°C. Setelah itu diambil sebanyak satu ose kultur kerja tersebut lalu dibiakkan ke dalam tabung berisi media Nutrien Broth (Difco). Setelah 24 jam inkubasi, kultur bakteri uji diambil dua ose untuk diinokulasikan ke larutan pengencer NaCl 0.85% lalu disetarakan kekeruhannya dengan standar Mc. Farland no 0.5, yang memiliki kesamaan dengan jumlah populasi bakteri sebesar
8x108 cfu/ml. Suspensi bakteri uji yang terbentuk kemudian diencerkan dengan NaCl fisiologis 0.85% sampai diperoleh konsentrasi 106 cfu/ml.
Suspensi bakteri uji yang telah diencerkan kemudian diambil sebanyak satu ml dengan pipet steril kemudian dituangkan ke dalam cawan Petri steril, setelah itu dilanjutkan dengan menuangkan media Mueller Hinton Agar (MHA) bersuhu + 50°C. Setelah mengeras dibuat lubang sumur berdiameter lima mm dengan menggunakan ujung pipet Pasteur steril. Sebanyak 50 µl supernatan bebas sel dituangkan ke dalam setiap lubang sumur. Seluruh cawan diinkubasi pada suhu 37°C selama 24 jam. Zona hambat yang terbentuk di sekitar sumur diamati dan diukur diameternya dengan memakai jangka sorong. Percobaan ini dilakukan sebanyak tiga kali ulangan secara duplo dengan menggunakan RAL.
Pengukuran pH dilakukan dengan menggunakan pH meter Hanna. Terlebih dahulu pH meter dikalibrasi dengan larutan standar (ber-pH 4 dan 7), kemudian elektrodanya dimasukkan ke dalam sampel 10 ml supernatan bebas sel dan diamati nilai pH-nya. Penentuan total asam laktat dilakukan dengan metode titrasi. Oleh karena pada pengujian awal diketahui bahwa semua isolat merupakan bakteri homofermentatif, maka total asam tertitrasi yang diperoleh dinyatakan sebagai asam laktat dengan adanya faktor koreksi asam laktat. Supernatan bebas sel sebanyak 10 ml dimasukkan ke dalam labu Erlenmeyer, kemudian ditambahkan tiga tetes larutan indikator phenophtalein 1%. Selanjutnya supernatan dititrasi dengan larutan NaOH 0.1 N sampai terbentuk warna merah muda. Total asam tertitrasi dihitung sebagai persen asam laktat dengan rumus:
NaOH (ml) x N.NaOH x BM x FK
% asam laktat = x 100%
sampel (ml) Keterangan : N = normalitas
BM = berat molekul asam laktat (90), 1 ml NaOH 0.1 N = 0.009 g asam laktat
Uji Koagregasi BAL dengan Bakteri Patogen
Uji koagregasi BAL dengan bakteri patogen dilakukan sesuai metode El-Naggar (2004). Isolat BAL ditumbuhkan pada suhu 37 °C selama 24 jam di MRS broth, sedangkan bakteri patogen ditumbuhkan pada media NB diinkubasikan pada suhu 37°C selama 24 jam. Suspensi isolat BAL dan bakteri uji diukur OD-nya pada panjang gelombang 660 nm. Setiap volume 0.5 ml dari setiap suspensi bakteri dicampur dengan vortex termasuk kontrol dan OD diukur setelah 4 jam. Tabung kontrol berisi 1 ml suspensi setiap bakteri. Percobaan dilakukan dengan RAL, tiga kali ulangan secara duplo. Persentase koagregasi dikalkulasikan dengan menggunakan persamaan sebagai berikut :
(A + B)/2 - C
x 100 (A + B)/2
Keterangan :
A = OD (660 nm) dari tabung kontrol isolat BAL yang diukur pada waktu inkubasi 4 jam
B = OD (660 nm) dari tabung kontrol bakteri patogen yang diukur pada waktu inkubasi 4 jam
C = OD (660 nm) yang diukur dari suspensi campuran bakteri patogen dengan isolat BAL pada waktu inkubasi 4 jam
Uji Penempelan BAL pada Permukaan Usus secara in vitro
Pengujian sifat penempelan BAL pada permukaan usus dilakukan sesuai dengan metode Kos et al. (2003) dan Nitisinprasert et al.,(2006) yang dimodifikasi. Sampel permukaan usus bagian ileum yang diambil dari tikus yang berusia enam minggu dipotong dengan ukuran 1 cm x 1 cm. Terlebih dahulu, usus dicuci dengan PBS sebanyak tiga kali, lalu dilakukan perendaman dengan PBS selama 30 menit pada suhu refrigerator untuk menghilangkan mukosa usus. Pengujian penempelan dilakukan dengan menginkubasikan permukaan usus yang telah dihilangkan mukosanya pada suspensi BAL (populasi 108 cfu/ml) pada larutan PBS pada suhu 37°C selama 30 menit, kemudian dilakukan pencucian dengan PBS kembali sebanyak tiga kali. Selain itu dipersiapkan kontrol yaitu usus
yang tidak diinkubasi dengan suspensi BAL. Setelah itu, dilakukan penghitungan populasi BAL yang menempel pada permukaan usus dengan metode tuang menggunakan media MRS agar ditambah CaCO3 0.5%. Sifat penempelan BAL
pada permukaan usus dihitung dengan cara menghitung selisih populasi BAL yang menempel pada permukaan usus pada perlakuan inkubasi dengan suspensi BAL indigenus dibandingkan populasi BAL pada kontrol. Percobaan ini dilakukan dengan RAL, tiga kali ulangan.
Analisis Data
Data yang diperoleh dianalisis dengan menggunakan Analysis of Variance (ANOVA) (Steel & Torrie 1995). Data populasi BAL terlebih dahulu ditransformasikan ke nilai log10. Apabila terjadi perbedaan antar perlakuan, maka
dilanjutkan dengan uji Tukey menggunakan bantuan program komputer Minitab 14.
HASIL DAN PEMBAHASAN
Ketahanan BAL terhadap pH Rendah sesuai Kondisi Saluran Pencernaan
Untuk dapat bertahan dalam saluran pencernaan isolat probiotik harus dapat melewati kondisi ekstrim keasaman yang tinggi di lambung serta mampu bertahan pada kondisi garam empedu di saluran pencernaan. Ketahanan terhadap tingkat keasaman yang tinggi merupakan sifat yang pertama yang harus dipenuhi sebagai probiotik pada saat akan melakukan seleksi isolat probiotik (Tuomola et
al. 2001). Isolat indigenus BAL sebanyak 28 isolat diseleksi ketahanan hidupnya
pada kondisi pH 2.0, 2.5, 3.2 dan 7.2. Nilai pH 2.0 pada larutan PBS mewakili nilai pH lambung saat lambung kosong, tidak terisi makanan, sedangkan nilai pH 2.5 dan 3.2 dipilih mewakili kondisi pH lambung saat lambung terisi makanan. Nilai pH 7.2 ditentukan dengan berdasarkan pertimbangan kondisi pH di usus halus. Populasi awal isolat indigenus BAL serta pertumbuhannya pada kondisi pH yang berbeda dapat dilihat pada Tabel 4.2.
Tabel 4.2 Rataan populasi awal dan populasi akhir 28 isolat indigenus BAL pada kondisi pH sesuai saluran pencernaan
No Kode Populasi Populasi akhir (log cfu/ml)
Isolat awal (log cfu/ml) pH 2.0 pH 2.5 pH 3.2 pH 7.2 1 2B4 9.90 6.82 8.42 8.87 9.49 2 1C1 9.65 3.11 7.51 8.68 8.64 3 1B1 10.10 5.74 7.05 8.18 8.27 4 1A5 9.94 8.09 8.36 9.06 8.68 5 1D1 9.95 3.26 8.39 8.85 8.91 6 2D41 9.54 3.66 6.74 8.73 8.71 7 1B2 11.50 4.30 5.46 9.21 9.03 8 2D2 10.30 4.33 7.78 8.9 8.81 9 2C2 10.50 7.46 7.7 8.78 10.7 10 2A2 10.10 3.26 7.56 8.51 8.94 11 2D1 9.78 5.53 8.66 10.7 8.49 12 2B2 11.10 7.45 8.54 9.07 8.84 13 1A4 11.10 4.3 7.35 9.21 8.92 14 1C4 10.10 5.64 7.29 8.42 8.89 15 1A1 9.75 4.12 5.94 8.85 8.72 16 2B1 9.76 5.49 6.28 8.69 8.9 17 1A32 10.10 5.42 7.36 9.35 11.3 18 2C12 9.84 7.44 7.45 8.61 10.2 19 1A6 10.50 4.86 5.32 9.65 9.7 20 2D42 9.76 4.14 5.55 7.36 8.6 21 1A2 11.90 5.86 7.79 8.85 11.0 22 2A3 9.86 3.69 5.25 7.4 8.43 23 1C6 10.90 3.79 5.82 7.37 6.82 24 1C3 10.80 4.57 5.4 8.84 10.5 25 2A1 9.42 3.33 4.44 7.84 7.84 26 2B3 9.66 3.26 4.68 7.49 8.35 27 1D2 9.65 3.48 5.88 8.82 9.34 28 1D3 9.60 4.69 6.62 8.6 8.65 Rata-rata 10.18 4.90 6.81 8.68 9.10
Tabel 4.3 Ketahanan hidup 28 isolat indigenus BAL pada berbagai kisaran pH
No Kode isolat Ketahanan hidup (%)
pH 2.0 pH 2.5 pH 3.2 pH 7.2
1. 2B4 68.92 ± 0.85 bc 88.71 ± 0.25 a 89.62 ± 0.89 bcdefgh 95.84 ± 3.76 cdef 2. 1C1 32.25 ± 0.35 j 77.83 ± 0.55 bcd 89.91 ± 0.94 bcdefg 89.55 ± 1.02 fghij 3. 1B1 56.71 ± 0.54 d 69.65 ± 0.21 fghi 80.82 ± 0.34 ijklmn 81.62 ± 0.78 klmn 4. 1A5 81.36 ± 0.20 a 84.08 ± 0.95 abc 91.13 ± 2.48 bcde 87.33 ± 0.05 ghijk 5. 1D1 32.76 ± 2.43 j 84.35 ± 5.21 ab 89.00 ± 0.64 bcdefghi 89.58 ± 0.48 fghij 6. 2D41 38.39 ± 1.06 ghij 70.69 ± 1.37 efghi 91.58 ± 4.33 bcd 91.37 ± 1.21 defghi 7. 1B2 37.34 ± 1.76 hij 70.69 ± 2.62 m 79.92 ± 1.85 jklmn 78.34 ± 0.21 n 8. 2D2 41.89 ± 1.80 fghi 75.32 ± 0.38 def 86.13 ± 3.85 bcdefghij 85.21 ± 0.51 ijklm 9. 2C2 70.74 ± 0.34 bc 73.06 ± 2.63 defgh 83.32 ± 0.21 cdefghijkl 101.10 ± 0.56 bc 10. 2A2 32.34 ± 2.39 j 75.04 ± 4.12 def 84.42 ± 1.40 bcdefghik 88.71 ± 2.08 ghij 11. 2D1 56.59 ± 1.41 d 88.56 ± 0.71 a 109.90 ± 2.07 a 86.82 ± 0.90 ghijkl 12. 2B2 67.21 ± 1.24 c 77.02 ± 0.83 cde 81.75 ± 0.20 ghijklmn 79.69 ± 0.32 mn 13. 1A4 38.58 ± 0.90 ghij 65.91 ± 0.54 ghij 82.60 ± 0.72 fghijklmn 80.06 ± 0.40 lmn 14. 1C4 56.03 ± 5.09 d 72.44 ± 0.97 defgh 83.71 ± 4.09 cdefghijkl 88.34 ± 0.48 ghijk 15. 1A1 42.21 ± 1.08 fgh 60.86 ± 0.29 jk 90.79 ± 0.67 bcdef 89.45 ± 0.67 fghij 16. 2B1 56.29 ± 4.37 d 64.39 ± 1.32 ij 89.01 ± 3.65 bcdefghi 91.23 ± 0.45 defghi 17. 1A32 53.71 ± 3.60 de 72.95 ± 3.10 ij 92.66 ± 0.48 b 112.40 ± 2.26 a 18. 2C12 75.60 ± 3.76 ab 75.75 ± 0.82 def 87.49 ± 1.37 bcdefghij 103.80 ± 0.68 b 19. 1A6 46.29 ± 0.79 efg 50.67 ± 0.20 lm 91.86 ± 2.97 bc 92.38 ± 4.92 defg 20. 2D42 42.44 ± 0.81 fgh 56.90 ± 1.06 kl 75.46 ± 1.22 lmno 88.16 ± 0.93 ghijk 21. 1A2 49.18 ± 1.35 def 65.44 ± 2.52 hij 74.28 ± 6.36 no 92.23 ± 0.08 defgh 22. 2A3 37.46 ± 2.16 hij 53.25 ± 2.32 lm 75.02 ± 2.0 mno 85.50 ± 0.58 hijklm 23. 1C6 34.75 ± 6.30 hij 53.35 ± 0.48 lm 67.55 ± 4.95 o 62.49 ± 1.60 o 24. 1C3 42.18 ± 1.75 fgh 49.81 ± 4.63 lm 81.62 ± 1.07 hijklmn 97.10 ± 5.44 bcd 25. 2A1 35.39 ± 3.72 hij 47.13 ± 0.61 m 83.24 ± 1.01 efghijklm 83.22 ± 2.17 jklm 26. 2B3 33.74 ± 2.50 ij 48.43 ± 2.56 m 77.58 ± 4.19 klmn 86.42 ± 2.94 hgijklm 27. 1D2 36.02 ± 4.94 hij 60.92 ± 1.11 jk 91.38 ± 1.10 bcde 96.72 ± 4.68 cde 28. 1D3 48.88 ± 0.92 def 68.95 ± 4.58 fghi 89.61 ± 1.93 bcdefgh 90.12 ± 2.66 efghi
Rata-rata 48.05 68.05 85.33 89.10
Semua isolat indigenus BAL mempunyai ketahanan hidup yang berbeda nyata (p<0.05) terhadap setiap kondisi pH 2.0, 2.5, 3.2, dan 7.2 (Tabel 4.2). Nilai persentase ketahanan hidup sangat bervariasi pada semua kondisi pH. Semua isolat indigenus BAL mampu bertahan hidup lebih baik pada kondisi pH yang lebih tinggi. Hal ini ditunjukkan dengan nilai rataan persentase ketahanan hidup semua isolat BAL pada kondisi pH 7.2 (sesuai kondisi pH di usus halus), adalah paling tinggi (89.10%), diikuti dengan ketahanan hidup pada pH 3.2 (85.33%), selanjutnya pada pH 2.5 (68.05%) dan ketahanan hidup terendah adalah pada pH 2.0 (48.05%).
Populasi awal semua isolat BAL yaitu populasi setelah ditumbuhkan pada media MRS broth pada suhu 37°C selama 24 jam, yang juga digunakan pada pengujian ketahanan pada pH rendah, berkisar pada 9 – 11 log cfu/ml, dengan rataan populasi 10.18 log cfu/ml. Pada pH rendah, yaitu pH 2.0, 2.5, dan 3.2, isolat BAL mengalami penurunan populasi, dengan rataan populasi yang tahan pada pH 2.0 adalah 4.90 log cfu/ml; pada pH 3.2 sebesar 6.81 log cfu/ml, rataan populasi pada pH 3.2 sebesar 8.68 log cfu/ml serta populasi yang mampu bertahan hidup paling tinggi adalah pada pH 7.2 sebesar 9.10 log cfu/ml. Pada kondisi pH 2.0 selama tiga jam, ketahanan hidup isolat indigenus BAL berkisar dari 32.34% - 75.60% dengan rataan 48.05%. Sebanyak 10 isolat mempunyai nilai persentase ketahanan hidup pada kondisi pH 2.0 lebih besar dari 50%. Kesepuluh isolat tersebut juga mampu mempertahankan populasinya minimal sebesar 105 cfu/ml. Lin et al (2006) menyatakan bahwa ketahanan hidup BAL ≥ 50% pada kondisi pH 2.0 mampu menunjukkan bahwa BAL tersebut mempunyai ketahanan hidup yang tinggi. Isolat tersebut adalah isolat 2B4, 1B1, 1A5, 2C2, 2D1, 2B2, 1C4, 2B1, 1A32 dan 2C12. Isolat BAL lainnya sebanyak 18 isolat tidak dapat hidup dengan baik pada pH 2.0. Hal ini ditunjukkan dengan nilai persentase ketahanan hidup di bawah 50% dan juga populasi akhir yang tidak mencapai 105 cfu/ml, walaupun populasi awalnya cukup tinggi (9-10 log cfu/ml).
Secara umum, nilai persentase ketahanan hidup semua isolat BAL pada pH 2.5 lebih baik dibandingkan dengan kondisi pada pH 2.0, yaitu di atas 40%, dengan kisaran 47.13-88.71% dan rataan 68.05% Sebanyak 14 isolat BAL mempunyai nilai ketahanan hidup pada pH 2.5 di atas 70%, termasuk diantaranya
adalah kesepuluh isolat BAL yang mampu bertahan hidup pada pH 2.0. Demikian juga halnya dengan ketahanan hidup isolat BAL pada pH 3.2 yang lebih baik dibandingkan dengan kondisi pH 2.5. Semua isolat BAL mampu bertahan hidup dengan nilai persentase ketahanan hidup di atas 60%, dengan kisaran 67.55-109.90%, dengan rataan 85.33%. Kesepuluh isolat yang mampu bertahan hidup pada pH 2.0 dan 2.5 menunjukkan nilai ketahanan hidup pada pH 3.2 lebih baik dengan nilai di atas 80%. Namun demikian, tidak semua isolat BAL mempunyai ketahanan hidup pada pH 7.2 yang lebih tinggi dibandingkan dengan kondisi pH 3.2. Sebanyak 17 isolat BAL menunjukkan adanya populasi yang lebih rendah dibandingkan dengan populasi pada pH 3.2. Namun, kesemuanya tetap berada pada nilai persentase ketahanan hidup di atas 78%, kecuali satu isolat yang hanya mampu bertahan hidup sebesar 62%. Kesepuluh isolat yang mempunyai nilai kemampuan bertahan hidup pada pH 2.0 cukup tinggi, mampu menunjukkan ketahanannya pada pH 7.2 yaitu di atas 79%, bahkan ada yang melampaui populasi awalnya yaitu isolat 1A32, 2C12 dan 2C2 dengan ketahanan hidup diatas 100%. Hal ini menunjukkan bahwa isolat yang mampu bertahan pada pH 2.0 juga mampu bertahan dengan baik pada pH yang lebih tinggi sampai pH 7.2. Kondisi ini sangat penting untuk menseleksi isolat BAL yang akan digunakan pada tahapan karakterisasi sifat probiotik selanjutnya. Secara umum, isolat 2C12 dan 2B4 mempunyai ketahanan hidup pada pH rendah dan pH 7.2 (pH usus) yang lebih baik dibandingkan dengan isolat lainnya.
Sebagian besar mikroorganisme akan mati dan rusak dengan adanya pengaruh pH yang rendah dan kondisi asam klorida di dalam lambung. Pada manusia, waktu transit dari makanan masuk ke mulut sampai lambung minimal sekitar 90 menit, dan efek bakterisidal asam akan terjadi pada pH asam (Kimoto-Nira et al. 2007). Bila bakteri terpapar oleh asam kuat, maka membran sel akan rusak sehingga beberapa komponen intraseluler akan keluar dari sel, di antaranya ion Mg, Ca, K, asam nukleat dan protein. Akibatnya, sel bakteri akan mengalami kematian. Hal inilah yang menyebabkan terjadinya penurunan populasi isolat BAL yang ditumbuhkan pada kondisi pH 2.0, 2.5 serta 3.2. Walaupun demikian, isolat BAL mempunyai sistem regulasi sel yang mampu mengatur kondisi pH intraselulernya sehingga mampu bertahan pada kondisi pH rendah.
BAL mempunyai mekanisme homeostatis instrinsik yang menyebabkannya mampu bertahan pada kondisi pH rendah atau keasaman yang tinggi. Mekanisme yang terjadi pada BAL adalah sistem glutamat-dekarboksilase (GAD), sistem arginin deiminasi (ADI) dan pompa proton H+ - ATP ase. Melalui salah satu dari ketiga mekanisme tersebut, BAL mampu meningkatkan pH intaseluler dengan memproduksi γ-aminobutirat dari dekarboksilasi glutamat di dalam sel, ataupun memproduksi amonia dari katabolisme arginin (Cotter & Hill 2003).
Hasil penelitian ini memperkuat beberapa penelitian lainnya yang menunjukkan bahwa tidak semua galur BAL yang diisolasi dari pangan mempunyai ketahanan hidup yang baik pada kondisi pH yang rendah di antaranya penelitian Lin et al. (2006); Moyano et al. (2008); Mourad dan Eddine (2006) serta Mourad dan Meriem (2008). Lin et al (2006) melaporkan pada yogurt yang mengandung BAL L. acidophilus dan Bifidobacteria mengalami penurunan jumlah populasi bakteri yang mampu bertahan hidup pada pH 2.0 selama tiga jam. Populasi total awal BAL pada produk yogurt cair yang mengandung L.
acidophilus dan Bifidobacteria sebesar 108 cfu/ml, dan mampu bertahan sekitar 105 cfu/ml pada pH 2.0.
Sumber pangan seperti sosis fermentasi (Moyano et al. 2008), buah zaitun fermentasi (Mourad & Eddine 2006), mentega susu onta (Mourad & Meriem 2008), tanaman horseradish (Gbassi 2011) berpotensi probiotik karena mengandung L. plantarum yang mampu tahan pada pH rendah sesuai pH lambung. Moyano et al. (2008) menseleksi BAL yang diisolasi dari sosis fermentasi Iberian sebagai probiotik. Sebanyak 15 isolat dari 173 isolat mampu bertahan pada kondisi pH 2.5 selama 1.5 jam dengan penurunan populasi akhir maksimal 2 log cfu/ml, dengan populasi awal sebesar 108 cfu/ml. Isolat yang mampu bertahan tersebut dinyatakan sebagai kandidat probiotik untuk digunakan pada kultur starter produk sosis fermentasi.
Peneliti lainnya yaitu Mourad dan Eddine (2006) melakukan seleksi in
vitro probiotik untuk isolat L. plantarum yang diisolasi dari buah zaitun
terfermentasi. Sebanyak 11 isolat L. plantarum tidak mampu hidup pada pH 1.0 selama dua jam, persentase ketahanan hidupnya pada pH 2.0 selama dua jam
berkisar 33-65% dan pada pH 2.0 selama empat jam berkisar pada 18-53%, selanjutnya menurun pada pH 2.0 selama enam jam dengan persentase ketahanan hidup berkisar pada 11-28%. Mourad dan Meriem (2008) melaporkan bahwa dua galur L. plantarum yang diisolasi dari mentega susu onta daerah Sahara Algeria mampu bertahan hidup pada pH 2.0 selama dua jam inkubasi dengan tingkat ketahanan hidup untuk L. plantarum SH12 sebesar 54% dan L. plantarum SH24 sebesar 55%. Gbassi (2011) juga melaporkan bahwa tiga galur L. plantarum, yang salah satunya diisolasi dari tanaman horseradish, mampu bertahan hidup pada kompartemen lambung dan jejunum secara in vitro.
Sepuluh isolat BAL yang berdasarkan seleksi awal mampu bertahan dengan baik pada pH 2.0, 2.5, 3.2, dan 7.2, dengan minimal ketahanan hidup pada pH 2.0 ≥ 50% dipilih untuk dilanjutkan pengujian sifat probiotik. Pengujian tersebut meliputi ketahanan hidup pada garam empedu, aktivitas antimikroba terhadap bakteri patogen, koagregasi terhadap bakteri patogen, serta sifat penempelannya pada sel epitel usus secara in vitro. Kesepuluh isolat tersebut adalah 2B4, 1B1, 1A5, 2C2, 2D1, 2B2, 1C4, 2B1, 1A32 dan 2C12.
Ketahanan Hidup BAL terhadap Garam Empedu
Konsentrasi garam empedu di usus halus adalah sekitar 0.3-0.5%. Pada manusia normal, waktu transit makanan dari mulut sampai usus halus adalah antara 4-6 jam akhirnya di usus besar selama 24-48 jam (Bourlioux et al. 2003). Oleh karenanya pada penelitian ini digunakan konsentrasi garam empedu sebesar 0.5% selama enam jam inkubasi berdasarkan konsentrasi terbesar garam empedu dan kisaran tertinggi lama waktu transit makanan sampai sekum. Ketahanan hidup isolat BAL pada kondisi garam empedu ditunjukkan pada Gambar 4.1.
Populasi awal kesepuluh isolat BAL yang tahan pada pH rendah adalah berkisar pada 108 -109 cfu/ml. Setelah diinokulasikan ke dalam media MRS yang diberikan garam empedu 0.5% maka terjadi penurunan sebesar 1-3 log dengan populasi berkisar pada 106 - 108 cfu/ml. Nilai ketahanan terhadap garam empedu berbeda nyata (p<0.05) pada semua isolat BAL (Gambar 4.1). Secara umum, kesepuluh isolat BAL yang tahan pada pH 2.0 juga mempunyai ketahanan hidup pada garam empedu 0.5% selama 6 jam yang baik yaitu berkisar antara 72.87
sampai 90.93%. Dari sepuluh isolat BAL yang diuji, isolat 2B4 mempunyai ketahanan hidup tertinggi yaitu sebesar 90.93%. Ketahanan hidup pada garam empedu sebesar 70-80% dimiliki oleh tiga isolat BAL yaitu 1C4, 1A32 dan 1A5. Sebanyak enam isolat BAL yaitu 2B2, 2B1, 2C12, 1B1, 2D1, dan 2C2 mempunyai nilai ketahanan terhadap garam empedu 80-90%. Variasi ketahanan terhadap garam empedu tergantung pada spesies dan isolat BAL.
Gambar 4.1 Ketahanan hidup isolat BAL pada kondisi garam empedu 0.5% selama 6 jam. Huruf berbeda pada histogram menunjukkan beda nyata (p<0.05)
BAL mempunyai ketahanan hidup pada kondisi garam empedu disebabkan oleh beberapa spesies BAL mampu mendekonjugasi garam empedu dengan menggunakan asam amino taurin sebagai akseptor elektron atau selain itu juga sebagian besar galur BAL mempunyai enzim Bile Salt Hydrolase (BSH) yang diatur oleh gen bsh (Moser & Savage 2001). Begley et al. (2006) melaporkan bahwa enzim BSH menguraikan asam empedu terkonjugasi menjadi asam empedu tidak terkonjugasi dan melepaskan asam amino glisin atau taurin.
Beberapa peneliti juga melakukan eksperimen mengenai ketahanan hidup BAL terhadap garam empedu. Hasilnya menunjukkan bahwa variasi spesies dan galur berpengaruh terhadap kemampuannya untuk bertahan hidup pada kondisi media yang mengandung garam empedu. Lin et al. (2006) menguji yoghurt yang mengandung L. acidophilus dan Bifidobacteria yang sebelumnya tahan terhadap pH 2.0 ternyata mampu bertahan hidup pada kondisi garam empedu 0.3%. Pada populasi awal sebesar 108 cfu/ml, hanya terdapat penurunan populasi sebesar 1-2 log dan mencapai populasi akhir pada media garam empedu 0.3 % sebesar 106
-88.22 ab 72.87 e 88.79 ab 78.72 d 83.79 c 90.93 a 85.42 bc 79.14 d 87.22 abc 86.97 bc 0 10 20 30 40 50 60 70 80 90 100 2B2 1C4 2B1 1A32 2C12 2B4 1B1 1A5 2D1 2C2 Ke ta h a n an h id u p (% )
107 cfu/ml. Pereira et al. (2003) menyatakan galur L. fermentum KC5b mempunyai toleransi yang tinggi terhadap kondisi asam lambung dan garam empedu dan juga aktivitas BSH-nya tinggi. Mourad dan Meriem (2008) melaporkan bahwa galur L. plantarum SH 12 mempunyai ketahanan terhadap garam empedu 2% sebesar 75% yang lebih tinggi dibandingkan dengan galur L.
plantarum SH 21 yaitu sebesar 65%.
Aktivitas Antimikroba BAL terhadap Bakteri Patogen
Bakteri patogen yang digunakan pada eksperimen pengujian aktivitas antimikroba isolat BAL terlebih dahulu dihitung populasi awalnya. Jumlah bakteri ini merupakan jumlah yang diinokulasikan pada cawan untuk prosedur difusi agar. Kesemua bakteri patogen telah memenuhi jumlah yang diinginkan untuk pengujian yaitu sebesar 106 cfu/ml (Tabel 4.4).
Tabel 4.4 Populasi bakteri patogen yang digunakan pada pengujian aktivitas antimikroba BAL
Jenis Bakteri Uji Populasi (cfu/ml)
E. coli ATCC 25922 3.2 x 106
S. aureus ATCC 25923 5.6 x 106
S. Typhimurium ATCC 14028 4.4 x 106
E. coli enteropatogen (EPEC) 4.0 x 106
Supernatan bebas sel yang digunakan pada pengujian aktivitas antimikroba juga diukur pH dan total asam tertitrasinya. Nilai pH semua supernatan bebas sel dari seluruh isolat BAL berkisar 3.90-4.70, sedangkan nilai total asam laktatnya berkisar 0.28-0.57% (Tabel 4.5).
Tabel 4.5 Nilai pH dan keasaman supernatan bebas sel BAL Kode isolat Nilai pH Nilai total asam laktat (%)
2B1 4.27 0.31 1A5 3.93 0.57 2B2 4.00 0.43 2B4 4.17 0.33 1B1 4.07 0.37 2D1 3.90 0.55 1C4 4.23 0.31 2C12 4.70 0.28 2C2 4.50 0.30 1A32 4.10 0.34
Supernatan bebas sel yang mengandung senyawa antimikroba yang digunakan dalam pengujian ini sebagian besar terdiri atas asam laktat hasil fermentasi gula yang diproduksi oleh isolat indigenus BAL. Berdasarkan hasil identifikasi biokimiawi awal diketahui bahwa semua isolat indigenus BAL yang digunakan dalam penelitian ini tidak menghasilkan gas dari fermentasi glukosa atau bersifat homofermentatif, sehingga produk akhir fermentasinya adalah berupa asam laktat.
Berdasarkan fungsinya sebagai probiotik, kemampuan aktivitas antimikroba terhadap bakteri patogen menjadi sangat penting. Hal ini karena BAL yang mempunyai aktivitas antimikroba terhadap bakteri patogen, khususnya bakteri enteropatogen, akan bermanfaat bagi kesehatan manusia. Hasil pengujian aktivitas antimikroba kesepuluh isolat BAL menunjukkan bahwa semua isolat BAL tersebut mempunyai aktivitas antimikroba yang dapat menghambat pertumbuhan bakteri patogen, baik Gram negatif maupun Gram positif (Gambar 4.2 - 4.5).
Gambar 4.2 Aktivitas antimikroba isolat BAL terhadap E. coli ATCC 25922 Huruf berbeda pada histogram menunjukkan beda nyata (p<0.05) Semua isolat BAL mempunyai aktivitas antimikroba yang dapat menghambat pertumbuhan E. coli ATCC 25922. Aktivitas antimikroba ditunjukkan dengan terbentuknya zona hambat melalui pengujian dengan metode difusi agar, yang berbeda nyata setiap isolatnya (p<0.05). Diamater zona hambat yang diperoleh pada pengujian ini berkisar pada 8.44 sampai 12.99 mm (Gambar 4.2). Besaran diameter zona hambat dikategorikan oleh Pan et al. (2009), yaitu diameter zona hambat 0-3 mm menunjukkan aktivitas antimikroba rendah, lebih dari 3 sampai 6 mm berarti aktivitas antimikroba sedang dan diameter zona hambat lebih dari 6 mm menunjukkan aktivitas antimikroba tinggi. Diameter zona hambat yang dihasilkan oleh semua isolat BAL adalah lebih dari 6 mm. Hal ini menunjukkan bahwa semua isolat BAL mempunyai aktivitas antimikroba yang tinggi terhadap E. coli ATCC 25922.
8.78 cd 12.38 ab 9.26 bcd 12.99 a 10.39 abcd 12.18 abc 8.44 d 10.40 abcd 9.76 abcd 12.83 ab 0 2 4 6 8 10 12 14 16 18 2B1 1A5 2B2 2B4 1B1 2D1 1C4 2C12 2C2 1A32 D ia m e te r zo n a h a m b at (m m )
Gambar 4.3 Aktivitas antimikroba isolat BAL terhadap EPEC
Huruf berbeda pada histogram menunjukkan beda nyata (p<0.05)
Aktivitas antimikroba isolat BAL terhadap EPEC ditunjukkan dengan zona hambat yang berkisar 5.62 – 13.87 mm (Gambar 4.3), dan secara statistik menunjukkan beda nyata (p<0.05). Penghambatan terhadap EPEC terbesar dimiliki oleh isolat BAL 2C12, yang dinyatakan dengan diameter zona hambat 13.87 mm. Jika dikategorikan berdasarkan diameter zona hambat menurut Pan et
al (2009), sebanyak sembilan isolat termasuk kategori aktivitas antimikroba tinggi
(diameter zona hambat >6 mm), dan hanya satu isolat yaitu 2B1 yang mempunyai aktivitas sedang (diameter zona hambat 3-6 mm). Namun demikian, secara umum, aktivitas antimikroba isolat BAL lainnya terhadap EPEC lebih rendah jika dibandingkan dengan terhadap galur E. coli yang lain yaitu E. coli ATCC 25922.
5.62 c 6.37 bc 6.59 bc 6.59 bc 7.01 bc 6.83 bc 8.73 b 13.87 a 7.91 bc 7.31 bc 0 2 4 6 8 10 12 14 16 18 2B1 1A5 2B2 2B4 1B1 2D1 1C4 2C12 2C2 1A32 D ia m et e r zo n a h am b at (m m )
Gambar 4.4 Aktivitas antimikroba isolat BAL terhadap S. Typhimurium ATCC 14028. Huruf berbeda pada histogram menunjukkan beda nyata (p<0.05)
Aktivitas antimikroba kesepuluh isolat BAL terhadap S. Typhimurium ATCC 14028 secara statistik berbeda nyata (p<0.05). Diameter zona hambat pada hasil pengujian menggunakan difusi agar berkisar dari 7.69 – 12.51 mm (Gambar 4.4). Aktivitas antimikroba ini termasuk kategori tinggi menurut Pan et al (2009).
Gambar 4.5 Aktivitas antimikroba isolat BAL terhadap S. aureus ATCC 25923 Huruf berbeda pada histogram menunjukkan beda nyata (p<0.05)
9.98 a 9.45 a 10.42 a 10.24 a 7.69 b 10.47 a 10.42 a 9.75 a 9.38 a 12.51 a 0 2 4 6 8 10 12 14 16 2B1 1A5 2B2 2B4 1B1 2D1 1C4 2C12 2C2 1A32 D ia m et e r zo n a h am b a t (m m )
Isolat bakteri asam laktat
10.66 ab 6.86 b 8.03 ab 8.55 ab 8.43 ab 9.51 ab 11.18 a 10.95 a 9.39 ab 11.29 a 0 2 4 6 8 10 12 14 2B1 1A5 2B2 2B4 1B1 2D1 1C4 2C12 2C2 1A32 D ia m e te r zo n a h a m b at (m m )
Penghambatan terhadap S. aureus oleh senyawa antimikroba yang diproduksi oleh isolat BAL dipengaruhi oleh spesies bahkan galur dari isolat BAL dan berbeda nyata (p<0.05) (Gambar 4.5). Aktivitas antimikroba yang ditunjukkan dengan diameter zona hambat terhadap S. aureus ATCC 25923 berkisar 6.86-11.29 mm. Kesembilan BAL selain 1A5 mempunyai aktivitas daya hambat yang tidak berbeda, namun 1A5 mempunyai aktivitas antimikroba terendah. Walaupun demikian, dengan nilai diameter zona hambat di atas 6 mm, jika dikategorikan sesuai dengan pendapat Pan et al. (2009) maka aktivitas antimikroba dari kesepuluh isolat BAL termasuk kategori tinggi.
Dibandingkan dengan jenis patogen yang digunakan, aktivitas antimikroba semua isolat BAL dimulai dari aktivitas antimikroba tertinggi berturut-turut adalah terhadap E. coli ATCC 25922, S. Typhimurium ATCC 14028, S.aureus ATCC 25923 serta aktivitas antimikroba terendah terhadap EPEC. Isolat BAL lebih mampu menghambat bakteri Gram negatif (E coli ATCC 25922 dan S Typhimurium ATCC 14028) kecuali terhadap EPEC, dibandingkan dengan Gram positif S. aureus ATCC 25923. Dilaporkan oleh Fitrial (2009) dan Miksusanti (2009), EPEC merupakan bakteri yang resisten terhadap beberapa jenis antibiotika. Pada dosis antibiotik 2% b/v, EPEC K11 tidak dapat dihambat pertumbuhannya oleh antibiotik amoksilin dan ampisilin (diameter zona hambat 0 mm), sedangkan penghambatan yang sangat rendah (diameter zona hambat 1.72 mm) ditunjukkan oleh antibiotik kloramfenikol (Fitrial 2009; Miksusanti 2009). Tingkat resistensi EPEC terhadap senyawa antibiotik yang cukup tinggi ini selaras dengan resistensi EPEC terhadap senyawa antimikroba yang diproduksi oleh isolat BAL. Jika dilihat dari zona hambat yang dihasilkan oleh isolat BAL terhadap EPEC, isolat 2C12 mampu melakukan penghambatan yang signifikan lebih tinggi dibandingkan dengan isolat lainnya. Secara umum, isolat 2C12 juga mempunyai aktvitas penghambatan yang tinggi terhadap E. coli 25922, S. Typhimurium ATCC 14028 serta S. aureus ATCC 25922. Diameter zona hambat isolat 2C12 terhadap bakteri patogen ditunjukkan pada Gambar 4.6.
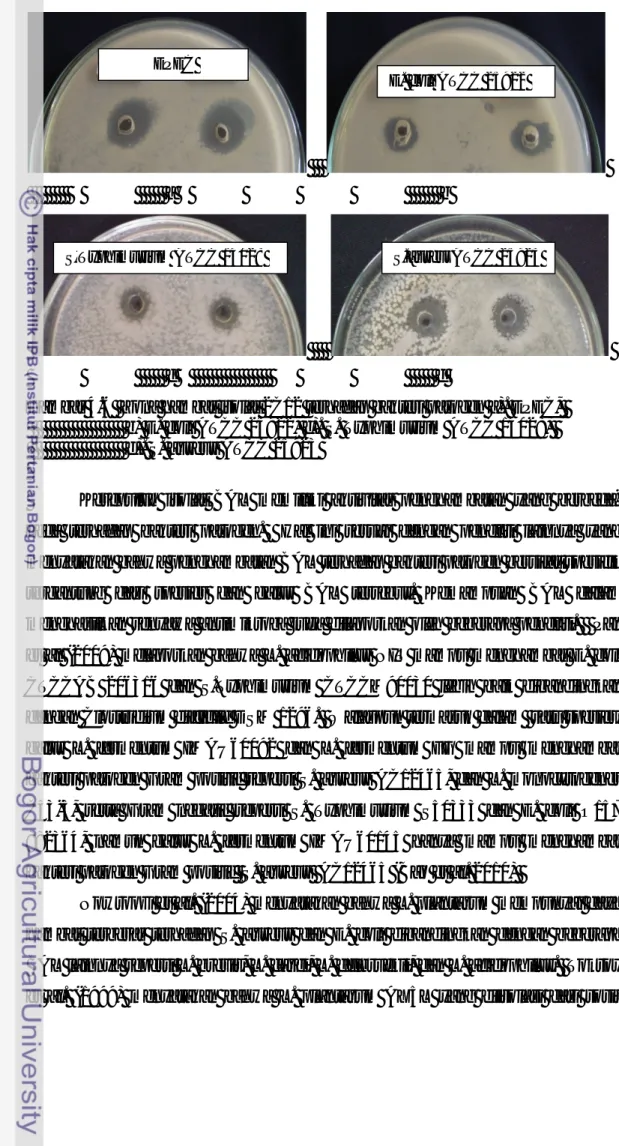
a b
c d
Gambar 4.6 Zona hambat isolat 2C12 terhadap bakteri patogen a). EPEC, b) E. coli ATCC 25922, c). S. Typhimurium ATCC 14028, d). S. aureus ATCC 25923
Kesepuluh isolat BAL memiliki aktivitas penghambatan yang berbeda-beda terhadap bakteri patogen. Hal ini sesuai dengan peneliti lainnya yang menyatakan bahwa penghambatan BAL terhadap bakteri patogen bersifat spesifik tergantung dari spesies dan galur BAL tersebut. Kemampuan BAL dalam menghasilkan senyawa antimikroba juga dilaporkan oleh beberapa peneliti. Pan
et al (2009) melaporkan bahwa L. acidophilus NIT mampu menghambat E. coli
CTCCAB 206316 dan S.Typhimurium CTCCM90030 lebih baik dibandingkan dengan Clostridium difficile DSM 1296. Walaupun termasuk dalam satu spesies, galur L. fermentum IMAU60092 dan L. fermentum FG mampu menghambat bakteri patogen Gram positif seperti S. aureus AC12465, dan L. monocytogenes C53-3, serta Gram negatif seperti S. Typhimurium S50333 dan E. coli O157 882364, namun galur L. fermentum IMAU60145 hanya mampu menghambat bakteri patogen Gram positif S. aureus AC12465 (Bao et al. 2010)
Nowroozi et al. (2004) menyatakan bahwa L. plantarum mempunyai daya hambat terbesar terhadap S. aureus dan E. coli dibandingkan dengan beberapa BAL lainnya seperti L. brevis, L. casei, L. delbruekii, dan L. acidophilus. Toksoy
et al. (1999) menyatakan bahwa L. plantarum AX5L yang diisolasi dari sosis
S.Typhimurium ATCC 14028 S.aureusATCC 25923
EPEC
dapat menghambat E. coli, S. aureus dan B. subtilis karena L. plantarum AX5L mampu menghasilkan H2O2, asam laktat sebesar 0.88% dan bakteriosin
plantarisin. Streptococcus lactis memiliki aktivitas bakterisidal terhadap bakteri Gram positif maupun Gram negatif antara lain Enterococcus faecalis, Bacillus
subtilis, S. Typhimurium dan E. coli (Suarsana et al. 2001).
Aktivitas antimikroba setiap isolat BAL yang berbeda terhadap spesies bakteri patogen yang berbeda disebabkan oleh komponen antimikroba yang dihasilkan oleh setiap isolat yang juga berbeda. Aktivitas antimikroba BAL disebabkan terutama oleh asam organik yang diproduksi sebagai hasil metabolisme glukosa. Pada penelitian ini, nilai total asam laktat berkisar pada 0.28-0.57% dengan kisaran pH 3.90-4.70. Asam laktat merupakan asam lemah tidak terdisosiasi yang mempunyai nilai pKa 3.86 pada suhu 25 °C (Bogaert & Naidu 2000). Mekanisme penghambatan asam laktat terhadap sel bakteri karena asam laktat mempunyai sifat hidrofobik, sehingga memudahkan difusi dalam bentuk proton ke dalam sel melalui membran sel. Akibatnya pH intraseluler lebih tinggi dibandingkan dengan pH ekstraseluler. Selanjutnya, di dalam sel, asam laktat terdisosiasi dan menurunkan pH intraseluler dengan melepaskan proton (Bogaert & Naidu 2000). Pelepasan proton/ ion hidrogen dapat mengganggu fungsi metabolik seperti translokasi substrat dan fosforilasi oksidatif, sehingga menyebabkan sel bakteri tersebut terhambat pertumbuhannya.
Selain asam laktat, BAL juga memproduksi senyawa antimikroba lainnya, di antaranya hidrogen peroksida dan senyawa bakteriosin (Bao et al. 2010). BAL memproduksi H2O2 (hidrogen peroksida) melalui transport elektron via enzim
flavin. Dengan adanya H2O2, bentuk anion superoksida merusak radikal hidroksi.
Proses antimikrobanya melibatkan peroksidase lipid membran dan meningkatkan permeabilitas membran. Hasilnya adalah efek bakterisidal dari metabolit oksigen yang mengakibatkan terjadinya oksidasi sel bakteri dan akhirnya merusak asam nukleat dan protein sel (Naidu & Clemens 2000).
Senyawa antimikroba lainnya yang diproduksi oleh BAL adalah bakteriosin. Bakteriosin merupakan molekul protein atau peptida ekstraseluler yang mempunyai aksi bakterisidal atau bakteriostatik terhadap bakteri yang mempunyai kekerabatan dekat (Savadogo et al. 2006; Albano et al. 2007). Bakteriosin dapat
didegradasi oleh enzim protease dalam saluran pencernaan. Bakteriosin bersifat
irrevesible, mudah dicerna, berpengaruh positif terhadap kesehatan dan aktif pada
konsentrasi rendah. (Pal et al. 2005; Savadogo et al. 2006). Mekanisme antimikroba bakterisoin dimulai dengan masuknya ke dalam sel sasarannya dengan cara membentuk pori di membran sel yang sensitif dan menurunkan potensial atau gradien pH yang menyebabkan rusaknya material seluler sehingga mampu menghambat pertumbuhan sel target (Ogunbawo et al. 2003; Moll et al. 1999).
Koagregasi BAL terhadap Bakteri Patogen
Bakteri probiotik dan patogen dapat membentuk gabungan agregrat yang disebut dengan koagregasi (Surono 2004). Probiotik yang mampu melakukan koagregasi dengan patogen akan efektif menghambat dan membunuh bakteri patogen karena senyawa antimikroba yang dihasilkan dapat beraktivitas langsung pada patogen (Surono 2004; Bao et al. 2010). Pada penelitian ini, dilakukan pengujian koagregasi antara sepuluh isolat indigenus BAL dengan bakteri patogen
E. coli ATCC 25922, EPEC, S.Typhimurium ATCC 14028 dan S. aureus ATCC
25923. Pengujian ini juga bertujuan untuk mengetahui kemampuan interaksi antara isolat BAL dengan bakteri patogen. Nilai koagregasi isolat indigenus BAL terhadap bakteri patogen ditunjukkan pada Gambar 4.7-4.10.
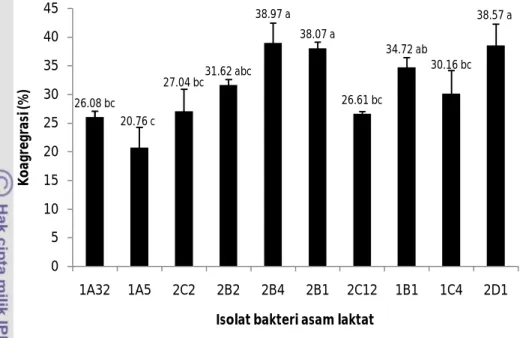
Gambar 4.7 Koagregasi isolat BAL terhadap E.coli ATCC 25922. Huruf berbeda pada histogram menunjukkan beda nyata (p<0.05) Isolat indigenus BAL mampu melakukan koagregasi secara nyata terhadap
E coli ATCC 25922 (p<0.05). Nilai kisaran koagregasi isolat BAL terhadap E. coli ATCC 25922 sebesar 20.76 – 38.97% (Gambar 4.7).
Gambar 4.8 Koagregasi isolat BAL terhadap EPEC. Huruf berbeda pada histogram menunjukkan beda nyata (p<0.05)
26.08 bc 20.76 c 27.04 bc31.62 abc 38.97 a 38.07 a 26.61 bc 34.72 ab 30.16 bc 38.57 a 0 5 10 15 20 25 30 35 40 45 1A32 1A5 2C2 2B2 2B4 2B1 2C12 1B1 1C4 2D1 Ko a gr e gr a si (% )
Isolat bakteri asam laktat
23.10 b 18.94 c 26.50 b 31.90 b 42.92 a 41.91 a 28.42 b 32.39 b 38.42 a 37.32 ab 0 5 10 15 20 25 30 35 40 45 50 1A32 1A5 2C2 2B2 2B4 2B1 2C12 1B1 1C4 2D1 Ko a gr e gr as i (% )
Isolat indigenus BAL mampu melakukan koagregasi dengan EPEC dan berbeda nyata secara statistik (p<0.05) dengan kisaran nilai 18.94 – 49.92% (Gambar 4.8). Kemampuan koagregasi ini sangat bermanfaat untuk menunjang kemampuan isolat BAL dalam menghambat pertumbuhan EPEC. Jika isolat BAL mampu melakukan koagregasi dengan EPEC, maka senyawa antimikroba yang dihasilkan oleh BAL akan lebih efektif bekerja dalam proses penghambatannya.
Gambar 4.9 Koagregasi isolat BAL terhadap S. Typhimurium ATCC 14028. Huruf berbeda pada histogram menunjukkan beda nyata (p<0.05) Isolat BAL mampu melakukan koagregasi dengan S. Typhimurium ATCC 14028 dan berbeda nyata (p<0.05) di antara 10 isolat. Kisaran nilai koagregasinya adalah 21.85 sampai 43.65% (Gambar 4.9). Nilai koagregasi ini lebih besar dibandingkan dengan koagregasi isolat BAL terhadap E.coli ATCC 25922 dan EPEC. 33.62 bcd 21.85 e 27.58 cde32.00 cd 42.57 ab 43.65 a 27.40 de 30.79 cde 37.13 abc 36.39 abcd 0 10 20 30 40 50 60 1A32 1A5 2C2 2B2 2B4 2B1 2C12 1B1 1C4 2D1 Ko ag re gr as i ( % )
Gambar 4.10 Koagregasi isolat BAL terhadap S. aureus ATCC 25923 Huruf berbeda pada histogram menunjukkan beda nyata (p<0.05)
Isolat BAL juga mampu melakukan koagregasi secara berbeda nyata terhadap S. aureus ATCC 25923 (p<0.05). Nilai kisaran koagregasinya sebesar 20.38 – 48.85% (Gambar 4.10). Jika dibandingkan antara jenis bakteri patogen, rataan koagregasi isolat BAL paling tinggi adalah terhadap S. aureus ATCC 25923, diikuti oleh S. Typhimurium 14028, EPEC dan terendah adalah terhadap
E. coli ATCC 25922. Koagregasi BAL terhadap bakteri Gram (+) lebih besar
daripada Gram (-). Hasil ini memperkuat penelitian Bao et al (2010) yang melaporkan bahwa koagregasi L. fermentum terhadap S. aureus lebih tinggi dibandingkan dengan E. coli dan S. Typhimurium. Kisaran nilai koagregasi galur
L. fermentum terhadap S. aureus antara 17.1- 49.9%. Nilai ini hampir sama
dengan hasil penelitian bahwa nilai koagregasi antara isolat BAL dengan S.
aureus ATCC 25923 berkisar pada 20.38 – 48.85%. Hal ini disebabkan oleh
morfologi dinding sel yang sama antara BAL dan S. aureus yaitu termasuk dalam Gram (+), yang memiliki lapisan peptidoglikan yang tebal dan bersifat hidrofobik sehingga memudahkan untuk saling berikatan.
Hasil penelitian ini lebih baik dibandingkan dengan hasil penelitian Kos et
al. (2003) yang melaporkan bahwa galur L. acidophilus M92 mampu melakukan
koagregasi dengan E. coli enteropatogen 304 sebesar 15.11% dan S. Typhimurium sebesar 15.70%. Nilai ini lebih rendah dibandingkan dengan nilai
35.27 bc 33.17 cd 37.79 abc 41.88 abc 48.85 a 36.79 abc 20.38 e 26.47 de 32.77 cde 46.23 ab 0 10 20 30 40 50 60 1A32 1A5 2C2 2B2 2B4 2B1 2C12 1B1 1C4 2D1 K o ag re gr as i (% )
koagregasi yang diperoleh pada rataan hasil penelitian ini yaitu 31.26% terhadap
E. coli ATCC 25922, 32.18% terhadap EPEC, 33.30% terhadap S. Typhimurium
ATCC 14028, serta 35.96% terhadap S. aureus ATCC 25923. El-Naggar (2004) melaporkan bahwa L. acidophilus dan L. plantarum memiliki sifat koagregasi yang baik dengan E. coli dan S. Typhimurium.
Koagregasi yang tinggi antara BAL dengan bakteri enteropatogen akan meningkatkan mekanisme pertahanan di saluran pencernaan dengan jalan mencegah kolonisasi bakteri enteropatogen di saluran pencernaan. Secara umum, isolat 2B4 mempunyai koagregasi terhadap bakteri patogen yang lebih baik daripada isolat lainnya. Hal ini sangat penting untuk mendukung efektivitas penghambatan bakteri patogen di saluran pencernaan.
Kemampuan koagregasi sangat dipengaruhi oleh spesies dan galur yang berbeda (Rinkinen et al. 2003; Bao et al. 2010). Penelitian Bao et al. (2010) menunjukkan bahwa sebanyak 11 galur L. fermentum mempunyai sifat koagregasi yang bervariasi terhadap lima jenis bakteri patogen yaitu L.
monocytogenes, S. aureus, E. coli, S.Typhimurium dan Shigella flexneri dan
hanya dua galur L. fermentum yang mempunyai nilai koagregasi yang tinggi (> 30%).
Penempelan BAL pada Permukaan Usus
Selain sifat ketahanannya terhadap pH rendah dan garam empedu, sifat BAL sebagai probiotik di saluran pencernaan juga ditentukan dengan uji penempelan. Berbagai model penempelan secara in vitro dilakukan antara lain penempelan ke permukaan usus babi oleh Kos et al. (2003), Mishra dan Prasad (2005) yang melakukan uji penempelan Lactobacillus casei secara in vitro ke sel usus tikus dan pemodelan penempelan ke stainless steel, Nitisinprasert et al. (2006) yang melakukan pengujian penempelan BAL menggunakan usus ayam, serta Blum et al. (1999) yang menggunakan model penempelan BAL sebagai probiotik secara in vitro ke sel Caco-2.
Kemampuan BAL untuk menempel pada permukaan sel epitel dan mukosa sangat penting, bukan hanya untuk menjaga keseimbangan jumlah bakteri dalam saluran pencernaan, tapi juga untuk mencegah asosiasi sel dan invasi bakteri
patogen (Ouwehand et al. 2001). Pada pengujian sifat penempelan ini digunakan permukaan usus tikus bagian ileum yang sudah dihilangkan mukosanya untuk mengetahui populasi BAL yang menempel. Usus tikus yang tidak diberikan perlakuan perendaman dengan suspensi BAL digunakan sebagai kontrol. Besaran penempelan BAL pada permukaan usus dinyatakan dengan menghitung selisih populasi BAL kontrol dengan populasi BAL pada perlakuan, selanjutnya dihitung persentase penempelannya. Hasil pengujian penempelan BAL pada permukaan usus tikus secara in vitro disajikan pada Tabel 4.6.
Tabel 4.6 Penempelan BAL pada permukaan usus tikus secara in vitro Sampel/isolat BAL
Rataan populasi BAL (log 10 cfu/cm2)
Persentase penempelan BAL ke permukaan usus (%)* Kontrol 5.53 ± 0.19 - 2B1 7.31 ± 0.21 24.18 ± 2.17 b 1A5 6.62 ± 0.19 15.90 ± 1.54 c 2B2 7.31 ± 0.36 24.08 ± 3.15 b 2B4 6.99 ± 0.28 20.88 ± 1.14 b 1B1 6.69 ± 0.05 16.85 ± 0.56 c 2D1 7.47 ± 0.44 25.62 ± 3.28 b 1C4 6.66 ± 0.33 16.35 ± 1.31 c 2C12 8.15 ± 0.31 31.57 ± 2.22 a 1A32 7.33 ± 0.24 23.87 ± 3.62 b 2C2 7.02 ± 0.26 20.94 ± 2.20 b
* = huruf berbeda pada kolom yang sama menyatakan beda nyata (p<0.05)
Kemampuan penempelan kesepuluh isolat BAL pada permukaan usus tikus bagian ileum secara in vitro berbeda nyata (p<0.05). Kemampuan penempelan BAL sangat berarti jika BAL dikonsumsi sebagai pangan ataupun suplemen fungsional, karena dengan adanya BAL yang menempel maka BAL tersebut mampu bertahan hidup lebih lama di saluran pencernaan yang selanjutnya dapat tumbuh, sedangkan BAL yang tidak mampu menempel dengan baik akan ikut gerakan peristaltik usus bersama sisa makanan untuk selanjutnya terbuang bersama feses. Implikasi selanjutnya adalah BAL yang mampu menempel di usus akan mampu memberikan efek pertahanan usus yang lebih baik untuk menolak adanya kemungkinan bakteri patogen yang mampu melakukan penempelan ke
usus. Dengan demikian, sifat penempelan yang lebih tinggi akan memberikan efek menguntungkan yang lebih tinggi.
Isolat BAL 2C12 mampu menempel pada permukaan usus lebih baik sebanyak 2.62 log cfu/cm2 atau sebesar 31.57% dibandingkan dengan isolat lainnya. Sebanyak enam isolat (2B1, 2B2, 2B4, 2D1, 1A32 dan 2C2) memiliki kemampuan penempelan pada permukaan usus yang tidak berbeda dengan kisaran 20.88-25.62%, sedangkan tiga isolat lainnya (1A5, 1B1 dan 1C4) memiliki penempelan terendah dengan kisaran 15.90 – 16.85%. Nilai penempelan di atas 20% dinyatakan tinggi oleh Nitisinprasert et al. (2006). Berdasarkan kriteria Nitisinprasert et al. (2006), sebanyak tujuh isolat BAL dinyatakan memiliki nilai penempelan tinggi (>20%) yaitu 2C12, 2B1, 2B2, 2B4, 2D1, 1A32 dan 2C2, sedangkan tiga isolat lainnya (1A5, 1B1 dan 1C4) mempunyai nilai penempelan rendah
Hasil penelitian ini menunjukkan bahwa kemampuan penempelan BAL pada permukaan usus dipengaruhi oleh spesies dan galur. Hasil penelitian ini memperkuat pendapat Morelli (2007) yang menyatakan bahwa kemampuan BAL pada sel epitel usus tergantung pada spesifik galur, dan tidak tergantung pada asal BAL tersebut diisolasi. Penelitiannya membuktikan bahwa sembilan galur L.
acidophilus mempunyai kemampuan menempel yang berbeda pada sel Caco-2.
Sebanyak dua galur L. acidophilus yang diisolasi dari manusia menunjukkan kemampuan menempel pada sel Caco-2 lebih baik daripada galur L. acidophilus yang diisolasi dari ayam, namun terdapat juga lima galur L. acidophilus dari manusia yang mempunyai nilai penempelan lebih rendah daripada L. acidophilus yang diisolasi dari ayam (Morelli 2007). Mishra dan Prasad (2005) yang melakukan penelitian penempelan BAL L. casei pada sel usus tikus juga menemukan bahwa galur L. casei yang diisolasi dari susu mempunyai nilai penempelan yang tinggi berkisar dari 52.8-66%. Nitisinprasert et al. (2006) melaporkan bahwa penempelan L. reuteri KUB-AC5, AC-16, AC 20 berkisar pada 0.87%-21.58%, sedangkan L. acidophilus KV-1 memiliki kemampuan penempelan sebesar 23.1%.
Hasil penelitian ini juga memperkuat hasil penelitian yang dilakukan oleh Pennacchia et al. (2006) yang menyatakan bahwa galur BAL mempengaruhi
kemampuan penempelan pada sel usus Caco-2 secara in vitro. Sebanyak 16 galur
Lactobacillus dengan populasi awal 109 cfu/ml diuji kemampuan penempelannya pada sel Caco-2 dan hasilnya menunjukkan bahwa sebanyak enam galur L.
plantarum, satu galur L. paraplantarum dan satu galur L. pentosus mempunyai
tingkat penempelan yang tinggi yaitu sebesar ( 6.5 x 107 cfu), sedangkan dua galur L. brevis mempunyai tingkat penempelan sedang (1.5 x 107 dan 2.1 x 107 cfu) dan satu galur L. paracasei mempunyai tingkat penempelan yang rendah (1.4 x 106 cfu).
Hasil penelitian ini juga sejalan dengan penelitian Lin et al (2006) yang menunjukkan bahwa isolat BAL yang terdapat pada produk yogurt B mampu menempel pada sel epitel usus manusia dengan populasi berkisar dari 105 – 106 cfu per sel Int-407, sedangkan isolat BAL pada produk A, C, D, dan E tidak ada yang mampu menempel pada sel epitel Int-407. Setelah diidentifikasi secara biokimiawi (API 50 CHL kit) dan molekuler (pita kromosom DNA dengan metode pulsed field gel electrophoresis/ PFGE), isolat BAL yang terdapat pada produk yogurt B adalah Lactobacilus acidophilus. Hal ini menunjukkan bahwa setelah mampu melewati kondisi asam lambung dan garam empedu di saluran pencernaan secara alami, L. acidophilus mampu menempel di mukosa usus selanjutnya berproliferasi sehingga populasinya semakin meningkat.
Penempelan bakteri pada permukaan epitel usus dipengaruhi oleh sel epitel usus, matriks ekstraseluler dan lapisan mukus. Lapisan mukus yang menutupi sel epitel merupakan kontak pertama di usus bagi mikroorganisme untuk melakukan penempelan dan kolonisasi di usus. Jika mukosa rusak, maka sel epitel usus merupakan tempat penempelan bakteri. Permukaan sel epitel usus diselimuti oleh lapisan yang bersifat visko-elastik yang terdiri dari glikoprotein yang merupakan sisi tempat penempelan bakteri. Setelah bakteri berhasil menempel dengan adanya interaksi antara adhesin dengan reseptor yang berupa glikoprotein di sel epitel usus, maka bakteri tersebut akan berkolonisasi dan memanfaatkan musin serta glikoprotein lainnya untuk pertumbuhannya (Adlerberth et al. 2000).
Adhesin merupakan suatu protein yang mengenali glikoprotein membran sel usus. Pada bakteri Gram positif, adhesin berada di dinding sel. L. plantarum
mengekspresikan manosa-binding adhesin yang lebih baik daripada spesies
Lactobacillus lainnya. Oleh karenanya L. plantarum cenderung memiliki sifat
penempelan ke permukaan usus yang baik (Adlerberth et al. 2000).
SIMPULAN
BAL indigenus asal daging sapi (28 isolat) menunjukkan ketahanan yang berbeda terhadap pH 2.0, 2.5, 3.2 dan 7.2, namun hanya 10 isolat (2B4, 1B1, 1A5, 2C2, 2D1, 2B2, 1C4, 2B1, 1A32 dan 2C12) yang mampu bertahan pada pH 2.0 dengan ketahanan hidup di atas 50% ( lebih dari 105 cfu/ml), pada pH 2.5 ( di atas 70%) serta pH 3.2 dan 7.2 ( di atas 80%). Kesepuluh isolat BAL juga mampu tahan garam empedu 0.5% dengan baik ( di atas 70%), mempunyai aktivitas antimikroba dan koagregrasi yang baik terhadap bakteri patogen E. coli ATCC 25922, S. Typhimurium ATCC 14028, EPEC dan S. aureus ATCC 25923 (diameter penghambatan lebih dari 6mm, kecuali isolat 2B1 terhadap EPEC; koagregasi lebih dari 20% kecuali isolat 1A5 terhadap EPEC). Kesepuluh isolat BAL mampu menempel pada permukaan usus sebesar 15.90-31.57%. Dengan demikian, 10 isolat BAL indigenus yang diisolasi dari daging sapi lokal mempunyai sifat sebagai kandidat probiotik.
DAFTAR PUSTAKA
Adlerberth I, Cerquetti M, Poilane I, Wold A, Collignon A. 2000. Mechanisms of colonization and resistance of the digestive tract. Part 1: bacteria/host interactions. Microbial Ecology in Health and Disease. 2 : 223-239. Albano H et al. 2007. Characterization of two bacteriocins produced by
Pediococcus acidilactici isolated from ‘Alheira’ a fermented sausage
traditionally produced in Portugal. Int J of Food Microbiol 116 : 239-247. Arief II, Maheswari RRA, Suryati T. 2007. Karakteristik dan Nilai Gizi Protein
Daging Sapi Dark Firm Dry (DFD) yang Difermentasi oleh Lactobacillus
plantarum yang Diisolasi dari Daging Sapi. Laporan Penelitian Hibah
Axelsson L. 1993. Lactid Acid Bacteria : classification and physiology. Di dalam: Lactid Acid Bacteria: Microbiology and Functional Aspects. 2nd Edition, Revised and Expanded. Salminen, S., and von Wright, A. (Editors.). New York : Marcell Dekker Inc.
Bao Y et al. 2010. Screening of potential probiotics properties of Lactobacillus
fermentum isolated from traditional dairy products. Food Control 21 :
695-708.
Bogaert JC, Naidu AS. 2000. Lactic acid. Di dalam: Natural Food Antimicrobial System. AS. Naidu (editor). Florida : CRC Press.
Begley M, Hill C, Grahan CGM. 2006. Bile salt hydrolase activity in probiotics.
Appl & Environ Microbiol 72: 1729-1738
Blum S et al. 1999. Adhesion studies for probiotics : need for validation and refinement. Trends in Food Sci & Technol 10 : 405-410.
Bourlioux P, Koletzko B, Guarner F, Braesco V. 2003. The intestine and its microflora are partners for the protection of the host : report on the Danone symposium ‘ The Intelligent Intestine’, held in Paris, June 14, 2002. Am J Clin Nutr 78: 675-683.
Bron PA et al. 2004. Genetic characterization of the bile salt response in
Lactobacillus plantarum and analysis of responsive promoters in vitro and
in situ in the gastrointestinal tract. J Bacteriol 186: 7829-7835
Cotter PD, Hill C. 2003. Surviving the acid test : responses of Gram-positive bacteria to low pH. Microbiol Molecular Biol Rev 67 (3): 429-453.
El-Naggar MYM. 2004. Comparative study of probiotic cultures to control the growth of Escherichia coli O157:H7 and Salmonella typhimurium.
Biotechnol 3: 173-180.
FAO/ WHO. 2002. Guidelines for the evaluation of probiotics in food. Report of Joint FAO/WHO Working Group on drafting Guidelines for the evaluation of probiotics in food. London Ontario, Canada.
Fitrial Y. 2009. Analisis potensi biji dan umbi teratai (Nymphaea pubescens wild) untuk pangan fungsional prebiotik dan antibakteri Escherichia coli enteropatogenik K.1.1. [Disertasi] Sekolah Pascasarjana Institut Pertanian Bogor.
Gbassi GK, Vandamme T, Yolou FS, Marchioni E. 2011. In vitro effects on pH, bile salts and enzymes on the release and viability of encapsulated
Lactobacillus plantarum strains in a gastrointestinal tract model. Int Dairy J 21: 97-102.
Herich R, Levkut M. 2002. Lactic acid bacteria, probiotics and immune system.
Kimoto-Nira H et al. 2007. Lactococcus sp. as potential probiotic lactic acid bacteria. JARQ 41: 181-189.
Kos B et al. 2003. Adhesion and agggregration ability of probiotic strain
Lactobacillus acidophilus M92. J Appl Microbiol 94: 981-987.
Lin WH, Hwang CF, Chen LW, Tsen HY. 2006. Viable counts, characteristic evaluation for commercial lactic acid bacteria products. Food Microbiol 23: 78-81.
Miksusanti. 2009. Aktivitas dan mekanisme antibakteri minyak atsiri temu kunci (Kaempferia pandurata roxb) serta inkorporasinya dalam pati sagu sebagai film edibel antibakteri. [Disertasi]. Sekolah Pascasarjana Institut Pertanian Bogor.
Mishra V, Prasad DN. 2005. Application of in vitro methods for selection of
Lactobacillus casei strains as potential probiotics. Int J Food Microbiol
103 : 109-115.
Moll GN, Konnings WN, Driessen AJM. 1999. Bacteriocins: mechanism of membrane insertion and pore formation. Antonie van Leeuwenhoek 76: 185-198.
Morelli L. 2007. In vitro assessment of probiotic bacteria : from survival to functionally. Int Dairy Journal 17: 1278-1283.
Moser SA, Savage DC. 2001. Bile salt hydrolase activity and resistance to toxicity of conjugated bile salts are unrelated properties in Lactobacilli. Appl &
Environ Microbiol 67: 3476-3480.
Mourad K, Eddine KN. 2006. In vitro preselection criteria for probiotic
Lactobacillus plantarum of fermented olives origin. Int J Probiotics and Prebiotic 1 : 27-32.
Mourad K, Meriem KH. 2008. Probiotics characteristics of Lactobacillus
plantarum strains from traditional butter made from camel milk in arid
region (Sahara) of Algeria. Grasas Y Aceites 59 : 218-224.
Moyano SR, Martin A, Benito MJ, Nevado FP, Cordoba MGG. 2008. Screening of lactic acid bacteria and bifidobacteria for potential probiotic use in Iberian dry fermented sausages. Meat Sci 80: 715-721.
Naidu AS, Clemens RA. 2000. Probiotics. Di dalam : Natural Food Antimicrobial Systems. A.S. Naidu (editor). Florida : CRC Press.
Nitisinprasert S, Pungsungworn N, Wanchaitanawong P, Loiseau W, Montet D. 2006. In vitro adhesion assay of lactic acid bacteria, Escherichia coli and
Salmonella sp. by microbiological and PCR methods. Songklanakarin J Sci Technol 28 (suppl.1) : 99-106.
Nowroozi J, Mirzaii M, Norouzi M. 2004. Studi of Lactobacillus as Probiotic Bacteria. Iranian J Publ Health 33 : 1-7.
Ogunbawo ST, Sanni AI, Onilude AA. 2003. Characterization of bacteriocin produced by Lactobacillus plantarum F1 and Lactobacillus brevis OG1.
Afr J Biotechnol 2 :219-227
Ouwehand AC, Tuomola EM, Tolkko S, Salminen S. 2001. Assessment of adhesion properties of novel probiotics strains to human intestinal mucus.
Int J Food Microbiol 64 : 119-126
Pal V, Jamuna M, Jeevaratnam K. 2005. Isolation and Characterization of Bacteriocin Producing Lactic Acid Bacteria from a South Indian Special Dosa (APPAM) Batter. J Culture Collection 4: 53-60
Pan X, Chen F, Wu T, Tang H, Zhao Z. 2009. The acid, bile tolerance and antimicrobial property of Lactobacillus acidophilus NIT. Food Control 20 : 598-602.
Pennachia C, Vaughan EE, Villani F. 2006. Potential probiotic Lactobacillus galurs from fermented sausages: Further investigations on their probiotic properties. Meat Sci 73: 90-101.
Pereira DIA, McCartey AL, Gibson GR. 2003. An in vitro study of the probiotic potential of a bile-salt-hydrolyzing Lactobacillus fermentum strain, and determination of its cholesterol-lowering properties. Appl & Environ
Microbiol. 69: 4743-4752.
Rinkinen M, Jalava K, Westermarck E, Salminen S, Ouwehand AC. 2003. Interaction between probiotic lactic acid bacteria and canine enteric pathogens: a risk factor for intestinal Enterococcus faecium colonization?.
Vet Microbiol 92: 111-119.
Roberfroid MB. 2000. Prebiotics and probiotics: are they functional foods?. Am
Clin Nutr 71(suppl) : 1682S-1687S.
Salminen S, Wright AV. 2004. Lactic Acid Bacteria. Microbiology and Functional Aspects. 2nd Edition, Revised and Expanded. New York : Marcell Dekker, Inc.,
Savadogo A, Outtara CAT, Bassole IHN, Traore AS. 2006. Bacteriocins and lactic acid bacteria – a minireview. Afr J Biotechnol 5 (9): 678-683.
Savadogo A, Outtara CAT, Bassole IHN, Traore AS. 2004. Antimicrobial activities of lactic acid bacteria strains isolated from Burkina Faso fermented milk. Pak J Nutr 3: 174-179.
Steel RGD, Torrie JH. 1995. Principles and Procedures of Statistic a Biomedical Approach, 3rd Edition. McGraw Hill,Inc. Singapore.
Suarsana IN, Utama IH, Suartini NGAA. 2001. Aktivitas in vitro senyawa antimikroba dari Streptococcus lactis. J Vet 2 : 25-31.
Sunny-Roberts EO, Knoor D. 2008. Evaluation of the response of Lactobacillus
rhamnosus VTT E-97800 to sucrose-induced osmotic stress. Food Microbiol 25 : 183-189.
Surono IS. 2004. Probiotik, Susu Fermentasi dan Kesehatan. YAPPMI. Jakarta. Toksoy A, Beyatli Y, Aslim B. 1999. Study on metabolic and antimicrobial
activities of some L. plantarum strains isolated from sausages. Tr J Vet An
Sci 533-540.
Tuomola E, Crittenden R, Playne M, Isolauri E, Salminen S. 2001. Quality assurance criteria for probiotic bacteria. Am J Clin Nutr 73 (suppl): 393S-398S.