KARAK
AS
KTERISA
SAL DAGI
IDENTI
UR
SE
INS
ASI BAKT
ING SAPI
IFIKASIN
RUTAN B
IRMA I
EKOLAH
STITUT P
TERI ASA
I SEBAGA
NYA DEN
BASA GEN
ISNAFIA
H PASCAS
PERTANIA
BOGOR
2011
M LAKTA
AI PROBI
NGAN ANA
N 16S rRN
ARIEF
SARJANA
AN BOGO
AT INDIG
IOTIK DA
ALISIS
NA
A
OR
PERNYATAAN MENGENAI DISERTASI DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa disertasi Karakterisasi Bakteri Asam Laktat Indigenus asal Daging Sapi sebagai Probiotik dan Identifikasinya dengan Analisis Urutan Basa Gen 16S rRNA adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Bogor, April 2011
ABSTRACT
IRMA ISNAFIA ARIEF. Characterization of Indigenous Lactic Acid Bacteria from Beef as Probiotic and Identification by 16S rRNA gene sequencing. Under supervisions of BETTY SRI LAKSMI JENIE, MADE ASTAWAN and
ARIEF BUDI WITARTO.
Functional foods are foods that have health promising benefit over and above their basic nutritional value. Probiotics are included as component of functional foods. Probiotics are live microorganisms which when administered in adequate amounts confer a health benefit on the host. The research was aimed to characterize the probiotic properties and to identify indigenous lactic acid bacteria (LAB) isolated from fresh beef derived from traditional market around Bogor, West Java, Indonesia. The twenty eight LAB isolates showed different ability to survive under simulated gastrointestinal conditions. Only 10 isolates could survive well at pH 2.0 (survival rate over than 50%) and the population increased at pH 2.5, 3.2 and 7.2. The ten LAB isolates (strain 2B4, 1B1, 1A5, 2C2, 2D1, 2B2, 1C4, 2B1, 1A32 and 2C12) could survive well at 0.5% bile salt, showed antibacterial activities and good coagregation capabilities against the tested pathogenic bacteria (Escherichia coli ATCC 25922, Salmonella Typhimurium ATCC 14028, Enteropathogenic Escherichia coli/EPEC, and Staphylococcus aureus ATCC 25923) and could adhere to intestinal surface by in vitro analysis. The 16S rRNA gene could be amplified by PCR (Polymerase Chain Reaction) to get single band with designed primer. Identification by 16S rRNA gene sequencing of 20 isolates showed that 11 isolates were identified as Lactobacillus plantarum, 6 isolates as Lactobacillus acidophilus, 2 isolates as Pediococcus pentosaceous and 1 isolate as Enterococcus faecium. The ten LAB isolates were proven to be probiotic candidates, which consist of 7 isolates of Lactobacillus plantarum (strain 1B1, 1A5, 2D1, 2B2, 1C4, 2B1, 2C12) and 3 isolates of Lactobacillus acidophilus (strain 2B4, 2C2, 1A32). Lactobacillus plantarum 2C12 and Lactobacillus acidophilus 2B4 were further evaluated to prevent diarrheae caused by EPEC. Albino rats (Rattus norvegicus) were daily orally administered by 108 cfu/ml of both probiotics without or simultaneously infected with EPEC (106 cfu/ml). Negative control was not infected by probiotic and EPEC while positive control was challenged with EPEC alone. It was observed that rats administered by L. plantarum 2C12 and L. acidophilus 2B4 which were challenged with EPEC had better performances when compared with the positive control for daily weight gain, feed consumption and feed efficiency rate. Both probiotics could prevent diarrhea caused by EPEC by increasing total population of lactic acid bacteria 1 log cfu/cm2 on mucosa of cecum and 1 log cfu/g on content of cecum, reducing population of E.coli 1-2 log cfu/cm2 on mucosa of cecum and 1 log cfu/g on cecum content also increasing 33.66-71.79 x 106 cell on lymphocytes. L. acidophilus 2B4 had better probiotic characteristics than L. plantarum 2C12, with specific health function to prevent diarrhea caused by EPEC.
RINGKASAN
IRMA ISNAFIA ARIEF. Karakterisasi Bakteri Asam Laktat Indigenus asal Daging Sapi sebagai Probiotik dan Identifikasinya dengan Analisis Urutan Basa Gen 16S rRNA. Dibimbing oleh BETTY SRI LAKSMI JENIE, MADE ASTAWAN, dan ARIEF BUDI WITARTO.
Diet atau asupan makanan memegang peranan penting untuk kesehatan manusia, khususnya pangan fungsional. Definisi pangan fungsional menurut BPOM (2005) adalah pangan yang secara alami maupun telah mengalami proses (produk olahan) mengandung satu atau lebih komponen fungsional yang berdasarkan kajian ilmiah memiliki fungsi fisiologis tertentu, terbukti tidak membahayakan dan bermanfaat bagi kesehatan. Salah satu contoh komponen pangan fungsional adalah probiotik. Probiotik didefinisikan sebagai mikroorganisme hidup yang apabila dikonsumsi dalam jumlah cukup, mampu memberikan manfaat kesehatan bagi inangnya (FAO/WHO 2002). Bakteri asam laktat (BAL) yang diisolasi dari bahan pangan dilaporkan mampu mempunyai sifat sebagai probiotik. Telah diisolasi sebanyak 28 isolat BAL indigenus dari daging sapi lokal Indonesia, bangsa sapi Peranakan Ongole, yang dijual di pasar tradisional daerah Bogor, Jawa Barat. Dalam rangka mencari keunggulan BAL indigenus tersebut, khususnya untuk pengembangan pangan fungsional di Indonesia, maka penelitian karakterisasi BAL indigenus asal daging sapi lokal sebagai probiotik perlu dilakukan. Tujuan penelitian ini secara umum adalah untuk melakukan karakterisasi dan seleksi BAL indigenus asal daging sapi lokal sebagai probiotik dan identifikasinya secara molekuler dengan menggunakan PCR dan analisis urutan basa gen 16S rRNA. Manfaat yang diperoleh dalam penelitian ini adalah galur BAL indigenus yang diperoleh akan sangat berguna bagi industri pangan fungsional berbasis probiotik yang dewasa ini semakin berkembang dan dibutuhkan oleh masyarakat.
Penelitian ini merupakan serangkaian tahapan kajian untuk mendapatkan galur BAL indigenus yang mempunyai sifat probiotik berdasarkan persyaratan yang ditetapkan oleh FAO/WHO (2002). Ruang lingkup kajian penelitian yang dilakukan meliputi tiga kajian yaitu : (1) seleksi dan karakterisasi isolat indigenus BAL sebagai kandidat probiotik secara in vitro melalui pengujian ketahanan terhadap pH rendah dan garam empedu, aktivitas antimikroba dan koagregrasi terhadap bakteri patogen serta penempelannya pada permukaan usus, (2) identifikasi isolat BAL indigenus sampai tingkat spesies dan galur secara molekuler menggunakan PCR dan analisis urutan basa gen 16S rRNA, dan (3) pengujian efektivitas dua galur BAL yang mempunyai sifat probiotik unggul sebagai pencegah diare pada tikus yang dipapar EPEC.
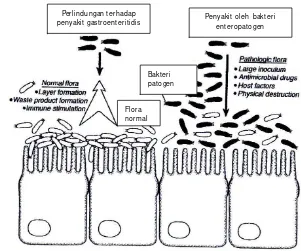
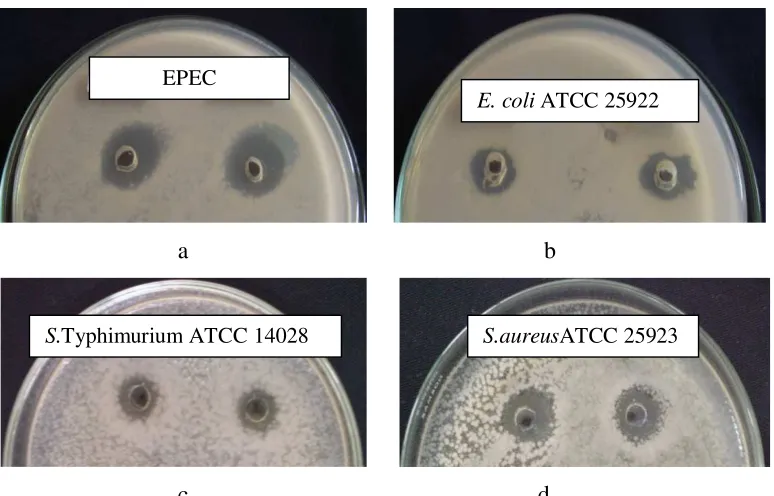
Kemampuan aktivitas antimikroba terhadap bakteri patogen dilakukan dengan menguji penghambatan BAL terhadap Escherichia coli ATCC 25922, S.Typhimurium ATCC 14028, Staphylococcus aureus ATCC 25923 serta E. coli enteropatogen (EPEC), dengan menggunakan metode difusi sumur. Selain itu, juga dilakukan pengujian koagregasi BAL terhadap empat jenis bakteri patogen tersebut. Pengujian sifat penempelan pada permukaan usus dilakukan dengan menggunakan permukaan usus tikus bagian ileum secara in vitro.
Identifikasi BAL indigenus asal daging sapi lokal Indonesia dilakukan secara molekuler dengan menggunakan PCR dan analisis urutan basa gen 16S rRNA. Gen 16S rRNA merupakan gen yang digunakan untuk menentukan adanya perbedaan taksonomi suatu bakteri. Primer yang digunakan untuk mengamplifikasi gen 16S rRNA adalah primer universal 9F (5’-GAGTTTGATCCTGGCTCAG-3’) dan 1541R (5’-AAGGAGGTGATCCAGCC-3’), sedangkan untuk analisis urutan basa (sequencing) gen 16S rRNA digunakan lima primer yaitu dua primer universal 785F (5’-GGATTAGATA CCCTGGTAGTC-3’) dan 802R (5’-TACCAGGGTATCTAATCC -3’), serta tiga primer yang didesain pada penelitian ini yaitu primer 1R (5’-GGGCATG ATGATTTGACGTC-3’), primer 2F (5’-GTGAGACTGCCGGTGACAAA-3’) dan primer 3R (5’-ATCAGACTTA AAAAACCGCC-3’).
Keunggulan BAL indigenus sebagai probiotik dievaluasi kemampuannya secara khusus untuk tujuan pencegah diare yang disebabkan EPEC dengan menggunakan tikus Sprague Dawley sebagai hewan model. BAL yang dipilih pada penelitian ini adalah BAL yang mempunyai sifat probiotik yang baik berdasarkan penelitian tahap sebelumnya. Terdapat 6 grup tikus yaitu grup tikus kontrol negatif (tanpa dicekok probiotik dan EPEC), grup tikus L.plantarum 2C12, grup tikus L. acidophilus 2B4, grup tikus L. plantarum 2C12 + EPEC, grup tikus L. acidophilus 2B4 + EPEC dan grup tikus kontrol positif. Dosis BAL yang diberikan adalah sebesar 108 cfu/ml sebanyak 1 ml per hari selama 21 hari. Pada hari ke-7 sampai ke-13, diberikan infeksi EPEC dengan dosis sebesar 106 cfu/ml sebanyak 1 ml per hari pada grup tikus yang dicekok EPEC.
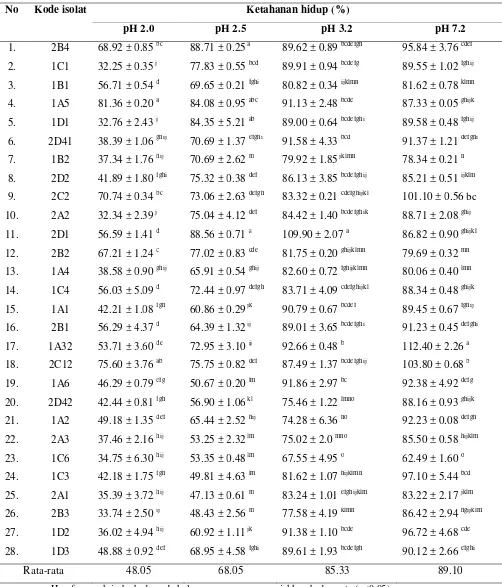
Hasil penelitian karakterisasi BAL indigenus sebagai probiotik secara in vitro menunjukkan bahwa 28 isolat BAL indigenus mempunyai ketahanan yang berbeda terhadap pH rendah. Hanya 10 isolat (2B4, 1B1, 1A5, 2C2, 2D1, 2B2, 1C4, 2B1, 1A32 dan 2C12) yang mampu bertahan dengan baik pada pH 2.0 dengan ketahanan hidup lebih dari 50%. Kesepuluh isolat tersebut juga menunjukkan ketahanan terhadap garam empedu 0.5% yang tinggi yaitu diatas 70%. Selain itu, kesepuluh isolat mempunyai aktivitas antimikroba yang tinggi dan mampu melakukan koagregasi terhadap bakteri patogen E. coli ATCC 25922, S. Typhimurium ATCC 14028, EPEC serta S. aureus ATCC 25923 (diameter penghambatan di atas 6mm, kecuali isolat 2B1 terhadap EPEC; koagregasi di atas 20% kecuali isolat 1A5 terhadap EPEC), serta mampu menempel pada permukaan usus sebesar 15.90-31.57%. Dengan demikian, 10 isolat BAL indigenus asal daging sapi Indonesia memiliki sifat sebagai kandidat probiotik.
V6-
V9 (600 pasang basa) dengan primer yang dirancang sendiri. Berdasarkan analisis urutan basa gen 16S rRNA terhadap 20 isolat BAL termasuk didalamnya 10 BAL yang terseleksi sebagai kandidat probiotik, BAL indigenus asal daging sapi lokal Indonesia terbagi dalam empat spesies yaitu Lactobacillus plantarum, Pediococcus pentosaceous, Enterococcus faecium dan Lactobacillus acidophilus. Kesepuluh BAL indigenus yang mempunyai sifat sebagai kandidat probiotik termasuk dalam L. plantarum sebanyak tujuh galur (1B1, 1A5, 2D1, 2B2, 1C4, 2B1, 2C12) dan tiga galur (2B4, 2C2, 1A32) diidentifikasi sebagai L. acidophilus. L. plantarum 2C12 atau L. acidophilus 2B4 mampu mencegah diare yang ditandai oleh feses yang mempunyai kadar air rendah (<60%). Pemberian L. plantarum 2C12 atau L. acidophilus 2B4 mampu meningkatkan populasi BAL sebesar 1 log cfu/cm2 di mukosa sekum dan 1 log cfu/g isi sekum, menurunkan populasi E. coli sebesar 1-2 log cfu/cm2 di mukosa sekum dan 1 log cfu/g pada isi sekum, serta meningkatkan jumlah sel limfosit sebesar 33.66-71.79 x 106 sel. L. acidophilus 2B4 lebih efektif menghambat E.coli di saluran pencernaan dibandingkan dengan L. plantarum 2C12.
Berdasarkan hasil penelitian, dapat disimpulkan bahwa dua spesies probiotik unggul asal daging sapi berhasil ditemukan dan diidentifikasi berdasarkan analisis urutan basa gen 16S rRNA, yaitu L. plantarum 2C12 dan L. acidophilus 2B4. Kedua BAL tersebut terbukti sebagai probiotik yang mempunyai klaim kesehatan sebagai pencegah diare yang disebabkan oleh EPEC.
Kata kunci : probiotik, bakteri asam laktat indigenus, analisis urutan basa gen 16S rRNA
@ Hak cipta milik IPB, tahun 2011
Hak cipta dilindungi Undang-undang
1. Dilarang mengutip sebagian atau seluruhnya karya tulis ini tanpa mencantumkan atau menyebutkan sumber.
a. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penulisan kritik atau tinjauan suatu masalah.
b. Pengutipan tidak merugikan kepentingan yang wajar IPB.
2. Dilarang mengumumkan dan memperbanyak sebagian atau seluruhnya karya tulis dalam bentuk apapun tanpa izin IPB.
KARAKTERISASI BAKTERI ASAM LAKTAT INDIGENUS
ASAL DAGING SAPI SEBAGAI PROBIOTIK DAN
IDENTIFIKASINYA DENGAN ANALISIS
URUTAN BASA GEN 16S rRNA
IRMA ISNAFIA ARIEF
Disertasi
sebagai salah satu syarat untuk memperoleh gelar Doktor pada
Program Studi Ilmu Pangan
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Penguji pada Ujian Tertutup : Dr. Ir. Lilis Nuraida, M.Sc.
Drh. Ita Djuwita, M.Phil, PhD
Penguji pada Ujian Terbuka : Prof. Dr. Ir. Zaenal Bachruddin, M.Sc.
Judul Disertasi : Karakterisasi Bakteri Asam Laktat Indigenus asal Daging Sapi sebagai Probiotik dan Identifikasinya dengan Analisis Urutan Basa Gen 16S rRNA
Nama : Irma Isnafia Arief NIM : F261060051
Disetujui
Komisi Pembimbing
Prof.Dr.Ir. Betty Sri Laksmi Jenie, M.S.
Ketua
Prof.Dr. Ir. Made Astawan, M.S. Dr. Arief Budi Witarto, M.Eng
Anggota Anggota
Mengetahui
Ketua Program Studi Dekan Sekolah Pascasarjana Ilmu Pangan
Dr. Ir. Ratih Dewanti H, M.Sc Dr. Ir. Dahrul Syah, MSc.Agr
“
Maka nikmat Tuhan kamu yang manakah
yang kamu dustakan?”
(QS. Ar-Rahman)
Karya ini kupersembahkan terutama untuk
PRAKATA
Puji syukur ke hadirat Allah SWT atas segala karunia dan rahmat-Nya
sehingga penulis mampu menyelesaikan disertasi dengan judul “Karakterisasi
Bakteri Asam Laktat Indigenus asal Daging Sapi sebagai Probiotik dan
Identifikasinya dengan Analisis Urutan Basa Gen 16S rRNA”. Disertasi ini
dibuat sebagai salah satu syarat bagi mahasiswa pascasarjana program S3 untuk
meraih gelar Doktor pada Program Studi Ilmu Pangan, Institut Pertanian Bogor.
Penulis menyampaikan penghargaan dan ucapan terima kasih kepada Prof.
Dr. Ir. Betty Sri Laksmi Jenie, M.S. selaku ketua komisi pembimbing, Prof. Dr. Ir.
Made Astawan, M.S. dan Dr. Arief Budi Witarto, M.Eng. selaku anggota komisi
pembimbing atas segala waktu, arahan, bimbingan, saran, ketulusan dan
kesabaran sehingga penulis dapat menyelesaikan penelitian ini dengan baik.
Kepada Prof. Dr. Kazuhito Fujiyama, International Center for Biotechnology
(IC-Biotech), Osaka University Jepang, penulis menyampaikan terimakasih atas bimbingan dan kesediaannya mengijinkan penulis melakukan sebagian penelitian
ini di laboratorium yang dipimpin, dengan didukung segala fasilitas yang tersedia.
Ucapan terimakasih juga penulis sampaikan kepada DIKTI yang telah
mendanai penelitian ini melalui penelitian Hibah Bersaing tahun 2009, serta
program Sandwich-like pada tahun 2009 sehingga penelitian dapat berjalan dengan lancar. Kepada Dr. Ir. Lilis Nuraida, M.Sc dan drh Ita Djuwita, M.Phil,
PhD penulis menyampaikan terimakasih atas masukannya sebagai penguji pada
ujian tertutup. Kepada Prof. Dr. Ir. Zaenal Bachruddin, M.Sc dan Dr. Ir. Ingrid S.
Surono, M.Sc, penulis mengucapkan terimakasih atas kesediaan dan masukannya
sebagai penguji pada ujian terbuka. Kepada seluruh staf pengajar Program Studi
Ilmu Pangan IPB, penulis mengucapkan terimakasih atas ilmu yang diberikan
selama perkuliahan.
Kepada rekan-rekan mahasiswa pascasarjana Program Studi Ilmu Pangan
IPB, khususnya angkatan 2006, penulis menyampaikan terimakasih atas segala
bantuan, dukungan dan waktu yang diluangkan untuk berdiskusi selama penulis
menempuh pendidikan program Doktor ini. Kepada Dr. Junko Ishoyama, penulis
IC-Biotech Osaka University Jepang. Kepada para teknisi yang membantu selama penelitian, penulis juga mengucapkan terima kasih. Kepada para sahabat, staf
pengajar Departemen Ilmu Produksi dan Teknologi Peternakan, Fakultas
Peternakan IPB, penulis juga menyampaikan terimakasih atas pengertian dan
dukungannya.
Kepada ayahanda dan ibunda tercinta, penulis sampaikan terimakasih atas
doa dan nasihat yang diberikan, juga terhadap ibu mertua dan bapak mertua (alm).
Kepada yang tercinta suami, Eka Sakti Habibullah, Lc., serta ketiga ananda :
Muhammad Taufiqurrahman, Muhammad Fathurrahman, serta Mohammad
Shofiyurrahman, terimakasih atas segala pengertian, dukungan dan pengorbanan
yang diberikan selama penulis menyelesaikan studi ini. Kepada keluarga dan
seluruh adik, penulis sampaikan terimakasih atas doa dan dukungannya.
Semoga Allah SWT memberikan balasan yang berlipatganda dan semoga
penelitian ini dapat memberikan manfaat.
Bogor, April 2011
RIWAYAT HIDUP
Penulis dilahirkan di Demak pada tanggal 4 Maret 1975, sebagai anak
pertama dari ayahanda HM. Sutarno dan Hj. Muslimatun. Pendidikan dasar
sampai menengah atas ditempuh di kota Demak, Jawa tengah. Pendidikan sarjana
ditempuh di Jurusan Ilmu Produksi Ternak, Fakultas Peternakan, Institut
Pertanian Bogor, mulai tahun 1993 dan lulus pada tahun 1998. Penulis
melanjutkan studi ke jenjang S2 di Program Studi Ilmu Pangan IPB, mulai tahun
1998 dan lulus pada tahun 2000 dengan bantuan beasiswa URGE Batch V dari
Bank Dunia. Pada tahun 2006, penulis melanjutkan studi S3 di Program Studi
Ilmu Pangan IPB dengan beasiswa BPPS DIKTI.
Sejak tahun 1999, penulis bekerja sebagai staf pengajar tetap di
Departemen Ilmu Produksi dan Teknologi Peternakan, Fakultas Peternakan,
Institut Pertanian Bogor.
Penulis telah mempresentasikan sebagian hasil penelitian ini pada
beberapa seminar. Seminar pertama diikuti dengan judul “Molecular detection
of 10 indigenous lactic acid bacteria isolated from fresh beef as probiotic candidates” pada presentasi oral 2ndInternational Symposium on Probiotic and Prebiotic as Functional foods for Human Health Promotion, Jakarta 4-5 Agustus 2010. Seminar kedua diikuti oleh penulis dengan mempresentasikan secara oral
hasil penelitian yang berjudul “Probiotic properties of indigenous Indonesian
lactic acid bacteria and their identification based on 16S rRNA” di ISNFF (International Society for Nutraceuticals & Functional Food) Conference, Bali 11-15 Oktober 2010. Selain itu pula, penulis juga berhasil memenangkan Student
competition PATPI 2009 sebagai juara kedua dengan makalah berjudul “Characterization indigenous lactic acid bacteria isolated from fresh beef as
probiotic candidates”. Naskah yang berjudul “Efektivitas probiotik Lactobacillus plantarum 2C12 dan Lactobacillus acidophilus 2B4 sebagai pencegah diare pada tikus percobaan” telah dipublikasikan pada Media Peternakan, jurnal terakreditasi
SK Dikti no 43/DIKTI/kep/2008, ISSN 0126-0472, Vol. 33 No.3 tahun 2010
DAFTAR ISI
Halaman
DAFTAR TABEL ………... xvii
DAFTAR GAMBAR ……… xix
DAFTAR LAMPIRAN ………. xxi
1. PENDAHULUAN Latar Belakang ……….. 1
Tujuan Penelitian ………... 4
Manfaat Penelitian ………. 4
Ruang Lingkup Penelitian ………. 5
2. TINJAUAN PUSTAKA ………. 7
3. METODOLOGI UMUM ………. 39
4. SELEKSI DAN KARAKTERISASI BAKTERI ASAM LAKTAT INDIGENUS ASAL DAGING SAPI SEBAGAI KANDIDAT PROBIOTIK SECARA IN VITRO Abstrak ……….. 43
Pendahuluan ……….. 43
Bahan dan Metode ……… 45
Hasil dan Pembahasan ………... 50
Simpulan ………... 74
Daftar Pustaka ……….. 74
5. IDENTIFIKASI BAKTERI ASAM LAKTAT INDIGENUS ASAL DAGING SAPI DENGAN MENGGUNAKAN PCR (POLYMERASE CHAIN REACTION) DAN ANALISIS URUTAN BASA GEN 16S rRNA Abstrak ………. 79
Pendahuluan ……….. 79
Bahan dan Metode ………... 82
Hasil dan Pembahasan ………... 89
Simpulan ………... 117
Daftar Pustaka ……….. 118
6. EFEKTIVITAS PROBIOTIK Lactobacillus plantarum 2C12 DAN Lactobacillus acidophilus 2B4 SEBAGAI PENCEGAH DIARE PADA TIKUS YANG DIPAPAR Escherichia coli enteropatogen (EPEC) Abstrak ………. 123
Pendahuluan ………. 123
Bahan dan Metode ………... 125
Hasil dan Pembahasan ……….. 131
Simpulan ………... 146
Halaman
7. PEMBAHASAN UMUM ………. 151
8. SIMPULAN DAN SARAN ………. 161
DAFTAR TABEL
Halaman
2.1 Hasil isolasi BAL dari berbagai bahan pangan dan non pangan... 9
4.1 Isolasi bakteri asam laktat asal daging sapi lokal ………. 46
4.2 Rataan populasi awal dan populasi akhir 28 isolat indigenus BAL
pada kondisi pH sesuai saluran pencernaan ………... 51
4.3 Ketahanan hidup 28 isolat indigenus BAL pada berbagai kisaran pH ………..
52
4.4 Populasi bakteri patogen yang digunakan pada pengujian aktivitas antimikroba BAL ………...
58
4.5 Nilai pH dan keasaman supernatan bebas sel BAL ... 59
4.6 Sifat penempelan BAL pada sel epitel usus tikus secara in vitro…… 71
5.1 Morfologi 20 isolat BAL asal daging sapi lokal ………... 82
5.2 Pemilihan isolat 20 BAL dari 28 isolat BAL untuk identifikasi
molekuler berdasarkan kemampuan fermentasi 12 jenis gula …….. 83
5.3 Nilai konsentrasi dan kemurnian ekstrak genom 20 isolat BAL …... 90
5.4 Komposisi nukleotida/basa gen penyandi 16S rRNA isolat BAL
……… 103
5.5 Jarak nukleotida (p-distance) yang merupakan proporsi perbedaan
diantara dua isolat yang dibandingkan pada 20 isolat BAL ……… 105
5.6 Similaritas (%) di antara dua isolat BAL (x versus y), berdasarkan
Tamura et al (2008) ………. 106
5.7 Urutan pertama identitas isolat BAL dengan isolat internasional yang terdaftar pada Genbank, berdasarkan pencarian BLAST
………. 108
5.8 Hasil analisis BLAST yang menunjukkan terdapat identitas maksimal 100% pada enam isolat BAL dengan L. acidophilus
NCFM ……….. 109
Halaman
6.2 Perlakuan pemberian probiotik dan EPEC ... 128 6.3 Kadar air feses tikus percobaan ... 132
6.4 Pengaruh pemberian probiotik L.plantarum 2C12 dan L. acidophilus 2B4 terhadap konsumsi ransum, pertambahan bobot badan dan efisiensi ransum tikus percobaan ……….. 133
6.5 Pengaruh pemberian probiotik L.plantarum 2C12 dan L.
acidophilus 2B4 terhadap total BAL mukosa sekum tikus sehat
(logcfu/cm2) ……….. 135 6.6 Pengaruh pemberian probiotik L.plantarum 2C12 dan L.
acidophilus 2B4 terhadap total BAL mukosa sekum tikus sakit (logcfu/cm2) ……….. 135 6.7 Pengaruh pemberian probiotik L. plantarum 2C12 dan L.
acidophilus 2B4 terhadap total BAL isi sekum tikus sehat
(log cfu/g) ... 137
6.8 Pengaruh pemberian probiotik L. plantarum 2C12 dan L. acidophilus 2B4 terhadap total BAL isi sekum tikus sakit
(log cfu/g) ... 137
6.8 Pengaruh pemberian probiotik L. plantarum 2C12 dan L.
acidophilus 2B4 terhadap total E. coli mukosa sekum tikus sehat (log cfu/cm2) ……… 138 6.9 Pengaruh pemberian probiotik L. plantarum 2C12 dan L.
acidophilus 2B4 terhadap total E. coli mukosa sekum tikus sakit (log cfu/cm2) ……… 139 6.10 Pengaruh pemberian probiotik L. plantarum 2C12 dan L.
acidophilus 2B4 terhadap total E. coli isi sekum tikus sehat
(log cfu/g) ……….. 141
6.11 Pengaruh pemberian probiotik L. plantarum 2C12 dan L. acidophilus 2B4 terhadap total E. coli isi sekum tikus sakit
(log cfu/g) ……….. 142
6.12 Pengaruh pemberian probiotik L. plantarum 2C12 dan L. acidophilus 2B4 terhadap jumlah sel limfosit tikus sehat
(sel) ………. 144
6.13 Pengaruh pemberian probiotik L. plantarum 2C12 dan L. acidophilus 2B4 terhadap jumlah sel limfosit tikus sakit
DAFTAR GAMBAR
Halaman
2.1 Mekanisme sistem glutamat dekarboksilasi ……… 14
2.2 Struktur kimia asam empedu (Begley et al. 2005) ……….. 17
2.3 Peranan enzim BSH dalam menguraikan asam empedu (Begley et al.
2006) ……… 18
2.4 Mekanisme pembentukan pori oleh bakteriosin (a). model
’wedge-like pore’, (b) model ’barrel-stave pore’ (Moll et al. 1999) ... 21
2.5 Struktur sederhana glikoprotein (Bourlioux et al. 2003) ... 24
2.6 Penempelan bakteri ke glikoprotein di sel epitel usus (Danone
research team 2002) ... 24
2.7 Kompetisi antara bakteri probiotik (flora normal) dan bakteri
patogen di usus ……… 26
2.8 Mekanisme penempelan EPEC di sel epitel usus (Lu & Walker
2001)………. 27
3.1 Tahapan aktivitas penelitian ……… 42
4.1 Ketahanan hidup isolat BAL pada kondisi garam empedu 0.5%
selama 6 jam ………. 57
4.2 Aktivitas antimikroba isolat BAL terhadap E. coli ATCC 25922
………... 60
4.3 Aktivitas antimikroba isolat indigenus BAL terhadap EPEC …….. 61
4.4 Aktivitas antimikroba isolat BAL terhadap S.Typhimurium ATCC
14028 ……… 62
4.5 Aktivitas antimikroba isolat BAL terhadap S. aureus ATCC 25923 ... 62
4.6 Zona hambat isolat 2C12 terhadap bakteri patogen a). EPEC , b) E.coli ATCC 25922, c). S.Typhimurium ATCC 14028, d). S.aureus
ATCC 25923 ……….. 64
4.7 Koagregasi isolat BAL terhadap E.coli ATCC 25922 ……… 67
Halaman
4.9 Koagregasi isolat BAL terhadap S. Typhimurium ATCC 14028 …... 68
4.10 Koagregasi isolat BAL terhadap S. aureus ATCC 25923 …………. 69
5.1 Lokasi amplikon analisis urutan basa gen ……… 87
5.2 Peralatan utama yang digunakan (a) PCR Applied Biosystem, (b) Elektroforesis agarosa Muphid, (c) Sekuenser gen ABI Prism 3100
genetic analyzer (Applied Biosystem) ……….. 88
5.3 Hasil pita elektroforesis agarosa gen 16S rRNA pada kondisi (a). PCR dengan suhu annealing 49○C, selama 15 detik dan (b). PCR
dengan suhu annealing 55°C selama 15 detik ……….. 91
5.4 Hasil PCR gen 16S rRNA, produk sebelum dipurifikasi pada
elektroforesis agarosa 1%... 93
5.5 Elektroferogram (ABI-chromatogram pada software Bioedit) sebagian urutan basa gen 16S rRNA isolat 2B4 dengan primer 802R
……….. 95
5.6 Alignment urutan basa ke-900 sampai 1540 gen 16S rRNA dari 20 isolat BAL yang terdapat daerah tetap (conserved region). Clustal Co= conserved region yang diperoleh pada Clustal W …….. 101
5.7 Contoh tampilan hasil analisis BLASTN untuk isolat 2C12 ………… 110
5.8 Dendogram pohon filogenetik isolat BAL (a) tanpa disejajarkan dengan isolat internasional (GenBank), (b) dengan bootstrap dan disejajarkan dengan L. acidophilus NCFM …….... ……… 111
5.9 Dendogram pohon filogenetik isolat BAL dengan bootsrap dan
disejajarkan dengan isolat GenBank ……. ………. 112
6.1 Kondisi fisik tikus a). Tikus tidak diare, bagian anus tidak merah. b).tikus diare, anus iritasi, radang dan merah ……….. 131
DAFTAR LAMPIRAN
Halaman
1. ANOVA ketahanan BAL terhadap pH 2 ……… 164
2. ANOVA ketahanan BAL terhadap pH 2.5 ………. 165
3. ANOVA ketahanan BAL terhadap pH 3.2 ………. 166
4. ANOVA ketahanan BAL terhadap pH 7.2 ... 167
5. ANOVA ketahanan BAL terhadap garam empedu ……… 168
6. ANOVA penghambatan BAL terhadap E.coli ATCC 25922 ……… 169
7. ANOVA penghambatan BAL terhadap EPEC ………. 170
8. ANOVA penghambatan BAL terhadap S.Typhimurium ATCC 14028 ……….. 171
9. ANOVA penghambatan BAL terhadap S.aureus ATCC 25923……. 172
10. ANOVA koagregrasi BAL terhadap E.coli ATCC 25922 ………… 173
11. ANOVA koagregrasi BAL terhadap EPEC ………. 174
12. ANOVA koagregrasi BAL terhadap S.Typhimurium ATCC 14028 ……….. 175
13. ANOVA koagregrasi BAL terhadap S.aureus ATCC 25923 ……… 176
14. Ranking sifat probiotik 10 isolat BAL indigenus ……… 177
15. ANOVA konsumsi ransum tikus percobaan ……….. 178
16. Surat keterangan E. coli ……… 179
17. Surat keterangan tikus percobaan dari BPOM ……… 180
18. Desain primer 1R, 2F dan 3R ……… 181
19. Contoh urutan pencarian BLAST yang menunjukkan identitas maksimal dekat dengan L. plantarum (Galur BAL 1C4) ……… 182 20. Contoh urutan pencarian BLAST yang menunjukkan homologi dekat dengan L. acidophilus (Galur BAL 2B4) ……….. 188
Halaman
22. Contoh urutan pencarian BLAST yang menunjukkan homologi
dekat dengan E.faecium (Galur BAL 2D2)……… 200
23. Hasil identifikasi isolat 2B4 dengan menggunakan API CHL …….. 206
1.
PENDAHULUAN
Latar Belakang
Konsep pangan fungsional telah dikenalkan sejak lama oleh Hippocrates
melalui moto ”Jadikan makanan sebagai obat”. Pembuktian moto tersebut
berkembang selama beberapa dekade ini yang menunjukkan bahwa diet atau
asupan makanan memegang peranan penting untuk kesehatan manusia (Vasiljevic
& Shah 2008). Definisi pangan fungsional menurut BPOM (2005) adalah pangan
yang secara alami maupun telah mengalami proses (produk olahan) mengandung
satu atau lebih komponen fungsional yang berdasarkan kajian ilmiah memiliki
fungsi fisiologis tertentu, terbukti tidak membahayakan dan bermanfaat bagi
kesehatan. Salah satu contoh komponen pangan fungsional adalah probiotik.
Pengembangan bakteri asam laktat (BAL) sebagai komponen pangan
fungsional menjadi tren dalam perkembangan teknologi pengolahan pangan saat
ini. Sebagai probiotik, BAL memiliki beberapa sifat fungsional yang
menguntungkan bagi kesehatan manusia. Beberapa produk pangan yang
menonjolkan sifat probiotik BAL antara lain adalah : kefir, susu asidofilus
(Surono 2004; Lin et al. 2006), sauerkraut (Plengvidhya et al. 2007) serta sosis
fermentasi (Antara et al. 2004, Aberle et al. 2000; Hopzapfel 1998; Toksoy et al.
1999; Erkilla 2001).
Probiotik didefinisikan sebagai mikroorganisme hidup yang bila
dikonsumsi dalam jumlah yang cukup mampu memberikan manfaat kesehatan
bagi inangnya (FAO/WHO 2002). Galur BAL dapat dinyatakan sebagai probiotik
jika memenuhi syarat sebagai berikut : (1). BAL tersebut termasuk dalam GRAS
(Generally Recognized as Safe) (FAO/WHO 2002); (2). BAL tetap bertahan
hidup selama pengolahan dan penyimpanan (FAO/WHO 2002; Sunny-Roberts &
Knoor 2008); (3). dapat bertahan hidup pada kondisi asam dan garam empedu;
(4). dapat menempel pada epitelium usus inangnya; dan (5). bersifat antagonistik
terhadap bakteri patogen (FAO/WHO 2002; Agostoni et al. 2004).
Keuntungan mengonsumsi probiotik menurut Tannock (1999) dan
Nowroozi (2004) antara lain : (1) meningkatkan sistem kekebalan tubuh, (2)
karsinogenik, (4) mengikis sel tumor, dan (5) mengurangi gejala lactose
intolerance. Tannock (1999) dan Roberfroid (2000) menambahkan bahwa
probiotik dapat digunakan sebagai antidiare dan mempunyai efek
hipokolesterolemik, serta masing-masing kultur probiotik mempunyai keunggulan
yang berbeda-beda. Probiotik juga berfungsi untuk menyempurnakan proses
pencernaan manusia di antaranya dengan cara melindungi saluran pencernaan dari
serangan bakteri patogen (Agostoni et al. 2004; Tannock 1999). Beberapa
probiotik bahkan diindikasikan mampu menjadi penangkal bau mulut. Probiotik
spesies Lactobacillus mampu membersihkan mulut dan melemahkan bakteri
penyebab bau mulut (Molin 2003).
Genus dan spesies umum dari bakteri probiotik adalah Lactobacillus dan
Bifidobacterium. Bakteri dari kelompok Lactobacilli antara lain Lactobacillus
acidophilus, Lactobacillus casei, Lactobacillus casei subsp. rhamnosus,
Lactobacillus fermentum, Lactobacillus reuteri dan Lactobacillus plantarum,
sedangkan bakteri dari kelompok Bifidobacterium adalah Bifidobacterium
bifidum, Bifidobacterium longum, Bifidobacterium infantis, Bifidobacterium
adolescentis dan Bifidobacterium breve. Galur BAL lainnya yang termasuk
dalam golongan probiotik antara lain Enterococcus faecium, Enterocococcus
faecalis dan Lactococcus lactis subsp. lactis (Tannock 1999; Bourlioux et al.
2003; Savadogo et al. 2006; Ishibashi & Yamazaki 2001; Makarova & Koonin
2007).
Fungsi dari bakteri probiotik akan maksimal jika mampu bertahan dalam
saluran pencernaan dalam waktu yang cukup lama. Bakteri probiotik tersebut juga
harus dapat bertahan pada kondisi ekstrim dalam saluran pencernaan sehingga
dapat melewati saluran pencernaan dalam keadaan hidup dan bertahan di dalam
usus. Kemampuan untuk bertahan dalam kondisi ekstrim dalam saluran
pencernaan nampak pada keberadaan mikroorganisme probiotik tersebut dalam
jumlah yang cukup dan berkurangnya mikroorganisme patogen di dalam saluran
pencernaan (Morelli 2007).
BAL sebagai komponen terbesar probiotik sering ditemukan secara
alamiah dalam bahan pangan. Bakteri ini hidup pada susu, daging segar, dan
pangan serta mengujinya sebagai probiotik di antaranya Erkilla dan Petaja (2000),
Rantsiou et al. (2005) dan Aymerich et al. (2003) yang melakukan isolasi BAL
dari daging dan produk olahannya. Tamang et al. (2008) mengisolasi BAL dari
batang bambu fermentasi; serta Moulay et al. (2006) dari susu kambing Algeria.
Mishra dan Prasad (2005) juga meneliti bakteri Lactobacillus casei yang diisolasi
dari susu di India dan mengujinya sebagai probiotik. Kusumawati (2002) meneliti
sifat-sifat probiotik Lactobacillus plantarum sa28k yang diisolasi dari asinan
kubis Indonesia di antaranya sifat ketahanan terhadap pH rendah, garam empedu,
aktivitas antimikroba dan hipokolesterolemik. Hasil penelitian dari para peneliti
tersebut menunjukkan bahwa BAL yang diisolasi dari pangan mempunyai sifat
sebagai probiotik. Hal ini mengindikasikan bahwa bahan pangan berpotensi
sebagai sumber probiotik.
Arief et al. (2007) telah melakukan isolasi BAL dari daging sapi lokal
Indonesia bangsa Peranakan Ongole dan mendapatkan 28 isolat BAL. Identifikasi
awal dengan menggunakan 12 jenis gula sederhana juga telah dilakukan. Hasil
identifikasi ini belum cukup untuk menentukan spesies BAL tersebut secara
akurat. Hasil isolasi BAL ini dapat diseleksi lebih lanjut untuk memperoleh isolat
unggul BAL probiotik. Di samping itu, perlu dilakukan identifikasi secara
molekuler untuk memenuhi salah satu syarat klaim probiotik menurut FAO/WHO
(2002) yaitu bahwa galur probiotik harus sudah diketahui dengan pasti. Lee
(2009) menyatakan bahwa analisis fenotipik untuk menentukan identitas BAL
seringkali tidak berhasil dengan tepat. Heterogenitas fenotipik kurang akurat dan
ambigu untuk mengidentifikasi BAL genus Lactobacillus. Oleh karena itu, ahli
taksonomi mensyaratkan identifikasi bakteri termasuk di antaranya BAL perlu
dilakukan dengan metode molekuler. Analisis urutan basa (sequencing) gen 16S
rRNA merupakan metode molekuler yang berhasil menentukan identitas dan
filogenetik spesies Lactobacillus.
Berbagai syarat probiotik lain juga perlu dipelajari meliputi kemampuan
bertahan BAL pada kondisi saluran pencernaan manusia (pH rendah dan garam
empedu), kemampuannya sebagai antimikroba, sifat penempelan pada permukaan
usus dan koagregasi pada bakteri patogen. Sifat fungsional khusus seperti
dengan menguji kemampuan probiotik melawan bakteri enteropatogen penyebab
diare yang sengaja diinfeksikan ke hewan percobaan. Probiotik dilaporkan
mampu mengatasi kejadian diare yang disebabkan oleh infeksi Escherichia coli
baik E.coli enterotoksigenik/ETEC (Oyetayo 2004) maupun E.coli
enterohemoragik/EHEC melalui percobaan pada hewan (Medellin-Pena &
Griffiths 2009).
Tujuan Penelitian
Tujuan penelitian secara umum adalah untuk melakukan seleksi dan
karakterisasi BAL indigenus asal daging sapi lokal sebagai probiotik dan
mengidentifikasi spesies BAL tersebut secara molekuler.
Secara khusus, tujuan penelitian ini adalah sebagai berikut :
a. memperoleh isolat BAL indigenus asal daging lokal yang mempunyai
ketahanan terhadap pH rendah dan garam empedu, sifat antimikroba dan
koagregasi terhadap beberapa bakteri patogen, serta kemampuan menempel
pada permukaan usus secara in vitro
b. menentukan genus, spesies dan galur BAL indigenus melalui identifikasi
secara molekuler dengan PCR (Polymerase Chain Reaction) dan analisis
urutan basa gen 16S rRNA
c. memperoleh galur BAL probiotik yang memiliki kemampuan mencegah diare
yang disebabkan Escherichia coli enteropatogen (EPEC) melalui pengujian
secara in vivo.
Manfaat Penelitian
Galur BAL indigenus yang diperoleh sebagai probiotik setelah melalui uji
klinis pada manusia dapat diaplikasikan lebih lanjut pada berbagai produk pangan
fungsional. Galur BAL tersebut sangat bermanfaat bagi industri pangan
fungsional berbasis probiotik yang dewasa ini semakin berkembang dan
Ruang Lingkup Penelitian
Penelitian ini merupakan serangkaian tahapan kajian penelitian untuk
mendapatkan galur BAL indigenus yang mempunyai sifat probiotik. Ruang
lingkup kajian penelitian yang dilakukan meliputi tiga kajian yaitu : (1) seleksi
dan karakterisasi isolat BAL indigenus asal daging sapi sebagai kandidat probiotik
secara in vitro melalui pengujian ketahanan terhadap pH rendah dan garam
empedu, aktivitas antimikroba dan koagregasi terhadap bakteri patogen serta
penempelannya pada sel epitel usus, (2) identifikasi BAL indigenus tersebut
sampai tingkat spesies secara molekuler menggunakan PCR dan analisis urutan
basa gen 16S rRNA, dan (3) pengujian efektivitas dua galur BAL yang
mempunyai sifat probiotik unggul berdasarkan hasil kajian penelitian (1) untuk
2.
TINJAUAN PUSTAKA
Bakteri Asam Laktat
BAL ditemukan pertama kali oleh Pasteur, seorang profesor kimia di
University of Lille pada tahun 1878. Pada tahun 1889, Tissier, peneliti Prancis
menemukan bakteri yang mendominasi saluran usus bayi yang minum air susu ibu
yaitu Bifidobacterium. BAL berbentuk bulat maupun batang, Gram positif dan
(dengan sedikit perkecualian) tidak motil, katalase negatif, tidak mempunyai
sitokrom, aerotoleran, anaerobik hingga mikroaerofolik, serta membutuhkan
nutrisi yang kompleks seperti asam amino, vitamin (B1, B6, B12 dan biotin), purin
dan pirimidin (Surono 2004). Walaupun BAL dapat hidup dengan dan tanpa
oksigen, sumber energi terbesarnya untuk tumbuh adalah fermentasi gula. Bakteri
ini mempunyai kapasitas respirasi yang sangat terbatas dan tidak dapat
memperoleh ATP dari proses respirasi (Salminen & Wright 2004).
BAL dibagi menjadi tiga grup berdasarkan pola fermentasinya, yaitu :
a. Grup I : BAL homofermentatif obligatif, yang mengubah heksosa menjadi
asam laktat melalui jalur Embden-Meyerhof, namun tidak bisa
memfermentasikan pentosa ataupun glukonat. BAL grup ini termasuk
dalam termobakterium, yang kekurangan glukosa-6 fosfat dehidrogenase
dan 6-fosfoglukonat. Sebagian besar BAL grup ini tumbuh pada suhu
45 ○C namun tidak tumbuh pada suhu 15 °C (Hopzapfel 1998).
b. Grup II : BAL heterofermentatif fakultatif, yang memfermentasikan
heksosa secara homofermentatif namun sebagian galur pada beberapa
kondisi mempunyai metabolisme heterofermentatif dari heksosa menjadi
asam laktat, karbondioksida dan ethanol atau asam asetat. Produksi asam
asetat terjadi jika NAD+ dapat diregenerasi tanpa pembentukan ethanol,
misalnya melalui reduksi fruktosa atau molekul oksigen. Pentosa
difermentasi melalui fosfoketolase menjadi asam laktat dan asam asetat.
BAL grup ini termasuk dalam streptobakterium, yang mempunyai dua
enzim dehidrogenase tetapi menggunakan jalur Embden-Meyerhof untuk
c. Grup III : BAL heterofermentatif obligatif, yang memfermantasikan
heksosa menjadi asam laktat, karbondioksida dan etanol atau asam asetat,
jika terdapat akseptor elektron alternatif. Pentosa diubah menjadi asam
laktat dan asam asetat. BAL grup ini termasuk dalam betabakterium, yang
kekurangan fruktosa 1.6 difosfat aldolase (Hopzapfel 1998).
BAL sering ditemukan secara alamiah dalam bahan pangan. Bakteri ini
hidup pada susu, daging segar, dan sayur-sayuran. Pada proses fermentasi daging
spontan, BAL yang berasal dari bahan mentah atau lingkungan menyebabkan
terbentuknya asam laktat dari penggunaan karbohidrat, maupun rendahnya nilai
pH (5.9 sampai 4.6) (Surono 2004). Beberapa peneliti berhasil mengisolasi BAL
dari berbagai bahan pangan dan non-pangan termasuk di antaranya dari saluran
pencernaan (Tabel 2.1).
Lactobacillus spp. merupakan genus terbesar dari kelompok BAL
(Axelsson 1993). Genus Lactobacillus bersifat Gram positif dan tidak membentuk
spora, bersifat anaerob fakultatif, tumbuh optimum pada kisaran suhu 30-40 °C
tapi dapat tumbuh pada kisaran 5-35 °C. Lactobacillus tumbuh optimum pada pH
5.5-5.8, namun secara umum dapat tumbuh pada pH kurang dari 5. Lactobacillus
spp. banyak terdapat pada produk makanan fermentasi seperti produk-produk susu
fermentasi (yoghurt, keju, yakult) produk fermentasi daging seperti sosis
fermentasi, serta produk fermentasi sayuran seperti pikel dan sauerkraut.
Lactobacillus spp. berkontribusi untuk pengawetan, ketersediaan nutrisi, dan
Tabel 2.1 Hasil isolasi BAL dari berbagai bahan pangan dan non pangan
Jenis BAL Asal isolasi Peneliti
L. brevis, L. plantarum, L.curvatus, L.brevis, Leuconostoc (leuc) citreum, Pediococcus pentosaceus
Batang bambu untuk tempat fermentasi susu
Tamang et al. (2008)
Lactococcus lactis subsp.lactis, Enterococcus sp,
Lactococcus lactis subsp. lactis biovar
diacetylactis
Susu kambing mentah Algeria
Moulay et al.
(2006)
L. plantarum U201, P.acidilactici U318 Sosis fermentasi tradisional Bali : Urutan
Antara et al. (2004)
L. plantarum, L. farciminis, L. fermentum, Weisella confusa, Pediococcus acidilactici, Enterococcus faecalis
Chili Bo, bumbu dari Malaysia
Leisner et al.
(1999)
L. plantarum, L. brevis, L. divergens, L. gasseri, L. rhamnosus, L. fermentum, L.viridescens,
L.farciminis, L.buchneri, L.acidophilus
Ikan segar dan ikan beku
Nair dan Surendran (2005)
Leuc. Mesenteroides subsp.mesenteroides MCRI1,
Lactococcus lactis subsp.lactis MCRI 3,
Leuc.citreum MCRI 4
Produk olahan daging yang telah dimasak
Hamasaki et al. (2003)
L. plantarum Silo (rumput
fermentasi)
Emanuel et al.
(2005)
Lactococcus lactis subsp.lactis Usus ikan Takifugu niphobles di perairan Shimoda, Shizuoka Jepang
Itoi et al. (2008)
L. fermentum LBP usus ayam dewasa
(Gallus domesticus)
Reque et al.
(2000)
Galur BAL tidak teridentifikasi usus ayam di Bangkok, Thailand
Nitisinprasert et al. (2006)
Enterococcus sp, Lactococcus sp, Pediooccus sp, Lactobacillus sp
Usus udang Cai et al. (1999)
L. rhamnosus R12, R21, R24 dan A31 Air susu ibu Nuraida et al.
(2010)
Enterococcus faecium IS-257526, L. plantarum
Probiotik
FAO/WHO (2002) telah mengeluarkan panduan untuk mengevaluasi
probiotik dalam makanan. Working Group yang dibentuk oleh FAO/WHO
menetapkan secara rinci panduan dan kriteria rekomendasi serta metodologi yang
digunakan untuk evaluasi probiotik, mengidentifikasi serta menentukan data-data
yang dibutuhkan untuk mengklaim kesehatan probiotik. Kriteria pertama yang
harus dipenuhi adalah bahwa galur yang didapatkan harus diketahui
identifikasinya, baik secara fenotipik maupun genotipik, mulai dari genus sampai
spesies bahkan sampai tingkatan sub spesies. Kriteria selanjutnya adalah
karakterisasi fungsional, baik secara in vitro maupun in vivo, kemudian
dilanjutkan dengan pengujian keamanan secara in vitro dan in vivo, serta studi
fase satu di manusia. Untuk evaluasi pangan probiotik dilakukan studi fase dua di
manusia yaitu secara double blind, acak, kontrol placebo (DBPC) atau desain lain
yang sesuai dengan ukuran sampel dan dampak primer untuk menentukan jika
galur/produk berpotensi efikasi dan dikonfirmasi kembali hasil yang didapatkan.
Fase tiga dilakukan untuk menguji efektivitas probiotik pada kondisi spesifik.
Kemudian dilakukan aplikasi probiotik ke dalam pangan probiotik yang harus
memenuhi syarat pelabelan antara lain pencantuman isi : genus, spesies, galur;
jumlah minimum bakteri hidup pada akhir masa simpan, kondisi penyimpanan
yang sesuai, serta kontak detil perusahaan untuk informasi konsumen (FAO/WHO
2002).
Di samping itu, beberapa peneliti lain telah mengemukakan jaminan
kriteria untuk bakteri probiotik. Beberapa di antaranya adalah sebagai berikut :
a. Probiotik harus dapat bertahan melewati lambung dan usus halus, sehingga
probiotik harus toleran terhadap suasana asam dan adanya asam empedu
(Tuomola et al. 2001, Bourlioux et al. 2003, Roberfroid 2000;
Sunny-Roberts & Knoor 2008).
b. Probiotik harus mempunyai kemampuan dalam melakukan penempelan ke
usus (Nitisinprasert et al. 2006; Tuomola et al. 2001; Bourlioux et al.
2003), karena sangat berkaitan dengan beberapa efek kesehatan antara lain
mikroba patogen (Tuomola et al. 2001; Herick & Levkut 2002; Bourlioux
et al. 2003).
c. Probiotik harus mampu bertahan selama proses pengolahan dan
penyimpanan (FAO/WHO 2002; Sunny-Roberts & Knoor 2008), sehingga
saat dikonsumsi masih mempunyai viabilitas yang cukup untuk mengatasi
berbagai masalah di saluran pencernaan antara lain dengan meningkatkan
pencernaan laktosa, mengontrol infeksi di usus, serta menjaga
keseimbangan barier mukosa usus (Tuomola et al. 2001; Agostoni et al.
2004).
Probiotik mempunyai efek kesehatan bagi manusia diantaranya (1)
menurunkan risiko lactose intolerance, (2) mengurangi kejadian diare (Reid 1999;
Talwalkar & Kailasapathy 2004), (3) menurunkan jumlah enzim mikrobial fekal
seperti -glukoronidase, -nitroreduktase, nitroreduktase dan urease yang
berperan dalam aktivasi mutagenesis dan karsinogenesis di kolon, serta berperan
dalam efek hipokolesterolemik (Roberfroid 2000), (4) meningkatkan respon
sistem imun (Perdigon et al. 2001; Bhatia & Rani 2008), (5) menurunkan risiko
penyakit kardiovaskuler pada perokok (Naruszewics et al. 2002), dan (6) bersifat
hipokolesterolemik (Kusumawati 2002; Kimoto-Nira et al. 2007). Kusumawati
(2002) melaporkan bahwa pemberian susu yang difermentasi oleh BAL
Lactobacillus acidophilus FNCC 116, Lactobacillus plantarum sa28k dan
Lactobacillus casei FNCC262 mampu menurunkan kadar kolesterol darah tikus
percobaan.
Beberapa BAL mampu mencegah terjadinya kanker kolon. BAL mampu
mereduksi level enzim di kolon yang mengubah prokarsinogen menjadi karsinogen. Secara spesifik, BAL dapat mereduksi level enzim -glukuronidase,
nitroreduktase dan azoreduktase. BAL juga berperan secara langsung dalam
mereduksi prokarsinogen, contohnya dengan mengikat nitrit dan mereduksi level
asam empedu sekunder (BC Dairy Foundation 1997; Burns & Rowlands 2000;
Brady et al. 2000; Wollowski et al. 1999).
Mekanisme yang terjadi sehingga BAL sangat bermanfaat untuk kesehatan
a. Mengikat karsinogen
Beberapa penelitian menunjukkan bahwa BAL mampu mengikat secara in
vitro senyawa karsinogen, di antaranya adalah heterosiklik amin selama
pemasakan daging, toksin fungi aflatoksin B1, benzo(a)pirene dan
makanan yang terkontaminasi aflatoksin AF2. Adsorpsi itu dikaitkan
dengan mekanisme pertukaran kation (Burns & Rowlands 2000).
b. Efek pada enzim bakteri dan produksi metabolit
Peningkatan konsentrasi BAL dalam setiap konsumsi mampu menurunkan
enzim bakteri yang berperanan dalam aktivasi atau sintesis karsinogen,
genotoksin dan promotor tumor (Burns & Rowlands 2000).
c. Stimulasi enzim protektif
Beberapa karsinogen seperti heterosiklik amin dan PAH (Polycyclic
Aromatic Hydrocarbon) dikenal dapat mengkonjugasikan glutation
sehingga menjadi tidak aktif. Enzim glutation transferase (GSH) berada
di hati dan jaringan lain termasuk saluran pencernaan. BAL mampu
meningkatkan enzim GSH (Wollowksi et al. 2001; Burns & Rowlands
2000).
d. Menurunkan pH kolon
Fermentasi yang dilakukan oleh probiotik mampu menurunkan pH kolon
dengan terbentuknya asam-asam organik seperti asam laktat dan SCFA
(Short Chain Fatty Acid) diantaranya asam butirat, propionat dan asam
asetat sehingga mampu menjaga kondisi kolon dari resiko kanker
(Augenlicht et al. 1999; Wollowski et al. 1999).
e. Meningkatkan respon imun
Probiotik mampu menurunkan respon inflamasi. Hal ini ditunjukkan
dengan studi mencit yang disuntikkan dengan sel tumor dan diberikan
yoghurt. Hal tersebut mampu menekan terjadinya inflamasi dengan
meningkatkan imunoglobin A (IgA) dan sel limfosit T CD 4+. Selain itu
juga, studi pada manusia menunjukkan bahwa konsumsi probiotik mampu
meningkatkan aktivitas fagositik dari sel imun monosit dan granulosit
serta meningkatkan level antibodi yang disekresikan oleh sel imun limfosit
melaporkan bahwa pemberian susu fermentasi yoghurt dapat
meningkatkan produksi interferon IFN- pada anak-anak yang kekurangan
gizi. Beberapa peneliti melaporkan hasil penelitiannya yang membuktikan
bahwa konsumsi BAL mampu meningkatkan sistem imun seluler dan
humoral di antaranya peningkatkan populasi dan proliferasi sel limfosit,
produksi sitokin interferon- (IFN- ), interleukin-12 (IL-12), IL-10, sel
imun Th, serta IgA, IgE, IgG, serta IgM (Kimura et al. 2006; Segawa et al.
2008; Gackowska et al. 2006; Aattouri et al. 2002).
Ketahanan Bakteri Asam Laktat pada pH Rendah
Roberfroid (2000) menyatakan bahwa probiotik adalah sel mikroba hidup
yang dikonsumsi oleh manusia, merupakan mikroflora yang dapat hidup di
saluran pencernaan dan mempunyai efek yang menguntungkan bagi kesehatan
manusia. Setelah dapat melewati lambung dan usus halus, bakteri yang termasuk
dalam probiotik dapat bertahan hidup di usus besar. Adanya kapasitas fermentasi
pada kolon memungkinkan bakteri probiotik berkembang biak, dan hasilnya,
sering ditemukan sejumlah probiotik yang terikut dalam feses. Oleh karenanya
salah satu syarat bakteri termasuk dalam probiotik adalah mampu bertahan hidup
pada kondisi sesuai saluran pencernaan yang meliputi keasaman yang tinggi dan
adanya sekresi garam empedu.
Cotter dan Hill (2003) melaporkan mekanisme homeostatik instrinsik yang
menyebabkan BAL mampu bertahan pada kondisi pH rendah atau keasaman yang
tinggi. Mekanisme yang terjadi pada BAL di antaranya adalah sistem
Glutamat-dekarboksilase (GAD), sistem arginin deiminasi (ADI) dan pompa proton H+ -
ATP ase.
Sistem glutamat dekarboksilase merupakan suatu mekanisme pertahanan
sel sebagian BAL terhadap kondisi pH yang rendah. Beberapa spesies
Lactobacillus sp dilaporkan memiliki mekanisme sistem GAD. Adapun
mekanisme sistem GAD adalah sebagai berikut : setelah mengkonsumsi glutamat
(Cotter & Hill 2003). Untuk lebih jelas, mekanisme sistem GAD untuk
mempertahankan pH intraseleluler bakteri dapat dilihat pada Gambar 2.1.
a. b
Gambar 2.1 Mekanisme Sistem Glutamat Dekarboksilasi (Cotter & Hill 2003)
Gambar 2.1.a menjelaskan mekanisme homeostatis sel BAL terhadap pH
rendah. Mekanisme ini meliputi adanya perpindahan ion glutamat ke dalam sel
dan produk GABA keluar sel yang diiringi oleh malat dekarboksilasi, ion malat
masuk ke dalam sel dan ion laktat keluar sel serta oksaloasetat dekarboksilasi, ion
laktat keluar sel dan ion sitrat masuk ke dalam sel mengakibatkan terjadinya
perbedaan potensial elektrogenik dan meningkatkan kondisi alkali sitoplasma.
Gambar 2.1.b menjelaskan bahwa sistem GAD berhubungan dengan pompa
proton serta jalur F1F0-ATPase sebagai transporter ion-ion glutamat, malat dan
sitrat, serta produk katabolismenya.
Keberadaan glutamat sebagai zat yang dapat mempertahankan kondisi
homeostatis pH internal sel BAL menjadi faktor yang penting untuk perlindungan
BAL terhadap kondisi pH rendah. Glutamat dapat diperoleh dari berbagai sumber
terutama dari makanan pembawa BAL misalnya makanan kaya protein (susu dan
[image:35.595.126.509.144.415.2]ditambahkan untuk pengawetan BAL selama pengolahan; misalnya monosodium
L-glutamat monohidrat (MSG),
Arginin deiminasi (ADI) sistem merupakan suatu mekanisme homeostatis
terhadap kondisi pH rendah yang dimiliki beberapa BAL seperti Lactobacillus
casei dan Lactobacillus sanfranciscensis. Kedua bakteri tersebut dapat
mengkatabolisme arginin menjadi ornithin, amonia, dan CO2. Amonia (NH4)
akan meningkatkan pH internal sitoplasma. Hal ini menjadikan kedua bakteri
tersebut dapat menyesuaikan hidupnya pada kondisi pH yang rendah. Sistem ADI
ini dikendalikan oleh gen arcA, arcB, arc, dan arcT, sehingga BAL yang tidak
mempunyai gen tersebut, tidak memiliki mekanisme homeostatis sistem arginin
deiminasi untuk bertahan pada pH rendah (Cotter & Hill 2003).
Marteau et al. (1997) melakukan penelitian untuk mengetahui ketahanan
hidup BAL pada kondisi saluran pencernaan melalui model dinamis in vitro
(gerakan peristaltik, perubahan pH, perubahan konsentrasi enzim dan garam
empedu di saluran pencernaan). BAL yang dipakai adalah galur tunggal
Lactobacillus acidophilus, Lactobacillus bulgaricus, Bifidobacterium bifidum dan
Streptococcus thermophilus. Model saluran pencernaan yang dirancang terdiri
dari dua kondisi yang berbeda yaitu simulasi sekresi fisiologis empedu dan sekresi
empedu yang rendah.
Streptococcus thermophilus dan Lactobacillus bulgaricus dalam produk
yogurt hanya mampu bertahan selama 20 menit di kompartemen lambung,
sedangkan Lactobacillus acidophilus dan Bifidobacteria bifidum dalam produk
Ofilus® lebih tahan dibandingkan produk yogurt. Bakteri dalam yogurt akan
mengalami kematian (populasi nol) setelah 110 menit berada dalam kompartemen
lambung, sedangkan produk Ofilus® mengalami kematian setelah 180 menit.
Setelah memasuki kompartemen usus, BAL dan bifidobakteria mampu hidup dan
melakukan pertumbuhan dan proliferasi, sehingga populasinya meningkat setelah
2 jam berada di kompartemen usus. Peningkatan L. acidophilus dan B. bifidum
pada produk Ofilus® lebih tinggi yaitu 60-70% dari populasi saat konsumsi
dibandingkan dengan peningkatan populasi L. bulgaricus dan S. thermophilus
pada produk yogurt yang mengalami peningkatan populasi maksimal sebesar
bifidum lebih tahan terhadap lingkungan saluran pencernaan yang meliputi
kondisi pH rendah, sekresi pankreatik, garam empedu, serta adanya bikarbonat,
dibandingkan dengan L. bulgaricus dan S. thermophilus (Martaeu et al. 1997).
Lin et al. (2006) juga melakukan penelitian untuk menguji sifat-sifat
probiotik beberapa produk komersial yogurt, produk granul dan bubuk yang
beredar di pasaran yang telah diklaim mengandung BAL probiotik. Sifat-sifat
probiotik yang diuji adalah sifat ketahanan hidup pada kondisi pH rendah dan
garam empedu serta uji penempelan pada sel epitel usus. Hasil penelitiannya
menunjukkan bahwa pada produk komersial yang mengandung BAL terdapat
penurunan jumlah populasi bakteri yang mampu bertahan hidup pada pH 2.0.
Populasi BAL pada produk cair sekitar 105 cfu/ml pada pH 2.0, yang lebih tinggi
dibandingkan dengan produk bubuk yaitu 104 cfu/g. Galur BAL yang mampu
bertahan hidup pada pH 2.0 juga mampu bertahan hidup pada kondisi garam
empedu 0.3%.
Zoumpopoulou et al. (2008) juga melakukan penelitian untuk menguji
ketahanan BAL pada kondisi yang disimulasikan seperti kondisi pada saluran
pencernaan manusia. Ketahanan hidup galur probiotik pada larutan PBS
(Phosphat Buffer Saline) pH 2.5 ditentukan setelah inkubasi pada suhu 370C
selama 0.5, 1, 2 dan 4 jam seperti masa transit makanan di dalam lambung.
Toleransi dalam garam empedu ditentukan dengan ketahanan hidup probiotik
pada larutan PBS pH 8 yang mengandung 1% dan 2% (w/v) oxgall (Ox-Bile,
LP0055, Oxoid) setelah inkubasi selama 1, 2 dan 4 jam seperti masa transit
makanan dalam usus halus.
Ketahanan BAL terhadap Garam Empedu
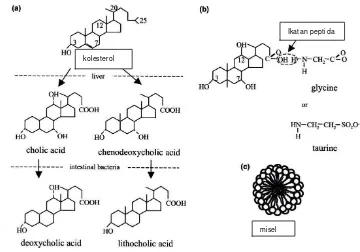
Empedu merupakan cairan kuning kehijauan yang terdiri dari asam
empedu, kolesterol, phospolipid dan pigmen biliverdin. Asam empedu primer
(asam kholat dan asam khenodeoksikholat) disintesis di hati dari kolesterol, yang
dapat dimodifikasi oleh enzim bakteri pada usus menjadi bentuk sekunder (asam
deoksikholat dan asam lithokholat). Semua asam empedu berkonjugasi dengan
glisin atau taurin sebelum disekresikan. Grup karboksil dari asam empedu dan
(Gambar 2.2). Garam empedu disintesis dalam hepatosit perisentral dalam hati,
disimpan dan dikonsentrasikan pada kantong empedu dan dilepaskan ke
[image:38.595.128.488.154.406.2]duodenum setelah ada makanan masuk ke usus halus (Begley et al. 2005)
Gambar 2.2 Struktur kimia asam empedu a) kolesterol, b) ikatan peptida pada garam empedu, c) misel (Begley et al. 2005)
Fungsi biologis garam empedu adalah sebagai detergen yang
mengemulsifikasi dan melarutkan lipid. Namun selain itu, garam empedu juga
dapat berfungsi sebagai antimikroba yaitu melalui perusakan membran sel bakteri
(Begley et al. 2005). Hal inilah yang menyebabkan isolat BAL mengalami
penurunan populasi pada kondisi media yang dipapar oleh 0.5% garam empedu.
Bron et al. (2004) menggambarkan kerusakan secara morfologis L.plantarum
pada kondisi dipapar garam empedu 0.05% sampai 0.15% selama 4 jam.
Kerusakan dinding sel diamati di bawah Scanning Electron Microscope (SEM),
semakin tinggi persentase garam empedu, maka kerusakan dinding sel bakteri
semakin besar dan akhirnya sel lisis.
Terdapat dua hipotesis yang menjelaskan BAL mampu bertahan pada
kondisi garam empedu. Hipotesis pertama adalah beberapa spesies BAL mampu
mendekonjugasi garam empedu dengan menggunakan asam amino taurin sebagai
kolest erol
Ikat an pept ida
akseptor elektron. Hipotesis kedua menyatakan bahwa BAL mampu bertahan
pada kondisi garam empedu karena sebagian besar galur BAL mempunyai enzim
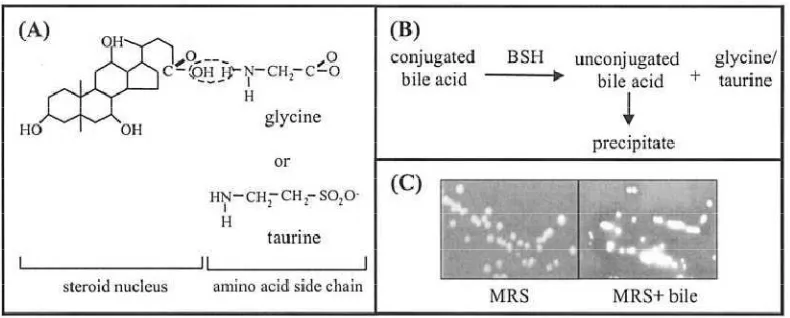
Bile Salt Hydrolase (BSH) yang diatur oleh gen bsh. Hipotesis kedua ini lebih
banyak dibuktikan oleh beberapa peneliti daripada hipotesis pertama (Moser &
Savage 2001). L. plantarum WCFS1, L. johnsonii NCC533, B. longum
NCC2705, L. acidophilus NCFM ATCC 700396, L. brevis ATCC 367 dan L.
gasseri ATCC 33323 mempunyai gen bsh yang terdiri atas 255-338 asam amino.
L. plantarum mempunyai aktivitas enzim BSH berdasarkan penelitian yang
dilakukan oleh Begley et al. (2006), yang membuktikan bahwa pada media MRS
yang disuplementasi garam empedu dan diinokulasikan L. plantarum terjadi
presipitasi asam empedu tidak terkonjugasi. Enzim BSH menguraikan asam
empedu terkonjugasi menjadi asam empedu tidak terkonjugasi dan melepaskan
[image:39.595.131.526.354.513.2]asam amino glisin atau taurin (Gambar 2.3).
Gambar 2.3 Peranan enzim BSH dalam menguraikan asam empedu: a) asam empedu, b) peranan enzim BSH, c) visualisasi presipitasi asam empedu di media MRS (Begley et al. 2006)
Aktivitas Antimikroba BAL
Kelompok BAL merupakan bakteri yang menghasilkan metabolit primer
berupa asam laktat. Peran lain dari BAL adalah mampu meningkatkan keamanan
pangan dengan cara menghambat pertumbuhan bakteri pembusuk makanan dan
bakteri patogen, baik bakteri Gram positif maupun Gram negatif (Robredo &
Torres 2000; El-Naggar 2004). Penghambatan yang dilakukan oleh BAL terhadap
metabolit yang bersifat antimikroba antara lain diasetil, hidrogen peroksida,
asam-asam organik dan bakteriosin (Jenie & Rini 1995; Surono 2004; Helander et al.
1997; Naidu & Clemens 2000).
Kemampuan BAL dalam menghasilkan senyawa antimikroba dilaporkan
oleh beberapa peneliti. Nowroozi et al. (2004) menyatakan bahwa L. plantarum
mempunyai aktivitas antimikroba lebih besar terhadap S. aureus dan E. coli
dibandingkan dengan beberapa BAL lainnya, seperti Lactobacillus brevis,
Lactobacillus casei, Lactobacillus delbruekii dan Lactobacillus acidophilus.
Toksoy et al. (1999) menyatakan bahwa L. plantarum AX5L yang diisolasi dari
sosis dapat menghambat E. coli, S. aureus dan B. subtilis karena L. plantarum
AX5L mampu menghasilkan H2O2, asam laktat sebesar 0.88% dan bakteriosin
plantarisin. Streptococcus lactis memiliki aktivitas bakterisidal terhadap bakteri
Gram positif maupun Gram negative, antara lain Enterococcus faecalis, Bacillus
subtilis, Salmonella typhimurium dan Eschericia coli (Suarsana et al. 2001).
Bakteriosin
Sejumlah galur BAL secara alami mampu menghasilkan substansi protein,
biasanya memiliki bobot molekul yang kecil yang mampu menghambat bakteri
lain, secara umum substansi ini dikenal dengan nama bakteriosin. Bakteriosin
mempunyai aktivitas antimikroba terhadap patogen pencemar makanan
(foodborne) dan organisme berspora lainnya (Tannock 1999; Karaoglu et al.
2003; Bromberg et al. 2004).
Bakteriosin diproduksi oleh BAL yang menguntungkan bagi kesehatan
manusia yang termasuk dalam GRAS yang merupakan pendekatan baru untuk
mengontrol mikroba patogen dalam bahan pangan. Bakteriosin merupakan
molekul protein atau peptida ekstraseluler yang mempunyai aksi bakterisidal atau
bakteriostatik terhadap bakteri yang mempunyai kekerabatan dekat. Bakteriosin
tersebut dapat didegradasi oleh enzim protease dalam saluran pencernaan.
Bakteriosin bersifat irrevesible, mudah dicerna, berpengaruh positif terhadap
kesehatan dan aktif pada konsentrasi rendah (Savadogo et al. 2006; Meghrous et
Berdasarkan karakteristiknya, bakteriosin dapat dikelompokkan menjadi
empat kelas yaitu kelas I adalah grup lantibiotik (modified bacteriocins) di
antaranya nisin, lactococin, lacticin, carnocin dan cytolysin; kelas II adalah
bakteriosin yang mempunyai berat molekul rendah (< 10 kDa), tahan panas
100-1210C; kelas III adalah bakteriosin yang mempunyai berat molekul tinggi (> 30
kDa) dan bersifat tidak tahan panas, serta kelas IV yaitu kompleks bakteriosin,
proteinnya berikatan dengan lipid dan atau karbohidrat (Karaoglu et al. 2003;
Savadogo et al. 2006).
Setiap bakteriosin mempunyai reseptor spesifik sel sasaran, dan memiliki
cara kerja yang berbeda-beda dalam menghambat sel sasaran, antara lain sebagai
berikut: (1) mengganggu metabolisme sel mikroba, (2) menghambat sintesis
dinding sel mikroba, (3) mengganggu keutuhan membran sel mikroba, (4)
menghambat sintesis protein sel mikroba yang berlangsung di ribosom, dan (5)
menghambat sintesis asam nukleat sel mikroba. Bakteriosin terlebih dahulu
masuk ke dalam sel sasarannya, melewati dinding atau membran sitoplasma agar
dapat masuk atau teradsorpsi ke dalam sel sasaran untuk menghambat bakteri
(Ogunbawo et al. 2003). Bakteriosin membentuk pori di membran sel yang
sensitif dan menurunkan potensial atau gradien pH yang menyebabkan rusaknya
material seluler. Efek penghambatan bakteriosin dipengaruhi oleh komposisi
fosfolipid pada galur bakteri target dan pH lingkungan (Albano et al. 2007; Pal et
al. 2005).
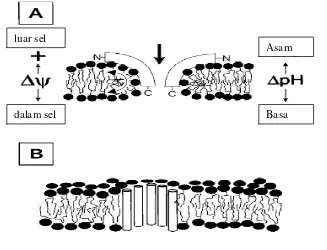
Bakteriosin kelas 1 yang dikenal dengan sebutan lantibiotik membentuk
pori pada dinding sel target dengan model ’wedge-like’, sedangkan bakteriosin
kelas II membentuk pori dengan sistem ’barrel-stave’ atau melalui mekanisme
’carpet’ (Gambar 2.4). Lantibiotik mengganggu susunan lapisan lipid bilayer
saat terikat pada membran sel. Masuknya lantibiotik ke dalam membran
dipromotori oleh gradien trans membran (∆ pH) atau trans negatif (∆ ψ). C
-terminal dari lantibiotik kemudian dapat masuk ke dalam membran, dan akhirnya
seluruh lantibioik dapat translokasi menembus membran sel, yang juga
dipengaruhi oleh ’proton motive force’. Mekanisme ini disebut dengan
pembentukan pori ’wedge-like pore’. Bakteriosin kelas II membentuk pori model
bakteriosin kelas II memulai insersi masuknya peptida ke dalam membran sel
target. Sisi hidrofilik dari ikatan peptida ampifatik α heliks akan membuka ikatan
asam lemak pada lipida membran. Akhirnya seluruh peptida bakteriosin dapat
[image:42.595.129.456.167.417.2]menembus membran sel (Moll et al. 1999).
Gambar 2.4 Mekanisme pembentukan pori oleh bakteriosin (a) model ’wedge- like pore’, (b) model ’barrel-stave pore’ (Moll et al. 1999).
Asam Organik
Terbentuknya asam laktat dan asam organik oleh BAL dapat
menyebabkan penurunan pH, akibatnya mikroba yang tidak tahan terhadap
kondisi pH yang relatif rendah akan terhambat. Akumulasi produk akhir asam
yang rendah pH-nya menghasilkan penghambatan yang luas terhadap Gram
positif maupun Gram negatif (Naidu & Clemens 2000).
Efek penghambatan dari asam organik terutama berhubungan dengan
jumlah asam yang tidak terdisosiasi. Asam yang tidak terdisosiasi dapat berdifusi
secara pasif ke dalam membran sel. Di dalam sel, asam tersebut terdisosiasi
menjadi proton dan anion lalu mempengaruhi pH di dalamnya (Branen &
Davidson 1993; Jenie 1996). Pada kondisi asam, konstanta disosiasi (nilai pKa)
dan konsentrasi molar merupakan faktor penentu aktivitas penghambatan asam
laktat dan asam asetat. Asam asetat mempunyai aktivitas antimikroba yang lebih
luar sel
dalam sel
Asam
tinggi dibandingkan dengan asam laktat. Asam asetat mempunyai nilai pKa 4.756
sedangkan asam laktat mempunyai nilai pKa 3.860. Pada pH usus sekitar 5.8,
sebanyak 8.4% asam asetat dan 1.1% asam laktat berada pada kondisi tidak
terdisosiasi (Naidu & Clemens 2000).
Asam a