KARAKTERISTIK KETAHANAN BAKTERI ASAM LAKTAT
INDIGENOUS KEFIR SEBAGAI KANDIDAT BAKTERI
PROBIOTIK PADA KONDISI SALURAN
PENCERNAAN in vitro
SKRIPSI AIP WIYANA
DEPARTEMEN ILMU PRODUKSI DAN TEKNOLOGI PETERNAKAN FAKULTAS PETERNAKAN
RINGKASAN
Aip Wiyana. D14062017. 2011. Karakteristik Ketahanan Bakteri Asam Laktat Indigenous Kefir sebagai Kandidat Bakteri Probiotik pada Kondisi Saluran Pencernaan invitro
.
Skripsi. Departemen Ilmu Produksi dan Teknologi Peternakan, Fakultas Peternakan, Institut Pertanian Bogor.Pembimbing Utama : Dr. Ir. Rarah Ratih Adjie Maheswari, DEA Pembimbing Anggota : Prof. Dr. Ir. Komang Gede Wiryawan
Makanan yang mengandung probiotik tergolong kedalam pangan fungsional karena berpotensi meningkatkan fungsi fisiologis usus dengan memodifikasi mikroflora usus. Bakteri probiotik merupakan mikroorganisme hidup yang bila diberikan dalam jumlah yang cukup akan memberikan manfaat kesehatan bagi penggunanya. Probiotik dapat diseleksi dari Bakteri Asam Laktat (BAL) yang terkandung dalam biji kefir. BAL indigenous kefir dapat digolongkan kedalam
bakteri probiotik, bila mempunyai karakterisitk diantaranya mampu bertahan dalam kondisi saluran pencernaan sehingga mampu menggantikan fungsi antibiotik untuk melawan bakteri patogen. Bifidobacterium longum dan Lactobacillus acidophilus
sering ditambahkan ke produk kefir sebagai mixes culture, sehingga khasiat kefir
menjadi jauh lebih bermanfaat.
Tujuan dari penelitian ini adalah menentukan karakteristik ketahanan BAL
indigenous kefir dan asal produk olahan susu sapi Bifidobacterium longum Y-01 dan Lactobacillus acidophilus Y-01 pada kondisi saluran pencernaan, meliputi resistensi
atau ketahanan terhadap kondisi pH yang berbeda (pH 2; 2,5; 3,2 dan 7,2), garam empedu dan antibiotik yang berbeda (amoksisilin dan klorampenikol) serta mengetahui kemampuan antagonistik BAL terhadap bakteri patogen (Staphylococcus aureus ATCC 25923, Escherichia coli ATCC 25922 dan Salmonella Typhimurium
ATCC 14028). Penelitian ini dilaksanakan di Laboratorium Mikrobiologi Bagian Teknologi Hasil Ternak, Fakultas Peternakan, Institut Pertanian Bogor pada bulan Maret – September 2010.
Penelitian dilakukan melalui beberapa tahap: (a) pertama yakni persiapan starter yang terdiri atas pemeriksaan kemurniaan BAL dan patogen; (b) tahap kedua adalah tahap penelitian utama meliputi pengujian BAL indigenous kefir dan asal olahan
susu sapi pada kondisi pH yang berbeda, garam empedu, antibiotik yang berbeda, serta aktivitas antagonistik terhadap bakteri patogen. Data yang diperoleh dianalisis dengan uji t untuk menentukan ketahanan bakteri terhadapkondisi pH yang berbeda, garam empedu, dan antibiotik berbeda serta Rancangan Acak Lengkap (RAL) untuk menentukan aktivitas antagonistik terhadap bakteri patogen.
Hasil pengujian menunjukkan bahwa bakteri asam laktat indigenous kefir
maupun produk olahan susu sapi B.longum Y-01 dan L. acidophilus Y-01 dapat
bertahan hidup dalam kondisi saluran pencernaan secara in vitro yaitu media dengan (a) pH yang berbeda, (b) garam empedu dan (c) antibiotik yang berbeda. Berdasarkan pengujian tersebut, BAL indigenous kefir, B.longum Y-01 dan L. acidophilus Y-01 tidak mengalami penurunan jumlah populasi dan ketiganya lebih tahan terhadap antibiotik kloramphenikol daripada antibiotik amoksisilin. Hasil uji antagonistik terhadap bakteri patogen menunjukkan bahwa BAL kefir, B. longum
ii bakteri patogen indikator. Spesies BAL yang berbeda mempengaruhi nilai diameter penghambatan pada bakteri patogen S. aureus, E. coli dan S. Typhimurium. Nilai
diameter zona hambat terhadap S. aureus ATCC, E. coli dan S. TyphimuriumATCC
14028 berturut-turut adalah 13,77 mm; 14,71 mm dan 13,24 mm dihasilkan oleh B. longum Y-01, 12,53 mm; 15,15 dan 15,35 mm dihasilkan oleh L. acidophilus Y-01 dan 8,46 mm; 9,10dan 7,72 mm dihasilakan oleh BAL kefir. Hasil pengujian in vitro
ABSTRACT
Resistance of Lactic Acid Bacteria Indigenous Kefir on In Vitro Gastrointestinal Conditions as Probiotic Candidates
Wiyana. A, R. R. A. Maheswari, K. G. Wiryawan
Functional food containing probiotic bacteria is potential for modification intestine microflora. The objective of this research was to assess the resistance characteristics of kefir indigenous Lactic Acid Bacteria (LAB) (LABs from kefir, Bifidobacterium longum Y-01 and Lactobacillus acidophilus Y-01) as probiotic bacteria through its
ability to grow in gastrointestinal conditions such as pH conditions (pH 2, 2.5, 3.2 and 7.2), the presence of bile salts in the small intestine, its resistance to antibiotics (amoxycillin and chloramphenicol) and its microbial activity to inhibit the pathogenic bacteria growth (Staphylococcus aureus ATCC 25923, Escherichia coli
ATCC 25922 and Salmonella Typhimurium ATCC 14028). The results of Gram staining and catalase assay showed that the three kefir indigenous LABs were not contaminated with other microorganisms. Three kefir indigenous LABs had good resistance in gastro intestinal conditions, as the population of all kefir indigenous LABs observed did not decrease when they were exposed to gastrointestinal condition. Kefir indigenous LABs were more resistant to chloramphenicol antibiotics than amoxycillin antibiotics. The antagonistic test of kefir indigenous LABs to pathogen bacteria showed that the three kefir indigenous LABs had a variety inhibition. The statistical analysis showed that different types of LABs had a significant influenced on the inhibition zone of S. aureus, E. coli and S.
Typhimurium. Therefore, the three tested kefir indigenous LABs had potential characteristics as probiotic bacteria.
KARAKTERISTIK KETAHANAN BAKTERI ASAM LAKTAT
INDIGENOUS KEFIR SEBAGAI KANDIDAT BAKTERI
PROBIOTIK PADA KONDISI SALURAN
PENCERNAAN in vitro
AIP WIYANA D14062017
Skripsi ini merupakan salah satu syarat untuk memperoleh gelar Sarjana Peternakan pada
Fakultas Peternakan Institut Pertanian Bogor
DEPARTEMEN ILMU PRODUKSI DAN TEKNOLOGI PETERNAKAN FAKULTAS PETERNAKAN
Judul : Karakteristik Ketahanan Bakteri Asam Laktat Indigenous Kefir sebagai Kandidat Bakteri Probiotik pada Kondisi Saluran Pencernaan invitro
Nama : Aip Wiyana NIM : D14062017
Menyetujui:
Mengetahui: Ketua Departemen
Ilmu Produksi dan Teknologi Peternakan Fakultas Peternakan IPB
(Prof.Dr.Ir.Cece Sumantri, M.Agr.Sc.) NIP. 19591212198603 1 004
Tanggal ujian: 22 Desember 2010 Tanggal lulus: 14 Januari 2011 Pembimbing Utama,
(Dr. Ir. Rarah R.A. Maheswari, DEA) NIP. 19620504198703 2 002
Pembimbing Anggota,
RIWAYAT HIDUP
Penulis dilahirkan di Indramayu pada tanggal 02 Juli 1988. Penulis merupakan anak pertama dari dua bersaudara dari pasangan Bapak Nana Sunarya dan Ibu Eti Rohaeti, S.Pd. Penulis menempuh pendidikan dasar di SDN Manangga (1994-2000), kemudian melanjutkan pendidikan di SMPN 2 Haurgeulis (2000-2003), pendidikan lanjutan tingkat atas dilanjutkan di SMAN 1 Cimalaka-Sumedang (2003-2006). Penulis diterima di Institut Pertanian Bogor melalui jalur Undangan Seleksi Masuk IPB (USMI) (2006), setelah menyelesaikan pendidikan di Tingkat Persiapan Bersama IPB, penulis diterima sebagai mahasiswa mayor jurusan Ilmu Produksi dan Teknologi Peternakan, Fakultas Peternakan, Institut Pertanian Bogor dengan minor Manajemen Fungsional.
Selama mengikuti pendidikan di Institut Pertanian Bogor, penulis aktif di beberapa organisasi diantaranya Himpunan Mahasiswa Ilmu Produksi dan Teknologi peternakan sebagai ketua divisi Kewirausahaan (2007-2008) dan ketua divisi Peduli Pangan Peternakan (2008-2009), EMULSI (Majalah Peduli Pangan dan Gizi) (2007-2009) dan Himpunan Mahasiswa Peduli Pangan Indonesia (HMPPI) (2008-(2007-2009). Penulis juga bergabung di Himpunan Wadah Pelajar dan Mahasiswa Asal Lingga Sumedang (WAPEMALA ) (2006-2010).
Penulis pernah magang kerja di Balai Inseminasi Buatan (BIB) Lembang (2007) dan Rumah Potong Hewan Kota Bogor (2008). Penulis juga Pernah menjadi Asisten Praktikum pada mata kuliah Dasar Teknologi Hasil Ternak (2009 dan 2010) Ilmu dan Teknologi Pengolahan Susu (2009). Pelatihan yang pernah diikuti oleh penulis diantaranya pelatihan Hazard Analytic Critical Control Poin (HACCP) (2010) dan pelatihan Kewirausahaan Building Entrepreneur Student Program
(BEST) (2010). Penulis pernah mendapat penghargaan sebagai juara 1 Lomba
Business Plan Kewirausahaan In Action Fakultas Peternakan IPB tahun 2009 dan Juara Harapan 1 National Food Innovation Competition HIMATEPA IPB (2009).
KATA PENGANTAR
Bismillahirrahmanirrahim,
Alhamdulillah. Puji dan syukur penulis panjatkan ke hadirat Allah SWT atas segala nikmat dan karunia-Nya yang telah diberikan sehingga penulis memperoleh kemudahan dalam menyusun dan menyelesaikan skripsi ini. Tugas akhir dalam bentuk skripsi yang berjudul “Karakteristik Ketahanan Bakteri Asam Laktat Indigenous Kefir sebagai Kandidat Bakteri Probiotik pada Kondisi Saluran Pencernaan secara In Vitro” merupakan salah satu syarat untuk memperoleh gelar Sarjana Peternakan di Fakultas Peternakan, Institut Pertanian Bogor.
Penelitian ini dilatarbelakangi oleh meningkatnya pengetahuan masyarakat mengenai kesehatan sehingga menimbulkan implikasi yang luas dalam memilih bahan makanan. Bahan makanan yang mengandung probiotik dipercaya mampu menjaga kesehatan secara preventif melelui perbaikan keseimbangan mikroflora usus. Probiotik dapat diseleksi pada Bakteri Asam Laktat (BAL) yang terkandung dalam kefir. Kultur indigenous tunggal BAL Bifidobacterium longum dan Lactobacillus acidophilus sering ditambahkan ke produk kefir, sehingga khasiat kefir
menjadi jauh lebih bermanfaat. Agar mampu menyeimbangkan mikroflora usus, BAL yang terkandung dalam kefir harus mampu melewati beberapa rintangan dalam saluran pencernaan serta mampu menekan perkembangan bakteri patogen. Oleh karena itu, pembuktian terhadap potensi kultur BAL indigenous kefir sebagai
probiotik dilakukan agar mendukung ketersediaan produk pangan yang dapat menguntungkan bagi kesehatan manusia.
Penulis menyadari bahwa skripsi ini belum sempurna. Penulis mengharapkan skripsi ini dapat bermanfaat bagi pembaca sebagai sumber informasi dan referensi dalam pengembangan penyediaan produk probiotik. Penulis menyampaikan rasa terima kasih yang tak terhingga kepada pihak yang telah turut membantu proses penyusunan skripsi ini. Semoga Allah SWT senantiasa membalasnya. Amin.
Bogor, Desember 2010
DAFTAR ISI Ketahanan terhadap Asam Lambung ... Ketahanan terhadap Garam Empedu ... Ketahanan terhadap Antibiotik ... Aktivitas Antimikroba terhadap Bakteri Patogen ... Bakteri Probiotik ...
Bifidobacterium longum ...
Lactobacillus acidophilus ...
Bakteri Patogen ... Pemeriksaan Kultur Bakteri Asam Laktat dan Patogen ....
x Penentuan Standar Populasi Bakteri Asam Laktat ...
Metode Hitungan Cawan ... Metode Turbidimetrik ... Penelitian Utama ... Persiapan Sel-sel Kultur Bakteri Asam Laktat ... Uji Ketahanan terhadap pH yang Berbeda ... Uji Ketahanan terhadap Garam Empedu ... Uji Ketahanan terhadap antibiotik ... Uji Sifat Antimikroba terhadap Bakteri Patogen ...
Persiapan Filtrat Bebas Sel (FBS) dan FBS Terkonsentrasi ... Persiapan Bakteri Indikator ... Konfrontasi Filtrat Bebas Sel dengan Bakteri Indikator ... Pemeriksaan Bakteri Asam Laktat dan Bakteri Patogen ... Penelitian Utama ... Karakteristik Pertumbuhan Kultur Starter BAL Indigenous
Kefir pada pH Berbeda ... Karakteristik Pertumbuhan Kultur Starter BAL Indigenous
Kefir terhadap Garam Empedu ... Karakteristik Pertumbuhan Kultur Starter BAL Indigenous
Kefir terhadap Antibiotik ... Aktivitas Antagonistik BAL Indigenous Kefir terhadap
DAFTAR GAMBAR
Nomor Halaman
1. Biji Kefir dan Mikroflora yang Terkandung dalam Biji Kefir ... 4
2. Mekanisme Skematik Sirkulasi Hepatik Asam Empedu ... 8
3. Skema Pengukuran Zona Hambat ... 22
4. Diagram Alir Proses Penelitian ... 23
5. Morfologi Bakteri Asam Laktat Kefir ... 28
6. Morfologi (a) B. longum Y-01dan (b) L.acidophilus Y-01 ... 29
7. Morfologi (a) S. aureus ATCC 25923 (b) E. coli ATCC 25922 dan (c) S. TyphimuriumATCC 14028 ... 29
8. Histogram Pertumbuhan Populasi Kultur BAL pada pH 2; pH 2,5; pH 3,2 dan pH 7,2 ... 34
9. Histogram Pertumbuhan Populasi Kultur BAL pada Konsentrasi Garam Empedu 0,3% dan Kontrol ... 38
10.Kurva Pertumbuhan Kultur BAL pada Kontrol; Antibiotik Amoksisilin dan Antibiotik Kloramfenikol ... 42
11.Total Zona Hambat (a) BAL Kefir, (b) B. longum Y-01 dan (c) L. acidophilus Y-01 terhadap S. aureus ATCC 25923 ... 44
12.Total Zona Hambat (a) BAL Kefir, (b) B. longum Y-01 dan (c) L. acidophilus Y-01 terhadap E. coli ATCC 25922 ... 45
DAFTAR TABEL
Nomor Halaman
1. Mikroflora yang Terkandung dalam Biji Kefir ... 5
2. Populasi Kelompok Bakteri Utama pada Usus Manusia ... 9
3. Persamaan Linier BAL Indigenous Kefir dan Produk Olahan Susu Sapi ... 19
4. Karakteristik BAL Indigenous Kefir dan Bakteri Patogen ... 26
5. Jumlah Populasi BAL pada pH yang Berbeda ... 35
6. Jumlah Populasi BAL pada Garam Empedu ... 37
7. Jumlah Populasi BAL pada Antibiotik ... 40
8. Aktivitas Antagonistik BAL terhadap S. aureus ATCC 25923 ... 44
9. Aktivitas Antagonistik BAL terhadap E. coli ATCC 25922 ... 45
DAFTAR LAMPIRAN
Nomor Halaman
1. Nilai Rataan optical density (OD) pada Pengujian Garam empedu .. 57 2. Nilai Rataan optical density (OD) pada Pengujian Antibiotik ... 58 3. Nilai Rataan optical density (OD) pada Pengujian pH yang
Berbeda… ... 59 4. Hasil Uji-t Jumlah Populasi BAL Indigenous Kefir dalam pH 2,5 ... 59 5. Hasil Uji-t Jumlah Populasi BAL Indigenous Kefir dalam pH 2,5 ... 60
6. Hasil Uji-t Jumlah Populasi BAL Indigenous Kefir dalam pH 3,2 ... 60
7. Hasil Uji-t Jumlah Populasi BAL Indigenous Kefir dalam pH 7,2 ... 61 8. Hasil Uji-t Jumlah Populasi BAL Indigenous Kefir pada Kontrol
11. Hasil Uji-t Jumlah Populasi BAL Indigenous Kefir pada Antibiotik Amoksisilin ... 63 12. Hasil Uji-t Jumlah Populasi BAL Indigenous Kefir pada Antibiotik
Kloramphenikol ... 63 13. Persentase BAL yang Hidup pada Kondisi pH yang Berbeda... 64 14. Persentase BAL yang Hidup pada Media tanpa atau dengan Garam
Empedu …. ... 64 15. Persentase BAL yang Hidup pada Media tanpa atau dengan
Antibiotik ………. ... 64 16. Hasil Analisis Ragam Aktivitas Antagonistik BAL Indigenous
Kefir terhadap S. aureus ATCC 25923 ... 64 17. Hasil Uji perbandingan Aktivitas Antagonistik BAL Indigenous
Kefir terhadap S. aureus ATCC 25923 ... 65
18. Hasil Analisis Ragam Aktivitas Antagonistik BAL Indigenous
Kefir terhadap E. coli ATCC 25923 ... 65 19. Hasil Uji perbandingan Aktivitas Antagonistik BAL Indigenous
Kefir terhadap E. coli ATCC 25923 ... 65
20. Hasil Analisis Ragam Aktivitas Antagonistik BAL Indigenous
Kefir terhadap S. TyphimuriumATCC 14028 ... 66
21. Hasil Uji perbandingan Aktivitas Antagonistik BAL Indigenou
xvi
23. Komposisi deMan Rogose Sharpe Agar (MRSA)-OXOID ... 66
24. Komposisi Phosphate Buffered Saline (PBS)-OXOID ... 67
25. Komposisi de Man Rogosa Sharpe (MRSB)-OXOID ... 67
PENDAHULUAN
Latar Belakang
Kesadaran masyarakat akan pentingnya kesehatan saat ini semakin meningkat, sehingga menimbulkan implikasi yang luas dalam memilih bahan makanan untuk kelangsungan hidup. Hal tersebut mendorong berkembangnya riset-riset mengenai makanan dan minuman yang mempunyai efek menyehatkan, termasuk pangan fungsional yang berasal dari ternak. Bioproduk atau makanan yang mengandung probiotik tergolong kedalam pangan fungsional karena selain mengenyangkan, berpotensi pula meningkatkan fungsi fisiologis usus dengan memodifikasi mikroflora usus. Makanan yang mengandung probiotik selain mempunyai nilai nutrisi yang baik, dianggap pula memberi manfaat kesehatan dan terapeutik serta bisa dijadikan sebagai pengganti antibiotik untuk menekan pertumbuhan bakteri patogen.
Mikroflora usus merupakan bagian yang terpenting bagi manusia untuk mengoptimalkan kesehatan. Kondisi kesehatan yang baik dipengaruhi oleh “mikroba baik” yang berguna bagi kesehatan yang kebanyakan dikelompokkan sebagai Bakteri Asam Laktat (BAL). Karakteristik yang dipertimbangkan untuk menentukan syarat utama isolat BAL sebagai bakteri probiotik diantaranya bersifat nonpatogenik, harus mampu bertahan hidup dan bersaing serta tidak hanya sekedar tumbuh dalam saluran pencernaan (Wahyudi dan Samsundari, 2008). Bakteri tersebut harus mampu melewati beberapa rintangan seperti keasaman lambung yang tinggi, keberadaan antibiotik dan sekresi garam empedu dalam usus halus. Selain itu BAL juga mampu menghasilkan senyawa antimikroba untuk menekan pertumbuhan bakteri patogen (Salminen et al., 2004; Winarno et al., 2003).
2 biokefir. Dengan adanya penambahan bakteri tersebut produk kefir akan jauh lebih bermanfaat.
Bifidobacterium longum Y-01 dan Lactobacillus acidophilus Y-01
merupakan kultur yang telah diisolasi dari produk olahan susu sapi dan telah dikembangkan untuk pembuatan biokefir secara terkontrol dengan penambahan biji kefir. Pembuktian terhadap potensi kultur tersebut sebagai probiotik perlu dilakukan untuk mendukung ketersediaan produk pangan fungsional yang menguntungkan bagi kesehatan manusia.
Tujuan
Mempelajari karakterisasi potensi BAL pada kefir, B. longum Y-01 dan L.
acidophilus Y-01 terseleksi sebagai kandidat bakteri probiotik melalui
resistensi/ketahanan terhadap kondisi saluran pencernaan manusia, khususnya pada kondisi pH yang berbeda (pH 2; 2,5; 3,2 dan 7,2), garam empedu dan antibiotik serta mengetahui kemampuan BAL dalam memproduksi antimikroba dan kemampuan daya hambatnya terhadap bakteri patogen (Staphylococcus aureus ATCC 25923,
TINJAUAN PUSTAKA
Bakteri Asam Laktat
Bakteri Asam Laktat (BAL) didefinisikan sebagai suatu kelompok bakteri Gram positif yang disatukan oleh berbagai morfologi. Karakteristik BAL secara umum tidak berspora, katalase negatif, berbentuk bulat atau batang, memerlukan nutrisi yang kompleks seperti asam-asam amino, vitamin (B1, B6, B12 dan biotin), purine dan pyrimidin. Kelompok bakteri ini mampu memproduksi asam laktat sebagai produk akhir metabolik utama selama fermentasi karbohidrat. Berdasarkan jenis fermentasinya BAL dibagi menjadi dua kelompok yaitu homofermentatif dan heterofermentatif. Produk akhir dari proses metabolisme homofermentatif sebagian besar berupa asam laktat sedangkan produk akhir dari proses metabolisme heterofermentatif adalah asam laktat, etanol, asam asetat dan CO2 (Surono, 2004). Adanya BAL homofermentatif digunakan dalam pengawetan makanan karena produksi asam laktat dalam jumlah besar serta mampu menghambat bakteri penyebab kebusukan makanan dan bakteri patogen lainnya. Golongan BAL heterofermentatif lebih ditujukan kepada pembentukan flavor dan komponen aroma, seperti asetildehid dan diasetil (Fardiaz, 1992).
Menurut Mitsuoka (1990), BAL dapat dibagi atas 4 grup, berdasarkan kemampuan hidupnya di dalam saluran pencernaan manusia, yaitu :
a) Grup yang berhasil hidup di dalam lumen usus dan merupakan organisme yang paling banyak ditemukan dalam spesimen usus manusia, contohnya galur-galur dari Bifidobacterium (B. bifidus, B. breve, B. longum, B. adolecentris, B. infantis).
b) Grup yang berhasil hidup di dalam lumen usus dan sering ditemukan dalam spesimen usus manusia, contohnya Lactobacillus (L. acidophillus, L. salivarus, L. fermentum).
c) Grup yang berhasil hidup di dalam lumen usus dan kadang-kadang ditemukan dalam spesimen usus manusia, contohnya Lactobacillus (L. casei, L. brevis, L. plantarum, L.buchneri).
4 Mitsuoka (1990) menyatakan bahwa BAL yang paling sering dijumpai pada usus dalam keadaan hidup serta dapat digunakan sebagai kultur starter produk fermentasi adalah Lactobacillus dan Bifidobacterium. Adanya BAL yang berasal dari
genus Lactococcus dan Streptococcus hanya dapat digunakan sebagai starter produk
fermentasi dan tidak dijumpai pada usus. Oleh karena itu, BAL yang umum digunakan dalam produk probiotik adalah Lactobacillus dan Bifidobacterium.
Golongan BAL tersebut di antaranya adalah L. acidophilus, L. casei, L. johnsonii, L. reuteri, L. rhamnosus, L. gasseri, L. bulgaricus, B. longum, B. lactis,dan B. bifidum
(Surono, 2004).
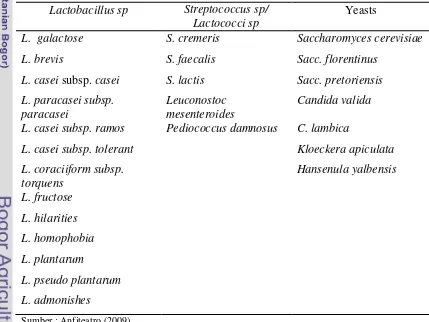
Kefir
Kefir merupakan salah satu produk susu fermentasi yang dihasilkan dari susu sapi, domba atau kambing yang difermentasi dengan cara menambahkan butir kefir/ biji kefir (kefir grain). Kefir mempunyai rasa asam beralkohol dengan kekentalan seperti krim dan sedikit berbuih. Selain itu, kefir mempunyai sensasi rasa berbusa (foam) dan beruap (fizzy) seperti bir. Rasa asam yang timbul dalam kefir disebabkan oleh aktivitas bakteri yang menghasilkan asam laktat, sedangkan alkohol, rasa berbusa dan beruap dihasilkan oleh khamir yang memfermentasi laktosa menjadi alkohol dan CO2. Kefir mengandung 0,5 - 1% alkohol dan 0,9 - 1,1% asam laktat (Rahman et al., 1992). Komposisi kefir menurut Codex (2003) terdiri atas: protein susu minimal 2,7% b/b, lemak susu kurang dari 10% b/b, Total Asam Tertitrasi (TAT) 0,7%, etanol minimal 0,5% v/b, jumlah mikroorganisme kultur starter minimal 107, dan khamir minimal 104 cfu/g.
Gambar 1. Biji Kefir dan Mikroflora yang Terkandung dalam Biji Kefir (Anfiteatro, 2009)
5
et al., 1992). Biji kefir mengandung 24 persen polisakarida yang bersifat lengket.
Biji kefir ini merupakan simbiosis antara bakteri asam laktat dan khamir dengan permukaan dilapisi kapang dalam perbandingan yang seimbang. Karakteristik sensori yang dimiliki kefir menurut Tamime (2006) adalah: (a) warnanya putih atau kekuningan; (b) aroma seimbang dan aroma yeasty; (c) rasanya asam, tetapi
menyenangkan dan menyegarkan; dan (d) teksturnya lebih tebal, tetapi tidak lengket dan mempunyai konsistensi yang elastis.
Tamime dan Marshall (1994) menjelaskan bahwa jenis mikroorganisme yang terdapat dalam biji kefir tergantung pada sumber dan negara asal, serta teknik pembuatan kultur yang digunakan untuk mengidentifikasi spesies yang beragam tersebut. Bakteri asam laktat yang termasuk penyusun mikroflora kefir adalah
Lactobacillus sp. dan Streptococcus sp. yang bersifat homofermentatif (Fardiaz,
1992). Contoh mikroflora yang terkandung dalam biji kefir terdapat pada Tabel 1.
Table 1. Mikroflora yang Terkandung dalam Biji Kefir
Lactobacillus sp Streptococcus sp/
Lactococci sp
Yeasts
L. galactose S. cremeris Saccharomyces cerevisiae
L. brevis S. faecalis Sacc. florentinus
L. casei subsp. casei S. lactis Sacc. pretoriensis
L. paracasei subsp. paracasei
Leuconostoc mesenteroides
Candida valida
L. casei subsp. ramos Pediococcus damnosus C. lambica
L. casei subsp. tolerant Kloeckera apiculata
6
Probiotik
Probiotik atau dikenal dengan mikroorganisme “baik” adalah preparat yang terdiri atas mikroba hidup yang dimasukkan ke dalam tubuh manusia atau hewan secara oral. Mikroba hidup itu diharapkan mampu memberikan pengaruh positif terhadap kesehatan manusia atau hewan dengan cara memperbaiki sifat-sifat yang dimiliki mikroba alami yang tinggal di dalam tubuh manusia atau hewan tersebut. Syarat - syarat probiotik yang baik adalah probiotik harus mempunyai kemampuan untuk bertahan hidup ketika melalui saluran pencernaan dan bermanfaat bagi kesehatan (Ardiansyah, 2007).
Keseimbangan yang baik dalam ekosistem mikroflora usus bisa menguntungkan kesehatan tubuh dan dapat dipengaruhi oleh konsumsi probiotik setiap hari (Lisal, 2005). Keuntungan dalam mengkonsumsi bakteri probiotik menurut Wahyudi dan Samsundari (2008) antara lain :
1. Meningkatkan pertumbuhan inang. Peningkatan pertumbuhan terjadi sebagai hasil dari penurunan infeksi subklinis akibat tertekannya pertumbuhan mikroorganisme penyebab penyakit. Mekanisme yang terjadi mirip dengan mekanisme kerja dari penggunaan antibiotik sebagai growth-promotor.
2. Memperbaiki penggunaan nutrisi makanan. Hal ini dapat terjadi melalui peningkatan efisiensi proses pencernaan atau peningkatan kecernaan senyawa-senyawa yang awalnya tidak tercerna.
3. Meningkatkan kesehatan. Resistensi inang terjadi terhadap penyakit infeksi baik secara langsung melalui mekanisme antagonis maupun melalui status kekebalan. Manusia menjadi kebal secara alami terhadap berbagai penyakit infeksi.
7
Clostridium perfringens penyebab radang usus dan menekan bakteri patogen lainnya
(Ardiansyah, 2007).
Karakteristik Probiotik
Syarat utama agar probiotik mampu memberikan efek positif bagi kesehatan inang adalah probiotik tersebut harus berada dalam keadaan hidup dan dikonsumsi dalam jumlah yang cukup. Kriteria yang perlu dipertimbangkan untuk mendapatkan produk probiotik dengan pengaruh positif optimal bagi inangnya, di antaranya adalah : (a) memiliki kemampuan untuk bertahan selama proses pengolahan dan selama waktu penyimpanan, (b) memiliki karakteristik sensorial yang baik, (c) memiliki kemampuan menempel dan mengkolonisasi usus, (d) memiliki sifat antagonistik terhadap mikroba patogen enterik, (e) terbukti memiliki pengaruh menguntungkan bagi kesehatan inang, (f) produk probiotik diharapkan memiliki jumlah sel hidup besar (10 7 -10 9 cfu/ml) dan (g) total konsumsi produk probiotik sekitar 300-400 Gram per minggu (Surono, 2004).
Salminen et al. (2004) menambahkan bahwa suatu bakteri dapat dikatakan
sebagai bakteri probiotik apabila memenuhi beberapa kriteria yakni bersifat nonpatogenik, masih aktif dalam kondisi asam lambung dan konsentrasi garam empedu yang tinggi dalam usus halus, mampu tumbuh dan melakukan metabolisme dengan cepat dan tepat dalam jumlah yang banyak dalam usus serta memiliki sifat antimikroba terhadap bakteri merugikan. Kriteria yang lain adalah dapat mengkolonisasi beberapa bagian dari saluran usus untuk sementara dan dapat memproduksi asam-asam organik secara efisien dan mudah diproduksi.
Ketahanan terhadap Asam Lambung
Ketahanan terhadap asam lambung merupakan syarat penting suatu BAL untuk dapat menjadi probiotik. Setiap organisme mempunyai kisaran nilai pH pertumbuhan, yaitu kondisi lingkungan pH yang masih memungkinkan pertumbuhan terjadi dan masing-masing bakteri biasanya mempunyai pH optimum. Kebanyakan mikroorganisme dapat tumbuh pada kisaran pH 6,0-8,0 dan nilai pH di luar kisaran kurang dari 2,0 dan lebih dari 10,0 biasanya bersifat merusak (Buckle et al., 2007).
8 kurang dari 2-3 liter getah lambung. Getah lambung merupakan cairan jernih berwarna kuning pucat yang mengandung HCl 0,2 - 0,5% dengan pH sekitar 2 bila lambung dalam kondisi kosong (Chou dan Weimer, 1999).
Bakteri Asam Laktat (BAL) merupakan mikroorganisme fermentatif yang dapat hidup pada kisaran pH yang luas. Setiap galur BAL memiliki ketahanan yang berbeda terhadap asam atau pH rendah, seperti contoh adalah Lactobacillus dan Bifidobacteria yang lebih toleran terhadap pH rendah daripada laktokoki dan streptokoki (Zavaglia et al., 1998; Chou dan Weimer, 1999).
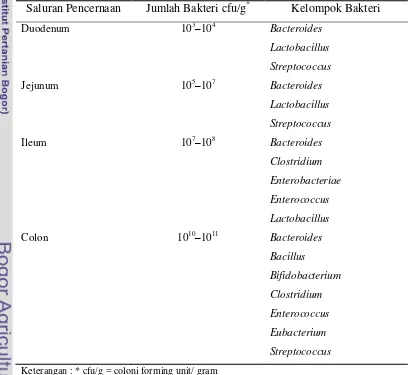
Ketahanan terhadap Garam Empedu
Ketahanan BAL terhadap garam empedu juga merupakan salah satu syarat penting untuk probiotik. Asam empedu disintesis dalam hati dari kolesterol, menghasilkan senyawa asam empedu primer. Asam empedu ini berkonjugasi dengan glisin atau taurin dan disekresikan ke dalam kantung empedu sebagai asam empedu terkonjugasi. Asam empedu di dalam kantung empedu dilepaskan ke lumen
duodenum dalam bentuk misel dengan asam lemak dan gliserol yang dihasilkan oleh
pencernaan lipase pankreatik. Sebanyak 5.500 sampai 35.500 mg asam empedu terkonjugasi disekresikan ke dalam usus kecil manusia setiap harinya (Corzo dan Gilliland, 1999). Asam empedu terkonjugasi diserap dari usus kecil (sekitar 97%) dan dikembalikan ke dalam hati melalui sirkulasi hepatik. Sebagian kecil dari asam empedu (250-400 mg) yang tidak terserap hilang dari tubuh manusia sebagai asam empedu bebas di feses. Mekanisme proses terjadinya penyerapan asam empedu dalam usus kecil dan kolon, dikenal dengan sirkulasi hepatik (Gambar 2).
9 Menurut Zavaglia et al. (1998), semua mikroba yang berhasil hidup setelah
ditumbuhkan dalam MRSA yang ditambah 0,3% oxgal, dinyatakan bersifat tahan terhadap garam empedu. Konsentrasi garam empedu sebesar 0,3% merupakan konsentrasi kritikal dan merupakan nilai yang cukup tinggi untuk menyeleksi isolat yang resisten terhadap garam empedu. Laktobasili yang paling bersifat resisten terhadap garam empedu terdapat pada bagian atas usus halus. Hal tersebut dilaporkan
oleh Tappenden et al. (2007) bahwa BAL ditemukan dalam usus halus yang terdapat
dalam jumlah yang lebih rendah di duodenum dibanding jejunum, ileumdan kolon.
Hal ini dikarenakan konsentrasi garam empedu pada bagian duodenumpaling tinggi, disebabkan lokasinya paling dekat bila garam empedu masuk ke dalam saluran usus. Populasi kelompok bakteri utama pada usus manusia disajikan pada Tabel 2.
Table 2. Populasi Kelompok Bakteri Utama pada Usus Manusia
Saluran Pencernaan Jumlah Bakteri cfu/g* Kelompok Bakteri
Duodenum 103–104
10
Ketahanan terhadap Antibiotik
Salah satu syarat BAL yang bermanfaat sebagai probiotik adalah memiliki ketahanan terhadap antibiotik. Antibiotik adalah suatu jenis senyawa antibakteri, baik alami maupun sintetik yang mempunyai efek menekan atau menghentikan suatu proses biokimia di dalam organisme. Setiap antibiotik sangat beragam keefektifannya dalam melawan jenis bakteri, baik bakteri Gram positif atau Gram negatif maupun yang memiliki spektrum luas (Black, 2004). Antibiotik bekerja sesuai dengan peptisida dengan menekan atau memutus suatu mata rantai metabolisme, hanya saja targetnya adalah bakteri. Jenis antibiotik yang dilihat dari target atau sasaran kerjanya di antaranya yakni:
1). Kloramfenikol
Kloramfenikol merupakan sutu antibiotik dengan spektrum luas. Kloramfenikol digunakan untuk peyembuhan penyakit tifus (demam tifoid) dan paratifoid, infeksi berat karena Salmonella sp, H. influenza (terutama meningitis), rickettzia, limfogranuloma, psitakosis, gastroenteristis, bruselosis, disentri. Kloramfenikol dapat merusak sistem pembentukan darah seperti anemia aplastik anemia (dapat berlanjut menjadi leukemia). Senyawa ini termasuk antibiotik yang paling stabil larut dalam air pada pH 6 menunjukkan kecenderungan terurai yang paling rendah. Antibiotik ini diabsorsi dalam saluran pencernaan secara cepat dan sempurna dengan bantuan hati dan ginjal (Scuhnack et al., 1990).
2). Amoksisilin
Amoksisilin adalah antibiotik yang termasuk ke dalam golongan penisilin, dengan aktivitasnya membunuh bakteri secara langsung. Amoksisilin sangat efektif untuk beberapa bakteri seperti H. influenza, N. gonorrhoea, E. coli, Pneumococci, Strptococci, dan beberapa strain dari
Staphylococci. Amoksisilin dapat menghambat pertumbuhan mikroorganisme
11 Amoksisilin biasa digunakan dalam pengobatan infeksi yang diduga disebabkan karena bakteri (Kline, 2009).
Aktivitas Antimikroba terhadap Bakteri Patogen
Syarat lain agar BAL layak digolongkan dengan bakteri probiotik yakni harus mampu menghasilkan senyawa antimikroba. Senyawa antimikroba merupakan suatu kemampuan antagonistik suatu senyawa kimia untuk menghambat pertumbuhan mikroba yang tidak diinginkan. Komponen antimikroba yang dimiliki BAL dapat menghambat bakteri patogen. Cotter dan Hill (2003) menyatakan bahwa asam laktat mampu menghambat pertumbuhan berbagai tipe bakteri pembusuk dan patogen termasuk spesies Gram negatif dalam famili Enterobacteriaceae dan Pseudomonadaceae. Lactobacillus dapat menghasilkan antibakteri, karena filtrat Lactobacillus mampu menghambat pertumbuhan bakteri patogen Staphylococcus aureus dan Escherichia coli (Hardiningsih et al., 2006).
Mekanisme penghambatan pertumbuhan mikroba oleh senyawa anti mikroba diantaranya : (1) perusakan dinding sel sehingga mengakibatkan lisis atau menghambat pertumbuhan dinding sel pada sel yang sedang tumbuh, (2) mengubah permeabilitas membran sitoplasma yang menyebabkan kebocoran nutrien di dalam sel, (3) denatuarasi protein sel, (4) perusakan sistem metabolisme dalam sel dengan cara menghambat kerja enzim intraseluler. Umumnya bakteri Gram negatif mempunyai ketahanan yang lebih baik terhadap senyawa antimikroba dibanding bakteri Gram positif. Struktur dinding sel bakteri Gram negatif lebih kompleks dari pada bakteri Gram positif, sehingga senyawa antimikroba akan lebih mudah masuk ke dalam sel bakteri Gram positif (Pelezar and Chan, 2007).
12 Asam organik merupakan substansi alami dari berbagai jenis makanan. Aksi antimikroba dari asam organik berdasarkan pada kemampuannya untuk menurunkan pH dalam pangan yang berfase air (Samelis dan Sofos, 2003). Bakteriosin merupakan senyawa protein aktif dan kompleks yang dihasilkan oleh bakteri asam laktat yang mempunyai aktivitas antimikroba misalnya melawan patogen pencemar makanan penyebab food borne disease dan organisme berspora lainnya (Ray, 2004).
Hidrogen peroksida merupakan salah satu agen pengoksidasi yang kuat dan dapat dijadikan sebagai zat antimikroba melawan bakteri, fungi dan bahkan virus (Ray, 2004).
Bakteri Probiotik
Bifidobacterium longum
Bifidobacterium longum memiliki bentuk batang dan termasuk ke dalam
golongan bakteri Gram positif, anaerob strict, tidak berspora, katalase negatif, pertumbuhan optimal pada suhu 36-37oC, memiliki pH optimum 6,5-7. Bakteri B. longum bersifat homofermentatif dengan rasio asam asetat dan asam laktat yang dihasilkan 1,5 : 1 (Nakazawa dan Hasono, 1992). Bifidobacterium hidup pada lapisan lumen kolon dan lebih spesifik lagi membentuk koloni dalam jumlah banyak, mensekresi asam laktat, asam asetat dan senyawa antimikroba. Bifidobacterium
dominan pada dinding usus sehingga mencegah dinding usus dari kolonisasi bakteri yang tidak diinginkan (E. coli) atau 7 khamir (candida) (Tamime dan Robinson, 1999).
Bifidobacterium sangat efektif untuk melawan bakteri yang merugikan atau patogen yang masuk dari luar maupun bakteri yang merugikan dalam saluran pencernaan seperti Shigella dysenteria, Salmonella typhosa, Staphylococcus aureus, E. coli, dan bakteri lainnya. Bakteri ini memproduksi zat-zat yang bersifat asam
lemak rantai pendek terutama asam asetat dan laktat, dan bisa juga menghasilkan zat bersifat antibiotik (Winarno et al., 2003). Bakteri B. longum diberikan untuk
13 Lactobacillus acidophilus
Lactobacillus acidophilus merupakan bakteri dari famili Lactobacillaceae
yang termasuk dalam golongan Gram positif, berbentuk batang, bersifat mesofilik dan tidak dapat membentuk spora. Bakteri L. acidophilus bersifat homofermentatif dengan asam laktat sebagai produk utama fermentasi karbohidrat (Rahman et al.,
1992). Saat ini telah diketahui bahwa keberadaan bakteri ini tidak bersifat patogen dan aman bagi kesehatan sehingga sering digunakan dalam industri pengawetan makanan, minuman dan berpotensi sebagai produk probiotik. Sifat yang menguntungkan dari bakteri Lactobacillus dalam bentuk probiotik adalah dapat
digunakan untuk mendukung peningkatan kesehatan. Bakteri tersebut berperan sebagai flora normal dalam sistem pencernaan yang berfungsi untuk menjaga keseimbangan asam dan basa sehingga pH dalam kolon konstan (Hardianingsih et al., 2006). Karakteristik L. acidophilus adalah : (1) tidak tumbuh pada suhu 15oC
dan tidak memfermentasi ribosa; (2) pertumbuhan optimum pada suhu 35-38oC dan pH optimum 5,5-6,0; (3) pada susu sapi memproduksi 0,30%-1,90% DL asam laktat (Nakazawa dan Hosono, 1992).
Bakteri L. acidophilus merupakan salah satu spesies penyusun mikroflora
alami usus yang mampu melewati hambatan di dalam saluran pencernaan. Spesies ini resisten terhadap enzim dalam saliva, asam lambung dan asam empedu sehingga mampu mencapai usus dalam keadaan hidup. Bakteri L. acidophilus banyak ditemukan pada bagian akhir usus halus dan bagian awal usus besar. Bakteri ini mampu memproduksi berbagai zat metabolit, seperti : asam organik, hidrogen peroksida dan berbagai bakteriosin yang dapat menghambat perkembangan bakteri patogen (Kanbe, 1992). Bakteri L. acidophilus dapat digolongkan dalam probiotik
potensial untuk digunakan pada ayam yang ditujukan untuk pengendalian
salmonellosis, colibacillosis dan clostridial necrotic enteritis (Natalia dan Priadi,
2006). Bakteri tersebut membantu mengendalikan infeksi dan peradangan usus, dengan fungsi tersebut maka mengurangi potensi diare, serta mampu menghalangi terbentuknya kanker dan membantu mengendalikan kadar kolesterol darah (Wahyudi dan Samsundari, 2008).
Bakteri Patogen
14 dan bakteri yang menyebabkan keracunan atau penyakit pada manusia atau disebut bakteri patogen. Food borne disease terjadi pada manusia melalui dua cara, yaitu : 1) intoksikasi, yakni makanan mengandung toksin yang dihasilkan bakteri yang tumbuh di dalam makanan tersebut, dan 2) infeksi, yakni penyakit yang disebabkan oleh masuknya bakteri ke dalam tubuh melalui makanan yang telah terkontaminasi dan adanya reaksi dari tubuh terhadap keberadaan suatu metabolit yang dihasilkan oleh bakteri yang bersifat patogen dan digunakan sebagai acuan untuk mengetahui besarnya tingkat aktivitas antimikroba (Suriawiria, 2005). Beberapa mikroba yang diketahui sebagai bakteri pembusuk dan patogen pada produk fermentasi adalah dari famili Enterobacteriaceae, meliputi famili Enterobacter, Erwina, Citobacter, Klebsiella, Proteus, Salmonella, Serattia, Shigella dan Yersinia (Fardiaz, 1992). Staphlococcus aureus
Staphlococcus aureus merupakan bakteri Gram positif, berbentuk kokus yang
terdapat dalam bentuk tunggal, berpasangan tetrad atau kelompok, seperti buah anggur berdiameter berkisar 0,5-1,5 µm, anaerob fakultatif, tidak bergerak, tidak berspora dan biasanya termasuk katalase positif (Holt et al., 1994). Bakteri ini sering berada pada pori-pori dan permukaan kulit, kelenjar keringat dan saluran usus serta dapat menyebabkan intoksikasi dan infeksi bisul (Fardiaz, 1992).
Suhu optimum pertumbuhan S. aureus adalah 35-57 oC, dengan kisaran suhu minimum adalah 6,7 oC dan suhu maksimum 45,5 oC. Bakteri ini dapat tumbuh pada kisaran pH 4,0-9,8 dengan pH optimum sekitar 7,0-7,8. Pertumbuhan pada pH mendekati 9,8 hanya mungkin apabila substratnya mempunyai komponen yang baik untuk pertumbuhannya (Buckle et al., 2007).
Escherichia coli
Escherichia coli merupakan bakteri Gram negatif, tidak mempunyai kapsul, umumnya mempunyai fimbriae, bersifat motil atau nonmotil dengan flagella, berukuran lebar 1-1,5 µm dan panjang 2-6 µm, bersifat anaerob fakultatif, tunggal atau berpasangan, mempunyai suhu optimal pertumbauhan 37oC, tetapi dapat tumbuh pada rentang suhu 15-45oC dan nilai aw optimum untuk pertumbuhannya adalah 0,96. (Willshaw et al., 2000).
15 Bayi yang baru dilahirkan di ususnya terdapat E. colli dan jumlahnya akan semakin
meningkat sesuai dengan peningkatan umur. E. coli dengan jumlah 105 – 108 cfu/g feses dapat menyebabkan diare dan kanker (Mitsuoka, 1990).
Salmonella enteritidis serotipe Typhimurium (S. Typhimurium)
Salmonella Typhimurium merupakan bakteri Gram negatif, berbentuk batang,
tidak berspora dan bersifat fakultatif anerobik. S. Typhimurium tumbuh optimum
pada suhu 37oC, dengan suhu terendah 20oC dan suhu tertinggi 60oC (Buckle et al.,
2007). Nilai pH untuk pertumbuhan S. Tyhimurium berkisar antara 4,0 – 9,0 dan nilai pH optimum 6,5 – 7,5, pada pH dibawah 4 dan di atas 9 bakteri ini akan mati perlahan-lahan. Viabilitas Salmonella akan menurun selama penyimpanan beku (Pelczar dan Chan, 2007).
Bakteri dari genus S. Typhimurium menyebabkan demam tipus yang akan terjadi setelah 7-14 hari terinfeksi dan umumnya penderita penyakit merasakan sakit kepala, kehilangan nafsu makan, lemah dan demam yang terus menerus. Penyakit yang disebabkan oleh S. Typhimuriumdapat mengakibatkan tingkat kematian sekitar 10%. Makanan yang pada umumnya terkontaminasi oleh S. Typhimurium adalah
METODE
Lokasi dan Waktu
Penelitian dilaksanakan di Laboratorium Mikrobiologi, Bagian Teknologi Hasil Ternak, Departemen Ilmu Produksi dan Teknologi Peternakan, Fakultas Peternakan, Institut Pertanian Bogor. Penelitian berlangsung pada bulan Maret -September 2010.
Materi Bahan
Bahan yang digunakan dalam penelitian ini berupa kultur starter Bakteri Asam Laktat (BAL) yang berasal dari Kefir dan bakteri hasil isolasi dari produk olahan susu sapi yaitu B. longum Y-01 dan L. acidophilus Y-01 yang merupakan
bakteri koleksi Laboratorium Mikrobiologi Bagian Teknologi Hasil Ternak, Fakultas Peternakan IPB. Bakteri patogen yang digunakan adalah S. aureus ATCC 25923, E. coli ATCC 25922, dan S. Typhimurium ATCC 14028. Bahan-bahan lain yang
dipergunakan adalah media tumbuh bakteri dan bahan kimia diantaranya meliputi susu skim, deMan’s Rogosa Sharpe Agar (MRSA), deMan’s Rogosa Sharpe Broth (MRSB), Buffer Pepton Water (BPW), Phosphate Buffered Saline (PBS), Eosin Methilen Blue Agar (EMBA), Salmonella Shigella Agar (SSA), Mueller Hinton Agar
(MHA), HCl, NaOH, NaCl, bile salt, antibiotik (amoksisilin dan kloramfenikol), alkohol 70%, kristal violet, iodin, safranin, minyak imersi, aquadestilata, alumunium foil dan kapas.
Alat
17
Prosedur
Pemeriksaan Kultur Bakteri Asam Laktat dan Patogen (Pelczar dan Chan, 2007)
Kultur BAL kefir, B. longum Y-01, L. acidophilus Y-01 dan bakteri patogen S. aureus ATCC 25923, E. coli ATCC 25922 dan S. typhimurium ATCC 14028
diperiksa karakteristik morfologinya. Pengujian morfologi dilakukan dengan pewarnaan Gram diikuti dengan pengujian katalse.
Pewarnaan Gram dilakukan dengan cara pengolesan preparat bakteri pada gelas objek, dilanjutkan dengan fiksasi di atas api. Setelah itu kristal violet diteteskan di atas preparat, didiamkan selama ±1 menit, kemudian dibilas dengan akuadestilata. Preparat dikeringudarakan kemudian ditetesi dengan larutan lugol iodin selama ±1 menit dan dibilas kembali dengan akuadestilata. Preparat kemudian dikeringudarakan, selanjutnya ditetesi dengan alkohol 95% sebagai bahan pemucat selama ±5 detik, dibilas kembali dengan akuadestilata dan dikeringudarakan. Pewarnaan terakhir menggunakan safranin selama ±30 detik dan dibilas kembali dengan akuadestilata, lalu preparat dikeringudarakan. Bakteri yang telah diwarnai diamati di bawah mikroskop dengan perbesaran 10 x 100 dengan bantuan minyak imersi.
Uji katalase menggunakan bahan kimia H2O2. Satu Öse preparat bakteri dioleskan pada gelas objek, kemudian ditetesi dengan satu tetes H2O2. Jika dihasilkan gelembung gas O2, maka bakteri yang diuji termasuk kelompok bakteri katalase positif (+), sebaliknya bila bakteri yang diuji tidak menghasilkan gelembung gas maka bakteri tersebut termasuk kelompok bakteri katalase negatif (-).
Penentuan Standar Populasi Bakteri Asam Laktat (Waluyo, 2008)
Tahap ini bertujuan untuk menentukan jumlah populasi BAL selama diberikan perlakuan (ketahanan dalam lingkungan pH yang berbeda, keberadaan garam empedu dan adanya antibiotik) yang dihitung dengan pendekatan dua metode yaitu metode pour plate (hitungan cawan) dan metode turbidimetrik dengan
spektrofotometer. Metode pour plate digunakan untuk penentuan populasi BAL
18
Metode Hitungan Cawan (Bakteriological Analytical Manual, 2001). Tahap ini
diawali dengan pengenceran yang dilakukan dengan mengambil 1 ml sampel yang sudah homogen menggunakan pipet steril, lalu dimasukkan ke dalam tabung reaksi berisi 9 ml laruran pengencer yaitu BPW, sehingga terbentuk pengenceran 10-1. Pengenceran terus dilakukan sampai pada pengenceran 10-9. Pengambilan sampel dilakukan menggunakan pipet steril pada pengenceran 10-6, 10-7, 10-8 dan 10-9 sebanyak 1 ml dan dipindahkan ke dalam cawan Petri steril secara duplo. Media MRSA ditambahkan ke dalam cawan Petri dengan metode tuang (pour plate)
sebanyak 12-15 ml. Campuran tersebut dihomogenkan dengan cara cawan Petri digerakkan dengan arah membentuk angka delapan. Cawan Petri diinkubasikan setelah agar mengeras, dengan posisi terbalik pada suhu 37 C selama 24–48 jam. Koloni mikroba yang terbentuk dihitung berdasarkan Standard Plate Count (SPC) dengan rumus sebagai berikut :
Populasi (cfu/ml) =
[n1 + (0,1 x n2)] x d
Keterangan :
N = Jumlah koloni yang berbeda dalam kisaran hitung (25-250 koloni) n1 = Jumlah cawan pertama yang koloninya dapat dihitung
n2 = Jumlah cawan kedua yang koloninya dapat dihitung d = Tingkat pengenceran pertama yang dihitung
Metode Turbidimetrik (Waluyo, 2008). Tahap ini diawali dengan penentuan
korelasi antara nilai optical density (OD) dengan populasi bakteri hasil pemupukan
dengan metode pour plate. Semakin tinggi nilai OD maka jumlah populasi bakteri
yang dipupukkan juga semakin banyak, sehingga membentuk persamaan linier y = a
+ bx (y jumlah populasi BAL, x nilai OD bakteri dan a dan b konstanta persamaan). Persamaan linier yang didapat (Tabel 3) digunakan dalam penentuan populasi BAL kefir, B. Longum Y-01 dan L. acidophilus Y-01 pada pengujian ketahanan terhadap pH yang berbeda, garam empedu, dan antibiotik yang berbeda. Nilai R2 merupakan nilai detrminan dari persamaan linier yang didapat, nilai R2 yang
19 mendekati nilai 1 maka persamaan linier akan semakin akurat dengan populasi yang dipupukkan.
Tabel 3. Persamaan Linier BAL Indigenous Kefir dan Produk Olahan Susu Sapi
No. Bakteri Persamaaan Linier R2
1. Bakteri Asam Laktat Kefir y = 7,1955 + 0,7034x 0,9246
2. B. longum Y-01 y = 6,6840 + 1,093x 0,9579
3. L. acidophilus Y-01 y = 7,2057 + 1,812x 0,9768
Penelitian Utama
Persiapan Sel-sel Kultur Bakteri Asam Laktat
Sel-sel kultur BAL kefir, B. longum Y-01 dan L. acidophilus Y-01 yang
berumur 24 jam masing-masing dalam MRSB dipanen melalui sentrifugasi pada kecepatan 3500 rpm selama 15 menit dalam suhu 4 0C. Bagian presipitat atau endapan dipisahkan dari bagian supernatannya. Presipitat selanjutnya distandarisasi dengan populasi awal ±107 cfu/ml ke dalam larutan PBS.
Uji Ketahanan terhadap pH yang Berbeda (Chou dan Weimer, 1999)
Presipitat sel-sel kultur BAL kefir, B. longum Y-01 dan L. acidophilus Y-01
yang sudah distandarisasi dengan populasi awal ±107 cfu/ml dimasukkan ke dalam larutan PBS yang telah dikondisikan pada pH 2,0 dengan bantuan HCl dan NaOH. Kultur bakteri dalam PBS diinkubasi pada suhu 37 0C selama 180 menit. Penghitungan populasi awal sebelum (t0) dan sesudah diinkubasi selama 180 menit (t180) dihitung dengan metode hitungan cawan. Perubahan populasi BAL selama perlakuan dalam pH yang berbeda diamati setiap 30 menit, melalui pengukuran nilai absorbansi ( 620 nm) dengan menggunakan spektrofotometer. Nilai OD (x) yang diperoleh dikonversikan dalam persamaan y a bx (Tabel 3) yang ada untuk memperoleh penyetaraan populasi BAL. Uji ketahanan kultur BAL kefir, B. longum
Y-01 dan L. acidophilus Y-01 terhadap pH yang berbeda ditentukan berdasarkan
20 Penelitian ini mengamati kemampuan bertahan atau tumbuh BAL pada saluran pencernaan. Kondisi keasaman lambung mempunyai kisaran pH antara 2-3,5 sehingga nilai pH yang diamati adalah 2; 2,5; 3,2. Kondisi pH pada usus adalah netral sehingga pengamatan dilakukan pada pH 7,2.
Uji Ketahanan terhadap Garam Empedu (Lin et al., 2006)
Uji ketahanan terhadap garam empedu dilakukan terhadap isolat bakteri BAL kefir, B. longum Y-01 atau L. acidophilus Y-01 yang dapat tumbuh pada pH 2,0. Pengujian disesuaikan dengan kadar garam empedu pada saluran pencernaan yaitu dengan menggunakan bile salt sebanyak 0,3% oxgall b/v dalam media PBS dengan
pH 7,2. PBS yang telah ditambahkan garam empedu dengan konsentrasi 0,3% pada pH 7,2, kemudian disterilisasi pada suhu 121 oC selama 15 menit.
Presipitat sel-sel kultur BAL kefir, B. longum Y-01 dan L. acidophilus Y-01
yang sudah distandarisasi dengan populasi awal ±107 cfu/ml diinokulasikan pada media PBS yang telah ditambahkan garam empedu 0,3% steril. Kultur diinkubasi pada suhu 37 0C selama 24 jam. Penghitungan populasi awal sebelum (t0) dan sesudah diinkubasi selama 24 jam (t24j) dihitung dengan metode hitungan cawan. Perubahan populasi BAL selama perlakuan dengan penambahan garam empedu 0,3% oxgal diamati setiap 1 jam selama 24 jam, melalui pengukuran nilai absorbansi ( 620 nm) dengan menggunakan spektrofotometer. Nilai OD (x) yang diperoleh dikonversikan dalam persamaan y a bx (Tabel 3) untuk memperoleh penyetaraan populasi BAL. Uji ketahanan kultur BAL kefir, B. longum Y-01 atau L. acidophilus
Y-01 terhadap garam empedu ditentukan berdasarkan jumlah kematian bakteri, yaitu bila kultur starter BAL mampu mempertahankan populasinya hingga 50% dinyatakan sebagai probiotik.
Uji Ketahanan terhadap Antibiotik (Modifikasi Liasi et al., 2009)
21 Pengukuran populasi awal dihitung dengan metode pemupukan sebelum diinkubasi (t0). Kultur diinkubasi pada suhu 37 0C selama 24 jam.
Penghitungan populasi awal sebelum (t0) dan sesudah diinkubasi selama 24 jam (t24j) dihitung dengan metode hitungan cawan. Perubahan populasi BAL selama perlakuan dalam pH yang berbeda diamati setiap 1 jam, melalui pengukuran nilai absorbansi ( 620 nm) dengan menggunakan spektrofotometer. Nilai OD (x) yang diperoleh dikonversikan dalam persamaan y a bx (Tabel 3) untuk memperoleh penyetaraan populasi BAL. Uji ketahanan kultur BAL kefir, B. longum Y-01 atau L. acidophilus Y-01 terhadap pH yang berbeda ditentukan berdasarkan jumlah kematian
bakteri, yaitu bila kultur starter BAL mampu mempertahankan populasinya hingga 50% dinyatakan sebagai probiotik.
Uji Sifat Antimikroba terhadap Bakteri Patogen (Modifikasi Maheswari, 2008) Persiapan Filtrat Bebas Sel (FBS) dan FBS Terkonsentrasi. Kultur bakteri yang
sudah disegarkan (populasi 107 CFU/ml) diinokulasikan dalam MRSB ( 5% v/v), lalu diinkubasi pada 37 oC selama 18 jam. Filtrat bebas sel (FBS) diperoleh dengan penyaringan steril menggunakan filter 0,22 m (Millipore). FBS dikonsentrasikan dengan cara menambahkan ke dalam FBS metanol (MeOH) dengan rasio 1:1, kemudian dievaporasi dalam rotary evaporator pada suhu 40-45 0C selama ± 60
menit atau hingga mencapai 1/5 volume awal, dengan tujuan untuk meningkatkan aktivitas antimikroba dari BAL. FBS terkonsentrasi segera disimpan dalam refrigerator (4 oC) sebelum digunakan.
Persiapan Bakteri Indikator. Bakteri uji (BAL dan bakteri patogen) yang
digunakan adalah bakteri yang berumur 24 jam. Bakteri patogen dengan populasi awal minimal 108 cfu/ml (standar Mc Farland no.2) dalam media NB terlebih dahulu diencerkan dalam media NaCl fisiologis hingga populasi mencapai 105 cfu/ml.
22 membentuk angka delapan. Media MHA berisi bakteri indikator dibiarkan memadat, kemudian dibuat sumur difusi berdiameter 7 mm dengan alat pelubang atau cork borer, lalu bagian bawah sumur dilapisi dengan media Bacteriological Agar untuk
menghindari filtrat merembes di dasar sumur. Sebanyak 50l FBS terkonsentrasi dipipet ke dalam sumur, lalu cawan beserta isi diletakkan dalam refrigerator untuk memberi kesempatan FBS berdifusi ke dalam agar. Cawan selanjutnya diinkubasi pada 37 oC selama 24 jam. Diameter penghambatan berupa zona bening di sekeliling sumur diukur dengan jangka sorong pada empat tempat yang berbeda, lalu hasil pengukuran dirata-ratakan. Percobaan dilakukan dengan 2 kali ulangan.
Gambar 3. Skema Pengukuran Zona Hambat a
b d
Area bakteri patogen Zona hambat/bening
Lubang sumur (d=7 mm) c
23
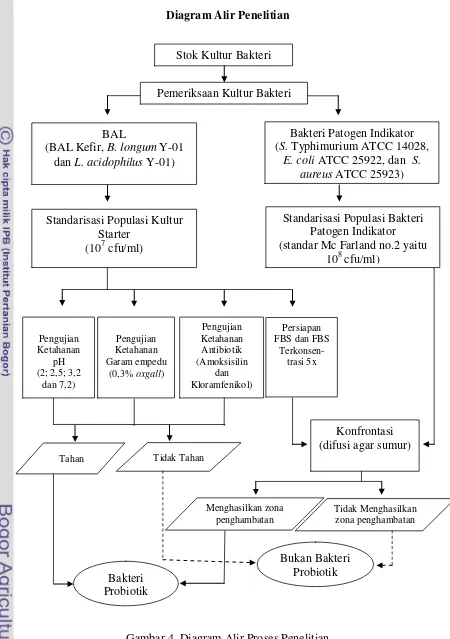
Diagram Alir Penelitian
Gambar 4. Diagram Alir Proses Penelitian Stok Kultur Bakteri
Pemeriksaan Kultur Bakteri
Bakteri Patogen Indikator (S. TyphimuriumATCC 14028,
24
Rancangan Percobaan Uji t.
Data ketahanan BAL kefir, B. longum Y-01 dan L. acidophilus Y-01 terhadap perlakuan pH yang berbeda (2; 2,5; 3,2 dan 7,2), keberadaan garam empedu 0,3% dan antibiotik yang berbeda (amoksisilin dan kloramfenikol) dianalisis dengan uji t. Data populasi BAL kefir, B. longum Y-01 dan L. acidophilus Y-01 dianalisis dengan
membandingkan populasi masing-masing BAL sebelum diberi perlakuan (t0) dan setelah diberi perlakuan (tx). Analisis data dipergunakan untuk melihat pengaruh perlakuan terhadap peubah yang diamati dengan masing-masing perlakuan terdiri atas tiga ulangan. Rumus yang digunakan dalam Uji t adalah sebagai berikut :
Keterangan :
μi = rata-rata perlakuan ke-i μj = rata-rata perlakuan ke-j s = simpangan baku n = jumlah data
Rancangan Acak Lengkap (RAL)
Rancangan Acak Lengkap digunakan untuk menganalisis aktivitas antimikroba BAL terhadap bakteri patogen yang berbeda (S. aureus ATCC 25923, E. coli ATCC 25922 dan S. typhimurium ATCC 14028) dan untuk menganalisis persentase bakteri yang hidup pada kondisi pH yang berbeda, garam empedu dan antibiotik berbeda. Persamaaan model rancangannya menurut Gaspersz (1994).
Keterangan :
Yij = Pengamatan pada perlakuan ke-i dan ulangan ke-j μ = Rataan Umum
i = Pengaruh perlakuan ke-i
ij = Pengaruh galat percobaan pada perlakuan ke-i ulangan ke-j i = BAL uji yang berbeda
25 j = Ulangan 1, 2, dan 3
Data hasil kedua rancangan selanjutnya dianalisis dengan Analysis of variance (ANOVA). Apabila pada analisis ragam didapatkan hasil yang berbeda
HASIL DAN PEMBAHASAN
Pemeriksaan Bakteri Asam dan Bakteri Patogen
Pemeriksaan terhadap kultur bakteri meliputi Bakteri Asam Laktat (BAL) dan bakteri patogen dilakukan diawal penelitian untuk memastikan bahwa kultur bakteri koleksi yang digunakan tidak terkontaminasi oleh kapang, khamir atau bakteri lain. Pemeriksaan secara sederhana yang umum dilakukan yaitu mengamati morfologi bakteri secara mikroskopik meliputi bentuk dan susunannya dengan bantuan pewarnaan Gram serta pengujian sifat katalase.
Hasil pemeriksaan terhadap BAL kefir, B. longum Y-01, L. acidophilus Y-01
serta bakteri patogen S. aureus ATCC 25923, E. coli ATCC 25922 dan S.
Typhimurium ATCC 14028 secara mikroskopik dengan bantuan pewarnan Gram mendapatkan bahwa semua kultur bakteri mempunyai koloni yang homogen, tidak terdapat kontaminasi dan menunjukkan kesesuaian karakteristik morfologi dari masing-masing kultur bakteri. Pengujian sifat katalase juga menunjukkan kesesuaian. Karakteristik morfologi dan sifat katalase kultur bakteri asam laktat asal kefir dan bakteri patogen indikator dapat dilihat pada Tabel 4.
Tabel 4. Karakteristik BAL Indigenous Kefir dan Bakteri Patogen
Jenis Bakteri Pewarnaan Bakteri asam laktat kefir Positif Bulat dan batang Negatif
B. longum Y-01 Positif Batang pendek berantai Negatif
L. acidophilus Y-01 Positif Batang berantai panjang Negatif
---Bakteri Patogen---
S. aureus ATCC 25923 Positif Bulat bergerombol Positif
E. coli ATCC 25922 Negatif Batang pendek Positif
S. TyphimuriumATCC 14028 Negatif Batang pendek Positif
27 pada organisme yang sama (Yuniarti et al., 2003). Bakteri berdasarkan reaksi
terhadap pewarna selama proses pewarnaan Gram dibedakan menjadi kelompok bakteri Gram positif dan Gram negatif.
BAL asal kefir, B. longum Y-01, L. acidophilus Y-01 dan S. aureus ATCC
25923 tergolong ke dalam kelompok bakteri Gram positif karena mampu mempertahankan warna ungu kristal violet setelah diberikan pewarna tandingan safranin, sebaliknya E. coli ATCC 25922 dan S. Typhimurium ATCC 14028 tidak
mampu mempertahankan warna ungu kristal violet setelah diberikan pewarna tandingan safranin, sehingga dikelompokkan ke dalam bakteri Gram negatif. Pengelompokan bakteri ke dalam Gram positif dan Gram negatif menunjukkan bahwa keduanya mempunyai susunan dinding sel yang berbeda. Bakteri Gram positif dapat mempertahankan warna ungu kristal violet karena memiliki dinding sel yang lebih tebal dari pada bakteri Gram negatif sehingga membuat zat pewarna kristal violet tidak dapat keluar dari sel. Menurut Fardiaz (1992), dinding sel bakteri Gram positif 90% terdiri atas lapisan peptidoglikan dengan ketebalan 18 sampai 80 nm dan 10% lapisan tipis yakni asam teikoat sehingga mampu menyerap warna ungu lugol dan tetap mempertahankan warna tersebut ketika dicuci dengan alkohol. Kandungan utama dinding sel bakteri Gram negatif yaitu lipopolisakarida tidak dapat mempertahankan warna ungu kristal violet sehingga berwarna merah setelah diberi zat pewarna tandingannya yaitu safranin.
28 Morfologi kultur starter bakteri BAL kefir menunjukkan hasil yang berbeda-beda yaitu didapatkan sel-sel bakteri dengan bentuk bulat (kokus) dan basil (Gambar 5). BAL dari kefir minimal tersusun atas dua spesies BAL yakni Lactobacillus sp.
yang ditunjukkan oleh sel-sel bakteri berbentuk basil panjang dalam susunan rantai pendek, serta Streptococcus sp. yang ditunjukkan oleh sel-sel bakteri berbentuk
kokus atau bulat dengan susunan rantai pendek dan panjang. Chen et al. (2008) juga
mendapatkan hasil yang sama yaitu berupa dua genus BAL pada saat melakukan isolasi bakteri asal biji kefir yakni Streptococcus sp. dan Lactobacillus sp. Fardiaz
(1992) menjelaskan bahwa morfologi Streptococcus berbentuk bulat yang tersusun
secara berpasangan, atau membentuk rantai pendek dan panjang, yaitu tergantung dari spesies dan kondisi pertumbuhannya. Genus Lactobacillus menurut Holt et al.,
(1994) berbentuk sel batang panjang tapi kadang-kadang hampir bulat, biasanya mempunyai susunan rantai yang pendek.
Keterangan: a = Lactobacillus sp.; b = Streptococcus sp.
Gambar 5. Morfologi Bakteri Asam Laktat Kefir
Pengamatan terhadap morfologi kultur B. longum Y-01 dan L. acidophilus
Y-01 didapatkan bahwa B.longum Y-01 berbentuk batang pendek dengan susunan rantai pendek dan L. acidophilus Y-01 berbentuk batang dengan susunan rantai panjang (Gambar 6). Holt et al (1994) menyatakan bahwa bentuk bakteri
Bifidobacterium adalah batang bentuk pasangan tersusun dalam bentuk V, kadang-kadang bentuk rantai, bentuk pada sel paralel, kadang-kadang-kadang-kadang menunjukkan bentuk bulat besar (gembung). Wahyudi dan Samsundari (2008) menyatakan bahwa L. acidophilus merupakan bakteri yang berbentuk batang dengan susunan tunggal maupun berantai pendek.
29 Gambar 6. Morfologi (a) B. longum Y-01dan (b) L.acidophilus Y-01
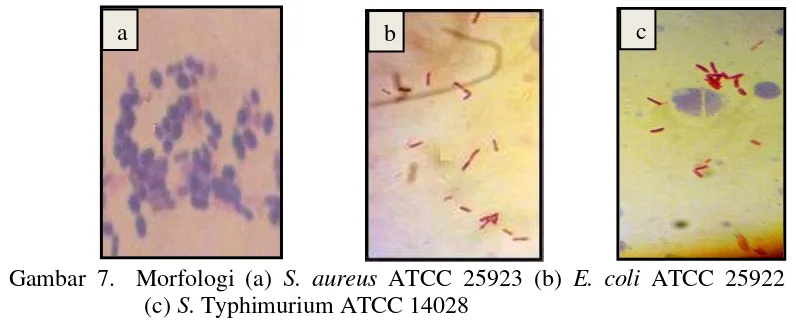
Pengamatan terhadap morfologi kultur bakteri patogen menunjukkan bahwa
bentuk dan susunan dari S. aureus ATCC 25923, E. coli ATCC 25922 dan
S. Typhimurium ATCC 14028 adalah berbeda satu sama lainya (Gambar 7). S. aureus ATCC 25923 mempunyai bentuk bulat bergerombol seperti buah anggur, E. coli ATCC 25922 berbentuk basil pendek, sedangkan S. TyphimuriumATCC 14028 berbentuk basil. Jay (2000) menjelaskan bahwa Salmonella berbentuk batang pendek, S. aureus berbentuk bulat tidak beraturan, tunggal atau berpasangan membentuk tetrad atau anggur dan E. coli berbentuk batang pendek.
Gambar 7. Morfologi (a) S. aureus ATCC 25923 (b) E. coli ATCC 25922 dan (c) S. TyphimuriumATCC 14028
Uji katalase dilakukan untuk mengetahui keberadaan enzim katalase pada bakteri yang diamati. Preparat kultur starter BAL kefir, B. longum Y-01 dan L. acidophilus Y-01 ketika ditetesi H2O2 3% tidak menghasilkan gelembung gas oksigen (O2), hal ini berarti bahwa kultur starter tersebut tidak memiliki enzim katalase yang dapat mengkatalis H2O2 menjadi H2O dan O2. Ketiga kultur starter tersebut termasuk dalam kelompok katalase negatif. Bakteri patogen S. aureus
ATCC 25923, E. coli ATCC 25922, dan S. TyphimuriumATCC 14028 termasuk ke b
a
c
30 dalam kelompok katalase positif atau menghasilkan enzim katalase, karena pada saat ditetesi dengan H2O2 3%, bakteri tersebut menghasilkan gelembung gas oksigen (O2).
Gas oksigen (O2) dalam lingkungan bakteri anaerobik akan menyebabkan racun karena oksigen akan bereaksi dengan flavoprotein yang menghasilkan senyawa H2O2 dan O2. Bakteri yang tergolong anaerobik tidak mempunyai enzim katalase ataupun enzim peroksidase yang mampu menginaktifkan atau memecah H2O2 H2O + O2. Keberadaan oksigen dalam lingkungan bakteri anaerobik fakultatif tidak mempengaruhi hidup bakteri tersebut. Bakteri anaerobik fakultatif meskipun tidak mempunyai enzim katalase, tetapi bakteri ini mempunyai enzim peroksidase sehingga H2O2 yang terbentuk akan diuraikan menjadi H2O dan O2. Oleh sebab itu, bakteri anaerobik fakultatif tidak terpengaruh oleh ada tidaknya oksigen (Fardiaz, 1992).
Penelitian Utama
Karakteristik Pertumbuhan Kultur Starter BAL Indigenous Kefir pada pH Berbeda
Aktivitas mikroba dipengaruhi oleh beberapa faktor lingkungan salah satunya adalah pH, yaitu merupakan suatu satuan ukur yang menguraikan derajat tingkat kadar keasaman atau kebasaan dari ion hidrogen dari suatu larutan (Volk dan Wheeler, 1993). Beberapa kriteria penting karakter fisiologi untuk seleksi kelayakan BAL sebagai bakteri probiotik antara lain adalah kemampuan pertumbuhan dan resistensi bakteri pada pH rendah yang menggambarkan kondisi lingkungan lambung (Hardiningsih et al., 2006). Kondisi saluran pencernaan erat kaitanya dengan pH
yang berbeda. Salah satu faktor yang paling menonjol dalam penentuan pH saluran pencernaan adalah keasaman lambung. Kondisi keasaman lambung berfungsi sebagai pintu gerbang pertama untuk melakukan seleksi mikroba sebelum masuk ke usus.
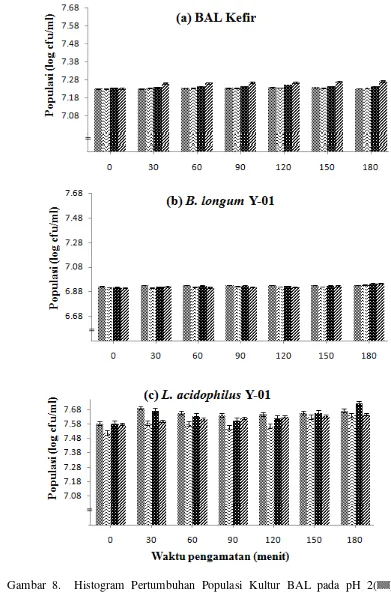
Pengujian ketahanan BAL indigenous kefir pada pH berbeda dilakukan pada
31 dalam usus halus (Mitsuoka, 1990). Kemampuan BAL kefir, B. longum Y-01 dan L. acidophilus Y-01 tumbuh atau bertahan pada taraf pH yang berbeda selama 180 menit dapat dilihat Tabel 5, sedangkan perubahan populasi selama perlakuan dapat dilihat pada Gambar 8.
Tabel 5. Jumlah Populasi BAL pada pH yang Berbeda
No. Lama
Jumlah populasi BAL yang diperoleh sebelum inkubasi (P0) pada kondisi pH 2,0 dan setelah inkubasi selama 180 menit (P180) menunjukkan bahwa BAL kefir, B.
longum Y-01 dan L. acidophilus Y-01 mampu bertahan pada kondisi lingkungan
32 pengujian terhadap kemampuan bertahan hidup pada kondisi pH 2, BAL asal kefir,
B. longum Y-01 dan L. acidophilus Y-01 dapat dikatakan berpotensi lebih lanjut untuk dikembangkan sebagai bakteri probiotik.
Serupa dengan kondisi pada pH 2, BAL asal kefir juga mampu mempertahankan jumlah populasi ketika ditumbuhkan dalam media dengan pH 2,5. Surono (2004) menyatakan, bahwa kondisi pada pH 2,5 merupakan kondisi pH ketika enzim pepsin disekresikan dalam lambung untuk menghidrolisis protein. Populasi BAL asal kefir dan L. acidophilus Y-01 mampu bertahan pada kisaran 7,0
log cfu/ml selama inkubasi pada kondisi pH 2,5 (P>0,05), sedangkan B. longum
Y-01 selain mampu bertahan juga dapat tumbuh dan populasinya nyata meningkat sebesar 0,26 log cfu/ml (P<0,05) selama pengujian 180 menit. Zavaglia et al. (1998) dalam penelitiannya menunjukkan bahwa uji ketahanan isolat klinis Bifidobacteria
pada pH rendah menghasilkan 11 dari 25 isolat klinis Bifidobacteria berhasil hidup dalam kondisi pH rendah.
Kondisi pada pH 3,2 merupakan kondisi ketika asam lambung akan disekresikan ke dalam lambung manusia yang didalamnya terdapat makanan (Mitsouka, 1990). Kondisi pH 3,2 mampu mempertahankan populasi BAL kefir dan
B. longum Y-01 > 7,0 log cfu/ml (P>0,05) setelah inkubasi selama 180 menit, sedangkan pada L. acidophilus Y-01 menunjukkan kemampuan bertahan dan mampu
bermultiplikasi yang ditunjukkan oleh peningkatkan jumlah populasi sebanyak 0,31 log cfu/ml (P<0,05).
Hasil pengujian pada kondisi pH 2,5 dan 3,2 menunjukkan adanya perbedaan kemampuan tumbuh antara BAL. B. longum Y-01 mampu bertahan dan tumbuh
pada kondisi pH 2,5 sedangkan L. acidophilus Y-01 mampu bertahan dan tumbuh
pada kondisi pH 3,2. Perbedaan tersebut disebabkan karakter fisiologis dari masing-masing bakteri yang berbeda-beda. Perbedaan ketahanan membran sel bakteri terhadap kerusakan akibat terjadinya penurunan pH ekstraseluler menyebabkan keragaman ketahanan sel. Hardiningsih et al. (2006) memaparkan bahwa strain
bakteri yang diisolasi dari indigenous mikroflora dari satu spesies tidak sama dengan spesies lain, meskipun Lactobacillus dan Bifidobacterium sama-sama diisolasi dari host yang sama, tetapi bakteri-bakteri tersebut mempunyai variasi biotypes yang