1
KARAKTERISTIK PERTUMBUHAN BAKTERI ASAM LAKTAT
INDIGENOUS SUSU SAPI SEGAR SEBAGAI KANDIDAT
BAKTERI PROBIOTIK DALAM SALURAN
PENCERNAAN in vitro
SKRIPSI
YOSHEFHIN MAHARANI ROSARI
DEPARTEMEN ILMU PRODUKSI DAN TEKNOLOGI PETERNAKAN FAKULTAS PETERNAKAN
i
RINGKASAN
Yoshefhin Maharani Rosari. D14061995. 2011. Karakteristik Pertumbuhan Bakteri Asam Laktat Indigenous Susu Sapi Segar sebagai Kandidat Bakteri Probiotik dalam Saluran Pencernaan in vitro. Skripsi. Departemen Ilmu
Produksi dan Teknologi Peternakan. Fakultas Peternakan. Institut Pertanian Bogor.
Pembimbing Utama : Dr. Ir. Rarah Ratih Adjie Maheswari, DEA Pembimbing Anggota : Prof. Dr. Ir. Cece Sumantri, MAgrSc
Pangan fungsional berupa yogurt probiotik berfungsi sebagai makanan yang memberikan efek kesehatan, terutama dalam saluran pencernaan, karena dapat menyeimbangkan mikroflora usus terutama antara bakteri menguntungkan dan bakteri patogen. Salah satu syarat bakteri asam laktat dikelompokkan sebagai probiotik adalah kemampuannya bertahan dalam kondisi saluran pencernaan. Pengujian secara in vitro untuk mengetahui ketahanan bakteri asam laktat dalam
kondisi pH rendah, keberadaan garam empedu atau antibiotik dan aktivitas antagonistiknya terhadap bakteri patogen telah banyak dilakukan untuk penentuannya sebagai bakteri probiotik.
Tujuan penelitian ini adalah mempelajari karakteristik bakteri asam laktat
indigenous susu sapi segar sebagai kandidat bakteri probiotik. Penelitian berlokasi Laboratorium Mikrobiologi Hasil Ternak, Bagian Teknologi Hasil Ternak dan Laboratorium Terpadu Departemen Ilmu Produksi dan Teknologi Peternakan, Fakultas Peternakan dan Laboratorium Kimia Analitik Fakultas MIPA, IPB. Isolat bakteri asam laktat asal susu segar yang digunakan adalah Streptococcus thermophilus S-01 dan Lactobacilus bulgaricus S-01, serta asal produk olahan susu
sapi Bifidobacterium longum Y-01 dan Lactobacillus acidophilus Y-01 sebagai mix culture yang semuanya merupakan koleksi Bagian Teknologi Hasil Ternak
(Maheswari, 2008). Bakteri patogen indikator yang digunakan adalah Escherichia coli ATCC 25922, Salmonella Typhimurium ATCC 14028 dan Stapylococcus aureus ATCC 25923.
Penelitian yang dilaksanakan selama tujuh bulan sejak Maret hingga September, dibagi dalam dua tahap. Tahap pertama adalah penelitian pendahuluan yang meliputi pemeriksaan kultur starter bakteri asam laktat dan bakteri patogen serta penentuan populasi bakteri asam laktat dan bakteri patogen indikator. Penelitian utama meliputi pengujian 1) karakteristik pertumbuhan S. thermophilus S-01, L. bulgaricus S-01, B. longum Y-01 dan L. acidophilus Y-01 pada media dengan :
a) pH saluran pencernaan yang berbeda (2, 2,5, 3,2 dan 7,2); b) garam empedu (0,3%
oxgall) dan c) antibiotik (amoksisilin dan kloramfenikol) serta 2) karakteristik antagonistik kultur starter terhadap bakteri patogen (E. coli ATCC 25922,
S.Typhimurium ATCC 14028 dan S. aureus ATCC 25923) dengan metode sumur
difusi agar. Rancangan percobaan yang digunakan adalah Rancangan Acak Lengkap dan Analisis Uji T.
Hasil pengujian menunjukkan bahwa bakteri asam laktat L. bulgaricus S-01,
B. longum Y-01 dan L. acidophilus Y-01 mampu bertahan dalam media yang
ii hidup sebesar 71-110%. S. thermophilus tidak mampu bertahan dalam pH 2 (P<0,05) dan 2,5 (P<0,01) terlihat dari tidak adanya pertumbuhan populasi setelah inkubasi pada masing-masing kondisi. Kedua bakteri asam laktat juga terhambat pertumbuhannya dalam media dengan garam empedu, ditunjukkan oleh penurunan populasi yang nyata berbeda (P<0,05). B. longum Y-01 dan L. acidophilus Y-01
mampu bertahan dan tumbuh dalam semua kondisi pengujian, terlihat dari jumlah populasi sebelum dan sesudah perlakuan yang mengalami kenaikan (P<0,05).
S.thermophilus S-01, L. bulgaricus S-01, B. longum Y-01 dan L. acidophilus Y-01
juga memproduksi antimikroba yang mempunyai aktivitas antagonistik terhadap pertumbuhan bakteri patogen (E. coli ATCC 25922, S. Typhimurium ATCC 14028
dan S. aureus ATCC 25923), ditunjukkan oleh penghambatannya berupa zona bening di sekitar sumur konfrontasi. Bakteri asam laktat indigenous susu sapi segar maupun asal olahan susu sapi mempunyai karakterisitik kemampuan bertahan dalam berbagai kondisi saluran pencernaan in vitro dan menghasilkan substrat antimikroba
yang mampu menghambat bakteri patogen, sehingga dapat digolongkan sebagai kandidat bakteri probiotik.
iii
ABSTRACT
Growth Characteristics of Lactic Acid Bacteria Indigenous Cow’s Milk as Candidates of Probiotic Bacteria at in vitro Gastrointestinal Tract Condition
Rosari, Y.M., R. R. A. Maheswari., C. Sumantri
Functional foods in the form of probiotic yogurt serves as a food that provides health effects, especially in the digestive tract. This probiotic yogurt can maintain the balance the intestinal microflora, especially between beneficial and pathogen bacterials. Terms of the probiotic bacteria concerned to lactic acid bacteria that were able to survive at the digestive tract. The purpose of this study was to investigate the characteristics of lactic acid bacteria indigenous cow’s milk as a candidate of probiotic bacteria. Resistancy of lactic acid bacteria through different pH conditions, in presence of bile salts or antibiotics, were tested in the media that was conditioned as human digestive tract (in vitro). Lactic acid bacteria resistance was seen through a
comparison of the original population before the treatment and the population after treatment. The results of this study, bacteria L. acidophilus Y-01, B. longum Y-01
and L. bulgaricus S-01 can be used as candidates probiotic bacteria because it survived in a pH condition (pH 2, 2,5, 3,2 and 7,2), the condition of bile salts, and antibiotics. Although the population of S. thermophilus S-01 and L bulgaricus S-01
decreased after treatment, all four of these bacteria also produce antimicrobial evidenced by the clear zone that formed around the supernatant. This antimicrobial activity showed inhibition to the growth pathogenic bacteria (E. coli, S.
Typhimurium, and S. aureus).
iv
KARAKTERISTIK PERTUMBUHAN BAKTERI ASAM LAKTAT
INDIGENOUS SUSU SAPI SEGAR SEBAGAI KANDIDAT
BAKTERI PROBIOTIK DALAM SALURAN
PENCERNAAN in vitro
YOSHEFHIN MAHARANI ROSARI
D14061995
Skripsi ini merupakan salah satu syarat untuk memperoleh gelar Sarjana Peternakan pada
Fakultas Peternakan Institut Pertanian Bogor
DEPARTEMEN ILMU PRODUKSI DAN TEKNOLOGI PETERNAKAN FAKULTAS PETERNAKAN
v Judul : Karakteristik Pertumbuhan Bakteri Asam Laktat Indigenous Susu Sapi Segar sebagai Kandidat Bakteri Probiotik dalam Saluran Pencernaan in vitro.
Nama : Yoshefhin Maharani Rosari
NIM : D14061995
Menyetujui,
Pembimbing Utama, Pembimbing Anggota,
(Dr. Ir. Rarah R. A. Mahewari, DEA) (Prof. Dr. Ir. Cece Sumantri, MAgrSc) NIP : 19620504 198703 2 002 NIP : 19591212 198603 1 004
Mengetahui: Ketua Departemen,
(Prof. Dr. Ir. Cece Sumantri, MAgrSc) NIP : 19591212 198603 1 004
vi
RIWAYAT HIDUP
Penulis dilahirkan di Temanggung, Jawa Tengah pada tanggal 16 Agustus 1988, dari pasangan Bapak Sugiyono dan Ibu Jeani S. Abbadi. Penulis merupakan anak bungsu dari dua bersaudara.
Pendidikan dasar diselesaikan pada tahun 2000 di SD Strada Budi Luhur II Bekasi, pendidikan lanjutan tingkat pertama diselesaikan tahun 2003 di SLTP Strada Budi Luhur Bekasi dan pendidikan menengah atas diselesaikan pada tahun 2006 di SMAN 2 Bekasi. Penulis diterima sebagai mahasiswa Institut Pertanian Bogor tahun 2006 melalui jalur Seleksi Penerimaan Mahasiswa Baru (SPMB) dan diterima sebagai mahasiswa Departemen Ilmu Produksi dan Teknologi Peternakan tahun 2007.
vii
KATA PENGANTAR
Puji syukur Penulis panjatkan kepada Tuhan Yesus Kristus dan Bunda Maria atas segala berkat-Nya, sehingga Penulis memperoleh kemudahan dan kelancaran dalam menyelesaikan penelitian dan penyusunan skripsi ini. Tugas akhir yang berjudul “Karakteristik Pertumbuhan Bakteri Asam Laktat Indigenous Susu Sapi Segar sebagai Kandidat Bakteri Probiotik dalam Saluran Pencernaan in
vitro ”, dipilih sebagai salah satu syarat untuk memperoleh gelar Sarjana Peternakan
di Fakultas Peternakan, Institut Pertanian Bogor.
Perubahan banyak dijumpai dalam bidang kesehatan dan pangan, salah satunya adalah munculnya konsep tentang pangan fungsional, yaitu pangan yang tidak hanya mengenyangkan bagi konsumen, tetapi juga memberikan efek yang menguntungkan terutama dalam menyeimbangkan mikroflora usus, yaitu dengan menekan populasi bakteri patogen dan menstimulasi pertumbuhaan bakteri yang menguntungkan dalam saluran pencernaan. Salah satu pangan fungsional yang mulai disukai dan banyak ditawarkan kepada masyarakat adalah yogurt probiotik. Pembuatan yogurt probiotik banyak terkendala oleh ketergantungan kultur starter yang harus diimpor. Ketersediaan kultur starter di dalam negeri akan membantu pengembangan berbagai produk susu fermentasi, tidak hanya yogurt probiotik.
Penelitian ini mempelajari tentang karakteristik isolat bakteri asam laktat asal susu sapi segar yang diidentifikasi sebagai S. thermophilus S-01 dan L. bulgaricus S-01 yang digunakan sebagai kultur starter yogurt, terhadap kemungkinannya digunakan juga sebagai bakteri probiotik, untuk menghasilkan bioyogurt sebagai pangan fungsional. Isolat asal produk olahan susu sapi yang diidentifikasi sebagai B. longun Y-01 dan L. acidophilus Y-01 digunakan sebagai kultur starter probiotik
viii Skripsi ini mungkin masih belum sempurna, mengingat masih ada beberapa karakteristik lain dari bakteri asam laktat untuk dikelompokkan sebagai probiotik, tetapi semoga karya kecil ini dapat bermanfaat dan menambah pengetahuan bagi penulis sendiri dan rekan-rekan yang membaca. Semoga skripsi ini pun menjadi berkat bagi kita semua. Tuhan Yesus memberkati.
ix
Toleransi Isolat Bakteri Asam Laktat terhadap Garam Empedu ... 7
x
Penentuan Populasi Bakteri Asam Laktat ... 14
Metode Hitungan Cawan ... ... 14
Uji Kemampuan Antimikroba Bakteri Asam Laktat terhadap Bakteri Patogen ... ... 18
Persiapan Filtrat Bebas Sel ... 18
Persiapan Bakteri Indikator ... 19
Konfrontasi Filtrat Bebas Sel dengan Bakteri Indikator ... ... 19
Rancangan Percobaan... ... 21
HASIL DAN PEMBAHASAN ... ... 23
Konfirmasi Kultur Starter Indigenous Susu Sapi Segar dan Bakteri Patogen Indikator ... ... 23
Ketahanan Kultur Starter BAL Indigenous Susu Sapi Segar pada pH Berbeda ... ... 26
Ketahanan Kultur Starter BAL Indigenous Susu Sapi Segar pada Garam Empedu ... ... 33
Ketahanan Kultur Starter BAL Indigenous Susu Sapi Segar pada Antibiotik ... ... 37
Populasi BAL Indigenous Susu Sapi Segar pada Amoksisilin ... ... 37
Populasi BAL Indigenous Susu Sapi Segar pada Kloramfenikol ... ... 39
Aktivitas Antimikroba Bakteri Asam Laktat terhadap Bakteri Patogen ... ... 42
Aktivitas Antagonistik BAL Indigenous Susu Sapi Segar terhadap Salmonella Typhimurium ATCC 14028 ... 43
Aktivitas Antagonistik BAL Indigenous Susu Sapi Segar terhadap Escherichia coli ATCC 25922... 45
Aktivitas Antagonistik BAL Indigenous Susu Sapi Segar terhadap Staphylococcus aureus ATCC 25923 ... 47
KESIMPULAN DAN SARAN ... ... 51
Kesimpulan... ... 51
xi UCAPAN TERIMAKASIH ... ... 52 DAFTAR PUSTAKA ... ... 53 LAMPIRAN ... ... ... 57
DAFTAR TABEL
Nomor Halaman
1. Standarisasi Bakteri Asam Laktat Indigenous Susu Sapi Segar
dan Produk Olahannya ... ... ... 16 2. Karakteristik Kultur Starter Indigenous Susu Sapi Segar dan Bakteri
Patogen ... ... ... 23 3. Jumlah Populasi BAL Indigenous Susu Sapi Segar pada pH Berbeda .. 27
4. Jumlah Populasi BAL Indigenous Susu Sapi Segar pada Garam
Empedu ... ... ... 33 5. Jumlah Populasi BAL Indigenous Susu Sapi Segar pada Amoksisilin .. 37 6. Jumlah Populasi BAL Indigenous Susu Sapi Segar pada
Kloramfenikol ... ... ... 39 7. Aktivitas Antagonistik BAL Indigenous Susu Sapi Segar terhadap
Salmonella Typhimurium ATCC 14028 ... ... ... 43
8. Aktivitas Antagonistik BAL Indigenous Susu Sapi Segar terhadap Escherichia coli ATCC 25922 ... ... ... 45 9. Aktivitas Antagonistik BAL Indigenous Susu Sapi Segar terhadap
xii
DAFTAR GAMBAR
Nomor Halaman
1. Pengukuran Diameter Zona Bening... ... ... 19 2. Diagram Alir Penelitian ... ... ... 20 3. Bentuk dan Morfologi BAL Indigenous Susu Sapi Segar Hasil
Pewarnaan Gram ... ... ... 25 4. Bentuk dan Morfologi Bakteri Patogen Hasil Pewarnaan Gram . ... 26 5. Kurva Pertumbuhan Bakteri Asam Laktat Indigenous Susu Sapi
Segar terhadap pH Berbeda ... ... ... 32 6. Kurva Pertumbuhan Bakteri Asam Laktat Indigenous Susu Sapi
Segar terhadap Garam Empedu ... ... ... 35 7. Kurva Pertumbuhan Bakteri Asam Laktat Indigenous Susu Sapi
xiii
DAFTAR LAMPIRAN
Nomor Halaman
1. Analisis Ragam S. thermophilus S-01 pada pH Berbeda ... 58
2. Analisis Ragam L. bulgaricus Y-01 pada pH Berbeda ... 58
3. Analisis Ragam B. longum Y-01 pada pH Berbeda ... 59
4. Analisis Ragam S. L. acidophilus Y-01 pada pH Berbeda ... 60
5. Analisis Ragam Bakteri Asam Laktat pada Garam Empedu... 60
6. Analisis Ragam S. thermophilus S-01 pada Antibiotik... 61
7. Analisis Ragam L. bulgaricus S-01 pada Antibiotik ... 61
8. Analisis Ragam B. longum Y-01 pada Antibiotik ... 62
9. Analisis Ragam L. acidophilus Y-01 pada Antibiotik ... 62
10. Uji non Parametrik Kruskal-Wallis Aktivitas Antimikroba BAL terhadap Salmonella Typhimurium ATCC 14028 ... 62
11. Uji non Parametrik Kruskal-Wallis Aktivitas Antimikroba BAL terhadap Escherichia coli ATCC 25922 ... 62
12. Uji non Parametrik Kruskal-Wallis Aktivitas Antimikroba BAL terhadap Stapylococcus aureus ATCC 25923 ... 63
13. Zona Bening yang Terbentuk sebagai Aktivitas Antimikroba BAL Indigenous Susu Sapi Segar terhadap Bakteri Patogen ... 63
1
PENDAHULUAN
Latar Belakang
Pola pikir dan gaya hidup masyarakat dewasa ini sudah mengalami perubahan, seiring dengan perkembangan ilmu pengetahuan dan teknologi. Perubahan banyak dijumpai dalambidang kesehatan dan pangan, yang salah satunya memunculkan konsep adanya pangan fungsional, yaitu pangan yang tidak hanya mengenyangkan bagi konsumen, tetapi juga memberikan efek yang menguntungkan terutama dalam menyeimbangkan mikroflora usus, yaitu dengan menekan populasi bakteri patogen dan menstimulasi pertumbuhan bakteri yang menguntungkan dalam saluran pencernaan. Salah satu pangan fungsional yang mulai disukai dan banyak ditawarkan kepada masyarakat adalah yogurt probiotik. Konsumsi yogurt probiotik secara kontinyu merupakansalah satu upaya dalam meningkatkan kesehatan.
Yogurt adalah produk hasil fermentasi susu dengan menggunakan bakteri asam laktat sebagai kulturnya yaitu Streptococcus salivarius ssp. thermophilus (S.thermophilus) dan Lactobacillus delbruekii ssp. bulgaricus (L. bulgaricus).
Yogurt akan meningkat manfaatnya dengan penambahan bakteri probiotik, yaitu mikroorganisme yang dimanfaatkan dalam menyeimbangkan populasi mikroba dalam usus. Bakteri probiotik yang umum digunakan dalam susu fermentasi adalah
Bifidobacterium longum dan Lactobacillus acidophilus.
S. thermophilus S-01 dan L. bulgaricus S-01 merupakan bakteri asam laktat
hasil isolasi dari susu sapi segar. Bakteri asam laktat ini telah digunakan sebagai kultur starter untuk menghasilkan yogurt, sehingga menarik untuk selanjutnya dipelajari potensinya sebagai bakteri probiotik. B. longum Y-01 dan L. acidophilus Y-01 merupakan bakteri asam laktat yang diisolasi dari produk olahan susu sapi dan dapat digunakan sebagai kultur campuran untuk menghasilkan bioyogurt (Maheswari, 2008). Studi tentang kedua bakteri ini telah banyak membuktikan kemampuannya sebagai bakteri probiotik. Perbedaan galur dan sumber isolasi bakteri dapat membedakan mekanisme dan metabolisme kerja setiap bakteri dalam bertahan dalam kondisi eksternal yang berbeda, sehingga menarik untuk diteliti lanjut karakteristik S. thermophilus S-01, L. bulgaricus S-01, B. longum Y-01 dan L. acidophilus Y-01 untuk memenuhi ketentuan sebagai probiotik, yang meliputi
2 khususnya pada kondisi lambung dan usus melaluipengujian ketahanan bakteri asam laktat tersebutterhadap pH rendah terutama kondisi seperti dalam lambung dan usus, ketahanan pada garam empedu, ketahanan terhadap antibiotik dan kemampuan memproduksi antimikroba terhadap bakteri patogen.
Tujuan
Penelitian ini bertujuan untuk mempelajari karakteristik isolat bakteri asam laktat S. thermophilus S-01, L. bulgaricus S-01, B. longum Y-01 dan L. acidophilus Y-01 sebagai kandidat bakteri probiotik, yang mempunyai kemampuan tumbuh pada
kondisi lingkungan dengan pH rendah atau mengandung garam empedu, tahan terhadap antibiotik, serta mempunyai kemampuan memproduksi antimikroba yang aktif terhadap bakteri patogen, diantaranya Escherichia coli ATCC 25922, Staphylococcus aureus ATCC 25923 dan Salmonella enteridis serotipeTyphimurium
ATCC 14028.
3
TINJAUAN PUSTAKA
Yogurt dan Kultur Starter Yogurt
Yogurt berdasarkan SNI 01-2981-1992 adalah produk yang diperoleh dari susu yang telah dipasteurisasi dan difermentasi dengan bakteri tertentu sehingga diperoleh keasaman, bau dan rasa khas, dengan atau tanpa penambahan bahan lain yang diizinkan (BSN, 1992). Yogurt adalah susu asam yang dihasilkan dari fermentasi susu oleh campuran bakteri asam laktat termofilik yaitu Lactobacillus delbrueckii ssp. bulgaricus dan Streptococcus salivarius ssp. thermophilus. Kedua bakteri ini bersama-sama membentuk rasa asam, kekentalan, memperbanyak asam laktat dan intensitas flavor (Rahman et al., 1992). Bakteri asam laktat sering
digunakan untuk menghasilkan produk akhir dengan karakteristik tertentu. Yogurt adalah salah satu pangan yang mengandung probiotik, dengan syarat produk akhir yogurt harus mengandung bakteri asam laktat ≥ 108 organisme/g (Adolfsson et al.,
2004).
Kultur starter merupakan bagian yang penting dalam pembuatan yogurt. Aspek yang harus diperhatikan untuk suatu mikroorganisme digunakan sebagai kultur yaitu bebas dari kontaminasi, pertumbuhan yang cepat, menghasilkan flavor
yang khas, tekstur dan bentuk yang bagus, tahan terhadap bakteriofage dan juga tahan terhadap antibiotik. Kultur starter yogurt terdiri atas bakteri asam laktat yang berperan dalam pengasaman dan fermentasi susu. Lactobacillus delbrueckii ssp. bulgaricus dan Streptococcus salivarius ssp. thermophilus merupakan bakteri asam
laktat homofermentatif yang terutama memproduksi asam laktat. Perbandingan yang baik antara bakteri ini untuk memproduksi yogurt adalah 1:1 (Rahman et al., 1992).
Lactobacillus delbrueckii ssp. bulgaricus dan Streptococcus salivarius ssp. thermophilus biasa digunakan dalam produk fermentasi. Kedua bakteri asam laktat
ini populasinya dalam saluran pencernaan manusia dan hewan masih sangat rendah jika dibandingkan dengan bakteri probiotik lainnya (Campo et al., 2005).
4 Robinson, 2008). Kultur starter L. bulgaricus sering digunakan dalam kombinasi dengan starter bakteri lain untuk memproduksi yogurt. L. bulgaricus bersifat
homofermentatif, memecah gula laktosa terutama menjadi asam laktatyang termasuk asam laktat D(-). L. bulgaricus akan menyediakan peptida dan asam amino yang
menstimulir pertumbuhan S. thermophilus, mengingat bakteri ini kemampuan proteolitiknya lebih rendah bila dibandingkan dengan L. bulgaricus (Walstra et al.,
2006; Rahman et al., 1992).
Streptococcus salivarius ssp. thermophilus (S. thermophilus). S. thermophilus
dibedakan dari Genus Streptococcus lainnya berdasarkan pertumbuhannya pada suhu
45oC, tidak tumbuh pada 10oC, berbentuk kokus dengan diameter <1µm, dengan bentuk berpasangan atau membentuk rantai pendek dan panjang, termasuk kelompok Gram positif, tidak berspora dan dengan pH optimal untuk pertumbuhannya adalah 6,5. S. thermophilus tidak mati dengan pemanasan suhu rendah karena bersifat
termofilik. S. thermophilus tidak membutuhkan oksigen, meskipun tidak mati dengan adanya oksigen dan bersifat homofermentatif (Tamime dan Robinson, 2008; Walstra et al., 2006).
S. thermophilus menghasilkan asam folat yang dibutuhkan oleh L. bulgaricus,
yang sebagai imbalannya menghasilkan asam amino dan peptida yang dibutuhkan oleh S. thermophilus. S. thermophilus dan L. bulgaricus pada yogurt akan saling mendukung dalam menghasilkan asam laktat dan aroma. S. thermophilus menghasil-kan asam laktat, asam piruvat, asam format serta asam folat yang menstimulir pertumbuhan L. bulgaricus (Surono, 2004; Silva et al., 2005).
Bakteri Probiotik
Bakteri probiotik merupakan mikroorganisme hidup yang dapat dimanfaatkan untuk meningkatkan keseimbangan populasi mikroba di dalam usus. Manfaat pro-biotik biasa dikaitkan dengan produk susu, yang secara nyata memberikan efek positif untuk kesehatan manusia, terutama dalam saluran pencernaan (Nowroozi et al., 2004). Kelompok Lactobacilli seperti L. bulgaricus, L. acidophilus dan
kelompok Bifidobacterium seperti B. bifidum dan B. longum merupakan strain yang
5 Naidu dan Clemens (2000) menambahkan bahwa suatu bakteri dapat dikatakan sebagai bakteri probiotik apabila memenuhi beberapa kriteria, yaitu 1) bersifat nonpatogenik dan mewakili mikrobiota normal usus dari inang tertentu serta masih aktif pada kondisi asam lambung dan konsentrasi garam empedu yang tinggi dalam usus halus, 2) mampu tumbuh dan melakukan metabolisme dengan cepat dan terdapat dalam jumlah yang banyak dalam usus, 3) dapat mengkolonisasi beberapa bagian dari saluran usus untuk sementara, 4) dapat memproduksi asam-asam organik secara efisien dan memiliki sifat antimikroba terhadap bakteri merugikan serta 5) mudah diproduksi, mampu tumbuh dalam sistem produksi skala besar dan hidup selama kondisi penyimpanan. Usus kecil dan usus besar adalah tempat yang paling banyak ditemukan bakteri probiotik, di mana mungkin probiotik juga menemukan lingkungan yang lebih menguntungkan.
Bifidobacterium longum. Beberapa jenis dari genus Bifidobacterium dianggap
probiotik dan digunakan sebagai bahan aktif dalam bahan dasar produk-produk susu fungsional. Mikroorganisme dari genus Bifidobacterium dapat mengkolonisasi usus dan merupakan komponen penting dari mikrobiota usus manusia, yang terdapat dalam konsentrasi 109-1010 sel per gram tinja. Bakteri ini harus mampu mengatasi hambatan biologis yang mencakup asam di lambung dan empedu dalam usus untuk mencapai kolonisasi ini (Madiedo et al., 2005).
Genus Bifidobacterium yang banyak digunakan sebagai probiotik adalah B. longum, B. animalis, B. adolescentes, B. infantis, B. thermophilum dan B. bifidum.
Bakteri B. longum memiliki bentuk batang, anaerob strict, Gram positif, tidak berspora, pertumbuhan optimal pada suhu 36-37oC dan menghasilkan asam laktat dan asam asetat (Naidu dan Clemens, 2000).
Lactobacillus acidophilus. Tamime dan Robinson (2008) mengemukakan bahwa L. acidophilus merupakan bakteri berbentuk batang, termasuk famili Lactobacillaceae
dan genus Lactobacillus. Bakteri ini tergolong bakteri Gram positif dan tidak
membentuk spora. L. acidophilus merupakan Lactobacili yang bersifat obligat
homofermentatif dan non motil.
Suhu optimum pertumbuhan L. acidophilus adalah 35-45oC, tidak tumbuh
5,5-6 6,0 serta memproduksi asam laktat sebesar 0,3%–1,9%. L. acidophilus mempunyai kemampuan koagregasi yang sangat baik setelah diinkubasi selama 25 jam. Koagregasi berperanan penting dalam usaha mencari bakteri probiotik yang baik karena dapat mencegah infeksi bakteri patogen (Natalia dan Priadi, 2006).
Waktu transit makanan melalui perut manusia adalah sekitar 90 menit. Menurut Chou dan Weimer (1999), beberapa strain L. acidophilus pada pH 3,5 hanya
dapat bertahan dalam jangka waktu yang pendek, hal ini dapat dilihat dari pertumbuhannya yang sedikit setelah diinkubasi selama 90 menit. L. acidophilus
menunjukkan kemampuannya untuk tumbuh denganpesat dalam media MRSB pada pH 3,5 yang mengandung 0,2% garam empedu. Isolat Lactobacillus spp. yang
diisolasi dari berbagai pangan fermentasi asalIndonesia, dinilai dapat bertahan hidup dan resisten terhadap pH rendah (Hardiningsih et al., 2005).
Bakteri Asam Laktat
Mikroba yang paling banyak digunakan dalam fermentasi susu adalah bakteri asam laktat. Menurut Surono (2004), bakteri asam laktat adalah bakteri Gram positif, bersifat katalase negatif, tidak mempunyai cytochrome, yang berbentuk batang atau kokus, tidak membentuk spora dan ada yang berbentuk rantai tunggal. Secara umum, bakteri asam laktat mempunyai toleransi terhadap konsentrasi asam tinggi. Bakteri asam laktat memerlukan nutrisi yang sangat kompleks, karena itu umumnya memerlukan habitat yang kaya akan nutrisi seperti susu dan daging.
Bakteri asam laktat yang bersifat sebagai probiotik pada pencernaan manusia, merupakan mikroflora normal usus, terdiri atas Bifidobacteria dan L. acidophilus. Genera Bifidobacteria dan Lactobacillus merupakan konsumsi probiotik yang utama
7 mempunyai ketahanan hidup yang lebih tinggi terhadap asam lambung daripada kultur bakteri lain, misalnya L. bulgaricus dan S. thermophilus. Meydani dan Ha
(2000) menyatakan, bahwa dari empat spesies Bifidobacterium (B. infantis, B. bifidum, B. adolescentis dan B. longum), B. longum adalah yang paling tahan
terhadap asam lambung.
Toleransi Isolat Bakteri Asam Laktat terhadap Asam
Ketahanan terhadap kondisi asam merupakan syarat penting bakteri asam laktat untuk dapat dikelompokkan sebagai bakteri probiotik. Jika isolat bakteri asam laktat masuk ke dalam saluran pencernaan, maka harus mampu bertahan dalam lambung yang mempunyai pH sekitar 2,5 (Jacobsen et al., 1999), bahkan bila
lambung dalam keadaan kosong akan mempunyai pH sekitar 1,5–2. Menurut Mitsuoka (1990), nilai pH lambung dalam keadaan normal berkisar 3,2-3,5.
Chou dan Weimer (1999) menyatakan, bahwa waktu yang diperlukan mulai dari bakteri masuk sampai keluar lambung adalah sekitar 90 menit. Jadi bakteri asam laktat yang diseleksi untuk digunakan sebagai probiotik harus mampu bertahan dalam keadaan asam lambung selama sedikitnya 90 menit. Toleransi yang tinggi dari bakteri asam laktat terhadap asam disebabkan oleh kemampuannya untuk mempertahankan pH sitoplasma dalam kondisi lebih basa daripada pH ekstraseluler. Menurut Siegumfeldt et al. (2000), pada bakteri asam laktat terjadi perubahan secara dinamis dari pH intraseluler seiring dengan terjadinya penurunan pH ekstraseluler, sehingga tidak terjadi gradien proton yang besar. Tiap galur bakteri memiliki ketahanan yang berbeda terhadap asam atau pH rendah, sebagai contohnya
Lactobacillus dan Bifidobacteria adalah lebih toleran terhadap pH rendah
dibandingkan Lactococci dan Streptococci (Farida, 2006; Zinedine dan Faid, 2007).
Toleransi Isolat Bakteri Asam Laktat terhadap Garam Empedu
8 dan disekresikan ke dalam kantung empedu sebagai asam empedu terkonjugasi. Asam empedu di dalam kantung empedu dilepaskan ke dalam lumen duodenum dalam bentuk misel dengan asam lemak dan gliserol yang dihasilkan oleh pencernaan lipase pankreatik. Mekanisme saat asam empedu diserap dalam usus kecil dan kolon, lalu disintesa kembali dan disekresikan lagi dikenal sebagai sirkulasi hati (Corzo dan Gilliland, 1999).
Menurut Madiedo et al. (2005), garam empedu yang disintesis dalam hati dari
kolesterol dan disekresikan sebagai konjugat asam amino ke dalam duodenum, yang merupakan tempat memfasilitasi penyerapan lemak. Senyawa empedu bersifat racun untuk sel-sel mikroba, sehingga mikrobiota gastrointestinal asli harus telah mengembangkan strategi untuk mempertahankan diri terhadap aksi beracun dari empedu.
Seperti halnya ketahanan terhadap asam, menurut Jacobsen et al. (1990),
semua mikroba yang berhasil hidup setelah ditumbuhkan dalam MRSA yang ditambah 0,3% oxgall, dinyatakan bersifat tahan terhadap garam empedu. Konsentrasi garam empedu sebesar 0,3% merupakan konsentrasi yang kritikal, serta merupakan nilai yang cukup tinggi untuk melakukan seleksi terhadap isolat yang resisten terhadap garam empedu. Ray (2004) dan Drouault et al. (1999) melaporkan, bahwa jumlah bakteri asam laktat yang terdapat pada jejunum lebih rendah dibanding
ileum, sekum dan kolon. Hal ini disebabkan konsentrasi garam empedu pada bagian
jejunum paling tinggi daripada ileum, karena lokasinya paling dekat bila garam empedu masuk ke dalam saluran usus.
Antibiotik
9 mengemukakan antibiotik adalah produk metabolik yang dihasilkan suatu organisme tertentu, yang dalam jumlah kecil dapat merusak atau menghambat organisme lain.
Kloramfenikol. Kloramfenikol adalah antibiotik yang mempunyai aktivitas bakteriostatik dan pada dosis tinggi bersifat bakterisidal. Aktivitas antibakterinya bekerja dengan cara menghambat sintesa protein dengan jalan mengikat ribosom subunit, yang merupakan langkah penting dalam pembentukan ikatan peptida (Pelczar dan Chan, 2008). Kloramfenikol adalah suatu antibiotik berspektrum luas dengan cara kerja bakteriostatik (Schunack et al., 1990). Aktivitas kloramfenikol
sangat nyata terhadap Salmonella (tergolong tifus dan paratipus) dan mempunyai
difusi ringan yang baik. Kloramfenikol efektif terhadap bakteri aerob Gram positif, termasuk Streptococcus pneumonia dan beberapa bakteri aerob Gram negatif,
termasuk Haemophilus influenzae, Neisseria meningitides, Salmonella, Proteus mirabilis, Pseudomonas mallei, Ps. cepacia, Vibrio cholera, Francisella tularensis, Yersinia pestis, Brucella dan Shigella.
Amoksisilin. Amoksisilin adalah antibiotik termasuk ke dalam golongan penisilin, dengan aktivitas membunuh bakteri secara langsung, tetapi dengan cara mencegah bakteri membentuk semacam lapisan yang melekat di sekujur tubuhnya. Lapisan ini mempunyai fungsi yang sangat vital bagi bakteri, yaitu untuk melindungi bakteri dari perubahan lingkungan dan menjaga agar tubuh bakteri tidak tercerai-berai. Amoksisilin sangat efektif untuk beberapa bakteri seperti H. influenza, N. gonorrhea, E.coli, Pneumococci, Streptococci dan beberapa strain dari Staphylococci (Schunack
et al., 1990). Pada penelitian didapatkan bahwa amoksisilin dapat menghambat pertumbuhan mikroorganisme Gram positif dan Gram negatif. Karena itu, amoksisilin biasa digunakan dalam pengobatan infeksi yang diduga disebabkan karena bakteri (Kline, 2009).
Antimikroba
10 bakteri), fungisidal (membunuh kapang), fungistatik (menghambat pertumbuhan kapang) dan germisidal (menghambat germinasi spora bakteri).
Sifat antimikroba dapat digunakan untuk menghambat pertumbuhan atau membunuh mikroba lain. Mekanisme merusak dinding sel dengan menghambat proses pembentukannya atau menyebabkan lisis pada dinding sel yang sudah terbentuk dan perubahan permeabilitas membran sitoplasma akan menyebabkan terhambatnya pertumbuhan atau matinya sel. Pada konsentrasi rendah, sebaiknya aktivitas mikroba harus dapat mematikan berbagai macam mikroba (Pelczar dan Chan, 2008).
11
Bakteri Patogen
Bakteri patogen adalah bakteri yang menimbulkan kerugian pada manusia. Cara penularan penyakit pada manusia, yaitu (1) intoksikasi, makanan mengandung toksin yang dihasilkan bakteri yang tumbuh pada makanan tersebut dan (2) infeksi, masuknya bakteri ke dalam tubuh melalui makanan yang terkontaminasi. Tiga bakteri patogen yang sering ditemukan dalam pangan dan ada secara alami dalam tubuh manusia adalah E. coli, S. Typhimuriumdan S. aureus (Todar, 2008).
Escherichia coli. Bakteri ini tumbuh pada kondisi aerobik ataupun anaerobik,
berbentuk batang, berukuran lebar 1,1-1,5 µm dan panjang 2,0-6,0 µm. Bakteri ini terdapat dalam bentuk berpasangan atau tunggal, bersifat motil dengan flagella peritrikal atau non motil. Tumbuh optimum pada pH 7-7,5 dengan pH mínimum 4 dan pH maksimum 8,5. Suhu pertumbuhan adalah 37oC dengan kisaran pertum-buhannya adalah pada suhu 10-40oC (Fardiaz, 1989). E. coli ditemukan di dalam
saluran usus hewan dan manusia, sehingga sering ditemukan dalam feses.
Menurut Todar (2008), terdapat lima kelas (virotipes) E. coli yang menyebabkan diare, yaitu E. enterotoxigenic coli (ETEC), E. enteroinvasive coli
(EIEC), E. enterohemorrhagic coli (EHEC), E. enteropathogenic coli (EPEC) dan E. enteroaggregative coli (EAEC). ETEC menyebabkan diare pada bayi dan beberapa masyarakat di negara-negara berkembang dengan sanitasi lingkungan yang buruk. Penyakit ini timbul akibat mengkonsumsi makanan dan air yang terkontaminasi, sayuran mentah, bahkan dari beberapa jenis keju lunak. EPEC menyebabkan diare, terutama pada anak-anak di negara berkembang. Penyakit ini disebabkan oleh air, daging dan produk daging yang terkontaminasi. EHEC menyebabkan diare berdarah atau kolitis hemorragik. Penyakit ini disebabkan oleh air atau makanan terkontaminasi, misalnya daging sapi, susu mentah, jus apel yang tidak dipasteurisasi dan sayuran mentah.
Staphylococcus aureus. Walstra et al. (2006) menyatakan bahwa S. aureus adalah
bakteri Gram positif berbentuk cocci, katalase positif, ukuran diameter 0,5-1,5 µm
dan berbentuk seperti anggur. Suhu optimum pertumbuhan S. aureus adalah 37oC
dengan kisaran 6-48oC. S. aureus mempunyai pH optimum pertumbuhan 7,0-7,5
12 organik pada medium pertumbuhannya. Bakteri ini mempunyai waktu generasi 27-30 menit S. aureus dapat memproduksi senyawa beracun enterotoksin dan
menyebabkan gastroenteritis. Pertumbuhan S. aureus dapat dihambat dengan
menurunkan suhu, menurunkan pH dan karena adanya komponen antagonistik dari BAL. Pemanasan juga dapat membunuh S. aureus.
Salmonella enteridis serotipe Typhimurium (S. Typhimurium). Salmonella
termasuk Gram negatif dan bersifat anaerobik fakultatif. S. Typhimurium berbentuk
batang lurus, berukuran 0,7-1,5 x 2-5 µm, tidak membentuk spora, oksidase negatif, katalase positif dan memecah nitrat. Bakteri ini tumbuh pada pH netral 6,6–8,2. Nilai pH media yang lebih besar dari 9,0 atau lebih kecil dari 4,0 akan mengakibatkan kematian bakteri ini. Suhu optimum untuk pertumbuhan adalah 37oC, suhu maksimum 45,6oC. S. Typhimurium menyebabkan gejala gastrointestinal
13
MATERI dan METODE
Lokasi dan Waktu
Lokasi penelitianbertempat di Laboratorium Mikrobiologi Bagian Teknologi Hasil Ternak, Laboratorium Terpadu Departemen IPTP, Fakultas Peternakan IPB dan Laboratorium Kimia Analitik Departemen Kimia Fakultas Matematika dan Ilmu Pengetahuan IPB. Penelitian dilaksanakan selama tujuh bulan, dimulai bulan Maret sampai September 2010.
Materi
Bahan yang digunakan dalam penelitian ini adalah bakteri Streptococcus thermophilus S-01, Lactobacillus bulgaricus S-01, Lactobacillus acidophilus Y-01, Bifidobacterium longum Y-01, S. Typhimurium ATCC 14028, E. coli ATCC 25922
dan S. aureus ATCC 25923 (Koleksi Bagian THT, Fapet IPB). Bahan media pertumbuhan bakteri yang digunakan adalah de’Mann Rogosa Sharpe Broth
(MRSB), Bacteriological Agar (BA), Buffer Pepton Water (BPW), Phosphate Buffered Saline (PBS), Nutrient Broth (NB), NaCl fisiologis, HCl, NaOH, etanol,
kertas saring, bile salt, Mueller Hinton Agar (MHA), antibiotik jenis amoksisilin dan
kloramfenikol, larutan buffer pH 4 dan 7, phenoptalein, kristal violet, iodin, safranin,
minyak imersi, alkohol 70%, kapas dan alumunium foil.
Alat-alat yang digunakan diantaranya adalah flux laminaire (ruang steril),
inkubator, waterbath, evaporator, spektrofotometer, sentrifus, timbangan digital,
autoklaf, oven, tabung eppendorf, tabung reaksi, labu Erlenmeyer, cawan Petri, pipet volumetrik, mikro pipet, refrigerator, gelas ukur, jarum Öse, cork borer, pemanas Bunsen, panci, sendok pengaduk, kompor, jangka sorong dan pH meter.
Prosedur
Penelitian Pendahuluan
Penelitian pendahuluan ini meliputi pemeriksaan kultur bakteri, baik bakteri asam laktat maupun bakteri patogen melalui pewarnaan Gram dan uji katalase untuk mengkonfirmasi keseragaman kultur .
14 24 jam. Kultur segar tersebut kemudian dihomogenkan dengan menggunakan
vortex, lalu sebanyak satu mata jarum Öse kultur segar kemudian dioleskan pada
kaca objek, diratakan, dikeringudarakandan difiksasi panas. Kristal violet diteteskan pada olesan bakteri tersebut, diratakan dan didiamkan satu menit, lalu dibilas dengan aquadestilata dan dikeringudarakan. Olesan contoh tersebut ditetes iodium Gram selama dua menit, dibilas dengan aquadestilata dan dikeringudarakan, kemudian dicuci dengan alkohol 95% dengan cara diteteskan di atas olesan bakteri dan ditunggu selama 5 detik. Preparat kemudian dibilas dengan aquadestilata dan dikeringudarakan. Preparat olesan bakteri ditetes safranin, diratakan dan didiamkan selama 30 detik, lalu dibilas dengan aquadestilata dan dikeringkan. Preparat yang akan diamati dioleskan minyak imersi terlebih dahulu. Pengamatan dengan mikroskop dilakukan pada perbesaran 10 x 100. Bakteri warna biru yang terlihat termasuk bakteri Gram positif, sedangkan bakteri Gram negatif terlihat berwarna merah.
Uji Katalase. Contoh bakteri asam laktat dan bakteri patogen segar berumur 24 jam, dioleskan pada kaca objek. Olesan bakteri ditetesi dengan H2O2. Jika terbentuk
gelembung udara, maka termasuk katalase positif, sedangkan jika hasil yang didapatkan tidak membentuk gelembung udara maka termasuk katalase negatif.
Penentuan Populasi Bakteri Asam Laktat (Pelczar dan Chan, 2007)
Tahap ini bertujuan untuk menentukan jumlah populasi BAL selama diberikan perlakuan (ketahanan dalam lingkungan pH yang berbeda, keberadaan garam empedu dan adanya antibiotik) yang dihitung dengan pendekatan dua metode yaitu metode pour plate (hitungan cawan) dan metode turbidimetrik dengan
spektrofotometer. Metode pour plate digunakan untuk penentuan populasi BAL
sebelum dan sesudah perlakuan, sedangkan metode turbidimetrik digunakan untuk penentuan perubahan populasi BAL selama perlakuan.
Metode Hitungan Cawan (Modifikasi Hadioetomo, 1993; FDA, 2001)
15 terkandung dalam sampel. Pemupukan diawali dengan pengenceran biakan. Sebanyak 1 ml contoh dari biakan diencerkan ke dalam 9 ml larutan pengencer. Pengenceran selanjutnya dilakukan hingga P-1, P-2, dst. Sebanyak 1ml contoh dari tiap pengenceran dipipet dan dimasukkan ke dalam cawan Petri steril dan dilakukan secara duplo setiap pengenceran. Media agar cair yang dipertahankan dalam
waterbath pada suhu 45oC±1oC dituang sebanyak 12-15 ml ke dalam cawan Petri
yang sudah berisi contoh. Supaya contoh dan agar cair homogen dilakukan pemutaran cawan membentuk angka delapan dan dibiarkan hingga agar mengeras, lalu diinkubasi pada suhu 37oC selama ±24 jam. Koloni yang terbentuk dihitung dengan metode Bacteriological Analytical Manual (BAM). Cawan yang dipilih
untuk perhitungan koloni adalah yang mengandung antara 25-250 koloni, dan dihitung dengan rumus sebagai berikut :
N = Σ C / [ (1 * n1) + (0.1 * n2) ] * (d)
N = jumlah koloni per ml atau g contoh, Σ C = jumlah seluruh koloni yang dapat dihitung, n1 = banyaknya cawan dengan pengenceran pertama yang dapat dihitung,
n2 = banyaknya cawan dengan pengenceran kedua yang dapat dihitung, dan d=
pengenceran pertama yang dapat dihitung.
Metode Turbidimetrik (Modifikasi Hadioetomo, 1993; Waluyo, 2008). Tahap ini
diawali dengan penentuan korelasi antara nilai optical density (OD) dengan populasi bakteri hasil pemupukan dengan metode pour plate, melalui persamaan y=a+bx (yjumlah populasi BAL, xnilai OD bakteri dan a dan bkonstanta persamaan). Persamaan linier yang didapat (y=a+bx) ini digunakan dalam penentukan populasi BAL S. thermophilus S-01, L. bulgaricus S-01, B. longum Y-01 dan L. acidophilus Y-01, pada pengujian ketahanan terhadap pH yang berbeda, garam empedu dan
antibiotik yang berbeda.
Pengukuran nilai absorbansi menggunakan spektrofotometer. Sebelum digu-nakan, panjang gelombang diatur pada 620 nm dan dikalibrasi dengan daya absorpsi 0 bila tidak ada sel. Blanko yang digunakan adalah media tanpa sel bakteri. Jika
sudah terkalibrasi dengan baik, blanko dikeluarkan dan diganti dengan contoh.
16 kuvet ke dalam tempat sampel alat. Nilai %T kemudian diubah dan dinyatakan sebagai nilai absorbansi (Å) atau rapat optis (optical density) atau OD.
Pembuatan Kurva Standar. Kultur segar 24 jam sebanyak 1ml
diencerkan pada pengenceran 1/2, 1/4, 1/8, 1/16 dan 1/32, lalu dari masing-masing pengenceran, diambil 1 ml untuk dipupukkan mengacu pada metode hitungan cawan, dengan terlebih dahulu diencerkan pada BPW 9 ml dan pengenceran dilakukan sampai P-8, sedangkan sisa dari pengenceran diukur nilai absorbansinya. Setelah inkubasi 24 jam, koloni yang tumbuh pada cawan dihitung. Kurva standar untuk menentukan yaitu hubungan populasi dengan nilai OD. Hasil standarisasi populasi bakteri asam laktat indigenous susu sapi dan olahan susu sapi dilihat pada Tabel 1.
Tabel 1. Standarisasi Bakteri Asam Laktat Indigenous Susu Sapi Segar dan Produk
Olahannya
BAL Persamaan R2
S. thermophilus S-01 Y = 7,854 + 2,023x 0,940
L. bulgaricus S-01 Y = 7,184 + 1,002x 0,920
B. longum Y-01 Y = 6,684 + 1,093x 0,957
L. acidophilus Y-01 Y = 7,205 + 1,812x 0,976
Keterangan : y = jumlah populasi; x = nilai absorbansi; R2 = determinasi
Penelitian Utama
Persiapan Sel-sel Kultur Bakteri Asam Laktat
Sel-sel kultur BAL S. thermophilus S-01, L. bulgaricus S-01, B. longum Y-01 dan L. acidophilus Y-01 yang berumur 24 jam masing-masing dalam MRSB dipanen melalui sentrifugasi pada kecepatan 3500 rpm selama 15 menit dalam suhu 4oC. Bagian presipitat atau endapan dipisahkan dari bagian supernatannya. Presipitat selanjutnya distandarisasi dengan populasi awal ±107cfu/ml ke dalam larutan PBS.
Uji Ketahanan terhadap pH rendah (Chou & Weimer, 1999)
Presipitat sel-sel kultur BAL S. thermophilus S-01, L. bulgaricus S-01, B. longum Y-01 dan L. acidophilus Y-01 yang sudah distandarisasi dengan populasi
17 suhu 37 0C selama 180 menit. Penghitungan populasi awal sebelum (t0) dan sesudah
diinkubasi selama 180 menit (t180) dihitung dengan metode hitungan cawan.
Perubahan populasi BAL selama perlakuan dalam pH yang berbeda diamati setiap 30 menit, melalui pengukuran nilai absorbansi (620 nm) dengan menggunakan spektrofotometer. Nilai OD (x) yang diperoleh dikonversikan dalam persamaan yabx yang ada untuk memperoleh penyetaraan populasi BAL.
Penelitian ini mengamati kemampuan bertahan atau tumbuh BAL pada saluran pencernaan. Kondisi keasaman lambung mempunyai kisaran pH antara 2-3,5 sehingga nilai pH yang diamati adalah 2; 2,5 dan 3,2. Kondisi pH pada usus adalah netral sehingga pengamatan dilakukan pada pH 7,2. Uji ketahanan kultur
S.thermophilus S-01, L. bulgaricus S-01, B. longum Y-01 dan L. acidophilus Y-01
terhadap pH yang berbeda ditentukan berdasarkan jumlah kematian bakteri, yaitu bila kultur starter BAL mampu mempertahankan populasinya minimal 20-40%.
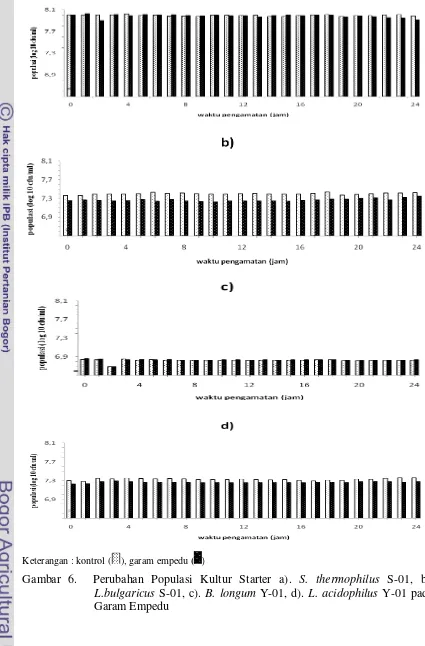
Uji Ketahanan terhadap Garam Empedu (Gilliland et al., 1984)
` Pengujian disesuaikan dengan kadar garam empedu pada saluran pencernaan yaitu dengan menggunakan bile salt sebanyak 0,3% oxgalldalam media PBS dengan pH 7,2. PBS yang telah ditambahkan garam empedu dengan konsentrasi 0,3% pada pH 7,2, kemudian disterilisasi pada suhu 121 oC selama 15 menit.
Presipitat sel-sel kultur BAL S. thermophilus S-01, L. bulgaricus S-01, L. acidophilus Y-01 dan B. longum Y-01 yang sudah distandarisasi dengan populasi awal ±107 cfu/ml diinokulasikan pada media PBS yang telah ditambahkan garam empedu 0,3% steril. Kultur diinkubasi pada suhu 370C selama 24 jam. Peng-hitungan populasi awal sebelum (t0) dan sesudah diinkubasi selama 24 jam (t24j)
dihitung dengan metode pemupukan hitungan cawan. Perubahan populasi BAL selama perlakuan dengan penambahan garam empedu 0,3% oxgall diamati setiap 1 jam selama 24 jam, melalui pengukuran nilai absorbansi (620 nm) dengan menggunakan spektrofotometer. Nilai OD (x) yang diperoleh dikonversikan dalam persamaan y a bx yang ada untuk memperoleh penyetaraan populasi BAL. Uji ketahanan kultur BAL S. thermophilus S-01, L. bulgaricus S-01, B. longum Y-01
18 kematian bakteri, yaitu bila kultur starter BAL mampu mempertahankan populasinya minimal 20-40%.
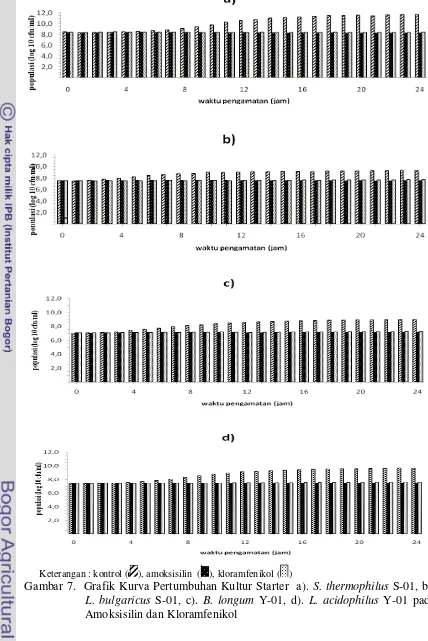
Uji Ketahanan terhadap Antibiotik (Liasi et al., 2009)
Kultur starter selanjutnya diuji berdasarkan sensitifitasnya terhadap antibiotik. Presipitat distandarisasi dengan populasi awal ±107 cfu/ml, lalu diinokulasikan ke dalam media MRSB yang telah ditambahkan antibiotik (amoksisilin atau kloramfenikol) sebanyak 30 µg/ml. Pengukuran populasi awal dihitung dengan metode pemupukan sebelum diinkubasi (t0). Kultur diinkubasi pada
suhu 37 0C selama 24 jam.
Penghitungan populasi awal sebelum (t0) dan sesudah diinkubasi selama 24
jam (t24j) dihitung dengan metode pemupukan hitungan cawan. Perubahan populasi
BAL selama perlakuan pada antibiotik (amoksisilin dan kloramfenikol), diamati setiap 1 jam, melalui pengukuran nilai absorbansi (620 nm) dengan menggunakan spektrofotometer. Nilai OD (x) yang diperoleh dikonversikan dalam persamaan y a bx yang ada untuk memperoleh penyetaraan populasi BAL. Uji ketahanan kultur BAL S. thermophilus S-01, L. bulgaricus S-01, B. longum Y-01 dan L. acidophilus
Y-01 terhadap antibiotik yang berbeda ditentukan berdasarkan jumlah kematian bakteri, yaitu bila kultur starter BAL mampu mempertahankan populasinya minimal 20-40%.
Uji Kemampuan Antimikroba terhadap Bakteri Patogen (Modifikasi Liasi et al. (2009), Maheswari (2008))
Persiapan Filtrat Bebas Sel. Kultur bakteri yang sudah disegarkan (populasi
107cfu/ml) diinokulasikan dalam MRSB (5 % v/v), lalu diinkubasi pada 37oC selama 24 jam. Filtrat bebas sel (FBS) diperoleh dengan penyaringan steril menggunakan filter 0,22 m (Millipore). FBS dikonsentrasikan dengan cara menambahkan ke dalam FBS metanol (MeOH) dengan rasio 1:1, kemudian dievaporasi dalam rotary evaporator pada suhu 40-450C selama ±60 menit atau hingga mencapai 1/5 volume
19
Persiapan Bakteri Indikator. Bakteri uji (BAL dan bakteri patogen) yang
digunakan adalah bakteri yang berumur 24 jam. Bakteri patogen dengan populasi awal minimal 108 cfu/ml (standar Mc Farland no.2) dalam media NB terlebih dahulu diencerkan dalam media NaCl fisiologis hingga populasi mencapai 105 cfu/ml.
Konfrontasi Filtrat Bebas Sel dengan Bakteri Indikator. Bakteri patogen yang
berumur 24 jam, dengan populasi awal minimal 108 cfu/ml yang telah disegarkan dalam media NB, kemudian diencerkan dengan populasi 105 cfu/ml, dan dimasukkan 1 ml ke dalam cawan Petri. Sebanyak 20 ml MHA bersuhu 45-50oC dimasukkan ke dalam cawan Petri, dan digerakkan seperti angka delapan, hingga agar dan bakteri homogen. Jika agar yang berisi biakan bakteri sudah memadat, dibuat lubang sumur pada agar dengan diameter 7 mm dan 2 lubang pada setiap cawan. Kultur bakteri yang sudah dievaporasi, kemudian diteteskan ke dalam lubang sebanyak 50 µl. Cawan beserta isi diletakkan dalam refrigerator selama 30 menit untuk memberikan kesempatan filtrat meresap, lalu diinkubasi pada suhu 37oC selama 24 jam. Pengamatan dilakukan dengan mengukur areal bening di luar sumur menggunakan jangka sorong. Aktivitas antagonistik bakteri terhadap patogen dinyatakan sebagai areal bening yang terbentuk. Pengukuran zona bening yang terbentuk dapat dilihat pada Gambar 1.
Bakteri patogen uji
Zona bening yang terbentuk
Filtrat bebas sel terkonsentrasi Keterangan : a, b, c = diameter zona hambat yang diukur Pengukuran diameter zona hambat = a +b + c
3
Gambar 1 . Pengukuran Diameter Zona Hambat b
a
20
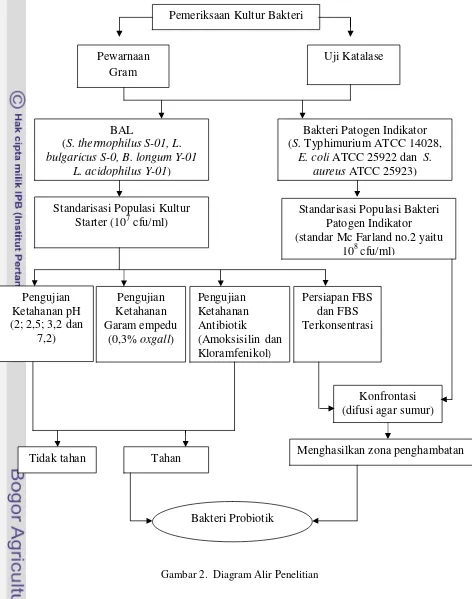
Diagram alir penelitian dapat dilihat pada Gambar 2.
Gambar 2. Diagram Alir Penelitian
21
Rancangan Percobaan
Penelitian ini menggunakan Rancangan Acak Lengkap (RAL) pola searah dan analisis uji t.
Uji t.
Data ketahanan BAL S. thermophilus S-01, L. bulgaricus S-01, B. longum Y-01 dan L. acidophilus Y-01 terhadap perlakuan pH yang berbeda (2; 2,5; 3,2 dan
7,2), keberadaan garam empedu 0,3% dan antibiotik yang berbeda (amoksisilin dan kloramfenikol) dianalisis dengan uji t. Data populasi BAL thermophilus S-01, L. bulgaricus S-01, S. B. longum Y-01 dan L. acidophilus Y-01 dianalisis dengan
membandingkan populasi masing-masing BAL sebelum diberi perlakuan (t0) dan
setelah diberi perlakuan (tx). Analisis data dipergunakan untuk melihat pengaruh
perlakuan terhadap peubah yang diamati dengan masing-masing perlakuan terdiri atastiga ulangan. Rumus yang digunakan dalam Uji t menurut Walpole (1995) :
Keterangan :
µi = rata-rata perlakuan ke-i µj = rata-rata perlakuan ke-j s = simpangan baku n = jumlah data
Rancangan Acak Lengkap (RAL) Pola Searah
Rancangan Acak Lengkap digunakan untuk menganalisis aktivitas antimikroba BAL terhadap bakteri patogen yang berbeda (S. aureus ATCC 25923,
E.coli ATCC 25922 dan S. Typhimurium ATCC 14028). Persamaaan model
rancangannya menurut Steel dan Torrie (1994) :
Keterangan :
Yij = pengamatan pada perlakuan ke-i dan ulangan ke-j
22 µ = rataan umum
i = pengaruh perlakuan ke-i
ij = pengaruh galat percobaan pada perlakuan ke-i ulangan ke-j
i = BAL uji yang berbeda j = ulangan 1, 2 dan 3
Data hasil kedua rancangan selanjutnya dianalisis dengan Analysis of variance (ANOVA). Apabila pada analisis ragam didapatkan hasil yang berbeda
23
HASIL DAN PEMBAHASAN
Bakteri asam laktat yang digunakan merupakan hasil isolasi dari susu sapi segar dan produk olahannya. Bakteri asam laktat indigenous susu sapi segar dan produk olahannya ini berpotensi untuk menjadi kandidat bakteri probiotik, dengan syarat tahan pada berbagai kondisi dalam saluran pencernaan.
Konfirmasi Kultur Starter Indigenous Susu Sapi Segar dan Bakteri Patogen Uji
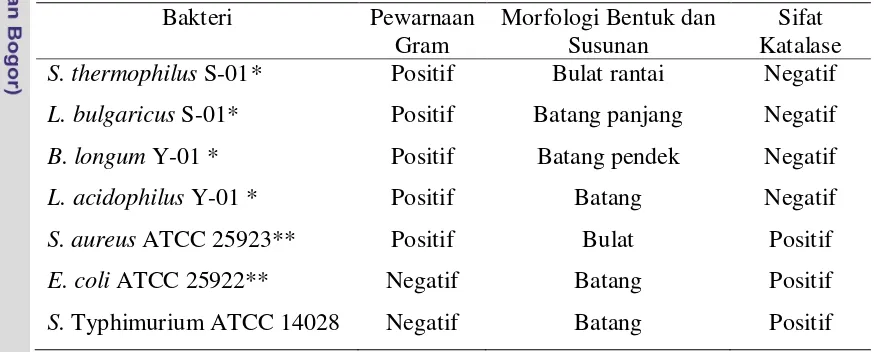
Bakteri asam laktat dan bakteri patogen yang diujikan harus terbebas dari kontaminasi bakteri lain. Uji konfirmasi dilakukan dengan pewarnaan Gram dan uji katalase untuk melihat morfologi BAL dan bakteri patogen uji yang seragam, homogen dan murni. Pewarnaan Gram dilakukan untuk menggolongkan jenis bakteri Gram positif atau negatif. Uji katalase dilakukan untuk mengetahui BAL dan bakteri patogen uji termasuk sifat katalase negatif atau positif. Karakteristik BAL dan bakteri patogen uji melalui uji konfirmasi dapat dilihat pada Tabel 2.
Tabel 2. Karakteristik BAL Indigenous Susu Sapi Segar dan Bakteri Patogen Uji
Bakteri Pewarnaan
S. thermophilus S-01* Positif Bulat rantai Negatif
L. bulgaricus S-01* Positif Batang panjang Negatif
B. longum Y-01 * Positif Batang pendek Negatif
L. acidophilus Y-01 * Positif Batang Negatif
S. aureus ATCC 25923** Positif Bulat Positif
E. coli ATCC 25922** Negatif Batang Positif
S. Typhimurium ATCC 14028 Negatif Batang Positif
Keterangan : * sesuai dengan Wardani (2009)
** sesuai dengan Ambarwati dan Gama (2009)
Pewarnaan Gram dilakukan untuk mengetahui bakteri tersebut termasuk Gram negatif atau Gram positif. Perbedaan ini dilihat berdasarkan komposisi dinding sel dan sifat pewarnaannya. Selain itu, juga berbeda dalam sifat sensiti-fitasnya terhadap kerusakan mekanis atau fisis, terhadap enzim, desinfektan dan antibiotik (Hadioetomo, 1993). S. thermophilus S-01, L. bulgaricus S-01, B. longum
24 positif, sedangkan E. coli ATCC 25922 dan S. Typhimurium ATCC 14028 adalah bakteri Gram negatif. Hasil pewarnaan menunjukkan bakteri-bakteri yang tergolong Gram positif tersebut terlihat berwarna biru (menyerap pewarna kristal violet), sedangkan bakteri-bakteri Gram negatif terlihat berwarna merah, karena lebih menyerap pewarna safranin.
Menurut Hadioetomo (1993), bakteri Gram negatif bersifat lebih konsisten terhadap reaksi pewarnaan, tetapi bakteri Gram positif sering berubah sifat pewarnaannya, sehingga bakteri Gram positif dapat menunjukkan reaksi Gram
variable. Kultur bakteri yang biasa digunakan dalam pewarnaan Gram adalah kultur
berumur 24 jam, jika kultur bakteri terlalu tua, maka bakteri tersebut akan kehilangan kemampuan untuk menyerap kristal violet dan lebih menyerap pewarna safranin. Perubahan ini dapat disebabkan juga oleh perubahan kondisi lingkungan dan modifikasi teknik pewarnaan.
Pewarnaan awal bakteri adalah dengan zat warna basa kristal violet, jika kelebihan warna, maka dicuci dengan air, kemudian diberi larutan yodium yang akan membentuk suatu kompleks antara kristal violet dan iodium. Pencucian dengan alkohol dimaksudkan untuk mencuci kompleks tersebut, sehingga kompleks tersebut keluar dari dinding sel bakteri Gram negatif, sehingga saat diberi pewarna safranin, dinding sel Gram negatif akan menyerap safranin dan menjadi berwarna merah. Gram positif tidak ada kompleks yang keluar karena lapisan peptidoglikan pada dinding selnya lebih tebal dan menyebabkan Gram positif tidak menyerap warna safranin dan tetap berwarna biru seperti Kristal violet (Hadioetomo, 1993).
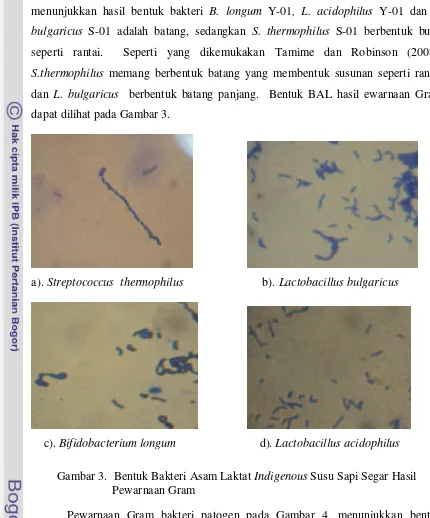
25 Pewarnaan Gram yang dilakukan terhadap keempat bakteri asam laktat menunjukkan hasil bentuk bakteri B. longum Y-01, L. acidophilus Y-01 dan L. bulgaricus S-01 adalah batang, sedangkan S. thermophilus S-01 berbentuk bulat
seperti rantai. Seperti yang dikemukakan Tamime dan Robinson (2008),
S.thermophilus memang berbentuk batang yang membentuk susunan seperti rantai dan L. bulgaricus berbentuk batang panjang. Bentuk BAL hasil ewarnaan Gram
dapat dilihat pada Gambar 3.
a). Streptococcus thermophilus b). Lactobacillus bulgaricus
c). Bifidobacterium longum d). Lactobacillus acidophilus
Gambar 3. Bentuk Bakteri Asam Laktat Indigenous Susu Sapi Segar Hasil
Pewarnaan Gram
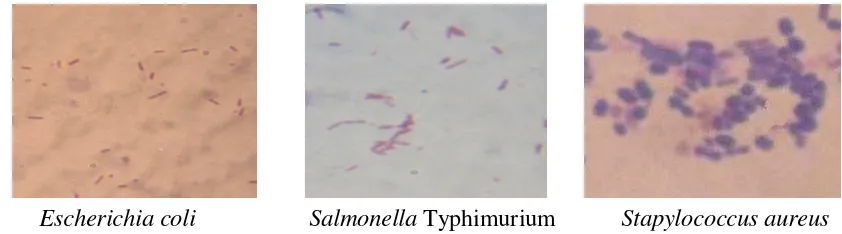
Pewarnaan Gram bakteri patogen pada Gambar 4, menunjukkan bentuk masing-masing bakteri patogen setelah dilakukan pewarnaan Gram dan sesuai dengan Hadioetomo (1993). E. coli berbentuk batang lurus. S. Typhimurium
berbentuk batang, sedangkan S. aureus berbentuk kokus membentuk anggur.
Uji katalase digunakan untuk mengetahui aktivitas katalase pada bakteri yang diuji. Kebanyakan bakteri memproduksi enzim katalase yang dapat memecah H2O2
26 karena H2O2 bersifat racun terhadap sel mikroba. Beberapa bakteri yang termasuk
katalase negatif adalah Streptococcus, Leuconostoc, Lactobacillus dan Clostridium.
Escherichia coli Salmonella Typhimurium Stapylococcus aureus
Gambar 4. Bentuk Bakteri Patogen Hasil Pewarnaan Gram
Bakteri katalase positif seperti S. aureus bisa menghasilkan gelembung-gelembung oksigen karena adanya pemecahan hidrogen peroksida (H2O2) oleh enzim
katalase yang dihasilkan oleh bakteri itu sendiri. Komponen H2O2 ini merupakan
salah satu hasil respirasi aerobik bakteri, misalnya S. aureus, dimana hasil respirasi tersebut justru dapat menghambat pertumbuhan bakteri karena bersifat toksik bagi bakteri itu sendiri. Oleh karena itu, komponen ini harus dipecah agar tidak bersifat toksik lagi. Bakteri katalase negatif tidak menghasilkan gelembung-gelembung. Hal ini berarti H2O2 yang diberikan tidak dipecah oleh bakteri katalase negatif, sehingga
tidak menghasilkan oksigen. Bakteri katalase negatif tidak memiliki enzim katalase yang menguraikan H2O2.
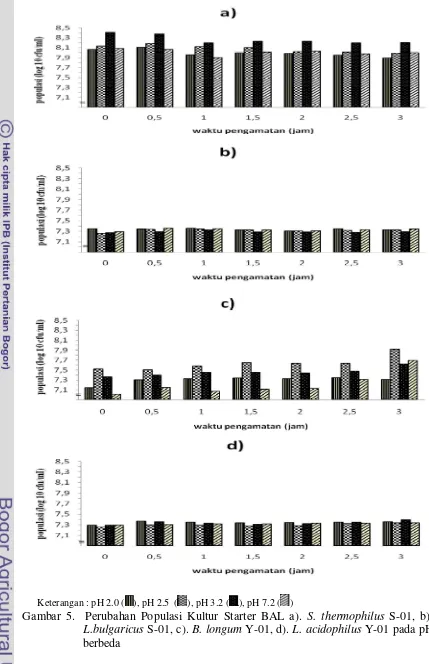
Ketahanan Kultur Starter BAL Indigenous Susu Sapi Segar pada pH Berbeda
27 Pengaturan pH media pertumbuhan BAL untuk menyamakan dengan kondisi dalam lambung (2, 2,5 dan 3,2) dan usus halus (7,2) adalah dengan menambahkan HCl dan NaOH. HCl digunakan untuk menurunkan pH media hingga mencapai kondisi pH yang diinginkan. Alasan penggunaan HCl adalah karena HCl mempunyai karakteristik yang hampir sama dengan asam yang dihasilkan di lambung. HCl adalah asam kuat yang mudah terdisosiasi menghasilkan proton, yang menyebabkan penurunan pH medium di luar sel atau pH ekstraseluler. NaOH digunakan untuk menaikkan pH, hingga mencapai kondisi pH 7,2, karena merupakan basa kuat, mengandung Na (garam) yang sama dengan karakteristik garam empedu yang disekresikan di dalam duodenum. Jumlah populasi BAL sebelum dan sesudah inkubasi dapat dilihat pada Tabel 3.
Tabel 3. Jumlah Populasi BAL Indigenous Susu Sapi Segar pada pH Berbeda
No Keterangan : * apabila hasilnya (-) menunjukan adanya kematian;
** huruf superskript (a dan b) yang berbeda pada kolom yang sama menunjukkan berbeda nyata (P<0,05)
ND = not detected (tidak terdeteksi adanya pertumbuhan)
28 asam dalam saluran pencernaan, salah satunya adalah kondisi di lambung yang dalam keadaan kosong mempunyai pH sangat asam, sekitar 1–2,5. Hasil sekresi lambung yang dikenal dengan getah lambung merupakan cairan jernih berwarna kuning pucat yang mengandung HCL 0,2–0,5% dan asam lambung dengan pH 3,2 disekresikan di dalam lambung (Mitsuoka, 1990). Menurut Jacobsen et al. (1999), dalam saluran pencernaan manusia, pH asam lambung yaitu sekitar 2,5, sedangkan pengujian ketahanan BAL pada pH 7,2 diujikan karena garam empedu disekresikan di dalam duodenum yang mempunyai kondisi pH netral sekitar 6,9-7,2.
Hasil pada tabel 3, menunjukkan S. thermophilus S-01 pada pH 2 dan 2,5
tidak dapat bertahan, ini dibuktikan dengan tidak adanya pertumbuhan yang terdeteksi setelah akhir perlakuan. S. thermophilus pada pH 3,2 sudah mulai
bertahan, walaupun masih mengalami penurunan populasi sekitar 2,03 log10 cfu/ml,
sedangkan pada pH 7,2 S. thermophilus dapat bertahan, bahkan mengalami kenaikan
populasi sekitar 0,42 log10 cfu/ml. Hasil analisis ragam menunjukkan S.thermophilus
S-01 pada kondisi pH 3,2 sebelum dan sesudah inkubasi berpengaruh nyata (P<0,05). Walaupun S. thermophilus S-01 mengalami penurunan, namun populasi akhir setelah diinkubasi 3 jam masih pada populasi 6,09 log10 cfu/ml. Jika dibandingkan dengan
kondisi pH 2 dan 2,5, maka S. thermophilus S-01 lebih tahan pada kondisi 3,2 dan 7,2. Pada kondisi pH 3,2, S. thermophilus S-01 mampu mempertahankan pH intraseluler sitoplasma, sehingga pH sitoplasma lebih basa dibanding dengan pH ekstraseluler. Membran sel S. thermophilus S-01 juga lebih tahan terhadap kebocoran pada pH 3,2. Ketiga BAL yang lain mampu bertahan dalam semua kondisi pH, terutama B. longum Y-01 dan L. acidophilus Y-01, bahkan mengalami
kenaikan populasi. L. bulgaricus S-01 juga mampu bertahan dalam semua kondisi
pH, walaupun mengalami penurunan populasi, mulai dari 0,18–0,8 log10 cfu/ml.
Hasil analisis ragam menunjukkan bahwa kondisi pH 7,2 berpengaruh nyata pada populasi awal dan akhir setelah inkubasi 3 jam bakteri asam laktat B. longum Y-01
dan L. acidophilus Y-01.
Tiap galur mempunyai ketahanan yang berbeda terhadap asam atau pH rendah, contohnya Lactobacillus lebih toleran terhadap pH rendah dibandingkan Lactococci dan Streptococci (Farida, 2006). Bifidobacteria juga dapat bertahan
29 tinggi dari Bifidobacteria sangat penting, karena mikroorganisme ini digunakan dalam formulasi atau ditambahkan dalam makanan dan harus tahan terhadap keasaman, terutama selama transit dalam lambung.
Toleransi terhadap asam pada bakteri asam laktat tergantung pada pH H+ -ATPase dan komposisi membran sitoplasma, yang sangat dipengaruhi oleh jenis bakteri, media pertumbuhan dan kondisi inkubasi (Oh et al., 2000). Saat memasuki
saluran pencernaan dengan kondisi pH sangat asam, bakteri dapat mengalami stress. Stress yang dialami adalah karena pH intraseluler bakteri berbeda dengan pH ekstraseluler, sehingga bakteri asam laktat harus melakukan metabolisme agar dapat menyesuaikan kondisi intraseluler dengan ekstraselulernya. Menurut Siegumfeldt et al. (2000), pada bakteri asam laktat terjadi perubahan dinamis pH intraseluler seiring
dengan terjadinya penurunan pH ekstraseluler sehingga tidak terjadi gradien proton yang besar. Toleransi bakteri asam laktat yang cukup tinggi terhadap asam disebabkan oleh kemampuannya untuk mempertahankan pH sitoplasma lebih basa daripada pH ekstraseluler. Bila sel bakteri terpapar pada kondisi yang sangat asam, maka membran sel dapat mengalami kerusakan dan berakibat hilangnya komponen intraseluler. Biasanya kerusakan ini menyebabkan kematian pada sel. Bakteri yang toleran terhadap asam, membran selnya lebih tahan terhadap kebocoran akibat pH rendah dibandingkan dengan yang tidak tahan.
Secara in vitro ketahanan terhadap pH rendah tergantung pada tipe buffer dan tipe makanan yang digunakan. Menurut Hardiningsih et al. (2005), ketahanan fisiologis dari setiap bakteri berbeda-beda. Perbedaan ketahanan membran sel bakteri terhadap kerusakan akibat terjadinya penurunan pH ekstraseluler menyebabkan keragaman ketahanan sel pada pH rendah.
Jacobsen et al. (1999) melakukan pengujian ketahanan 47 isolat bakteri asam laktat dari berbagai sumber pada pH 2,5. Sebanyak 47 isolat tersebut hanya 29 isolat yang mampu bertahan pada pH 2,5 dan tidak ada satupun yang mampu tumbuh setelah inkubasi empat jam. Kondisi pH 2,5 bagi beberapa bakteri asam laktat memang sangat asam, sehingga banyak yang tidak dapat mempertahankan kondisi basa intraseluler dan terjadi kerusakan pada membran sel bakteri. Berdasarkan hasil ini, S. thermophilus S-01 dan L. bulgaricus S-01 diduga mengalami kerusakan
30 BAL mempunyai dinding sel yang tebal dengan lipid yang tipis sekitar 1-4%. Menurut (Fardiaz, 1989), bakteri Gram positif, 90% dari dinding selnya terdiri dari lapisan peptidoglikan, sedangkan lapisan tipis lainnya adalah asam teikoat. Asam teikoat mengandung unit-unit gliserol atau ribitol yang terikat satu sama lain oleh ester fosfat dan biasanya mengandung gula lain dan D-alanin. Peptidoglikan ini terdiri dari turunan gula yaitu N-asetilglukosamin dan N-asetilmuramat serta beberapa asam amino yaitu L-alanin, D-alanin, asam D-glutamat dan asam diaminopimelat (ADP). Peptidoglikan yang tebal dan ikatan rantai asam teikoat inilah yang dapat mempertahankan bentuk dinding sel dari kondisi asam ekstraseluler. Kondisi ektraseluler yang asam memang dapat menyebabkan dinding sel BAL menjadi lisis. Namun, dinding sel BAL ini dapat mempertahankan bentuknya, sehingga bagian dalam sel masih dapat terlindungi. Membran sel pun dapat mengangkut nutrien dan garam yang dibutuhkan untuk melakukan metabolisme dan tidak permeabel terhadap senyawa yang tidak dibutuhkan. Lapisan lipid yang tipis membuat pori-pori dinding menjadi mengecil, sehingga permeabilitas sel berkurang dan tidak terjadi ekstraksi komponen intraseluler. Asam dapat merusak lapisan lipid yang ada pada membran sel, namun lapisan lipid ini mengandung protein khusus. Beberapa dari protein membran merupakan enzim, sementara yang lainnya dapat mengikat nutrien dan mengangkutnya ke dalam sel.
Menurut Chou dan Weimer (1999), strain L. acidophilus pada pH sekitar 3,5 hanya tahan jangka pendek, terlihat dari pertumbuhannya yang sedikit melambat setelah inkubasi 90 menit. Tidak seperti bakteri netrofilik (yang dapat tumbuh pada kondisi pH mendekati netral) yang menjaga pH intraselulernya mendekati netral, pada bakteri asam laktat terjadi perubahan dinamis pH intraseluler seiring dengan perubahan pH lingkungannya (Siegumfeldt et al., 2000). Ini membuktikan, semua bakteri yang diisolasi memang mempunyai karakteristik yang berbeda dan metabolisme yang berbeda, bakteri-bakteri ini bersifat strain dependent.
Pertumbuhan optimal L. bulgaricus adalah pada kondisi asam, pH sekitar
5,2–5,8 dan akan terhenti pada pH sekitar 3,8. S. thermophilus S-01 tumbuh optimal
pada pH sekitar 6,5 dan akan terhenti pada pH 4,2–4,4. Pada pembuatan yogurt digunakan campuran S. thermophilus dan L. bulgaricus. S. thermophilus akan