BAKTERI ASAM LAKTAT ASAL BEKASAM
PENGHASIL LIPASE PADA SUBSTRAT MARGARIN
AHADYAH AYU UMAIYA
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul Bakteri Asam Laktat Asal Bekasam Penghasil Lipase pada Substrat Margarin adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, September 2015
ABSTRAK
AHADYAH AYU UMAIYA. Bakteri Asam Laktat Asal Bekasam Penghasil Lipase pada Substrat Margarin. Dibimbing oleh SRI BUDIARTI dan DESNIAR.
Enzim lipase pada mikroorganisme memiliki potensi yang besar di bidang kesehatan, industri dan proses bio-diesel. Mikroorganisme penghasil lipase diantaranya adalah bakteri asam laktat (BAL). Margarin merupakan bahan pangan yang digunakan hampir pada setiap makanan. Penelitian ini bertujuan untuk mendapatkan isolat BAL asal bekasam yang memiliki potensi lipolitik pada substrat margarin. Delapan belas isolat asal bekasam terkoleksi di laboratorium disegarkan kembali pada media MRSA suhu 37ºC selama 48 jam kondisi anaerob. Isolat terpilih diuji potensi penghasil lipolitik pada substrat margarin 1% menggunakan indikator Rhodamine B dan dilihat di bawah UV 365 nm, diidentifikasi nama spesies dengan API KIT 50 CHL. Isolat terpilih diukur kurva pertumbuhan dan aktivitas lipase. Isolat BI(2), BP(3), BP(6), SK(5), dan NS(6) menunjukkan kemampuan mendegradasi lipid pada margarin dengan pendaran warna jingga. Isolat BI(2) memiliki pendaran terkuat. Hasil identifikasi isolat BAL BI(2) adalah Lactococus lactis spp. lactis dengan nilai ID 82.40%. Jumlah sel dan aktivitas unit lipase tertinggi Lactococcus lactis terlihat pada fase log akhir yaitu jam ke-12 sebesar 4.741 CFU/mL dan 29.812 unit/mL.
Kata kunci: bakteri asam laktat, bekasam, Lactococcus lactis, lipase, margarin
ABSTRACT
AHADYAH AYU UMAIYA. Lactic Acid Bacteria from Bekasam as Lipase Producing in Margarine Substrate. Guided by SRI BUDIARTI and DESNIAR.
Lipase enzymes of microorganisms has a great potential in the fields of health, industry, and the process of bio-diesel. Lipase-producing microorganisms include lactic acid bacteria (LAB). Margarine is a food that is used in almost every meal. The purpose of this study was to obtain LAB bekasam origin which has the potential lipolytic on the margarine substrate. Eighteen of the collected isolates were refreshed on MRSA media at 37ºC for 48 hours in anaerobic conditions. Selected isolates were tested the potential of producing a lipolytic on the 1% margarine substrate use Rhodamine B as indicator and viewed under UV 365 nm, were identified by KIT API 50 CHL. Selected isolates were analised of the growth curve and lipase activity. The isolates BI(2), BP(3), BP(6), SK(5), and NS(6) show the ability to degrade lipids in 1% margarine with orange luminescence. The BI(2) isolate has the strongest luminescence. Results of identification BI(2) isolate is Lactococus lactis spp. lactis with a value of ID 82.40%. The number of cells and the activity of lipase unit of Lactococcus lactis
was highest seen at the end of the log phase that hour of the 12th of 4.741 CFU/ mL and 29.812 units/mL.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada
Departemen Biologi
BAKTERI ASAM LAKTAT ASAL BEKASAM
PENGHASIL LIPASE PADA SUBTRAT MARGARIN
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
BOGOR 2015
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Januari 2015 ini ialah Bakteri Asam Laktat asal Bekasam Penghasil Lipase pada Substrat Margarin.
Penulis mengucapkan terima kasih kepada seluruh pihak yang terlibat (baik langsung maupun tidak) dalam seluruh kegiatan tugas akhir penulis: Dr dr Sri Budiarti dan Dr Desniar SPi MSi atas bantuan materiil dan non materiil, bimbingan, serta arahan selama penelitian hingga akhir penulisan karya ilmiah. Terima kasih tak terhingga penulis sampaikan kepada seluruh staff dosen, laboran, dan Sekretariat Akademik Departemen Biologi yang telah membatu kelancaran studi selama belajar 4 tahun di IPB. Selain itu, terima kasih penulis sampaikan kepada ibu serta seluruh keluarga atas semangat, doa dan dukungan yang selalu diberikan kepada penulis. Terima kasih juga kepada laboran Bu Ema, Mbak Dilla, Mbak Dini; teman-teman Laboratorium Mikrobiologi Hasil Perairan Departemen THP-FPIK IPB yaitu Titin, Atika, Susi, Mbak Astri, Mbak Alif dan Mbak Ayu; rekan satu bimbingan Elda dan Azmah atas bantuan dan kerja sama selama penelitian berlangsung. Teman-teman Biologi 48, FORCES IPB, LDF Serum-G FMIPA IPB, Pondok Pesantren Mahasiswi Al-Iffah IPB, Pinky Kost, dan kepada banyak pihak yang tidak bisa penulis sebutkan satu per satu terima kasih atas segala bantuan dan motivasinya. Semoga Allah SWT membalas kebaikan kalian semua.
Akhir kata semoga karya ilmiah ini bermanfaat. Aamiin.
Bogor, September 2015
DAFTAR ISI
DAFTAR TABEL xiv
DAFTAR GAMBAR xiv
DAFTAR LAMPIRAN xiv
PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 2
BAHAN DAN METODE 3
Waktu dan Tempat 3
Bahan dan Alat 3
Metode Penelitian 3
Verifikasi Isolat Bakteri Asam Laktat 3
Uji Lipolitik Isolat Bakteri Asam Laktat pada Subtrat Margarin 4 Identifikasi Isolat Bakteri Asam Laktat Terpilih 4 Pengukuran Kurva Pertumbuhan Isolat Terpilih 5
Pengukuran Aktivitas Unit Lipase 5
HASIL DAN PEMBAHASAN 7
Verifikasi Isolat Bakteri Asam Laktat 7
Uji Lipolitik Bakteri Asam Laktat pada Substrat Margarin 9
Identifikasi Isolat BAL BI(2) 10
Kurva Tumbuh dan Aktivitas Unit Lipase Lactococcus lactis 12
SIMPULAN DAN SARAN 14
Simpulan 14
Saran 14
DAFTAR PUSTAKA 15
LAMPIRAN 17
DAFTAR TABEL
1 Hasil peremajaan 18 isolat asal bekasam koleksi Desniar (2012) 7
2 Hasil verifikasi 6 isolat bakteri terpilih 8
3 Hasil uji fermentasi gula dengan API 50 CHL 11
DAFTAR GAMBAR
1 Pengamatan mikroskopis morfologi isolat bakteri dengan pewarnaan
Gram Perbesaran 40x10 9
2 Uji lipolitik di bawah sinar UV 10
DAFTAR LAMPIRAN
1 Kuantitasi mikrob: hitungan cawan BAL BI(2) 17
2 Kuantitasi mikrob: pengukuran massa sel BAL BI(2) 18 3 Identifikasi BI(2) menggunakan API 50 CHL (API System, BioMerieux
France) 18
4 Bagan alir pembuatan reagen cupric acetate-pyridine 19
5 Kurva standar asam oleat 20
PENDAHULUAN
Latar Belakang
Lipase merupakan enzim yang menghidrolisis lipid menjadi asam lemak dan gliserol. Lipase berasal dari mikroorganisme memiliki potensi industri yang besar karena spesifitas substrat dan kemampuan enzim untuk tetap aktif dalam pelarut organik. Enzim lipase telah diaplikasikan pada berbagai bidang kesehatan; industri makanan, detergen, kertas dan pulp; sintesis bahan organik serta proses biodiesel (Sharma et al. 2001).
Bakteri asam laktat (BAL) merupakan salah satu mikroorganisme penghasil lipase (Andersen dan Ostdal 1995; Meyers et al. 1996; Lopes et al. 2002; Kumar
et al. 2012). Bakteri asam laktat merupakan kelompok bakteri gram positif yang tidak membentuk spora dan dapat memfermentasikan karbohidrat untuk menghasilkan asam laktat. Bakteri asam laktat berperan penting dalam proses fermentasi makanan untuk mengawetkan kualitas nutrisi bahan baku serta menghambat pertumbuhan bakteri pembusuk dan patogen (Diop et al. 2007). Peranan penting lainnya di bidang industri dan pertanian antara lain: penambahan aroma pada keju (Bettache et al. 2012), fermentasi daging untuk bahan sosis (Sihombing et al. 2015), pembuatan yoghurt dari sari kedelai (Yusmarini et al.
2010) dan fermentasi ikan untuk produk pangan (Paludan-Muller et al. 2002). Desniar (2012) telah mengisolasi bakteri asam laktat asal bekasam dari Indramayu (Jawa Barat), Ogan Ilir dan Ogan Komiring Ilir (Sumatera Selatan). Bekasam merupakan salah satu makanan olahan tradisional khas Indonesia yang berasal dari fermentasi ikan. Bekasam memiliki rasa asam dan banyak mengandung bakteri asam laktat. Proses pembuatan bekasam menggunakan fermentasi secara spontan dengan bahan baku ikan air tawar, garam dan sumber karbohidrat seperti nasi atau tape dengan lama fermentasi 4-10 hari.
Bakteri asam laktat asal bekasam berpotensi penghasil lipase pendegradasi lipid pada margarin perlu dicari. Margarin merupakan produk pangan dari minyak nabati memiliki kandungan asam lemak jenuh dan tidak jenuh (Hermanto et al.
2010). Hampir setiap jenis pangan olahan seperti aneka kue, roti, makanan cepat saji yang disukai masyarakat mengandung margarin. Konsumsi margarin yang berlebih akan menaikkan kadar kolesterol dalam darah yang mengakibatkan penyakit hiperkolesterolemia. Seseorang dengan kadar lipase dalam tubuh tidak kecukupan, margarin yang berfungsi sebagai sumber energi tidak dapat dicerna sehingga kecukupan energi tidak terpenuhi. Enzim lipase akan membantu mencerna margarin dalam tubuh maupun mendegradasi lipid dalam margarin.
2
Tujuan Penelitian
3
BAHAN DAN METODE
Waktu dan Tempat
Penelitian dilaksanakan pada bulan Januari hingga Juli 2015 di Laboratorium Mikrobiologi Hasil Perairan, Departemen Teknologi Hasil Perairan (THP), FPIK IPB dan Laboratorium Mikrobiologi, Departemen Biologi, FMIPA IPB.
Bahan dan Alat
Bahan utama yang digunakan dalam penelitian ini antara lain: isolat bakteri asam laktat asal bekasam (BI(1), BI(2), BI(3), BP(3), BP(4), BP(6), BP(7), BP(10), BP(20), SK(5), SK(16), SS(8), SS(10), SS(13), NS(6), NS(9), NS(14), NS(16)) yang diperoleh dari hasil isolasi Desniar (2012) dari pengolah lokal di Kabupaten Indramayu, Jawa Barat dan Kabupaten Ogan Komiring Ilir, Sumatera Selatan; Staphylococcus aureus; Escherichia coli; sulfid indol motility (SIM),
nutrient agar (NA), de man rogosa agar (MRSA), de man rogosa broth (MRSB), margarin komersial 1% (b/v), Rhodamine B (Merck), minyak zaitun (virgin olive oil) komersial, lugol, kristal ungu, safranin, hijau malasit, minyak imersi, alkohol 95%, safranin, H2O2 3% (v/v), mineral, akuades, buffer fosfat, 6N HCl, isooktan,
dan cupric acetate pyridine.
Alat-alat penelitian meliputi: API 50 CHL (BioMerieux France), mikroskop optiklab (Olympus), gelas obyek, kaca preparat, oven, inkubator (Yamato IS900), inkubator bergoyang (Termoshaker), UV (Alpha Innotech), autoklaf (Yamato SM 52), sentrifuge (Eppendorf Mini Spin dengan Rotor F-45-12-11), vortex, spektrofotometer (Sprectonic 20 Genesys), jarum oose, bunsen, pipet mikro (Gilson), tabung reaksi, cawan petri kecil, dan elenmeyer.
Metode Penelitian
Verifikasi Isolat Bakteri Asam Laktat
Delapan belas Isolat bakteri asam laktat koleksi Desniar (2012) diremajakan di media agar miring MRSA. Isolat-isolat tersebut diambil masing-masing sebanyak 3 loop menggunakan jarum oose kemudian digores zig-zag secara aseptik. Isolat diinkubasi selama 48 jam pada suhu 37ºC dalam kondisi anaerob. Isolat yang tumbuh pada media MRSA kemudian diidentifikasi ulang karakter meliputi: uji pewarnaan Gram, uji katalase, uji motilitas, dan uji pewarnaan spora (Fardiaz 1989).
1) Uji perwanaan Gram
4
diwarnai dengan larutan safranin selama 10-20 detik dan dibilas dengan air dan keringkan dengan kertas serap. Bakteri diamati di bawah mikroskop optiklab menggunakan lensa obyektif 100x dan diberi minyak imersi kemudian dicatat bentuk, besar mikroba, cara pengelompokan (tunggal, berpasangan, rantai, bergerombol, dsb), pembentukan spora, dan reaksi Gram.
2) Uji katalase
Uji katalase dilakukan pada biakan isolat terpilih. Sebanyak satu oose bakteri dioleskan pada kaca objek kering dan diteteskan 2-3 tetes H2O2 3%. Bila
terbentuk gelembung udara, maka bakteri dinyatakan katalase positif. Bakteri aerob memberikan reaksi positif sedangkan bakteri anaerob memberikan reaksi negatif.
3) Uji motilitas
Uji motilitas dilakukan dengan mengambil satu loop isolat bakteri asam laktat yang sudah disegarkan kemudian dimasukkan ke agar SIM pada tabung reaksi. Hasil uji isolat yang motil ditunjukkan dengan pertumbuhan bakteri di permukaan agar SIM.
4) Uji pewarnaan spora
Pewarna hijau malasit diteteskan di atas gelas obyek dan dibiarkan selama 20 menit tanpa pemanasam atau selama 5 menit di atas penangas air. Kemudian dicuci hati-hati dengan air selama 20-30 detik dan diberi safranin 30 detik. Gelas obyek dibilas kembali dengan air lalu diserap dengan kertas serap. Bentuk dan besar endospora serta letak endospora di dalam sel diamati di bawah mikroskop optiklab menggunakan lensa obyektif minyak imersi.
Uji Lipolitik Isolat Bakteri Asam Laktat pada Subtrat Margarin
Bakteri asam laktat penghasil lipase pendegradasi margarin dikerjakan berdasarkan metode Kouker dan Jaeger (1987) dengan modifikasi. Biakan bakteri asam laktat ditumbuhkan di cawan petri yang berisi media MRSA yang mengandung 200µL Rhodamine B dan substrat margarin komersial 1%. Biakan bakteri sebanyak dua loop diambil menggunakan oose kemudian ditotolkan pada tengah media dalam kondisi aseptik. Cawan petri disimpan di wadah kedap udara lalu diinkubasi pada suhu 37ºC selama 48 jam. Kultur bakteri diamati menggunakan UV pada 365 nm untuk melihat ada tidaknya pendaran pada sel. Perlakuan kontrol positif digunakan bakteri S. aureus sedangkan kontrol negatif digunakan bakteri E.coli dengan langkah-langkah sama seperti di atas. Media pertumbuhan untuk S. aureus dan E. coli menggunakan NA. Percobaan masing-masing dilakukan sebanyak dua kali ulangan. Bakteri asam laktat yang menghasilkan lipase akan muncul pendaran warna merah pada koloni sel bakteri. Identifikasi Isolat Bakteri Asam Laktat Terpilih
Pola fermentasi gula ditentukan menggunakan uji kit API 50 CHL (API System, BioMerieux France) (Lampiran 3). Isolat diidentifikasi menggunakan software apiweb yaitu API 50 CHL V5.1 dari BioMerieux. Isolat BAL terpilih yang telah disegarkan dan ditumbuhkan dari agar miring ke cawan gores MRSA diambil dengan ose ke dalam media API 50 CHL lalu dimasukkan ke dalam kit dengan mikropipet steril dan bagian atasnya ditutup dengan mineral oil. Kit
diinkubasi dalam inkubator 37˚C selama 48 jam dan diamati perubahan warnanya.
5 mengandung bahan aktif dan digunakan sebagai kontrol positif sedangkan tube 1-49 berisi gula dan turunannya. Selama inkubasi (24 - 48 jam), gula akan difermentasi menjadi asam yang akan menurunkan pH. Penurunan pH terlihat adanya perubahan warna dari ungu menjadi kuning. Maka, hasil tersebut adalah positif. Khusus tube nomor 25 (uji Esculin Ferric Citrate) hasil positif ditunjukkan dengan perubahan warna hitam. Hasil dari kit tersebut merupakan profil biokimia yang digunakan untuk mengidentifikasi spesies BAL.
Pengukuran Kurva Pertumbuhan Isolat Terpilih
Pembuatan kurva pertumbuhan isolat BAL terpilih dilakukan dengan beberapa tahapan, yaitu: kuantasi mikrob (pengukuran massa sel isoalt terpilih), pembuatan kurva standar, dan pengukuran kurva pertumbuhan isolat BAL terpilih pada substrat minyak zaitun (Hadioetomo 1993).
1) Kuantitasi Mikrob Isolat Terpilih
Kultur bakteri 1 mL dari starter di atas diencerkan ke dalam tabung reaksi yang berisi 9 mL larutan garfis NaCl kemudian diambil 1 mL dari tabung sebelumnya dan dipindahkan ke tabung reaksi dengan pengenceran yang lebih tinggi. Pengenceran dibuat sampai dengan pengenceran 10-9, masing-masing duplo. Penghitungan jumlah koloni bakteri di cawan yang mengandung jumlah 30-300 koloni. Perhitungan Total Bakteri BAL menggunakan rumus di bawah ini :
Jumlah koloni bakteri =
2) Pembuatan Kurva Standar
Pembuatan kurva pertumbuhan diawali dengan pembuatan starter isolat terpilih. Isolat terpilih diinokulasikan pada 50 mL MRSB (tanpa substrat margarin) dan diinkubasi secara anaerob di inkubator suhu 37ºC selama 24 jam. Starter sebanyak 3 mL diambil kemudian dipindahkan ke larutan MRS-B di dalam tabung reaksi dengan perbandingan 1:2, 1:4, 1:8, 1:16. Densitas sel diukur menggunakan spektrofotometer sebanyak duplo pada tiap pengenceran. Data OD (Optical Density) 660 nm digunakan untuk mengetahui kurva standar bakteri (Lampiran 2).
3) Pengukuran Kurva Pertumbuhan
Starter isolat BAL terpilih 200 mL ditambahkan substrat minyak zaitun 1%. Lalu, diinkubasi menggunakan inkubator bergoyang 130 rpm pada suhu 37ºC selama 48 jam. Setiap 4 jam sekali dilakukan pengambilan kultur sel bakteri untuk diukur densitas selnya menggunakan spektrofotometer pada panjang gelombang 660 nm sebanyak 2 kali ulangan duplo.
Pengukuran Aktivitas Unit Lipase (Kwon dan Rhee 1986)
6
mL dipindahkan ke dalam tabung baru lalu ditambahkan dengan 1 mL cupric acetate-pyridine (Lampiran 4) dan dihomogenasikan menggunakan vortex selama 1 menit. Campuran diuukur menggunakan spektrofotometer pada absorbansi 715 nm. Pengukuran aktivitas lipase menggunakan kurva standar asam oleat yang diukur absorbansinya pada 715 nm (Lampiran 5). Aktivitas unit lipase dicari melalui rumus berikut:
Aktivitas unit lipase (unit/mL) = [ ]
Keterangan:
Volume total = volume total larutan awal (minyak zaitun, buffer, enzim) Volume akhir = volume larutan setelah inkubasi
1000 = nilai konversi dari mL ke µL
Volume enzim = volume enzim/supernatan yang diberikan ke dalam larutan T = waktu inkubasi (30 menit)
7
HASIL DAN PEMBAHASAN
Verifikasi Isolat Bakteri Asam Laktat
Peremajaan biakan menggunakan media MRSA bertujuan memberikan penyegaran pada nutrien yang dibutuhkan untuk pertumbuhan bakteri. Media MRSA merupakan media spesifik dan kompleks karena media mengandung komposisi nutrien yang lengkap dan selektif untuk pertumbuhan BAL. Hasil peremajaan tercantum pada Tabel 1. Isolat yang tumbuh yaitu BI(2), BP(3), BP(6), SK(5), SK(16), dan NS(6).
Isolat-isolat BAL memiliki kemampuan tumbuh berbeda karena bakteri memiliki respon beragam baik dalam persyaratan nutrisi maupun kondisi fisik (Pelczar dan Chan 2010). Selain, nutrien yang sesuai untuk kultivasi bakteri, kondisi fisik perlu disediakan di dalam lingkungannya yang memungkinkan pertumbuhan optimum, meliputi: suhu, oksigen yang tersedia, kondisi garam dan pH. Perlakuan suhu inkubasi yang diberikan terhadap 18 isolat sama yaitu suhu 37ºC selama 48 jam. Meyers et al. (1996) menyatakan bahwa masing-masing spesies BAL memiliki suhu kondisi pertumbuhan optimum yang berbeda, seperti
Lactococcus dan Leuconostoc 32˚C, Pediococcus 37˚C, serta Lactobacillus dan
Streptococcus 42˚C. Bakteri asam laktat yang memiliki adaptasi fisiologi baik akan mampu bertahan pada kondisi garam tinggi tinggi 2-7%, kondisi minim oksigen dan pH rendah (asam) 4.4 sampai basa 8.8 (Desniar 2012).
Tabel 1 Hasil peremajaan 18 isolat asal bekasam koleksi Desniar (2012)
Keterangan:
+ : tumbuh - : tidak tumbuh No Kode isolat Lokasi pengambilan
8
Tabel 2 Hasil verifikasi 6 isolat bakteri terpilih
No Kode isolat
Uji
Pewarnaan Gram Katalase Motilitas Pewarnaan spora
Keenam isolat kemudian dilakukan identifikasi ulang untuk memastikan bahwa keenam isolat kultur bakteri masih memiliki karakter sebagai bakteri asam laktat (BAL). Pengujian karakteristik BAL meliputi pewarnaan Gram, katalase, motilitas, dan perwarnaan spora. Hasil verifikasi keenam isolat terpilih dapat dilihat pada Tabel 2 dan Gambar 1.
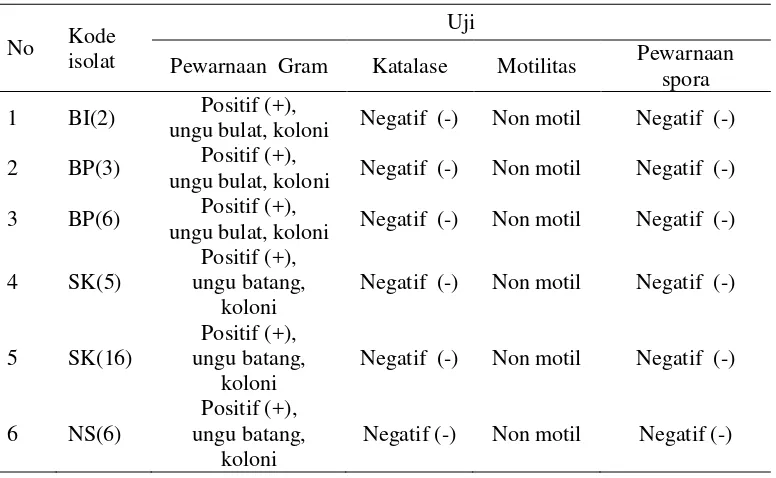
Berdasarkan karakter-karakter pada Tabel 2 diketahui bahwa semua isolat merupakan Gram positif; berbentuk kokus untuk isolat BI(2), BP(3), dan BP(6) serta berbentuk batang untuk SK(5), SK(16), dan NS(6); tidak menghasilkan gas hidrogen peroksida (H2O2) pada uji katalase karena kondisi pertumbuhan
mikroaerofilik atau hidup pada kondisi sedikit oksigen. Beberapa BAL menghasilkan H2O2 pada kondisi aerob dan karena kekurangan katalase selular.
Hidrogen peroksida merupakan agen pengoksidasi kuat dan dapat menjadi antimikroba terhadap bakteri, jamur, dan bakteriofage. Aktivitas H2O2 terhadap
bakteri Gram positif bersifat bakteristatik, sedangkan beberapa Gram negatif bersifat bakterisidal (Ouwend dan Vesterlund 2004 dalam Desniar 2012).
9
Gambar 1 Pengamatan mikroskopis morfologi isolat bakteri dengan pewarnaan Gram perbesaran 40x10 : a. BI(2), b. BP(3), c. BP(6), d. SK(5), e. SK(16), f. NS(6)
Uji Lipolitik Bakteri Asam Laktat pada Substrat Margarin
Kemampuan suatu mikroorganisme dalam menghasilkan lipase disebut lipolitik. Enzim lipase (acyl gliserol hydrolases EC 3.1.1.3) memiliki kemampuan memecah ikatan ester pada lemak menjadi asam lemak dan gliserol. Koloni BAL yang memiliki aktivitas lipase dapat dideteksi di bawah sinar UV secara sederhana yaitu menggunakan indikator Rhodamine B dan pemberian triasilgliserida yang diberikan pada media MRSA (Hou dan Johnson 1992). Substrat yang digunakan pada penelitian ini adalah margarin 1% berfungsi sebagai subtitusi triasilgriserida.
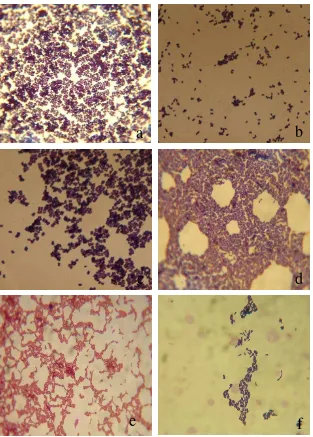
Hasil penelitian menunjukkan bahwa keenam isolat memiliki aktivitas lipase, meskipun dengan kekuatan pendaran yang berbeda (Gambar 2). Kontrol
a
c
a
b
a
d
aa
a
e
10
positif digunakan S. aureus menunjukkan pendaran warna jingga terang, sedangkan kontrol negatif digunakan E.coli yang tidak menghasilkan pendaran berwarna jingga. Pendaran terkuat dari keenam isolat BAL dihasilkan oleh isolat BI(2) kemudian SK(5) dan BP(3). Kouker dan Jeager (1987) menjelaskan bahwa
Rhodamine B merupakan indikator flouresens yang sensitif terhadap lipase. Bila, keenam isolat BAL terdapat aktivitas lipase, maka Rhodamine B akan mengikat asam-asam lemak yang terdapat pada margarin. Pembentukan dimer kompleks antara Rhodamine B dengan asam-asam lemak dan mono atau digliserida kemudian menghasilkan pendaran warna jingga yang dapat dideteksi di bawah sinar UV. Hal ini serupa dengan pernyataan Hou dan Johnson (1992) bahwa bakteri penghasil lipase yang baik dapat dilihat dari kekuatan pendaran dan besarnya diameter zona halo flourecense yang dihasilkan.
Gambar 2 Uji lipolitik di bawah sinar UV: a. Kontrol positif S. aureus
memperlihatkan aktivitas lipase; b. Kontrol E. coli tidak memerlihatkan aktivitas lipase; c-h. Isolat BI(2), BP(3), BP(6), SK(5), SK(16) dan NS(6) memperlihatkan aktivitas lipase pada media
Identifikasi Isolat BAL BI(2)
Berdasarkan analisis pola fermentasi gula menggunakan aplikasi web API 50 CHL V5.1, spesies BAL BI(2) adalah Lactococcus lactis ssp. lactis dengan nilai ID 82.40% (Tabel 3). Lactococcus lactis ssp. lactis merupakan salah satu strain dari Lactococcus lactis.
a
b
b
d
e
f
g
h
c
c
a
e
h
11 Tabel 3 Hasil uji fermentasi gula dengan API 50 CHL
No Atribut Gula Hasil
48 2KG Potassium 2-keto-gluconate -
12
Keterangan: + = dapat difermentasi, - = tidak dapat difermentasi
Lactococcus lactis merupakan spesies BAL yang memfermentasi glukosa utama atau disebut homofermentatif obligat. Berdasarkan Tabel 3, Lactococcus lactis dapat memfermentasi gula arabinosa, L-arabinosa, galaktosa, D-glukosa, D-fruktosa, D-mannosa, N-asetil glukosamin, amidalin, arbutin, erkulin ferisitrat, salisin, D-selobiosa, D-maltosa, D-laktosa, sukrosa, D-trehalosa, gentabiosa, dan D-tagatosa. Fermentasi glukosa dari BAL homofermentatif ini melalui glikolisis (Embden-Meyerhof-Parnas pathway) yang hasil asam organik dominannya berupa asam laktat (Lampiran 6). Lactococcus lactis merupakan bakteri non patogen dengan status aman GRAS (Generally Recognized as Safe) oleh US Food and Drug Administration dan status keamanan Qualified Presumption of Safety oleh European Food Safety Authority List of Microorganism (USA FDA 1995). Meskipun Lactococcus lactis dianggap aman dan menguntungkan, beberapa kasus tidak biasa sudah didokumentasikan pada pasien immunosupresan (Casalta dan Montel 2008).
Beberapa dekade terakhir, Lactococcus lactis menjadi fokus area penelitian yang sangat cepat karena berperan penting dalam industri hasil peternakan, misalnya Lactococcus lactis dapat digunakan untuk menambah cita rasa dan tekstur keju yang produksi aromanya oleh senyawa eksopolisakarida (Mireau dan Kleerebezem 2005). Lactococcus lactis juga ditemukan pada makanan fermentasi Korean Kim-chi dan Polynesian (Brown dan Valiere 2004). Hasil penelitian yang sudah diketahui khususnya tentang Lactococcus lactis spp. lactis antara lain: penghasil bakteriosin tipe nisin (Masud dan Anwar 2002), probiotik (Conway 1996), dan enzim proteinase (Sharpe 1979).
Kurva Tumbuh dan Aktivitas Unit Lipase Lactococcus lactis
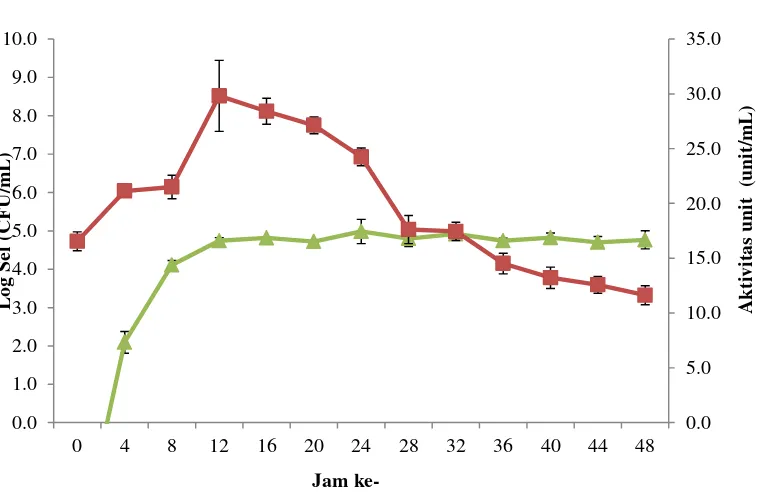
Jumlah sel dan aktivitas unit lipase tertinggi Lactococcus lactis terlihat pada fase log akhir yaitu masing-masing pada jam ke-12 sebesar 4.741 CFU/mL dan 29.812 unit/mL (Gambar 3). Pertumbuhan Lactococcus lactis memasuki fase stasioner mulai jam ke-16 sampai 48, sedangkan aktivitas lipase mulai menurun seiring pertumbuhan bakteri yang stasioner. Aktivitas lipase pada pengukuran jam ke-48 sebesar 11.619 unit/mL. Hasil ini sesuai dengan pernyataan Ngom (2000), kurva pertumbuhan dan aktivitas lipase berbanding lurus. Semakin tinggi pertumbuhan Lactococcus lactis, maka semakin besar aktivitas lipase yang dihasilkan. Lipase yang dihasilkan oleh Lactococcus lactis adalah lipase ekstraselular. Jaeger et al. (1994) menyatakan bahwa lipase ekstraselular tampak pada kultur media ketika pertumbuhan bakteri mencapai fase log akhir. Enzim ekstraselular tersebut disekresikan melalui membran luar ke kultur media.
13
Gambar 3 Kurva pertumbuhan dan aktivitas unit lipase Lactococcus lactis spp.
lactis pada susbtrat minyak zaitun. Keteran gan: log sel, aktivitas lipase.
Penelitian ini menggunakan reaksi katalis oleh aktivitas unit lipase, artinya kemampuan satu unit lipase dalam menghidrolisis minyak zaitun menjadi asam oleat per satuan mL. Asam oleat merupakan asam lemak tidak jenuh dan monomer penyusun trigliserida yang dihasilkan dari hidrolisis trigliserida oleh lipase. Berdasarkan Kwon dan Rhee (1986), penggunaan asam oleat pada kurva standar bertujuan untuk mendekati jumlah asam lemak yang dibebaskan oleh minyak zaitun oleh enzim ekstrak kasar.
Sintesis lipase oleh bakteri dipengaruhi oleh kondisi pertumbuhan, termasuk ketersediaan sumber karbon dan nitrogen, jumlah oksigen, aktivator substrat, suhu inkubasi, pH, dan sumber inokulum (Hadeball 1991). Shelley et al. (1987) menambahkan tiga faktor yang harus kerja bersama jika aktivitas lipase dari bakteri Gram positif ingin dideteksi, yaitu: bakteri harus tumbuh, bakteri memproduksi lipase mengikuti kurva pertumbuhannya, dan metode deteksi lipase yang digunakan. Faktor-faktor yang dikemukan di atas akan berpengaruh terhadap berhasil tidaknya produksi enzim lipase.
Penelitian tentang BAL yang sudah diketahui memiliki aktivitas lipase antara lain: Lactobacillus plantarum MF32 dari daging fermentasi (Andersen dan Ostdal 1994); Lactobacillus sp., Lactococcus sp., Streptococcus thermophilus
(Meyers et al. 1996); dan Lactobacillus plantarum DSMZ 12028 dari sosis tradisional Portugis (Lopes et al. 2002). Hasil aktivitas lipase pada penelitian BAL asal bekasam diharapkan mampu berperan memberikan tambahan informasi dalam aplikasi Lactococcus lactis di bidang kesehatan sebagai pendegradasi lipid akibat konsumsi margarin berlebih.
14
SIMPULAN DAN SARAN
Simpulan
Isolat BI(2), BP(3), BP(6), SK(5), SK(16), dan NS(6) memiliki potensi lipolitik dalam mendegradasi lipid pada margarin. Pendaran terkuat oleh isolat BAL BI(2). Identifikasi isolat BAL BI(2) adalah Lactococus lactis spp. lactis. Jumlah sel dan aktivitas lipase tertinggi Lactococcus lactis terlihat pada fase log akhir.
Saran
Penelitian selanjutnya perlu dilakukan pengukuran aktivitas lipase spesifik
15
DAFTAR PUSTAKA
Andersen JH, Ostdal H. 1995. Partial purification and characterisation of a lipase from Lactobacillus plantarum MF32. Food Chemistry. 53: 369-373. Bettache G, Fatma A, Miloud H, Mebrouk K. 2012. Isolation and identification of
Lactic Acid Bacteria from Dhan a traditional butter and thei major technology traits. World Applied Sciences Journal. 17(4): 480-488.
Brown AC, Valiere A. 2004. The medicinal uses of poi. Nutr.Clin.Care. 7: 705-817.
Casalta E, Montel MC. 2008. Safety assessment of dairy microorganism the
Lactococcus genus. Int.J.Food Microbiol. 126: 271-273.
Conway PL. 1996. Selection criteria for probiotic microorganism. Asia Pasific J. Clin. Nutr. 10-14.
Diop MB et al. 2007. Bacteriocin producers from traditional food products.
Biotechnol Agron Soc Environ. 11: 275-281.
Desniar. 2012. Karakterisasi bakteri asam laktat asal dari produk fermentasi ikan bekasam [disertasi]. Bogor (ID): Institut Pertanian Bogor.
Fardiaz S. 1989. Penuntun Praktek Mikrobiologi Pangan. Bogor (ID): IPB Press Hadeball W. 1991. Production of lipase by Yarrowia lipolytica lipases from yeasts
review. Acta Biotech. 11: 159-167.
Hadioetomo RS. 1993. Mikrobiologi Dasar dalam Praktek. Jakarta (ID): PT Gramedia Pustaka Utama.
Hermanto S, Muawanah A, Wardhani P. 2010. Analisis Tingkat Kerusakan Lemak Nabati dan Lemak Hewani Akibat Proses Pemanasan [internet]. [diacu pada tanggal 5 Juli 2015]. Tersedia pada http: www.journal.uinjkt.ac.id.
Kouker G, Jaeger KE. 1987. Specific and sensitive plate assay for bacterial lipases. Appl. Environ Microbiol. 53: 211-213.
Kumar A, Surendra S, Parihar S, Batra N. 2012. Enrichment isolation and optimization of lipase producing Staphylococcus sp. from oil mill waste oil cake. Journal of Experimental Sciences. 3(8):26-30.
Kwon YD, Rhee JS. 1986. A simple and rapid colorimetriv method for determination of free fatty acids for lipase assay. JAOCS. 63(1): 89-92. Lopes M, Leitao AL, Regalla M, Marquez JJ, Carrondo MJ, Crespo MT. 2002.
Characterization of a highly thermostable extracellular lipase from
Lactobacillus plantarum. International Journal of Food Microbiology. 76: 107-115.
Masud SHT, Anwar K. 2002. Role of lactic acid bacteria in food preservatiob and human health. Pakistan Journal of Nutrition. 1(1): 20-24.
Meyers SA, Cuppett SL, Hutkins RW. 1996. Lipase production by lactic acid bacteria and activity on butter oil. Int.J.Food Microbiol. 13: 383-389. Mireau I, Klereebezem M. 2005. 10 years of the nisin controlled gene expression
system in Lactococcus lactis. Appl.Microbiol.Biotechnol. 68: 705-717. Ngom MO. 2000. Extracellular lipase from selected microorganisms [tesis].
16
Paludan-Muller C, Madsen M, Sophanodora P, Gram L, Moller PL. 2002. Fermentation and microflora of plaa-som a Thai fermented fish product prepared with salt consentations. Int J Food Microbiol. 73: 61-70.
Pelczar MJ, Chan ECS. 2010. Dasar-Dasar Mikrobiologi Jilid 1. Jakarta (ID): Penerbit UI Press.
Sharma R, Chisti Y, Benerjee UC. 2001. Research review paper production purification characterization and applications of lipases. Biotechonoly Advances. 19:627-662.
Sharpe ME. 1979. Lactic acid bacteria in dairy industry. JSOC Dairy Technol. 32: 9-18.
Shelley AW. Deeth HC, Macrae IC. 1987. Revie methods of enumeration detection and isolation of lipolytic microorganisms with special reference to dairy applications. J. Microb. Methods. 6: 123-137.
Sihombing DE, Arief II, Budiarti S. 2015. Application of antibacterial agent produced by Lactobacillus plantarum IIA-1A5 as natural preventation on beef during room temperate storage. Advance Journal of Food Science and Technology. 8(4): 251-255.
US FDA. 1995. Aminopeptidase Enzyme Preparation Derived from Lactococcus lactis [internet]. [diacu pada tanggal 1 Agustus 2015]. Tersedia pada http: www.accessdata.fda.gov.
Wiseman A. 1975. Enzyme Induction Organism Catalyse The Hydrolysis of Esters Other Than Acylglycerols. New York (USA): Plenum Press.
17
LAMPIRAN
Lampiran 1 Kuantitasi mikrob: hitungan cawan BAL BI(2) Pengenceran Jumlah
sel/mL
10-1 TBUD
10-2 TBUD
10-3 TBUD
10-4 TBUD
10-5 TBUD
10-6 TBUD
10-7 1.42 x 109 10-8 0.34 x 109
10-9 TSUD
18
Lampiran 2 Kuantitasi mikrob: pengukuran massa sel BAL BI(2) Pengenceran Ulangan Optical density (A) Rata-rata
OD (A)
19 Pengukuran pertumbuhan BAL Lactococcus lactis spp. lactis pada substrat minyak zaitun
Jam ke-
Rata-rata OD (A) Log sel (CFU/mL)
Rata-rata log sel Ulangan
1
Ulangan 2
Ulangan 1
Ulangan 2
0 0.008 0.036 -3.627 -3.464 -3.546 ± 0.115 4 0.939 1.007 1.895 2.296 2.095 ± 0.283 8 1.298 1.327 4.023 4.195 4.109 ± 0.122 12 1.428 1.409 4.797 4.684 4.741 ± 0.080 16 1.429 1.434 4.800 4.833 4.816 ± 0.023 20 1.415 1.415 4.720 4.717 4.718 ± 0.002 24 1.422 1.497 4.761 5.207 4.984 ± 0.315 28 1.404 1.453 4.655 4.942 4.799 ± 0.204 32 1.444 1.455 4.889 4.957 4.923 ± 0.048 36 1.427 1.410 4.788 4.690 4.739 ± 0.069 40 1.447 1.418 4.907 4.738 4.822 ± 0.120 44 1.430 1.394 4.809 4.592 4.701 ± 0.153 48 1.451 1.395 4.934 4.598 4.766 ± 0.237 Keterangan:
18
Lampiran 3 Identifikasi BI(2) menggunakan API 50 CHL (API System, BioMerieux France)
Kontrol positif
Hasil Positif, media
berwarna kuning
Negatif, media tetap berwarna biru
Sumur ke-1
Hasil Positif (sumur ke-25), media
berwarna hitam
19 Lampiran 4 Bagan alir pembuatan reagen cupric acetate-pyridine
5 gram cupric-acetate
dilarutkan dengan 100 mL akuades hingga homogen
pH larutan disesuaikan dengan pyridine hingga
20
Lampiran 5 Kurva standar asam oleat Konsentrasi
Pengukuran aktifitas unit lipase Lactococcus lactis spp. lactis
Jam ke-
21 Lampiran 6 Jalur fermentasi BAL homofermentatif
Keterangan: garis putus-putus menunjukkan bagian oksidasi-reduksi
22
RIWAYAT HIDUP
Penulis dilahirkan di Pati 19 September 1993 dari pasangan Alm. Fandori dan Siti Khotijah. Penulis merupakan anak kelima dari lima bersaudara. Tahun 2011 penulis lulus dari SMA Negeri 1 Tayu, Kabupaten Pati Provinsi Jawa Tengah, dan pada tahun yang sama penulis diterima di Departemen Biologi FMIPA IPB melalui jalur SNMPTN Undangan. Penulis mendapatkan beasiswa Bidik Misi dari DIKTI tahun 2011-2015.
Selama menumpuh pendidikan di IPB, berbagai pengalaman organisasi dan prestasi akademik serta non akademik telah penulis dapatkan. Penulis pernah aktif di lembaga kemahasiswaan Dewan Musholla Asrama TPB IPB (2011-2012), UKM Keilmiahan FORCES (2011-2015), Ikatan Keluarga Mahasiswa Pati IPB (2011-2015), koordinator putri Paguyuban Bidik Misi FMIPA IPB (2011-2013), dan LDF Serambi Ruhiyah (Serum)-G FMIPA IPB (2014-2015).
Prestasi unggulan yang pernah penulis peroleh antara lain: PKM-M didanai DIKTI (2012), Finalis 4 besar tingkat Regional Science Project OSN Pertamina (2012), Juara 1 Poster Terfavorit Science Project OSN Pertamina tingkat Jawa Barat (2012), Runner up Scientific Paper 3rd International Multidisiplinary Research di Kota Bacolod-Filipina (2013), Juara 1 LKTI tingkat Nasional di Universitas Jember (2013), Delegasi Departemen Biologi AIMS
Preliminary Short Stay Program di Universitas Ibaraki-Jepang (2014), peringkat 1 Mahasiswa Berprestasi Departemen Biologi (2014-2015), serta peringkat 3 Mahasiswa Berprestasi FMIPA IPB (2015).