PRODUKSI ENZIM PROTEASE DARI BAKTERI ASAM
LAKTAT ASAL BEKASAM
NURTIKA KURNIATI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul Produksi enzim protease dari bakteri asam laktat asal bekasam adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor
Bogor, Februari 2015
RINGKASAN
NURTIKA KURNIATI. Produksi Enzim Protease dari Bakteri Asam Laktat asal Bekasam. Dibimbing oleh NISA RACHMANIA MUBARIK dan DESNIAR.
Protease adalah enzim yang mampu menghidrolisis protein menjadi senyawa-senyawa yang lebih sederhana seperti peptida kecil dan asam amino. Industri enzim dunia hampir 60% merupakan enzim protease yang berasal dari mikroba. Industri pengguna protease diantaranya ialah industri deterjen, makanan, obat-obatan, kimia, kulit, dan kertas. Mikroorganisme sebagai sumber enzim lebih menguntungkan karena biaya produksi yang murah, menggunakan sumber yang ramah lingkungan, lebih mudah ditingkatkan produktivitasnya dan termostabil.
Salah satu mikroorganisme potensial penghasil enzim protease ialah bakteri asam laktat (BAL) yang diisolasi dari bekasam. Lactobacillus plantarum SK (5) ialah jenis bakteri asam laktat yang diisolasi dari produk fermentasi ikan (bekasam) Indonesia yang digunakan pada penelitian ini. Penelitian pendahuluan dilakukan sebelum melakukan optimasi medium, pH, dan inokulum meliputi pemeliharaan dan pertumbuhan bakteri asam laktat dengan menggunakan medium de Man Ragosa Sharpe (MRSA), penapisan isolat bakteri asam laktat penghasil protease berdasarkan zona bening yang terbentuk dari medium dengan menggunakan nutrient broth (NB), skim milk agar (SMA), MRSA, serta pembuatan kurva tumbuh dan produksi protease untuk mengetahui waktu optimum dari bakteri asam laktat terpilih. Selanjutnya dilakukan produksi enzim protease dengan menggunakan response surface methodology (RSM). Tujuan penelitian ini ialah untuk mendapatkan kondisi optimum produksi enzim protease dari bakteri asam laktat terpilih dengan menggunakan RSM dengan variasi glukosa, pepton, ekstrak khamir, volume inokulum, dan pH.
Penentuan titik optimum aktivitas enzim protease menggunakan response surface methodology (RSM) dan rancangan percobaan menggunakan central composite design (CCD). Response surface methodology mempelajari faktor terhadap respon secara bersamaan dan juga mempelajari hubungan satu atau lebih faktor (variabel independen) dengan respon (variabel dependent). Nilai respon aktivitas spesifik protease (U/mg) tertinggi ialah 6.393 U/mg protein dengan variabel independen yang mempengaruhi ialah glukosa 6%, pepton 6%, ekstrak khamir 7.5%, inokulum 3 mL, dan pH 6 pada isolat Lactobacillus plantarum SK (5) dan nilai validasi komposisi media sebesar 6.5034 U/mg protein pada jam ke-12. Sedangkan kondisi aktivitas enzim protease sebelum dioptimasi ialah 3.615 U/mg protein. Hasil validasi menunjukan bahwa model persamaan kondisi optimum ialah Y = -130.1888 + 11.7A + 9.433B + 3.896C + 5.976D + 15.573E – 0.976A2 – 0.7683B2 – 0.251C2 – 0.98D2 – 1.25E2. Optimasi produksi protease L. plantarum SK (5) dengan menggunakan RSM mengalami peningkatan dua kali lipat aktivitas enzim spesifik sebelum dioptimasi dan setelah dioptimasi.
SUMMARY
NURTIKA KURNIATI. Production of Protease Enzyme by Lactic Acid Bacteria from Bekasam. Supervised by NISA RACHMANIA MUBARIK and DESNIAR.
Proteases are the enzymes that hydrolyze the peptide linkages of proteins to simple proteins, peptides, and amino acid. Among all the different commercial enzymes, microbial protease in particular, represents about 60% of the enzyme industrial sales in the world. Proteases find their applications in several industrial sector like in the detergent, food, pharmaceuticals, chemicals, leather and paper. Microbial proteases are gaining more important because of the cheaper production cost, use of renewble resources, due to their productivity and thermostability
One potential microorganism producing the protease enzyme is lactic acid bacteria (LAB ) were isolated from bekasam. Lactobacillus plantarum SK (5) is a lactid acid bacteria which isolated from Indonesia fermented fish (bekasam). The isolate was chosen to this study. Preliminary research conducted prior to the optimization of medium, pH, and inoculum covers the maintenance and growth of lactic acid bacteria by using the medium of de Man Ragoso Sharpe (MRSA) screening isolates of protease producing lactic acid bacteria based on a clear zone formed from the medium by using nutrient broth (NB), skim milk agar (SMA), MRSA, as well as the manufacture and production of protease growth curve to determine the optimum time of selected lactic acid bacteria. Further optimization of enzyme production using response surface method (RSM). The aims of this study was to select the composition of medium having the highest spesific protease activity produced from lactid acid bacteria selected using response surface methodology. The variables involved in this study were glucose, peptone, yeast extract, inoculation and pH.
These variables would be optimazed by central composite design (CCD) matrix of response surface methodology. Response surface methodology is a usefull tool for studying factors the effect the responses by varying them simultaneously and it can also be used to study the relationships between one are more factors (independent variables) and response (dependent variables). The optimal cultural condition for protease production obtained with response surface methodology were glucose 6%, peptone 6%, yeast extract 7.5%, inoculation 3 mL and pH 6. The spesific protease activity under unoptimized conditions was 3.615 U/mg. Under the final optimed conditions, the predicted response from protease production was 6.393 U/mg and the observed validated experiment value was 6.503 U/mg. The result of optimum equation based on the experiment RSM for spesific activity of protease Y = -130.1888 + 11.7A + 9.433B + 3.896C + 5.976D + 15.573E – 0.976A2 – 0.7683B2– 0.251C2– 0.98D2– 1.25E2. The optimization of the production of protease with response surface methodology resulted in about two fold increase in the production of enzyme by L. plantarum SK (5).
© Hak Cipta Milik IPB, Tahun 2014
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
PRODUKSI ENZIM PROTEASE DARI BAKTERI ASAM
LAKTAT ASAL BEKASAM
NURTIKA KURNIATI
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Bioteknologi
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PRAKATA
Puji dan syukur penulis panjatkan kepada Tuhan Yang Maha Esa atas segala rahmat dan karunia-Nya penulis dapat menyelesaikan tesis dengan judul "Produksi Enzim Protease dari Bakteri Asam Laktat asal Bekasam". Penulis mengucapkan terima kasih kepada semua pihak yang telah membantu dalam menyelesaikan tesis ini, terutama kepada:
1. Dr. Nisa Rachmania Mubarik, M.Si dan Dr. Desniar, S.Pi, M.Si sebagai dosen pembimbing tesis yang telah senantiasa memberikan arahan dan bimbingan, nasehat, saran, motivasi, waktu konsultasi, serta solusi dari setiap permasalahan yang dihadapi penulis selama menyelesaikan tesis ini.
2. Dr. Ir. Titi Candra Sunarti, M.Si sebagai penguji tesis yang telah memberikan masukan dan saran pada saat ujian tesis.
3. Prof. Dr. Ir. Suharsono, DEA sebagai ketua program studi Bioteknologi yang senantiasa memberikan motivasi dan arahan selama menyelesaikan tesis ini. 4. Kedua orang tua, mertua serta kakak, adik-adik, mba leni dan neng rike yang
senantiasa mendoakan dan memberikan semangat selama menyelesaikan tesis ini.
5. Suami saya tercinta, Dwi Fitrian Saputro, S.Si, M.Si yang selalu memberikan motivasi, dukungan moril dan materil selama menyelesaikan tesis ini.
6. Keluarga besar mahasiswa sekolah pascasarjana program studi Bioteknologi, yang telah memberikan dorongan semangat baik selama penelitian maupun saat penyusunan tesis ini.
7. Teman-teman dan semua pihak yang tidak bisa disebutkan satu persatu. Penulis menyadari bahwa masih terdapat kekurangan dalam penyusunan tesis ini. Penulis sangat mengharapkan kritik dan saran yang membangun. Semoga karya ilmiah ini bermanfaat
Bogor, 26 Februari 2015
DAFTAR ISI
DAFTAR TABEL viii
DAFTAR GAMBAR viii
DAFTAR LAMPIRAN viii
PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 2
Manfaat Penelitian 3
Ruang Lingkup Penelitian 3
TINJAUAN PUSTAKA 3
Bekasam 3
Bakteri Asam Laktat 4
Enzim Protease 5
Sistem Proteolitik pada Bakteri Asam Laktat 5
Produksi Enzim Protease 7
Response Surface Methodology 7
METODE 9
Waktu dan Tempat Penelitian 9
Peremajaan dan Penapisan Isolat Proteolitik 9
Penentuan Kurva Tumbuh dan Produksi Enzim 10
Penentuan Kondisi Produksi Protease 10
Rancangan untuk Produksi Enzim Protease 11
Prosedur Pengukuran 11
HASIL DAN PEMBAHASAN 12
Hasil 12
Pembahasan 20
SIMPULAN DAN SARAN 24
Simpulan 24
Saran 24
DAFTAR PUSTAKA 25
LAMPIRAN 31
DAFTAR TABEL
1 Optimasi enzim menggunakan RSM dengan berbagai bakteri 8
2 Penentuan kondisi produksi protease 10
3 Kode dan variabel percobaan dari 5 variabel bebas yang diamati dengan
CCD berdasarkan respon surface methodology 11
4 Aktivitas protease dari delapan isolat BAL 12
5 Hasil Analisi Ragam (ANOVA) 16
DAFTAR GAMBAR
1 Mekanime kerja enzim protease 5
2 Sistem proteolitik pada bakteri asam laktat (Savikoji et al. 2006) 6 3 Zona bening di sekeliling koloni bakteri Lactobacillus plantarum SK (5)
pada medium A) skim milk agar, B) nutrient agar; C) MRSA
yang mengandung susu skim 1% 13
4 Pertumbuhan sel dan aktivitas protease pada Lactobacillus plantarum
SK (5) pada media MRS ditambahkan 1% susu skim 13
5 Pengaruh konsentrasi glukosa (%) 14
6 Pengaruh konsentrasi pepton (%) 15
7 Pengaruh konsentrasi ekstrak khamir (%) 15
8 Pengaruh inokulum (mL) 16
9 Response surface plots bentuk tiga dimensi yang menggambarkan pengaruh variabel independen dengan respon (aktivitas enzim spesifik
(U.mg-1); a) pepton dan glukosa, b) ekstrak khamir dan glukosa 18 10 Response surface plots bentuk tiga dimensi yang menggambarkan
pengaruh variabel independen dengan respon (aktivitas enzim spesifik
(U.mg-1); a) pH dan glukosa, b) pH dan ekstrak khamir 18 11 Response surface plots bentuk tiga dimensi yang menggambarkan
pengaruh variabel independen dengan respon (aktivitas enzim spesifik
(U.mg-1); a) inokulum dan ekstrak khamir, b) ektrak khamir dan pepton 19 12 Response surface plots bentuk tiga dimensi yang menggambarkan
pengaruh variabel independen dengan respon (aktivitas enzim spesifik
(U.mg-1); a) inokulasi dan pepton dan b) pH dan pepton 20
DAFTAR LAMPIRAN
1 Metode pengujian aktivitas protease (Walter 1984) 31 2 Prosedur pembutan reagen yang digunakan dalam penelitian 32 3 Metode pengukuran kadar protein (Bradford 1976) 32 4 Respon aktivitas spesifik protease yang diamati dan diprediksi dengan
PENDAHULUAN
Latar Belakang
Industri enzim telah berkembang pesat dan menempati posisi penting dalam bidang industri. Kesadaran masyarakat terhadap masalah lingkungan serta adanya tekanan dari para ahli dan pecinta lingkungan menjadikan teknologi enzim sebagai salah satu altematif untuk menggantikan berbagai proses kimiawi dalam bidang industri (Akhdiya 2003). Menurut laporan baru oleh Industri Global Analis, Inc (2011) pasar global untuk enzim industri diperkirakan akan mencapai US$ 3,74 miliar pada tahun 2015. Pada tahun 2000 nilai perdagangan enzim di dunia telah mencapai 1.8 miliar US$ (Marketresearch 2001) dimana 60% diantaranya adalah enzim protease (Rao et al. 1998; Suhartono 2000; Industri Global Analis 2011).
Protease adalah enzim yang mampu menghidrolisis protein menjadi senyawa-senyawa yang lebih sederhana seperti peptida kecil dan asam amino. Industri pengguna protease di antaranya ialah industri deterjen, kulit, tekstil, makanan, hidrolisat protein, pengolahan susu, farmasi, makanan, bir, film, dan limbah (Huang et al. 2006). Kebutuhan enzim protease di Indonesia terus mengalami peningkatan namun masih tergantung pada produksi impor. Hampir semua kebutuhan enzim dipenuhi dari impor mencapai 108 ribu ton pada tahun 2000 dan 122.33 ribu ton pada 2001 dengan nilai perdagangan masing-masing US$ 124.1 juta dan US$ 124.1 juta (BPS 2001). Pada tahun 2013, menurut data Badan Pusat Statistik 2013 Indonesia mengimpor enzim sebanyak 531 ribu ton dengan nilai perdagangan mencapai US$ 2.48 miliar.
Melihat potensi pasar yang demikian besar, Indonesia seharusnya mampu memanfaatkan peluang tersebut untuk mendapatkan sumber penghasil enzim yang potensial. Menurut Oyeleke et al. (2010) protease dapat dengan mudah diisolasi dari berbagai sumber dari tanaman, hewan dan mikroorganisme dengan proses fermentasi. Mikroorganisme sebagai sumber enzim lebih menguntungkan dibandingkan dengan tumbuhan dan hewan karena pertumbuhannya cepat, dapat tumbuh pada substrat yang murah, lebih mudah ditingkatkan hasilnya melalui pengaturan kondisi pertumbuhan (Burhan et al. 2003) dan rekayasa genetika (Sandhya et al. 2005), serta mampu mencukupi aplikasi bioteknologi (Kumar et al. 2005). Adinarayana dan Ellaiah (2002) melaporkan bahwa sumber enzim protease yang digunakan industri berasal dari mikroorganisme. Adanya mikroorganisme yang unggul merupakan salah satu faktor penting dalam usaha produksi enzim.
2
dari pla-ra (Vichasilp et al. 2008). Pediococcus acidilactici ATCC 8042 diketahui menunjukkan aktivitas proteolitik ekstraseluler (Adriana et al. 2008). BAL telah terkenal secara luas sebagai mikroorganisme yang aman sehingga enzim yang dihasilkan dari BAL dapat digunakan secara langsung khususnya pada makanan (Jokar dan Karbassi 2011).
Banyak penelitian dilakukan untuk mencari dan mendapatkan informasi tentang BAL. Penelitian BAL dari bekasam telah dilakukan oleh Desniar (2012) yang secara umum memiliki ciri dan sifat Gram positif, berbentuk selnya batang atau bulat, katalase negatif, tidak membentuk endospora dan tidak motil. Enzim protease yang dihasilkan dari bakteri asam laktat seperti Pediococcus pentosaceus menghasilkan aktivitas sebesar 0,501 U/mL (Suri et al. 2013).
Optimasi produksi perlu dilakukan untuk memaksimalkan nilai produksi enzim protease (El Enshasy et al. 2008). Optimasi dengan metode konvensional membutuhkan waktu yang lama dan sangatlah mahal (Vohra dan Satyanarayana 2002). Dalam menggunakan metode konvensional dalam sekali percobaan, hanya satu variabel yang divariasikan sehingga variabel yang satu dengan variabel yang lain tidak diketahui dengan jelas. Tiap variabel diasumsikan independen satu sama lainnya sehingga perlu dilakukan banyak uji secara bertahap dan akan ada banyak variabel yang dipelajari pada saat proses produksi. Proses optimasi secara normal membutuhkan waktu yang lama dengan biaya yang mahal (Saravanakumar et al. 2010) untuk mempelajari berbagai variabel. Oleh karena itu, prosedur optimasi dengan jumlah percobaan yang begitu banyak dapat dilakukan dengan mudah mengunakan response surface methodology.
Response surface methodology merupakan suatu model untuk mempelajari faktor yang mempengaruhi respon secara bersamaan tanpa banyak percobaan yang dilakukan. Teknik optimasi dengan menggunakan response surface methodology dilakukan untuk mendapatkan solusi terbaik dari kombinasi variabel seperti pH, sumber karbon, serta nitrogen. Kelebihan teknik response surface methodology ialah untuk meminimalkan waktu, tenaga dan biaya (Adinarayana dan Ellaiah 2002).
Perumusan Masalah
1. Apakah produksi enzim protease dari BAL asal bekasam dapat dioptimasi dengan menggunakan response surface methodology (RSM)?
2. Bagaimana kondisi dan parameter produksi ketika jumlah enzim protease yang dihasilkan mencapai optimum?
Tujuan Penelitian
3 Manfaat Penelitian
Hasil penelitian ini diharapkan dapat memberikan informasi kondisi optimum produksi enzim protease dari Lactobacillus plantarum SK (5) dengan menggunakan response surface methodology (RSM) pada bidang industri makanan dan pakan hewan.
Ruang Lingkup Penelitian
Ruang lingkup dalam penelitian ini meliputi penapisan isolat serta optimasi kondisi bakteri asam laktat terpilih penghasil protease dengan variasi sumber karbon, nitrogen, pH, dan volume inokulum. Substrat yang digunakan pada saat produksi protease menggunakan metode RSM ialah glukosa sebagai sumber karbon, pepton dan ekstrak khamir sebagai sumber nitrogen. Bakteri asam laktat yang digunakan merupakan hasil isolasi oleh Dr. Desniar, S.Pi, M.Si dari bekasam yang karakteristiknya sudah diuji. Optimasi meliputi analisis regresi menggunakan menggunakan Software statistic „Design-ExpertR 8.0’, Stat-Ease, Inc., Minneapolis, USA, penentuan titik optimum aktivitas enzim protease menggunakan respon surface methodology (RSM) dan rancangan percobaan menggunakan central composite design (CCD) serta analisis pemilihan model dilakukan berdasarkan jumlah kuadrat dari urutan model (Sequential Model Sum of Squares), pengujian ketidaktepatan model (Lack of Fit) dan ringkasan model secara statistika (Model Summary Statistics).
TINJAUAN PUSTAKA
Bekasam
Bekasam adalah salah satu produk fermentasi ikan yang dijumpai di berbagai daerah di Indonesia terutama Sumatera Selatan, Kalimantan Selatan, dan Sulawesi. Fermentasi ikan menurut Adams (2009) merupakan suatu proses penguraian glikogen (protein kompleks) menjadi asam laktat yang disebabkan oleh pembakaran yang terjadi dalam daging ikan sesaat setelah aliran pada daging ikan berhenti. Protein kompleks tersebut terdapat dalam tubuh ikan yang diubah menjadi senyawa-senyawa lebih sederhana dengan bantuan enzim dari tubuh ikan atau mikroorganisme serta berlangsung dalam keadaan terkontrol atau diatur. Selama proses fermentasi, protein ikan akan terhidrolisis menjadi asam-asam amino dan peptida, kemudian asam-asam amino akan terurai lebih lanjut menjadi komponen-komponen lain yang berperan dalam pembentukan cita rasa produk. Menurut Ng et al. (2011) aktivitas protease pada hidrolisis protein ikan selama proses fermentasi ikan di Malaysia (Budu) menggunakan Valamugil seheli dan Ilisha melastoma sebagai substrat fermentasi mengindikasikan peningkatan aktivitas protease dan hidrolisisnya.
4
(Hwanhlem et al. 2010) dengan menggunakan proses metabolisme mikrob ataupun enzimatik dan menyebabkan perubahan dalam struktur biokimiawinya. Proses fermentasi menghasilkan zat-zat yang memberikan hasil rasa dan aroma yang spesifik dan disukai orang.
Proses pembuatan bekasam secara umum ialah ikan dibersihkan kemudian dicampur dengan garam dan diberi nasi setelah ditiriskan lalu dimasukkan ke dalam plastik, diikat dan disimpan pada wadah yang kedap udara selama kurang lebih satu minggu (Irianto dan Irianto 2009).
Bakteri Asam Laktat
Bakteri asam laktat (BAL) merupakan kelompok ordo Lactobacillales (Brener et al. 2005) yang memiliki ciri-ciri: Gram positif, berbentuk batang atau kokus, tidak berspora, non motil, katalase negatif dan oksidase negatif. BAL menggunakan karbohidrat sebagai sumber energi dan menghasilkan asam laktat sebagai produk utama atau satu-satunya fermentasi dan merupakan golongan bakteri fakultatif anaerob (Willey et al. 2009).
Berdasarkan hasil fermentasinya bakteri asam laktat dapat dibedakan atas 2 kelompok. Bakteri homofermentatif yaitu glukosa difermentasi menghasilkan asam laktat sebagai satu-satunya produk. Contoh bakteri homofermentatif ialah Streptococus, Pediococcus, dan beberapa Lactobacillus. Bakteri heterofermentatif yaitu glukosa difermentasikan selain menghasilkan asam laktat juga memproduksi senyawa-senyawa lainnya yaitu etanol, asam asetat dan CO2. Contoh bakteri heterofermentatif ialah Leuconostoc, dan beberapa spesies Lactobacillus.
Perbedaan kedua kelompok bakteri ini didasarkan pada kemampuan bakteri asam laktat dalam menghasilkan enzim fruktosa difosfat aldolase. Bakteri asam laktat homofermentatif mampu menghasilkan enzim fruktosa difosfat aldolase, sedangkan bakteri asam laktat heterofermentatif tidak mampu menghasilkan enzim tersebut tetapi bakteri asam laktat heterofermentatif mampu menghasilkan glukosa 6 fosfat dehidrogenase dan 6 fosfat glukonat dehidrogenase sehingga mempunyai jalur pembentukan asam laktat yang berbeda. Pada heterofermentatif, tidak ada aldolase dan heksosa isomerase tetapi menggunakan enzim fosfoketolase dan menghasilkan CO2. Metabolisme heterofermentatif dengan menggunakan heksosa (golongan karbohidrat yang terdiri dari 6 atom karbon) akan melalui jalur heksosa monofosfat atau pentosa fosfat. Sedangkan homofermentatif melibatkan aldolase dan heksosa aldolase namun tidak memiliki fosfoketolase serta hanya sedikit atau bahkan sama sekali tidak menghasilkan CO2. Jalur metabolisme dari yang digunakan pada homofermentatif adalah lintasan Embden-Meyerhof-Parnas (Aarnikunnas 2006; Axelsson 2004).
5 Enzim Protease
Enzim adalah suatu protein yang bertindak sebagai katalis biologis yang dapat mempercepat reaksi kimia namun tidak ikut bereaksi (Oyeleke dan Oduwole 2009). Enzim protease merupakan salah satu enzim yang penting dalam aplikasi bioteknologi. Protease merupakan satu di antara tiga kelompok enzim komersial yang diperdagangkan dengan nilai mencapai 60% total penjualan enzim yang aplikasinya sebagai katalisator hayati (Suhartono 2000). Protease adalah enzim yang mampu menghidrolisis protein menjadi senyawa-senyawa yang lebih sederhana seperti peptida kecil dan asam amino.
Berdasarkan mekanisme kerjanya dalam memotong ikatan peptida, enzim protease dibagi menjadi eksopeptidase dan endopeptidase. Eksopeptidase terdiri atas karboksi-ekso-peptidase yang memotong peptida dari arah gugus karboksil terminal dan amino-eksopeptidasedari gugus amino terminal, sedang endopeptidase memecah ikatan peptida dari dalam (Turk 2006).
Gambar 1 Mekanisme kerja enzim protease
Mikrob sebagai sumber enzim lebih menguntungkan karena pertumbuhannya cepat, dapat tumbuh pada substrat yang murah, lebih mudah ditingkatkan hasilnya melalui pengaturan kondisi pertumbuhan (Burhan et al. 2003). Protease mikrob dapat diklasifikasikan sebagai protease serin (E.C. 3.4.21), protease sulfhydril (E.C.3.4.22), protease asam (E.C.3.4.23) dan metaloprotease (E.C.3.4.24) (Ward et al. 2009).
Sistem Proteolitik pada Bakteri Aam Laktat
Bakteri asam laktat mempunyai sistem proteolitik yang kompleks yang dibutuhkan untuk pertumbuhan BAL itu sendiri dan juga memberi kontribusi yang
6
dan Lc. lactis, namun S. thermophilus memproduksi asam lebih cepat. Garabal et al. (2007), menyatakan bahwa Lactococcus lactis mempunyai aktivitas proteolitik lebih besar dibandingkan Lactobacilli dan Leuconostoc.
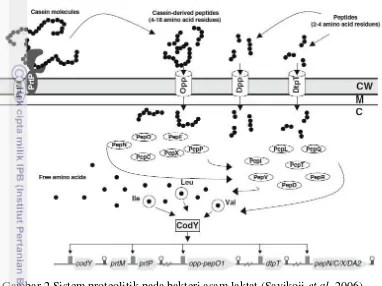
Gambar 2 Sistem proteolitik pada bakteri asam laktat (Savikoji et al. 2006) Tahap pertama dalam pemanfaatan kasein oleh BAL dilakukan oleh sel CEPS. Lima jenis enzim yang berbeda dikloning dan dikarakterisasi dari BAL, meliputi PrtP dari L. lactis dan Lactobacillus paracasei, PrtH dari L. helveticus, PrtR dari Lactobacillus rhamnosus, PRT dari S. thermophilus, dan PrtB dari L. bulgaricus (Kok et al.1988;. Holck dan Naes 1992; Gilbert et al. 1996; Pederson et al. 1999; Siezen 1999; Fernandez-Espla et al. 2000; Pastar et al. 2003). Pada lactococci, gen PrtP dapat menjadi plasmid, sedangkan CEPS dikarakterisasi dari lactobacilli. BAL biasanya hanya memiliki satu CEP tetapi adanya dua CEPS dilaporkan dalam strain L. helveticus dan L. bulgaricus (Stefanitsi et al. 1995; Pederson et al. 1999). Gen PrtP ditranskripsikan oleh gen yang mengkode membran terikat pada lipoprotein (PrtM) untuk autokatalitik PrtP (Haandrikman et al. 1989). CEPS memiliki preferensi yang kuat untuk kasein hidrofobik, protein paling melimpah dalam susu (Swaisgood 1982). Kasein dibagi ke dalam αs1-, αs2-, β-, dan -kasein. PrtPs Lactococcus dibagi menjadi enzim PI dan PIII yang dibedakan berdasarkan spesifisitas substrat untuk αS1-, β-, dan -kasein (Kunji et al. 1996). PI untuk mendegradasi β-kasein yang lebih dari 100 oligopeptida menjadi 4-30 residu asam amino (Juillard et al. 1995). Substrat -kasein dapat didegradasi oleh enzim yang aktivitasnya lebih rendah dari pada enzim PI, sedangkan PIII mampu mendegradasi αS1-, β-, dan -kasein sama baiknya (Pritchard dan Coolbear 1993).
7 2005). Dalam L. lactis MG1363, gen yang mengkode ikatan protein oligopeptida (Oppa), dua membran terpisahkan (OppB dan OppC) dan ikatan nukleotida (OppD dan OppF) yang ada di dalam operon (Tynkkynen et al. 1993). Sistem Opp L. lactis meliputi 18 residu peptida dan sifat peptida ini secara signifikan mempengaruhi transportasi kinetika yang terlibat (Detmers et al. 1998; Juillard et al. 1998).
Pepo dan PepF adalah endopeptidases, PepN/ PepC/ PEPP aminopeptidases, PepX X-prolyl dipeptidyl aminopeptidase, PepT tripeptidase, PepQ prolidase, PepR prolinase, Pepi iminopeptidase prolin, dan PepD dan PepV dipeptidases D dan V adalah enzim pertama yang bertindak atas oligopeptida. Endopeptidases tidak dapat menghidrolisis kasein secara utuh tetapi memiliki kemampuan untuk menghidrolisis ikatan peptida dari peptida yang berasal dari internal kasein. Setelah menjadi asam amino bebas, asam amino rantai cabang (isoleusin, leusin, dan valin) yang merupakan represor transkripsi Cody yang menggunakan sisa asam amino sebagai kofaktor Cody untuk merepresi ekspresi gen yang terdiri dari sistem proteolitik pada L. lactis.
Produksi Enzim Protease
Protease adalah enzim-enzim yang mengkatalisis pemecahan protein. Enzim protease merupakan enzim yang paling banyak dibutuhkan. Berbagai usaha telah dilakukan untuk mencari cara yang mudah dan murah dalam produksi enzim protease dengan aktivitas katalitiknya. Enzim protease banyak diproduksi dari mikrob diantaranya Bacillus sp. (Puri et al. 2002), Bacillus licheniformis (Soeka et al. 2011; El Enshasy et al. 2008), bakteri asam laktat (Yusmarini et al. 2010; Cristian et al. 2010), Lactobacillus plantarum (Margono et al. 2014), Serratia marcescens B08 (Venil et al. 2009).
Mikroorganisme merupakan salah satu faktor penting dalam usaha produksi enzim dengan keunggulan diantaranya dapat diproduksi dalam jumlah besar, produktivitasnya mudah ditingkatkan, mutu lebih seragam, harga lebih murah, dapat ditumbuhkan dengan cepat, pertumbuhannya mudah diatur, enzim yang dihasilkan mudah diisolasi. Keunggulan lainnya adalah mikroorganisme dapat hidup dan berkembang biak dalam media limbah pertanian yang relatif lebih murah (Stanbury and Whitaker 1984).
Peningkatan produksi protease seiring dengan meningkatnya pertumbuhan bakteri dan dipengaruhi oleh nutrien, oksigen, potensial oksidasi reduksi dan adanya zat-zat penghambat (Putri 2012) waktu, suhu, dan pH inkubasi (Soeka et al. 2011) `
Response Surface Methodology (RSM)
8
yang paling popular untuk studi optimasi. Metode ini memerlukan data yang tidak terlalu banyak, sehingga kondisi optimum respons dapat diperoleh dengan waktu yang tidak terlalu lama dan biaya yang minimum (Nuryati dan Salimy 2008).
RSM dapat dipergunakan untuk mencari suatu fungsi pendekatan yang cocok untuk meramalkan respons yang akan datang, serta menentukan nilai-nilai dari variabel bebas yang mengoptimumkan respons yang dipelajari. RSM memiliki variabel-variabel bebas sebagai X1, X2,….Xk yang akan dipelajari. Variabel-variabel bebas itu diasumsikan merupakan variabel kontinu dan dapat dikendalikan oleh peneliti tanpa kesalahan, sedangkan respons yang didefinisikan sebagai variabel tak bebas Y diasumsikan merupakan variabel acak (random variable).
Tabel 1 Optimasi enzim menggunakan RSM dengan berbagai bakteri Jenis Bakteri Faktor Independen Response Sumber
Bacillus sp. Pati, pepton,
Keberhasilan penerapan RSM telah dilaporkan pada berbagai penelitian antara lain senyawa antikapang (asam laktat) yang dihasilkan oleh Lactobacillus plantarum DR 1-6-2 berhasil dioptimasi dengan RSM (Rohmatussolihat 2013). Metode RSM dapat digunakan untuk mengoptimasi produksi enzim protease berbagai variabel (Adinarayana dan Ellaiah 2002). RSM dapat diaplikasikan pada proses kimia dan biokimia (Bas dan Boyaci 2007).
9 dan Rajni 2010). Aktivitas enzim protease bersifat alkali tertinggi dengan yield 1939 U.mL-1 pada batch fermentation oleh Bacillus sp. dengan menggunakan response surface methodology (RSM) dengan 4 variabel meliputi pati, pepton, waktu inkubasi dan inokulum (Puri et al. 2002).
Tahapan yang perlu dilakukan dalam melakukan optimasi dengan menggunakan RSM antara lain
1. Screening: berbagai faktor yang diduga berpengaruh diuji untuk diseleksi faktor mana saja yang benar-benar memberikan dampak besar terhadap sistem. 2. Improvisasi: pengubahan nilai-nilai faktor-faktor secara berulang-ulang
sehingga mendapatkan sekumpulan variasi data yang dapat diolah secara statistika kemudian dicari nilai optimumnya.
3. Penentuan titik optimum: proses pencarian titik optimum menggunakan metode regresi orde dua (Bakti 2012).
METODE
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan pada bulan Oktober 2013 hingga Juli 2014 di Laboratorium Mikrobiologi, Departemen Biologi, FMIPA dan Departemen Teknologi Hasil Perairan, FPIK, IPB.
Peremajaan dan Penapisan Isolat Proteolitik
Sebanyak 10 isolat bakteri dengan kode isolat SK (5), SK (15), BP (3), BP (8), BP (20), NS (9), NS (6), NS (5), BI (2) dan BI (3) yang diisolasi dari bekasam digoreskan pada media MRSA. Isolat kemudian diinkubasi selama 48 jam pada suhu 37 °C. Koloni tunggal kemudian ditumbuhkan pada skim milk agar (SMA), nutrient agar (NA) dan de Man ragoso sharpe agar (MRSA) dengan penambahan susu skim 1%. Isolat kemudian diinkubasi kembali pada inkubator Merk Yamato IS900 disimpan dalam keadaan kaleng tertutup pada suhu 37 oC selama 48 jam (Desniar 2012). Isolat proteolitik ditandai dengan pembentukan zona bening pada medium SMA, NA, dan MRSA dengan penambahan susu skim 1%. Indeks protease dihitung menggunakan rumus (A-B).B-1, A adalah diameter zona bening, B adalah diameter koloni bakteri.
10
Penentuan Kurva Tumbuh dan Produksi Enzim Protease
Sebanyak 2 lup isolat bakteri terpilih ditumbuhkan di medium MRS ditambahkan 1% susu skim kemudian diinkubasi selama 12 jam dengan kecepatan 130 rpm pada suhu 37 oC. Selanjutnya 1% (8.8 x 108 CFU.mL-1) inokulum diinokulasi ke medium MRS 100 mL ditambah 1% susu skim dalam Erlenmeyer 250 mL sebagai media produksi dan diinkubasi pada suhu 37 oC dengan kecepatan 130 rpm (Pranomo et al. 2003; Panda et al. 2008; Cristian et al. 2010; Margono et al. 2014). Setiap 3 jam dilakukan pengambilan kultur sel untuk diukur densitas selnya pada panjang gelombang 600 nm yang berlangsung 24 jam lalu dibandingkan dengan kurva standar sel. Kultur sel yang sama kemudian disentrifugasi selama 10 menit dengan kecepatan 10.000 rpm (Eppendorf MiniSpin dengan rotor jenis F-45-12-11) pada suhu ruang. Supernatan yang diperoleh merupakan enzim ekstrak kasar yang selanjutnya diukur aktivitas proteasenya.
Penentuan Kondisi Produksi Protease
Penentuan kondisi produksi protease menggunakan metode optimasi one-variable-at-a-time (OFAT) perlu dilakukan sebelum melakukan optimasi dengan menggunakan RSM. Variabel yang akan diuji ialah glukosa dan pepton 6%, ekstrak khamir 7,5%, inokulum 3 mL dan pH 6 (Adinarayana dan Ellaiah 2002; Gupta et al. 2010; Cristian et al. 2010). Medium yang digunakan ialah MRSA dengan komposisi: 1% pepton 0.8% Lab. lemco powder 0.4% ekstrak khamir 2% glukosa 0.2% K2HPO4, 0.315% natrium asetat, 0.2% diamonium sitrat 0.02% MgSO4·7H2O 0.005% MnSO4·H2O, 0,1% Tween 80, 0.5% CaCO3 dan 2% agar-agar. Penentuan menggunakan lima variabel yang diuji menggantikan komposisi glukosa, pepton, ekstrak khamir pada MRSA dengan konsentrasi sesuai dengan Tabel 2 serta pH dan inokulum menyesuaikan. Sedangkan komposisi lain tetap. Tiap variabel diasumsikan independen satu sama lain. Selanjutnya diuji aktivitas enzim berdasarkan metode Walter (1984).
Tabel 2 Penentuan kondisi produksi protease [Glukosa]% [Pepton]% [Ekstrak
11 Rancangan untuk Produksi Enzim Protease
Produksi enzim protease pada medium MRS menggunakan respon surface methodology (RSM) dengan central composite design (CCD) yang dibuat dengan variabel glukosa, pepton, ekstrak khamir, inokulum (8,8 x 108 CFU/mL) dan pH. Software statistic „Design-ExpertR 8.0’, Stat-Ease, Inc., Minneapolis, USA digunakan untuk menganalisa desain percobaan.
Model yang digunakan adalah response surface mengikuti persamaan:
Y adalah aktivitas enzim protease sedangkan X1, X2, …., Xn merupakan variabel yang diuji dan βo adalah intercept serta βi…., βin adalah koefisien regresi.
Tabel 3 Kode dan variable percobaan dari 5 variabel bebas yang diamati dengan CCD berdasarkan respon surface methodology
Variabel Kode Tingkat Variabel
-2 -1 0 +1 +2
Glukosa (%)a 4 5 6 7 8
Pepton (%)a 4 5 6 7 8
Ekstrak khamir ( %)b 5.5 6.5 7.5 8.5 9.5 Inokulasi (mL)b 1 2 3 4 5
pHc 4 5 6c 7 8
a
Adinarayana dan Ellaiah (2002); bGupta et al. (2010); cCristian et al. (2010)
Isolat BAL terseleksi diinokulasikan ke dalam 50 mL medium MRS selanjutnya diinkubasi pada suhu 37 °C selama 48 jam dan selanjutnya dipakai sebagai inokulasi. Inokulum kemudian ditambahkan ke dalam 50 mL medium produksi berdasarkan variasi kombinasi yang ditentukan oleh RSM. Kultur disentrifugasi pada kecepatan 10.000 rpm (Eppendorf MiniSpin dengan rotor jenis F-45-12-11) selama 5 menit. Enzim ekstrak kasar yang terdapat dalam supernatan dianalisis aktivitas protease dengan menggunakan metode Walter (1984).
Prosedur Pengukuran
Pengukuran Aktivitas Protease
12
ditambahkan dengan 1,25 mL Na2CO3 0.5 M dan 0.25 mL Folin Ciocalteu (1:2) diinkubasi selama 20 menit pada suhu 37 °C. Supernatan diukur absorbansinya pada panjang gelombang 578 nm dengan menggunakan L-tirosin sebagai standar (Lampiran 2). Satu unit aktivitas protease didefinisikan sebagai jumlah enzim yang dapat menghasilkan 1 µmol tirosin per menit pada kondisi optimum pengukuran.
Pengukuran Kadar Protein
Kadar protein ditentukan dengan metode Bradford (1976) menggunakan Bovine Serum Albumin (BSA) Fraction V sebagai standar protein. Masing- masing tabung reaksi sebanyak 20 µL enzim ditambahkan sebanyak 1 mL pereaksi Bradford. Blanko dibuat dengan cara mencampurkan 20 µL akuades dan direaksikan dengan 1 mL pereaksi Bradford. Setelah sekitar 5 menit, masing-masing campuran reaksi diukur absorbansinya pada panjang gelombang 595 nm. (Lampiran 3).
HASIL DAN PEMBAHASAN
Hasil
Penapisan Isolat Bakteri Asam Laktat Penghasil Protease
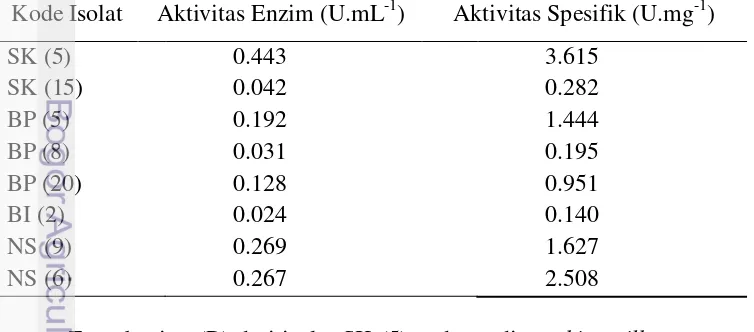
Penapisan dari 10 isolat bakteri asam laktat diperoleh 8 isolat yang memiliki aktivitas protease. Isolat SK (5) memiliki aktivitas protease tertinggi dibandingkan isolat lainnya. Aktivitas enzim kasar dan aktivitas spesifik enzim protease dari isolat SK (5) dengan medium MRS dan susu skim 1 % masing– masing sebesar 0.443 U.mL-1 dan 3.615 U.mg-1 protein (Tabel 4).
Tabel 4 Aktivitas protease dari delapan isolat BAL
Kode Isolat Aktivitas Enzim (U.mL-1) Aktivitas Spesifik (U.mg-1)
SK (5) 0.443 3.615
SK (15) 0.042 0.282
BP (5) 0.192 1.444
BP (8) 0.031 0.195
BP (20) 0.128 0.951
BI (2) 0.024 0.140
NS (9) 0.269 1.627
NS (6) 0.267 2.508
13 berarti semakin besar pula kemampuan isolat tersebut untuk menghasilkan enzim protease.
A B C
Gambar 3 Zona bening di sekeliling koloni bakteri Lactobacillus plantarum SK (5) pada medium A) skim milk agar, B) nutrient agar; C) MRSA yang mengandung susu skim 1%
Isolat SK (5) merupakan isolat yang sudah diidentifikasi berdasarkan penelitian sebelumnya yakni Lactobacillus plantarum 1 (99.9 %) menggunakan API 50 CHL dan L. plantarum subsp. plantarum NC 8 (93%) dengan menggunakan 16s rRNA (Desniar 2012).
Kurva Pertumbuhan dan Produksi Protease dari Lactobacillus plantarum SK (5)
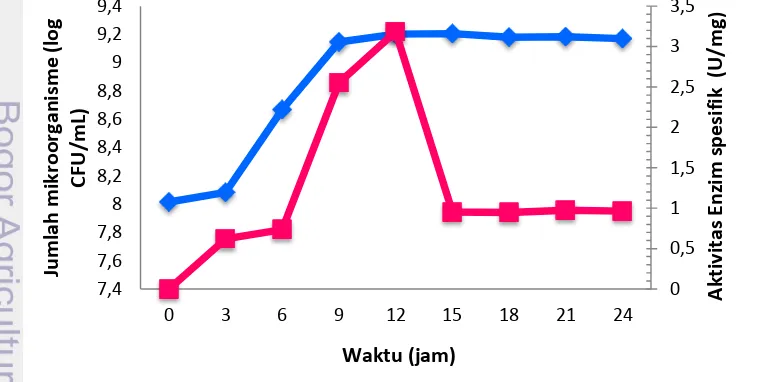
Isolat yang diuji mampu tumbuh pada medium MRS ditambahkan susu skim 1% pada pH 6.9 dan suhu 37 oC. Pertumbuhan isolat Lactobacillus plantarum SK (5) meningkat pada 0-12 jam setelah inkubasi dan pertumbuhan cenderung stabil hingga 24 jam inkubasi.
Gambar 4 Pertumbuhan sel ( ) dan aktivitas protease ( ) Lactobacillus plantarum SK (5) pada media MRS ditambahkan 1% susu skim
14
Produksi protease dari isolat ini mulai terlihat pada jam ke-3 inkubasi dan relatif meningkat hingga jam ke-12. Aktivitas protease tertinggi ditemukan pada 12 jam (Gambar 4).
Penentuan Kondisi Produksi Protease
Pengaruh Konsentrasi Glukosa (%) Terhadap Aktivitas Protease
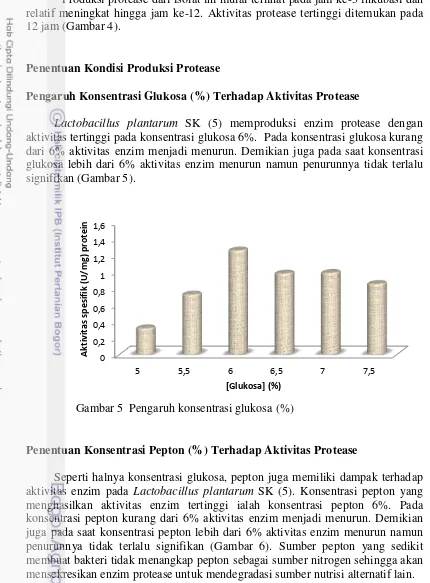
Lactobacillus plantarum SK (5) memproduksi enzim protease dengan aktivitas tertinggi pada konsentrasi glukosa 6%. Pada konsentrasi glukosa kurang dari 6% aktivitas enzim menjadi menurun. Demikian juga pada saat konsentrasi glukosa lebih dari 6% aktivitas enzim menurun namun penurunnya tidak terlalu signifikan (Gambar 5).
Gambar 5 Pengaruh konsentrasi glukosa (%)
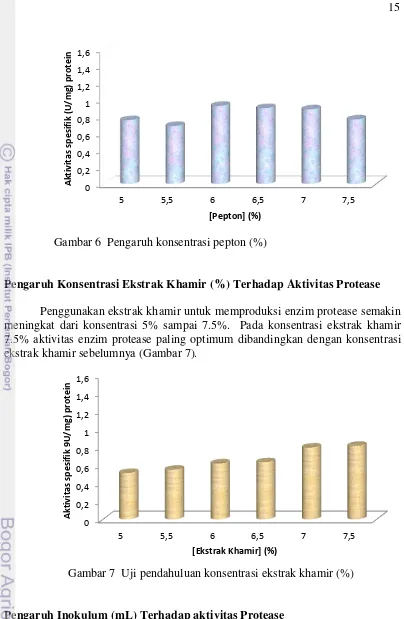
Penentuan Konsentrasi Pepton (%) Terhadap Aktivitas Protease
15
Gambar 6 Pengaruh konsentrasi pepton (%)
Pengaruh Konsentrasi Ekstrak Khamir (%) Terhadap Aktivitas Protease
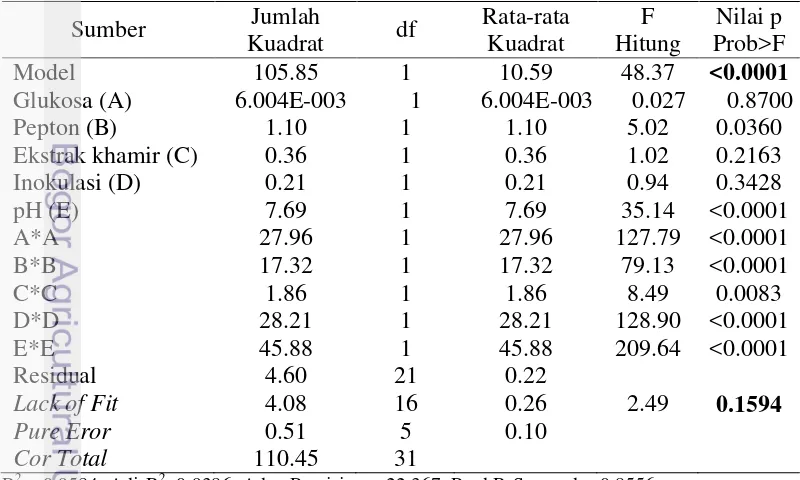
Penggunakan ekstrak khamir untuk memproduksi enzim protease semakin meningkat dari konsentrasi 5% sampai 7.5%. Pada konsentrasi ekstrak khamir 7.5% aktivitas enzim protease paling optimum dibandingkan dengan konsentrasi ekstrak khamir sebelumnya (Gambar 7).
Gambar 7 Uji pendahuluan konsentrasi ekstrak khamir (%)
Pengaruh Inokulum (mL) Terhadap aktivitas Protease
16
Produksi enzim protease dilakukan dengan menggunakan variabel 32 percobaan yang dilakukan 6 kali pengulangan pada center point (Lampiran 4). Hasilnya dianalisis menggunakan Analysis of Variance (ANOVA) dikomputasi dengan Software statistic „Design-ExpertR 8.0’, Stat-Ease, Inc., Minneapolis, USA. Analisis pemilihan model dilakukan berdasarkan jumlah kuadrat dari urutan model (Sequential Model Sum of Squares), pengujian ketidaktepatan model (Lack of Fit) dan ringkasan model secara statistika (Model Summary Statistics). Model yang terpilih untuk menjelaskan respon (aktivitas spesifik protease U/mg) berdasarkan hasil analisis ialah model kuadratik vs 2F1 (Tabel 5).
Tabel 5 Hasil analisi ragam (ANOVA)
Sumber Jumlah
17 Hasil analisis ragam diperoleh bahwa model yang digunakan dengan probability (prob>F) < 0.001 signifikan terhadap respon (aktivitas protease) artinya model dapat diterima untuk melihat perkiraan pengaruh setiap peubah dan interaksi faktor independen dengan respon. Pengujian ketidaktepatan model (Lack of Fit) menunjukkan hasil tidak signifikan dengan nilai p (prob>F) lebih dari taraf nyata α 0.05. Adequate Precision menunjukkan rasio 22.367 lebih besar dari 4 artinya model persamaan regresi dapat digunakan untuk menjadi pedoman membuat desain ruang dari respon permukaan.
Bentuk umum regresi linear menggunakan actual factors ialah:
Y = -130.1888 + 11.7A + 9.433B + 3.896C + 5.976D + 15.573E – 0.976A2
– 0.7683B2– 0.251C2– 0.98D2– 1.25E2
Ada 6 model yang signifikan yakni B, E, A2, B2, C2, D2, E2. A adalah konsentrasi glukosa, B adalah konsentrasi pepton, C adalah konsentrasi ekstrak khamir, D adalah volume inokulum dan E adalah pH. Nilai koefisien determinan R2 ialah 0.9584 menunjukkan adanya hubungan yang tinggi antara pengaruh variabel faktor terhadap respon artinya 95% variabel respon dipengaruhi oleh variabel independen. Signifikansi setiap variabel independen ditentukan oleh nilai probability. ANOVA memperlihatkan efek kuadratik variabel glukosa, pepton, ekstrak khamir, volume inokulum dan pH sangat signifikan dibandingkan efek linearnya. Variabel konsentrasi pepton dan pH menunjukkan hasil signifikan pada efek linear masing-masing (p ≤ 0.0001) dan (p = 0.0360) dan kuadratik. Hal ini menandakan bahwa konsentrasi pepton dan pH memberikan pengaruh nyata pada produksi protease.
Interaksi antara sumber nitrogen dengan sumber karbon memberikan pengaruh pada aktivitas enzim protease (Gambar 9a dan 9b). Interaksi antara pepton dan glukosa tampak bahwa aktivitas bergerak menuju optimum ketika konsentrasi pepton 6% dan konsentrasi glukosa 6%. Semakin meningkat dan menurun konsentrasi pepton dan glukosa maka aktivitas optimum juga semakin menurun (Gambar 9a). Interaksi antara ekstrak khamir dan glukosa tampak bahwa aktivitas bergerak menuju optimum ketika konsentrasi ekstrak khamir 7.5% sedangkan nilai konsentrasi glukosa semakin meningkat (Gambar 9b). Adanya asupan nitrogen yang banyak membuat bakteri lebih aktif. Dalam hal ini perlu diimbangi oleh tersedianya kalor yang cukup untuk aktivitas enzim yang meningkat. Interaksi yang terjadi antara konsentrasi sumber nitrogen dan konsentrasi sumber karbon adalah interaksi sinergis.
18
a
(a) (b)
Gambar 9 Response surface plots bentuk tiga dimensi yang menggambarkan pengaruh variabel independen dengan respon (aktivitas enzim spesifik (U.mg-1); a) pepton dan glukosa, b) ekstrak khamir dan glukosa
(a) (b)
19 Sedangkan interaksi yang terjadi antara pH dan konsentrasi ektrak khamir adalah pada pH tinggi aktivitas enzim cenderung optimum dan konsentrasi ekstrak khamir tinggi, namun ketika pH rendah aktivitas enzim justru menurun pada konsentrasi ekstrak khamir yang cenderung rendah. Aktivitas optimum didapat ketika pH semakin meningkat dan konsentrasi ekstrak khamir meningkat pula (Gambar 10b).
(a) (b)
Gambar 11 Response surface plots bentuk tiga dimensi yang menggambarkan pengaruh variabel independen dengan respon (aktivitas enzim spesifik (U.mg-1); a) inokulum dan ekstrak khamir, b) ekstrak khamir dan pepton
Interaksi antara inokulum dan konsentrasi ekstrak khamir serta interaksi konsentrasi ekstrak khamir dan pepton juga memberikan pengaruh pada aktivitas enzim yang dihasilkan oleh Lactobacillus plantarum SK (5). Aktivitas optimum terjadi pada konsentrasi ekstrak khamir meningkat dan inokulum meningkat (Gambar 11a). Sedangkan aktivitas optimum terjadi pada konsentrasi ekstrak khamir meningkat dan konsentrasi pepton semakin meningkat juga (Gambar 11b). Aktivitas optimum terjadi pada inokulum 3 mL dan konsentrasi pepton 6% (Gambar 12a). Sedangkan interaksi antara pH dan konsentrasi pepton, aktivitas optimum terjadi pada pH 6 dan konsentrasi pepton 6% (Gambar 12b).
20
glukosa, pepton dan ektrak khamir tinggi atau lebih rendah serta perubahan pH dan volume inokulum akan berpengaruh pada peningkatan aktivitas protease yang dapat dilihat dari pelengkungan pada kurva.
(a) (b)
Gambar 12 Response surface plots bentuk tiga dimensi yang menggambarkan pengaruh variabel independen dengan respon (aktivitas enzim spesifik (U/mg)); a) inokulum dan pepton, b) pH dan pepton
Efek masing-masing variabel independen terhadap aktivitas enzim protease menunjukkan bahwa pH, glukosa, pepton, volume inokulum diperlukan dalam kisaran level center point, ekstrak khamir diperlukan dalam jumlah sedikit. Selanjutnya, RSM akan memberikan saran titik komposisi yang akan divalidasi untuk melihat batas kecocokan, maka dilakukan kembali optimasi enzim protease sesuai dengan saran desain RSM. Hasil validasi kondisi optimum dilakukan secara empiris di laboratorium dengan perolehan nilai aktivitas enzim spesifik sebesar 6.5107 U.mg-1 protein atau meningkat 2 kali lipat dari kondisi media tanpa optimasi (Tabel 4). Nilai dari hasil validasi mendekati nilai prediksi sehingga model regresi yang digunakan ideal untuk produksi protease dari isolat Lactobacillus plantarum SK 5.
Pembahasan
21 ekstraseluler yang mendegradasi kasein dalam oligopeptida, sistem transportasi kemudian mentranslokasi peptida dan asam amino ke dinding sel, berbagai peptidase intraseluler mendegradasi lebih lanjut peptida menjadi asam amino, dan enzim yang berbeda yang mengkonversi asam amino yang dibebaskan ke dalam berbagai komponen (Kunji et al. 1996).
Kemampuan bakteri asam laktat untuk menghasilkan protease ekstraseluler sangat penting. Hal ini karena kebanyakan bakteri asam laktat (BAL) diisolasi dari produk fermentasi susu yang memiliki beberapa asam amino sehingga untuk dapat tumbuh dalam medium kaya protein BAL bergantung pada ekspresi sistem proteolitik untuk mendegradasi kasein yang merupakan protein utama dalam susu (Kok 1993; Visser 1993). BAL mempunyai kemampuan untuk mendegradasi kasein dengan sistem proteolitik untuk memproduksi peptida dan asam amino yang dibutuhkan dalam pertumbuhannya (Savikoji et al. 2006).
Aktivitas proteolitik secara kualitatif ditandai dengan terbentuknya zona bening di sekitar koloni bakteri pada medium yang mengandung susu skim 1%. Dari hasil pengukuran diameter zona bening (Gambar 3) diketahui bahwa ada perbedaan kemampuan isolat dalam menghasilkan enzim protease. Diameter zona bening pada medium agar-agar MRS yang dihasilkan oleh isolat SK (5) lebih kecil dibandingkan dengan medium lainnya. Kemampuan isolat SK (5) untuk menghasilkan asam pada medium MRS diduga sedikit lebih tinggi atau isolat tersebut lebih cepat menghasilkan asam dibanding menggunakan medium SMA dan NA. Adanya kemampuan isolat untuk menghasilkan asam menyebabkan terjadinya perbedaan zona bening pada medium yang digunakan untuk penapisan.
Berbagai jenis Lactobacillus sp. tumbuh baik dalam susu skim (Gilbert et al. 1996). Besarnya nilai R menunjukkan kemampuan proteolitik isolat Lactobacillus plantarum. Pada plara diketahui R sebesar 1,66 untuk jenis Pediococcus sedangkan Lactobacillus mempunyai R sebesar 2.71 (Vishasilp et al. 2008). Menurut Wikandari et al. (2012) dan Yusmarini et al. (2009) bahwa bakteri asam laktat dari bekasam yang memiliki aktivitas proteolitik tinggi ialah L. plantarum, L. pentosus, dan P. pentosaceus. Selain itu, pengujian aktivitas proteolitik L. plantarum dan L. brevis yang diisolasi dari keju menunjukkan aktivitas proteolitik yang tinggi (Topisirovic et al. 2007).
22
penggunaan metabolisme dalam fermentasi dan proses jalur metabolik bakteri asam laktat sangat dipengaruhi oleh berbagai parameter seperti suhu, pH, kecepatan agitasi dan tingkat oksigen terlarut.
Penurunan produksi protease terjadi setelah fermentasi pada jam ke-12 pada saat fase stasioner. Cohen (2011) menyatakan bahwa jika kondisi nutrisi esensial hilang selama pertumbuhan, medium menjadi terlalu asam atau terlalu basa maka kecepatan pertumbuhan akan menurun dan mendekati nol. Sehingga akumulasi substansi toksik akan dapat menghambat pembelahan sel.
Respon produksi protease diamati pada jam ke-12 dengan RSM. Menurut Vohra dan Satyanarayana (2002) metode RSM berhasil digunakan dalam penentuan optimasi medium, kondisi hidrolisis secara enzimatik dan fermentasi. Tujuan utama dari metode response surface adalah mendapatkan komposisi taraf perlakuan yang menghasilkan respon optimum. Secara umum, metode response surface dapat digambarkan secara visual melalui response surface plot dan kontur plot. Melalui plot tersebut dapat diketahui bentuk hubungan antara respon dengan variabel bebasnya. Nilai respon aktivitas spesifik protease (U.mg-1) tertinggi ialah 6.806 U.mg-1 protein dengan variabel independen yang mempengaruhi ialah glukosa 6% dan pepton 6%, ekstrak khamir 7.5%, inokulum 3 mL, dan pH 6 pada isolat L. plantarum SK (5) (Lampiran 4). Menurut Haq dan Mukhtar (2006) L. paracasei memiliki aktivitas tertinggi protease sebesar 7.28 U/mg dengan kondisi optimum pada pH 6 dan suhu 35 °C. Enzim protease dari L. acidophilus memiliki aktivitas proteolitik optimum pada pH 5.5 dan suhu 37 °C (Putranto 2006). Aktivitas protease dari spesies Lactobacillus yang diisolasi dari rumen memiliki kondisi optimum pada suhu 37 °C (Sharmin et al. 2004). Kondisi optimum produksi enzim protease terjadi pada glukosa 6%, pepton 6% dan garam 7.5% (Adinarayana dan Ellaiah, 2002). Sedangkan aktivitas optimum enzim protease pada volume inokulum 3 mL (Gupta et al. 2010).
RSM juga telah digunakan dalam mengoptimasi enzim lain yang berasal dari bakteri. Menurut Gangadharan et al. (2008) menggunakan RSM untuk melakukan optimasi produksi alpa-amilase oleh Bacillus amyloliquefaciens. Brocchini et al. (2002) dan Heck et al. (2005) juga menggunakan RSM untuk melakukan optimasi produksi enzim xylanase yang berasal dari B. circulans dan B. coagulans.
23 Menurut Boominadhan et al. (2009) produksi enzim protease dengan sumber karbon terbaik ialah glukosa. Produksi protease disebabkan adanya konsentrasi glukosa dan pepton. Glukosa dan pepton merupakan nutrient utama yang mengontrol biosintesis enzim (Adinarayana dan Ellaiah 2002). Menurut Adinarayana et al. (2003), sumber karbon menjadi faktor yang paling mempengaruhi produksi protease. Menurut Saravanakumar et al. (2010) optimasi produksi memerlukan berbagai parameter seperti sumber karbon dan nitrogen, konsentrasi substrat, pH, suhu dan waktu inkubasi (El Enshasy et al. 2008) agar produksi protease meningkat. Pada kondisi asam (pH 6) semakin besar konsentrasi substrat alami maka semakin banyak nutrisi yang dapat diakses oleh bakteri maka semakin besar pula aktivitas enzim yang dihasilkan. Meskipun ada perbedaan aktivitas proteolitik dari isolat yang digunakan namun pemecahan protein oleh enzim protease tersebut relatif sama (Yusmarini 2010).
Dalam penelitian ini dilakukan penentuan kondisi produksi protease untuk menentukan nilai central composite design (CCD) sebelum menggunakan RSM. Penentuan kondisi produksi protease bertujuan untuk meninjau secara kasar bagaimana pengaruh berbagai kondisi parameter produksi protease. Pada saat menentukan CCD, parameter pH tidak dilakukan uji pendahuluan karena dari penelitian sebelumnya oleh Haq dan Mukhtar (2006) dan Cristian et al. (2010) sudah didapatkan pH optimum untuk bakteri Lactobacillus sp. ialah pH 6. Metode yang dilakukan untuk penentuan kondisi produksi protease ialah metode optimasi one-variable-at-a-time (OFAT). Dalam metode ini tiap variabel yang dicari nilai optimumnya sementara variabel lainnya diatur pada nilai yang tetap. Variabel yang dilakukan uji pendahuluan ialah konsentrasi glukosa, pepton, ekstrak khamir, dan inokulum (Adinarayana dan Ellaiah 2002; Gupta et al. 2010; Cristian et al. 2010). Medium yang digunakan pada optimasi ialah MRSA. Komposisi agar-agar MRS (pH 6,9) yaitu 1% pepton, 0,8% Lab. lemco powder, 0,4% ekstrak khamir, 2% glukosa, 0,2% K2HPO4, 0,315% natrium asetat, 0,2% diamonium sitrat, 0,02% MgSO4·7H2O, 0,005% MnSO4·H2O, 0,1% Tween 80, 0,5% CaCO3 dan 2% agar-agar. Variabel yang digantikan dalam komposisi MRSA ialah glukosa 6%, pepton 6%, ekstrak khamir 7,5%, pH 6, dan inokulum 3 mL sedangkan komposisi yang lainnya tetap.
Hasil optimasi dari penentuan kondisi produksi protease dengan menggunakan metode OFAT dapat digunakan sebagai pertimbangan dalam menentukan central point yang akan dioptimasi menggunakan RSM. Dari poin-poin desain CCD, perlu ditentukan nilai batas bawah (-1) dan batas atas (+1), sisanya ditentukan dengan rumus otomatis dengan RSM. Batas atas dan bawah nilai variabel yang diuji sebaiknya tidak memiliki selisih yang terlalu jauh, supaya posisi optimum lebih jelas terlihat (Bakti 2012).
RSM memberikan enam titik pusat dalam desain (Lampiran 4). Hal ini berkaitan dengan variasi dari nilai prediksi dalam melakukan perkiraan fungsi respon di wilayah desain untuk menemukan nilai optimal. Enam titik pusat adalah perkiraan yang sama dengan variasi di tepi. Sedangkan, jika hanya satu titik pusat maka kurang presisi di bagian tengah daripada yang didapatkan tepi. Ketika melampaui jarak 1 coded unit akan lebih banyak variasi dan kurang presisi.
24
penentuan batas atas dan batas bawah sehingga variabel yang digunakan menghasilkan aktivitas protease yang tinggi. Tidak dapat dilihat secara jelas titik optimum pada variabel yang digunakan karena plot tiga dimensi menggambarkan stationary ridge (Gambar 9b, 10b, 11a, dan 11b). Selain itu, interaksi antar variabel tidak signifikan kemungkinan adanya variasi volum inokulum yang menyebabkan volume akhir produksi pada setiap perlakuan berbeda.
Nilai respon aktivitas spesifik protease (U.mg-1) tertinggi ialah 6.393 U.mg-1 protein (Tabel 4) dan nilai validasi komposisi media sebesar 6.5034 U/mg protein pada jam ke-12. Sedangkan kondisi aktivitas enzim protease sebelum dioptimasi ialah 3.615 U.mg-1 protein artinya optimasi produksi protease L. plantarum SK (5) dengan menggunakan RSM mengalami peningkatan dua kali lipat aktivitas enzim spesifik sebelum dioptimasi dan setelah dioptimasi. Aktivitas protease juga meningkat 2.6 sampai 6.36 kali dengan menggunakan RSM (Puri et al. 2002; Manikandan et al. 2011; Moorthy dan Baskar 2013; Rajheree dan Rajni 2014).
Keunggulan RSM, secara praktis tidak terlihat secara langsung model first order maupun second order tersebut. Ketika persamaan (1) tidak memberikan lack-of-fit, maka Montgomery (1997) menyatakan bahwa titik optimal tidak terdapat pada desain first order tersebut. Untuk itu, level faktor yang diteliti harus diarahkan sedemikian rupa ke arah optimalisasi respons. Pergeseran level-level faktor menuju ke arah kondisi respons optimum inilah yang menjadi keunggulan di dalam RSM.
SIMPULAN DAN SARAN
Simpulan
Isolat Lactobacillus plantarum SK (5) memiliki aktivitas protease tertinggi dibandingkan isolat bakteri asam laktat lainnya. Produksi enzim protease menggunakan response surface methodology (RSM) menghasilkan kondisi optimum yang tampak jelas memperlihatkan hubungan antar variabel yang terlibat. Penetapan kisaran produksi protease tertinggi pada Lactobacillus plantarum SK (5) asal bekasam ialah glukosa 6%, pepton 6%, ekstrak khamir 7%, inokulasi 3 mL dan pH 6 dengan hasil perkiraan teoritis 6.510 U.mg-1 protein dan nilai validasi komposisi media sebesar 6.5034 U.mg-1 protein pada jam ke-12.
Sedangkan kondisi aktivitas enzim protease sebelum dioptimasi ialah 3.615 U.mg-1 protein.
Saran
25 http://www.bps.go.id/exim-frame.php?kat=2. Impor Menurut Komoditi, Tahun 2013.
Aarnikunnas J. 2006. Metabolic engineering of lactic acid bacteria and characterization of novel enzymes for the production of industrially important compounds. [dissertation]. Helsinki: Fakulty of Veterinary Medicines. University of Helsinki.
Adams MR, Maurice, Moss O. 2009. Food Microbiology. Third edition. Cambridge (US): The Royal Society of Chemistry.
Adawyah R. 2007. Pengolahan dan Pengawetan Ikan. Jakarta (ID): Bumi Aksara. Adinarayana K dan Ellaiah P. 2002. Response surface optimization of the critical medium components for the production of alkaline protease by a newly isolated Bacillussp. J Pharm Sci Tech. 5(3) : 272-278.
Adinarayana K, Ellaiah P, Prasad DS. 2003. Purification and partial characterization of thermostable serine alkaline protease from a newly isolated Bacillus subtilis PE-11 AAPS. J Pharm Sci Tech. 4(4) : 56-59. Adriana L, Perez B, Mungula S, Farres A. 2008. Novel extracelluler proteolytic in
pediococcus acidilactici ATCC 8042. Can J Microbiol. 54(8): 694-699. Akhdiya A. 2003. Isolasi bakteri penghasil enzim protease alkalin termostabil. Bul
Plasma Nutfah. 2003. 9(2): 38-44.
Axelsson L. 2004. Lactic acid bacteria: classification and physiology. Di dalam Salminen S, Wright SV, Ouwehand A, editor. Lactic Acid Bacteria.
Microbiological and Functional Aspects Third edition, Revised and
Expanded. New York: Marcel Dekker, Inc. hlm 19-68.
Bakti CP. 2012. Optimasi produksi enzim selulase dari Bacillus sp. BPPT CC RK2 dengan variasi pH dan suhu menggunakan response surface methodology [skripi]. Depok (ID): Universitas Indonesia.
Bas D, Boyoci IH. 2007. Modeling and optimatization I: usability of respon surface methodology. J Food Eng. 78:836-845.
Boominadhan U, Rajakumar R, Sivakumaar PKV, Joe MM. 2009. Optimization of protease enzyme production using Bacillus sp. isolated from different wastes. Bot Res Intern. 2(2): 83-87.
Bradford MM. 1976. A rapid and sensitive method for the quantitation on microgram quantities of protein in utilizing the principle of protein dye binding. Anal Biochem. 72: 248-254.
Brenner J, Kreig R, Stanley T. 2005. The Probacteria, Part A Introductory Essay. Clasification of prokaryotic organism and the concept of bacteria speciation. Di dalam bergey, Garrity M, Editor. Bergey’s Manual of Systematic Bacteriology. Ed ke-2. Springer (US): Verlag US. hlm. 27-32. Brocchini M, Svendsen IA, Prasad RS, Bellotti G. 2002. A comparison of two
26
Burhan A, Nisa U, Gokhan C, Ashabil A, Osmair G. 2003. Enzymatic properties of a novel thermostable ther-mophilic alkaline and chelator resistant amylase from an al-kaphilic Bacillus sp, isolate ANT-6. Proc Biochem. 38: 1397–1403.
Cohen GN. 2011. Microbial Biochemistry. Ed. ke-2. London (GB): Springer Science. hlm 7-10.
Cristian JB, De Lima, Coelho LF, Contiero J. 2010. The use of response surface methodology in optimization of lactid acid production: focus on medium supplementation, temperature and pH control. Food Technol Biotechnol. 48(2): 175-181.
Desniar. 2012. Karakterisasi Bakteri Asam Laktat dari Produk Fermentasi Ikan (Bekasam). [disertasi]: Bogor (ID): Institut Pertanian Bogor.
Detmens FJ, Kunji ER, Lanfermeijer FC, Poolman B, Konings WN. 1998. Kinetics and specificity of peptide uptake by the oligopeptide transport system of Lactococcus lactis. J Biochem. 37: 16671-16679.
Diop MB, Dubois-Dauphin R, Tine E, Ngom A, Destain J, Thonart P. 2007. Bacteriocin producers from traditional food products. Biotechnol Agron Soc Environ. 11(4): 275–281.
Doeven MK, Kok J, Poolman B. 2005. Specificity and selectivity determinants of peptide transport in Lactococcus lactis and other microorganisms. Mol Microbiol. 57: 640-649.
El Enshasy H, Abuoul-Enein A, Helmy S, El Azaly Y. 2008. Optimization of the industrial production of alkaline protease by Bacillus licheniformis in different production scales. J Appl Sci.2(3): 583-593. [Internet]. [diunduh 2013 Okt 1]. Tersedia pada: http://www.apfic.org/
enzymes/proteases_carbohydrases/prweb8121185.htm
Elfahri K. 2012. Release of bioactive peptides from milk proteins by Lactobacillus spesies [tesis]. Melbourne (US): Victoria University.
Fernandes-Espla MD, Garault P, Monnet V, Rul E. 2000. Strepcoccus thermophilus cell wall-anchored proteinase: release, purification and biochemical and genetic characterization. Appl Eniron Microbiol. 66: 4772-4778.
Gangadharan D, Sivaramakrihnan, Swetha, Nampoothiri, Madhavan, ukumaran, Rajeev, Pandey A. 2008. Response surface methodology for the optimization of alpha amylase production by Bacillus amylolique faciens. Bioresour Technol. 99 (1): 4597-4602.
Gálvez A, Abriouel H, López RL, Omar NB. 2007. Bacteriocin-based strategies for food biopreservation. Int J Food Microbiol. 120: 51–70.
Galbe M, Zacchi G. 2007. Pretreatment of lignocellulosic materials for efficient bioethanol production. Adv Biochem Engin/Biotechnol. 108: 41-65.
Garabal, J. I., Alonso, P. R. and. Centeno, J. A. 2007. Characterization of lactic acid bacteria isolated from raw cow‟s milk cheeses currently produced in Galicia ( NW Spain). Swiss (US): Swiss Soc. of Food Sci. And Technol. Gilbert C, Atlan D, Blanc B, Portailer R, Germond J, Lapierre L , Mollet B. 1996.
27 Gupta N, Kim KH, CulleyDE, Richard DS, Pavel A. 2010. Analyzing protease specificity and detecting in vivo proteolytic events using tandem mass spectrometry. Proteomics. 10 (15): 2833–2844. doi: 10.1002/pmic. 200900821.
Haandrikman A, Kok J, Laan H, Soemitro S, Ledeboer A, Konings W, Venema G. 1989. Identification of a gene required for maturation of an extracellular lactococcal serine proteinase. J Bacteriol 171:2789–2794.
Haq I dan Mukhtar H. 2006. Biosynthesis of protease from Lactobacillus paracasei : Kinetic analysis of fermentation parameters. Ind J Biochem Biophys. 43 : 377-381.
Holck A, Naes H. 1992. Cloning, sequencing and expression of the gene encoding the cell-envelope-associated proteinase from Lactobacillus paracasei subsp. paracasei NCDO 151. J Gen Microbiol.138:1353–1364.
Heck GR, Armstrong CL, Astwood JD, Behr CF, Bookout JT, Brown SM, Cavato TA, Deboer DL, Deng MY, George C, et al. 2005. Development and characterization of CP4EPSPS-baed, Glyphoate-tolerant corn event. Crop Sci. 45 (1): 329-339.
Huang G, Ying T, Huo P, Jiang J. 2006. Purification and characterization of a protease from thermophilic Bacillus strain HS08. Biotechnology. 5:2433-2438.
Hwanhlem N, Buradaleng S, Wattanachant S, Benjakul S, Tani A, Maneerat S. 2010. Isolation and screening of lactic acid bacteria from Thai traditional fermented fish (Plasom) and production of plasom from selected strains. Food Control. 22: 401-407.
Industri Global Analis, Inc. 2011. Nilai perdagangan enzim dunia. [Internet]. [diunduh 2013 Okt 20]. Tersedia pada: http://www.prweb.com/releases/ industrial_enzymes/proteases_carbohydrases/prweb8121185.htm.
Irianto HE, Irianto G. 2009. Tradisional fermented fish products in Indonesia. [Internet]. [diunduh 2013 Okt 1].Tersedia pada: http://www.apric.org/ Archive/symposia/1998/05.pdf
Jokar A, Karbassi A. 2011. In-house production of lactose-hydrolysed milk by β -galactosidase from Lactobacillus bulgaricus. J Agr Sci Technol. 13:577-584.
Juillard V, Laan H, Kunji E, Jeronimus-Stratingh CM, Bruins A, Konings W. 1995. The extracellular PI-type proteinase of Lactococcus lactis hydrolyzes
β-casein into more than one hundred different oligopeptides. J Bacteriol
177:3472–3478
Juillard V, Guillot A, Le Bars D, Gripon JC. 1998. Specificity of milk peptide
utilization by Lactococcus lactis. Appl Environ Microbiol. 64:1230–1236 .
Kok J, Leenhouts KJ, Haandrikman AJ, Ledeboer AM, Venema G (1988) Nucleotide sequence of the cell wall proteinase gene of Streptococcus
cremoris Wg2. Appl Environ Microbiol 54:231–238
Kok J. 1993. Genetic and proteolytic enzymes of lactococci and their role in cheese flavor development. J. Dairy Sci. 76 : 2056-2064.
28
Kunji ERS, Smid EJ, Plapp R, Poolman B, Konings WN. 1996. The proteolytic system of lactic acid bacteria. Antonie Van Leeuwenhoek. 70 : 187-221. Manikanda BN, Sekaran G, Karthihegan S, Maharaja P, Gupta VK, Ananda C.
2011. Response surface methodology for optimization heterocatalitic fenol oxidation of persistence organic pollution in high total dissolued solid containing waster water. 21 (2): 1489-1502.
Margono T, Sumargono W, Malik A,Sadikin M. 2014. Characterization of trypsin like protease of Lactobacillus plantarum FNCC 0270. HAYATI J Biosci. 21 (2): 87-98. DOI: 10.4308/hjb.21.2.87.
Marketresearch. 2001. Nilai perdagangan enzim di dunia. [Internet]. [diunduh 2013 Okt 20]. Tersedia pada: http://www.prweb.com/releases/industrial_ Archive/symposia/1998/05.pdf.
Matthews A. 2004. Lactic acid bacteria as a potential source of enzymes for use in vinification. Appl Environ Microbiol. 70: 5715–5731.
Montgomery DC. 1997. Design and Analysis of Experiments. Ed ke-4. New York (US): John Wiley & Sons.
Moorthy IM, Baskar R. 2013. Statistical modeling and optimization of alkaline protease production from a newly isolated alkalophilic Bacillus spesies BGS using response surface methodology and genetic algorithm. Prep Biochem Amp Biotechnol. 43 (3): 293-314. Doi: 10.1080/10826068. 2012.719850.
Ng YL, Mann V, Gulabivala K. 2011. A prospective study of the factors affecting outcome of non surgical root canal treatment: part 2: tooth survival. J Intern Endo. 44: 610-625.
Nuryati dan Salimy D. 2008. Metode permukaan respon dan aplikasinya pada optimal eksperimen kimia. risalah lokakarya komputasi dalam sains dan teknologi nuklir; 2008 Agustus 6-7; Serpong, Indonesia. Serpong (ID): Pusat Pengembangan Energi Nuklir BATAN. hlm 373-391.
Oyeleke SB, Egwin EC, Auta SH. 2010. Screening of Aspergillus flavus and Aspergillus fumigates strains for extracellular protease enzyme production. J Microbiol Antimicrob. 2(6): 2141-2307.
Padmavathi M. 2013. Identification,characterization, optimization studies and applications of protease enzyme from Bacillus lichenifirmis. J Chem Bio Phy Sci. 3(3): 1920-1926.
Panda SH, Swain MR, Shakmimay K, Ray RC, Montet D. 2008. Statistical optimization of α-amylase production by probiotic Lactobacillus plantarum MTCC 1407 in submerged fermentation. Polish J Microbiol. 57 (2):149-155.
Pastar I, Tonic I, Golic N, Kojic M, van Kranenburg R, Kleerebezem M, Topisirovic L, Jovanovic G. 2003. Identification and genetic characterization of a novel proteinase, PrtR, from the human isolate Lactobacillus rhamnosus BGT10. Appl Environ Microbiol. 69:5802–5811. Pederson JA, Mileski GJ, Weimer BC, Steele JL. 1999. Genetic characterization
of a cell envelope-associated proteinase from Lactobacillus helveticus CNRZ32. J Bacteriol. 181:4592–4597.