DETEKSI
Mycobacterium avium
subspesies
paratuberculosis
PADA SAMPEL PENYAKIT HEWAN DI BALAI BESAR
UJI STANDAR KARANTINA PERTANIAN
BAYU FIRMALA KUSUMA
FAKULTAS KEDOKTERAN HEWAN INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul Deteksi Mycobacterium avium subspesies paratuberculosis pada Sampel Penyakit Hewan di Balai Besar Uji Standar Karantina Pertanian adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
ABSTRAK
BAYU FIRMALA KUSUMA. Deteksi Mycobacterium avium subspesies paratuberculosis pada Sampel Penyakit Hewan di Balai Besar Uji Standar Karantina Pertanian. Dibimbing oleh RAHMAT HIDAYAT dan MUJIATUN.
Paratuberkulosis atau Johne’s disease merupakan penyakit infeksius pada ruminansia (sapi, kerbau, domba, dan kambing), disebabkan oleh Mycobacterium avium subspesies paratuberculosis (MAP), ditandai dengan manifestasi enteritis granulomatosa pada saluran pencernaan (usus halus). Infeksi MAP terjadi sejak neonatal dengan masa inkubasi sangat panjang, beberapa bulan sampai tahunan. Gejala klinis pada stadium akhir berupa diare kronis dan kehilangan berat badan yang baru muncul setelah sapi berumur 2 sampai 10 tahun. Penelitian ini menggunakan sampel serum darah sapi sebanyak 361 dari peternakan di daerah Bandung, Bandung Barat, Lebak dan Pandenglang, Yogyakarta dan Klaten, Surabaya, Kebumen, Bandarlampung, Malang, dan Cilegon menggunakan metode sampling by judgement. Pengujian MAP menggunakan Enzyme Linked Immunosorbent Assay (ELISA) menunjukkan ditemukannya seropositif MAP sebanyak 7.20% (26/361) dan 0.55% (2/361) sampel suspect, kemudian dilakukan uji konfirmasi pada feses menggunakan PCR primer IS900, 8 dari 28 sampel menunjukkan hasil positif. Selanjutnya, uji konfirmasi PCR menggunakan primer F57 dan F57 Rn tidak memperlihatkan pita DNA MAP pada semua sampel positif tersebut, sehingga dapat disimpulkan bahwa pada penelitian ini tidak ditemukan seropositif dan DNA spesifik MAP.
Kata kunci: ELISA, Paratuberkulosis (Johne’s disease), PCR, ruminansia
ABSTRACT
BAYU FIRMALA KUSUMA. Detection of Mycobacterium avium subspesies paratuberculosis in Samples of Animal Disease in Center of Diagnostic Standard Agriculture Laboratory. Supervised by RAHMAT HIDAYAT and MUJIATUN.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Kedokteran Hewan
pada
Fakultas Kedokteran Hewan
DETEKSI
Mycobacterium avium
subspesies
paratuberculosis
PADA SAMPEL PENYAKIT HEWAN DI BALAI BESAR
UJI STANDAR KARANTINA PERTANIAN
BAYU FIRMALA KUSUMA
FAKULTAS KEDOKTERAN HEWAN INSTITUT PERTANIAN BOGOR
Judul Skripsi : Deteksi Mycobacterium avium subspesies paratuberculosis pada Sampel Penyakit Hewan di Balai Besar Uji Standar Karantina Pertanian
Nama : Bayu Firmala Kusuma NIM : B04100136
Disetujui oleh
Drh Rahmat Hidayat, MSi Pembimbing I
Drh Mujiatun, MSi Pembimbing II
Diketahui oleh
Drh Agus Setiyono, MS, PhD, APVet Wakil Dekan Fakultas Kedokteran Hewan
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Juli 2013 ini ialah Mycobacterium avium subspesies paratuberculosis (MAP) pada sampel koleksi penyakit hewan karantina, dengan judul Deteksi Mycobacterium avium subspesies paratuberculosis pada Sampel Penyakit Hewan di Balai Besar Uji Standar Karantina Pertanian (BBUSKP).
Terima kasih penulis ucapkan kepada Bapak Drh Rahmat Hidayat, MSi selaku pembimbing I dan Ibu Drh Mujiatun, MSi selaku pembimbing II, dan Bapak Dr Drh Heru Setijanto, PAVet (K) yang telah banyak memberi saran. Penghargaan penulis sampaikan kepada Bapak Dr Drh Syafril Daulay, MM sebagai Kepala BBUSKP beserta jajarannya: Ibu Drh Sri Yusnowati dan Ibu Drh Nuryani Zainuddin, MSi atas izinnya sehingga penulis bisa melakukan penelitian di BBUSKP, serta segenap staf Balai Besar Uji Standar Karantina Pertanian (BBUSKP): Ibu Drh Haeriah, Bapak Ahmad, Bapak Marjono, dan kawan-kawan yang telah banyak membantu selama penelitian dan pengumpulan data. Ucapan terima kasih juga penulis sampaikan kepada Bapak dan Ibu tercinta (Bapak Turiman dan Ibu Hermi Widayati), adik tersayang (Wisnu Krisna Jaya dan Rafly Firmansyah), seluruh keluarga, Wuri Wulandari, Sandhi Yudha Prawira, sahabat, serta teman-teman Acromion 47 atas segala bentuk dukungan baik doa, saran, semangat, dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat.
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR LAMPIRAN vi
PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 2
Manfaat Penelitian 2
TINJAUAN PUSTAKA 2
Mycobacterium avium subspesies paratuberculosis 2
Inang Rentan 3
Patogenesis 3
Gejala Klinis 4
MATERI DAN METODE 4
Tempat dan Waktu 4
Alat dan Bahan 5
Metode Penelitian 5
Interpretasi Hasil 7
Analisa Data 7
HASIL DAN PEMBAHASAN 8
SIMPULAN DAN SARAN 11
Simpulan 11
Saran 11
DAFTAR PUSTAKA 11
LAMPIRAN 14
DAFTAR TABEL
1 Interpretasi hasil ELISA 7
2 Persentase hasil pengujian ELISA dari sampel serum sapi 8 3 Hasil uji konfirmasi PCR pada sampel positif dan suspect ELISA 9
DAFTAR LAMPIRAN
1 Hasil visualisasi uji PCR primer IS900, F57, dan F57 Rn dari sampel
1
PENDAHULUAN
Latar Belakang
Indonesia memiliki sumber daya alam yang sangat melimpah, terutama sumber daya hewani yang memiliki potensi besar di sektor peternakan. Sektor peternakan dapat memenuhi kebutuhan protein hewani masyarakat dari konsumsi daging dan susu apabila dikelola dengan baik. Konsumsi protein asal daging per kapita per hari mengalami peningkatan, tahun 2011 sebesar 2.76 gram, menjadi 2.92 gram pada tahun 2012 (BPS 2013). Peningkatan konsumsi protein hewani disebabkan beberapa faktor antara lain jumlah penduduk yang semakin meningkat, peningkatan pendapatan dan kesadaran masyarakat untuk mengkonsumsi makanan bergizi. Peningkatan taraf pendidikan dan perubahan gaya hidup masyarakat menjadi faktor pendukung lainnya.
Kebutuhan protein hewani yang bersumber dari susu belum terpenuhi. Hal tersebut dikarenakan terbatasnya jumlah populasi sapi perah. Berdasarkan laporan Direktorat Jenderal Peternakan dan Kesehatan Hewan (2012), populasi sapi perah tahun 2012 adalah 630 ribu ekor yang menyumbangkan 1 017 930 ton atau hanya sekitar 32% dari kebutuhan susu nasional, sehingga masih diperlukan impor susu untuk menutupi kekurangannya. Hal yang sama terjadi pada ketersediaan daging sapi nasional yang jumlahnya belum mencukupi. Kebutuhan daging tahun 2012 tercatat 484 ribu ton, sedangkan ketersediaan daging nasional hanya mencapai 399 ribu ton. Usaha untuk menutupi kekurangan daging nasional dilakukan kebijakan importasi sapi (Ditjen PKH 2012).
Kebijakan impor sapi memiliki risiko, diantaranya ancaman penyakit pada ternak. Penyakit pada ternak sapi dikelompokkan menjadi penyakit menular dan tidak menular. Beberapa penyakit seperti mastitis, brusellosis, antrak, septicemia, epizootica (ngorok), bovine viral diarrhea (BVD), infectious bovine rhinotracheitis, dan kecacingan masih sering terjadi dan dilaporkan di Indonesia (Nugroho 2008). Kasus penyakit kronis seringkali kurang menjadi perhatian dan dapat menghambat pertumbuhan dan produktivitas ternak (Sudarwanto 1999; Putra 2006). Penyakit bersifat kronis yang berpotensi menjadi ancaman bagi usaha peternakan sapi salah satunya adalah paratuberkulosis atau Johne’s disease (JD). Penyakit yang disebabkan oleh bakteri Mycobacterium avium subspesies paratuberculosis (MAP) ini belum banyak mendapat perhatian pemerintah. Berdasarkan laporan Adji (2004), kasus paratuberkulosis pernah terdeteksi secara serologis pada sapi perah di Jawa Barat. Di beberapa negara pengekspor sapi seperti New Zealand, Australia, Inggris dan negara Mediterranean, penyakit JD merupakan penyakit menular penting pada industri peternakan sapi dan domba (Tarmudji 2007). Hasil survei nasional di Amerika, penyakit JD menimbulkan kerugian ekonomi yang cukup besar pada industri peternakan mencapai 1.5 milyar dollar US per tahun (Harris dan Barletta 2001). Kerugian yang sama dikhawatirkan terjadi pada industri peternakan Indonesia.
2
baik daging maupun susu. Lebih dikhawatirkan lagi dampak paratuberkulosis pada manusia (Crohn’s disease) yang berkemungkinan dapat ditularkan melalui produk susu sapi dan olahannya (Nugroho 2008), tidak ditutup kemungkinan paratuberkulosis ditularkan melalui konsumsi usus sapi yang masih digemari oleh masyarakat Indonesia.
Kajian mengenai paratuberkulosis di Indonesia sejauh ini belum banyak dilakukan sehingga dikhawatirkan penyakit ini tidak terpantau sehingga mudah masuk dan menyebar yang berdampak masalah bagi peternakan dan kesehatan masyarakat. Oleh karena itu, perlu dilakukan langkah cepat untuk mencegah masuknya penyakit paratuberkulosis demi ketahanan pangan asal hewan dan kesejahteraan masyarakat Indonesia. Pencegahan dapat dilakukan dengan berbagai cara antara lain monitoring, pengujian penyakit pada masa karantina, vaksinasi, pengelolaan peternakan yang baik, desinfeksi kandang dan peralatan, serta mengontrol lalu lintas dan pemusnahan ternak yang terjangkit.
Balai Besar Uji Standar Karantina Pertanian (BBUSKP) sebagai laboratorium pusat untuk badan karantina pertanian memiliki tugas dan fungsi yaitu melakukan uji konfirmasi, uji rujukan, dan koleksi penyakit hewan karantina. Koleksi agen dan serum positif suatu penyakit merupakan salah satu cara untuk mendukung fungsi yang lainnya melalui kajian yang lebih mendalam terhadap suatu penyakit maupun terkait dengan validasi metode.
Tujuan Penelitian
Penelitian ini bertujuan mendeteksi adanya serum positif antibodi dan bakteri MAP pada sampel penyakit hewan Balai Besar Uji Standar Karantina Pertanian untuk kepentingan koleksi serum positif antibodi dan bakteri MAP, serta kajian penyakit hewan karantina.
Manfaat Penelitian
Penelitian ini diharapkan dapat memperoleh koleksi serum positif antibodi dan bakteri MAP untuk kepentingan kajian penyakit hewan karantina, serta dapat memberikan informasi terkini terhadap perkembangan penyakit paratuberkulosis di beberapa daerah sentral peternakan sapi di Indonesia.
TINJAUAN PUSTAKA
Mycobacterium avium subspesies paratuberculosis
3 ruminansia yang menyebabkan radang granulomatosa saluran pencernaan (SCAHAW 2000). MAP adalah bakteri Gram positif berbentuk batang lurus atau sedikit bengkok dan terkadang bercabang, dinding sel tersusun dari lapisan lipida kompleks, bersifat aerobik, tidak bergerak dan tidak berspora (Gallagher dan Jenkins 1998; Harris dan Barletta 2001). Bakteri ini memiliki waktu tumbuh 2-60 hari (Holt et al. 1994), namun waktu tumbuhnya dapat mencapai 18 bulan untuk isolat lapang (Shanahan 1994). Koloni memiliki permukaan halus atau kasar, tumbuh pada suhu 25-45 °C dengan suhu optimal 39 °C, bakteri ini juga mampu hidup di dalam makrofag, tahan pada pH 5.5, alkohol, dan tahan panas (Griffiths 2003).
Sifat tahan panas bakteri MAP berbeda dengan Mycobacterium lainnya. Pasturisasi umumnya mampu mematikan M. tuberculosis, M. bovis, dan lainnya, namun hal ini kurang berhasil untuk bakteri ini (Sung et al. 2004; Nugroho 2008). Beberapa penelitian melaporkan bakteri MAP mampu bertahan pada suhu pasturisasi low temperature long time dan high temperature short time (Chiodini dan Hermon-Taylor 1993; Grant et al. 1996).
Inang Rentan
Bakteri MAP menginfeksi semua jenis sapi (potong dan perah), domba, dan kambing. Infeksi MAP dapat terjadi pada satwa liar seperti bison, kijang, kelinci, dan burung liar meski tidak menimbulkan gejala klinis (Acha dan Szyfres 2003). Hewan penderita paratuberkulosis akan menunjukkan gejala sakit 2-5 tahun setelah infeksi. Penderita paratuberkulosis subklinis akan merugikan peternak karena penurunan produktivitas ternak.
Bakteri MAP sering diduga dan berkaitan dengan kejadian kasus Crohn’s disease (CD) yaitu penyakit radang saluran pencernaan bagian bawah yang bersifat kronis pada manusia. Menurut Nugroho (2008), manusia berumur 15-24 tahun memiliki peluang tertinggi terinfeksi MAP dan terkadang terjadi pada keluarga dengan status sosial baik. Kasus CD banyak dikaitkan dengan susu dan olahannya yang berasal dari ternak yang terinfeksi MAP. Berdasarkan beberapa laporan di negara Eropa, cemaran MAP pada susu segar dan produk olahannya seperti susu pasturisasi, susu formula, dan keju telah menunjukkan cemaran yang tinggi (SCAHAW 2000).
Patogenesis
4
penting bakteri dalam bertahan dan bereplikasi di dalam makrofag (Harris dan Barletta 2001).
Lesi granulomatosa mulai muncul pada lokasi peyer patches. Luka ini akan bertahan dalam keadaan laten untuk waktu yang lama. Perkembangan infeksi selanjutnya, peyer patche akan menyebar ke seluruh usus dan menimbulkan radang granulomatosa pada usus, penebalan dinding usus, limfoglandula mesenterika membengkak, dan kondisi paling ekstrim adalah terbentuknya lubang (perforasi) pada usus. Lesi-lesi tersebut jelas akan mengganggu absorbsi makanan pada hewan yang terinfeksi.
Gejala Klinis
Infeksi MAP terjadi pada periode neonatal (0-4 bulan), gejala klinik paratuberkulosis pada sapi biasanya muncul setelah hewan berumur lebih dua tahun. Sapi muda yang terinfeksi MAP tidak menunjukkan gejala klinis (silent infection) seolah seperti hewan yang tidak terinfeksi (Baumgartner dan Kohl 2006). Rute utama infeksi melalui makanan, susu, dan kolostrum yang tercemar MAP.
Perkembangan penyakit paratuberkulosis dibagi menjadi 3 stadium. Stadium 1, tipe silent atau subklinis. Infeksi tidak dapat terdeteksi pada stadium ini, terjadi pada anak sapi dan sapi dara ditandai dengan tidak menunjukkan gejala klinis. Pada stadium 2, hewan dalam kondisi subklinis dengan tanggap kebal seluler dan humoral yang sedang. Fase ini juga ditandai dengan peningkatan konsentrasi bakteri pada mukosa usus dan ruang usus. Stadium 3 (fase terminal) merupakan fase hewan menunjukkan gejala klinik yang ditandai adanya diare kronis, gejala infeksi umum seperti emasiasi, penurunan produksi susu, edema submandibulla (bottle jaw), anemia, rambut kasar, kulit kering dan infertilitas yang merupakan tanda akhir yang dominan (Tarmudji 2007). Aborsi dan alopesia merupakan tanda yang terlihat pada stadium lanjut dan hewan mati dengan status kaheksia. Pada fase klinis jumlah bakteri yang dikeluarkan melalui feses dapat mencapai 1010 CFU/g feses. Distribusi bakteri MAP selain pada organ pencernaan, juga terdapat pada organ reproduksi hewan jantan dan betina terinfeksi. Organisme ini dapat diisolasi dari fetus yang berasal dari sapi penderita meskipun penularan melalui intrauteri belum dapat dibuktikan (Stabel 1998).
MATERI DAN METODE
Tempat dan Waktu
5
Alat dan Bahan
Alat yang digunakan pada uji ELISA antara lain micropipet, microplate, microplate covers (alumunium foil), microplate shaker, ELISA reader, tissue towel, sarung tangan, masker, kain, vortex, dan timer. Alat yang digunakan pada uji PCR antara lain tabung reaksi, vortex, tabung Eppendorf, penangas air (waterbath), mesin centrifuge, QIAmp spin column, PCR chamber, Mesin PCR konvensional, mesin elektroforesis, dan gel documentation system.
Bahan yang digunakan pada uji ELISA antara lain serum darah sapi sebanyak 361 sampel, aquadest, reagen kit ELISA Idexx yang terdiri dari washing concentrate, reagent conjugate, dilution buffer N.1 dan N.12, tetramethyl benzydine (TMB) substrate, stop solution, kontrol positif, dan kontrol negatif. Bahan yang digunakan pada uji PCR antara lain feses sapi yang menunjukkan hasil positif dan suspect uji ELISA, buffer ASL, tablet InhibitEX, Proteinase K, buffer AL, buffer AW1, buffer AW2, buffer AE1, etanol 96%, primer IS900, primer F57, primer F57 Rn, primer R57, aquadest, PCR buffer, Taq Polymerase, DNA template, loading dye, kontrol positif dan negatif, 2% agarose elektroforesis, ethidium bromide, dan marker 100 bp DNA ladder.
Metode Penelitian Persiapan Sampel
Sampel yang diuji merupakan sampel koleksi Balai Besar Uji Standar Karantina Pertanian yang diambil secara acak menggunakan metode sampling by judgement. Sampel tersebut diambil dari serum darah dan feses sapi potong maupun sapi perah yang berasal dari peternakan sapi di beberapa daerah yang diduga positif terhadap MAP antara lain Bandung, Bandung Barat, Lebak dan Pandenglang, Yogyakarta dan Klaten, Surabaya, Kebumen, Bandarlampung, Malang, dan Cilegon dengan jumlah sampel serum darah dan feses masing-masing sebanyak 361 sampel. Sampel serum digunakan untuk pengujian ELISA. Hasil positif dan suspect ELISA dilanjutkan dengan uji PCR menggunakan sampel feses.
Prosedur ELISA
6
aluminium foil dan diinkubasi selama 45 menit pada suhu 18-26 ºC. Setiap sumur dicuci dengan washing solution masing-masing 300 µl sebanyak 3 kali hingga bersih.
Tahap selanjutnya yaitu sebanyak 100 µl reagent conjugate dimasukkan ke dalam semua sumur dan ditutup kembali dengan aluminium foil dan diinkubasi selama 30 menit dalam suhu 18-26 ºC. Setiap sumur dicuci kembali dengan washing solution masing-masing 300 µl sebanyak 3 kali. Setelah pencucian selesai, 100 µl TMB substrate dimasukkan ke dalam semua sumur, kemudian diinkubasikan selama 10 menit dalam suhu 18-26 ºC pada tempat gelap. Sebanyak 100 µl stop solution ditambahkan ke semua sumur, kemudian digoyangkan perlahan. Hasil pengujian dibaca menggunakan ELISA reader dengan nilai optical densities 450 nm.
Prosedur PCR
Ekstraksi DNA MAP
Ekstraksi DNA bertujuan membuang dan memisahkan asam nukleat dari komponen sel lainnya. Tahapan pertama ekstraksi DNA yaitu sampel feses sebanyak 1 gram dimasukkan ke dalam tabung 15 ml steril dan ditambahkan buffer ASL sebanyak 10 ml, kemudian divorteks selama 1 menit hingga homogen. Lysate diambil sebanyak 2 ml dan dimasukkan ke dalam tabung Eppendorf, selanjutnya dimasukkan dalam waterbath pada suhu 80 oC selama 5 menit, kemudian divorteks selama 15 detik dan disentrifugasi dengan kecepatan 14000 rpm selama 1 menit, kemudian supernatan diambil sebanyak 1.2 ml dan dimasukkan ke dalam tabung Eppendorf yang baru. 1 tablet InhibitEX ditambahkan ke dalam tabung dan divorteks hingga larut, kemudian diinkubasikan pada suhu kamar selama 1 menit dan disentrifugasi dengan kecepatan 14000 rpm selama 3 menit. Semua supernatan diambil dan dimasukkan ke dalam tabung Eppendorf, kemudian disentrifugasi kembali dengan kecepatan 14000 rpm selama 3 menit. Proteinase K sebanyak 15 µl dimasukkan ke dalam tabung Eppendorf yang baru, kemudian supernatan tersebut diambil 200 µl dan dimasukkan ke dalam tabung tersebut, kemudian 200 µl buffer AL ditambahkan dan divorteks selama 15 detik, selanjutnya diinkubasikan selama 10 menit pada suhu 70 oC dalam waterbath.
7 Eppendorf yang mengandung filtrat diambil, kemudian disimpan pada suhu -20
o
C.
Amplifikasi DNA menggunakan primers IS900 (TJ1-2) dan F57
Amplifikasi DNA merupakan proses perbanyakan segmen DNA spesifik yang melibatkan sepasang primer, enzim DNA polymerase, dan deoxynucleotida trifosfat. Prosedur amplifikasi PCR fragmen DNA dilakukan menggunakan primers IS900 forward TJ1 (5’-GCT GAT CGC CTT GCT CAT-3’) dan reverse TJ2 (5’-CGG GAG TTT GGT AGC CAG TA-3’) dengan produk PCR 356 bp (Tasara dan Stephan 2005). Hasil positif selanjutnya dilanjutkan dengan pengujian menggunakan primers F57 yaitu forward F57 (5’-CCT GTC TAA TTC GAT CAC GGA CTA GA-3’) dan reverse R57 (5’-TCA GCT ATT GGT GTA CCG AAT GT-3’) dengan produk PCR 432. Nested PCR dilakukan untuk mendapatkan hasil yang lebih jelas dilakukan dengan primer forward F57 Rn (5’-TGG TGT ACC GAA TGT TGT TGT CAC-3’) dan primer reverse R57 (5’-TCA GCT ATT GGT GTA CCG AAT GT-3’) dengan produk PCR 424 bp. PCR dilakukan dengan total volume 50 µl larutan reaksi yang terdiri dari 34.25 µl aquadest steril, 5 µl 10x PCR buffer, 1.5 µl MgCl2, 1.0 µl dNTP, 1.5 µl primers, 0.25 µl Taq
Polymerase, dan 5 µl DNA template. Kontrol positif dan negatif harus diikutkan dalam setiap amplifikasi. Pengujian PCR konvensional dilakukan dengan 1 siklus pada suhu 95 oC selama 5 menit, 35 siklus pada suhu 94 oC selama 45 detik, 58 oC selama 45 detik, dan 72 oC selama 1 menit, kemudian dilanjutkan dengan 1 siklus pada suhu 72 oC selama 10 menit.
Produk PCR (amplikon) diambil 8 µl dan dicampur dengan 2 µl loading dye solution di atas kertas parafilm, selanjutnya diseparasi menggunakan 2% agarose elektroforesis pada tegangan 100 Volt selama 60 menit menggunakan marker 100 bp DNA ladder dan pewarna ethidium bromide 15 µl. Hasil elektroforesis selanjutnya dilihat dengan menggunakan gel documentation system dan divisualisasikan menggunakan program aplikasi komputer Image LabTM Software.
Interpretasi Hasil
Sampel dengan nilai S/P diatas 0.55 artinya sampel mengandung antibodi terhadap bakteri MAP dan hasil ujinya positif. Perhitungan sample value related to positive value (S/P) dapat dihitung dengan formula sebagai berikut:
Nilai sampel yang diuji – nilai kontrol negatif Nilai rataan kontrol positif – nilai kontrol negatif
Tabel 1 Interpretasi hasil ELISA
Nilai S/P Status antibodi
<0.45 Negatif
0.45-0.55 Suspect
>0.55 Positif
8
Analisis Data
Data yang digunakan dalam penelitian ini adalah hasil pemeriksaan antibodi bakteri MAP menggunakan uji ELISA. Hasil positif dan suspect uji ELISA dilanjutkan dengan uji PCR. Data hasil uji ELISA dan PCR dianalisis secara deskriptif.
HASIL DAN PEMBAHASAN
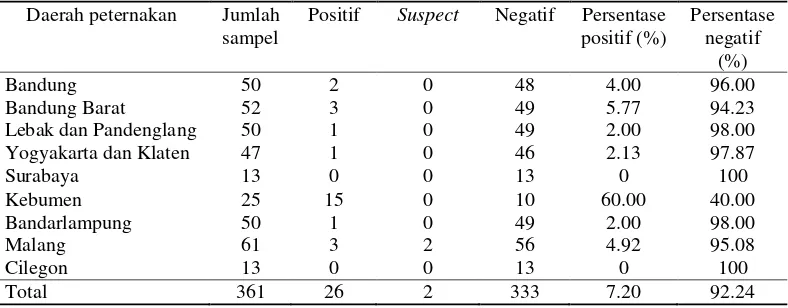
Serum sapi yang diperiksa pada penelitian ini berjumlah 361 sampel yang berasal dari beberapa peternakan diantaranya Bandung (50 sampel), Bandung Barat (52 sampel), Lebak Pandenglang (50 sampel), Yogyakarta dan Klaten (47 sampel), Surabaya (13 sampel), Kebumen (25 sampel), Bandarlampung (50 sampel), Malang (61 sampel), dan Cilegon (13 sampel). Penelitian ini tidak mempertimbangkan bobot badan, umur, jenis kelamin, dan ras sapi. Hasil pengujian ELISA terhadap 361 sampel serum menunjukkan adanya sampel yang positif mengandung antibodi bakteri MAP antara lain peternakan di Bandung (2 sampel), Bandung Barat (3 sampel), Yogyakarta dan Klaten (1 sampel), Kebumen (15 sampel), Lebak dan Pandenglang (1 sampel), Bandarlampung (1 sampel), dan Malang (3 sampel). Hasil persentase nilai positif uji ELISA disajikan pada Tabel 2.
Tabel 2 Persentase hasil pengujian ELISA dari sampel serum sapi
Daerah peternakan Jumlah sampel
Positif Suspect Negatif Persentase positif (%)
9 diperiksa dengan ELISA dinyatakan positif mengandung antibodi MAP (Adji 2004).
Deteksi MAP dengan uji serologis salah satunya dapat menggunakan uji Enzyme-Linked Immunosorbent Assay (ELISA), yaitu uji yang digunakan untuk mendeteksi dan menghitung jumlah antibodi atau antigen (Noviyanti 2008). Penelitian ini menggunakan metode ELISA tidak langsung yang paling spesifik dan sensitif untuk mengukur titer antibodi MAP (OIE 2000). McKenna (2005) menjelaskan bahwa hasil uji ELISA berkaitan erat dengan fase perkembangan penyakit pada inang. Pada fase preklinis, sensitivitas ELISA masih sangat rendah dan akan meningkat pada fase klinis seiring reaksi tanggap kebal inang. Reaksi tanggap kebal humoral itu sendiri sudah dapat terdeteksi pada fase preklinis tanpa disertai pengeluaran bakteri pada fesesnya (Roussel et al. 2007). Kelemahan metode ini adalah tidak adanya spesifitas sebagai akibat reaksi dengan antigen yang tidak murni, misalnya hasil vaksinasi dengan antigen yang tidak terkait dapat menimbulkan reaksi tidak spesifik (Burgess 1995). Metode ini cukup baik dengan sensitivitas relatif tinggi yaitu 91-95%, namun masih memungkinkan terjadinya reaksi silang yang mengakibatkan positif palsu, sehingga memerlukan uji lanjutan untuk memastikan ketepatan hasil uji ELISA.
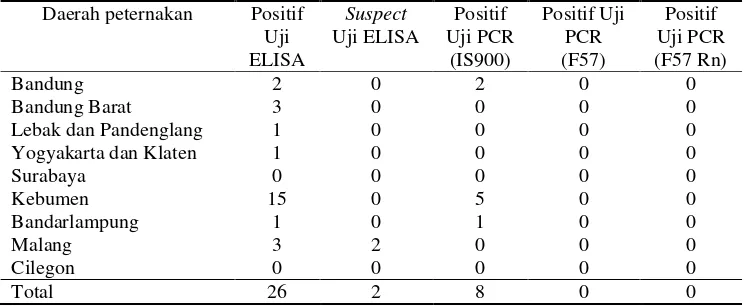
Metode ELISA memiliki keunggulan diantaranya: metodenya sederhana, harga yang terjangkau, memiliki kinerja yang cepat, memberikan sensitivitas mirip dengan isolasi bakteri, dan dapat digunakan untuk mendiagnosa penyakit serta sebagai screening awal terhadap infeksi (OIE 2000). Antibodi yang terdeteksi menggunakan metode ELISA tidak hanya karena infeksi MAP, antibodi juga dapat disebabkan akibat reaksi silang dengan M. avium complex atau akibat dari vaksinasi, sehingga perlu diperhatikan riwayat vaksinasi agar hasil terinterpretasikan secara tepat. Penelitian ini terdapat dokumen yang menyatakan seluruh sapi belum pernah divaksinasi MAP sebelumnya, sehingga dikhawatirkan seropositif disebabkan oleh infeksi alami, sehingga hasil positif dan suspect ELISA harus diuji konfirmasi menggunakan PCR sebagai uji lanjutan untuk meneguhkan diagnosa. Hasil uji konfirmasi PCR primer IS900, F57, dan nasted PCR primer F57 Rn pada sampel positif dan suspect ELISA disajikan pada Tabel 3.
Tabel 3 Hasil uji konfirmasi PCR pada sampel positif dan suspect ELISA
Daerah peternakan Positif
10
yang sama. Dari pengujian feses diharapkan bakteri dapat terdeteksi secara molekuler dengan PCR. Polymerase Chain Reaction (PCR) merupakan metode yang cepat dan sederhana untuk memperbanyak urutan DNA spesifik yang diinginkan dan divisualisasikan sebagai pita DNA pada gel agarose. Penelitian ini menggunakan sekuen IS900 dan F57 sebagai primer MAP. Primer IS900 diketahui dapat meningkatkan sensitivitas dan spesifitas diagnosis PCR terhadap MAP, bahkan dapat membedakannya dengan subspesies lain dari M. avium complex dan M. silvaticum (Harris dan Barletta 2001). Sedangkan primer F57 merupakan hasil pengembangan dari sekuen yang sudah ada yang mempunyai kinerja sangat baik, memiliki spesifisitas yang lebih tinggi dibanding sekuen IS900 dan terbukti memiliki akurasi lebih baik.
Berdasarkan Tabel 3, pengujian PCR menggunakan primer IS900, 8 dari 28 sampel yang diuji menunjukkan hasil positif ditandai ditemukannya pita DNA MAP. Selanjutnya, 8 sampel positif tersebut dilakukan PCR menggunakan primer F57 dan F57 Rn yang memiliki sensitifitas dan akurasi lebih baik. Hasil analisis PCR konvensional primer F57 dan F57 Rn menunjukkan tidak adanya pita DNA MAP pada semua sampel. Harris dan Barletta (2001) menyatakan bahwa primer IS900 memiliki kelemahan yaitu adanya 229 wilayah amplifikasi yang tumpang tindih dengan sekuen dari M. avium atau Mycobacterium lingkungan non-MAP lainnya sehingga sering memperlihatkan hasil positif palsu. Hasil negatif uji PCR kemungkinan disebabkan akibat tidak ada atau sedikitnya bakteri yang ada pada feses (Whipple et al. 1992; Nugroho et al. 2008) dan sifat penyebaran (shedding) bakteri pada feses yang bersifat intermittent (Tarmudji 2007). Berdasarkan Kementan (2012), apabila uji ELISA menunjukkan hasil positif, hal tersebut baru menunjukkan reaktor positif, untuk hewan terduga harus dipisahkan dan dilakukan uji konfirmasi dengan PCR. Apabila uji PCR menunjukkan hasil negatif, pemeriksaan ELISA harus diulang kembali 6 bulan kemudian, sedangkan apabila uji PCR positif, maka harus dilakukan kultur bakteri sebagai gold standar pengujian MAP.
Peluang terbesar masuknya paratuberkulosis ke Indonesia yaitu melalui importasi ternak bibit maupun bakalan yang terdiri dari sapi perah, sapi pedaging, kambing dan domba dari negara tertular. Resiko diperbesar oleh sifat bakteri yang sulit untuk dideteksi, antara lain karena ternak yang terinfeksi MAP sebagian besar tidak menunjukkan gejala klinis (subklinis), masa inkubasi yang cukup lama, dan penyebaran bakteri (shedding) lewat feses secara intermittent (berselang-seling) yang tidak diketahui waktunya (Tarmudji 2007). Selain itu, waktu yang lama untuk tumbuh di media biakan laboratorium dan belum ditemukannya satu metode diagnosa yang akurat semakin mempersulit dalam pendeteksian secara dini. Penyebaran penyakit dikhawatirkan semakin cepat melalui lalu lintas hewan, produk jeroan, semen, dan limbah hewan (pupuk) (Kementan 2012). Upaya untuk mencegahnya diperlukan deteksi penyakit secara dini, informasi daerah asal hewan, dan teknik diagnosa yang akurat.
11 validasi metode pengujian laboratorium, pengketatan persyaratan kesehatan hewan pada importasi hewan peka, pelaksanaan program dan strategi vaksinasi, pengawasan lalu lintas dan karantina hewan peka, isolasi dan penerapan zonasi, serta pemusnahan hewan diduga terinfeksi paratuberkulosis. Penyakit paratuberkulosis perlu mendapat perhatian yang lebih dari pemerintah karena berpotensi merugikan ekonomi, kesehatan manusia, lingkungan, dan keresahan masyarakat.
SIMPULAN DAN SARAN
Simpulan
Sampel penyakit hewan karantina Balai Besar Uji Standar Karantina Pertanian yang diuji menggunakan uji ELISA, kemudian dikonfirmasi menggunakan uji PCR menunjukkan tidak terdeteksi adanya serum positif antibodi dan DNA spesifik Mycobacterium avium subspesies paratuberculosis, sehingga belum dapat dilakukan koleksi serum positif antibodi dan bakteri MAP untuk kepentingan kajian penyakit hewan karantina.
Saran
Perlu dilakukan kajian epidemiologi terhadap paratuberkulosis dan tindakan kesiagaan darurat veteriner oleh Direktorat Jenderal Peternakan dan Kesehatan Hewan, Badan Karantina Pertanian, dan Dinas Peternakan dan Kesehatan Hewan.
DAFTAR PUSTAKA
Acha PN, Szyfres B. 2003. Zoonoses and Communicable Disease Common to Man and Animals. Vol I. 3rd ed. Washington (US): Pan American Health Organization. hlm 283-297.
Adji RS. 2004. Isolasi dan uji serologi terhadap Mycobacterium paratuberculosispada sapi perah. Prosiding Seminar Nasional Teknologi Peternakan dan Veteriner. Bogor, 4-5 Agustus 2004. Bogor (ID): Pusat Penelitian dan Pengembangan Peternakan. hlm. 281-284.
[BPS] Badan Pusat Statistik. 2013. Konsumsi Protein Penduduk Indonesia. Jakarta (ID): Badan Pusat Statistik.
Baumgartner W, Kohl JL. 2006. Paratuberculosis (Johne’s Disease) in ruminant an ongoing story. Slov Vet Res. 43(1):5-10.
Burgess GW. 1995. Teknologi ELISA dalam Diagnosis dan Penelitian. Artama WT, penerjemah. Yogyakarta (ID): UGM Pr. Terjemahan dari: ELISA Technology in Diagnosis and Research.
12
[Ditjen PKH] Direktorat Jenderal Peternakan dan Kesehatan Hewan. 2012. Buku Statistik Peternakan Tahun 2012. Jakarta (ID): Kementerian Pertanian Republik Indonesia.
[Ditjen PKH] Direktorat Jenderal Peternakan dan Kesehatan Hewan. 2012. Press Release Konfrensi Pers Direktur Jenderal Peternakan dan Kesehatan Hewan Tentang Supply Demand Daging Sapi/Kerbau sampai dengan Desember 2012. Jakarta (ID): Direktorat Jenderal Peternakan dan Kesehatan Hewan. Gallagher J, Jenkins PA. 1998. Mycobacterial Diseases. Di dalam: Palmer SR,
Soulsby L, Simpson DIH, editor. Zoonoses, Biology, Clinical Practice, and Public Health Control. New York (US): Oxford University Pr. hlm 161-162.
Grant IR, Ball HJ, Neill SD, Rowe MT. 1996. Inactivation of Mycobacterium paratuberculosis in cow’s milk at pasteurization temperatures. J Appl Environ Microbiol. 62:631-636.
Griffiths M. 2003. Mycobacterium Paratuberculosis. Di dalam: Blackburn CW, McClure PJ, editor. Food-borne Pathogenes. Edisi ke-1. Florida (US): CRC Pr. hlm 489-500.
Harris NB, Barletta RG. 2001. Mycobacterium avium subsp. paratuberculosis in veterinary medicine. Clin Microbiol Rev. 14:489-512.
Holt JG, Krieg NR, Sneath PHA, Staley JT, Williams ST. 1994. Bergey’s Manual of Determinative Bacteriology. Edisi ke-9. Maryland (US): Williams & Wilkins. hlm 597.
[Kementan] Kementerian Pertanian Republik Indonesia. 2012. Kesiagaan Darurat Veteriner Indonesia (KIATVETINDO) Paratuberculosis. Jakarta (ID): Kementrian Pertanian Republik Indonesia.
McKenna SLB. 2005. Comparison of two enzyme-linked immunosorbent assay for diagnosis of Mycobcaterium avium subsp. paratuberculosis. J Vet Diagn Invest. 17:426-466.
Noviyanti. 2008. Deteksi keberadaan antibodi anti H5N1 menggunakan metode Enzyme-Linked Immunosorbent Assay (ELISA) pada serum sapi yang divaksinasi H5N1 [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Nugroho WS. 2008. Deteksi Mycobacterium avium subspesies paratuberculosis pada sapi perah, susu pasturisasi, dan susu formula lanjutan di wilayah Bogor [disertasi]. Bogor (ID): Institut Pertanian Bogor.
Nugroho WS, Adji RS, Wahyuni A. 2008. Uji konfirmasi isolat lokal terduga Mycobacterium avium subspesies paratuberculosis menggunakan polymerase chains reaction (PCR) F57. JITV. 13(2):127-132.
[OIE] Office International des Epizooties. 2000. Paratuberculosis. In: Manual of Standards Diagnostic Test and Vaccines. Paris (FR): OIE.
Putra AAG. 2006. Situasi penyakit hewan menular strategis pada ruminansia besar: surveilans dan monitoring. Bulet Vet. 18:98-113.
Roussel AJ, Fosgate GT, Manning EJB, Collins MT. 2007. Association of fecal shedding of Mycobcateria with ELISA-determined seroprevalence for paratubeculosis in beef herds. JAVMA. 230:890-895.
13 Shanahan JF. 1994. Mycobacteria. Di dalam: Potts LM, editor. Bailey and Scott’s
Diagnotic Mycrobiology. New York (US): Mosby-Year Book. Hlm 591. Sudarwanto MB. 1999. Usaha peningkatan produk susu melalui program
pengendalian mastitis sub klinis [orasi ilmiah guru besar]. Bogor (ID): Institut Pertanian Bogor.
Stabel JR. 1998. Johne’s disease: a hidden threat. J Dairy Sci. 81:283-288.
Sung N, Takayama K, Collins MT. 2004. Possible associatin of GroES and antigen 85 protein with heat resistance of Mycobacterium paratuberculosis. J Appl Environ Microbiol. 70:1688-1697.
Tarmudji. 2007. Kejadian paratuberkulosis (Johne’s Disease) pada ruminansia di Indonesia perlu diwaspadai. Wartazoa. 17:81-82.
Tasara T, Stephan R. 2005. Development of an F57 sequence-based real-time PCR assay for detection of Mycobacterium avium subspesies paratuberculosis. J Appl Environ Microbiol. 10:5957-5968.
14
Lampiran 1 Hasil visualisasi uji PCR primer IS900, F57, dan F57 Rn dari sampel feses sapi
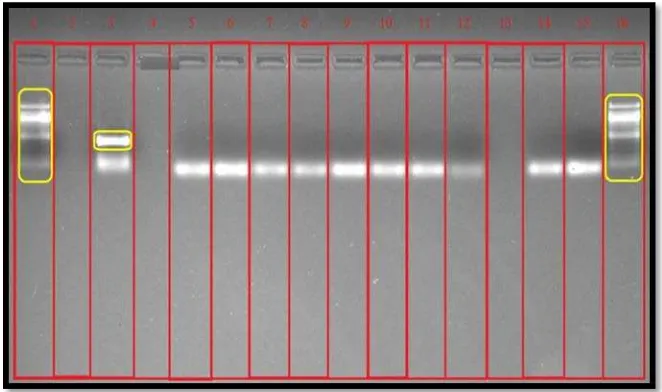
Gambar 1 Hasil uji PCR primer IS900 pada sampel dari peternakan di daerah Malang. Pita DNA MAP tidak terdeteksi pada ke-5 sampel (kolom 4-8), kontrol positif (kolom 2), kontrol negatif (kolom 9), dan marker 100 bp DNA ladder (kolom 1 dan 11).
15
Gambar 3 Hasil uji PCR primer IS900 pada sampel dari peternakan di daerah Kebumen, Bandung, Bandung Barat, dan Bandarlampung. Pita DNA MAP terdeteksi pada sampel kolom 8-12 (sampel Kebumen), kolom 17 dan 18 (sampel Bandung), dan kolom 19 (sampel Bandarlampung). Pita DNA tidak terdeteksi pada sampel kolom 3-5 (sampel Bandung Barat), 6-7 dan 13-16 (sampel Kebumen). Kontrol positif (kolom 2), kontrol negatif (kolom 20), dan marker 100 bp DNA ladder (kolom 1 dan 21).
16
17
RIWAYAT HIDUP
Penulis dilahirkan di Cilacap pada tanggal 8 Maret 1992 dari pasangan Bapak Turiman dan Ibu Hermi Widayati. Penulis merupakan putra pertama dari tiga bersaudara. Penulis lulus dari SMA Negeri 1 Majenang pada tahun 2010 dan diterima di Institut Pertanian Bogor pada tahun yang sama melalui jalur Undangan Seleksi Masuk IPB (USMI) pada Fakultas Kedokteran Hewan.