KARAKTERISASI ENZIM ALGINAT LIASE DARI ISOLAT
BAKTERI Bacillus megaterium ASAL INDONESIA
YUWANITA ARDILASARI
ILMU DAN TEKNOLOGI PANGAN FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul Karakterisasi Enzim Alginat Liase dari Isolat Bakteri Bacillus megaterium Asal Indonesia adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
ABSTRAK
YUWANITA ARDILASARI. Karakterisasi Enzim Alginat Liase dari Isolasi Bakteri Bacillus megaterium Asal Indonesia. Dibimbing oleh MAGGY T. SUHARTONO
Produktivitas rumput laut coklat di Indonesia mencapai 300 ton/tahun, namun pemanfaatan rumput laut coklat di Indonesia sejauh ini hanya dikeringkan dan diekspor dengan harga yang sangat rendah yaitu Rp 2000,00/kg. Rumput laut coklat berpotensi menghasilkan 40% alginat dari berat kering. Alginat adalah polisakarida alam yang banyak ditemukan pada beberapa jenis rumput laut yang secara kimia tersusun oleh dua jenis asam uronat. Unit monomer alginat terdiri atas asam guluronic (G) dan manuronic (M). Aplikasi alginat liase adalah untuk preparasi alginat oligosakarida bioaktif, meningkatkan efektivitas pemakaian antibiotik, dan berpotensi menghasilkan monosakarida turunan untuk produksi biofuel. Enzim alginat liase dapat diproduksi oleh bakteri tanah, bakteri laut, dan moluska.
Tujuan dari penelitian ini adalah memproduksi enzim alginat liase dari isolat bakteri Bacillus megaterium yang diisolasi dari Sargassum sp dan karakterisasi suhu, pH , dan jenis substrat optimum untuk enzim alginat liase. Analisis enzim yang dilakukan menggunakan metode DNS (3,5 dinitro salicilic acid). Pada penelitian ini, media cair yang digunakan untuk menumbuhkan kultur isolat yaitu Luria Bertani Broth pH 7 dengan penambahan alginat sebanyak 5 mg/mL. Uji kadar protein dilakukan menggunakan metode Bradford. Hasil penelitian menunjukkan bahwa kadar protein enzim alginat liase setelah pemekatan menggunakan ammonium sulfat lebih tinggi daripada sebelum pemekatan (655.15 mg/mL menjadi 1176.26 mg/mL). Kondisi aktivitas optimum enzim alginat liase pada suhu 45 0C dengan aktivitas enzim sebesar 9.00 U/menit/mL dan pH netral yaitu 7 dengan aktivitas enzim sebesar 8.72 Unit/menit/mL. Substrat manuronat memiliki nilai Km dan Vmak sebesar 79.8 mg/mL dan 200 Unit/menit/mL, sedangkan jenis substrat guluronat memiliki nilai Km dan Vmak sebesar 13.17 mg/mL dan 27.78 Unit/menit/mL, sehingga enzim alginat liase dari isolat bakteri Bacillus megaterium spesifik terhadap dua substrat yaitu manuronat dan guluronat.
ABSTRACT
YUWANITA ARDILASARI. Characterization of Alginate Lyase Enzyme from Indonesian Bacillus megaterium Isolates. Supervised by MAGGY T. SUHARTONO
Brown seaweed productivity has reached 300 tons per year in Indonesia, but this brown seaweed is only dried and exported with a low price, which is 2000 IDR/kg. Brown seaweed has a potential to produce 40 % alginate (dry weight). Alginate is a polysaccharide that can be found in several species of seaweed and chemically composed by two types of acid uronat. Alginate consists of guluronic acid ( G ) and manuronic acid ( M ) as monomer. Alginate lyases can be used for preparation of alginat bioactive olligosaccharide, can increase the effectiveness of antibiotics usage, and the enzyme is also usefull for production of monosaccharide derivatives for biofuel. The alginate lyases enzyme can be produced by a marine bacteria, soil bacteria, and molluscs.
The purpose of this research was to produce alginate lyases enzymes from Bacillus megaterium which was isolated from Sargassum sp and characterizes the optimum temperature, pH, and substrate type for alginat lyases enzyme. Enzyme analysis was conduction used DNS methods (3.5 dinitro salicilic acid). In this study, Luria Bertani Broth was used to grow the isolates at pH 7 with addition of alginate as much as 5 mg/mL. Protein level analysis was performed using Bradford method. The results showed that the protein level of ammonium sulphate precipitated of alginate lyases enzyme was higher than the non precipitated enzyme (655.15 mg/mL to 1176.26 mg/mL). Optimum conditions for the alginate lyases enzyme activity was 45 0C with enzyme activity of 9.00 Unit/Min/mL and at pH 7 with enzyme activity of 8.72 Units/min/mL. When mannuronat substrate was had Km and Vmak was 79.8 mg/mL and 200 Unit/min/mL, whereas the gulluronat substrate was had Km was 13.17 mg/mL and Vmax was 27.78 Unit/min/mL, there for alginate lyases enzymes from Bacillus megaterium isolate good degree in two substrates, namely mannuronat and gulluronat.
Keywords : alginate, alginate lyase, Bacillus megaterium, bradford, DNS.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Teknologi Pertanian
pada
Departemen Ilmu dan Teknologi Pangan
KARAKTERISASI ENZIM ALGINAT LIASE DARI ISOLAT
BAKTERI Bacillus megaterium ASAL INDONESIA
YUWANITA ARDILASARI
ILMU DAN TEKNOLOGI PANGAN FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR BOGOR
PRAKATA
Puji dan syukur penulis panjatkan teramat banyak kepada Allah subhanahu wa ta’ala atas segala limpahan rahmat, hidayah, dan karunia-Nya sehingga skripsi yang berjudul “Karakterisasi Enzim Alginat Liase dari Isolat Bakteri Bacillus
megaterium Asal Indonesia” telah berhasil diselesaikan.
Pada kesempatan ini penulis mengucapkan terima kasih kepada:
1. Bapak Suprapto dan Ibu Unik Marlina selaku orang tua yang telah mendoakan dan memberikan semangat, nasehat, dan dukungannya, serta buat kakak tercinta Nafel yang siap mendengarkan semua cerita selama penelitian.
2. Prof.Dr.Ir. Maggy T. Suhartono sebagai dosen pembimbing skripsi yang telah banyak memberikan arahan dan bimbingan kepada penulis hingga terselesaikannya skripsi ini.
3. Bapak Ir. Sutrisno Koswara, M.SI dan Dr-Ing. Dase Hunaefi, STP., MFoodST sebagai dosen penguji.
4. Bapak Subaryono dari Balai Pascapanen dan Bioteknologi Kelautan dan Perikanan yang telah mendukung dan memberikan dana dalam penelitian ini melalui proyek Scalling Up Pengembangan Pangan dari Alginat Termodifikasi.
5. Para teknisi laboratorium ITP yaitu Pak Yahya, Pak Rojak, Pak Wahid, Mas Edi, Mbak Nurul, Mbak Irin, dan semuanya teknisi yang telah membantu saya selama penelitian.
6. Teman-teman ITP 47, geng Tonot-Tonot dan semua teman-teman yang telah membantu dalam penulisan skripsi ini yang tidak dapat disebutkan satu persatu.
Semoga skripsi ini bermanfaat dan dapat dijadikan acuan. Terima kasih.
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 5
Manfaat Penelitian 5
METODE 5
Waktu dan Tempat 5
Bahan 5
Alat 5
Prosedur Analisis Data 6
HASIL DAN PEMBAHASAN 9
Pemekatan Enzim Alginat Liase dengan Pengendapan Ammonium Sulfat dan
Kadar Protein Alginat Liase 9
Karakterisasi Enzim Alginat Liase 10
Suhu 11
Tingkat Keasaman (pH) 12
Jenis Substrat Spesifik 13
SIMPULAN DAN SARAN 17
Simpulan 17
Saran 17
DAFTAR PUSTAKA 17
LAMPIRAN 19
DAFTAR TABEL
1. Komposisi kimia Sargassum sp 2
2. Organisme penghasil alginat liase dan karakteristik enzim 4 3. Nilai Km dan Vmak Enzim Alginat Liase dari isolat Bacillus
megaterium 16
DAFTAR GAMBAR
1. Sargassum sp. 1
2. Struktur kimia asam uronat penyusun alginat 3
3. Diagram alir produksi dan karakterisasi enzim alginat liase 8
4. Kurva standar BSA (Bovin Serum Albumin) 9
5. Kadar protein alginat liase 10
6. Kurva standar D-Manosa 10
7. Pengaruh suhu terhadap aktivitas alginat liase 11 8. Pengaruh tingkat keasaman (pH) terhadap aktivitas alginat liase 13 9. Kurva Michaelis-Menten (a) substrat guluronat (b) substrat manuronat 14 10.Kurva Lineweaver-Burk (a) substrat guluronat (b) substrat manuronat 15
DAFTAR LAMPIRAN
1. Nilai absorbansi kurva standar BSA (Bovin Serum Albumin) 19
2. Data kadar protein alginat liase 19
3. Data absorbansi kurva standar D-Manosa 19
4. Data nilai aktivitas enzim alginat liase berbagai perlakuan suhu 20 5. Data nilai aktivitas enzim alginat liase berbagai perlakuan pH 21 6. Data nilai aktivitas enzim alginat liase berdasarkan substrat guluronat 22
7. Data nilai aktivitas enzim alginat liase berdasarkan substrat
PENDAHULUAN
Latar Belakang
Perairan Indonesia merupakan perairan tropika yang kaya akan sumber daya plasma nutfah rumput laut (menurut ekspedisi oleh Van Bosse 1899-1900 mencapai 555 jenis), membuat komoditas rumput laut menjadi salah satu hasil laut yang diunggulkan dan dikembangkan secara luas, tersebar di seluruh wilayah perairan Indonesia (mencapai 384,73 ribu ha) (Kementrian Perdagangan 2013). Produksi rumput lauit ini mencapai 300ton/tahun, namun sampai saat ini pemanfaatan rumput laut coklat hanya dikeringkan dan diekspor dengan harga yang rendah yaitu Rp 2000,00/kg. Pemanfaatan rumput laut ini masih belum optimal, sehingga nilai ekonomisnya masih rendah (Subaryono 2010).
Rumput laut coklat adalah kelompok alga yang secara umum berwarna coklat atau pirang. Warna tersebut tidak berubah walaupun alga ini mati atau kekeringan (Atmadja 1996). Salah satu rumput laut coklat adalah Sargassum sp, yang tersebar luas di Indonesia. Zat yang dapat diekstrak dari alga ini adalah alginat, yaitu suatu garam dari asam alginik yang mengandung ion sodium, kalsium dan barium (Aslan 1999). Visualisasi Sargassum sp dapat dilihat pada Gambar 1.
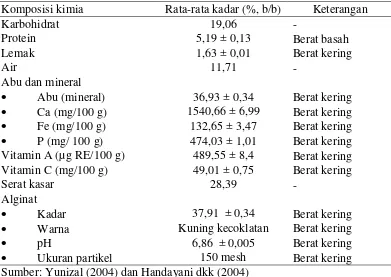
Alga Sargassum mudah diperoleh di perairan Indonesia, kandungan kimia utamanya sebagai sumber alginat dan mengandung protein, karbohidrat, lemak, air, abu, mineral, serat kasar, vitamin A, dan vitamin C. Komposisi kimia dari Sargassum sp. dapat dilihat pada Tabel 1.
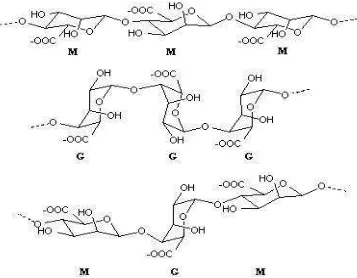
Alginat adalah polisakarida alam yang banyak ditemukan pada beberapa jenis rumput laut maupun merupakan produk metabolit beberapa jenis bakteri, yang secara kimia tersusun oleh dua jenis asam uronat. Unit monomer alginat terdiri dari asam guluronic (G) dan manuronic (M). Kandungan alginat dalam rumput laut coklat sangat melimpah dapat mencapai 40% dari berat kering rumput laut (Draget et al. 2005)
2
Berdasarkan jenis substrat spesifiknya alginat liase dikelompokkan menjadi dua kelompok. Kelompok pertama adalah alginat liase yang spesifik mendepolimerisasi polimannuronat, disebut poly (β-D-mannuronate) lyases (EC4.2.2.3). Kelompok kedua adalah alginat liase yang memiliki aktifitas hidrolitik pada blok poliguluronat, disebut poly (α-L-guluronate) lyases (EC 4.2.2.11) (Wong et al 2000). Meskipun demikian, ada beberapa karakteristik alginat liase yang spesifik terhadap kedua substrat tersebut (homopolimer). Hal ini membuktikan bahwa suatu organisme dapat memproduksi lebih dari satu liase atau satu enzim yang memiliki aktifitas ganda baik terhadap mannuronat maupun guluronat (Wong, et al., 2000). Struktur kimia asam uronat penyusun alginat dapat dilihat pada Gambar 2.
Alginat liase komersial produksi SIGMA diketahui merupakan alginat lyase yang specifik terhadap manuronat (EC 4.2.2.3) sehingga aktivitasnya bisa jauh berkurang pada kondisi substrat yang kaya poliguluronat. Isolasi dan produksi enzim alginat lyase dari bakteri yang berasosiasi dengan rumput laut lokal diharapkan akan mendapatkan enzim yang sesuai dengan substrat yang tersedia, sehingga aktivitasnya tetap tinggi pada substrat yang kaya akan poliguluronat (Subaryono 2013).
Tabel 1. Komposisi kimia Sargassum sp
Komposisi kimia Rata-rata kadar (%, b/b) Keterangan
Karbohidrat 19,06 -
Warna Kuning kecoklatan Berat kering
pH 6,86 ± 0,005 Berat kering
Ukuran partikel 150 mesh Berat kering
3
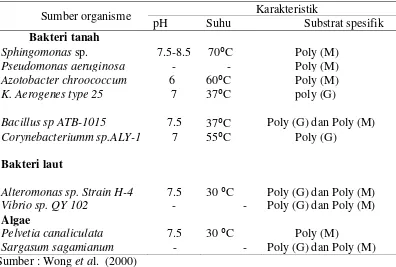
Alginat liase dapat dihasilkan dari berbagai mikroorganisme seperti bakteri tanah, bakteri laut, rumput laut maupun moluska dan gastropod. Dari masing-maing sumber tersebut mempunyai karakteristik yang berbeda. Organisme penghasil alginat liase dan karakterisasinya dapat dilihat pada Tabel 2.
Aplikasi dari alginat liase yaitu sebagai preparasi biofungsional alginat oligosakarida yang dapat berfungsi sebagai immunomodulator, menurunkan kandungan kolesterol dalam darah khususnya LDL, dan menurunkan potensi penyakit akibat infeksi bakteri usus. Bidang medis, alginat liase mampu meningkatkan afektivitas antibiotik. Selain itu alginat liase berpotensi sebagai derivat monosakarida untuk produksi biofuel dan biochemical (Kim et al 2011).
Terdapat beberapa faktor yang memengaruhi kerja enzim. Faktor-faktor tersebut erat kaitannya dengan sifat enzim sebagai protein. Faktor-faktor tersebut diantaranya :
1) Suhu
Suhu sangat berperngaruh terhadap kerja enzim karena enzim terdiri atas protein. Semakin suhunya tinggi, reaksi kimia akan semakin cepat. Akan tetapi enzim akan mengalami denaturasi jika suhu terlalu tinggi. Enzim yang mengalami denaturasi akan mengalami perubahan konformasi dari enzim, sehingga enzim tersebut tidak aktif (Abdurahman 2008)
2) Derajat keasaman (pH)
Seperti protein, enzim juga bekerja dipengaruhi oleh derajat keasaman lingkungan. Setiap enzim memiliki pH lingkungan yang khas untuk mencapai aktivitas optimumnya. Di luar pH tersebut, kerja enzim akan terganggu bahkan akan terdenaturasi.Perubahan aktivitas enzim akibat perubahan pH lingkungan disebabkan terjadinya perubahan ionisasi enzim, substrat atau kompleks enzim
4
substrat, serta perubahan kemampuan peningkatan dan pengaruh laju reaksi. Pada umumnya enzim menunjukkan aktivitas maksimum pada kisaran pH yang disebut pH optimum antara pH 4.5-8.0 (Winarno 1986).
3) Zat penghambat
Kerja enzim dapat dihambat oleh zat penghambat/inhibitor. Terdapat dua jenis inhibitor yakni inhibitor kompetitif dan inhibitor non-kompetitif. Inhibitor kompetitif menghambat kerja enzim dengan cara berikatan dengan enzim pada sisi aktifnya. Inhibitor ini bersaing dengan substrat untuk menempati sisi aktif enzim. Hal ini terjadi karena inhibitor memiliki struktur yang mirip dengan substrat. Berbeda dengan inhibitor kompetitif, inhibitor non-kompetitif tidak bersaing dengan substrat untuk berikatan dengan enzim. Inhibitor jenis ini akan berikatan dengan enzim pada sisi yang berbeda (bukan sisi aktif enzim). Jika telah terjadi ikatan enzim-inhibitor, sisi aktif enzim akan berubah sehingga substrat tidak dapat berikatan dengan enzim (Tranggono dan Sutardi 1990).
4) Konsentrasi enzim dan substrat
Pada reaksi dengan konsentrasi enzim yang lebih sedikit dibandingkan substrat, penambahan enzim akan meningkatkan laju reaksi. Peningkatan laju reaksi ini terjadi secara linear. Jika konsentrasi substart dan enzim sudah seimbang, laju reaksi akan relatif konstan. Penambahan konsentrasi substrat pada reaksi yang dikatalisis oleh enzim awalnya akan meningkatkan laju reaksi. Akan tetapi, setelah konsentrasi substrat dinaikkan lebih lanjut, laju reaksi akan mencapai titik jenuh dan tidak bertambah lagi (Poedjiadi dan Supriyanti 2005)
Tabel 2. Organisme penghasil alginat liase dan karakteristik enzim
Sumber organisme Karakteristik
pH Suhu Substrat spesifik
5 Tujuan Penelitian
Tujuan penelitian ini adalah memproduksi enzim alginat liase dari isolat bakteri Bacillus megaterium asal Indonesia dan mengetahui optimasi suhu, pH, dan jenis substrat spesifik pada enzim alginat liase dengan mengacu pada aktivitas enzim yang optimum.
Manfaat Penelitian
Manfaat yang diharapkan dari penelitian ini adalah diperolehnya informasi tentang karakter enzim alginat liase yang dihasilkan oleh isolate bakteri Bacillus
megaterium pilihan dari rumput laut jenis Sargassum terhadap suhu, pH, dan
substrat yang digunakan sehingga proses hidrolisis dalam skala komersial dapat dioptimalkan.
METODE
Waktu dan Tempat
Penelitian dilaksanakan dari bulan Desember 2013 sampai bulan April 2014 di Laboratorium Ilmu dan Teknologi Pangan IPB.
Bahan
Bahan yang digunakan dalam memproduksi enzim alginat liase adalah pepton, yeast extrac, NaCl, aquades, Na-Alginat, alkohol, media Luris-Bertani, dan isolat bakteri Bacillus megaterium. Isolat bakteri Bacillus megaterium berasal dari dekomposisi rumput laut jenis Sargassum sp (Subaryono 2014). Bahan yang digunakan dalam analisis adalah enzim alginat liase, buffer universal pH 6-12, substrat manuronat dan guluronat, larutan BSA (Bovin Serum Albumin), larutan Bradford, dan larutan DNS (3,5 dinitro salicilic acid). Komposisi dari buffer universal adalah larutan A dan larutan B. Larutan A terdiri dari asam sitrat, KH2PO4, H3BO3, dan dietil barbiturat. Sedangkan larutan B terdiri dari NaOH.
Alat
6
Prosedur Analisis Data
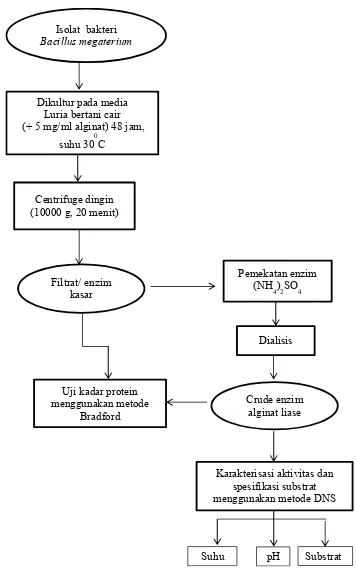
Produksi Enzim Alginat Liase (Subaryono 2013)
Produksi enzim dimulai dari tahapan ekstraksi dengan mengkultur bakteri terpilih pada media luria bertani cair yang diberikan tambahan alginat 5 mg/ml selama 48 jam pada suhu 300C. Selanjutnya kultur disentrifuge 10000 g selama 20 menit, dan filtrat dipisahkan dari endapan. Terhadap filtrat dilakukan uji kadar protein. Filtrat selanjutnya diendapkan dengan menambahkan amonium sulfat sampai konsentrasi 35% (b/v) kemudian distirer selama 2 jam dan disentrifuge 10000 g selama 10 menit. Supernatan diendapkan kembali dengan penambahan amonium sulfat sampai konsentrasi total 30%, distirer selama 2 jam pada suhu 4 ⁰C dan disentrifuge 10000 g selama 10 menit. Endapan dikumpulkan dan didialisis dengan 20 mM buffer universal (pH 7.0) pada suhu 4 ⁰C selama 24 jam hingga diperoleh crude enzim. Enzim kasar dan crude enzim alginat liase diuji kadar proteinnya menggunakan metode Bradford. Selanjutnya crude enzim alginat liase dikarakterisasi aktivitas enzim pada berbagai kondisi suhu, pH dan jenis substrat spesifik dengan metode DNS.
Analisis Karakterisasi Enzim Alginat Liase
1. Kadar Protein Metode Bradford (Bradford 1976 Termodifikasi)
Persiapan preaksi Bradford dilakukan dengan cara melarutkan 5 mg coomasive brilliant blue G-250 dalam 2.5 mL etanol 95% (v/v), lalu ditambahkan dengan 5 mL asam fosfat 85% (v/v). Jika telah larut dengan sempurna lalu ditambahkan akuades hingga 250 mL dan disaring dengan kertas saring Whatman no. 1 dan diencerkan 5 kali sesaat sebelum digunakan.
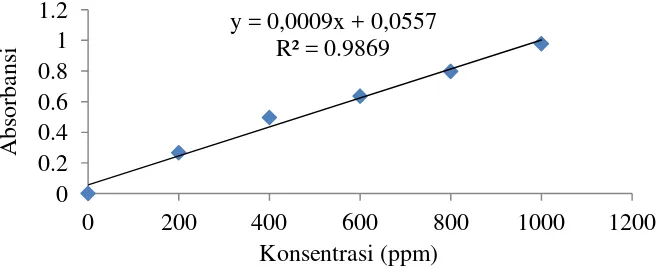
Sebanyak 2 ml sampel ditambahkan 2 ml reagen bradford. Kemudian di inkubasi pada suhu ruang selama 15 menit di tempat tertutup. Selanjutnya penghitungan absorbansi menggunakan spektrofotometer UV-Vis pada panjang gelombang 595 nm. Kurva standar protein pada konsentrasi 200-1000 ppm menggunakan standar BSA. Plot hubungan antara absorbansi sampel dengan kurva standar dan kadar protein dihitung dalam mg/ml.
2. Aktivitas Enzim kuantitatif menggunakan metode DNS (3,5 dinitro salicilic acid) (AOAC 2000 Termodifikasi)
Pereagen DNS terdiri dari larutan NaOH 2% 50 mL, DNS (3,5 dinitro salicilic acid) sebanyak 1 gram, fenol 0.2 gram, Na bisulfit sebanyak 0.05 gram , K-Na tartarat sebanyak 20 gram, kemudian distirer hingga larut. Setelah semuanya larut, tepatkan hingga 100 mL menggunakan akuades.
7 gelombang 550 nm. Pembuatan kurva standar menggunakan standar gula pereduksi D-manosa pada konsentrasi 0.1-0.9 mg/mL. Sebagai blanko digunakan blanko enzim dan blanko substrat. Blanko enzim terdiri dari 0.4 mL enzim yang telah diinkubasi, 0.1 mL substrat, dan 0.5 mL buffer. Blanko substrat terdiri dari 0.4 mL subtrat, 0.1 mL akuades, dan 0.5 mL buffer.
3. Karakterisasi Aktivitas Enzim Alginat Liase (Subaryono 2013)
Karakterisasi aktivitas enzim pada berbagai suhu akan dilakukan dengan memvariasikan suhu inkubasi. Kisaran suhu ini dipilih berdasar penelitian terdahulu bahwa suhu optimum alginat liase berada di antara suhu 30 sampai 550C. Sebanyak 0.5 mL buffer universal pH 7.5 ditambah dengan 0.1 mL larutan alginat 1% dan 0.4 mL enzim. Kemudian dicampur merata dan diinkubasi pada suhu 25, 35, 45, 55, 65, 75, 80, dan 90 0C selama 30 menit. Aktivitas enzim dihentikan dengan pemanasan pada air mendidih selama 10 menit dan aktivitas alginat liase diukur dengan pengukuran gula pereduksi dengan metode DNS.
Aktivitas alginat liase pada berbagai pH dilakukan dengan menggunakan buffer universal pH sistem antara 6-11. Sebanyak 0.5 mL bufer universal dengan pH 6, 7, 8, 9, 10, dan 11 ditambah dengan 0.1 mL larutan alginat 1% dan 0.4 mL enzim, dicampur merata dan diinkubasi pada suhu optimum selama 10 menit. Aktivitas enzim dihentikan dengan pemanasan pada air mendidih selama 10 menit, dan aktivitas alginat lyase diukur dengan pengukuran gula pereduksi dengan metode DNS.
8
Gambar 3. Diagram alir produksi dan karakterisasi enzim alginat liase ara erisasi a i i as dan
s esi i asi subs ra engguna an e ode
u u ubs ra
ji adar ro ein
engguna an e ode
rad ord
rude en i
algina liase Isola ba eri
a ll at
i ul ur ada edia uria ber ani air g l algina ja
su u
en ri uge dingin g eni
il ra en i asar
e e a an en i
9
HASIL DAN PEMBAHASAN
Pemekatan Enzim Alginat Liase dengan Pengendapan Ammonium Sulfat dan Kadar Protein Alginat Liase
Berdasarkan letaknya, enzim dikelompokkan menjadi dua, yaitu enzim intraseluler dan enzim ekstraseluler. Letak enzim tersebut sangat mempengaruhi teknik yang akan digunakan untuk mengekstraksi dan memurnikan enzim (Suhartono 1989).
Enzim kasar alginat liase diendapkan dengan menambahkan garam. Tujuan pengendapan ini adalah untuk memisahkan, sekaligus memurnikan secara parsial enzim alginat liase dari protein-protein lain yang terdapat pada ekstrak kasar enzim tersebut, sehingga akan mempunyai aktivittas yang lebih tinggi dibandingkan dengan ekstrak kasar enzim tersebut. Garam yang digunakan untuk mengendapkan enzim kasar alginat liase adalah amonium sulfat. Garam tersebut dapat menstabilkan protein dari proses denaturasi, proteolisis maupun kontaminasi bakteri ( Kumaila 2008).
Pellet yang diperoleh dari pengendapan dengan garam ammonium sulfat (NH4) 2SO4, kemudian didialisis menggunakan membran selofan berukuran 10 kDa. Kegunaan utama dialisis ialah untuk pemekatan, pembuangan garam, dan pemurnian bahan-bahan seperti protein, hormon, dan enzim. Zat tertahan ialah berisi protein dengan ukuran molekul yang lebih besar dari ukuran pori (Sanagi 2001). Prinsip dari dialisis ialah aplikasi preparasi enzim ke dalam kantong dialisis yang terbuat dari membran semi-permeabel yang memungkinkan molekul berukuran kecil untuk bermigrasi (Grogan 2009).
Kandungan protein pada ekstrak enzim merupakan gambaran kuantitas enzim yang terkandung, dan berfungsi untuk menentukan satuan aktivitas enzim. Protein terlarut ditetapkan berdasarkan kurva standar Bovin Serum Albumin (BSA) (Rahmansyah dan Sudiana 2003).
10
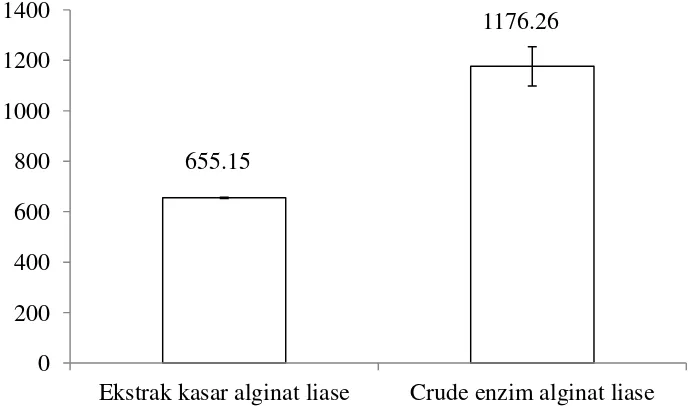
Kadar protein terlarut pada ekstrak kasar alginat sebesar 655.15 mg/mL. Sedangkan pada crude enzim alginat liase, kandungan protein terlarut sebesar 1176.26 mg/mL. Hal ini menunjukkakn bahwa kandungan kadar protein alginat liase setelah mengalami pemekatan dengan ammonium sulfat lebih tinggi daripada ekstak enzim kasar sebelum pemekatan.
Karakterisasi Enzim Alginat Liase
Karakterisasi dilakukan untuk melihat seberapa besar pengaruh kondisi lingkungan terhadap aktivitas enzim. Karakterisasi enzim menggunakan metode DNS dengan standar berupa Manosa. Sehingga diperoleh kurva standar D-Manosa yang selanjutnya digunakan dalam perhitungan aktivitas enzim.
Gambar 5. Kadar protein alginat liase 655.15
Ekstrak kasar alginat liase Crude enzim alginat liase
11 Karakterisasi juga dapat diketahui kondisi optimum lingkungan untuk mendapatkan enzim dengan aktivitas yang tinggi. Karakterisasi yang dilakukan pada enzim alginat liase berupa suhu, tingkat keasaman (pH), dan jenis substrat yang spesifik.
Suhu
Penurunan aktivitas pada suhu tinggi terjadi karena struktur molekul enzim tersebut mengalami denaturasi. Akibatnya sisi aktif enzim tidak sesuai lagi dengan substratnya. Selain itu, struktur molekul dari substrat pun dapat mengalami perubahan konformasi, sehingga mengalami hambatan untuk mencapai lokasi aktif enzim (Lehninger, 1993).
Setiap enzim memiliki kisaran suhu tertentu untuk mencapai aktivitas yang optimum. Di luar kisasan suhu tersebut enzim akan tidak aktif atau aktivitasnya akan terhambat. Hal ini terjadi karena suhu menyediakan pasokan energi termal untuk memecah beberapa interaksi intramolekul grup polar (ikatan hidrogen, atraksi dipol-dipol, interaksi inonik) serta kekuatan hidropobik diantara grup non polar di dalam struktur enzim. Enzim alginat liase pun mempunyai kisaran suhu tertentu dalam menghasilkan aktivitas yang optimum. Pengaruh suhu terhadap aktivitas enzim alginat liase digambarkan pada Gambar 7.
Berdasarkan Gambar 7 dapat dilihat bahwa peningkatan suhu menyebabkan peningkatan aktivitas enzim alginat liase sampai pada titik tertentu. Sementara peningkatan suhu lebih lanjut akan membuat aktivitas enzim menjadi menurun. Pada penelitian ini enzim alginat liase memiliki aktivitas optimum pada suhu 45 °C dengan nilai aktivitas sebesar 9.00 U/menit/mL. Suhu di bawah suhu optimum aktivitas enzimnya rendah, hal ini disebabkan oleh rendahnya energi aktivasi yang tersedia. Aktivitas enzim mencapai kondisi yang maksimum saat suhu optimum ketika energi kinetik enzim dan substrat mencapai titik untuk bereaksi secara sempurna. Sedangkan aktivitas akan cenderung semakin menurun pada suhu 55 °C.
12
Suhu yang lebih tinggi akan membuat molekul lebih sering bertabrakan. Konsep ini berlaku juga untuk tumbukan antar molekul substrat dengan enzim. Hal ini disebabkan suhu yang tinggi akan mengkatalisis reaksi enzimatis. Namun, ketika kenaikan suhu melebihi titik tertentu akan menyebabkan gangguan terhadap struktur tersier enzim. Perubahan struktur tersier pada sisi aktif akan menghambat aktivitas katalitik enzim (Stoker 2010).
Penelitian terdahulu mengenai karakteristik suhu optimum enzim alginat liase sangat bervariasi. Masing-masing mikroorganisme memiliki suhu optimum yang berbeda. Seperti yang ditunjukkan pada Tabel 2, dimana Bacillus sp ATB-1015 memiliki suhu optimum sebesar 37 °C sedangkan mikroorganisme Bacillus megaterium pada penelitian ini suhu optimum yaitu 45 °C. Hal ini telah membuktikan, bahwa setiap mikroorganisme penghasil enzim alginat liase memiliki karakter yang berbeda-beda. Sehingga karakterisasi dari suhu optimum perlu dilakukan agar aktivitas enzim alginat liase dapat optimum juga.
Tingkat Keasaman (pH)
Pengikatan antara enzim dengan substrat dan reaksi katalisisnya bergantung pada interaksi antara substrat dengan rantai samping asam amino yang menyusun sisi aktif enzim (Bender 2002). Peristiwa ini harus berada pada keadaan ionisasi yang tepat untuk mengikat, dan hal ini tergantung pada pH medium.
Semua reaksi enzim dipengaruhi oleh pH medium tempat reaksi terjadi. Setiap enzim memiliki pH optimum yang khas. Profil aktivitas pH enzim menggambarkan pH pada saat pemberi dan penerima proton yang penting pada sisi katalitik enzim berada pada tingkat ionisasi yang diinginkan. pH tertentu dapat menyebabkan enzim yang menyebabkan enzim kehilangan aktivitas biologisnya (Lehninger 1993).
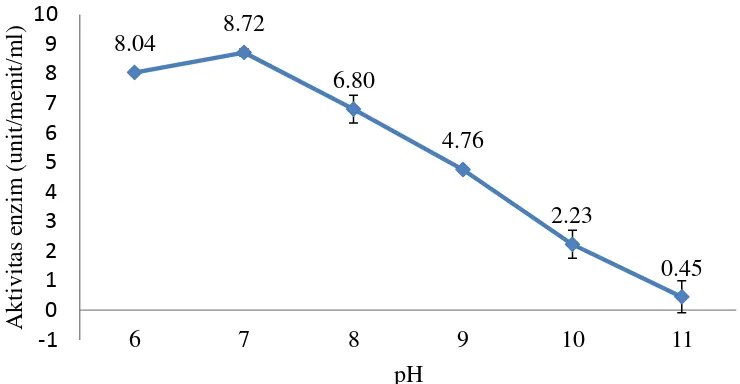
Gambar 8 menunjukkan bahwa tingkat keasamaan berpengaruh terhadap aktivitas enzim alginat liase. Enzim alginat liase digambarkan memiliki aktivitas optimal pada pH 7 sebesar 8.72 Unit/menit/mL. Jika tingkat keasaman semakin rendah nilai aktivitas enzim alginat liase semakin rendah dan akan terus menurun jika pH semakin basa. Terlihat pada Gambar 8 bahwa aktivitas enzim alginat liase mengalami penurunan secara terus menerus pada perlakuan pH 8-11. Hal ini dikarenakan enzim alginat liase terdenaturasi dan tidak efektif dalam mendegradasi substrat.
13
Jenis Substrat Spesifik
Kemampuan enzim alginat lyase dalam mendegradasi alginat dipengaruhi oleh perbedaan komposisi rasio manuronat dan guluronat yang terdapat pada alginat, mengingat spesifitas alginat liase yang berbeda-beda antara satu dengan yang lain (Kawamoto et al., 2006). Beberapa penelitian sebelumnya menunjukkan bahwa alginat dari rumput laut lokal seperti Sargassum sp. dan Turbinaria sp. memiliki proporsi poliguluronat yang lebih tinggi dibandingkan polimanuronat (MG rasio 0.72-0.94), dan berbeda dengan jenis rumput laut dari perairan sub tropis seperti Macrocystis pyrivera yang lebih kaya polimannuronat (MG rasio 1.37) (Subaryono et al., 2010).
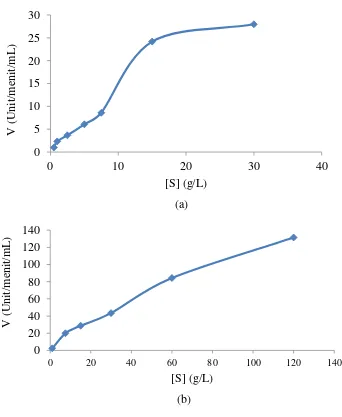
Penetuan nilai Km dan Vmaks berguna untuk menentukan kinetika enzim sehingga dapat diketahui seberapa besar ikatan enzim dan subsrat dan seberapa cepat enzim dapat melakukan aktivitas. Penetuan nilai Vm dan Km dilakukan dengan cara mengukur kecepatan awal enzim alginat liase pada berbagai konsentrasi substrat. Perhitungan Km dan Vmaks menggunakan kurva Michaelis-Menten. Kurva Michaelis- Menten menyatakan adanya hubungan kuantitatif antara konsentrasi substrat dan kecepatan reaksi enzimatik.
Gambar 9 menunjukkan bahwa kenaikan konsentrasi substrat akan diikuti dengan kenaikan kecepatan reaksi enzimatiknya, hingga tercapai suatu titik batas yang membuat kecepatan meningkat sedemikian kecil. Nilai dugaan Km dan Vmaks dapat diperoleh dengan menggunakan kurva Michaelis-Menten itu, namun sangat sulit untuk menentukan Vmaks dengan tepat. Nilai Vmaks dari kurva Michaelis-Menten tidak akan pernah diketahui nilai sebenarnya. Oleh sebab itu diperlukan cara lain untuk memperoleh nilai Km yang lebih tepat, yaitu memetakan data dengan memanfaatkan transformasi aljabar persamaan Michaelis- Menten yang disebut persamaan Lineweaver-Burk.
14
15
Berdasarkan Gambar 10 dapat diperoleh informasi mengenai nilai persamaan linear yang akan digunakan dalam menentukan nilai Km dan Vmak dari masing-masing substrat. Persamaan linear untuk substrat manuronat Y= 0.3991 x + 0.0052 dan R2= 0.9991. Sedangakan persamaan linear untuk jenis substrat guluronat Y= 0.4746 x + 0.0366 dan R2= 0.9835. Dari persamaan linear tersebut dapat diperoleh nilai Km dan Vmak yang dapat dilihat pada tabel 3.
16
Substrat manuronat memiliki nilai Km dan Vmak sebesar 79.8 mg/mL dan 200 Unit/menit/mL. Sedangkan substrat guluronat memiliki nilai Km dan Vmak sebesar 13.17 mg/mL dan 27.78 Unit/menit/mL. Nilai Km dan Vmak yang diperoleh menunjukkan bahwa, reaksi enzim alginat liase dari isolat bakteri Bacillus megaterium pada penelitian ini spesifik terhadap kedua substrat tersebut, yaitu manuronat dan guluronat. Menurut penelitian Cao et al (2007), enzim alginat liase dari Streptomyces stain A5 yang diisolat dari buah pisang spesifik terhadap substrat manuronat dengan nilai Km dan Vmak yaitu 0.13 mg/mL dan 1.17 Unit/mL/menit. Hal ini menunjukkan bahwa, enzim alginat liase dari bakteri
Streptomyces stain A5 lebih efektif dari pada enzim alginat liase dari Bacillus
megaterium. Menurut Bregeut et al ( 2007), enzim alginat liase dari
Flavobacterium sp spesifik terhadap substrat guluronat dengan nilai Km dan Vmak sebesar 54.4 mg/mL dan 48.1 Unit/menit/mL. Untuk jenis substrat guluronat, enzim alginat liase yang berasal dari Bacillus megaterium lebih efektif daripada enzim alginat liase dari Flavobacterium sp. Hal ini sebabkan oleh nilai Km rendah, dimana semakin rendah nilai Km maka semakin bagus aktivitas enzim tersebut karena jumlah konsentrasi yang rendah dapat menaikkan laju reaksi sebesar setengah Vmak. Hubungan nilai Vmak dengan aktivitas enzim adalah berbanding lurus, jika nilai Vmak yang tinggi maka laju reaksi dari aktivitas enzim juga tinggi.
Sumber Jenis substrat Km
(mg/mL)
Vmak (Unit/menit/mL)
Penelitian Manuronat 79.8 200
Guluronat 13.17 27.78
Cao et al 2007 Manuronat 0.13 1.17
Bregeut et al 2007 Guluronat 54.4 48.1
17
SIMPULAN DAN SARAN
Simpulan
Pemekatan menggunakan ammonium sulfat dapat meningkatkan kadar protein terlarut enzim alginat liase (655.15 mg/mL menjadi 1176.26 mg/mL). Enzim alginat liase mempunyai aktivitas optimum pada tingkat keasaman (pH) netral yaitu 7 dengan aktivitas enzim sebesar 8.72 U/menit/mL dan suhu optimum 45 ⁰C dengan aktivitas enzim sebesar 9.00 U/menit/mL . Reaksi enzimatis alginat liase dengan substrat manuronat memiliki nilai Km dan Vmak sebesar 79.8 mg/mL dan 200 Unit/menit/mL. Sedangkan reaksi enzimatis alginat liase dengan substrat guluronat memiliki nilai Km dan Vmak sebesar 13.17 mg/mL dan 27.78 Unit/menit/mL. Dengan demikian enzim alginat liase dari isolat bakteri Bacillus megaterium spesifik terhadap dua substrat tersebut, yaitu spesifik terhadap manuronat dan guluronat.
Saran
Perlu dikaji ulang mengenai perbedaan aktivitas enzim alginat liase setelah dan sesudah pemekatan dengan garam ammonium sulfat. Selain itu juga perlu dikaji ulang mengenai lama penyimpanan enzim yang akan berpengaruh terhadap nilai aktivitas enzim alginat liase.
DAFTAR PUSTAKA
Abdurahman D. 2008. Biologi Kelompok Pertanian. Jakarta: Grafindo Media Pratama.
AOAC. 2000. Official Methods of Analysis of AOAC International 7th Edition. AOAC International. Geitherburgh. MD. USA.
Aslan LM. 1999. Budidaya Rumput Laut. Yogyakarta : Penerbit Kanisius.
Atmadja WS. 1996. Pengenalan Jenis Algae Coklat (Phaeophyta). Di dalam Pengenalan Jenis-jenis Rumput Laut Indonesia. Jakarta : Puslitbang Oseanologi-LIPI.
Bender DA. 2002. Introduction to Nutrition and Metabolism. Vol. 1. New York: Taylor & Francis Inc.
Bradford MM. 1976. A Rapid and Sensitive Method for Quantification of Microgram Quantities of Protein Utilizing The Principle of Protein Dye Binding.Anal Biochem 72:234-254.
Breguet V, Stockar U, and Marison. 2007. Characterization of Alginate Lyase Activity on Liquid, Gelled, and Complexed States of Alginar. Bioctechnol. Prog.23: 1223-1230.
18
Draget, K. I., O. Smidsrøt, G. Skjåk-Braek. 2005. Alginat from algae In Polysaccharides and Polyamides in The Food Industry. Edited by A. einbű el and . . R ee. Wiley-VCH Verlag GmbH & co. KgaA.
Grogan G. 2009. Practical Biotransformation. Postgraduates Chemistry Series. Chichester: John Willey & Sons Ltd.
Handayani T, Sutarno, dan Dwi A. 2004. Analisis Komposisi Nutrisi Rumputlaut Sargassum crassifolium J. Agardh. Biofarmasi,2(2). pp. 45-52.
Kawamoto H, Horibe A, Miki Y, Kimamura T, Nakagawa T, Kawamukai M, and Matsumada H. 2006. Cloning and Sequencing Analysis of Alginate Lyase Genes from The Marine Bacterium Vibrio sp. 02. Marine Biotechnology (8): 481-490.
Kementrian Perdagangan. 2013. Rumput Laut Indonesia. Jakarta: Warta Ekspor. Kim H, Lee C, and Yeol E. 2011. Alginate Lyase: Structure, Property, and
Application. Biotechnology and Bioprocess Enggineering 16: 843-851.
Kumaila R. 2008. Ekstraksi, Karakterisasi, dan Aplikasi Enzim Kolagenase dari Organ Dalam Ikan Tuna [Skripsi]. Bogor: Fakultas Perikanan dan Ilmu Kelautan, IPB.
Lehninger AL. 1993. Dasar-Dasar Biokimia Ed. Ke-3. Terjemahan. Maggy Thenawidjaja. Jakarta: Erlangga.
Poedjiadi A dan Supriyanti T. 2005. Dasa-dasar Biokimia. Bandung: UI Press. Putri K. 2011. Pemanfaatan Rumput Laut Coklat (Sargassum sp) Sebagai Serbuk
Minuman Pelangsing Tubuh [Skripsi]. Bogor: Fakultas Perikanan dan Ilmu Kelautan, IPB.
Rahmansyah M, Sudiana I. 2003. Optimasi Analisis Amilase dan Glukonase yang Diekstrak dari Miselium Pleurotus Ostreatus dengan Asam 3,5 Dinitrosalisilat. Berk.Penel.Hayati(9): 7-12.
Sanagi MS. 2001. Teknik Pemisahan dalam Analisis Kimia. Melaka: Percetakan Surya.
Shinya H. 2008. The Miracle of Enzyme. Bandung: Mizan Utama.
Stoker HS. 2010. General, Organic, and Biological chemistry. USA: Cengage Learning.
Subaryono. 2013. Produksi Alginate Oligosaccharides (AOS) dari Rumput Laut Coklat Lokal Sargassum sp. dan Aktivitas Biologisnya sebagai Senyawa Imunomodulator [Disertasi]. Bogor: Fakultas ilmu dan Teknologi Pangan, IPB. Subaryono, 2010. Potensi dan Peluang Pemanfaatan Rumput Laut Coklat di
Indonesia. Squalen Buletin Pascapanen dan Bioteknologi Kelautan dan Perikanan 6: 55-62.
Suhartono MT. 1989. Enzim dan Bioteknologi. Bogor: Dirjen Dikti, PAU, Bioteknologi, IPB.
Trenggono dan Sutardi. 1990. Biokimia dan Teknologi Pasca Panen. PAU Pengadaan Gizi. Yogjakarta: UGM Press.
Winarno FG. 1986. Enzim Pangan. Jakarta: PT. Gramedia Pustaka Utama.
Wong, T. Y., Preston, L. A., and Shiller, N.L., 2000. Alginate Lyase: Review of Major Sources and Enzyme Characteristics, Structure-Function Analysis, Biological Roles, and Applications. Annual Review of Microbiology. 54: 289-340.
19
LAMPIRAN
LAMPIRAN
Lampiran 1. Nilai absorbansi kurva standar BSA (Bovin Serum Albumin)
konsentrasi (ppm) Absorbansi
0 0
200 0,266
400 0,496
600 0,635
800 0,797
1000 0,978
Lampiran 2. Data kadar protein alginat liase
Perlakuan Ulangan Absorbansi Kadar Protein (mg/mL)
Rata-rata Std Sebelum
pemekatan 1 0,647 657
655,15 2,31
2 0,646 655,89
3 0,643 652,56
Setelah
pemekatan 1 1,074 1131,44
1176,26 77,62
2 1,195 1265,89
3 1,074 1131,44
Lampiran 3. Data absorbansi kurva standar D-Manosa
Konsentrasi (ppm) Abs
0,1 0,117
0,3 0,467
0,5 0,828
0,7 1,203
20
Perlakuan
suhu (⁰C) Ulangan
Aktivitas Enzim
(Unit/mL/menit) Rata-rata Std
25
21
pH Ulangan Aktivitas Enzim
(Unit/mL/menit) Rata-rata Std
6
1 8,1
8,04 0,07
2 7,96
3 8,06
7
1 8,58
8,72 0,12
2 8,76
3 8,81
8
1 6,27
6,8 0,47
2 7,16
3 6,97
9
1 4,71
4,76 0,08
2 4,71
3 4,85
10
1 1,98
2,23 0,48
2 2,78
3 1,93
11
1 0,14
0,45 0,54
2 1,08
3 0,14
22
Lampiran 6. Data nilai aktivitas enzim alginat liase berdasarkan substrat guluronat
Konsentrasi
(g/L) [S] Ulangan
Aktivitas enzim (Unit/mL/menit)
[V]
Rata-rata Std 1/[S] 1/[V]
0.5 1 1,03
0,99 0,05 2,00 1,01
2 0,99
3 0,94
1 1 2,45
2,35 0,09 1,00 0,10
2 2,35
3 2,26
2.5 1 3,77
3,69 0,07 0,40 0,27
2 3,67
3 3,63
5 1 5,98
6,05 0,07 0,20 0,16
2 6,12
3 6,03
7.5 1 8,58
8,59 0,03 0,13 0,12
2 8,58
3 8,62
15 1 24,41
24,24 0,15 0,07 0,04
2 24,13
3 24,18
30 1 27,95
27,96 0,07 0,03 0,04
2 28,04
23
Konsentrasi
(g/L) [S] Ulangan
Aktivitas enzim (Unit/mL/menit)
[V]
Rata-rata Std 1/[S] 1/[V]
1 1 2,45
2,46 0,03 1,00 0,41
2 2,49
3 2,45
7,5 1 20,03
20,00 0,05 0,13 0,05
2 20,03
3 19,93
15 1 28,84
28,78 0,05 0,07 0,03
2 28,75
3 28,75
30 1 43,31
43,41 0,09 0,03 0,02
2 43,41
3 43,50
60 1 84,37
84,32 0,12 0,02 0,01
2 84,18
3 84,41
120 1 131,41
131,44 0,05 0,01 0,01
2 131,50
3 131,41
24