KAJIAN VIRUS AVIAN INFLUENZA PADA
ANAK BURUNG PUYUH (Coturnix coturnix japonica)
NUR ISTI KHOMAH
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Kajian Virus Avian Influenza pada Anak Burung Puyuh (Coturnix coturnix japonica) adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
RINGKASAN
NUR ISTI KHOMAH. Kajian Virus Avian Influenza pada Anak Burung Puyuh (Coturnix coturnix japonica). Dibimbing oleh TRIOSO PURNAWARMAN dan RETNO D. SOEJOEDONO
Avian Influenza (AI) merupakan masalah penyakit yang paling utama, tidak hanya untuk unggas tapi juga untuk spesies burung lain, mamalia dan manusia. Pemerintah Indonesia bertanggungjawab melakukan pencegahan terhadap penyebaran penyakit AI dengan melakukan pengawasan lalulintas unggas dan hewan pembawa AI lainnya dari satu daerah ke daerah lain. Burung puyuh Jepang (Japanese quail/Coturnix coturnix Japonica) berpotensi menjadi inang perantara dan reservoir dari virus AI. Tujuan dari penelitian ini adalah untuk mendeteksi kasus AI pada anak burung puyuh umur sehari dan anak burung puyuh yang ditransportasikan melalui bandar udara Adi Soetjipto.
Tiga puluh sampel usap trakea dari anak burung puyuh umur sehari dan anak burung puyuh berasal dari Klaten, Solo, Boyolali dan Yogyakarta yang dikoleksi dari Laboratorium Karantina Hewan di Yogyakarta. Jumlah besaran sampel tersebut dihitung berdasarkan rumus mendeteksi penyakit. Sampel-sampel tersebut dikumpulkan menjadi enam sesuai dengan asal daerah sampel. Metode pengujian yang digunakan dalam penelitian ini adalah real time reverse transcriptase polymerase chain reaction (rRT-PCR). Primer yang digunakan adalah Primer H5-Duplex Primer Probe Mix yang terdiri dari primer forward H5 IVA-D148H5, primer reverse H5 IVA-D149H5, probe H5-IVA-H5a dan primer
forward H5-IVA-D204f, primer forward H5-IVA-D205r dan probe H5-IVA-D215P.
Hasil dari pengujian rRT-PCR sampel usap trakea menunjukkan bahwa anak burung puyuh umur sehari dan anak burung puyuh tidak terdeteksi virus AI. Hal ini dapat disimpulkan bahwa pengujian rRT-PCR dapat disarankan untuk mendeteksi agen virus AI pada burung puyuh yang akan dilalulintaskan antar area.
SUMMARY
NUR ISTI KHOMAH. Study of Avian Influenza Virus in Quail (Coturnix coturnix japonica). Supervised by TRIOSO PURNAWARMAN and RETNO D. SOEJOEDONO
Avian Influenza is a major disease problem, not only for poultry but also for other avian species, mammals and human beings. Indonesian Government has been taking reasonable precautions against the spread of the disease by monitoring the traffic of poultry and other avian influenza (AI) hosts from one region to another. Japanese quail (Coturnix cortunix japonica) is a potential intermediate host and reservoir of avian influenza virus. The aim of this study was to detect cases of AI in one day old quails (DOQ) and quails transported via Adi Soetjipto Airport.
Thirty tracheal swabs of DOQ and quail originating from Klaten, Solo, Boyolali, and Yogyakarta were taken from animal quarantine laboratory in Yogyakarta shortly before the birds being sent to other areas. The sample size was calculated based on formula of disease detection. Samples were pooled into six based on the region of origin. The examination of samples was conduted using real time reverse transcriptase polymerase chain reaction (rRT-PCR). This test
uses Primer H5-Duplex Primer Probe Mix consisting of primer forward H5 IVA-D148H5, primer reverse H5 IVA-D149H5, probe H5-IVA-H5a and
primer forward H5-IVA-D204f, primer forward H5-IVA-D205r and probe H5-IVA-D215P.
The results of rRT-PCR test from tracheal swab samples showed that DOQs and quails were not detected towards avian influenza virus. It was concluded that rRT-PCR test should be conducted to determine whether there is an agent of avian influenza virus on existing traffic between quails.
© Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Kesehatan Masyarakat Veteriner
KAJIAN VIRUS AVIAN INFLUENZA PADA
ANAK BURUNG PUYUH (Coturnix coturnix japonica)
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2015
Judul Tesis : Kajian Virus Avian Influenza Pada Anak Burung Puyuh (Coturnix coturnix japonica)
Nama : Nur Isti Khomah NIM : B251130254
Disetujui oleh Komisi Pembimbing
Dr Drh Trioso Purnawarman, MSi Ketua
Prof Dr Drh Retno D Soejoedono, MS Anggota
Diketahui oleh
Ketua Program Studi
Kesehatan Masyarakat Veteriner
Dr med vet Drh Denny Widaya Lukman, MSi
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MSc Agr
Tanggal Ujian: (6 Februari 2015)
Tanggal Lulus:
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga penulis dapat menyelesaikan tesis. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Agustus 2014 ini ialah avian influenza, dengan judul Kajian Virus Avian Influenza pada Anak Burung Puyuh (Coturnix coturnix japonica).
Penghargaan tertinggi dan ungkapan terima kasih penulis disampaikan kepada Bapak Dr Drh Trioso Purnawarman, MSi dan Prof Dr Drh Retno D Soejoedono, MS selaku pembimbing yang banyak meluangkan waktu untuk membimbing, mengarahkan dan mendorong penulis sejak awal usulan penelitian hingga selesainya tesis ini serta Bapak Dr med vet Drh Denny W Lukman, MSi selaku Ketua Program Studi Kesehatan Masyarakat Veteriner yang telah banyak memberi saran dan motivasi kepada penulis untuk menyelesaikan tesis ini juga Prof. Dr. Drh. I Wayan Teguh Wibawan, MS selaku dosen penguji.
Ucapan terima kasih kepada Badan Karantina Pertanian, Kementerian Pertanian selaku pemberi dana beasiswa, Balai Karantina Pertanian Kelas II Yogyakarta atas dukungannya kepada penuli beserta Balai Besar Veteriner Wates Yogyakarta yang telah membantu pelaksanaan penelitian ini. Terima kasih juga saya persembahkan kepada Ibunda Choryatun atas dukungan moral dan material dalam pelaksanaan penelitian ini dan teman – teman kelas KMV 13 (Anin, Imelda, Winda, Saimah, Novi, Yasmin, Intarti, Ambar, Doni, Adit, Kamil, Syahdu, Leo, Susanto, Rifki, Sumitro, Heru, Hanif, Zulfikhar) atas dukungan dan kerjasamanya selama perkuliahan dan penelitian ini.
Semoga karya ilmiah ini bermanfaat.
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
1 PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 3
Manfaat Penelitian 3
2 TINJAUAN PUSTAKA
Burung Puyuh 4
Virus Avian Influenza 4
Karakteristik Virus Avian Influenza 4
Penularan dan Transmisi Virus Avian Influenza 5
Patogenesitas Virus Avian Influenza 6
Diagnosa Laboratorium Virus Avian Influenza 7
Kejadian Avian Influenza pada Puyuh 7
Penanggulangan Avian Influenza 8
3 METODE 9
Waktu dan Penelitian 9
Bahan dan Alat 9
Metode Pengambilan Sampel 9
Metode rRT-PCR (Real Time Reverse Transcription- 10 Polymerase Chain Reaction)
Analisis Data 13
4 HASIL DAN PEMBAHASAN 14
Pengujian rRT-PCR 14
Pemeriksaan Fisik Burung Puyuh 16
5 SIMPULAN DAN SARAN 22
DAFTAR PUSTAKA 23
DAFTAR TABEL
1 Data sampel anak burung puyuh yang diambil di Laboratorium
Karantina Hewan BKP Kelas II Yogyakarta 10 2 Preparasi untuk membuat viral lysis/binding solution 11
3 Preparasi wash solution mix 11
4 Preparasi untuk membuat bead resuspension mix 11
5 Komponen-komponen reaksi rRT-PCR 12
6 Hasil rRT-PCR 14
DAFTAR GAMBAR
1 Anatomi virus Influenza A 5
2 Grafik hasil pengujian rRT-PCR 14
3 DOQ (day old quail) yang sehat 17
4 K
emasan untuk pengiriman anak burung puyuh melalui BKP Kelas
1 PENDAHULUAN
Latar Belakang
Avian influenza (AI) adalah penyakit viral pada unggas peliharaan, termasuk ayam dan unggas liar yang disebabkan oleh virus influenza tipe A. Penyakit ini dikenal dengan nama flu burung, fowl pest, fowl plaque atau avian flu
(“flu avian”) (Fouchier et al. 2005) dan dapat menimbulkan penyakit dengan derajat keparahan bervariasi, mulai dari infeksi yang bersifat asimtomatik sampai yang fatal dan bersifat multisistemik (Swayne 2005). Hospes alami dan reservoir virus AI adalah unggas air liar. Jenis unggas tersebut biasanya menunjukkan infeksi pencernaan asimptomatik, tetapi dapat membebaskan virus AI dalam jumlah yang besar melalui feses. Virus AI yang ganas tidak ditemukan dalam unggas liar, tetapi sumber infeksi virus tersebut dapat ditemukan pada burung peliharaan (Tabbu et al. 2006).
Kejadian AI telah menjadi perhatian utama dunia, terutama sejak merebaknya kasus AI H5N1 yang telah menewaskan enam orang penduduk Hongkong dari 18 yang terinfeksi pada tahun 1997 (Harimoto & Kawaoka 2001). Kejadian tersebut bersifat epizootik dan meluas hingga ke seluruh Asia Tenggara dan telah terjadi penularan antarspesies hingga mencapai status traversed interclass barriers, yaitu kemampuan transmisi penularan virus AI H5N1 (manusia, babi dan kucing) (Perkins & Swayne 2002).
Kejadian AI H5N1 (lebih dikenal dengan sebutan flu burung), di Indonesia telah banyak menimbulkan kerugian yang meluas baik dari sektor ekonomi, kesehatan masyarakat, dan ketahanan pangan (Widiasih et al. 2012). Wabah AI di Indonesia pertama kali terjadi pada bulan Agustus 2003 di Kabupaten Pekalongan dan Tanggerang. Wabah ini menyerang ayam ras petelur dan pedaging, burung puyuh, ayam kampung dan itik. Angka kesakitan (morbiditas) dan angka kematian (mortalitas) kasus ini sangat tinggi yaitu mencapai 90%. Penyebaran terjadi dengan sangat cepat terutama melalui perdagangan dan lalulintas unggas (Dharmayanti 2006). Kejadian tersebut meluas ke seluruh pulau Jawa, Bali, dan beberapa daerah di Sumatera serta Kalimantan. Pada tahun 2004 jumlah kematian unggas terus meningkat dan menyebar ke-16 provinsi yang mencakup 100 kabupaten/kota. Mulai bulan Agustus 2003 hingga November 2005 kematian unggas cenderung mengalami penurunan meski wilayah yang terjangkit cenderung meluas. Menteri Pertanian secara resmi pada bulan Januari 2004 mengumumkan bahwa virus AI subtipe H5N1 telah masuk di Indonesia, dan sampai saat ini virus tersebut dinyatakan endemik di 31 dari Provinsi di Indonesia (Setyawati 2010).
2
hari atau day old duck (DOD), telur dan pakan ternak dari daerah tertular ke daerah bebas dapat diizinkan dengan persyaratan tertentu. Peraturan ini digunakan sebagai tolok ukur untuk lalu lintas anak burung puyuh umur sehari atau day old quail (DOQ) maupun anak burung puyuh umur lebih dari satu hari (Deptan 2005). Menurut Darminto (2006) peraturan tersebut dibuat dengan pertimbangan untuk memenuhi kebutuhan konsumen di daerah yang masih bebas AI tetapi tidak memiliki peternakan komersial karena sentra industri peternakan unggas sebagian besar terletak di Pulau Jawa yang merupakan daerah tertular. Sampai saat ini belum diketahui dengan pasti penyebab wabah penyakit AI cepat sekali menyebar ke seluruh wilayah Indonesia walaupun pemerintah Indonesia telah mengupayakan pencegahan dan pengendaliannya. Kondisi ini sangat memprihatinkan karena timbul berbagai dugaan tentang penyebaran virus AI yang mengakibatkan masyarakat takut berdekatan dengan unggas dan mengonsumi produk unggas. Para ahli biodiversiti menyimpulkan bahwa perdagangan global burung sebagai hewan kesayangan berperan dalam perpindahan virus secara besar-besaran. Jalur penularan AI antara lain melalui migrasi burung liar, perdagangan unggas peliharaan dan unggas liar (Mujiatun 2009).
Wibawan (2012) menyatakan bahwa infeksi virus AI saat ini berbentuk subklinis, yaitu hewan terlihat sehat tetapi sebenarnya sakit. Adanya kasus penyakit yang tidak terdeteksi dengan tepat akan menyebabkan meluasnya kasus AI dilapangan. Tinginya tingkat infeksi virus AI juga memungkinkan virus ini bertahan dan memunculkan strain virus yang lebih patogen melalui proses mutasi dan/atau genetic reassortment. Genetic diversity (keanekaragaman genetik) virus AI pada reservoir hewan liar kemungkinan juga berperan penting dalam proses keberlangsungan hidup virus AI di alam.
Puyuh merupakan reservoir virus influenza yang potensial dapat melakukan mutasi yang transmissible menular ke mamalia (Sun et al. 2011). Burung puyuh mampu bertindak sebagai sumber penularan bagi unggas lain karena didalam tubuh burung puyuh semua subtipe virus AI asal unggas air dapat bereplikasi dan berperan dalam penyebaran unggas lain (Wijanarko 2011) sehingga lalu lintas puyuh harus diawasi. Penelitian mengenai puyuh sangatlah sedikit. Peraturan mengenai petunjuk teknis lalu lintas terhadap DOQ maupun puyuh juga belum ada, oleh karena itu peneliti melakukan penelitian ini. Perkembangan jaman terakhir, pemeliharaan ternak burung puyuh ini sudah menyebar keseluruh wilayah Indonesia yang semula terpusat di Jawa Tengah dan Daerah Istimewa Yogyakarta. Penyebaran populasi burung puyuh ini melalui bandara mengharuskan adanya tindakan karantina untuk mencegah penyebaran virus.
Perumusan Masalah
3 penyetor komoditas ini ke daerah-daerah yang membutuhkan seperti Pulau Sulawesi dan Pulau Sumatera.
Anak burung puyuh sebagai salah satu hewan pembawa AI untuk itu perlu pengawasan yang ketat sebelum dilalulintaskan. Pengambilan sampel dilakukan sebelum komoditas dilalulintaskan. Penentuan jumlah sampel disesuaikan dengan jumlah yang akan dilalulintaskan dan diambil sampel usap trakea maupun kloaka dari anak burung puyuh tersebut.
Pengujian sampel usap trakea (oropharingeal) maupun sampel usap kloaka yang berada dalam viral transport media dengan metode pengujian reverse transcriptase polymerase chain reaction (rRT-PCR)
Tujuan Penelitian
Penelitian ini bertujuan untuk mendeteksi keberadaan agen virus AI pada anak burung puyuh dan DOQ yang dilalulintaskan melalui BKP Kelas II Yogyakarta menggunakan metode rRT-PCR.
Manfaat Penelitian
4
2 TINJAUAN PUSTAKA
Burung Puyuh
Puyuh (Coturnix coturnix japonica.) merupakan salah satu sumber diversifikasi produk daging dan telur. Dengan ukuran tubuh yang kecil, puyuh memiliki keunikan, yaitu pertumbuhan yang cepat, dewasa kelamin lebih awal, produksi telur yang relatif tinggi, interval generasi dalam waktu singkat, dan periode inkubasi relatif cepat (Siregar 2008). Susilorini (2007) menyampaikan, beberapa tahun terakhir puyuh juga dimanfaatkan sebagai hewan coba dalam berbagai penelitian karena tahan terhadap stress, tahan pada berbagai penyakit, dan memiliki daya kesembuhan relatif tinggi.
Anak burung puyuh yang berumur satu hari disebut DOQ. Besarnya seukuran jari dengan berat 8-10 gram dan berbulu jarum halus. Anak burung puyuh yang sehat berbulu kuning mengembang, gerakannya lincah, besarnya seragam dan aktif mencari makan atau minum (Sugiharto 2005).
Virus Avian influenza
Virus avian influenza (AI) adalah virus RNA yang termasuk ke dalam anggota dari famili Orthomixoviridae dan masuk dalam genus influenza virus tipe A. Virus ini memiliki tiga genus yaitu virus Influenza A, B dan C. Perbedaan tersebut berdasarkan perbedaan karakter nukleoprotein (NP) dan matriks antigenik protein (M) (Harder & Werner 2006).
Berdasarkan analisis filogenetik, virus influenza tipe A dan tipe B mempunyai hubungan lebih dekat dibandingkan dengan virus tipe C (Suzuki & Nei 2002). Influenza tipe B dan tipe C dapat menyerang manusia, tetapi bersifat kurang patogen dan tidak menyebabkan wabah pandemik (Horimoto & Kawaoka 2001). Virus Influenza A memiliki 16 antigen hemaglutinin (H1-H16) dan sembilan antigen neuraminidase (N1-N9) pada pembungkus luar virus (amplop) dan jika dikombinasikan akan membentuk 144 subtipe. Virus Influenza merupakan virus RNA untai tunggal segmen negatif (Fourchier et al. 2005; OIE 2005; WHO 2002).
Karakteristik Virus Avian Influenza
5
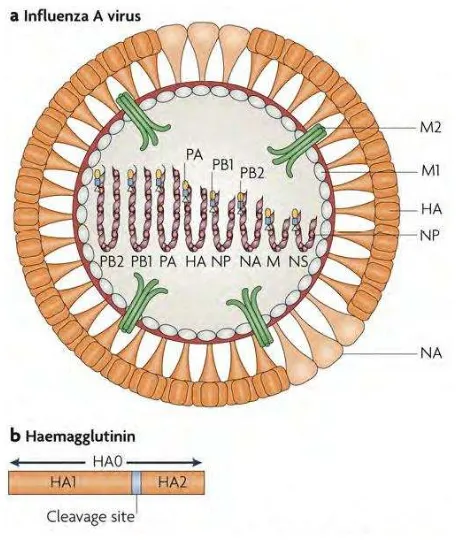
Gambar 1 Anatomi Virus Influenza A (Subbarao & Joseph 2007)
Membran glikoprotein HA berfungsi sebagai binding receptor pada sialyloligosaccharide dan fusi membran glikoprotein pada pintu masuk sel, sedangkan membran glikoprotein NA berfungsi sebagai enzim penghancur reseptor pada pelepasan virus. Antibodi melawan HA sangat penting dalam proses netralisasi virus dan perlindungan terhadap infeksi virus, aktivitas enzim neuraminidase bertanggung jawab pada pelepasan virus baru dari sel melalui aktivitasnya pada reseptor asam neuraminik. Antibodi terhadap NA juga sangat penting dalam perlindungan, terutama dengan mencegah penyebaran virus dari sel yang terinfeksi (Mujiatun 2009).
Genom dari virus ini berbentuk untai tunggal, bersegmen, masing-masing segmennya ada dalam nucleocapsid yang terpisah. Segmen virus ada delapan buah segmen berupa negative-sense single-stranded RNA, yang memungkinkan untuk terjadinya genetic reassortment pada suatu sel yang mengalami infeksi campuran oleh lebih dari satu virus dan akan menghasilkan sejumlah strain baru yang berbeda dari strain asalnya. Amplop glikoprotein dari virus influenza A, HA
dan NA tersebar di permukaan virion membentuk struktur khas “spike-shaped”. Variasi antigenik pada glikoprotein tersebut dipakai untuk menentukan subtipe virus influenza A (Setyawati 2010).
Penularan dan Transmisi Virus Avian Influenza
6
unggas suhu 4 oC virus dapat bertahan sampai 35 hari, namun pada suhu kamar (26 oC) hanya selama enam hari ( James 2000; Yuwono 2008).
Penularan virus AI terjadi secara horizontal. Penyebaran virus melalui feses dilakukan oleh unggas air dan unggas liar yang bermigrasi. Penularan dapat terjadi melalui unggas yang tertular serta peralatan yang tercemar. Adanya reservoir unggas liar menyebabkan kemungkinan penyebaran virus menjadi sangat efektif. Infeksi penyakit dapat terjadi melalui kontak langsung dan tidak langsung. Kotak langsung dapat terjadi antara unggas yang terinfeksi dan unggas sehat yang peka. Penularan melalui materi organik berupa feses dan sekresi saluran pernafasan (leleran hidung) serta air liur dari unggas yang terinfeksi. Kontak tidak langsung dapat terjadi karena penularan vektor mekanik dan biologis, seperti melalui droplet (aerosol) udara yang tercemar oleh material/debu, makanan/minuman, alat/perlengkapan peternakan. Kandang, pakaian, kendaraan, peti telur, egg tray, burung, mamalia dan insekta yang mengandung atau tercemar virus AI (Tabbu 2000; Harder et al. 2006).
Beberapa faktor yang berperan dalam transmisi virus AI antara lain buruknya biosekuriti pada sistem peternakan, keluar masuknya unggas dan produknya, perdagangan hewan hidup di pasar. Air di kolam atau genangan air memungkinkan virus bertahan di luar induk semang, sehingga dapat menjadi sumber penyebaran virus. Migrasi unggas liar pembawa virus low-pathogenic Avian Influenza (LPAI) maupun highly pathogenic Avian Influenza (HPAI) berperan dalam penyebaran virus ini (Goutard et al. 2007).
Virus AI berpotensi untuk menular ke manusia, walaupun secara alami virus AI tidak dapat menular secara langsung dari unggas ke manusia oleh karena reseptor virus AI pada unggas berbeda dengan reseptor virus influenza pada manusia. Reseptor virus AI pada unggas adalah asam sialat (SA) α 2,3 galaktosa, sedangkan reseptor virus influenza pada manusia adalah SA α 2,6 galaktosa (Tabbu 2006).
Patogenesitas Virus Avian Influenza
Patogenitas virus AI pada unggas sangat bervariasi dan tidak bisa diramalkan berdasarkan hospesnya atau serotipe antigenik dari virus tertentu (Alexander & Brown 2009). Virus AI sebagai patogen intraseluler memiliki mekanisme untuk menghindari respon imun hospes sehingga virus dapat bertahan hidup dan bereplikasi dalam tubuh hospes. Peningkatan kemampuan virus untuk menghindari sistem imun hospes secara langsung berkorelasi dengan peningkatan patogenisitas virus. Virus AI ini mempunyai berbagai mekanisme untuk menghindar dari respon imun bawaan dan respon imun dapatan hospes (Coleman 2007). Kebanyakan AI tidak virulen atau patogenitas rendah mempunyai daerah pemotongan satu asam amino basa, namun strain patogenitas tinggi mempunyai daerah pemotongan lebih dari satu asam amino (Munch et al. 2001).
7 Pada ayam dan puyuh, antigen nukleoprotein virus dideteksi dalam jumlah paling besar pada organ jantung 88% (ayam) dan 89% (puyuh), saluran nafas, pencernaan dan saluran urinasi. Pada itik virus hanya ditemukan pada organ respirasi sehingga memberikan dukungan terhadap hipotesis bahwa jalur transmisi virus HPAI dari spesies ini melalui aerosol dan oral (Mujiatun 2009).
Menurut OIE (2005) VAI dibagi menjadi dua bentuk yaitu highly pathogenic avian influenza (HPAI) dan low pathogenic avian influenza (LPAI). Virus AI yang sangat virulen disebut HPAI, infeksinya bersifat sistemik, dengan mortalitas pada flok pada beberapa spesies rentan dapat mencapai 100% (Capua & Maragon 2007). Terminologi highly pathogenic avian influenza dan fowl plague merupakan infeksi dari strain virulen influenza A yang diisolasi dari unggas domestik. Isolat highly pathogenic Avian Influenza diklasifikasikan ke dalam notifiable Avian Influenza (NAI).
Isolat strain virulen pada saat ini berasal dari subtipe H5 atau H7, namun sebagian besar H5 dan H7 memiliki virulensi rendah. Penyebab perubahan virulensi pada H5 dan H7 dapat terjadi akibat mutasi pada induk semang unggas, sehingga semua subtipe H5 dan H7 diklasifikasikan sebagai NAI virus (OIE 2005). Subtipe H5 dan H7 memiliki kemampuan menginfeksi unggas, namun tidak semua tipe H5 dan H7 ini menyebabkan kasus HPAI. Subtipe H5 dan H7 yang memiliki intra vena pathogenecity index (IVPI) ≥ 1.2 adalah kelompok virus HPAI, sedangkan subtipe H5 dan H7 serta subtipe yang lainnya yang memiliki IVPI < 1.2 adalah kelompok virus LPAI (Wijanarko 2011)
Diagnosa Laboratorium Virus Avian Influenza
Diagnosa laboratorium terhadap virus AI yang paling utama adalah identifikasi agen penyebab. Sampel berasal dari hewan hidup maupun mati. Sampel asal unggas mati dapat berupa organ pencernaan, trakea, paru-paru dan jantung. Sampel dari hewan hidup dapat berupa satu gram feses, usapan trakea dan usapan kloaka. Sampel dimasukkan ke dalam media transport pH 7.0-7.4, ditambahkan antibiotik. Sampel tersebut dapat diisolasi virusnya dengan menyuntikkan pada telur ayam berembrio spesifik pathogen free (TAB-SPF) atau spesifik antibody negative (SAN) umur 9-11 hari selama 4-7 hari (OIE 2005).
Diagnosis awal pengujian (presumptive diagnosis) AI adalah melalui pengamatan gejala klinis dan perubahan patologi, rapid test kit (antigen capture test) dan uji serologis AI, sedangkan sebagai diagnosis akhir (definitive diagnosis) adalah dengan isolasi AI dan molekuler diagnosis subtipe/patotipe (real time reverse transcription-polymerase chain reaction) (Widiasih et al. 2012).
Metode RT-PCR dapat digunakan sebagai metode diagnosis cepat untuk mendeteksi dan menentukan sensitifitas virus AI secara spesifik (Payungporn et al. 2004; Haryanto et al. 2012).
Kejadian Avian Influnza pada Puyuh
8
pengganti HA dan / atau NA ternyata mampu bereplikasi dan menyebar secara efisien pada burung puyuh hanya melalui perubahan gen HA saja, sedangkan pada ayam diperlukan perubahan molekuler gen-gen internal yang lebih kompleks. Pada penelitian menggunakan angsa yang diinfeksi A/Goose/GD/1/96 (H5N1), puyuh dapat tertular melalui kontak dengan feses, sedangkan pada ayam hanya tertular melalui kontak dengan feses (Webster et al. 2002).
Burung puyuh mempunyai peranan dalam evolusi virus tipe A dengan menyediakan lingkungan yang memungkinkan virus influenza asal itik dapat beradaptasi dan menghasilkan varian yang mempunyai kemampuan untuk menginfeksi spesies unggas lain. Puyuh dianggap sebagai hospes asal virus H5N1/97 yang menginfeksi manusia. Hal ini didasarkan pada tinggi derajat kerentanan puyuh terhadap virus A/Goose/Guang Dong/1/96 (H5N1) dan infeksi ulang yang terus menerus dari virus H6N1 dan H9N2 pada puyuh (Webster et al. 2002). Dalam hal ini burung puyuh mungkin berperan sebagai mixing vessel yang memfasilitasi peristiwa reasortasi virus H9N2, H5N1 dan H6N1 dan terjadinya virus pandemik potensial di Asia (Xu et al. 2007).
Penanggulangan Avian Influenza
9
3 METODE
Waktu dan Tempat Penelitian
Pengambilan sampel dilakukan di Balai Karantina Pertanian Yogyakarta. Penelitian telah dilaksanakan sejak bulan Juli sampai dengan Oktober 2014. Penelitian dilaksanakan di Laboratorium Bioteknologi Balai Besar Veteriner Wates Yogyakarta. Pengambilan sampel usap trakea anak burung puyuh yang dilakukan di ruang pengambilan sampel laboratorium wilayah kerja Adi Soetjipto Balai Karantina Pertanian kelas II Yogyakarta.
Bahan dan Alat
Bahan yang digunakan sebagai penelitian ini adalah sampel usap trakea anak burung puyuh yang berumur satu sampai lima hari yang akan dilalulintaskan melalui bandara Adi Soetjipto Yogyakarta. Etanol 96-100%, isopropanol, H5 Duplex Primer Prob Mix, MagMaxTM-96 AI/ND viral RNA isolation kit (Ambion cat. No. AM1835), Ag-Path-ID One-step RT-PCR kit (Ambion,Cat. No AM1005), nucleus free water, PBS Steril.
Alat-alat yang digunakan yaitu media transport virus yang berisi BHI, alat usap trakea, heating blok, sentrifus, refrigerator, freezer -20, Biosafety Cabinet Clas II (BSL II), PCR Work Station, Mikropipet dan mikrotips dengan ukuran 0.1-2,5µl; 2-20 µl; 20-200 µl dan 100-1000 µl. Tabung mikrosentrifus 2 ml, tabung mikrosentrifus 15 ml, optical PCR tube atau optical 96-weel microplate (ABI PRISMTM 96-well optical), adhesive cover untuk optical tube atau 96-well microplate, adhesive cover applicator, mesin realtime PCR ABI 7500, mortar dan pastel steril, gunting dan pinset steril, tabung steril 10 ml.
Metode Pengambilan Sampel
Sampel yang diambil adalah usap trakea dari anak burung puyuh yang akan dilalulintaskan melalui Bandara Adi Soetjipto Yogyakarta. Penentuan jumlah sampel dengan menggunakan rumus mendeteksi penyakit dengan tingkat kejadian penyakit (prevalensi) AI pada burung puyuh di wilayah Jawa Timur, Jawa Tengah dan DIY adalah 78,1% (Tabbu et al I 2006). Pengambilan sampel (sampling) dilakukan secara acak (convenience/sampling acak). Sampel yang didapat disimpan di media transport virus yang berisi brain heart infusion broth (BHI).
10
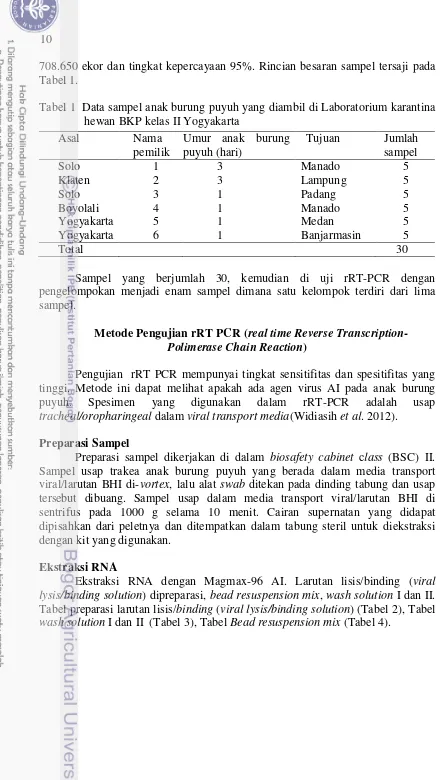
708.650 ekor dan tingkat kepercayaan 95%. Rincian besaran sampel tersaji pada Tabel 1.
Tabel 1 Data sampel anak burung puyuh yang diambil di Laboratorium karantina hewan BKP kelas II Yogyakarta pengelompokan menjadi enam sampel dimana satu kelompok terdiri dari lima sampel.
Metode Pengujian rRT PCR (real time Reverse Transcription- Polimerase Chain Reaction)
Pengujian rRT PCR mempunyai tingkat sensitifitas dan spesitifitas yang tinggi. Metode ini dapat melihat apakah ada agen virus AI pada anak burung puyuh. Spesimen yang digunakan dalam rRT-PCR adalah usap tracheal/oropharingeal dalam viral transport media(Widiasih et al. 2012).
Preparasi Sampel
Preparasi sampel dikerjakan di dalam biosafety cabinet class (BSC) II. Sampel usap trakea anak burung puyuh yang berada dalam media transport viral/larutan BHI di-vortex, lalu alat swab ditekan pada dinding tabung dan usap tersebut dibuang. Sampel usap dalam media transport viral/larutan BHI di sentrifus pada 1000 g selama 10 menit. Cairan supernatan yang didapat dipisahkan dari peletnya dan ditempatkan dalam tabung steril untuk diekstraksi dengan kit yang digunakan.
Ekstraksi RNA
11 Tabel 2 Preparasi untuk membuat viral lysis/binding sol
Viral lysis/binding solution Volume per 1 sampel
Tabel 3 Preparasi untuk wash solution mix Wash solution mix Volume per 1
sampel/well
Volume untuk 26 sampel Larutan Wash solution mix I (35 ml
isopropanol absolute dimasukkan
Tabel 4 Preparasi untuk membuat bead resuspension mix Larutan Bead resuspension
12
ke dalam masing-masing sampel. Microplate 96-well yang berisi sampel digoyang dengan orbital shaker dengan posisi 2-3 (550-600 rpm) selama empat menit. Microplate 96-well diletakkan ke dalam 96-well magnetic stand dan diinkubasi pada suhu kamar selama dua menit untuk capture RNA binding (capture telah sempurna jika timbul transparansi pada suspense). Supernatant (kira-kira 170 µl per well) diambil kemudian dibuang. Jika supernatant terambil semua maka akan diperoleh RNA yang lebih murni. Plate dilepaskan dari magnetic stand, lalu ditambahkan 100 µl wash solution I ke dalam masing-masing sampel. Microplate 96-well kemudian digoyang dengan orbital shaker dengan posisi 4-5 (550-600 rpm) selama 30 detik. Plate diletakkan ke dalam 96-well magnetic stand dan diinkubasi pada suhu kamar (20 sampai 25 oC) selama satu menit untuk capture RNA binding. Sejumlah 100 µl per well supernatan dibuang. Plate dipindahkan dari magnetic stand, lalu ditambahkan 100 µl wash solution II ke dalam masing-masing sampel. Plate kemudian digoyang dengan orbital shaker dengan posisi 4-5 (550-600 rpm) selama 30 detik. Plate diletakkan ke dalam 96-well magnetic stand dan inkubasi pada suhu kamar selama satu menit untuk capture RNA binding. Supernatan yang terbentuk dibuang (kira-kira 100 µl per well) untuk memperoleh RNA lebih murni. Plate dipindahkan dan diletakkan ke dalam shaker dan digoyang selama dua menit pada posisi 4-5 (550-600 rpm) untuk mengevaporasi sisa-sisa alkohol. 35 µl buffer elusi ditambahkan ke dalam masing-masing sampel dan dishaker selama 3 menit. Plate diletakkan ke dalam 96-well magnetic stand dan diinkubasi pada suhu kamar selama 1 menit untuk capture RNA binding. Supernatan diambil sebanyak 30 µl dan dimasukkan ke dalam tabung 1.5 ml kemudian langsung diuji.
Penyiapan reagen master mix
Ag-Path-ID One-Step RT-PCR Kit (Ambion, Cat. No AM1005) digunakan untuk reaksi rRT-PCR dengan total volume 25 µl. Primer yang digunakan adalah Primer H5-Duplex Primer Probe Mix yang terdiri dari primer forward H5 IVA-D148H5 (AAHL, Geelong, Australia), Primer reverse H5 IVA-D149H5 (AAHL, Geelong, Australia), Probe H5-IVA-H5a (AAHL, Geelong, Australia) dan Primer forward H5-IVA-D204f (AAHL, Geelong, Australia), Primer forward H5-IVA-D205r (AAHL, Geelong, Australia) dan probe H5-IVA-D215P (AAHL, Geelong, Australia). Semua komponen reaksi rRT-PCR yang tercantum pada Tabel 5.
Tabel 5 Komponen-komponen reaksi rRT-PCR Komposisi master mix RRT-PCR untuk H5-Influenza A
Komponen Volume untuk 1
reaksi (µl)
Volume untuk 6 x reaksi
Nuclease free water 0.124 0.744
13
Reaksi rRT-PCR
Dalam reaksi PCR sebaiknya diikutkan kontrol : Kontrol positif tinggi, kontrol positif rendah, kontrol positif ekstraksi, kontrol negatif dan kontrol tanpa cetakan/cetakan RNA ( NTC : Non template control ), Master mix Ag-Path-ID One-Step RT-PCR Kit disiapkan (Ambion, Cat. No. AM1005) untuk uji berdasarkan hitungan jumlah reaksi yang telah ditentukan pada. Semua larutan dicampur dengan baik dengan cara memvorteks. Aliquot 20 µl master mix ke dalam lubang yang telah ditentukan pada ABI PRISMTM 96-well optical. Sebanyak 5 µl RNA virus dimasukkan ke dalam lubang uji secara hati-hati. Untuk kontrol tanpa template tidak dimasukkan RNA sama sekali. Tutup dengan ABI PRISMTM optical adhesive cover dan sentrifus untuk menurunkan semua reagen ke dasar tabung. Jalankan pengujian dengan thermocycler dengan kondisi reaksi 10 menit pada suhu 45 oC.
Analisis Data
14
4 HASIL DAN PEMBAHASAN
Pengujian rRT-PCR
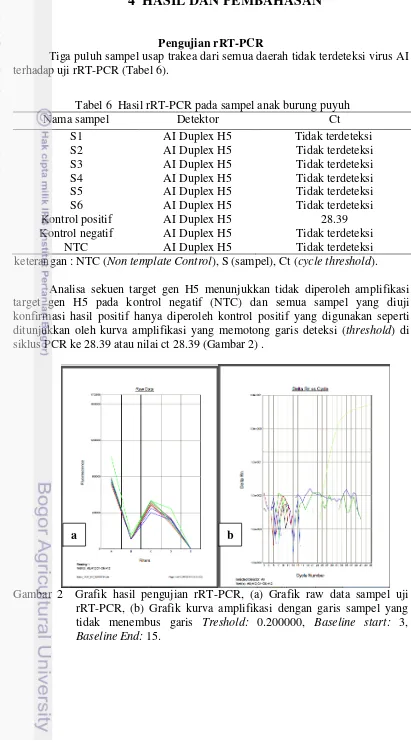
Tiga puluh sampel usap trakea dari semua daerah tidak terdeteksi virus AI terhadap uji rRT-PCR (Tabel 6).
Tabel 6 Hasil rRT-PCR pada sampel anak burung puyuh
Nama sampel Detektor Ct
S1 AI Duplex H5 Tidak terdeteksi
S2 AI Duplex H5 Tidak terdeteksi
S3 AI Duplex H5 Tidak terdeteksi
S4 AI Duplex H5 Tidak terdeteksi
S5 AI Duplex H5 Tidak terdeteksi
S6 AI Duplex H5 Tidak terdeteksi
Kontrol positif AI Duplex H5 28.39
Kontrol negatif AI Duplex H5 Tidak terdeteksi
NTC AI Duplex H5 Tidak terdeteksi
keterangan : NTC (Non template Control), S (sampel), Ct (cycle threshold). Analisa sekuen target gen H5 menunjukkan tidak diperoleh amplifikasi target gen H5 pada kontrol negatif (NTC) dan semua sampel yang diuji konfirmasi hasil positif hanya diperoleh kontrol positif yang digunakan seperti ditunjukkan oleh kurva amplifikasi yang memotong garis deteksi (threshold) di siklus PCR ke 28.39 atau nilai ct 28.39 (Gambar 2) .
Gambar 2 Grafik hasil pengujian rRT-PCR, (a) Grafik raw data sampel uji rRT-PCR, (b) Grafik kurva amplifikasi dengan garis sampel yang tidak menembus garis Treshold: 0.200000, Baseline start: 3, Baseline End: 15.
15 Hasil pembacaan rRT-PCR pada sampel ini memberikan informasi bahwa sampel anak burung puyuh yang akan dilalulintaskan tidak terdeteksi adanya agen virus AI. Hasil pemeriksaan fisik mendukung hasil pengujian rRT-PCR yang menunjukkan bahwa sampel pada tersebut tidak terdeteksi virus AI.
Real time PCR adalah teknik yang relatif baru, namun sudah banyak digunakan untuk mendiagnosa dan mempelajari penyakit-penyakit unggas yang pathogen (Lee & Suarez 2004). Untuk mempermudah dan mempercepat waktu deteksi virus AI ini maka metode yang digunakan adalah rRT-PCR, dikarenakan dengan rRT-PCR akan mempersingkat waktu dan dengan jumlah virus yang sedikit pun mampu mendeteksi karena rRT-PCR mempunyai sensitifitas dan spesitifitas yang tinggi dibangingkan dengan pengujian PCR konvensional (Widiasih et al. 2012).
Metode pengujian rRT-PCR berfokus pada fase eksponensial karena memberikan data yang paling tepat dan akurat. Garis threshold adalah tingkat deteksi dimana reaksi mencapai intensitas fluoresens diatas latar belakang. Jumlah siklus PCR yang dibutuhkan untuk mendapatkan signal fluoresens yang melintasi threshold disebut cycle threshold (Ct). Nilai Ct digunakan dalam kuantisasi hilir atau deteksi ada atau tidaknya agen. Jumlah template DNA pada reaksi yang tidak diketahui dapat ditentukan secara akurat dengan membandingkan nilai-nilai Ct sampel yang tidak diketahui konsentrasinya dengan standart uji (AAHL 2013). Nilai Ct berkorelasi dengan kuantitas urutan DNA target. Kuantitas urutan DNA target tinggi diawal reaksi, nilai Ct akan lebih cepat diketahui (Hejawuli & Dharmayanti 2014).
Sampel yang digunakan adalah usap trakea, dikarenakan hampir sebagian besar subtipe virus influenza A selain bereplikasi pada saluran pernafasan juga bereplikasi pada saluran pencernaan (Tumpey et al. 2002) sehingga diharapkan hasil akan lebih akurat dengan adanya jumlah virus yang lebih banyak pada alat swab yang digunakan. RT-PCR merupakan salah satu alternatif metode yang dapat digunakan untuk mengidentifikasi virus influenza walaupun gen virus ada dalam jumlah sedikit pada suatu sampel, spesimen asal hewan hidup yang dapat digunakan untuk diagnosis AI berupa usap pada traktus respiratorius bagian atas (usap hidung, usap trakea) atau usap kloaka, namun pada kondisi di lapang cara pengambilan usap kloaka merupakan cara yang paling cepat dan aman (WHO 2003).
Sejumlah kecil RNA virus AI dapat dideteksi bahkan ketika virus sudah terinaktivasi dengan menggunakan teknik RT-PCR, sedangkan isolasi virus pada TAB (telur ayam berembrio) membutuhkan virus yang hidup, oleh karenanya metode amplifikasi dengan RT-PCR lebih sensitif. Pada surveilans virus AI secara rutin di lapangan, diperlukan metode yang cepat, akurat, sensitive, dan spesifik sehingga keberadaan virus AI dapat dengan cepat, tepat, dan akurat diketahui. Metode RT-PCR dapat menjadi solusi karena beberapa kelebihan yang dimiliki. Sampel yang dibutuhkan juga bervariasi, baik sampel usap maupun sampel organ. Pada studi mengenai surveilans virus AI pada pasar unggas ditunjukkan pada usap trakea lebih cocok digunakan dan mengandung lebih banyak virus dibandingkan sampel dari usap kloaka atau lingkungan (Bulaga et al., 2003; Haryanto et al. 2012).
16
serta media yang digunakan harus dipastikan dalam keadaan baik dan tidak melewati masa kadaluwarsa pemakaian media tersebut agar hasil diagnosa yang didapat benar-benar akurat (Fiqri et al. 2011). Amplifikasi gen virus AI secara RT-PCR akan memberikan hasil positif apabila dilakukan dengan jumlah RNA sebagai template memenuhi jumlah minimum yang telah ditentukan. Jumlah DNA virus kurang dari 0.01-0.1µg tidak dapat diamplifikasi menggunakan RT-PCR (Yuwono 2006). Beberapa faktor yang dapat mempengaruhi hasil amplifikasi RT-PCR adalah adanya perbedaan materi dan metode yang digunakan serta adanya perbedaan strain dan subtipe virus yang diteliti, selain itu perbedaan kualitas masing-masing sampel juga ikut berperan (Noroozian et al. 2007).
Penggunaan primer H5-Duplex Primer Probe mix pada penelitian ini dikarenakan diantara 16 subtipe HA, virus-virus AI dari subtipe H5 dan H7 memiliki kemampuan untuk melakukan mutasi genetik yang berakibat pada perubahan patogenesitas virus dari LPAI menjadi HPAI yang umumnya terjadi setelah proses introduksi dan adaptasi virus LPAI pada unggas-unggas domestik golongan ayam, puyuh dan kalkun. Indonesia adalah salah satu Negara yang masih melaporkan adanya kasus AI khususnya H5N1 HPAI pada unggas (Wibawa, 2013). Agen VAI tidak terdeteksi dalam pengujian rRT-PCR yang sudah menggunakan primer H5-Duplex Primer Probe mix ini menunjukkan bahwa tidak adanya VAI dari subtipe H5 yang sudah banyak ditemukan di wilayah Jawa Tengah dan DIY, sehingga dapat disimpulkan bahwa burung puyuh yang diperiksa tidak terinfeksi VAI terutama subtipe H5.
Menurut Kartikasari (2008), metode rRT-PCR ini memiliki sensitifitas dan spesitivitas yang sangat tinggi dalam mendeteksi keberadaan virus influenza dalam spesimen apapun walaupun dalam jumlah yang sangat sedikit. Ketika pembacaan amplifikasi DNA menggunakan mesin rRT-PCR, selain sampel yang dibaca, disertakan juga kontrol positif dan kontrol negatif. Fungsi dari kontrol ini adalah untuk mengetahui apakah sewaktu mencampurkan mix reagen ke dalam sampel terdapat kontaminasi atau tidak. Kontrol negatif akan tetap negatif setelah pembacaan jika tidak ada kontaminasi atau dengan kata lain bahwa pengerjaan pencampuran reagen berhasil dan hasil rRT-PCR dianggap layak dan dapat dipercaya. Hal itu pun berlaku sebaliknya, apabila kontrol negatif menjadi positif maka dapat diperkirakan adanya kontaminasi pada saat pencampuran reagen dan hasil dari pembacaan itu dianggap tidak dapat dipercaya dan untuk selanjutnya pemeriksaan harus dilakukan pengulangan. Pada penelitian ini telah melalui proses yang benar dengan hasil kontrol negatif tetap negatif sehingga pembacaan proses rRT-PCR ini dapat dipercaya.
Pemeriksaan Fisik Anak Burung Puyuh
Sebanyak 30 sampel usap trakea anak burung puyuh dan DOQ yang berasal dari Kota Solo, Kabupaten Klaten, Boyolali dan DI Yogyakarta diambil sesaat sebelum dilalulintaskan dengan disertai tindakan karantina di tempat pengeluaran seperti pemeriksaan fisik dan dokumen.
17 pengiriman anak burung puyuh selain yang berumur satu hari ada juga yang berumur tiga sampai lima hari, karena pada umur tersebut kondisi anak burung puyuh masih seragam dengan cara pemberian pakan yang mudah pada saat dalam kemasan (sebagian besar sampai umur tiga hari masih ada yolk sac pada anak burung puyuh tersebut) (Wheindrata 2014).
Hasil pemeriksaan fisik sebelum pengambilan sampel usap trakea, menunjukkan bahwa DOQ maupun anak burung puyuh yang akan dilalulintaskan dalam kondisi sehat dan tidak menunjukkan gejala klinis penyakit AI. Gejala LPAI pada unggas dalam bentuk ringan yang tidak diikuti oleh infeksi sekunder, akan terlihat adanya gangguan pernafasan, anoreksia, depresi, sinusitis, serta tidak menunjukkan ada gejala-gejala penyakit seperti lesu, menyendiri, mengantuk (Tabbu 2000) seperti pada Gambar 3.
Gambar 3 DOQ yang sehat
Menurut Tabbu (2006) gejala klinis HPAI pada ayam pedaging, ayam buras maupun burung puyuh cenderung bersifat tidak spesifik dibandingkan dengan gejala klinis HPAI pada ayam petelur. Gejala yang terlihat biasanya hanya depresi berat dan peningkatan kematian yang drastis dari hari ke hari. Mortalitas dapat mencapai 70%-100%. Hasil pengumpulan informasi dari peternak burung puyuh yang akan dilalulintaskan, tidak mengalami penurunan produksi maupun peningkatan jumlah kematian dalam kurun waktu enam bulan terakhir (BKPK II Yogyakarta 2014).
18
Gambar 4 Kemasan box untuk pengiriman Anak burung puyuh melalui BKP II Yogyakarta ke luar Jawa, (a) Box tertutup, (b) Box terbuka.
Proses pemilihan unggas yang akan dikirim termasuk faktor utama dalam lalu lintas unggas termasuk pemilihan bibit burung puyuh. Bibit burung puyuh yang unggul merupakan modal utama beternak burung puyuh untuk mencapai produktivitas yang tinggi dan kelangsungan produksi telur yang panjang. Berawal di Semarang Selatan, pembibitan burung puyuh ini menyebar sampai ke wilayah Jawa Tengah bagian selatan seperti Kota Solo, Kabupaten Boyolali, Sukoharjo, Klaten bahkan Daerah Istimewa Yogyakarta. Seiring perkembangan jaman ternak burung puyuh merambat sampai pulau Sumatera, Kalimantan, Sulawesi dan juga Papua (Wheindrata 2013). Oleh karena itu burung puyuh sebagai salah satu hewan pembawa virus AI yang sebagian besar berasal dari daerah yang endemik AI serta burung puyuh merupakan reservoir yang paling potensial untuk terjadinya mutasi genetik virus AI ke bentuk yang transmissible ke mamalia (Sun et al. 2011) maka perlu dilakukan pengawasan yang ketat terhadap lalu lintas media pembawa AI ini.
Saat ini, burung puyuh Jepang (Coturnix coturnix japonica) banyak berkembang untuk tujuan produksi daging dan telur. Produksi puyuh telah menjadi sektor yang penting dalam industri perunggasan bagi banyak Negara. Rasa yang khas dari daging dan telur, pertumbuhan yang lebih cepat dibanding dengan unggas lain, produksi lebih cepat dengan hasil yang banyak, biaya pemeliharaan rendah merupakan beberapa keuntungan dari burung puyuh (Ozsoy & Orhan 2011).
Bibit burung puyuh yang unggul merupakan modal utama beternak burung puyuh untuk mencapai produktivitas yang tinggi dan kelangsungan produksi telur yang panjang. Berawal di Semarang Selatan, pembibitan burung puyuh ini menyebar sampai ke wilayah Jawa Tengah bagian selatan seperti Kota Solo, Kabupaten Boyolali, Sukoharjo, Klaten bahkan Daerah Istimewa Yogyakarta. Seiring perkembangan jaman ternak burung puyuh merambat sampai pulau Sumatera, Kalimantan, Sulawesi dan juga Papua (Wheindrata 2013).
Gejala klinis HPAI pada ayam pedaging, ayam buras maupun burung puyuh cenderung bersifat tidak spesifik dibandingkan dengan gejala klinis HPAI pada ayam petelur. Gejala yang terlihat biasanya hanya depresi berat dan peningkatan kematian yang drastis dari hari ke hari. Mortalitas dapat mencapai 70-100%. Kondisi tersebut mungkin erat hubungannya dengan proses penyakit yang berlangsung lebih cepat kepada ayam pedaging, ayam buras ataupun burung
19 puyuh sehinga ayam/unggas telah mati sebelum terbentuk lesi tertentu. Hal ini mengingat bahwa ayam/unggas tersebut tidak divaksinasi terhadap AI dan kondisi biosekuriti cenderung kurang baik (Tabbu 2006).
Pada dunia peternakan burung puyuh, jarang ada program vaksinasi terhadap AI hanya vaksinasi terhadap virus ND. Sebagian besar peternak melakukan biosekuriti yang ketat untuk kandangnya. Bisosekuriti yang dilakukan seperti menyemprot kandang secara rutin dan pada saat kandang kosong, membersihkan kandang rutin, memelihara sirkulasi udara. Pemelihaaran kesehatan merupakan faktor utama, kesehatan dipengaruhi oleh perubahan cuaca disekitarnya terutama musim pancaroba dan musim penghujan karena pada musim ini banyak penyakit akan mudah menyerang seperti penyakit bakterial maupun viral seperti AI (Wheindrata 2013). Pernyataan ini sesuai dengan waktu pengambilan sampel dilakukan pada bulan Agustus sampai awal September yang termasuk pada musim kemarau.
Menurut Setyawati (2010) tingkat kejadian AI pada musim kemarau cenderung rendah atau lebih sedikit, hal ini dikarenakan virus AI relatif tidak stabil pada lingkungan dan virus cepat mengalami inaktivasi ketika terjadi perubahan pH (kondisi nonisotonik) dan suhu (panas) serta kekeringan. Penyakit AI dan beberapa penyakit unggas lainnya biasanya muncul saat pergantian musim/perubahan cuaca disekitarnya, terutama pada musim pancaroba dan musim penghujan yang mana angin cukup deras dan udara cukup dingin yang menyebabkan burung puyuh mudah lapar dan mengalami cekaman sehingga daya tahan melemah dan mudah sekali terinfeksi oleh agen penyakit (Wheindrata 2014). Hal ini mendukung hasil tidak terdeteksinya agen virus AI pada burung puyuh yang diperiksa, karena tidak adanya wabah AI pada peternakan dan wilayah disekitar peternakn burung puyuh tersebut.
Penelitian yang dilakukan Nili et al (2007) menyatakan respon serologi pada puyuh yang di tantang dengan vaksinasi dan tidak divaksinasi tidak ada perbedaan secara signifikan. Sehingga banyak peternakan puyuh tidak melakukan program vaksinasi, apabila dalam satu peternakan terserang oleh AI maka biasanya dilakukan stamping out dan semprot kandang menggunakan desinfektan serta istirahat kandang selama dua minggu. Sehingga dalam pemeriksaan dengan menggunakan rRT-PCR tidak ditemukan agen penyakit AI karena pada sampel yang diperiksa tidak terinfeksi virus AI baik secara alami maupun sengaja seperti vaksinasi.
Wabah AI di Indonesia dimulai pada awal Agustus 2003 di beberapa peternakan ayam ras komersial di Jawa Barat dan Jawa Tengah yang kemudian menyebar ke seluruh Jawa dan beberapa provinsi di Indonesia. Dalam kurun waktu beberapa bulan (Agustus 2003–Februari 2004) telah terjadi kematian unggas sebesar 4.859.911 atau sebesar 6.4% dari populasi unggas di seluruh provinsi di Pulau Jawa, Bali, Kalimantan Selatan, Kalimantan Tengah dan Lampung (Ditkeswan 2009). Oleh karena itu burung puyuh sebagai salah satu hewan pembawa virus AI yang sebagian besar berasal dari daerah yang endemik AI maka perlu dilakukan pengawasan lalulintas AI. Selain itu, burung puyuh merupakan reservoir yang paling potensial untuk terjadinya mutasi genetik virus AI ke bentuk yang transmissible ke mamalia (Sun et al. 2011).
20
virus yang diisolasi dari burung puyuh ada dua isolat H5N1 HPAI yaitu A/Quail/Guangdong/342/2008 (QL 342) clade 2.3.2 dan A/Quail/ Guangdong/176/2004 (QL 176) clade 7 serta mempunyai tingkat
mortalitas 18,3-100% dan dapat ditularkan dengan kontak langsung antar burung puyuh. Hal ini sesuai dengan informasi bahwa tidak ada kejadian dalam tiga bulan terakhir karena apabila terjadi wabah AI pada suatu peternakan burung puyuh maka akan segera dilakukan stamping out.
Burung puyuh mempunyai peranan dalam evolusi virus tipe A dengan menyediakan lingkungan yang memungkinkan virus influenza asal itik dapat beradaptasi dan menghasilkan varian yang mempunyai kemampuan untuk menginfeksi spesies unggas lain. Puyuh dianggap sebagai hospes asal virus H5N1/97 yang menginfeksi manusia. Hal ini didasarkan pada tinggi derajat kerentanan puyuh terhadap virus A/Goose/Guang Dong/1/96 (H5N1) dan infeksi ulang yang terus menerus dari virus H6N1 dan H9N2 pada puyuh (Webster et al. 2002). Dalam hal ini burung puyuh mungkin berperan sebagai mixing vessel yang memfasilitasi peristiwa reasortasi virus H9N2, H5N1 dan H6N1 dan terjadinya virus pandemik potensial di Asia (Xu et al. 2007). Menurut Bertran et al (2013) menyatakan bahwa burung puyuh jepang ( Coturnix c Japonica) merupakan host intermediet dan reservoir dari virus AI. Burung puyuh mampu bertindak sebagai sumber penularan bagi unggas lain karena di dalam tubuh burung puyuh semua tipe virus AI asal unggas air yang dapat bereplikasi dan berperan dalam penyebaran virus ke unggas lain . Dari 15 subtipe virus AI pada burung puyuh yang disaji, 14 subtipe mampu bereplikasi pada burung puyuh, terutama pada saluran pernafasannya (Wan & Perez 2006).
Dampak sosio-ekonominya cukup luas mempengaruhi status kesehatan masyarakat dan perdagangan internasional terutama pada perdagangan produk unggas dan hasil olahannya. Penyakit ini menyebabkan penurunan produksi serta memiliki tingkat morbiditas dan mortalitas tinggi. Salah satu faktor yang berperan dalam kegiatan perniagaan unggas adalah pasar hewan tradisional atau pasar unggas hidup (live bird markets). Sistem perdagangan atau penjualan unggas hidup di pasar antar daerah bahkan antar pulau, meningkatkan potensi terjadinya penyebaran penyakit ini dengan adanya pencampuran unggas berbagai macam ras dan jenis dalam satu kandang. Penempatan unggas dari berbagai macam sumber dalam satu kandang di pasar juga menjadi salah satu faktor risiko terjadinya penularan penyakit AI (Dinar Hadi & Diarmita 2014).
21 angsa yang diinfeksi A/Goose/GD/1/96 (H5N1), puyuh dapat tertular melalui kontak dengan udara dan feses, sedangkan pada ayam hanya tertular melalui kontak dengan feses (Webster et al. 2002).
22
5 SIMPULAN DAN SARAN
Simpulan
Sampel usap trakhea yang berjumlah 30 sampel berasal dari beberapa peternak anak burung puyuh daerah Kabupaten Klaten, kota Solo dan DI Yogyakarta menunjukkan bahwa virus AI tidak terdeteksi dengan pembacaan rRT-PCR.
Saran
Perlu dilakukan penelitian lebih lanjut mengenai deteksi virus avian influenza pada anak burung puyuh secara serologi di BKP kelas II Yogyakarta
23
DAFTAR PUSTAKA
[AAHL] Australian Animal Health Laboratory. 2013. Nucleic Acid Detection for Diagnosis and Emergency Disease Investigation: Influenza Virus Type A Generic AI Matrix Gene and H5 TaqMan PCR. Geelong (AUS): CSIRO. Alexander DJ, Brown LH. 2009. History of highly pathogenic avian influenza.
Rev Sci Tech Off Int Epiz. 28(1):19-38
Bulaga LL, Garber L, Senne DA, Myers TJ, Good R, Wainwright S, Trock S, Suarez DL. 2003. Epidemiologic and surveillance studies on avian influenza in live-bird Markets in New York and New Jersey 2001. Avian Dis. 47:996-1001.
Bertran K, Dolz R, Busquets N, Gamino V, Vergara-Alert J, Chaves JA, Ramis A, Abad FX, Hofle U, Majo N. 2013. Pathobiology and transmission of highly pathogenic avian influenza viruses in European quail (Coturnix c coturnix). Vet Res. 44(1):23.
[BKP K II Yogyakarta] Balai Karantina Pertanian Kelas II Yogyakarta. 2014. Laporan Tahunan BKP Kelas II Yogyakarta 2014. Yogyakarta (ID): BKPK II Yogyakarta.
Capua I, Maragon S. 2007. The challenge of controlling notifiable avian influenza by means of vaccination. Avian Dis. 51:317-322.
Chen W, He B, Li C, Zhang X, Wu W, Yin X, Fan, B, Fan X, Wang J. 2007. Real-time RT-PCR for H5N1 avian Influenza a virus detection. J Med Microbiol. 56:603-607.
Coleman JR. 2007. The PB1-F2 protein of influenza a virus: Increasing pathogenic by disrupting alveolar macrophages. Virol 4:1-5.
Darminto .2006. Mengenal Penyakit Flu Burung dan Strategi Pengendaliannya, An Introduction to Avian Influenza and It’s Control Strategy. Yogyakarta (ID): UGM Pr.
[DEPTAN] Departemen Pertanian. 2005. Peraturan Dirjen Peternakan nomor: 46/PD.640/F/08.05 tahun 2005 tentang Revisi Keputusan Dirjen Peternakan nomor: 17/Kpts/PD.640/F/02.04 Tahun 2004 tentang Pedoman Pencegahan, Pengendalian dan Pemberantasan Penyakit Hewan Menular di Indonesia pada Unggas (Avian Influenza). Jakarta (ID): DEPTAN.
Dharmayanti INLP, Indriani R, Adjid R.M.A. 2006. Identifikasi virus avian influenza pada beberapa jenis unggas di Taman Margasatwa Ragunan dan upaya eradikasinya. Med Kedok Hew. 22(2):79-83.
Dinar Hadi, WH, Diarmita, IK. 2014. Perkembangan Situasi Penyakit Avian Influenza H5N1 Clade 2.3.2 dan Kewaspadaan Dini Penyakit Influenza
H7N9 di Wilayah Kerja Balai Besar Veteriner Denpasar. Bali (ID): BB-Vet Bali.
[Ditkeswan] Direktorat Kesehatan Hewan. 2009. Pedoman Surveilans dan Monitoring Avian Influenza di Indonesia. Jakarta (ID): Ditkeswan Ditjenak Deptan.
24
Fouchier RA et al. 2005. Characterization of a novel influenza A virus
hemaglutinin subtype (H16) obtained from black headed gulls. J Virol. 19(5):2814-2822.
Goutard F, Roger J, Guitian J, Balanc G, Argaw K, Demissie A, Soti V, Martin V, Pfeiffer. 2007. Conceptual framework for avian influenza risk assessment in Africa: The case of Ethiopia. Avian Dis 51:504–506
Harder TC. Werner O. 2006. Avian Influenza in : Influenza Report. Sevilla(ES): Flying Pub.
Haryanto A, Andinita D, Irianingsih SH, Yudianingtyas DW. 2012. Diagnosa cepat virus avian influenza tipe A subtipe H5 dari spesimen lapangan dengan metode onestep simplex RT-PCR. J Ked Hewan. 6(1):6-10.
Hejawuli DA, Dharmayanti NLPI. 2014. Perkembangan teknologi reverse transcriptase-polimerase chain reaction dalam mengidentifikasi genom Avian Influenza dan New Castle Diseases. Wartazoa. 24(1):16-29.
Horimoto T, Kawaoka Y. 2001. Pandemic Threat Posed By Avian Infuenza A Viruses. J Clin Microbiol. 14:129-149.
James C. 2000. Control of communicable disease manual. Apha. 17:284-290. Kartikasari DS. 2008. Perbandingan Tingkat Sensitivitas dan Spesitifitas pada
Pemeriksaan Influenza A Dengan Menggunakan Rapid Test dan Real Time-Reverse Transcriptase PCR (rRT-PCR) [tesis]. Semarang (ID): Universitas Diponegoro Pr.
[Kementan] Kementerian Pertanian. 2012. Pedoman Penataan Budidaya Puyuh. 2012. Direktorat Budidaya Ternak, Direktorat Jenderal Peternakan dan Kesehatan Hewan Kementerian Pertanian. Jakarta (ID): Kementan. Kilpatrick AM, Chmura AA, Gibbons DW, Fleischer RC, Marra PP, Daszak P.
2006. Predicting the global spread of H5N1 avian influenza. Proc Natl Acad Sci. 103(51):19368-19373.
Lee CW, Suarez DL. 2004. Application of real-time RT-PCR for the quantitation replication study of H5 and H7 subtype Avian Influenza Virus. J of Virol Methods. 119:151-158.
Mattjik AN, Sumertajaya IM. 2013. Perancangan Percobaan dengan Aplikasi SAS dan Minitab. Bogor (ID): IPB Pr.
Michael LP. 2008. Avian influenza. Iowa (USA): Blackwell Pub.
Mujiatun, 2009. Deteksi Keberadaan Virus Avian Influenza Pada DOC yang
Murphy FA, Gibbs EPJ, Horzinek MC, Studdert MJ. 1999. Veterinary Virology. 3rd ed. California (ID): Academic Pr.
Nili H, Asasi K, Dadras , Ebrahim SM. 2007. Pathology of H9N2 avian influenza
virus in Japanese quail (Cortunix coturnix japonica). Avian dis. 51(1):390-3922
25 [OIE] Office International des Epizooties. 2005. Avian Influenza. Chapter 2.7.12.
Manual of diagnostic test and vaccines for terrestrial animals. Paris: OIE. www.oie.int
Ozsoy AN, Orhan. 2011. The prediction of genetic parameters for body weights in Japanese quails by Gibbs sampling method. J of Trends Anim Vet Sci. 2(1):21-24
Payungporn SP, Phakdeewirot S, Chutinimitkul A, Theamboonlers J, Keawcharoen K, Oraveerakul A, Amonsin, Poovorawan Y. 2004.
Perkins LEL, Swayne DE. 2002. Pathogenecity of Hongkong origin H5N1 highly pathogenic avian influenza virus from esmus, geese, ducks and pigeon. Avian Influenza Disease. 46:53-63.
Setyawati S. 2010. Kajian Epidemiologi Virus Avian Influenza Pada Distribusi Anak Ayam Umur Satu Hari. Bogor (ID): IPB Pr.
Siregar RMP. 2008. Pengaruh Suplementasi Asam Amino Metionin dan Lisin dalam Ransum Terhadap Fertilitas, Daya tetas dan Mortalitas Telur Burung Puyuh (Coturnix-coturnix japonica). Medan (ID): USU Pr.
Subbarao K, Joseph T. 2007. Scientific barriers to developing vaccines against avian influenza viruses. Nature Rev Immunol 7:267-278.
Sugiharto RE, 2005. Meningkatkan Keuntungan Beternak Puyuh. Jakarta (ID): Agromedia Pustaka.
Sun H, Jiao P, Cheng Y, Yuan R, Cui P, Jin L, Xin C and Liao M. 2011. The pathogenecity variation of two quail-origin H5N1 HPAV to BALB/c mice after six passages in quail. J Anim Vet Adv. 10(15):1974-1980.
Susilorini, TE. 2007. Budi Daya 22 Ternak Potensial. Jakarta (ID): Penebar Swadaya.
Suzuki Y, Nei M. 2002. Origin and evolution of influenza hemaglutinin genes. Mol Biol Evol. 19:501-509.
Swayne DE, Arkey B. 2005. Avian Influenza Control Strategis in The United State of America. San diego(US): Academi Pr.
Tabbu CR. 2000. Penyakit Ayam dan Penanggulangannya Penyakit bacterial, mikal dan viral. Yogyakarta(ID): Kanisius Pr.
Tabbu CR, Budiharta S, Salasia SIO, Asmara W, Sumiarto B, Wahyuni AETH, Susetyo H, Kurniasih, Haryadi M, Widiasih DA, et al. 2006. Laporan Kajian Avian Influenza Di Jawa Timur, Jawa Tengah Dan Daerah Istimewa Yogyakarta. Yogyakarta (ID): UGM Pr.
Tumpey TM, Suarez DL, Perkins DL, Senne DA, Lee JG, Lee YJ, Mo IP, Sung HW, Swayne DE. 2002. Characterization of highly pathogenic H5N1 avian influenza A virus isolated from duck meat. J Virol. 76(12):6344-6355.
Thrusfield M. 2005. Veterinary Epidemiology 3rd Edition:Veterinary Clinical Studies. Edinburgh: Backwell Science University of Edinburgh.
26
Webster RG, Guan Y, Peiris M, Walker D, Krauss S, Zhou NN, Govorkova EA, Ellis TM, Dyrting KC, Sit T. 2002. Characterization of H5N1 Influenza Viruses that continue to circulate in geese in Southern China. J Virol. 76(1):118-126.
Wheindrata HS. 2013.Panduan Lengkap Beternak Burung Puyuh Petelur. Yogyakarta (ID): Penerbit ANDI.
[WHO] World Health Organization, Department of Communicable Disease Surveillance and Response. 2002. WHO manual on Animal Influenza diagnosis and surveillance. Geneva: WHO. www.who.int
[WHO] World Health Organization. 2003. Technical Report Series Recommendations for production and control of influenza vaccine (Inactivated).
Wibawa H. 2013. Epidemiologi, filogeni dan resiko penularan antar spesies virus avian influenza baru subtipe H7N9. Bul Lab Ve. BBVET. 13(2):0863-7968. Wibawan IWT. 2012. Manifestasi Sub klinis Avian Influenza pada Unggas:
Ancaman Kesehatan dan Penanggulangannya. Bogor (ID): IPB Pr.
Widiasih DA, Budiharta S, Zakariya F, Susetya H. 2012. Epidemiologi Zoonosis Di Indonesia. Yogyakarta (ID): UGM Pr.
Wijanarko. 2011. Kajian Lintas Seksional Avian Influenza pada Sentra Peternakan Itik Alabio di Kabupaten Hulu Sungai Utara Propinsi Kalimantan Selatan. Yogyakarta (ID): UGM Pr.
Wood JP, Choi YW, Chappie DJ, Rogers JV, Kanye JZ. 2010. Environmental Persistence of a Higly Pathogenic Avian Influenza (H5N1) virus. American Chemical Society. Environ. Sci. Technol. 44 (19):7515-7520. Xu KM, Li KS, Smith GJD, Li JW, Tai H, Zhang JX, Webster RG, Peiris JSM,
Chen H, Guan Y. 2007. Evolution and moleculer epidemiology of H9N2 influenza A viruses from quail n Southern China 2000-2005. J. Viral 81(6):2635-2645.
Yuwono D. 2008. Pemantauan Serotipe Virus Influenza di Jakarta Dalam Rangka Penentuan Komposisi Antigenik Vaksin Influenza. Yogyakarta (ID): Penerbit ANDI.
27
RIWAYAT HIDUP
Penulis dilahirkan di Klaten Jawa Tengah pada tanggal 24 September 1982, merupakan anak pertama dari pasangan Bapak Kuwadno dan Ibu Choryatun. Penulis menyelesaikan pendidikan Sekolah Dasar pada tahun 1994 di SD Pangudiluhur (Sugiyapranata) Klaten dan pada tahun 1997 menyelesaikan pendidikan Sekolah Menengah Pertama di SMP Negeri 1 Klaten. Selanjutnya penulis menyelesaikan Sekolah Menengah Atas di SMA Negeri 1 Klaten dan lulus pada tahun 2000. Tahun 2000 penulis melanjutkan kuliah di Fakultas Kedokteran Hewan Universitas Gadjah Mada Yogyakarta dan meraih gelar Dokter Hewan pada tahun 2006.