BIOAKTIVITAS EK
JENIS ISOL
MATI P
SEK
INSTI
EKSTRAK MAHONI DAN IDENTIFIKA
LAT
Botryodiplodia
sp. PENYEBAB
TI PUCUK PADA BIBIT JABON
AJI WINARA
EKOLAH PASCASARJANA
STITUT PERTANIAN BOGOR
BOGOR
2014
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Bioaktivitas Ekstrak Mahoni dan Identifikasi Jenis IsolatBotryodiplodiasp. Penyebab Mati Pucuk pada Bibit Jabon adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Agustus 2014
Aji Winara
AJI WINARA. Bioaktivitas Ekstrak Mahoni dan Identifikasi Jenis Isolat
Botryodiplodia sp. Penyebab Mati Pucuk pada Bibit Jabon. Dibimbing oleh ACHMAD dan SYAMSUL FALAH.
Penyakit mati pucuk pada bibit jabon (Anthocephalus cadamba (Roxb.) Miq.) yang disebabkan oleh fungi Botryodiplodia sp. telah menurunkan kualitas bibit dan merugikan para pegiat budidaya jabon. Saat ini pengendalian penyakit mati pucuk pada bibit jabon menggunakan fungisida nabati sangat minim. Mahoni (Swietenia macrophylla King.) merupakan salah satu potensi tumbuhan obat Indonesia yang ketersediaannya melimpah namun potensinya sebagai fungisida nabati belum diketahui terutama dalam mengendalikan patogenisitas isolat
Botryodiplodia sp. Penelitian ini bertujuan mengukur bioaktivitas dan efikasi ekstrak mahoni secara in vitro dan mengidentifikasi spesies dari isolat
Botryodiplodia sp. penyebab mati pucuk pada bibit jabon. Pengukuran bioaktivitas dan efikasi ekstrak mahoni dilakukan melalui teknik peracunan makanan, sementara identifikasi jenis berdasarkan karakter morfologi dan sekuensi DNA.
Hasil penelitian menunjukkan bahwa secarain vitroekstrak metanol mahoni (daun, kulit buah, biji, kulit batang dan akar) dapat menghambat pertumbuhan isolat Botryodiplodia sp. dengan nilai persentase penghambatan terbesar dihasilkan oleh ekstrak biji mahoni. Uji in vitro efikasi ekstrak metanol dan air panas biji mahoni dengan berbagai taraf konsentrasi menunjukkan bahwa nilai penghambatan terbesar dihasilkan oleh ekstrak metanol pada taraf konsentrasi 50% dengan nilai penghambatan pertumbuhan isolat hingga 63.33%. Penghambatan pertumbuhan isolat Botryodiplodia sp. akibat ekstrak biji mahoni disebabkan oleh adanya perubahan morfologi hifa menjadi tidak normal yaitu berupa pengerutan dan perubahan arah pertumbuhan akibat degradasi dinding sel.
Hasil identifikasi morfologis dan molekuler menunjukkan bahwa isolat
Botryodiplodia sp. yang menyebabkan penyakit mati pucuk pada bibit jabon adalah Botryodiplodia theobromae Pat. teleomorf Botryosphaeria rhodina (Berk. & MA. Curtis). Sedangkan secara morfologis isolat B. theobromae dicirikan dengan konidia matang berdinding tipis, berseptat dengan ukuran 14.6 sampai 23.3 µm x 8.0 sampai 12.3 µm serta pada media kultur menghasilkan oozing
berupa cairan pekat berwarna hitam pada permukaan koloni miselium. Pertumbuhan koloni isolat B. theobromae lebih optimum pada media kentang sukrosa (Potatoes Sucrose Medium).
SUMMARY
AJI WINARA.
Bioactivities of Mahogany Extracts and Identification ofBotryodiplodiasp. Isolate Causing Dieback on Jabon Seedling. Supervised by ACHMAD and SYAMSUL FALAH.
Dieback on jabon (Anthocephalus cadamba(Roxb.) Miq.) seedling caused by fungi Botryodiplodia sp. decreased seedling’s quality and nurseries economic benefits. Less studies on the control of dieback pathogen on jabon seedling used biofungicide from plant extract have been reported nowadays. Mahogany (Swietenia macrophylla King.) is one of the promising medicinal plants in Indonesia but its utilization as a biofungicide specially for controlling the dieback on jabon seedling has not been reported. This research aimed to estimate the bioactivities and efficacy of mahogany extracts and to identify the pathogen species of Botryodiplodia sp. causing dieback on jabon seedling. The poisoned food technique was used to estimate the bioactivities and efficacy of mahogany extract, while morphological characteristic and molecular identifications with DNA sequensing were used to identify the pathogen isolate.
The result showed that methanol extracts of leaves, bark, seeds, fruit shells and root of mahogany could inhibit the growth of Botryodiplodia sp. isolate with the highest growth inhibition was the extract of seeds. In vitro test of the efficacy of methanolic and hot water mahogany seed extract with any concentration showed the highest efficacy was 50% methanolic seed extract with 63.33% inhibition of the fungal growth. Microscopical examination showed the inhibition of mycelium growth was caused by the changes on hyphae morphology and growth direction which were shrinking and curling due to the cell wall degradation.
Morphological and molecular identification results showed that
Botryodiplodia sp. isolate causing dieback on jabon seedling was Botryodiplodia theobromae Pat. teleomorph Botryosphaeria rhodina (Berk. & MA. Curtis). Morphology of B. theobromae isolate was characterized by the ripe thin-walled conidia with septate size was rangging from 14.6 to 23.3 µm x 8.0 to 12.3 µm and production of oozing on the culture medium which was thick black liquids on the surface of the mycelium colonies. The growth of B. theobromae isolate was more optimum onPotatoes Sucrose Medium.
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Silvikultur Tropika
BIOAKTIVITAS EKSTRAK MAHONI DAN IDENTIFIKASI
JENIS ISOLAT
Botryodiplodia
sp. PENYEBAB
MATI PUCUK PADA BIBIT JABON
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Tesis : Bioaktivitas Ekstrak Mahoni dan Identifikasi Jenis Isolat
Botryodiplodiasp. Penyebab Mati Pucuk pada Bibit Jabon Nama : Aji Winara
NIM : E451120071
Disetujui oleh
Komisi Pembimbing
Prof Dr Ir Achmad, MS Ketua
Dr Syamsul Falah, S.Hut, MSi Anggota
Diketahui oleh
Ketua Program Studi Silvikultur Tropika
Prof Dr Ir Sri Wilarso B R, MS
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
Puji dan syukur penulis panjatkan kepada AllahSubhanahu Wa Ta’alaatas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Desember 2013 ini ialah pengendalian penyakit tanaman, dengan judul Bioaktivitas Ekstrak Mahoni dan Identifkasi Jenis IsolatBotryodiplodiasp. Penyebab Mati Pucuk pada Bibit Jabon.
Terima kasih penulis ucapkan kepada Prof Dr Ir Achmad, MS dan Dr Syamsul Falah, SHut MSi selaku pembimbing yang telah membimbing penulis dalam menyelesaikan studi. Di samping itu, penulis sampaikan terima kasih kepada Pusat Diklat Kehutanan Kementerian Kehutanan yang telah memberikan beasiswa studi dan membantu pembiayaan kegiatan penelitian hingga akhirnya tesis ini dapat disusun dan Kepala Balai Penelitian Teknologi Agroforestry yang telah memberikan kesempatan kepada penulis untuk melanjutkan studi S2. Tak lupa penulis ucapkan terima kasih kepada Kepala Laboratorium Patologi Hutan, Laboratorium Kimia Kayu, Laboratorium Biorin dan Laboratorium Pilot Plan PAU IPB serta Kepala Balai Penelitian Teknologi Perbenihan Bogor yang telah memberikan izin pada penulis untuk melaksanakan kegiatan penelitian di lingkungan kerjanya. Terima kasih pula penulis sampaikan kepada Ibu Ai Rosah Aisah, SHut MSi, Ibu Tutin BScF, Bu Tati BPTP, Bapak Iwan Kustiawan, Bapak Suprihatin, Ibu Pepy, Ibu Encah, Bapak Dr. A. Fadly Yahya, Bapak Galih Ary W Siregar, SPt, Bapak Eter Cahyadi, S.Hut dan rekan-rekan mahasiswa Silvikultur Tropika angkatan 2012 serta rekan-rekan-rekan-rekan mahasiswa S1 dan S2 yang berada dibawah lingkup Lab. Patologi Hutan serta semua pihak yang telah membantu teknis pelaksanaan penelitian ini.
Ungkapan terima kasih yang mendalam kami juga sampaikan kepada istri tercinta yang senantiasa mendukung dan memberikan dorongan moral serta anak-anakku tersayang yang sabar dalam mendampingi penulis. Rasa hormat dan terima kasih penulis sampaikan kepada ayah dan ibu serta seluruh keluarga besar atas segala do’a dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat.
Bogor, Agustus 2014
DAFTAR ISI
DAFTAR TABEL ii
DAFTAR GAMBAR iii
DAFTAR LAMPIRAN iii
1 PENDAHULUAN
Latar Belakang 1
Perumusan Masalah 1
Tujuan Penelitian 2
Hipotesis 2
Manfaat Penelitian 2
2 TINJAUAN PUSTAKA
Mahoni (Swietenia macrophyllaKing.) 3 Jabon (Anthocephalus cadambaRoxb.Miq) 6
FungiBotryodiplodia 8
3 BAHAN DAN METODE
Waktu dan Tempat Penelitian 11
Bahan dan Alat 11
Metode 12
Analisis Data 18
4 HASIL DAN PEMBAHASAN
Hasil 18
Pembahasan 23
5 SIMPULAN DAN SARAN
Simpulan 29
Saran 30
DAFTAR PUSTAKA 30
LAMPIRAN 39
1 Kandungan fitokimia beberapa bagian mahoni 4 2 Sifat farmakologi beberapa bagian mahoni 5 3 Beberapa jenis Botryodiplodia dan Lasiodiplodia penyebab mati
pucuk pada tanaman berkayu 9 4 Beberapa jenis tumbuhan yang memiliki sifat antifungi
B. theobromae 11
5 Skor nilai efektivitas ekstrak mahoni dalam menghambat
pertumbuhan isolatBotryodiplodiasp. 18
DAFTAR GAMBAR
1 Profil mahoni (sumber: Soerianegara & Lemmens 1993) 3 2 Profil jabon (sumber: Soerianegara & Lemmens 1993) 7 3 Profil fungiBotryodiplodiasp. (sumber: Barnet & Hunter 1999) 9 4 Tahapan kegiatan penelitian 12 5 Kondisi bibit jabon pada uji virulensi patogen Botryodiplodia sp.:
a. sehat ( 4 HSI), b. layu (6 HSI) dan d. mati (10 HSI) 13 6 Metode pengukuran diameter radial koloniBotryodiplodiasp. 15 7 Pertumbuhan isolat Botryodiplodia sp. pada media kultur padat (a)
dan cair (b) 19
8 Pengaruh ekstrak metanol beberapa bagian mahoni terhadap penghambatan pertumbuhan isolatBotryodiplodia sp. secarain vitro.
Huruf-huruf di atas balok data menunjukkan pembandingan nilai
tengah antar perlakuan berdasarkan uji duncan pada taraf nyata 0.05 20 9 Pengaruh taraf konsentrasi ekstrak biji mahoni terhadap
penghambatan pertumbuhan radial miselium isolatBotryodiplodiasp. EMB (■ ), EAB (□ ). Huruf-huruf di atas balok data menunjukkan pembandingan nilai tengah antar perlakuan berdasarkan uji Duncan
pada taraf nyata 0.05 21
10 Pengaruh taraf konsentrasi ekstrak dan waktu inkubasi EMB (a) dan EAB (b) terhadap penghambatan pertumbuhan radial miselium
Botryodiplodiasp. -♦- 5%, -■ - 10%, -▲ - 25% dan -x- 50% 21 11 Morfologi hifa Botryodiplodia sp. secara mikroskopis : a. normal,
b. mengerut c. perubahan arah pertumbuhan. Tanda panah
menunjukkan letak morfologi hifa yang tidak normal 22 12 Morfologi isolat Botryodiplodia sp. secara mikroskopis : a. hifa,
b. konidia muda c. konidia matang 23
DAFTAR LAMPIRAN
1 Kadar air dan kadar zat ekstraktif sampel mahoni 40 2 Koloni isolat Botryodiplodia sp. pada media kultur PSA (a), PDA
(b) dan MEA (c) 40
taraf konsentrasi ekstrak biji mahoni. Huruf a sampai dengan e menunjukkan EAB dengan taraf a. konsentrasi 0% (kontrol), b. 5%, c. 10%, d. 25% dan e. 50%. Huruf f sampai dengan j menunjukkan EMB dengan taraf f. konsentrasi 0% (kontrol), g. 5%, h. 10%, i.
25% dan j. 50% 40
4 Hasil sekuensi DNA isolat Botryodiplodia sp. (sbjct) dan kedekatannya dengan data sekuens B. rhodina (query) berdasarkan hasil output BLAST library pada GenBank. Tanda lingkaran
menunjukkan letak perbedaan sekuensi basa. 41 5 Hasil analisis sidik ragam dan uji selang berganda Duncan uji
in vitro pengaruh media kultur dan bioaktivitas ekstrak mahoni
1
PENDAHULUAN
Latar Belakang
Penyakit mati pucuk pada bibit Jabon (Anthocephalus cadamba (Roxb.) Miq.) telah menurunkan kualitas bibit dan merugikan para pegiat budidaya jabon. Jabon saat ini menjadi komoditi hutan tanaman khususnya sebagai penyedia bahan baku kayu lapis, papan partikel, papan semen, papan blok, pulp dan kertas, kayu kontruksi ringan, bahan baku kerajinan, perahu, batang korek api, batang sumpit dan pensil (Soerianegara & Lemmens 1993). Selain itu jabon banyak digunakan sebagai tanaman penghijauan dan rehabilitasi lahan bekas tambang disebabkan sifatnya yang adaptif pada berbagai kondisi tempat tumbuh.
Patogen primer penyakit mati pucuk pada bibit jabon adalah fungi
Botryodiplodiasp. dengan tingkat patogenisitas yang tinggi hingga menimbulkan kematian pada bibit (Aisah 2014). Fungi Botryodiplodia sp. tergolong kelompok fungi anamorfik dan menjadi patogen penyakit tanaman berkayu khususnya di daerah tropis (Ellis et al. 2007). Menurut Anggraeni dan Lelana (2011), fungi
Botryodiplodiasp. dilaporkan menjadi patogen pada beberapa tanaman kehutanan di Indonesia antara lain menyebabkan bercak daun pada pulai (Alstonia sp.), busuk akar pada meranti (Shorea sp.), bercak daun pada merbau (Intsia bijuga
Kuntze.), bercak daun pada bakau (Rhizophora mucronata Lamk.), bledok pada nyamplung (Calophyllum inophyllum Linn.), penyakit batang pada gaharu (Aquilaria malaccensis Lamk.) dan bercak daun pada skubung (Macaranga giganteaMuell.).
Kegiatan pengendalian penyakit mati pucuk pada bibit jabon hingga saat ini masih menggunakan fungisida sintetik. Adapun pemanfaatan fungisida nabati dalam pengendalian penyakit mati pucuk belum dilakukan disebabkan kurangnya informasi tentang potensi fungisida nabati, padahal potensi tumbuhan obat di Indonesia sangat tinggi yang kemungkinan berpotensi pula sebagai bahan baku fungisida nabati, salah satunya adalah mahoni (Swietenia macrophylla King.). Beberapa bagian mahoni telah diketahui secara ilmiah memiliki sifat farmakologi sebagai obat untuk penyakit pada manusia seperti bersifat antifungi, antibakteri, antivirus, antitumor, antikanker, antidiabetes, antioksidan, antimutagenik, antihepatitis C dan anti inflammatori (Moghadamtousiet al. 2013; Eidet al.2013). Adapun bagian mahoni yang telah diketahui bersifat antifungi khususnya terhadap fungi patogen penyakit pada manusia antara lain daun (Tan et al. 2009), kulit batang (Dewanjee et al. 2007) dan biji (Maiti et al. 2007a). Sementara itu pemanfaatan mahoni sebagai fungisida nabati belum banyak diketahui terutama potensinya dalam mengendalikan penyakit mati pucuk pada bibit jabon.
Perumusan Masalah
jabon yang terkena mati pucuk Botryodiplodia adalah berupa nekrotik pada batang yang bergerak secara vertikal menuju daun kemudian pucuk, mengakibatkan batang membusuk, daun menguning dan pucuk mati.
Adanya fakta lapangan mengenai serangan penyakit mati pucuk pada bibit jabon mengharuskan adanya upaya pengendalian penyakit tersebut agar tidak menjadi penyakit yang bersifat epidemik. Penggunaan fungisida sintetik kerap digunakan sebagai pengendalian penyakit pada persemaian tanaman kehutanan secara umum (Darmawan & Anggraeni 2012) termasuk dalam kegiatan pengendalian penyakit jabon pada skala persemaian, padahal Indonesia memiliki potensi tanaman obat yang tinggi sebagai tanaman antimikroba yang kemungkinan dapat pula diaplikasikan dalam pengendalian penyakit pada tanaman. Mahoni merupakan salah satu jenis tanaman kehutanan yang ketersediaannya melimpah sebagai penghasil kayu pertukangan dan berkhasiat pula sebagai tumbuhan obat. Namun kajian mengenai pemanfaatan mahoni sebagai fungisida nabati belum banyak dilaporkan hingga saat ini terutama potensinya dalam mengendalikan penyakit mati pucuk pada bibit jabon.
Tujuan Penelitian
Tujuan penelitian ini antara lain :
1. Menguji bioaktivitas dan efikasi ekstrak mahoni (EM) terhadap isolat
Botryodiplodiasp. penyebab mati pucuk pada bibit jabon secarain vitro.
2. Mengidentifikasi jenis fungi Botryodiplodia sp. secara morfologis dan molekuler.
Hipotesis
Hipotesis penelitian ini antara lain :
1. Ekstrak mahoni efektif dalam menghambat pertumbuhan isolat
Botryodiplodiasp. secarain vitro.
2. Jenis fungi Botryodiplodiasp. penyebab penyakit mati pucuk pada bibit jabon adalahBotryodiplodia theobromaePat.
Manfaat Penelitian
Manfaat penelitian ini antara lain :
1. Memberikan sumbangsih bagi ilmu pengetahuan khususnya di bidang budidaya tanaman hutan dan penyakit tanaman hutan.
2. Memberikan informasi bagi penggiat persemaian tanaman kehutanan tentang penyakit mati pucuk pada jabon dan upaya pengendaliannya dengan menggunakan EM.
3
2 TINJAUAN PUSTAKA
Mahoni (Swietenia macrophyllaKing.)
Taksonomi dan Botani
Taksonomi mahoni (Swietenia macrophylla King.) adalah sebagai berikut (Soerianegara & Lemmens 1993) :
Nama botani : Swietenia macrophyllaKing. Famili : Meliaceae
Subfamili : Swietenoideae
Sinonim : Swietenia beliensisLundell, Swietenia candollei Pittier,
Swietenia krukovii Gleason,Swietenia macrophylla King var. marabaensis Ledoux et. Lobato, Swietenia tessmannii Harms.
Nama dagang : Mahoni (Indonesia), Big Leaf Mahogany(Inggris).
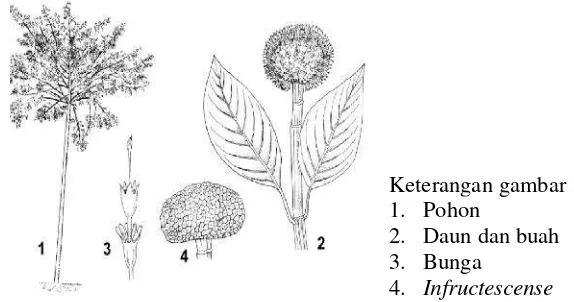
Keterangan gambar : 1. Pohon
2. Bunga dan daun 3. Bagian bunga jantan 4. Bagian bunga betina 5. Buah
6. Biji
Gambar 1 Profil mahoni (sumber: Soerianegara & Lemmens 1993)
Mahoni merupakan tumbuhan asli dari wilayah Amerika Tengah dan Amerika Selatan, yang secara alami tumbuh menyebar dari wilayah Meksiko hingga Bolivia. Mahoni pada habitat aslinya banyak dieksploitasi hingga dimasukkan ke dalam daftar indeks II CITES, namun di Asia Pasifik termasuk di Indonesia, mahoni banyak dibudidayakan sebagai komoditi hutan tanaman dan hutan rakyat khususnya di Pulau Jawa (Krisnawatiet al.2011b).
sampai 1.0 cm, berjumlah banyak. Buah berbentuk kapsul bulat hingga lonjong, berwarna abu-abu hingga coklat kemerahan, panjang 11.6 sampai 38.7 cm dan diameter 6.7 sampai 12.0 cm, memiliki 4 sampai 5 katup kulit buah (Soerianegara & Lemmens 1993).
Kandungan Fitokimia
Kandungan fitokimia mahoni banyak diungkap melalui penelitian baik secara kualitatif maupun kuantitatif hingga kandungan senyawa bioaktif. Secara kualitatif mahoni mengandung senyawa metabolit sekunder antara lain alkaloid, flavanoid, saponin, tanin, antrakuinon dan terpenoid (Tabel 1), sedangkan komponen utama hampir semua bagian adalah limonoid yang merupakan derivasi dariTetracyclic triterpenes mirip denganeuphol (H-20β)atau tirucallol (H-20α)
(Moghadamtousiet al.2013).
Tabel 1 Kandungan fitokimia beberapa bagian mahoni
Bagian
Mahoni telah lama dimanfaatkan sebagai sebagai sumber bahan baku kayu pertukangan dan tergolong kelas kualitas tinggi karena kekuatan kayunya dan keindahan motif coraknya. Kayu mahoni biasa digunakan sebagai bahan baku
plywood, pembuatan pintu rumah, kusen, lantai, alat musik hingga bodi kendaraan dan ornamen lainnya (Krisnawati et al. 2011b), sedangkan bagian akar sering dimanfaatkan untuk membuat meja dan bangku unik. Selain itu pohon mahoni sering digunakan untuk kegiatan rehabilitasi dan reboisasi lahan. Beberapa bagian mahoni memiliki manfaat sebagai obat tradisional seperti biji mahoni bermanfaat sebagai obat malaria di Indonesia dan Bolivia (Munoz et al. 2000; Murnigsih
et al. 2005) serta obat demam dan sakit gigi bagi suku Maya di Meksiko (Kashnapiour & McGee 2004).
Sifat Farmakologi
5
Tabel 2 Sifat farmakologi beberapa bagian mahoni
Bagian Tumbuhan
Aktivitas Farmakologi Sumber Pustaka
Batang Antivirus hepatitis C Wuet al.(2012)
Biji Antimalaria Murnigsihet al.(2005)
Antibabesia Murnigsihet al.(2005)
Antitumor, antimutagenik Gueveraet al.(1996)
Daun Antioksidan Tanet al.(2009);
Antibakteri (S. aureus, Bacillus subtilis,E.coli, P.aeruginosa,)
Tanet al.(2009);
Antibakteri (S. aureus,Sarcina luteus, Bacillus pumilus, B. subtilis, P. aeruginosa, E. coli, Shigella dysenteriae, Shigella soneii, Shigella flexneri, Shigella boydii dan Vibrio colerae) dan Antifungi (C. albicans, A. niger, Penicillium notatumdan
Penicillium funiculosum)
Dewanjeeet al.(2007)
Mantel biji Antibakteri (S. aureusdanE.coli) Nouret al.(2012) Mantel
buah
Ekstrak daun mahoni telah diketahui bersifat antihama tanaman seperti bersifat racun bagi Hypsiphyla grandella (Flores et al. 2012) dan Varoa destructor (ElZalabani et al. 2012). Demikian pula kulit buah mahoni bersifat racun perut bagi beberapa jenis Eurema spp. (Darwiati 2012), Spodoptera frugiferda, Acalymna vittarum dan Artemia salina (Mikolajczak & Reed 1987; Mootoo et al. 1999). Namun sifat ekstrak mahoni sebagai antifungi patogen tumbuhan belum diketahui kecuali sifat antifungi senyawa limonoid dari jenis mahoni daun kecil (Swietenia mahagoni(L) Jacq.) yaitu6-acetylswieteninedan 6-acetyl-3-tygloylswietonolide efektif dalam menghambat fungi patogen pada kacang tanah jenisPuccinia arachidis(Govindachariet al.1999).
Jabon (Anthocephalus cadamba(Roxb.) Miq)
Taksonomi dan Botani
Secara taksonomi jabon dapat dideskripsikan sebagai berikut (Soerianegara & Lemmens 1993) :
Nama botani : Anthocephalus cadamba (Roxb.) Miq Famili : Rubiaceae
Submarga : Cinehonoideae
Sinonim : Anthocephalus chinensis (Lamk.) A Rich. Ex. Walp.,
Anthocephalus macrophyllus (Roxb.) Havil., Nauclea cadamba (Roxb.), Neolamarkcia cadamba (Roxb.) Bosser, Sarcocephalus cadamba (Roxb.) Kurz.,
Anthocephalus indicus A. Rich., Anthocephalus morindaefolius.
Nama daerah : Jabon, jabun, hanja, kelampeyan, kelampaian (Jawa); galupai, harapean, johan, alampain, kelampai, kelempi (Sumatera); ilan, kelampayan, taloh, tawa telan, tuak, tuneh, tuwak (Kalimantan); bance, pute, loeraa, pontua, suge manai, sugi manai, pekaung, toa (Sulawesi); gumpayan, kelapan, mugawe, sencari(Nusa Tenggara); aparabire, masarambi (Papua). (Martawijayaet al.1989).
7
bulat dan lunak, dengan bagian atas terdiri dari empat struktur berongga atau padat. Buah jabon mengandung biji yang sangat kecil, berbentuk kapsul berdaging yang berkelompok rapat bersama untuk membentuk daging buah yang berisi sekitar 8000 biji. Biji kadang berbentuk trigonal atau tidak teratur dan tidak bersayap (Soerianegara & Lemmens 1993).
Keterangan gambar : 1. Pohon
2. Daun dan buah 3. Bunga
4. Infructescense
Gambar 2 Profil jabon (sumber: Soerianegara & Lemmens 1993)
Jabon tersebar secara alami pada beberapa wilayah antara lain Australia, China, India, Indonesia, Malaysia, Papua Nugini, Filipina, Singapura dan Vietnam dengan habitat berupa lahan basah baik permanen maupun musiman dan dapat tumbuh baik pula pada hutan sekunder sekitar pinggiran sungai (Orwaet al.2009). Jabon di Indonesia saat ini memiliki prospek tinggi sebagai komoditi hutan tanaman industri dan tanaman penghijauan karena pertumbuhannya yang cepat, mampu beradaptasi pada beberapa kondisi tempat tumbuh yang marjinal dan perlakuan silvikulturnya yang relatif mudah (Krisnawatiet al.2011a).
Manfaat dan Kegunaan
Pemanfaatan jabon secara besar-besaran sebagai tanaman budidaya di Indonesia dilakukan sejak tahun 1930-an dan hingga saat ini telah menjadi komoditi hutan rakyat dari Sumatera hingga Papua. Jabon memiliki beberapa manfaat antara lain kayu digunakan sebagai bahan baku kayu lapis, konstruksi ringan, pulp dan kertas, langit-langit, kotak, peti, mainan, ukiran, korek api, sumpit dan pensil (Soerianegara & Lemmens 1993). Selain kayu jabon dapat digunakan sebagai bahan baku perahu, bahan papan partikel, papan semen dan papan blok serta sering digunakan sebagai peneduh dan hiasan di tepi jalan di perkampungan-perkampungan ( Kisnawati at al. 2011a). Jabon bermanfaat pula sebagai obat dan hasil uji farmakologi bersifat sebagai antioksidan dan antimikroba (Umachigiet al.2007).
massif sebagaimana komoditi kayu hutan tanaman industri lainnya, namun pengembangan hutan rakyat jabon khususnya di Jawa sangat massif.
Permasalahan Penyakit Jabon
Salah satu tantangan dalam pengembangan hutan jabon adalah gangguan hama dan penyakit. Serangan penyakit pada jabon dewasa tidak banyak dilaporkan melainkan hanya satu jenis yaitu seranganGloeosporium anthocephali
yang menyebabkan defoliasi pada sebagian atau seluruh daun (Soerianegara & Lemmens 1993). Sementara itu serangan penyakit pada tingkat bibit telah dilaporkan oleh Herliyana et al. (2012) dan Aisah (2014) yaitu fungi
Botryodiplodia sp. yang menyebabkan mati pucuk, fungi Rhizoctonia sp. yang menyebabkan penyakit bercak daun dan fungi Fusarium sp. yang menyebabkan penyakit hawar daun serta menurut Anggraeni dan Lelana (2011) yang melaporkan adanya serangan bercak daun pada bibit jabon disebabkan oleh fungi
Colletotrichumsp.
Menurut Aisah (2014), penyakit mati pucuk pada bibit jabon yang disebabkan oleh fungi Botryodiplodia sp. dapat menyebabkan kematian bibit hingga 15% khususnya ditemukan pada persemaian di daerah Bogor. Gejala mati pucuk pada bibit jabon diawali dengan nekrosis pada batang hingga pucuk dan batang mengering hingga tidak mampu menopang daun. Gejala mati pucuk pada bibit jabon ditemukan pada bibit jabon dengan rentang umur 2 sampai 6 bulan.
FungiBotryodiplodia
Taksonomi dan Morfologi
Taksonomi fungi Botryodiplodia (Alexopoulos et al. 1960) adalah sebagai berikut:
Domain : Eukaryota Kingdom : Fungi
Phylum : Deuteromycota Kelas : Deuteromycetes Ordo : Sphaeropsidales Famili : Sphaeropsidaceae Genus :Botryodiplodia
Spesies :Botryodiplodia sp.
Fungi Botryodiplodia (sinonim Lasiodiplodia) merupakan fungi yang bereproduksi secara aseksual (anamorph). Fungi Botryodiplodia memiliki fase seksual atau telemorf yang bergantung pada spesiesnya, seperti fase telemorf jenis
B. theobromaeadalah fungi Botryosphaeria rhodina. JenisBotryodiplodia cukup banyak namun secara taksonomi morfologis cukup membingungkan (Burgess et al. 2006). Berdasarkan penelusuran melalui MycoBank (www.mycobank.org), jumlah jenis Botryodiplodia sebanyak 224 jenis sejak tahun 1884 sedangkan
9
Gambar 3 Profil fungiBotryodiplodiasp. (sumber : Barnet & Hunter 1999)
Fungi Botryodiplodia secara morfologi dicirikan dengan konidia yang khas dan pertumbuhannya yang cepat pada media agar. Jenis B. theobromae
merupakan jenis dominan dari genus Botryodiplodia yang menjadi patogen pada beberapa tanaman berkayu khususnya dominan di daerah tropis (Punithalingham 1980 dalam Burgess et al. 2006). Menurut Gandjar et al. (1999), koloni
B. theobromae pada media OA (Oatmeal Agar) dan PDA (Potatoes Dextrose Agar) membentuk miselia aerial yang lebat dan berwarna coklat tua dengan piknidia muncul berupa klaster dalam stromata, berbentuk bulat dengan leher panjang dan berwarna gelap hitam kehijauan, sedangkan fialid berbentuk silindris dan berukuran 5 sampai 12 µm x 2 sampai 4 µm serta konidia bersel dua bila tua, berukuran 22 sampai 28 µm x 12 sampai 15 µm, berbentuk elips, berwarna coklat tua dan memiliki garis-garis longitudinal. Pematangan konidia B. theobromae
berjalan lambat.
Inang dan Patogenesitas
Fungi Botryodiplodia menjadi patogen pada beberapa tanaman di dunia dengan kisaran inang yang luas. Jenis Botryodiplodia yang paling banyak memiliki inang ialah B. theobromae atau Lasiodiplodia theobromae dengan kisaran inang mencapai 500 tanaman (Ellis et al. 2007). Beberapa jenis
Botryodiplodia atau Lasiodiplodia dilaporkan menjadi patogen mati pucuk pada beberapa tanaman berkayu (Tabel 3).
Tabel 3 Beberapa jenisBotryodiplodia dan Lasiodiplodia penyebab mati pucuk pada tanaman berkayu
No. Jenis Patogen Jenis Inang Sumber Pustaka 1. B. theobromae Sengon (Albizia
falcataria)
Sharma dan Shankaran (1988)
2. B. theobromae Kakao (Theobroma cacao)
Semangun (2000); Mbenon
et al.(2008); Kannanet al.
(2010)
3. B. theobromae Jeruk (Citrusspp.) Alamet al.(2001); Salamiahet al.(2008) 4. B. theobromae Annona squamosadan
Annona cherimola
Haggag dan Nofal (2006)
5. B. theobromae Pear (Prunusspp.) Shahet al.(2010)
1 2
3
No. Jenis Patogen Jenis Inang Sumber Pustaka 6. Botryodiplodiasp. Jabon (A. cadamba) Herliyanaet al.2012 7. L. theobromae Pinus taedaL, pinus
elliotiiElngm
Cillieret al.(1993)
8. L. theobromae Aprikot Jepang, Persik Liet al.(1995) 9. L. theobromae Mangga (Mangifera
indicaL)
Khanzadaet al.(2004); Ismailet al.(2012) 10. L. theobromae Gravepine (Vitis vinifera
L)
Torreset al.(2008); Al-Saadonet al.(2012) 11. L. theobromae Syzygium cordatum Pavlicet al.(2007) 12. L. theobromae Grivellea robusta
Cunn.ex.R.Br
Njuguna (2011)
13. L. theobromae Sawo Mamey (Pouteria sapota)
Pedrazaet al.(2013)
14. Lasiodiplodia pseudotheobromae
Mangga (M. indicaL) Ismailet al.(2012)
15. Lasiodiplodia egyptiacae
Mangga (M. indicaL) Ismailet al.(2012)
Selain itu, fungi Botryodiplodia dilaporkan menjadi penyebab penyakit hawar daun, bercak daun, gummosis, kanker batang dan busuk akar pada beberapa tanaman baik kehutanan, pertanian maupun perkebunan. SeranganBotryodiplodia
sp. pada beberapa tanaman kehutanan di Indonesia menyebabkan beberapa penyakit antara lain lodoh padaPinus merkusii dan busuk pangkal batang pada bibit mahoni (Suharti 1973dalamHadi 1994), bercak daun pada pulai, busuk akar pada meranti, bercak daun pada merbau, bercak daun pada bakau, bledok pada nyamplung, penyakit batang pada gaharu dan bercak daun pada skubung (Anggraeni & Lelana 2011). Sementara itu di India, jenis B. theobromae pernah menyebabkan penyakit kanker dan mati pucuk pada Albizia falcataria secara massif (Sharma & Shankaran 1988).
Sementara itu Dammet al.(2007) mengisolasi beberapa jenisLasiodiplodia
yang menjadi patogen potensial bagi tanaman Prunus di Afrika antara lain
Lasiodiplodia plurivora, L. theobromae, L. crassispora, L. venezuelensis,
L. rumbropurpurea dan L. gonublensis. Demikian pula Begoude et al. (2010) mengisolasi beberapa jenis Lasiodiplodia yang berasosiasi dengan ketapang (Terminalia catappa) di Afrika Selatan dan Madagaskar yaitu jenis
L. pseudotheobromae, L. mahajangana sp nov. L. pseudotheobromae dan
L. theobromae.
Sifat Antifungi Ekstrak Tanaman terhadap FungiBotryodiplodia
11
Tabel 4 Beberapa jenis tumbuhan yang memiliki sifat antifungiB. theobromae
No. Jenis Tumbuhan Bagian Pelarut Konsentrasi Efektif
Daun Air dingin 10% (v/v) Agbeniyi dan Ayodele
Daun Air dingin 25% (v/v) Sangeethaet al.(2013)
3. Lidah Buaya (Aloe vera)
Daun Air dingin 100% (v/v) Ukoima et al.(2013)
Daun Air dingin 10% (v/v) Agbeniyi dan Ayodele
Air dingin 100% (v/v) Ukoima et al.(2013)
3 BAHAN DAN METODE
Waktu dan Tempat Penelitian
Penelitian dilaksanakan selama 8 bulan mulai bulan Desember 2013 sampai dengan Juli 2014. Lokasi penelitian antara lain Laboratorium Patologi Hutan dan Lab. Kimia Kayu Fahutan IPB, Lab. Biorin dan Pilot Plan PAU IPB dan Lab. Penyakit Benih, Balai Penelitian Teknologi Perbenihan Bogor.
Bahan dan Alat
buah, kulit batang dan akar), metanol, aquades steril, bahan-bahan untuk ekstraksi DNA dan bahan-bahan laboratorium umum lainnya. Sedangkan alat yang digunakan antara lain laminar air flow, autoclave, oven, mikroskop cahaya, alat ekstraksi DNA, elektroforesis, mesin PCR dan mesin sekuensi, vacuum pan evaporator, rotary vacuum evaporator, water bath, cawan petri diameter 9 cm, tabungerlenmeyerdan beberapa peralatan laboratorium lainnya.
Metode
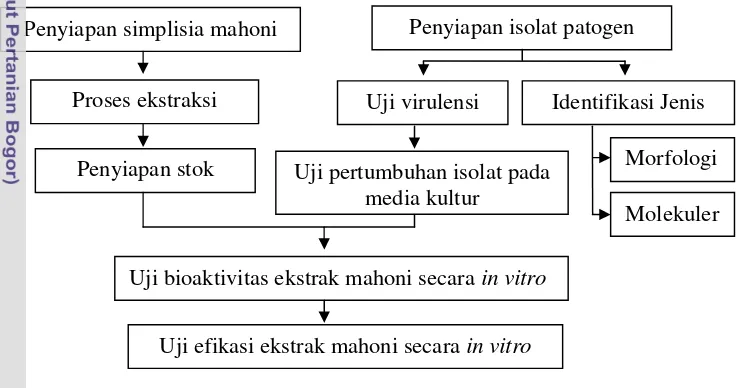
Penelitian ini terdiri atas 6 kegiatan, yaitu: (1) studi pertumbuhan isolat
Botryodiplodia sp. pada media kultur dan uji virulensinya pada bibit jabon, (2) pengumpulan sampel beberapa bagian mahoni di Hutan Penelitian Cigeurendeng Balai Penelitian Teknologi Agroforestry, Ciamis, (3) proses ekstraksi sampel mahoni, (4) uji bioaktivitas EM terhadap pertumbuhan isolat
Botryodiplodiasp. secara in vitro, (5) uji efikasi EM terhadap pertumbuhan isolat
Botryodiplodiasp. secara in vitro, dan (6) identifikasi morfologis dan molekuler isolatBotryodiplodiasp. (Gambar 4).
Gambar 4 Tahapan kegiatan penelitian
Penyiapan Patogen dan Uji Virulensi
IsolatBotryodiplodiasp. patogen mati pucuk pada bibit jabon diperoleh dari Laboratorium Patologi Hutan Fakultas Kehutanan IPB dengan kode isolat
Botryodiplodiasp. JPPon. Perbanyakan isolat dilakukan pada media selektif PDA dan PSA (mengandung antibiotik kloramfenikol 250 mg l-1).
Sebelum isolat Botryodiplodia sp. digunakan pada uji bioaktivitas ekstrak mahoni, dilakukan terlebih dahulu uji virulensi patogen pada bibit jabon berumur 4 bulan dengan metode inokulasi blok agar tempel mengacu pada Michailides (1991). Hasil uji virulensi patogen menunjukkan bahwa isolatBotryodiplodia sp. menyebabkan gejala mati pucuk hingga kematian bibit setelah 10 hari sejak
Uji pertumbuhan isolat pada media kultur
Uji bioaktivitas ekstrak mahoni secarain vitro
Uji efikasi ekstrak mahoni secarain vitro
Morfologi s
Penyiapan isolat patogen
Uji virulensi Proses ekstraksi
sampel
Penyiapan stok ekstrak
Identifikasi Jenis Penyiapan simplisia mahoni
13
inokulasi (HSI) yang menunjukkan bahwa isolat Botryodiplodia sp. masih memiliki virulensi yang tinggi (Gambar 5).
Gambar 5 Kondisi bibit jabon pada uji virulensi patogen Botryodiplodia sp. a. sehat ( 4 HSI), b. layu (6 HSI) dan d. mati (10 HSI)
Penyiapan Ekstrak Mahoni
Sampel mahoni sebagai bahan baku EM diperoleh dari Hutan Penelitian Cigeurendeng Balai Penelitian Teknologi Agroforestry di Kabupaten Ciamis, Jawa Barat. Bagian mahoni yang digunakan antara lain daun, kulit batang, akar dan beberapa bagian buah yaitu kulit buah dan biji. Semua bagian simplisia mahoni diperoleh dari mahoni dengan diamater pohon di atas 30 cm.
Pembuatan EM dilakukan menggunakan dua pelarut yaitu air panas dan metanol mengacu pada Maiti et al. (2007a) dan Falah et al. (2010). Sebelum proses ekstraksi dilakukan, sampel mahoni dikeringudarakan terlebih dahulu selama satu bulan, kemudian dijadikan serbuk dengan ukuran 40 sampai 60 mesh menggunakan alat Willey Mill untuk membantu optimalisasi proses ekstraksi. Kadar air sampel mahoni yang telah dijadikan serbuk diukur sebelum proses ekstraksi dilakukan.
a. Kadar Air Sampel Mahoni
Penetapan kadar air sampel mahoni dilakukan dengan cara mengeringkan cawan porselin pada suhu 102 ± 3 ºC selama 30 menit, kemudian ditimbang setelah sebelumnya didinginkan pada desikator. Serbuk sampel masing-masing sebanyak 2 gram dimasukkan ke dalam cawan porselin kemudian dikeringkan dalam oven selama 3 jam pada suhu 102 ± 3 ºC, didinginkan dalam desikator dan ditimbang. Prosedur ini dilakukan berulang-ulang sampai diperoleh bobot yang tetap.
Kadar air % BKU BKT
BKT x 100%
Keterangan :
BKU = Bobot serbuk kering udara (g) BKT = Bobot serbuk kering oven (g)
b. Ekstraksi Sampel Mahoni
Proses ekstraksi dilakukan dengan teknik maserasi menggunakan dua pelarut yaitu metanol dan air panas. Proses ekstraksi metanol dilakukan dengan
cara sebanyak 400 sampai 500 g serbuk sampel mahoni direndam dalam larutan metanol dengan perbandingan 1:3 (v/v) selama 3x24 jam sehingga diperoleh ekstrak metanol. Selama proses perendaman dilakukan pengadukan menggunakan pengaduk kaca. Pemisahan cairan ekstrak dari residu dilakukan dengan bantuan kertas saring. Ekstrak metanol tersebut kemudian dipekatkan dengan rotary vacuum evaporatorhingga diperoleh ekstrak pekat, kemudian dikeringkan dengan oven pada suhu 40 ºC. Sementara itu proses ekstraksi air panas sampel mahoni dilakukan dengan cara sebanyak 500 g sampel mahoni dilarutkan dengan aquades pada perbandingan 1:3 (v/v), kemudian dipanaskan menggunakan alat waterbath
dengan suhu 100 ºC selama 4 jam. Cairan esktrak disaring dengan kain empat lapis, kemudian cairan ekstrak yang diperoleh dijadikan serbuk dengan alat
vacuum pan evaporatorpada suhu 60 ºC.
c. Kadar Zat Ekstraktif
Penghitungan kadar zat ekstraktif setiap sampel mahoni dilakukan terhadap hasil ekstrak mahoni dengan pelarut air panas dan pelarut metanol.
Kadar Zat Ekstraktif % = BKE
BKSx 100%
Keterangan :
BKE = Bobot kering tanur zat ekstraktif (g) BKS = Bobot kering tanur serbuk sampel (g)
d. Penyiapan Stok Ekstrak
Stok EM yang akan digunakan dalam setiap pengujian dibuat dengan cara sebanyak 5000 mg EM dilarutkan hingga homogen dengan 100 ml aquades steril panas. Khusus untuk ekstrak metanol mahoni disterilisasi dengan menambahkan sebanyak 5 ml metanol terlebih dahulu sebelum ditambahkan aquades, sedangkan sterilisasi EM yang dihasilkan dari pelarut air panas dilakukan pada autoclave
dengan suhu 121 ºC tekanan 1 atm selama 15 menit mengacu pada Achmad dan Suryana (2009).
Pertumbuhan Isolat pada Media Kultur
Uji pengaruh media kultur terhadap pertumbuhan isolat Botryodiplodia sp. dilakukan pada media kultur padat dan cair selektif antara lain PDA, PSA, MEA, PDB, PSB dan MEB mengacu pada Alamet al.(2001) dan Marksonet al. (2012). Rancangan penelitian yang digunakan ialah rancangan acak lengkap (RAL) dengan tiga perlakuan dan tiga ulangan untuk media padat, serta tiga perlakuan dan lima ulangan untuk media cair. Parameter uji yang diukur antara lain diameter koloni miselium pada media padat dan bobot kering biomassa miselium pada media cair.
15
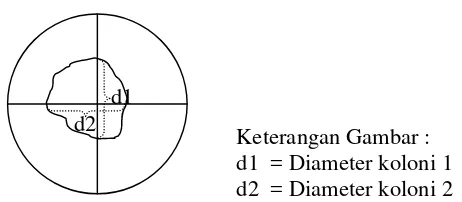
Keterangan Gambar : d1 = Diameter koloni 1 d2 = Diameter koloni 2
Gambar 6 Metode pengukuran diameter radial koloniBotryodiplodiasp.
Selanjutnya diamater radial koloni dihitung dengan menggunakan rumus :
Diamater Koloni = d1 + d2 2
Sedangkan proses inkubasi isolat pada media kultur cair dilakukan selama 10 hari. Pengukuran bobot biomassa miselium dilakukan setelah masa inkubasi selesai dengan cara menyaring miselium dengan kertas saring dan miselium yang tersaring dioven pada suhu 60 ºC selama 24 jam. Bobot kering biomassa miselium dihitung dengan cara mengurangi bobot kering biomassa miselium pada kertas saring setelah dioven dengan bobot kering kertas saring setelah dioven.
Bioaktivitas Ekstrak Mahoni
Uji bioaktivitas EM terhadap isolat Botryodiplodia sp. dilakukan secara
in vitropada media kultur padat selektif PSA sesuai rekomendasi uji pertumbuhan isolat pada media kultur. Metode uji yang digunakan adalah teknik peracunan makanan mengacu pada Achmad dan Suryana (2009). Rancangan penelitian yang digunakan ialah RAL dengan enam perlakuan dan tiga ulangan. Perlakuan yang diberikan antara lain kontrol, ekstrak metanol daun, kulit batang, kulit buah, biji dan akar mahoni pada taraf konsentrasi 16.67 % (v/v).
Ujiin vitrodilakukan pada cawan petri berdiameter 9 cm yang berisi media kultur PSA selektif dengan cara sebanyak 2 ml ekstrak mahoni ditambahkan pada 10 ml media kultur, kemudian dihomogenkan dengan cara penggoyangan manual dan dibiarkan memadat. IsolatBotryodiplodiasp. berdiameter 6 mm diletakkan di tengah media kultur, kemudian dilakukan proses inkubasi pada suhu ruang hingga koloni miselium pada perlakuan kontrol memenuhi cawan petri dan dilakukan proses pengukuran diameter koloni. Sementara itu penghitungan nilai penghambatan ekstrak mahoni terhadap pertumbuhan isolat Botryodiplodia sp. mengacu pada Dubeyet al. (2009).
P (%) = C T
C × 100%
Keterangan :
P= Penghambatan pertumbuhan (%) C= Diamater radial koloni kontrol (mm) P= Diameter radial koloni perlakuan (mm)
1
Efikasi Ekstrak Mahoni
Uji efikasi ekstrak mahoni terhadap pertumbuhan Botryodiplodia sp. dilakukan secara in vitro dengan metode peracunan makanan. Rancangan penelitian yang digunakan ialah RAL pengamatan berulang dengan sepuluh perlakuan ekstrak mahoni dan tiga kali ulangan. Ekstrak mahoni yang dijadikan sebagai perlakuan adalah ekstrak mahoni yang memberikan penghambatan terbaik pada perlakuan uji bioaktivitas EM sebelumnya serta EM dengan pelarut air panas untuk sampel mahoni yang sama. Perlakuan yang diberikan berupa konsentrasi ekstrak air panas dan metanol mahoni pada taraf 0%, 5%, 10%, 25% dan 50% mengacu pada Sangeetha et al (2013). Penyiapan konsentrasi ekstrak dilakukan dengan cara mencampur EM dengan media kultur PSA steril (v/v) sesuai konsentrasi yaitu sebanyak 0.0 ml, 0.5 ml, 1.0 ml, 2.5 ml dan 5.0 ml EM dicampurkan dengan 10.0 ml, 9.5 ml, 9.0 ml, 7.5 ml, dan 5.0 ml PSA untuk menghasilkan media padat nutrisi teracuni EM pada konsentrasi 0% (kontrol), 5%, 10%, 25% dan 50%.
Semua proses penyiapan media kultur uji efikasi dilakukan secara steril padalaminar air flow cabinet. Parameter uji yang diukur adalah diameter koloni miselium setiap periode 12 jam dan pengukuran dihentikan pada saat koloni miselium perlakuan kontrol memenuhi cawan petri. Selanjutnya nilai efikasi ekstrak mahoni terhadap pertumbuhan isolat dihitung dengan rumus penghambatan pertumbuhan isolat mengacu pada Dubeyet al(2009).
Identifikasi Jenis Patogen
Identifikasi jenis patogen dilakukan hingga tingkat spesies dengan pendekatan morfologis dan molekuler DNA. Identifikasi morfologis dilakukan secara makroskopis dan mikroskopis, sedangkan isolasi dan sekuensi DNA dilakukan sebagai upaya konfirmasi jenis patogen.
a. Identifikasi Morfologis
Identifikasi jenis dan morfologi patogen Botryodiplodia sp. dilakukan pada media kultur selektif. Pengamatan pertumbuhan dan morfologi isolat yang berada pada media selektif serta identifikasi jenis mengacu pada Gandjar et al. (1999), Shah et al. (2010) dan El-Morsi dan Ibrahim (2012). Beberapa karakter morfologi yang diamati antara lain koloni miselium, hifa,oozingdan konidia.
Pengamatan koloni miseliumBotryodiplodiasp. pada media kultur dilakukan terhadap warna koloni permukaan atas dan bawah cawan petri, arah pertumbuhan dan kecepatan pertumbuhan. Pengamatan dan pemotretan struktur fungi dilakukan di bawah mikroskop dengan menyiapkan preparat fungi terlebih dahulu. Hifa dan konidia dipotret dan diukur ciri morfologinya meliputi panjang, lebar, bentuk dan tebal dinding.
b. Identifikasi Molekuler
17
(1992) dengan modifikasi laboratorium. Tahapan analisis DNA meliputi persiapan kultur, ekstraksi DNA, elektroforesis, PCR (Polymerase Chain Reaction) dan sekuensi DNA.
1) Persiapan Kultur
Isolat Boytyodiplodia sp. diremajakan pada media PDB dan dilakukan proses inkubasi pada suhu 30 ºC selama 2 sampai 3 hari. Selama proses inkubasi, kultur fungi dilakukan penggoyangan pada kecepatan 1500 rpm.
2) Ekstraksi DNA
Ekstraksi DNA dilakukan dengan cara memanen miselium isolat yang telah dikulturkan sebelumnya dengan kertas saring, kemudian sebanyak 0.1 g miselium digerus hingga halus dengan bantuan N2 cair. Miselium yang sudah halus di
masukan ke dalam tabung dendorf berukuran 1.5 ml kemudian ditambahkan 600 µl buffer lisis (CTAB 2%) dan dilakukan proses inkubasi pada suhu 65 ºC selama 30 menit. Selanjutnya tabung dipindahkan ke dalam es selama 5 menit kemudian ditambahkan 600 µl Kloroform:Isoamilalkohol (C:I) dan dibolakbalik secara perlahan, setelah itu disentrifugasi dengan kecepatan 10 000 rpm selama 10 menit. Fase atas dipindahkan ke dalam tabung baru dan ditambahkan 600 µl perbandingan Fenol:Kloroform:Isoamilalkohol (F:K:I) kemudian dibolak balik secara perlahan dan disentrifugasi dengan kecepatan 10 000 rpm selama 10 menit. Selanjutnya fase atas dipindahkan ke dalam tabung baru dan ditambahkan NaOAce 2 M sebanyak 0.1 kali dan Ethanol 100% sebanyak 2 sampai 3 kali dari volume cairan yang diperoleh. Fase atas disimpan pada pendingin selama minimal 1 sampai 2 jam dan setelah itu disentrifugasi dengan kecepatan 10 000 rpm selama 20 sampai 30 menit pada suhu 4 ºC. Pelet yang diperoleh ditambahkan 500 µl Ethanol 70% kemudian disentrifugasi selama 5 menit. Pelet DNA dikeringkan pada pengering vakum selama 10 sampai 15 menit, kemudian ditambahkan dH2O
lalu diresuspensi. Resuspensi DNA ditambahkan Rnase 1 mg ml-1 sebanyak 0.2 kali dari volume suspense dan dilakukan proses inkubasi pada suhu 37 ºC selama 10 menit. Selanjutnya Rnasediinaktifasi pada suhu 70 ºC selama 10 menit.
3) Elektroforesis
Proses elektroforesis dilakukan dengan cara 1% agaros dilarutkan ke dalam buffer TAE, kemudian dipanaskan hingga bening dan dituangkan ke dalam cetakan serta dibiarkan hingga gel memadat. Selanjutnya sampel DNA dimasukan kedalam gel beserta marka DNA kemudian dielektroforesis selama 30 menit pada tegangan 100 V. Gel diamati dan dipotret dengan menggunakan alat foto gel.
4) PCR
Template DNA 1.0 µl dicampurkan dengan 1.0 µl dNtp 2 mM, 10x1.0 µl Buffer taq polymerase, 0.5 µl primer dengan konsentrasi 10 pmol µl-1, 0.2 µl taq polymerase konsentrasi 5 U µl-1dan 6.3 µl dH2O, kemudian dimasukkan ke dalam
5) Sekuensi DNA dan Identifikasi Jenis
Sampel DNA dikirim ke perusahaan yang menyediakan jasa sekuensi dan hasil sekuensi DNA diunggah pada GenBank (situs internet www. ncbi.nlm.nih.gov/BLAST) untuk mengetahui kedekatan jenis fungi dengan fungi yang telah terdata padaGenBank.
Pangamatan Mikroskopis
Pengamatan mikroskopis isolatBotryodiplodiasp. yang tumbuh pada media kultur dilakukan untuk mengetahui karakteristik morfologi hifa dan konidia serta morfologi hifa yang tidak normal akibat peracunan nutrisi oleh EM. Pengamatan morfologi hifa setiap perlakuan dilakukan dengan mikroskop cahaya pada media gelas preparat.
Analisis Data
Semua data hasil uji penghambatan EM terhadap pertumbuhan miselium
Botryodiplodiasp. dilakukan analisis ragam pada tingkat kepercayaan 95% sesuai dengan model rancangan penelitian RAL dan RAL pengamatan berulang mengacu pada Mattjik dan Sumertajaya (2002), apabila perlakuan secara umum berpengaruh nyata terhadap parameter uji maka dilanjutkan dengan uji selang berganda Duncan untuk mengetahui signifikansi perbedaan diantara perlakuan.
Efektivitas EM dalam menghambat pertumbuhan isolat Botryodiplodia sp. secara in vitrodiukur dengan kategorisasi efektivitas ekstrak tanaman (Tabel 5) mengacu pada Sangoyomi (2004)dalamOkigbo dan Emeka (2010).
Tabel 5 Skor nilai efektivitas ekstrak mahoni dalam menghambat pertumbuhan isolatBotryodiplodiasp.
Efektivitas Uraian
Tidak efektif Penghambatan≤ 0% Rendah Penghambatan > 0%–20% Sedang Penghambatan > 20%–50% Cukup Penghambatan > 50%–<100% Tinggi Penghambatan 100 %
4 HASIL DAN PEMBAHASAN
Hasil
Pertumbuhan Isolat pada Media Kultur
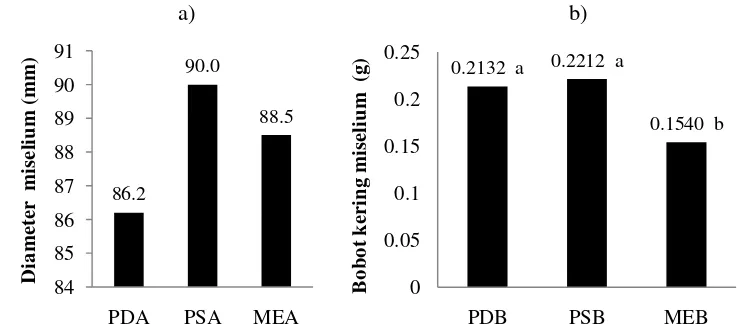
19
nyata namun pertumbuhan isolatBotryodiplodiasp. pada media kultur PSA lebih cepat dibandingkan pertumbuhannya pada media PDA dan MEA. Koloni miselium isolat Botryodiplodia sp. pada media PSA memenuhi cawan petri berdiamater 9 cm setelah 3 hari masa inkubasi, sedangkan pada media PDA dan MEA koloni isolat Botryodiplodia sp. memenuhi cawan petri setelah 3.5 hari masa inkubasi.
Gambar 7 Pertumbuhan isolatBotryodiplodiasp. pada media kultur padat (a) dan cair (b)
Sementara itu pertumbuhan miselium isolat Botryodiplodia sp. pada media kultur cair menunjukkan hasil yang berbeda dengan pertumbuhan pada media kultur padat yaitu terjadi pengaruh yang nyata antara perlakuan media kultur cair dengan bobot kering biomassa isolat. Pertumbuhan isolat Botryodiplodia sp. pada media PSB menunjukkan bobot kering miselium lebih besar dibandingkan bobot miselium pada media PDB dan MEB meskipun secara statistik bobot miselium pada media PSB dan PDB tidak berbeda nyata, sedangkan terhadap bobot miselium pada media MEB menunjukkan hasil yang berbeda nyata. Secara umum media kultur kentang sukrosa (Potatoes Sucrose Medium) baik padat maupun cair menunjukkan hasil yang optimal bagi pertumbuhan isolat
Botryodiplodiasp.
Bioaktivitas Ekstrak Mahoni
Gambar 8 Pengaruh ekstrak metanol beberapa bagian mahoni terhadap penghambatan pertumbuhan isolat Botryodiplodia sp. secara
in vitro. Huruf-huruf di atas balok data menunjukkan pembandingan nilai tengah antar perlakuan berdasarkan uji selang berganda Duncan pada taraf nyata 0.05
Gambar 8 menunjukkan semua sampel ekstrak dapat menghambat pertumbuhan isolat meskipun sebagian besar nilai persentase penghambatannya berbeda nyata secara statistik kecuali untuk pengaruh ekstrak biji dan akar yang menunjukkan hasil yang tidak berbeda nyata. Ekstrak metanol kulit buah mahoni memberikan pengaruh penghambatan yang terendah terhadap pertumbuhan isolat
Botryodiplodia sp. dibandingkan ekstrak lainnya, demikian pula ekstrak metanol daun dan kulit batang mahoni memberikan pengaruh yang berbeda jika dibandingkan dengan ekstrak biji dan akar.
Meskipun ekstrak metanol biji mahoni memiliki pengaruh yang tidak berbeda nyata secara statistik jika dibandingkan dengan ekstrak akar, namun ekstrak metanol biji mahoni yang akan digunakan dalam uji efikasi selanjutnya disebabkan nilai penghambatan pertumbuhan isolat Botryodiplodia sp. yang dihasilkan oleh ekstrak biji mahoni lebih besar dibandingkan dengan ekstrak akar mahoni. Disamping itu kajian mengenai kandungan fitokimia biji mahoni telah banyak dilakukan sebagai acuan dibandingkan kandungan fitokimia akar mahoni yang masih sangat jarang dilakukan.
Efikasi Ekstrak Biji Mahoni
Ekstrak metanol biji mahoni memiliki aktivitas antifungi tertinggi terhadap pertumbuhan isolat Botryodiplodia sp. dibandingkan sampel ekstrak mahoni lainnya, namun nilai persentase penghambatannya masih rendah (18.48%) sehingga diperlukan uji efikasi pada beberapa taraf konsentrasi yang berbeda dan pengembangan dengan jenis pelarut ekstrak yang berbeda yaitu pelarut air panas. Penggunaan air panas sebagai pelarut tambahan dalam mengekstrak biji mahoni dilakukan guna kepentingan aplikasi praktis dan komparasi pengaruh efikasi.
Adapun hasil uji efikasi ekstrak biji mahoni (EBM) baik dengan pelarut air panas (EAB) maupun pelarut metanol (EMB) terhadap isolat Botryodiplodia sp.
menunjukkan adanya pengaruh yang nyata perlakuan ekstrak terhadap penghambatan pertumbuhan miselium secara in vitro(Gambar 9). Disamping itu berdasarkan uji selang berganda Duncan pada taraf nyata 0.05, perlakuan EAB dan EMB menunjukkan hasil yang berbeda.
5.14b 6.29b
Daun Kulit Batang Biji Kulit Buah Akar
21
Gambar 9 Pengaruh taraf konsentrasi ekstrak biji mahoni terhadap penghambatan pertumbuhan radial miselium isolat Botryodiplodia sp. EMB (■ ),
EAB (□ ). Huruf-huruf di atas balok data menunjukkan pembandingan nilai tengah antar perlakuan berdasarkan uji selang berganda Duncan pada taraf nyata 0.05
Gambar 9 menunjukkan secara umum adanya perbedaan pengaruh diantara ekstrak metanol dan air panas biji mahoni terhadap pertumbuhan isolat
Botryodiplodiasp. dengan nilai penghambatan tertinggi dihasilkan oleh perlakuan EMB pada taraf konsentrasi 50% yaitu dapat menghambat pertumbuhan isolat sebesar 63.33%. Sedangkan perlakuan EAB pada taraf konsentrasi 50% menunjukkan pengaruh yang sama secara statistik dengan perlakuan EMB 25% meskipun nilai persentase penghambatannya secara nominal berbeda. Merujuk pada kriteria efektivitas penghambatan ekstrak pada Tabel 5, maka EMB cukup efektif dalam menghambat pertumbuhan isolat Botryodiplodia sp., sedangkan EAB termasuk kategori efektivitas sedang.
Gambar 10 Pengaruh taraf konsentrasi ekstrak dan waktu inkubasi EMB (a) dan EAB (b) terhadap penghambatan pertumbuhan radial miselium
Selain itu Gambar 9 dan 10 menunjukkan adanya tren peningkatan nilai penghambatan dari kedua jenis ekstrak seiring dengan meningkatnya taraf konsentrasi ekstrak. Hal ini menunjukkan diperlukan adanya kajian lanjutan mengenai taraf konsentrasi ekstrak yang lebih tinggi untuk mengetahui nilai penghambatan optimum dari EMB terhadap pertumbuhan isolatBotryodiplodiasp. secarain vitro.
Berdasarkan pengamatan pertumbuhan isolat Botryodiplodia sp. secara berulang setiap 12 jam pada setiap perlakuan ekstrak biji mahoni, diperoleh hasil yang menunjukkan adanya pengaruh perlakuan dan waktu inkubasi terhadap penghambatan pertumbuhan miselium isolat Botryodiplodia sp. (Gambar 10). Pengaruh waktu inkubasi ekstrak biji mahoni ditunjukkan dengan adanya penurunan nilai penghambatan pada semua taraf konsentrasi kedua ekstrak biji mahoni hingga jam ke-48. Penurunan persentase penghambatan EMB pada taraf konsentrasi 50% menunjukkan nilai yang berbeda dan relatif tidak mengalami penurunan yang drastis sebagaimana terjadi pada EAB. Hal ini menunjukkan secara in vitro pengaruh EMB terhadap penghambatan pertumbuhan isolat
Botryodiplodiasp. lebih stabil dibandingkan EAB.
Mikroskopis Morfologi Hifa
Hasil pengamatan miskroskopis terhadap morfologi hifaBotryodiplodia sp. yang mendapatkan perlakuan EBM menunjukkan adanya bentuk morfologi hifa yang tidak normal yaitu berupa pengerutan hifa dan arah pertumbuhan hifa yang melingkar (Gambar 11). Morfologi hifa yang tidak normal ditemukan pada setiap perlakuan EBM baik EMB maupun EAB. Selain adanya morfologi hifa yang tidak normal, terlihat pula adanya kemampuan hifa untuk tumbuh kembali sebagai hifa normal setelah mengalami pengerutan (Gambar 11c). Demikian pula pada hifa yang mengalami pertumbuhan yang melingkar masih terjadi pertumbuhan normal meskipun secara radial pertumbuhannya akan mengalami hambatan.
Gambar 11 Morfologi hifa Botryodiplodia sp. secara mikroskopis : a. normal, b. mengerut c. perubahan arah pertumbuhan. Tanda panah menunjukkan letak morfologi hifa yang tidak normal.
Identifikasi Jenis Patogen
Karakteristik isolatBotryodiplodia sp. yang tumbuh pada media kultur agar menunjukkan pertumbuhan radial miselium yang cepat dan aerial. Koloni miselium muda berwarna putih kapas hingga berumur ± 7 hari dan berwarna abu-abu hingga hitam pekat pada miselium yang tua. HifaBotryodiplodiasp. bersekat, hialin ketika muda dan coklat kehijauan jika sudah tua. Salah satu penciri spesifik dari isolat Botryodiplodia sp. adalah pada koloni miselium yang sudah tua (> 2 bulan) muncul oozing pada permukaan koloni yang berisi cairan pekat
b
23
berwarna hitam. Penciri spesifik lain dari isolat Botryodiplodia sp. adalah morfologi konidia yang berbentukellipsoidatauavoid, hialin ketika muda dengan ukuran 12.5 µm x 9.5 µm dan bersel dua (septat) serta berwarna coklat tua ketika sudah matang, berdinding tipis dan berukuran 14.6 sampai 23.3 µm x 8.0 sampai 12.3 µm (Gambar 12). Berdasarkan ciri spesifik isolat Botryodiplodia sp. dan mengacu pada karakteristik B. theobromae maka isolat tersebut tergolong jenis
B. theobromae.
Gambar 12 Morfologi isolat Botryodiplodia sp. secara mikroskopis : a. hifa, b. konidia muda, c. konidia matang.
Sementara itu hasil isolasi dan sekuensi DNA isolat Botryodiplodia sp. dengan kode gen M114 18Sr RNAsetelah diunggah padaGenBank menunjukkan hasil bahwa isolat Botryodiplodia sp. memiliki kedekatan jenis sebesar 99% dengan fungi Botryosphaeria rhodina (Berk. & MA Curtis) yang merupakan teleomorf dariB. theobromae. Jumlah total basa isolat Botryodiplodia sp. adalah sebanyak 547 basa. Adapun perbedaan urutan DNA antara isolat patogen yang menjadi sampel penelitian dengan database GenBank pada BLAST library
terletak pada perbedaan sekuensi basa ke-87 dan 119. Pada sekuensi basa ke-87 terjadi insersi, sedangkan pada sekuensi basa ke-119 terjadi substitusi dari Citosin menjadi Timina (Lampiran 4).
Mengacu pada hasil identifikasi morfologis dan molekuler yang menunjukkan hasil yang sama maka isolat Botryodiplodia sp. yang menjadi penyebab penyakit mati pucuk pada bibit jabon adalah jenis B. theobromae
(teleomorf B. rhodina).
Pembahasan
Pertumbuhan Isolat pada Media Kultur
Pertumbuhan fungi melibatkan banyak faktor yang menentukan seperti faktor organisme itu sendiri dan lingkungan (Griffin 1991). Media kultur dapat dijadikan sebagai sarana untuk mengukur pertumbuhan fungi berdasarkan fungsi waktu baik pada media kultur padat maupun media kultur cair (Chang & Miles 2004). Hasil pengukuran pertumbuhan isolat Botryodiplodia sp. pada media kultur padat menunjukkan bahwa media PSA menjadi media yang terbaik bagi pertumbuhan radial miselium isolat Botryodiplodia sp. Hal ini senada dengan hasil penelitian Khanzada et al. (2006) bahwa isolat B. theobromae Pat. tumbuh optimum pada media PSA dengan produksi konidia yang sedang. Namun hasil penelitian Latha et al. (2013) menunjukkan hasil yang berbeda yaitu isolat
b
L. theobromae tumbuh optimum pada media kultur PDA dibandingkan PSA. Meskipun hasil Lathaet al. (2013) berbeda dengan penelitian ini namun hasil uji beda antar perlakuan media secara statistik menunjukkan hasil yang sama yaitu pertumbuhan L. theobromae dan Botryodiplodia sp. pada media PDA tidak berbeda nyata dengan media PSA, sedangkan Alam et al. (2001) melaporkan pertumbuhan B. theobromae pada media PDA lebih cepat dibandingkan media lainnya meskipun tidak dibandingkan dengan media PSA.
Pertumbuhan isolat Botryodiplodia sp. pada media PSA lebih cepat dibandingkan pada media PDA kemungkinan disebabkan oleh sumber karbon yang terkandung di dalam media tersebut. Alam et al. (2001) melaporkan bahwa kecepatan pertumbuhan radial miselium B. theobromae menurun seiring dengan bertambahnya kadar glukosa pada media kultur. Demikian pula menurut Lathaet al. (2013) bahwa pertumbuhan radial miselium L. theobromaepada media kultur padat dengan sumber karbon sukrosa lebih cepat dibandingkan sumber karbon glukosa.
Sementara itu bobot biomassa miselium Botryodiplodia sp. pada media cair menunjukkan bahwa pertumbuhan isolat pada media PSB lebih baik dibandingkan media PDB dan MEB meskipun secara statistik bobot miselium pada media PSB dan PDB tidak berbeda nyata. Adanya perbedaan bobot biomassa miselium yang dihasilkan antara media PDB dengan MEB senada dengan Sahaet al. (2008) yang melaporkan bahwa bobot miselium L. theobromae pada media PDB lebih berat dibandingkan pada media MEB.
Secara umum, pertumbuhan miselium isolat Botryodiplodia sp. pada beberapa media kultur padat dan cair menunjukkan bahwa media kultur kentang sukrosa (Potatoes Sucrose Medium)menghasilkan pertumbuhan miselium terbaik dibanding media lainnya baik pada pertumbuhan radial maupun bobot biomassa. Ketiga jenis media kultur tersebut memiliki sumber karbon yang berbeda yaitu sukrosa, dekstrosa dan maltosa. Menurut Chang dan Miles (2004), sumber karbon merupakan unsur yang penting bagi struktur dan sumber energi pertumbuhan sel fungi. Sukrosa menjadi sumber karbon penting bagi pertumbuhan isolat
Botryodiplodia sp. pada media kultur yang ditunjukkan dengan pertumbuhan miselium yang lebih cepat dan bobot miselium yang lebih berat, meskipun berbeda dengan hasil DaCunha et al. (2012) dan Saha et al. (2008) yang melaporkan bahwa bobot miseliumL. theobromaepada media cair dengan sumber karbon glukosa dan maltosa lebih baik dibandingkan sumber karbon sukrosa. Meskipun secara umum glukosa menjadi sumber karbon yang utama bagi banyak fungi pada media kultur karena tergolong gula sederhana (Chang dan Miles 2004), namun secara khusus pertumbuhan isolat Botryodiplodia sp. lebih optimum pada media dengan sumber sukrosa dibandingkan glukosa.
Sukrosa merupakan sumber karbon yang tergolong disakarida sehingga metabolisme disakarida oleh fungi dilakukan dengan cara hidrolisis oleh enzim invertase (disebut juga sakarase atau sukrose) menjadi monomernya yang kemudian diangkut ke dalam sel (Floreset al.2000). Menurut Oetari (2006), tidak banyak jenis fungi yang mampu menghidrolisis sukrosa. Adapun beberapa jenis fungi lain yang tumbuh lebih baik pada media cair dengan sumber karbon berupa sukrosa dibandingkan glukosa dan maltosa diantaranya adalah Hericium erinaceus (Huang et al. 2007), Coriolus versicolor (Wang et al. 2012) dan
25
Bioaktivitas Ekstrak Mahoni
Hasil uji bioaktivitas menunjukkan bahwa semua ekstrak sampel mahoni dapat menghambat petumbuhan isolat Botryodiplodia sp. secara in vitro atau ekstrak metanol daun, kulit batang, kulit buah, biji dan akar mahoni memiliki sifat antifungi. Adanya aktivitas antifungi beberapa bagian mahoni senada dengan hasil penelitian Tan et al. (2009) dan Ayyappadhas et al. (2012) bahwa ekstrak daun mahoni bersifat antifungi khususnya terhadap jenis C. albicans, A. flavus, A. niger dan T. mentagrophyte. Di samping itu Maiti et al. (2007a) melaporkan bahwa ekstrak metanol biji mahoni dapat menghambat pertumbuhan fungi
C. albicans, A. niger, A. flavus dan C. albidus secara in vitro. Demikian pula Dewanjee et al. (2007) melaporkan bahwa ekstrak metanol kulit batang dapat menghambat pertumbuhan fungi C. albicans, A. niger, P. notatum dan
P. funiculosum. Adapun informasi mengenai sifat antifungi ekstrak kulit buah dan akar mahoni belum ada laporan melalui publikasi ilmiah.
Adanya aktivitas antifungi dari beberapa ekstrak bagian mahoni menunjukkan bahwa semua bagian mahoni mengandung metabolit sekunder yang bersifat antifungi Botryodiplodia sp. Komponen utama yang terkandung pada beberapa bagian mahoni adalah limonoid seperti terdapat pada daun, biji, dan ranting meskipun kandungan tipe limonoid pada biji lebih banyak (Moghadamtousi et al. 2013). Menurut Harborne (1987), limonoid adalah turunan dari limonin yang merupakan senyawa pahit dan larut dalam lemak serta turunan dari triterpenoid yang banyak dijumpai pada tanaman famili Meliaceae
dan Euphorbiaceae. Triterpenoid merupakan komponen aktif dalam tumbuhan obat tumbuhan tinggi yang berpotensi sebagai senyawa antifungi, antimalaria, antidiabetes dan antiserangga (Robinson 1995). Di samping itu, ekstrak metanol beberapa bagian mahoni mengandung senyawa fenol, tanin dan flavonoid (Chen
et al. 2010). Menurut Vickery dan Vickery (1981), senyawa-senyawa fenolat seperti fenol, flavonoid dan tanin digunakan tumbuhan tingkat tinggi sebagai pertahanan alami terhadap serangan fungi melalui mekanisme gangguan terhadap fungsi metokondria fungi atau kerja respirasi sel sehingga pertumbuhan fungi menjadi terganggu.
Sementara itu kulit batang mahoni disamping mengandung terpenoid yang bersifat antifungi, mengandung pula komponen polifenol seperti
swietemacrophyllanin, catechin dan epicatechin (Falah et al. 2008). Senyawa katekin tergolong flavonoid yang tanwarna dan terdapat pada seluruh dunia tumbuhan terutama pada tumbuhan berkayu serta telah dikenal sebagai komponen metabolit sekunder tanaman yang bersifat obat beberapa penyakit pada manusia termasuk bersifat antifungi (Robinson 1995). Dewanjee et al.(2007) melaporkan bahwa ekstrak metanol kulit batang mahoni memberikan efek antifungi yang berbeda dengan efikasi terbaik terhadap fungi C. albicans pada konsentrasi 2000 µg ml-1.
Meskipun sifat antifungi ekstrak daun, kulit batang dan biji telah dilaporkan sebelumnya, namun sampel fungi yang digunakan dalam uji berasal dari isolat patogen penyakit pada manusia bukan patogen penyakit tanaman, sehingga adanya aktivitas antifungi ekstrak beberapa sampel mahoni terhadap isolat