DAYA TAHAN PEMBEKUAN SEMEN EMPAT GENETIK
AYAM LOKAL PADA PROGRAM KRIOPRESERVASI
PLASMA NUTFAH INDONESIA
JUNAEDI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul “Daya Tahan Pembekuan Semen Empat Genetik Ayam Lokal pada Program Kriopreservasi Plasma Nutfah Indonesia” adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Agustus 2015
Junaedi
RINGKASAN
JUNAEDI. Daya Tahan Pembekuan Semen Empat Genetik Ayam Lokal pada Program Kriopreservasi Plasma Nutfah Indonesia. Dibimbing oleh CECE SUMANTRI, ASEP GUNAWAN dan RADEN IIS ARIFIANTINI.
Ayam merupakan ternak yang sangat umum dijumpai di Indonesia, serta telah terbukti mempunyai potensi yang tinggi sebagai penghasil daging dan telur. Salah satu upaya pelestarian plasma nutfah ayam adalah dengan pembekuan (kriopreservasi) semen. Pembekuan semen merupakan cara yang digunakan untuk memperpanjang daya hidup spermatozoa dan salah satu cara untuk melestarikan plasma nutfah ayam terancam punah. Tujuan dari penelitian ini adalah membandingkan kualitas spermatozoa berbagai genetik rumpun ayam pejantan lokal, menentukan jenis krioprotektan (dimethyl sulfoxide/ DMSO), gliserol, dan dimethyl acetamide/ DMA) yang terbaik pada proses pembekuan semen setiap galur ayam lokal, dan menentukan konsentrasi krioprotektan yang paling optimum pada proses pembekuan semen setiap galur ayam lokal Indonesia
Penelitian ini dibagi menjadi beberapa tahap yaitu; 1) Uji banding kualitas semen segar antar rumpun ayam lokal, 2) Penentuan konsentrasi krioprotektan DMSO pada pengencer ringer laktat dan kuning telur, 3) Penentuan konsentrasi krioprotektan gliserol pada pengencer ringer laktat dan kuning telur, 4) Penentuan konsentrasi krioprotektan DMA pada pengencer ringer laktat dan kuning telur, 5) Uji banding freezing capability antara empat rumpun ayam, yaitu ayam pelung, ayam kampung, ayam sentul, dan ayam persilangan kampung broiler menggunakan jenis dan konsentrasi krioprotektan terbaik dari masing-masing perlakuan. Penelitian tahap 1 sampai 4 dirancang menggunakan rancangan acak lengkap sedangkan tahap 5 menggunakan rancangan faktorial. Jika terdapat perbedaan antar perlakuan dilanjutkan menggunakan uji Duncan.
Hasil penelitian menunjukkan bahwa secara umum kualitas semen segar ayam pelung lebih baik dari rumpun ayam lainnya. Penggunaan DMSO 7% merupakan konsentrasi terbaik pada pembekuan semen ayam kampung dibandingkan dengan konsentrasi DMSO 5% dan DMSO 9%. Penggunaan gliserol 5% merupakan konsentrasi terbaik pada pembekuan semen ayam sentul dibandingkan dengan konsentrasi gliserol 7% dan gliserol 9%. Penggunaan DMA 9% merupakan konsentrasi terbaik pada pembekuan semen ayam silangan kampung broiler dibandingkan dengan konsentrasi DMA 5% dan DMA 7%. Penggunaan gliserol 5%, DMSO 7%, dan DMA 9% didapatkan gliserol 5% terbaik pada pembekuan semen ayam kampung, sentul, pelung dan silangan kampung broiler. Recovery rate (RR) pada ayam sentul lebih tinggi dibanding rumpun ayam lokal lainnya. Rumpun ayam dan tipe krioprotektan berpengaruh pada penurunan motilitas semen beku selama proses pembekuan.
SUMMARY
JUNAEDI. Freezing Capability of Semen Four Genetic Local Chicken on Cryopreservation Germplasm Program Indonesia. Supervised by CECE SUMANTRI, ASEP GUNAWAN and RADEN IIS ARIFIANTINI.
Chicken is a very common animal in Indonesia, and has been shown high potential as meat and eggs producer. Semen cryopreservation as one way to preserve endangered local chicken breed. The purpose of this study was to compare the genetic quality by analyze of sperm quality of various local chicken breed, determine the best cyoprotectant concentration (dimethyl sulfoxide/ DMSO), glycerol, and dimethyl acetamide/ DMA) in ringer lactate egg yolk extender in different breed and to compare freezing capability among breed using the best concentration of cryoprotectant in each breed.
The research was conducted into 5 step; 1) comparison of fresh semen quality among local chicken breed 2) determination the best DMSO concentration in Ringer's lactate diluent egg yolk (RLEY) of kampung chicken breed 3) determination of the best glycerol concentration in RLEY of sentul chicken breed 4) determination of the DMA concentration in RLEY of kampung broiler cross breed 5) to compare freezing capability among local chicken breed using the best cryoprotectan concentration of each breed. Step 1 to step 4 were design using completely randomized and step 5 using factorial design.
The results showed that fresh semen of pelung chicken demonstrated higher quality compare to other. The use of 7% DMSO was the best concentration of frozen semen compared to 5% and 9% of kampung chicken breed. Glycerol 5% using was the best concentration in frozen semen compared with 7% and 9% of sentul chicken breed. For kampung broiler cross breed, 9% DMA more suitable compare to 5% and 7%. When compare between 5% glicerol, 7% DMSO, and 9% DMA for kampung chicken, sentul chicken, pelung chicken, and kampung broiler cross breed, 5% glicerol demonstrated the best cryoprotectan for all breed chicken. Recovery rate (RR) of sentul was higher than kampung chicken, sentul chicken, pelung chicken, and kampung broiler cross breed. Breed and type cryoprotectan influenced the decrease of spermatozoa motility during freezing process.
© Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Ilmu Produksi dan Teknologi Peternakan
DAYA TAHAN PEMBEKUAN SEMEN EMPAT GENETIK
AYAM LOKAL PADA PROGRAM KRIOPRESERVASI
PLASMA NUTFAH INDONESIA
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2015
Penguji Luar Komisi pada Ujian Tesis: Prof Dr drh Iman Supriatna
PRAKATA
Puji dan syukur Penulis panjatkan kepada Allah Subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Salawat kepada junjungan Nabi Muhammad Shalallahu‘alaihiwasallam. Karya ilmiah ditulis berdasarkan hasil penelitian yang dilaksanakan pada bulan Mei – Oktober 2014. Judul yang dipilih dalam penelitian yaitu Daya Tahan Pembekuan Semen Empat Rumpun Genetik Ayam Lokal pada Program Kriopreservasi Plasma Nutfah Indonesia.
Terima kasih penulis sampaikan kepada Direktorat Jenderal Perguruan Tinggi (DIKTI) yang telah memberikan dana beasiswa pada studi Magister melalui BPPDN-CD (Beasiswa Program Pascasarjana Dalam Negeri Calon Dosen). Terima kasih penulis ucapkan kepada segenap pembimbing yaitu, Prof Dr Ir Cece Sumantri, MSc, Dr Agr Asep Gunawan, SPt MSc dan Prof Dr Dra Raden Iis Arifiantini, MSi. Disamping itu, kepada semua pihak yang telah membantu penelitian ini, penulis sampaikan ucapan terima kasih kepada Saudara Khaerudin, Nu’man Hidayat, Muktakim, Pak Dadang dan Pak Bondang beserta staf Laboratorium Unit Rehabilitasi Reproduksi IPB.
Ucapan terima kasih kepada Keluarga tercinta Bani Sulaiman (Bapak Sulaiman, Ibunda Jumiati, Adinda Junardi, Adinda Rumailah, dan Adinda Abu Abdillah Muhammad Sholih Al Jenepontoji) atas semua kebaikan, do’a, kasih sayang dan motivasinya. Kepada teman-teman mahasiswa Prodi IPTP 2013 terima kasih atas segenap bantuan dan kerjasamanya. Staf IPB dan jajarannya serta ikhwan Ahlu Sunnah Wal Jama’ah (As Salafiyyun) di Bogor penulis mengucapkan terima kasih atas bantuannya.
Meskipun karya ilmiah ini dibuat sedemikian teliti dan kehati-hatian dari kesalahan akan tetapi karena keterbatasan Penulis sebagai manusia yang tak luput dari kesalahan. Penulis memohon maaf atas kekurangan yang ada pada karya ilmiah ini.
Semoga karya ilmiah ini dapat menjadi referensi yang bermanfaat bagi pembaca dan menambah khasanah keilmuan.
DAFTAR ISI
DAFTAR TABEL xii
DAFTAR GAMBAR xii
DAFTAR LAMPIRAN xii
PENDAHULUAN 1
Latar Belakang 1
Rumusan Masalah 2
Tujuan Penelitian 2
Manfaat Penelitian 3
METODE PENELITIAN 3
Lokasi dan Waktu Penelitian 3
Materi Penelitian 4
Metode Penelitian 4
Rancangan Percobaan dan Analisis Data 9
HASIL DAN PEMBAHASAN 9
Uji Banding Kualitas Semen Segar 9
Kualitas Semen Beku Ayam Kampung dengan Konsentrasi DMSO 11 Kualitas Semen Beku Ayam Sentul dengan Konsentrasi Gliserol 13 Kualitas Semen Beku Ayam KB dengan Konsentrasi DMA 14 Uji Banding Freezing Capability antar Rumpun Genetik Ayam 15
Recovery Rate Semen Beku 17
Penurunan Motilitas Spermatozoa Semen Beku Ayam 18
SIMPULAN DAN SARAN 20
Simpulan 20
Saran 20
DAFTAR PUSTAKA 21
DAFTAR TABEL
1 Kandungan zat gizi pakan dari perusahaan pt. Gold coin indonesia 3 2 Komposisi bahan pengencer semen beku ayam kampung
menggunakan kadar dmso yang berbeda 6
3 Komposisi bahan pengencer semen beku ayam sentul menggunakan
kadar gliserol yang berbeda 7
4 Komposisi bahan pengencer semen beku silangan KB menggunakan
kriprotektan dma dengan kadar yang berbeda. 8
5 Jenis dan konsentrasi krioprotektan terbaik dari masing-masing
perlakuan pada tahap II, III, dan IV. 8
6 Karakteristik semen segar ayam kampung, ayam silangan KB, sentul,
dan pelung. 10
7 Kualitas semen beku ayam kampung pada berbagai tahapan
pembekuan dalam pengencer ringer laktat kuning telur pada berbagai
dosis DMSO 12
8 Kualitas semen beku ayam sentul pada berbagai tahapan pembekuan dalam pengencer ringer laktat kuning telur pada berbagai dosis
gliserol 13
9 Kualitas semen beku ayam silangan KB pada berbagai tahapan pembekuan pada pengencer ringer laktat kuning telur pada berbagai
dosis DMA 14
10 Karakteristik semen beku berbagai rumpun ayam lokal dalam pengencer ringer laktat kuning telur pada jenis dan konsentrasi
krioprotektan terbaik dari perlakuan 16
11 Recovery rate semen beku berbagai rumpun ayam lokal dalam pengencer ringer laktat kuning telur pada berbagai jenis
krioprotektan 18
DAFTAR GAMBAR
1 Skema alur penelitian 4
2 Penurunan motilitas semen beku berbagai rumpun ayam lokal pada
setiap tahap pebekuan 19
3 Penurunan motilitas semen beku ayam lokal pada setiap tahap
pembekuan dengan penggunaan jenis krioprotektan yang berbeda 20
DAFTAR LAMPIRAN
1 Proses pembuatan pengencer 24
2 Proses koleksi semen ayam 24
3 Proses pengemasan dan ekuilibrasi semen ayam 25 4 Prosedur pembekuan dan penyimpana semen beku 25 5 Hasil analisis ragam (ANOVA) dan uji Duncan abnormalitas total
6 Hasil analisis ragam (ANOVA) dan uji Duncan abnormalitas primer
semen segar empat rumpun ayam lokal indonesia 26 7 Hasil analisis ragam (ANOVA) dan uji Duncan abnormalitas sekunder
semen segar empat rumpun ayam lokal indonesia 27 8 Hasil analisis ragam (ANOVA) dan uji Duncan motilitas semen segar
empat rumpun ayam lokal indonesia 27
9 Hasil analisis ragam (ANOVA) dan uji Duncan viabilitas semen segar
empat rumpun ayam lokal indonesia 28
10 Hasil analisis ragam (ANOVA) dan uji Duncan konsentrasi semen
segar empat rumpun ayam lokal indonesia 28
11 Hasil analisis ragam (ANOVA) dan uji Duncan volume semen segar
empat rumpun ayam lokal indonesia 29
12 Hasil analisis ragam (ANOVA) dan uji Duncan motilitas setelah
ekuilibrasi semen ayam dengan konsentrasi dmso yang berbeda 29 13 Hasil analisis ragam (ANOVA) dan uji Duncan viabilitas setelah
ekuilibrasi semen ayam dengan konsentrasi dmso yang berbeda 30 14 Hasil analisis ragam (ANOVA) dan uji Duncan motilitas setelah
thawing semen ayam dengan konsentrasi dmso yang berbeda 30 15 Hasil analisis ragam (ANOVA) dan uji Duncan recovery rate semen
ayam dengan konsentrasi dmso yang berbeda 31
16 Hasil analisis ragam (ANOVA) dan uji Duncan viabilitas setelah
thawing semen ayam dengan konsentrasi dmso yang berbeda 31 17 Hasil analisis ragam (ANOVA) dan uji Duncan motilitas setelah
ekuilibrasi semen ayam dengan konsentrasi gliserol yang berbeda 32 18 Hasil analisis ragam (ANOVA) dan uji Duncan viabilitas setelah
ekuilibrasi semen ayam dengan konsentrasi gliserol yang berbeda 32 19 Hasil analisis ragam (ANOVA) dan uji Duncan motilitas setelah
thawing semen ayam dengan konsentrasi gliserol yang berbeda 32 20 Hasil analisis ragam (ANOVA) dan uji Duncan recovery rate semen
ayam dengan konsentrasi gliserol yang berbeda 32 21 Hasil analisis ragam (ANOVA) dan uji Duncan viabilitas setelah
thawing semen ayam dengan konsentrasi gliserol yang berbeda 33 22 Hasil analisis ragam (ANOVA) dan uji Duncan motilitas setelah
ekuilibrasi semen ayam dengan konsentrasi dmso yang berbeda 33 23 Hasil analisis ragam (ANOVA) dan uji Duncan viabilitas setelah
ekuilibrasi semen ayam dengan konsentrasi dma yang berbeda 33 24 Hasil analisis ragam (ANOVA) dan uji Duncan motilitas setelah
thawing semen ayam dengan konsentrasi dma yang berbeda 34 25 Hasil analisis ragam (ANOVA) dan uji Duncan rr semen ayam
dengan konsentrasi dma yang berbeda 34
26 Hasil analisis ragam (ANOVA) dan uji Duncan viabilitas setelah
thawing semen ayam dengan konsentrasi dma yang berbeda 35 27 Hasil analisis ragam (ANOVA) dan uji Duncan motilitas semen
segar pada tahap terakhir 35
28 Hasil analisis ragam (ANOVA) dan uji Duncan viabilitas semen
29 Hasil analisis ragam (ANOVA) dan uji Duncan motilitas setelah ekuilibrasi semen beku ayam dengan jenis dan konsentrasi
krioprotektan terbaik dari perlakuan 37
30 Hasil analisis ragam (ANOVA) dan uji Duncan viabilitas setelah ekuilibrasi semen beku ayam dengan jenis dan konsentrasi
krioprotektan terbaik dari perlakuan 37
31 Hasil analisis ragam (ANOVA) dan uji Duncan motilitas setelah thawing semen beku ayam dengan jenis dan konsentrasi
krioprotektan terbaik dari perlakuan 38
32 Hasil analisis ragam (ANOVA) dan uji Duncan viabilitas setelah thawing semen beku ayam dengan jenis dan konsentrasi
krioprotektan terbaik dari perlakuan 39
33 Hasil analisis ragam (ANOVA) dan uji Duncan recovery rate semen beku ayam dengan jenis dan konsentrasi krioprotektan terbaik dari
perlakuan 40
34 Hasil analisis ragam (ANOVA) dan uji Duncan penurunan kualitas semen segar- ekuilibrasi dari berbagai rumpun ayam lokal dengan
jenis dan konsentrasi krioprotektan terbaik dari perlakuan 41 35 Hasil analisis ragam (ANOVA) dan uji Duncan penurunan kualitas
semen dari ekuilibrasi - setelah thawing dari berbagai rumpun ayam lokal dengan jenis dan konsentrasi krioprotektan terbaik dari
perlakuan 41
36 Hasil analisis ragam (ANOVA) dan uji Duncan penurunan kualitas semen segar- thawing dari berbagai rumpun ayam lokal dengan jenis
PENDAHULUAN
Latar Belakang
Ayam merupakan ternak yang sangat umum dijumpai di Indonesia, dan telah terbukti mempunyai potensi yang tinggi sebagai penghasil daging dan telur. keanekaragaman hayati dari ternak ayam cukup besar, terbuka peluang untuk melakukan pemuliabiakan jenis ternak tersebut sehingga dapat dihasilkan ras atau bangsa ayam baru (proven breed) yang produktivitasnya lebih baik. Program pemuliaan pengujian kualitas sperma jantan berbagai genetik pejantan perlu dilakukan untuk mendapatkan produktivitas yang tinggi. Semen yang mempunyai kualitas jelek menyebabkan fertilitas telur rendah dan sebaliknya untuk semen kualitas baik akan menghasilkan persentase telur fertil yang lebih baik. Hal ini tergantung dari pejantan, khususnya kualitas semen yang dihasilkan pejantan.
Salah satu upaya pelestarian plasma nutfah ayam adalah dengan kriopreservasi semen. Pembekuan semen merupakan upaya yang digunakan untuk memperpanjang daya hidup spermatozoa. Teknik kriopreservasi akan menjadi alat yang sangat berharga bagi industri unggas (Fulton 2006) dan untuk keberhasilan pelestarian sumber daya genetik unggas yang masih ada. Namun dalam proses pembekuan yang sering dihadapi adalah cold shock dan kerusakan sel akibat terbentuknya kristal es. Pengolahan semen beku perlu memperhatikan beberapa faktor diantaranya pengencer dan krioprotektan yang tepat sehingga dapat melindungi spermatozoa dari efek pembekuan. Pengencer semen harus mengandung sumber nutrisi, larutan penyangga, bahan anti cold shock, krioprotektan, dan antibiotika.
Pembekuan semen perlu ditambahkan zat pelindung yang biasa disebut sebagai krioprotektan yang dapat mencegah terbentuknya kristal es dan menstabilkan membran plasma spermatozoa selama proses pembekuan. Krioprotektan yang digunakan harus mudah larut dalam air dan harus mempunyai bobot molekul yang kecil agar lebih cepat penetrasi ke dalam sel dan mengurangi toksisitas akibat osmolaritas yang tinggi. Jenis dan konsentrasi krioprotektan yang tepat dalam bahan pengencer sangat penting untuk melindungi spermatozoa selama pembekuan (Suidzinska dan Lukaszewicz 2008).
Krioprotektan berperan dalam mengurangi pengaruh mematikan selama pembekuan, baik berupa pengaruh larutan maupun adanya pembentukan kristal es sehingga viabilitas sel dapat dipertahankan. Krioprotektan dikelompokkan menjadi krioprotektan yang bekerja di dalam dan di luar sel (Chen et al. 2005; Luz et al. 2009). Sementara itu, berdasarkan bahan krioprotektan dikelompokkan menjadi dua golongan, yaitu kelompok alkohol seperti etilen glikol, dan gliserol serta kelompok amida seperti dimetilformamid, asetamid, dan metilformamid (Alvarenga et al. 2005).
Dimethyl sulfoxide (DMSO) adalah campuran organosulfur dengan rumus kimia (CH3)2SO dan mempunyai berat molekul sebesar 78.13 g/mol dengan titik
2
white leghorn, ovambo, dan potchefstrom koekoek terbaik adalah 5% (Makhafola et al. 2009).
Dimethyl acetamide (DMA) merupakan senyawa dengan berat molekul 87.12 g/mol dan berat jenis 0.94 g/cm3 merupakan larutan yang mudah larut dalam air, alkohol, ether, aseton, benzena dan larutan lain. Krioprotektan DMA mempunyai kemampuan penetrasi yang baik pada sel-sel dengan kandungan lipid membran yang banyak. Dosis optimum DMA dalam pengencer semen itik sebesar 10% (Han et al. 2005), dan ayam arab sebesar 7% (Iskandar et al. 2006).
Gliserol (C3H8O3)merupakan senyawa golongan alkohol polihidrat dengan
tiga buah gugus hidroksil dalam satu molekul, bersifat polar, berat molekul 92.09 g/mol, dan berat jenis 1.26 g/cm3. Gliserol merupakan krioprotektan intraseluler yang paling banyak digunakan untuk pembekuan semen. Gliserol dapat masuk ke dalam sel spermatozoa untuk mengikat sebagian air bebas, sehingga kristal-kristal es yang terbentuk di dalam medium pengencer pada waktu pembekuan dapat dicegah. Konsentrasi gliserol yang digunakan berbeda bergantung jenis semen serta pengencer yang digunakan (Azizah dan Arifiantini 2009).
Selain jenis krioprotektan yang digunakan, konsentrasi krioprotektan pun akan memengaruhi kualitas semen beku. Adanya keragaman kualitas spermatozoa unggas serta efektivitas optimum dari krioprotektan pada proses kriopreservasi yang berbeda dari hasil setiap peneliti. Penelitian terdahulu didapatkan kinerja optimum dari DMA, DMSO, maupun gliserol yaitu 5-10%. Penelitian ini dilaksanakan untuk menentukan efektifitas setiap jenis dan konsentrasi krioprotektan (5%, 7% dan 9%) dalam pengencer ringer laktat kuning telur pada pembekuan semen ayam dan untuk menguji kualitas spermatozoa berbagai rumpun genetik ayam pejantan, menguji daya tahan terhadap pembekuan (freezing capability) dari berbagai rumpun genetik ayam lokal.
Rumusan Masalah
Uraian di atas dapat diambil rumusan masalah;
1. Apakah kualitas semen segar dari berbagai rumpun ayam lokal berbeda? 2. Bagaimanakah daya tahan spermatozoa terhadap pembekuan (freezing
capability) dari berbagai rumpun genetik ayam pejantan?
3. Jenis dan konsentrasi krioprotektan manakah yang memberikan kinerja optimum terhadap kemampuan daya tahan spermatozoa selama proses pembekuan (freezing capability) dari berbagai rumpun genetik ayam pejantan?
Tujuan Penelitian
1. Membandingkan kualitas spermatozoa berbagai genetik rumpun ayam pejantan local.
2. Menentukan konsentrasi krioprotektan yang terbaik pada proses pembekuan semen setiap galur ayam lokal.
3 Manfaat Penelitian
1. Mendapatkan satu paket teknologi untuk meningkatkan populasi ayam. 2. Menghasilkan peluang usaha baru di bidang pembenihan unggas
khususnya ayam.
3. Merintis pembentukan bank genetik khusus dalam bentuk semen ayam dalam rangka pelestarian satwa aves lokal Indonesia.
METODE PENELITIAN
Lokasi dan Waktu Penelitian
Penelitian ini dilaksanakan di kandang Pemuliaan Ternak Unggas, Fakultas Peternakan IPB dan di Laboratorium Unit Rehabilitasi Reproduksi (URR), Bagian Reproduksi dan Kebidanan, Fakultas Kedokteran Hewan IPB pada bulan Mei- Oktober 2014.
Materi Penelitian
Sumber Semen
Ayam jantan yang digunakan dalam penelitian ini terdiri dari empat genetik ayam jantan yang berbeda, masing-masing 3 ekor ayam jantan pelung, 3 ekor ayam jantan kampung, 3 ekor ayam jantan sentul, dan 3 ekor ayam jantan persilangan kampung broiler. Ayam jantan yang digunakan telah dewasa kelamin dan berumur 1 tahun. Ayam jantan dikandangkan secara individual. Ayam jantan yang digunakan diadaptasikan terhadap kolektor semen maupun pada lingkungan kandang. Adaptasi memerlukan waktu dua bulan. Setelah terbiasa dengan lingkungan kandang dan kolektor, baru ayam tersebut bisa dipakai dalam penelitian untuk ditampung semennya.
Pakan yang diberikan berupa pakan jadi (pakan komersial) berbentuk pellet dari perusahaan PT. Gold Coin Indonesia. Pakan diberikan dengan takaran 150 gram/hari dan pemberian air minum secara adlibitum. Kandungan zat gizi pakan dapat dilihat pada Tabel 1.
Tabel 1 Kandungan zat gizi pakan dari perusahaan PT. Gold Coin Indonesia.
Komposisi Kandungan Gizi
Protein kasar (%) 17.00
Abu (%) 14.00
Serat kasar (%) 6.00
Lemak kasar(%) 3.00
Kalsium (%) 4.20
Fosfor (%) 0.60
Bahan dan Peralatan
4
Peralatan yang dipakai untuk penampungan dan evaluasi adalah spoit 1 mL, microtube 2 mL, mikroskop, obyek gelas, gelas penutup, rak tabung semen, counting chamber, pipet plastik, gunting atau straw cutter, dan lemari es. Sedangkan peralatan yang dilibatkan untuk kriopresevasi semen temasuk pembekuan dan pencairan semen beku yaitu meliputi tabung koleksi semen 2 mL, tabung reaksi 5 mL, mikropipet, tip mikropipet, kotak styrofoam, seperangkat penyimpanan semen beku (storage container) atau kontainer nitrogen cair (- 196oC), pipet, jerami plastik (straw) berukuran 0.25 mL, spoit 1 mL dilengkapi dengan konektor straw, rak tabung, semen dalam kotak plastik, bunsen, thermometer, dan lemari es.
Metode Penelitian
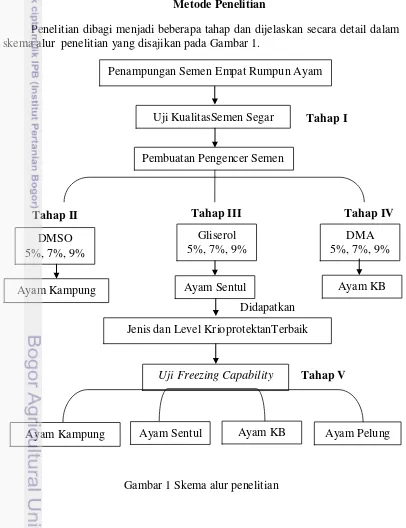
Penelitian dibagi menjadi beberapa tahap dan dijelaskan secara detail dalam skema alur penelitian yang disajikan pada Gambar 1.
Gambar 1 Skema alur penelitian Uji KualitasSemen Segar
Pembuatan Pengencer Semen
DMSO 5%, 7%, 9%
Gliserol 5%, 7%, 9%
DMA 5%, 7%, 9% Penampungan Semen Empat Rumpun Ayam
Ayam Kampung Ayam Sentul Ayam KB
Jenis dan Level KrioprotektanTerbaik
Uji Freezing Capability Didapatkan
Ayam Kampung Ayam Sentul Ayam KB Ayam Pelung
Tahap I
Tahap II Tahap III Tahap IV
5 Tahap 1: Uji Banding Kualitas Semen Segar Empat Rumpun Ayam Lokal
Koleksi Semen Segar
Koleksi semen dari tiap perlakuan dilakukan tiga kali seminggu. Adapun teknik penampungan semen yang digunakan adalah dengan pengurutan (masase) pada bagian punggung ayam. Penampungan semen dilakukan oleh dua orang. Seorang memegang ayam pada kedua pahanya dengan tangan kiri sambil mengurut bagian punggung ayam untuk merangsang keluarnya semen, dan seorang lagi menyiapkan tabung penampung semen berskala dan tissue pembersih kotoran ayam. Pengurutan dilakukan beberapa kali sampai terjadinya rangsangan pada ayam yang ditandai dengan peregangan tubuh ayam dan keluarnya papillae dari proktodaeum kloaka. Ketika ereksi mencapai maksimal, tangan kanan dan kiri orang yang melakukan pengurutan bekerjasama memerah semen. Pada saat yang sama, orang kedua bersiap-siap menampung semen dengan tabung penampung berskala.
Evaluasi Semen Segar
Setelah koleksi semen dievaluasi secara makroskopis dan mikroskopis. Evaluasi secara makroskopis dilakukan terhadap volume, warna, konsistensi, dan derajat keasamaan (pH). Volume semen diukur dengan menggunakan pipet ukur, pH semen diukur menggunakan pH special indicator paper, konsistensi semen dibedakan antara kental dan sedang, dan warna dibedakan menjadi krem dan putih susu dilihat secara visual. Evaluasi secara mikroskopis meliputi gerakan massa, motilitas spermatozoa, konsentrasi spermatozoa per ml, spermatozoa hidup, dan morfologi spermatozoa.
Gerakan massa spermatozoa dinilai dengan cara meneteskan semen segar pada objek glass lalu diamati di bawah mikroskop dengan perbesaran 10 X 10 (100X). Penilaian dilakukan berdasarkan tebal tipisnya gelombang massa serta kecepatan gelombang massa berpindah tempat, dengan kriteria penilaian sangat baik (+++/3), baik (++/2), lumayan (+/1), dan buruk (tidak ada gelombang).
Motilitas spermatozoa adalah persentase spermatozoa yang maju ke depan (progresif), dinilai dengan cara meneteskan 1 tetes semen ditambah 8-10 tetes NaCl fisiologis, dihomogenkan dan dipindahkan 1 tetes di atas obyek gelas yang lain dan ditutup dengan gelas penutup. Motilitas spermatozoa dinilai secara estimasi dari lima lapangan pandang dengan cara membandingkan jumlah spermatozoa yang bergerak maju ke depan dengan gerakan spermatozoa yang lain dinyatakan dalam persentase (Arifiantini 2012).
6
spermatozoa hidup adalah jumlah spermatozoa yang hidup dibagi jumlah spermatozoa terhitung dikali 100%.
Morfologi spermatozoa dilakukan menggunakan pewarnaan yang sama dengan spermatozoa hidup. Morfologi dibedakan berdasarkan morfologi yang normal dan morfologi yang abnormal. Abnormalitas spermatozoa dihitung minimal 200 sel berdasarkan perhitungan 10 lapang pandang (Arifiantini et al. 2005). Persentase spermatozoa yang abnormal dibedakan berdasarkan abnormalitas primer dan abnormalitas sekunder (Alkan et al. 2002).
Pengukuran Tekanan Osmotik Semen Segar dan Bahan Pengencer
Dilakukan pengukuran tekanan osmotik semen segar semua jenis ayam dan tekanan osmotik bahan pengencer yang digunakan.
Tahap II: Penentuan Konsentrasi Krioprotektan DMSO pada Pengencer Ringer Laktat dan Kuning Telur
Koleksi Semen dan Evaluasi Semen
Koleksi semen dari tiap perlakuan dilakukan tiga kali seminggu. Adapun teknik penampungan semen yang digunakan adalah dengan pengurutan (masase). Semen yang diperoleh dievaluasi seperti yang dilakukan pada tahap I.
Penyiapan Bahan Pengencer
Bahan pengencer yang digunakan larutan ringer laktat dengan tiga konsentrasi DMSO (Tabel 2).
Tekanan osmotik pengencer diukur menggunakan osmometer. bpH pengencer di-ajust (dipaskan) dengan Tris hydroxymethyl aminomethan.
Pengenceran dan Pengemasan Semen
Semen yang menunjukkan motilitas spermatozoa lebih dari 75% dengan konsentrasi spermatozoa lebih dari 2500 x 106 per mL, dibagi ke dalam tiga tabung, masing-masing diencerkan dengan pengencer ringer laktat kuning telur (RLKT) dengan DMSO 5% (RLKT5), RLKT DMSO 7% (RLKT7) dan RLKT
DMSO 9% (RLKT9) dengan dosis 50x106 per 0.25 mL. Semen yang diencerkan
7 Ekuilibrasi dan Pembekuan Semen
Straw selanjutnya diekuilibrasi pada suhu 5 oC selama 2 jam (Bearden et al. 2004), dibekukan pada uap nitrogen cair selama 10 menit (Han et al. 2005), kemudian disimpan pada kontainer nitrogen cair (-196 oC) untuk pengujian berikutnya.
Penyimpanan
Semen beku disimpan dalam nitrogen cair selama 24 jam untuk pengujian lebih lanjut.
Pengujian Kualitas Semen Beku
Pengujian kualitas semen beku dilakukan 24 jam setelah penyimpanan, dengan cara melakukan thawing semen beku dalam air hangat (37 oC) selama 30 detik. Pengujian dilakukan terhadap motilitas dan viabilitas spermatozoa seperti yang dilakukan pada semen segar. Keberhasilan pembekuan juga dinilai dengan Recovery rate yaitu persentase spermatozoa yang berhasil pulih dari proses pembekuan yang dihitung dengan membandingkan persentase spermatozoa motil pada semen segar dan setelah thawing
.
Tahap III: Penentuan Konsentrasi Krioprotektan Gliserol pada Pengencer Ringer Laktat dan Kuning Telur
Penyiapan Bahan Pengencer
Bahan pengencer yang digunakan pada tahap III sama dengan tahap yang ke II, perbedaannya adalah pada jenis dan konsentrasi krioprotektan yang digunakan, dapat dilihat pada Tabel 3.
Tabel 3 Komposisi bahan pengencer semen beku menggunakan kadar gliserol
Tekanan osmotik pengencer diukur menggunakan osmometer. bpH pengencer di-ajust (dipaskan) dengan Tris hydroxymethyl aminomethan.
8
Tahap IV: Penentuan Konsentrasi Krioprotektan DMA pada Pengencer Ringer Laktat dan Kuning Telur
Penyiapan Bahan Pengencer
Bahan pengencer yang digunakan pada tahap III sama dengan tahap yang ke II, perbedaannya adalah pada jenis dan konsentrasi krioprotektan yang digunakan, dapat dilihat pada Tabel 4.
Tabel 4 Komposisi bahan pengencer semen beku menggunakan kriprotektan DMA dengan kadar yang berbeda.
Komposisi DMA
Tekanan osmotik pengencer diukur menggunakan osmometer. bpH pengencer di-ajust (dipaskan) dengan Tris hydroxymethyl aminometha
Prosedur selanjutnya adalah koleksi, evaluasi, dan pengolahan semen sama seperti yang dilakukan pada tahap II dan III.
Tahap V: Uji Banding Freezing Capability Empat Genetik Rumpun Ayam
Uji banding freezing capability antar empat genetik rumpun ayam yaitu ayam pelung, ayam kampung, ayam sentul dan ayam persilangan kampung broiler menggunakan jenis dan konsentrasi krioprotektan terbaik dari masing-masing perlakuan (Tabel 5). Parameter yang diukur dalam pemeriksaan semen adalah persentase motilitas dan viabilitas.
Tabel 5 Jenis dan konsentrasi krioprotektan terbaik dari masing-masing perlakuan pada tahap II, III, dan IV
9 Rancangan Percobaan dan Analisis Data
Pelaksanaan proses penelitian pada tahap I menggunakan rancangan acak lengkap (RAL) dengan empat perlakuan (ayam kampung, sentul, silangan KB, dan pelung). Sedangkan mulai dari tahap II - IV dianalisa dengan menggunakan RAL tiga perlakuan dengan model matematika sebagai berikut:
Yij= µ + αi+ εij
Keterangan:
Yij : Respon yang diperoleh dari pengaruh perlakuan (DMSO/Gliserol/DMA)
ke-i (5%, 7% dan 9%) dan ulangan ke-j (1, 2, 3, 4, 5, 6, 7, 8, dan 9) µ : Nilai rataan umum
αi : Pengaruh perlakuan ke-i
εij : Pengaruh galat perlakuan ke-i (5%, 7% dan 9%) ) dan ulangan
ke-j (1, 2, 3, 4, 5, 6, 7, 8, dan 9)
Pada tahap V dilakukan dengan pola faktorial. Adapun model matematika yang digunakan adalah sebagai berikut:
Y
ijk = µ + Ai + Bj + ABij + εijkABij : Interaksi antara Faktor A dengan Faktor B
εijk : Pengaruh galat pada Faktor A taraf ke-i, Faktor B taraf ke-j dan ulangan
ke-k
Pengujian selanjutnya dilakukan terhadap nilai rata-rata perlakuan pada tingkat P (<0.05) (Gomes dan Artuto 2007).
HASIL DAN PEMBAHASAN
Uji Banding Kualitas Semen Segar Spermatozoa antar Rumpun Ayam Lokal
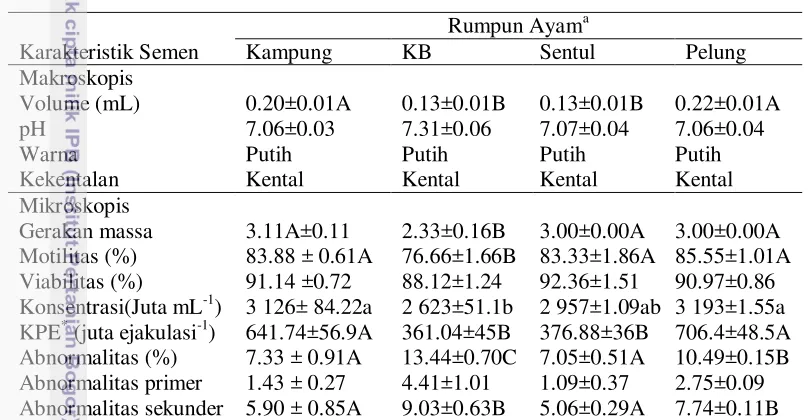
Hasil pengamatan karakteristik semen segar terdapat perbedaan kualitas semen segar antara berbagai rumpun. Secara makroskopis, volume semen pada ayam kampung (0.20±0.01mL) dan volume semen ayam pelung (0.22±0.01 mL) lebih besar (P<0.01) dibanding volume semen ayam silangan kampung broiler (0.13±0.01 mL) dan volume pada ayam sentul (0.13±0.01 mL). Sedangkan pada pH, kekentalan dan warna pada keempat rumpun ayam lokal tidak memperlihatkan perbedaan. Semen segar pada semua rumpun ayam yang digunakan dalam penelitian mempunyai kualitas baik dan berada pada kisaran normal.
10
aktif dan semakin banyak spermatozoa yang bergerak ke depan, semen akan mempunyai kualitas yang semakin baik (semakin tebal dan pergerakannya semakin cepat). Persentase motilitas spermatozoa ayam kampung, ayam sentul, ayam pelung yang lebih besar (P<0.01) dari motilitas ayam silangan kampung broiler. Namun keempat rumpun ayam lokal ini masih berada dalam kisaran motilitas yang normal yaitu > 70% (Dumpala et al. 2006). Motilitas spermatozoa merupakan salah satu indikator ukuran kemampuan spermatozoa membuahi ovum dalam proses fertilisasi.
Tabel 6 Karakteristik semen segar ayam kampung, ayam silangan kampung broiler, sentul, dan pelung
Rumpun Ayama
Karakteristik Semen Kampung KB Sentul Pelung
Makroskopis
Volume (mL) 0.20±0.01A 0.13±0.01B 0.13±0.01B 0.22±0.01A
pH 7.06±0.03 7.31±0.06 7.07±0.04 7.06±0.04
Warna Putih Putih Putih Putih
Kekentalan Kental Kental Kental Kental
Mikroskopis
Gerakan massa 3.11A±0.11 2.33±0.16B 3.00±0.00A 3.00±0.00A Motilitas (%) 83.88 ± 0.61A 76.66±1.66B 83.33±1.86A 85.55±1.01A Viabilitas (%) 91.14 ±0.72 88.12±1.24 92.36±1.51 90.97±0.86 Konsentrasi(Juta mL-1) 3 126± 84.22a 2 623±51.1b 2 957±1.09ab 3 193±1.55a KPE* (juta ejakulasi-1) 641.74±56.9A 361.04±45B 376.88±36B 706.4±48.5A Abnormalitas (%) 7.33 ± 0.91A 13.44±0.70C 7.05±0.51A 10.49±0.15B Abnormalitas primer 1.43 ± 0.27 4.41±1.01 1.09±0.37 2.75±0.09 Abnormalitas sekunder 5.90 ± 0.85A 9.03±0.63B 5.06±0.29A 7.74±0.11B
a
Huruf berbeda yang mengikuti angka pada baris yang sama menunjukkan perbedaan (Huruf besar berbeda sangat nyata (P<0.01). Huruf kecil menunjukkan berbeda nyata (P<0.05). KPE*: Konsentrasi spermatozoa ejakulasi-1.
Viabilitas spermatozoa ayam kampung (91.14±0.72%), ayam silangan kampung broiler (88.12±1.24%), ayam sentul (92.36±1.51%), dan ayam pelung (90.97±0.86%) tidak memiliki perbedaan. Hasil penelitian viabilitas spermatozoa semen keempat rumpun ini, lebih tinggi dibandingkan dengan viabilitas spermatozoa semen ayam parent stock yaitu hanya 82.3±5.9% (Castillo et al. 2010), juga lebih besar daripada hasil penelitian semen ayam kampung hasil penelitian Dadang et al. (2007) yaitu 86%. Persentase spermatozoa hidup lebih tinggi dari pada spermatozoa motil karena dari jumlah spermatozoa yang hidup belum tentu semuanya motil progresif (Kostaman dan Sutama 2006).
Konsentrasi spermatozoa ayam kampung (3 126±84.22 juta mL-1), ayam sentul (2 957±1.09 juta mL-1), dan ayam pelung (3 193±1.55 juta mL-1) lebih tinggi (P<0.05) dari konsentrasi spermatozoa pada ayam hasil persilangan kampung broiler (2 623±51.09 juta mL-1). Konsentrasi spermatozoa ayam kampung, ayam sentul, dan ayam pelung lebih besar dibandingkan ayam domestik 2 730 juta mL-1 dan ayam bantam 1 830 juta mL-1 (Malik et al. 2013).
11 lainnya. Ayam pelung dengan konsentrasi spermatozoa 706.47±48.5 juta ejakulasi-1 dan motilitas 85.55±1.01% mampu membuahi ayam betina sebanyak 12 ekor. Perhitungan tersebut dengan jumlah spermatozoa untuk satu kali IB sebanyak 50 juta seekor ayam betina.
Total abnormalitas spermatozoa ayam kampung (7.33±0.91%) dan ayam sentul (7.05±0.51%) lebih rendah dibanding abnormalitas spermatozoa ayam pelung (10.49±0.15%) maupun abnormalitas spermatozoa ayam silangan kampung broiler (13.44±0.70%). Nilai ini cukup kecil dibandingkan laporan Iskandar et al., (2006) abnormalitas spermatozoa 14.75 % pada ayam Arab dan 15.50% pada ayam pelung (Widya et al. 2013). Abnormalitas primer keempat rumpun ayam hasil penelitian tidak memperhatikan perbedaan.
Abnormalitas sekunder pada spermatozoa ayam kampung (5.90±0.85%) dan ayam sentul (5.06±0.29%) lebih rendah P(<0.01) dibanding abnormalitas spermatozoa pada ayam silangan kampung broiler (9.03±0.63%) dan ayam pelung (7.74±0.11%). Bentuk abnormal dari spermatozoa pada penelitian ini kebanyakan abnormalitas sekunder seperti ekor bergulung, leher patah, dan leher putus dan ekor berganda. Abnormalitas sekunder disebabkan perlakuan ketika pembuatan preparat ulas dan faktor lingkungan lainnya (Solihati et al. 2008). Sedangkan menurut Arifiantini et al. (2005) spermatozoa abnormal biasanya disebabkan karena ketidakseimbangan nutrisi dan endokrin.
Abnormalitas spermatozoa yang tinggi dapat memengaruhi fertilitas. Morrel et al. (2008) melaporkan bahwa angka fertilitas berkorelasi kuat dengan morfologi normal spermatozoa. Hal tersebut disebabkan karena spermatozoa abnormalitas kesulitan dalam menembus zona pelucida (Mitchell et al. 2006). Hal ini sesuai oleh Saacke (2008) menyatakan spermatozoa dengan abnormalitas bagian kepala akan menghasilkan embrio berkualitas rendah dan mudah berdegenerasi.
Kerusakan membran pada bagian kepala akan menyebabkan enzim yang berfungsi untuk fertilisasi keluar dan spermatozoa kehilangan fertilitasnya, meskipun secara fungsional enzim dan materi genetik masih ada. Bagian kepala spermatozoa membawa materi genetik dan enzim yang akan berfungsi pada saat spermatozoa menembus ovum dan lapisan-lapisan sel yang melindunginya. Sebaliknya kerusakan spermatozoa pada bagian ekor menyebabkan spermatozoa akan kehilangan kemampuan untuk bergerak. Ekor spermatozoa terdiri atas bagian leher, tengah, utama dan ujung. Ekor spermatozoa mengandung axonema yang ditutupi oleh membran plasma dimana axonema tersebut bertanggung jawab terhadap motilitas spermatozoa.
Kualitas Semen Beku Ayam Kampung dengan Konsentrasi DMSO pada Pengencer Ringer Laktat dan Kuning Telur
12
spermatozoa akan mengalami penurunan kualitas spermatozoa. Pembentukan kristal es selama proses pembekuan merupakan salah satu faktor utama penyebab kerusakan membran spermatozoa. Salah satu kerusakan pada spermatozoa selama proses pembekuan adalah terjadinya peroksidasi lipid (Waluyo 2006). Kerusakan spermatozoa berdampak pada penurunan motilitas dan viabilitas spermatozoa. Motilitas dan viabilitas spermatozoa merupakan parameter yang sangat diperhatikan pada evaluasi spermatozoa. Kerusakan spermatozoa pada pembekuan semen akibat proses pembekuan yang melewati berbagai suhu ekstrim (Nebel 2007).
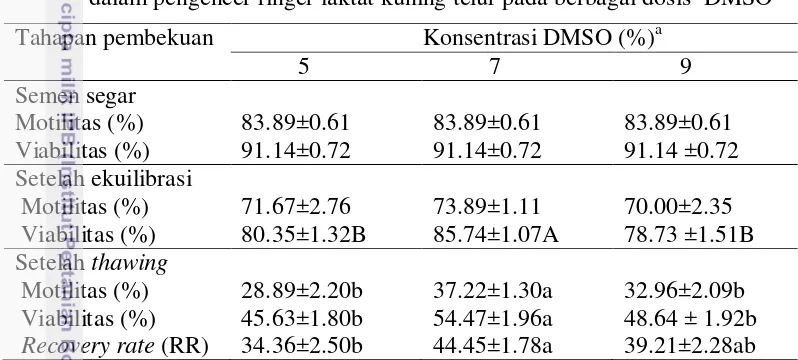
Tabel 7 Kualitas semen beku ayam kampung pada berbagai tahapan pembekuan dalam pengencer ringer laktat kuning telur pada berbagai dosis DMSO
Tahapan pembekuan Konsentrasi DMSO (%)a
5 7 9
Semen segar
Motilitas (%) 83.89±0.61 83.89±0.61 83.89±0.61 Viabilitas (%) 91.14±0.72 91.14±0.72 91.14 ±0.72 Setelah ekuilibrasi
Motilitas (%) 71.67±2.76 73.89±1.11 70.00±2.35 Viabilitas (%) 80.35±1.32B 85.74±1.07A 78.73 ±1.51B Setelah thawing
Motilitas (%) 28.89±2.20b 37.22±1.30a 32.96±2.09b Viabilitas (%) 45.63±1.80b 54.47±1.96a 48.64 ± 1.92b Recovery rate (RR) 34.36±2.50b 44.45±1.78a 39.21±2.28ab a
Huruf berbeda yang mengikuti angka pada kolom dan baris yang sama menunjukkan perbedaan (Huruf besar berbeda sangat nyata (P<0.01) sedangkan huruf yang kecil menunjukkan hasil berbeda nyata (P<0.05).
Kualitas semen beku setelah thawing menunjukkan motilitas (37.22±1.30%) dan viabilitas spermatozoa (54.47±1.96% ) pada pengencer yang diberi DMSO 7% paling tinggi (P<0.05) dibandingkan dengan penambahan 9% ataupun 5% dan tidak terdapat perbedaan antara DMSO 9 dan 5% (Tabel 7). Hasil penelitian ini berbeda dengan laporan Makhafola et al. (2009) pada penelitiannya menggunakan DMSO 5% ayam white lenghorn menghasilkan motilitas 20%; ayam avambo 35%; dan ayam potchefstrom koekoek 30%. Terbaiknya konsentrasi DMSO 7% pada penelitian ini hampir sama dengan yang dilaporkan oleh Han et al. (2005) pada semen itik dapat mencapai motilitas hingga 38.30%.
13 lipoprotein kuning telur mirip dengan struktur membran plasma sehingga dapat melindungi membran sel spermatozoa.
Keberhasilan pembekuan selain dilihat dari kualitas semen setelah thawing juga dapat dinilai dari banyaknya spermatozoa yang berhasil pulih kembali dari proses pembekuan yang disebut recovery rate (RR). Semen dengan pengencer DMSO 7% lebih tinggi (44.45±1.78%) dibandingkan 5% (34.36±2.50%) dan DMSO 9% (39.21±2.28%). Sehingga dapat simpulkan bahwa spermatozoa yang dibekukan menggunakan pengencer DMSO 7% lebih banyak spermatozoa yang berhasil pulih setelah proses pembekuan. Krioprotektan dibutuhkan untuk mencegah pembentukkan kristal es, akan tetapi krioprotektan juga bersifat toksik pada saat ekuilibrasi dan setelah thawing. Spermatozoa ayam sangat mudah rusak karena bentuk morfologi kepala yang lonjong, sehingga pengencer dan konsentrasi DMSO yang tepat mutlak dibutuhkan.
Kualitas Semen Beku Ayam Sentul dengan Konsentrasi Gliserol pada Pengencer Ringer Laktat dan Kuning Telur
Semen yang telah dibekukan dengan menggunakan konsentrasi gliserol 5% secara deskriptif memiliki nilai motilitas, viabilitas, dan recovery rate lebih tinggi dari gliserol 7% dan 9%. Berdasarkan hasil analisis dalam penelitian ini, faktor konsentrasi gliserol tidak memengaruhi kualitas semen beku yang dihasilkan walaupun terdapat variasi nilai (Tabel 8). Motilitas semen setelah ekuilibrasi dengan penambahan gliserol pada pengencer semen beku pada ayam berkisar 70-75% dan viabilitas setelah ekuilibrasi berkisar 85.61-88.12%. Sedangkan motilitas setelah thawing berkisar 27.96-34.26% dan viabilitas sebesar 43.53-50.09%. Tabel 8 Kualitas semen beku ayam sentul pada berbagai tahapan pembekuan
dalam pengencer ringer laktat kuning telur pada berbagai dosis gliserol Tahapan pembekuan Konsentrasi Gliserol (%)
5 7 9
Semen segar
Motilitas (%) 83.33±1.86 83.33±1.86 83.33±1.86
Viabilitas (%) 92.36±1.51 92.36±1.51 92.36±1.51 Setelah ekuilibrasi
Motilitas (%) 75.00±1.17 70.00±2.64 71.11±2.86
Viabilitas (%) 88.12±1.19 87.17±1.25 85.61±1.05
Setelah thawing
Motilitas (%) 34.26±1.64 30.18±3.27 27.96±3.28
Viabilitas (%) 50.09±1.29 47.07±3.31 43.53±3.19 Recovery rate (RR) 41.36±2.32 36.08±3.78 33.54±3.90
14
Recovery rate. Namun secara deskriptif didapatkan konsentrasi terbaik pada semua tahap pembekuan yaitu penggunaan gliserol 5%.
Kualitas Semen Beku Ayam Silangan Kampung Broiler dengan Konsentrasi DMA pada Pengencer Ringer Laktat dan Kuning Telur
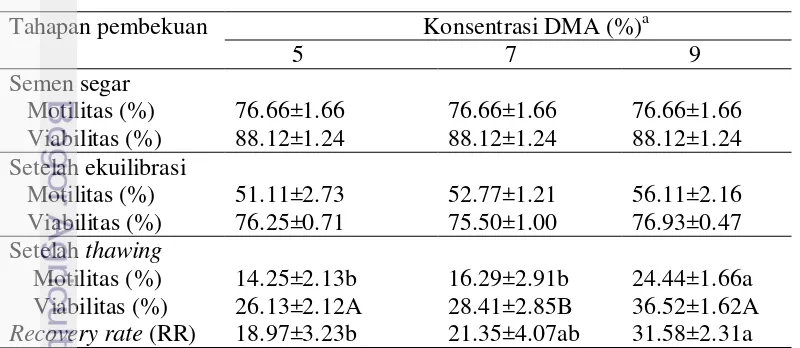
Hasil penelitian menunjukkan bahwa penambahan DMA ke dalam pengencer ringer laktat kuning telur tidak memengaruhi motilitas dan viabilitas spermatozoa setelah ekuilibrasi. Sesuai dengan hasil analisis statistik yang menunjukkan bahwa DMA berbeda tidak nyata terhadap persentase motilitas dan viabilitas spermatozoa setelah ekuilibrasi (Tabel 9). Hal ini disebabkan karena pada waktu ekuilibrasi belum terjadi penurunan temperatur yang drastis (dari suhu tubuh ke temperatur yang sangat rendah) sehingga efek perlindungan DMA belum terlihat.
Motilitas semen beku setelah thawing dengan penambahan DMA memperlihatkan pengaruh yang berbeda nyata (P<0.05). Penambahan DMA 9% ke dalam pengencer ringer laktat kuning telur menghasilkan persentase motilitas setelah thawing (24.44±1.66%) lebih besar dibanding DMA 5% (14.25±2.13%) dan DMA 7% (16.29±2.91%). Viabilitas setelah thawing dengan menggunakan DMA 9% (36.52±1.62%) lebih tinggi (P<0.01) dibanding DMA 5% (26.13±2.12%) dan DMA 7% (28.41±2.85%).
Tingginya persentase motilitas dan viabilitas spermatozoa setelah thawing pada perlakuan penambahan DMA 9%, memperlihatkan bahwa penambahan DMA 9% dalam bahan pengencer yang lebih untuk menyediakan perlindungan kelangsungan hidup spermatozoa selama proses pembekuan. Semen dengan pengencer DMA 9% (31.58±2.31%) lebih tinggi (P<0.05) dibandingkan 5% (18.97±3.23%) dan DMA 7% (21.35±4.07%). Sehingga dapat disimpulkan bahwa spermatozoa yang dibekukan menggunakan pengencer DMA 9% lebih banyak spermatozoa yang berhasil pulih setelah proses pembekuan.
Tabel 9 Kualitas semen beku ayam KB pada berbagai tahapan pembekuan pada pengencer ringer laktat kuning telur pada berbagai dosis DMA
Tahapan pembekuan Konsentrasi DMA (%)a
5 7 9
Semen segar
Motilitas (%) 76.66±1.66 76.66±1.66 76.66±1.66 Viabilitas (%) 88.12±1.24 88.12±1.24 88.12±1.24 Setelah ekuilibrasi Recovery rate (RR) 18.97±3.23b 21.35±4.07ab 31.58±2.31a a
15 Penggunaan DMA sebagai krioprotektan tidak terlalu efektif dalam mempertahankan kualitas semen beku. DMA tidak mampu melindungi kerusakan membran plasma, sebagai akibat terbentuknya peroksidasi lipid yang mengakibatkan perubahan struktur dan fungsi membran. Sehingga ketika dicairkan kembali menyebabkan perubahan aktivitas protein dan perubahan permeabilitas terhadap air dan zat terlarut. Peroksidasi lipid akan meningkat pasca thawing karena spermatozoa yang dibekukan lebih rentan terhadap stres oksidatif daripada spermatozoa segar.
Gillan et al. (2004) dan Dziekonska et al. (2009) juga menyatakan bahwa pendinginan dan pemanasan kembali akan merusak lipoprotein yang ada pada membran spermatozoa. Perubahan struktur yang dihasilkan dalam membran sel spermatozoa setelah thawing terutama terkait dengan kemampuan untuk mengubah sumber energi. Hal ini memengaruhi metabolisme seluler dan fungsi spermatozoa seperti pada motilitas. Motilitas terjadi jika spermatozoa mempunyai membran yang berfungsi dengan baik untuk menghasilkan energi gerak.
Uji Banding Freezing Capability antar Empat Rumpun Ayam Lokal dalam Pengencer Ringer Laktat Kuning Telur Menggunakan Jenis Krioprotektan
Berbeda
Pada saat proses pembekuan dan thawing spermatozoa mengalami berbagai perubahan suhu dan tekanan osmotik sehingga menurunkan kualitas semen diantaranya adalah penurunan motilitas dan viabilitas. Jenis individu dan jenis krioprotektan sangat memengaruhi kualitas semen beku pada setiap tahap pembekuan (Cooter et al. 2005; Andrabi 2007; Clulow et al. 2008).
Motilitas spermatozoa setelah ekuilibrasi tidak berbeda antara rumpun ayam lokal dengan nilai motil 68.44-70%. Gliserol 5% (74.58±0.96%) dan DMSO 7% (73.33±0.71%) memiliki nilai motil lebih besar (P<0.01) dibanding penggunaan jenis DMA 9% (60.83±1.92 %). Viabilitas spermatozoa setelah ekuilibrasi baik antara rumpun ayam maupun jenis krioprotektan yang digunakan menunjukkan perbedaan (P<0.01). Didapatkan hasil bahwa ayam sentul dan ayam pelung dengan penggunaan giserol 5% dan DMSO 7% merupakan yang terbaik pada penelitian ini.
Evaluasi kualitas semen sebelum dilakukan inseminasi merupakan ukuran kualitas yang sebenarnya dan dapat memberikan gambaran tingkat fertilitas yang akan dicapai. Ayam mempunyai sensitivitas yang tinggi terhadap cold shock dibanding spesies lainnya (Loomis dan Graham 2008). Pembekuan spermatozoa agar tercapai tingkat ketahanan yang tinggi, maka spermatozoa melewati periode adaptasi dahulu pada suhu 5o C. Tujuannya adalah memberikan kesempatan krioprotektan untuk melakukan penetrasi di membran plasma sel spermatozoa.
16
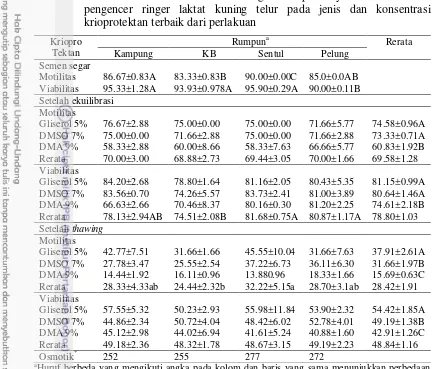
Tabel 10 Karakteristik semen beku berbagai rumpun ayam lokal dalam pengencer ringer laktat kuning telur pada jenis dan konsentrasi krioprotektan terbaik dari perlakuan
Kriopro Tektan
Rumpuna Rerata
Kampung KB Sentul Pelung
Semen segar
Motilitas 86.67±0.83A 83.33±0.83B 90.00±0.00C 85.0±0.0AB Viabilitas 95.33±1.28A 93.93±0.978A 95.90±0.29A 90.00±0.11B Setelah ekuilibrasi
Motilitas
Gliserol 5% 76.67±2.88 75.00±0.00 75.00±0.00 71.66±5.77 74.58±0.96A DMSO 7% 75.00±0.00 71.66±2.88 75.00±0.00 71.66±2.88 73.33±0.71A DMA 9% 58.33±2.88 60.00±8.66 58.33±7.63 66.66±5.77 60.83±1.92B Rerata 70.00±3.00 68.88±2.73 69.44±3.05 70.00±1.66 69.58±1.28 Viabilitas
Gliserol 5% 84.20±2.68 78.80±1.64 81.16±2.05 80.43±5.35 81.15±0.99A DMSO 7% 83.56±0.70 74.26±5.57 83.73±2.41 81.00±3.89 80.64±1.46A DMA 9% 66.63±2.66 70.46±8.37 80.16±0.30 81.20±2.25 74.61±2.18B Rerata 78.13±2.94AB 74.51±2.08B 81.68±0.75A 80.87±1.17A 78.80±1.03 Setelah thawing
Motilitas
Gliserol 5% 42.77±7.51 31.66±1.66 45.55±10.04 31.66±7.63 37.91±2.61A DMSO 7% 27.78±3.47 25.55±2.54 37.22±6.73 36.11±6.30 31.66±1.97B DMA 9% 14.44±1.92 16.11±0.96 13.880.96 18.33±1.66 15.69±0.63C Rerata 28.33±4.33ab 24.44±2.32b 32.22±5.15a 28.70±3.1ab 28.42±1.91 Viabilitas
Gliserol 5% 57.55±5.32 50.23±2.93 55.98±11.84 53.90±2.32 54.42±1.85A DMSO 7% 44.86±2.34 50.72±4.04 48.42±6.02 52.78±4.01 49.19±1.38B DMA 9% 45.12±2.98 44.02±6.94 41.61±5.24 40.88±1.60 42.91±1.26C Rerata 49.18±2.36 48.32±1.78 48.67±3.15 49.19±2.23 48.84±1.16
Osmotik* 252 255 277 272
a
Huruf berbeda yang mengikuti angka pada kolom dan baris yang sama menunjukkan perbedaan (Huruf besar berbeda sangat nyata (P<0.01) sedangkan huruf yang kecil menunjukkan hasil berbeda nyata (P<0.05). *Osmotik: Tekanan osmotik (mOsmol kg -1).
Motilitas merupakan salah satu parameter yang paling sering digunakan untuk mengevaluasi fertilitas spermatozoa (Dziekonska et al. 2009). Motilitas spermatozoa juga berkaitan erat dengan viabilitas spermatozoa. Artinya, nilai persentase motilitas spermatozoa yang rendah akan menghasilkan nilai persentase viabilitas yang rendah. Begitu juga sebaliknya, nilai persentase motilitas spermatozoa yang tinggi akan menghasilkan nilai persentase viabilitas yang tinggi. Hal ini berarti nilai motilitas spermatozoa berpengaruh terhadap nilai viabilitas spermatozoa. Persentase motilitas spermatozoa yang tinggi mempunyai daya gerak yang progresif dan menghasilkan gerakan massa sehingga menunjukkan bahwa spermatozoa masih banyak yang hidup dan menghasilkan persentase viabilitas yang tinggi. Semen yang memiliki persentase motiltas spermatozoa yang rendah memiliki ketahanan hidup yang jelek.
17 7% juga memberikan hasil yang lebih baik daripada penggunaan DMA 9% (P<0.01) dalam mempertahankan daya hidup spermatozoa selama penyimpanan.
Kematian spermatozoa terjadi karena sifat kimiawi spermatozoa yang menghasilkan metabolisme sel yang dapat menjadi racun bagi kehidupannya. Yulnawati dan Setiadi (2005) menjelaskan bahwa spermatozoa yang mati dan menjadi toksik terhadap spermatozoa lain yang masih hidup, sehingga secara umum viabilitasnya menjadi menurun. Keberadaan zat yang bersifat toksik baik yang berasal dari spermatozoa yang telah mati maupun yang berasal dari zat yang terkandung dari pengencer yang telah mengalami oksidasi akibat penyimpanan dapat menyebabkan tingginya kadar radikal bebas yang dapat merusak keutuhan membran plasma spermatozoa. Begitupula pendapat Solihati et al. (2006) bahwa jumlah spermatozoa yang mati akan memengaruhi spermatozoa yang masih hidup selama proses penyimpanan.
Uji tekanan osmotik menunjukkan bahwa semen segar pada berbagai rumpun ayam lokal memiliki nilai kisaran 252-277 mOsmol kg-1. Pengujian tekanan osmotik berguna untuk menentukan penggunaan jenis krioprotektan yang digunakan pada pembekuan semen. Pengujian tekanan osmotik pada pengencer semen adalah 889-2 298 mOsmol kg-1 menunjukkan tekanan osmotik yang cukup tinggi dibandingkan tekanan osmotik semen ayam. Hasil pengujian tekanan osmotik pengencer dengan penambahan krioprotektan didapatkan pengencer semen beku ayam dengan tekanan osmotik ideal yaitu 1 010-1 230 mOmol kg-1. Berdasarkan hasil tersebut terlihat bahwa bahan pengencer mempunyai tekanan yang hiperosmotik. Tingginya tekanan osmotik diluar sel akan menyebabkan keluamya air dari dalam sel sehingga menyebabkan sel mengkerut dan cairan sel yang keluar diganti oleh krioprotektan.
Faktor yang perlu diperhatikan dalam memilih jenis krioprotektan untuk pembekuan yaitu, bahan pengencer sebaiknya tidak mudah mengalami perubahan struktur menjadi bentuk ion yang dapat mengubah tekanan osmotik larutan pengencer, agar integritas membran plasma sel tidak mudah rusak (Souhoka et al. 2009). Membran spermatozoa adalah selaput yang bersifat semipermiabel. Sehingga perubahan tekanan osmotik yang mendadak menyebabkan kejutan yang berakibat pada penurunan viabilitas spermatozoa dan kerusakan membran.
Selama kriopreservasi terjadi perubahan temperatur dan osmolalitas yang ekstrem. Aksi tersebut berefek pada perubahan struktur dan komposisi lipid membran plasma yang mempengaruhi bagian penting spermatozoa (Moće dan Graham 2008). Konsekuensinya adalah terjadi kerusakan fungsional spermatozoa yang berefek pada penurunan motilitas, pergerakan abnormal dan kematian dini spermatozoa (Loomis dan Graham 2008).
Recovery Rate Semen Beku Berbagai Rumpun Ayam Lokal pada Berbagai Jenis Krioprotektan
18
krioprotektan yang digunakan dalam pengencer semen beku. Pada keempat rumpun ayam tersebut, terlihat bahwa masing-masing jenis mempunyai RR yang berbeda (Tabel 11).
Ayam sentul ternyata memiliki RR lebih tinggi (P<0.05) daripada ayam kampung, pelung, maupun ayam silangan kampung broiler. Sedangkan ayam kampung, ayam pelung, dan ayam silangan kampung broiler tidak memiliki perbedaan. Nilai RR ayam lebih kecil dibanding pada itik bisa mencapai 73.12% (Han et al. 2005). Nilai RR berbeda-beda antar individu, atau antar ternak. Pada ternak sapi nilai RR antara 61.70% sapi Simental (Sukmawati 2014) sampai dengan 69.56% sapi FH (Arifiantini et al. 2005), pada ternak kuda nilai RR sangat rendah hanya 32.7% (Arifiantini et al. 2007).
Tabel 11 Recovery rate semen beku berbagai rumpun ayam lokal dalam pengencer ringer laktat kuning telur pada berbagai jenis krioprotektan Kriopro
Tektan
Rumpun Ayama Rerata
Kampung KB Sentul Pelung
Gliserol 5% 50.62±10.42 38.03±2.37 52.40±10.19 37.83±8.05 44.72±2.91A DMSO 7% 32.67±4.08 31.98±3.09 43.14±8.98 43.30±7.00 37.77±2.25B DMA 9% 17.03±2.42 19.82±2.29 16.34±1.13 21.57±1.96 18.69±0.80C Rerata 33.44±5.21ab 29.94±2.78b 37.29±5.86a 34.23±3.73ab 33.73±2.22 a
Huruf berbeda yang mengikuti angka pada kolom dan baris yang sama menunjukkan perbedaan (Huruf besar berbeda sangat nyata (P<0.01) sedangkan huruf yang kecil menunjukkan hasil berbeda nyata (P<0.05).
Nilai RR pada semen beku tanpa memerhatikan rumpun ayam, penggunaan gliserol 5% (44.72%) lebih tinggi (P<0.01) dibandingkan DMSO 7% (37.77±%) dan DMA 9% (18.69%). Nilai RR dengan menggunakan DMSO 7% lebih tinggi (P<0.01) dibandingkan penggunaan DMA 9%. Spermatozoa yang dibekukan menggunakan pengencer gliserol 5% dan DMSO 7% lebih banyak spermatozoa yang berhasil pulih setelah proses pembekuan. Krioprotektan dibutuhkan untuk mencegah pembentukkan kristal es, akan tetapi krioprotektan juga bersifat toksik pada saat ekuilibrasi dan setelah thawing. Spermatozoa ayam sangat mudah rusak karena bentuk morfologi kepala yang lonjong, sehingga pengencer dan konsentrasi yang tepat mutlak dibutuhkan. Hasil penelitian menunjukkan jenis krioprotektan yang terbaik pada pembekuan semen ayam yaitu gliserol 5%. Hal ini sesuai pendapat Mumu (2009) bahwa gliserol memiliki peranan yaitu mencegah terjadinya dehidrasi, karena memiliki daya pengikat air yang kuat. Hal ini akan memengaruhi tekanan uap sehingga titik beku medium menurun, akibatnya sel spermatozoa akan memperoleh kesempatan lebih lama untuk mengeluarkan air. Gliserol akan memberikan perlindungan yang efektif terhadap spermatozoa selama proses pembekuan bila konsentrasinya di dalam pengencer optimal.
Penurunan Motilitas Spermatozoa Semen Beku berbagai Rumpun Ayam Lokal dengan Penggunaan Krioprotektan Terbaik
19 setelah ekuilibrasi, dari ekuilibrasi ke setelah thawing dan juga dari semen segar ke setelah thawing (Gambar 2). Pengukuran penurunan motilitas setiap tahap pembekuan semen ayam bertujuan untuk mengetahui titik kritis dari pembekuan semen ayam tersebut. Pengetahuan tentang penurunan motilitas pada pembekuan semen sangat penting karena dianggap sebagai salah satu parameter yang paling sering digunakan untuk mengevaluasi fertilitas spermatozoa. Spermatozoa yang memiliki penurunan sangat tinggi menandakan bahwa kualitas spermatozoa tersebut kurang baik untuk digunakan pada inseminasi. Penurunan kualitas spermatozoa pada setiap tahap pembekuan dipengaruhi oleh kualitas spermatozoa dan kualitas pengencer semen yang digunakan.
Gambar 2 Penurunan motilitas semen beku berbagai rumpun ayam lokal pada setiap tahap pembekuan. Huruf berbeda di atas balok data menunjukkan perbedaan penurunan motilitas yang nyata (P<0.05). Penurunan kualitas semen segar ayam sampai setelah ekuilibrasi berbeda (P<0.05) antara rumpun ayam lokal (Gambar 2). Ayam hasil silangan kampung broiler memiliki penurunan 14.44% lebih rendah dibanding ayam ayam kampung (16.67%), ayam sentul (20.55%), dan ayam pelung (15.00%). Hal ini disebabkan karena kualitas semen segar yang dihasilkan berbeda-beda sehingga berpengaruh terhadap kualitas semen setelah ekuilibrasi yang dihasilkan. Namun pada proses pembekuan sampai setelah penyimpanan penurunan kualitas semen antara rumpun ayam lokal tidak berbeda dengan penurunan 37.22 - 44.44%. Bangsa ayam tidak berpengaruh terhadap penurunan kualitas semen beku secara total mulai pada semen segar sampai setelah thawing dengan kisaran (56.29-58.88%). Penurunan motilitas terjadi karena terbentuknya kristal es menyebabkan kerusakan struktur membran secara fisik dan adanya radikal bebas yang terbentuk dapat memicu terjadinya peroksidasi lipid sehingga akan menurunkan motilitas spermatozoa (Carreira et al. 2013).
20
Gambar 3 Penurunan motilitas semen beku ayam lokal pada setiap tahap pembekuan dengan penggunaan jenis kriorotektan berbeda. Huruf yang berbeda di atas balok data menunjukkan perbedaan penurunan motilitas (huruf besar berbeda sangat nyata (P<0.01) sedangkan huruf yang kecil menunjukkan hasil berbeda nyata (P<0.05)).
Penurunan motilitas spermatozoa akibat pembekuan terkait dengan kerusakan mitokondria. Motilitas spermatozoa bergantung pada fungsi mitokondria. Sebagaimana yang dikemukakan oleh Dziekonska et al. 2009) bahwa Adenosine Tri Phosphate (ATP) dihasilkan oleh fosforilasi oksidatif di dalam membran mitokondria dan ditransfer ke mikrotubulus untuk motilitas. Hal tersebut sesuai dengan pendapat Susmiarsih (2010) yang menyatakan bahwa DNA mitokondria berperan pada gangguan motilitas spermatozoa. Hal ini diperjelas oleh Tremellen (2008) rusaknya membran plasma mitokondria spermatozoa mengakibatkan terganggunya metabolisme sel spermatozoa, sehingga menyebabkan penurunan motilitas spermatozoa.
SIMPULAN DAN SARAN
Simpulan
Kualitas semen segar ayam pelung lebih baik dibandingkan semen segar ayam kampung, pelung dan silangan kampung broiler. DMSO 7% merupakan konsentrasi terbaik pada pembekuan semen ayam kampung. Gliserol 5% merupakan konsentrasi terbaik pada pembekuan semen ayam sentul. DMA 9% merupakan konsentrasi terbaik pada pembekuan semen ayam KB. Penggunaan gliserol 5% merupakan krioprotektan terbaik pada pengencer semen beku dibandingkan dengan krioprotektan DMSO 7% dan DMA 9% pada berbagai rumpun ayam lokal. Ayam sentul memiliki freezing capability paling tinggi dibandingkan rumpun ayam lokal lainnya.
Saran
Pembekuan semen ayam kampung dan ayam sentul dapat menggunakan gliserol 5%. Sedangkan pembekuan semen ayam pelung menggunakan DMSO 7%. Penelitian lebih lanjut diperlukan untuk uji in vivo pada ternak ayam.
21
DAFTAR PUSTAKA
Alkan S, Baran A, Banu, Evecan M. 2002. Morphological defects in Turkey semen. J Vet Anim Sci. 26:1087-1092.
Alvarenga MA, Papa FO, Landim FC. 2005. Amides as cryoprotectants for freezing stallion semen. Anim Reprod Sci. 89:105–113.
Andrabi SMH. 2007. Fundamental principles of cryopreservation of Bos taurus and Bos indicus bull spermatozoa. J Agri and Biol. 9:367-369.
Arifiantini I, Yusuf TL, Graha N. 2005. Recovery rate dan longivitas pasca thawing semen beku sapi FH (Friesian Holstein) menggunakan berbagai bahan pengencer. Buletin Peternakan. 29(2):53-61.
Arifiantini I, Supriatna I . 2007. Stallion semen cryopreservation using different cryoprotective agents on the skim milk trehalosa extender. JITV. 12(2):139-146.
Arifiantini I. 2012. Teknik Koleksi dan Evaluasi Semen pada Hewan. Bogor (ID): IPB Pr.
Azizah dan Arifiantini I. 2009. Kualitas semen beku kuda pada pengencer susu skim dengan konsentrasi gliserol yang berbeda. Jurnal Veteriner. 10(2):63-70.
Dziekońska A, Fraser L, Strzeżek J. 2009. Effect of different storage temperatures on themetabolic activity of spermatozoa following liquid storage of boar semen. J Anim and Feed Sci. 18:638-649.
Bearden HJ, Fuquay JW, Willard ST. 2004. Applied Animal Reproduction. 6thed. New Jersey (US): Pearson Prentice Hall.
Castillo A, Romboi I, Marzoni M. 2010. Preliminary investigation on fertility and hatchability by the use of cryopreserved cock semen. Av Biol Res. 3:127-128.
Chen SU, Lien YR, Chen HF, Chang LJ, Tsai YY, Yang YS. 2005. Observational clinical follow-up of oocyte cryopreservation using a slow-freezing method with 1,2-propanodiol plus sucrose followed by ICSI. Hum Reprod. 20:1975-1980.
Cooter PZ, HA Goolsby, SD Prien. 2005. Preliminary evaluation of a unique freezing technology for bovine spermatozoa cryopreservation. Reprod Dom Animal. 40:98- 99.
Dadang MS, Sugiyatno. 2007. Pengaruh aras gliserol terhadap motilitas dan fertilitas spermatozoa ayam kampung yang dibekukan dengan nitrogen cair. Anim Product. 1411-2027.
Dumpala PR, Parker HM, Daniel MC. 2006. The effect of semen storage temperature and diluent type on the sperm quality index of Broiler breeder semen. J Poult Sci. 5:838–845.
Dziekońska A, Fraser L, Strzeżek J. 2009. Effect of different storage temperatures on the metabolic activity of spermatozoa following liquid storage of boar semen. J Anim and Feed Sci. 18:638-649.
22
Gerzilov V. 2010. Influence of various cryoprotectants on the sperm mobility of Muscovy semen before and after cryopreservation. Agric Sci Technol. 2:57 – 60.
Gillan L, Maxwell WMC, Evans G. 2004. Preservation and evaluation of semen for artificial insemination. Reprod Fertil Dev. 16:447-454.
Gomes KA, Artuto AG. 2007. Prosedur Statistik untuk Penelitian Pertanian. Endang S, Justika SB penerjamah. Jakarta (ID):UI Pr
Han XF, Niu ZY, Liu FZ, Yang CZ. 2005. Effects of diluents, cryoprotectants, equilibration time and thawing temperature on cryopreservation of duck semen. J Poult Sci. 4:197-201.
Iskandar SR, Mardalestari R, Hernawati E, Mardiah, Wahyu E. 2006. Pengaruh jenis, konsentrasi krioprotektan dan metode thawing terhadap kualitas semen beku ayam Arab. JITV. 11:34 –38.
Kostaman T, Sutama IK. 2006. Studi motilitas dan daya hidup spermatozoa kambing boer pada pengencer tris sitrat-fruktosa. J Sain Vet. 24(1):58-64. Loomis PR, Grahamb JK. 2008. Commercial semen freezing: Individual male
variation in cryosurvival and the response of stallion sperm to customized freezing protocols. Anim Reprod Sci. 105:119–128.
Luz MR, Holanda CC, Pereira JJ, Teixeira NS, Vantini R, Freitas PMC, Salgado AEP, Oliveira SB, Guaitolini CRF, Santos MC. 2009. Survival rate and in vitro development of in vivo-produced and cryopreserved dog embryos. Reprod Fertil Develop. 22:208 – 209.
Makhafola MB, Lehloenya KC, Mphaphathi ML, Dinnyes A, Nedambale TL. 2009. The effect of breed on the survivability and motility rate of cryopreserved cock semen. South African J Anim Sci. 39:242 – 245.
Malik A, Haron AW, Yusoff R, Nesa M, Bukar M, Kasim A. 2013. Evaluation of the ejaculate quality of the red jungle fowl, domestic chicken, and bantam chicken in Malaysia. J Vet Anim Sci. 37:564-568
Mitchell V, Rives N, Albert M, Peers M, Selva J, Clavier B, Escudier E, Escalier D. 2006. Outcome of ICSI with ejaculated spermatozoa in a series of men with distinct ultrastructural fl agellar abnormalities. Hum Reprod. 21:2065– 2074.
Moce E, Graham JK. 2008. In vitro evaluation of sperm quality. Anim Reprod Sci. 105:104-118.
Morrell JM, Johannisson A, Dalin AM, Hammar L, Sandebert T, Rodriguez-Martinez H. 2008. Sperm morphology and chromatin integrity in Swedish warmblood stallions and their relationship to pregnancy rates. Acta Vet Scand. 50:1-7.
Mumu IM. 2009. Viabilitas semen sapi simmental yang dibekukan menggunakan krioprotektan gliserol. J Agroland. 16(2):172-179.
Nebel RL. 2007. Techniques for Artificial Insemination of Cattle With Frozen Thawed Semen. Di dalam: Current Therapy In Large Animal. 2th ed. Saunders Elselvier. (JP): Missouri.
Saacke RG. 2008. Sperm morphology: Its relevance to compensable and uncompens-able traits in semen. Theriogenology. 70:473–478.
23 Solihati N, Idi R, Rasad SD, Rizal M, Fitriati M. 2008. Kualitas spermatozoa cauda epididymis sapi peranakan ongol (PO) dalam pengencer susu, tris dan sitrat kuning telur pada penyimpanan 4-5 oC. J Anim Prod. 10(1):22-29. Souhoka DF, Matatula MJ, Mesang-Nalley WM, Rizal M. 2009. Laktosa
mempertahankan daya hidup spermatozoa kambing peranakan etawa yang dipreservasi dengan plasma semen domba priangan. J Veteriner. 10 (3):135-142.
Suidzinska, A, Lukaszewicz E. 2008. The effect of breed on freezability of semen of fancy fowl. Anim Sci Pap Rep. 26:331 – 340.
Sukmawati E. 2014. Daya tahan spermatozoa terhadap proses pembekuan pada berbagai jenis sapi pejantan unggul [tesis]. Bogor (ID): Institut Pertanian Bogor
Susmiarsih T. 2010. Peran Genetik DNA Mitokondria (mtDNA) pada Motilitas Spermatozoa. Jakarta (ID). Pharma Medika.
Tremellen K. 2008. Oxidative stress and male infertility – a clinical perspective. Hum Reprod. 14:243-258.
Valerdi MR, Eftekhari P, Yazdi, Karimian L, Hassani F, Movaghar B. 2009. Vitrification versus slow freezing gives excellent survival, post warming embryo morphology and pregnancy outcomes for human cleaved embryos. J Assist Reprod Genet. 26:347 – 354.
Waluyo TS. 2006. Pengaruh penggunaan prolin dalam pengencer susu skim pada spermatozoa beku terhadap kualitas spermatozoa domba priangan. Anim Prod. 8: 22- 27.
Widya A, Kustono, Widayati TA, Bintara S, Ismaya. 2013. Pengaruh dosis sperma yang diencerkan dengan NaCl fisiologis terhadap fertilitas telur pada inseminasi buatan ayam Kampung. Buletin Peternakan. 37(1):1-5.
24
LAMPIRAN
Lampiran 1 Proses pembuatan pengencer
25 Lampiran 3 Proses pengemasan dan ekuilibrasi semen ayam