INISIASI RIMPANG MIKRO
Kaempferia parviflora
SECARA
IN VITRO
DENGAN PENAMBAHAN BAP DAN SUKROSA
LEFIN KAFINDRA
DEPARTEMEN AGRONOMI DAN HORTIKULTURA FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Inisiasi Rimpang Mikro Kaempferia parviflora secara In Vitro dengan Penambahan BAP dan Sukrosa adalah benar karya saya dengan arahan dari pembimbing skripsi dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Januari 2015
Lefin Kafindra
ABSTRAK
LEFIN KAFINDRA. Inisiasi Rimpang Mikro Kaempferia parviflora secara In Vitro
dengan Penambahan BAP dan Sukrosa. Dibimbing oleh NURUL KHUMAIDA dan SINTHO WAHYUNING ARDIE.
Kaempferia parviflora merupakan tanaman obat yang mengandung metabolit sekunder dan berkhasiat untuk mengobati berbagai macam penyakit. Perbanyakan
K. parviflora menggunakan rimpang terkendala oleh lamanya waktu untuk memproduksi rimpang di lapang, yaitu mencapai 8 bulan setelah tanam. Tujuan dari penelitian ini adalah untuk memperoleh konsentrasi sukrosa terbaik dan konsentrasi BAP terbaik dalam inisiasi rimpang mikro K. parviflora. Percobaan ini disusun berdasarkan rancangan kelompok lengkap teracak dengan dua faktor dan tiga ulangan. Faktor pertama adalah konsentrasi BAP dengan 3 taraf, yaitu 0, 2, dan 4 mg L¯1.Faktor kedua adalah konsentrasi sukrosa dengan 4 taraf, yaitu 0, 30, 60, dan 90 g L¯1. Data yang diperoleh dianalisis menggunakan uji F dan apabila berpengaruh nyata, maka dilanjutkan dengan uji lanjut DMRT (Duncan MultipleRange Test) pada taraf α= 5 %. Hasil penelitian menunjukkan bahwa K. parviflora dapat membentuk rimpang mikro in vitro. Hal tersebut ditunjukkan oleh struktur anatomi rimpang mikro yang serupa dengan rimpang in vivo. K. parviflora yang dikulturkan pada media MS yang mengandung 90 g L¯1 sukrosa tanpa BAP memiliki jumlah rimpang mikro tertinggi pada 8 MSP. Kata kunci: kesehatan, kencur hitam, obat tradisional
ABSTRACT
LEFIN KAFINDRA. Application of BAP and Sucrose In The In Vitro Micro Rhizome Initiation of Kaempferia parviflora.Supervised by NURUL KHUMAIDA and SINTHO WAHYUNING ARDIE.
Kaempferia parviflora is a medicinal plant that contains secondary metabolites and efficacious for treating various diseases. Rapid multiplication of K. parviflora
through its rhizome is hamprered by the long period needed to produce the rhizome. The objectives of this research were to obtain the best sucrose concentration and to determine the best BAP concentration in the in vitro micro rhizome initiation of K. parviflora. The experiment was arranged in a randomized complete block design with two factors and three replications. The first factor was BAP concentration, consisted of three levels i.e. 0, 2, and 4 mg L¯1. The second factor was sucrose concentration, consisted of four levels i.e. 0, 30, 60, and 90 g L¯1. Data obtained were analyzed by F-test, followed by DMRT (Duncan Multiple Range Test) at 5 % significant level. Sucrose concentration significantly affected the number of shoots and plantlets fresh weight. The results showed that K. parviflora could form micro rhizome in vitro, as indicated by the similar anatomical structure compared to the rhizome produced in vivo. K. parviflora cultured in MS medium cointaining 90 g L¯1 sucrose without BAP had the highest number of micro rhizome at 8 WAC.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Pertanian
pada
Departemen Agronomi dan Hortikultura
INISIASI RIMPANG MIKRO
Kaempferia parviflora
SECARA
IN VITRO
DENGAN PENAMBAHAN BAP DAN SUKROSA
LEFIN KAFINDRA
DEPARTEMEN AGRONOMI DAN HORTIKULTURA FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR BOGOR
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak Maret hingga Agustus 2014 ini ialah Inisiasi Rimpang Mikro Kaempferia parviflora secara In Vitro dengan Penambahan BAP dan Sukrosa.
Terima kasih penulis ucapkan kepada Ibu Dr Ir Nurul Khumaida, MSi dan Ibu Dr Sintho Wahyuning Ardie, SP, MSi selaku pembimbing skripsi, Prof Dr Ir H Didy Sopandie, M.Agr selaku pembimbing akademik, yang telah banyak memberikan bimbingannya, dan Dr Ir Agus Purwito, M.Agr selaku penguji tugas akhir. Rekan-rekan AGH 47 dan UKM Pramuka IPB, serta keluarga Pringsewu IPB yang telah banyak memberi saran dan semangat. Ungkapan terima kasih juga disampaikan kepada ayah, ibu, serta seluruh keluarga, atas segala doa dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat.
Bogor, Januari 2015
DAFTAR ISI
DAFTAR TABEL vii
DAFTAR GAMBAR vii
DAFTAR LAMPIRAN vii
PENDAHULUAN 1
Latar Belakang 1
Tujuan 2
TINJAUAN PUSTAKA 2
Kaempferia parviflora 2
Pengumbian Mikro 4
METODE PENELITIAN 5
HASIL DAN PEMBAHASAN 7
SIMPULAN DAN SARAN 18
Simpulan 18
Saran 18
DAFTAR PUSTAKA 18
LAMPIRAN 23
DAFTAR TABEL
1 Rekapitulasi sidik ragam peubah yang diamati pada inisiasi rimpang mikro
K. parviflora 9
2 Pengaruh konsentrasi sukrosa terhadap jumlah tunas 2 MSP dan bobot
basah planlet K. parviflora pada 10 MSP 10
3 Pengaruh konsentrasi sukrosa dan BAP terhadap pertumbuhan planlet
K. parviflora pada 8 MSP 10
4 Interaksi konsentrasi BAP dan sukrosa terhadap jumlah rimpang mikro
planlet K. parviflora pada 8 MSP 12
5 Korelasi beberapa parameter pengamatan K. parviflora pada 8 MSP 15
DAFTAR GAMBAR
1 Planlet K. parviflora yang terserang cendawan pada 4 (a) dan 8 (b) MSP 8 2 Kondisi planlet K. parviflora pada berbagai media perlakuan pada 8 MSP 11 3 Grafik pertumbuhan tinggi planlet K. parviflora 12 4 Grafik pertumbuhan jumlah tunas planlet K. parviflora 13 5 Grafik pertumbuhan jumlah daun planlet K. parviflora 13 6 Keragaan rimpang dan anatomi in vitro dan in vivo Kaempferia parviflora 16 7 Keragaan tangkai daun dan anatomi in vitro pada 8 MSP dan in vivo pada
12 bulan setelah aklimatisasi K. parviflora 16
8 Keragaan daun anatomi daun in vitro dan in vivo Kaempferia parviflora 17
DAFTAR LAMPIRAN
PENDAHULUAN
Latar Belakang
Tanaman obat merupakan salah satu tanaman yang penting keberadaannya di Indonesia, hal tersebut karena masyarakat Indonesia banyak memanfaatkannya sebagai ramuan obat tradisional. Angka impor total tanaman obat 2012 mencapai 24 352.81 ton, sedangkan ekspor 3 466.22 ton dengan nilai sebesar US$18 040 581 dan US$7 469 935 (Ditjen Hortikultura 2012). Bentuk ekspor pada umumnya berupa bahan-bahan mentah,
seperti tanaman kering, bahan-bahan ekstrak, dan sebagian kecil produk jadi (INATRIMS 2014). Bentuk bahan baku obat tradisional yang diimpor berupa bahan
baku jamu, bahan baku ekstrak terstandar, bahan baku fitofarmaka (obat berbahan alam yang memenuhi syarat aman, berguna, dan berkhasiat yang dibuktikan dengan uji klinis), serta simplisia (bahan alam yang telah dikeringkan berupa tanaman utuh, daun, buah, batang, akar dan ekstrak tanaman) (Putri 2014a). Permintaan yang cukup tinggi terhadap tanaman obat menunjukkan bahwa pengembangan tanaman obat memiliki peluang pasar yang cukup besar di Indonesia.
Tanaman dari famili Zingiberaceae memiliki berbagai manfaat bagi masyarakat seperti, obat batuk, rematik, masuk angin, bumbu masak, dan sebagainya. Tanaman
Kaempferia parviflora termasuk dalam famili Zingiberaceae, yang berasal dari Thailand dan dikenal dengan sebutan “krachai dum”, banyak digunakan sebagai obat tradisional, viagra (Wannanon et al. 2012; Wattanathorn et al. 2012), juga banyak digunakan sebagai obat tradisional penambah energi (Putiyanan et al. 2008). Penelitian menunjukkan bahwa ekstrak rimpang tanaman tersebut memiliki banyak khasiat seperti antioksidan (Vichitphan et al. 2007), anti depresi (Wattanathorn et al. 2007; Rajput et al. 2011), anti halusinasi (Tewtrakul dan Subhadirasakul 2008) dan menghambat aktivitas Helicobacter pylori (Chaichanawongsaroj et al. 2010), serta sebagai obat stroke (Phachonpai et al. 2012). Tanaman tersebut banyak digunakan sebagai obat dan dalam kegiatan spiritual oleh masyarakat Thailand (Picheansoonthon dan Koonterm 2008). Tanaman ini juga banyak digunakan sebagai ramuan untuk menyeimbangkan tekanan darah serta mengurangi sakit perut di daerah asalnya yaitu Provinsi Loei (Trisomboon 2009). Menurut Lawrence dan Bacharach (1964) K. parviflora dapat dimanfaatkan sebagai tanaman hias dan rimpangnya dapat diolah untuk ekstrak rasa, bumbu, serta minyak wangi untuk parfum.
2
secara in vitro perlu dilakukan untuk memperoleh bahan tanam yang seragam, dengan mutu yang baik, serta waktu yang cepat. Teknik perbanyakan tanaman secara cepat diperlukan untuk memenuhi kebutuhan penyediaan bahan tanam dalam negeri. Inisiasi rimpang mikro penting dilakukan karena propagul rimpang mikro yang berasal dari eksplan bebas penyakit yang akan menghasilkan rimpang mikro yang bebas penyakit. Wattimena (2000) menyatakan bahwa penggunaan umbi mikro pada kentang dapat menghasilkan tanaman yang seragam dan umur panen sama dengan rimpang biasa, mudah dalam penyimpanan, transportasi dan pengiriman, mudah memenuhi persyaratan karantina untuk lalu lintas propagul baik dalam atau luar negeri. Oleh karena itu, pengembangan rimpang mikro pada K. parviflora juga dapat mempermudah penyimpanan dan transportasi rimpang untuk perbanyakan.
Beberapa senyawa dapat digunakan untuk menginduksi terbentuknya umbi atau rimpang mikro. Hartanto et al. (2010) melaporkan bahwa aplikasi sukrosa dengan konsentrasi 6 % dapat menginduksi terbentuknya rimpang tanaman daun dewa secara
in vitro. Aplikasi sukrosa untuk menginduksi rimpang mikro juga telah dilaporkan pada gembili, yaitu dengan konsentrasi 3-8 % (Ratna 2010). Selain sukrosa, 6-benzyl-adeno-purine (BAP) dilaporkan dapat menginduksi terbentuknya rimpang mikro pada jahe (Rahmawati et al. 2004). Hasil beberapa penelitian tersebut menunjukkan bahwa penambahan BAP dan sukrosa diperlukan untuk menginisiasi terbentuknya rimpang mikro.
Tujuan
Tujuan umum dari penelitian ini adalah untuk mempelajari inisiasi rimpang mikro
Kaempferia parviflora secara in vitro dan mendapatkan komposisi media yang optimum.
Tujuan khusus dari penelitian ini adalah:
1) Mengetahui pengaruh konsentrasi sukrosa terhadap pembentukan rimpang mikro
K. parviflora.
2) Mengetahui pengaruh konsentrasi BAP terhadap pembentukan rimpang mikro
K. parviflora.
3) Mengetahui pengaruh interaksi BAP dan sukrosa dalam pembentukan rimpang mikro
K. parviflora.
TINJAUAN PUSTAKA
Kaempferia parviflora
3 2008), dan Phitsanulok (Chivapat et al. 2010). Tanaman tersebut banyak ditemukan di hutan yang lembab, dan hutan bambu serta di bawah tegakkan pepohonan (Picheansoonthon dan Koonterm 2008).
Klasifikasi K. parviflora secara taksonomi adalah sebagai berikut (ICS Unido 2004):
Kingdom : Plantae
Sub-kingdom : Phanerogamae Divisi : Spermatophyta
Subdivisi : Angiospermae Kelas : Monocotyledonae Ordo : Scitaminales Family : Zingiberaceae Genus : Kaempferia
Species : Kaempferia parviflora
Tanaman K. parviflora memiliki keragaan morfologi yang khas seperti warna rimpang ungu kehitaman apabila dibelah (Graham et al. 2006; Putiyanan et al. 2008), rimpang luar berwarna kecokelatan (Putiyanan et al. 2008), penampang melintang rimpang K. parviflora berbentuk bundar atau elips dan memiliki garis lingkaran di tengah dan rimpang yang memiliki kuncup merupakan calon rimpang yang akan tumbuh menjadi individu tanaman (Graham et al. 2006). Penelitian Evi (2012) menunjukkan bahwa daun K. parviflora berbentuk elips dengan dasar bulat, panjang daun 8 sampai 21 cm, lebar daun 5 sampai 11 cm, serta batas daun bergelombang dan berwarna kemerahan, sementara penelitian Putiyanan et al. (2008) menunjukkan daun berwarna hijau, epidermis atas berwarna hijau tua, epidermis bawah berwarna hijau muda, tangkai daun berwarna hijau marun gelap. Bunga K. parviflora berwarna merah keunguan atau merah muda (Putiyanan et al. 2008), sedangkan Graham et al. (2006) menunjukkan bahwa terdapat spot ungu pada bagian bunga yang berwarna putih, bunga muncul di tengah antara 2 daun, tanaman memiliki 1 sampai 4 bunga dari satu perbungaan, dan bentuk bunga tidak teratur atau bilateral simetris.
Kaempferia parviflora dapat tumbuh dengan baik pada daerah dataran tinggi 500 sampai 700 m dpl (ICS Unido 2009). Pertumbuhan vegetatif dan produksi rimpang
K. parviflora paling baik pada ketinggian 1 200 m dpl (Rahma 2013). Tanaman tersebut dapat tumbuh dengan sangat baik dengan tanah beraerasi serta cahaya yang cukup. Rimpang siap panen kencur hitam tersebut berumur antara 11 sampai 12 bulan, rimpang yang telah dipanen baik disimpan pada tempat kering dan dingin sekitar 1 sampai 3 bulan sebelum masa penanaman. Berdasarkan penelitian Evi (2012), Kaempferia parviflora dapat tumbuh dengan baik pada deaerah dengan naungan alami. Zulfa (2012) melaporkan bahwa bio-fertilizer dapat meningkatkan hasil dan mencegah penyebaran penyakit nematoda pada akar. Tanaman kencur hitam juga dapat diperbanyak secara
in vitro dengan media MS0, dengan waktu multlipikasi selama 4 minggu setelah subkultur (Alveno 2012). Bibit hasil perbanyakan secara in vitro terbukti dapat diaklimatisasi dengan tingkat keberhasilan 100 % setelah 10 Minggu setelah aklimatisasi (Putri 2014b).
4
tubuh. Manfaat utama tanaman tersebut sebagai viagra (Wannanon et al. 2012; Wattanathorn et al. 2012), juga banyak digunakan sebagai obat tradisional penambah energi (Putiyanan et al. 2008). Penelitian menunjukkan bahwa ekstrak rimpang tanaman tersebut memiliki banyak khasiat seperti antioksidan (Vichitphan et al. 2007), anti depresi (Wattanathorn et al. 2007; Rajput et al. 2011), anti halusinasi (Tewtrakul dan Subhadirasakul 2008) dan menghambat aktivitas Helicobacter pylori
(Chaichanawongsaroj et al. 2010), serta sebagai obat stroke (Phachonpai et al. 2012). Tanaman tersebut banyak digunakan sebagai obat dan dalam kegiatan spiritual oleh masyarakat Thailand (Picheansoonthon dan Koonterm 2008). Tanaman ini juga banyak digunakan sebagai ramuan untuk menyeimbangkan tekanan darah serta mengurangi sakit perut di daerah asalnya yaitu Provinsi Loei (Trisomboon 2009). Menurut Lawrence dan Bacharach (1964) K. parviflora dapat dimanfaatkan sebagai tanaman hias dan rimpangnya dapat diolah untuk ekstrak rasa, bumbu, serta minyak wangi untuk parfum.
Spesies tanaman obat yang berbeda memiliki kandungan bahan aktif yang berbeda pula. Kandungan bahan aktif pada rimpang Kaempferia galanga diantaranya adalah minyak atsiri 2.4 sampai 3.9 % yang terdiri atas 25 % ethyilcinnamate, serta lebih dari 30 % metil p-metoksisinamat (De Padua 1999). Kandungan bahan aktif Kaempferia parviflora diantaranya adalah senyawa fenol yaitu flavonoid sebagai antioksidan (Chansakaow 2005;Vichitphan et al. 2007). Kaempferia parviflora mengandung flavonoid dalam jumlah besar diantaranya hydroxy-3,7-dimethoxyflavone, 5-hydroxy-7-methoxyflavone, 5-hydroxy-3,7,4´ trimethoxyflavone, 5-hydroxy-7,4´-dimethoxy-flavone, 5-hydroxy-3,7,3´4´ tetramethoxyflavone, 3,5,7 trimethoxy-flavone, 3,5,74´-tetramethoxyflavone, 5,7,4´-trimethoxyflavone, dan 5,7,3´4´-tetramethoxyflavone (Yenjai et al. 2004). Terdapat 2 jenis flavonoid yaitu 5,7-dimethoxyflavone dan 3,5,7,3´4´-pentamethoxyflavone sehingga jumlah flavonoid total yang terdapat pada rimpang Kaempferia parviflora adalah 11 flavonoid berdasarkan penelitian (Sutthanut 2007).
Pengumbian Mikro
Komposisi media pada umumnya berupa anorganik terdiri atas garam, zat pengatur tumbuh, vitamin, asam amino, karbohidrat, agar, aquades, dan tambahan bahan organik lainnya (Dodds dan Roberts 1995). MS0 adalah media yang bersifat umum sehingga dapat digunakan pada berbagai jenis tanaman yang belum diketahui media yang cocok untuk tanaman tersebut. Alveno (2012) melaporkan bahwa K. parviflora dapat ditunaskan dengan media MS0 dengan tingkat keberhasilan 100 % pada 4 MST.
5 Sukrosa merupakan komponen organik yang terdiri atas glukosa dan fruktosa yang wajib ada pada media sebagai sumber energi pada eksplan yang tidak berfotosintesis (Wattimena 1988). Rahmawati et al. (2004) melaporkan bahwa penambahan sukrosa sebesar 20 sampai 50 g L¯1 mampu mempercepat terbentuknya rimpang pada jahe. Penambahan konsentrasi sukrosa sebesar 30 sampai 50 g L¯1 mampu menginduksi terbentuknya umbi mikro pada kentang (Ratna 2010). Media MS yang mengandung konsentrasi rendah berisi 3 g L¯1 sukrosa, 1 mg L¯1 BA serta 0.5 mg L¯1 ancymidol, dapat menginduksi rimpang pada ruang gelap dengan konsentrasi sukrosa sebesar 6 dan 8 % (Archana et al. 2013a). Ni’mah et al. (2012) mengemukakan sukrosa berfungsi sebagai sumber karbon, sumber energi, pengatur tekanan osmotik, pengatur stabilitas membran, serta pelindung terhadap stress.
Konsentrasi sukrosa untuk pengumbian kentang secara in vitro harus lebih tinggi dibandingkan konsentrasi untuk pertunasan karena digunakan sebagai induksi umbi mikro. Konsentrasi gula yang rendah maka akan membuat waktu pembentukan umbi menjadi lama. Konsentrasi sukrosa yang diperlukan berkisar antara 90 sampai 100 g L¯1. Sukrosa dalam hal tersebut berperan dalam penyediaan karbohidrat untuk pengumbian, karena pada in vitro suhu dalam botol akan meningkat melebihi batas yang dapat diterima oleh tunas in vitro sehingga diperlukan penambahan sukrosa (Puspitanigtyas dan Wattimena 1992). Penambahan sukrosa tersebut diharapkan akan diakumulasi dalam organ planlet berupa rimpang sebagai tempat penyimpanan hasil sisa sukrosa yang dipergunakan. Pembentukan rimpang pada kultur jaringan umumnya dilakukan di tempat gelap, hal tersebut didukung oleh Artati (1989) yang mengemukakan bahwa dalam pembentukan umbi mikro kentang secara in vitro diperlukan keadaan tanpa cahaya dan suhu yang rendah (15 sampai 20 °C).
Nayak dan Naik (2006) melaporkan bahwa rimpang Curcuma dapat diinduksi pada media MS0 yang ditambahkan BA 13.3 με dan sukrosa 60 g L¯1 serta diinkubasi di tempat tanpa penyinaran 20 jam per hari. Rimpang yang dihasilkan dari hasil induksi tersebut berkisar antara 1 sampai 4, dengan bobot antara 50 sampai 580 mg. Archana et al. (2013b) melaporkan juga penambahan 60 g L¯1 sukrosa, 3 ppm BA, serta 0.5 ppm ancymidol dapat menginduksi terbentuknya rimpang mikro pada Curcuma
dengan jumlah berkisar 3 sampai 8 rimpang. Singh et al. (2014) melaporkan bahwa kombinasi NAA, BAP, sukrosa, dan AgNO3 mampu menginduksi terbentuknya rimpang mikro pada Zingiber officinale. Konsentrasi optimum berdasarkan penelitian tersebut yaitu NAA 1 mg L¯1, BAP 2 mg L¯1, sukrosa 80 g L¯1, dan AgNO3 11 με. Jumlah rimpang yang terbentuk mencapai 28 rimpang per botol. Cheethaparambil et al.
(2014) melaporkan bahwa hanya dengan pemberian sukrosa 80 g L¯1 dan ½ MS0 mampu menginduksi terbentuknya rimpang mikro pada Curcuma. Rimpang yang terbentuk berkisar antara 7 sampai 9 per botol. Archana et al. (2013b) juga melaporkan bahwa pemberian 90 g L¯1 mampu menginduksi rimpang mikro Curcuma dengan jumlah berkisar antara 2 sampai 5.
METODE PENELITIAN
6
dimulai dari bulan Maret sampai dengan Agustus 2014. Bahan tanaman yang digunakan adalah planlet Kaempferia parviflora dengan umur 4 MST yang dikultur pada media MS0, setiap botol terdiri atas 1 planlet, kemudian dilakukan inisiasi rimpang dengan penambahan media cair yang berisi kombinasi antara BAP dan sukrosa. Pengamatan terhadap inisiasi rimpang dilakukan selama 8 MSP.
Percobaan disusun berdasarkan rancangan kelompok lengkap teracak (RKLT) dengan dua faktor dan tiga ulangan. Faktor pertama adalah konsentrasi BAP (B) dengan 3 taraf yaitu 0, 2, dan 4 mg L¯1 (berturut-turut b1, b2, b3). Faktor kedua adalah konsentrasi sukrosa (S) dengan 4 taraf konsentrasi yaitu 0, 30, 60, dan 90 g L¯1 (berturut-turut s1, s2, s3, s4). Setiap ulangan terdiri atas 3 botol, tiap botol ditanami 1 tunas. Setiap eksplan menjadi satuan pengamatan.
Model rancangan yang digunakan dalam penelitian adalah (Gomez dan Gomez 1995) :
Yijk = μ + αi + βj + (αβ)ij + k + ijk
Keterangan :
Yijk = respon perlakuan konsentrasi sukrosa taraf ke-i dan BAP pada taraf ke-j pada ulangan ke-k
μ = pengaruh rata-rata umum
αi = pengaruh perlakuan taraf konsentrasi sukrosa, i = 1, 2, 3, 4 βj = pengaruh perlakuan taraf konsentrasi BAP, j = 1, 2, 3
(αβ)ij = pengaruh interaksi antara sukrosa taraf ke-i dan BAP taraf ke-j k = pengaruh ulangan ke-k, k = 1, 2, 3
ijk = Galat pada perlakuan konsentrasi sukrosa taraf ke-i dan BAP taraf ke-j pada ulangan ke-k.
Data hasil pengamatan dianalisis dengan menggunakan uji F. Apabila terdapat pengaruh yang nyata, maka dilanjutkan dengan uji lanjut DMRT (Duncan Multiple Range Test) pada taraf α= 5 %. Pengolahan data dilakukan dengan program Statistical Analysis System (SAS).
Botol kultur yang akan digunakan, pinset, gunting, dan cawan petri dicuci menggunakan detergen. Seluruh peralatan yang digunakan disterilkan dalam autoklaf selama 60 menit pada suhu 121 ºC dengan tekanan 17.5 psi (pounds per square inch). Media pertunasan menggunakan media MS0, dari larutan yang dibuat dengan kode A, B, C, D, E, dan F yaitu larutan yang berisi garam-garam anorganik, seperti yang terlampir pada Lampiran 1. Konsentrasi media pada larutan dipipet, kemudian ditambahkan myo-inositol 10 ml L¯1, gula 40 g L¯1, agar 7 g L¯1 dan vitamin (thiamine, nicotine, pyridoxine, glycine) 10 ml L¯1.
Larutan media diaduk merata dan pH-nya diatur sekitar 5.8 sampai 6.0 dengan penambahan beberapa tetes KOH 1 N. Media pertunasan ditambahkan agar 7 g L¯1, setelah itu semua larutan yang telah disiapkan dicampur dengan agar dan dimasak hingga mendidih. Media yang telah masak dimasukkan kedalam botol kultur yang telah di autoklaf dengan volume sekitar 25 mL botol¯1. Botol kemudian ditutup dengan plastik dan diikat dengan karet gelang, lalu disterilkan kembali pada tekanan 17.1 psi selama 30 menit.
7 kemudian setiap botol ditanam tunas sebanyak 1 eksplan. Botol yang sudah berisi tunas ditutup dengan plastik dan diikat dengan karet gelang. Botol kemudian diletakkan di atas rak kultur dengan penyinaran 24 jam hari¯1. Suhu ruang kultur sekitar 23 sampai 25 ºC. Lama eksplan pada media pertunasan yaitu 4 minggu. Eksplan yang telah berumur 4 minggu kemudian ditambah dengan larutan inisiasi rimpang sebanyak 20 mL botol¯1. Botol kemudian diinkubasi di ruang gelap selama 8 minggu agar menginduksi munculnya rimpang pada eksplan tersebut.
Pengamatan dilakukan sebelum dan sesudah perlakuan inisiasi rimpang. Peubah yang diamati sebelum perlakuan adalah tinggi planlet, jumlah daun per planlet, dan jumlah akar. Peubah yang diamati setiap minggu setelah perlakuan yaitu jumlah daun total per planlet, jumlah daun gugur, tinggi planlet, waktu terbentuk rimpang mikro, jumlah rimpang per planlet, dan jumlah kontaminasi. Pengamatan pada akhir perlakuan dilakukan terhadap morfologi rimpang, bobot rimpang per planlet, bobot basah keseluruhan, bobot kering contoh, morfologi rimpang mikro dibandingkan dengan rimpang in vivo, anatomi rimpang mikro yang dibandingkan dengan rimpang in vivo
menggunakan mikroskop. Mikroskop yang digunakan pada pengamatan yaitu mikroskop elektrik (Mulyono 2014).
HASIL DAN PEMBAHASAN
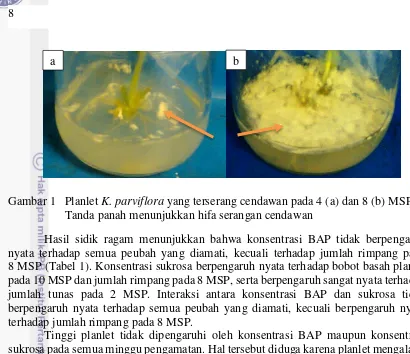
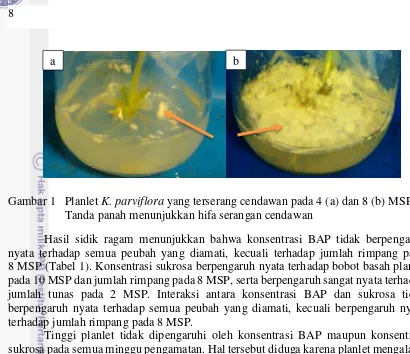
Secara umum suhu rata-rata ruang kultur adalah 25 °C, dengan kelembaban udara rata-rata 80 %. Terdapat planlet yang terserang cendawan pada saat planlet diinkubasi di ruang gelap. Serangan cendawan mulai terjadi pada umur 4 sampai 5 MSP. Kultur yang terserang cendawan mencapai 25 % dari seluruh total unit percobaan pada 5 MSP, dan meningkat menjadi 35 % pada 8 MSP. Hifa cendawan menutupi hampir seluruh permukaan media (Gambar 1), dan menyebabkan pertumbuhan planlet terhambat bahkan mati. Serangan cendawan dapat disebabkan oleh lingkungan kultur yang kurang steril, kontaminasi pada saat penanaman, dan kontaminan yang terbawa oleh eksplan.
8
Gambar 1 Planlet K. parviflora yang terserang cendawan pada 4 (a) dan 8 (b) MSP Tanda panah menunjukkan hifa serangan cendawan
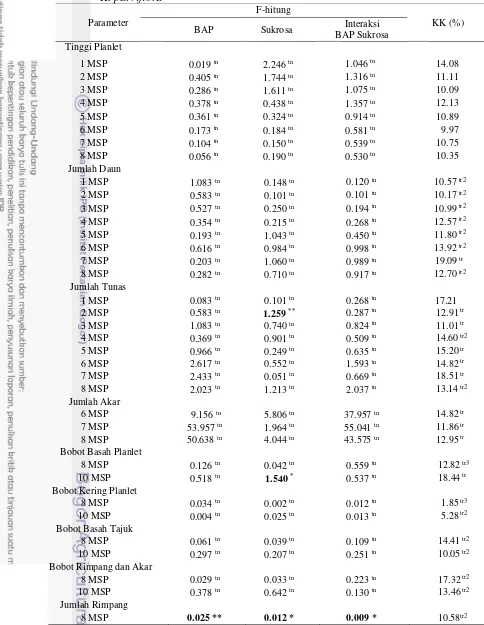
Hasil sidik ragam menunjukkan bahwa konsentrasi BAP tidak berpengaruh nyata terhadap semua peubah yang diamati, kecuali terhadap jumlah rimpang pada 8 MSP (Tabel 1). Konsentrasi sukrosa berpengaruh nyata terhadap bobot basah planlet pada 10 MSP dan jumlah rimpang pada 8 MSP, serta berpengaruh sangat nyata terhadap jumlah tunas pada 2 MSP. Interaksi antara konsentrasi BAP dan sukrosa tidak berpengaruh nyata terhadap semua peubah yang diamati, kecuali berpengaruh nyata terhadap jumlah rimpang pada 8 MSP.
Tinggi planlet tidak dipengaruhi oleh konsentrasi BAP maupun konsentrasi sukrosa pada semua minggu pengamatan. Hal tersebut diduga karena planlet mengalami etiolasi. Ruang kultur gelap merupakan faktor yang dapat menyebabkan planlet mengalami etiolasi. Tyagi et al. (2006) melaporkan bahwa etiolasi dapat terjadi apabila tanaman kurang mendapat cahaya atau berada di tempat gelap. Konsentrasi BAP dan sukrosa tidak berpengaruh terhadap jumlah daun, jumlah akar, bobot kering planlet, bobot basah tajuk, bobot rimpang tidak dipengaruhi oleh konsentrasi BAP dan sukrosa. Tabel 1 menunjukkan jumlah tunas dipengaruhi oleh konsentrasi sukrosa pada 2 MSP. Karimah et al. (2013) melaporkan bahwa pertambahan tunas berhubungan erat dengan banyaknya calon-calon rimpang yang akan dihasilkan dari planlet tersebut, semakin banyak jumlah tunas yang dihasilkan semakin banyak pula rimpang yang akan diperoleh.
Harjadi (1989) melaporkan bahwa fase vegetatif tanaman meliputi perkembangan akar, daun dan batang baru. Fase tersebut berhubungan dengan 3 proses penting yaitu pembelahan sel, pemanjangan sel, dan tahap awal diferensiasi sel. Laju pembelahan sel berhubungan erat dengan laju pembentukan daun, batang, dan akar. Pembelahan, pembesaran dan pembentukan jaringan berhubungan erat dengan ketersediaan karbohidrat. Fase vegetatif dari suatu perkembangan organ tanaman memerlukan tersedianya karbohidrat yang banyak, agar laju perkembangannya menjadi cepat. Berdasarkan hal tersebut laju terbentuknya rimpang berhubungan erat dengan ketersediaan karbohidrat dalam media induksi. Ketersediaan karbohidrat yang banyak akan mempercepat laju terbentuknya rimpang mikro. Harjadi (1991) melaporkan bahwa cadangan makanan disimpan pada suatu organ, salah satu organ tersebut berupa rimpang. K. parviflora merupakan tanaman yang menyimpan cadangan makanannya dalam bentuk rimpang.
9 Tabel 1 Rekapitulasi sidik ragam peubah yang diamati pada inisiasi rimpang mikro
K. parviflora
10
Planlet yang dikulturkan pada media yang mengandung sukrosa 30, 60, dan 90 g L¯1 memiliki bobot basah yang lebih tinggi dibandingkan planlet yang dikulturkan pada media tanpa sukrosa (Tabel 2) pada 10 MSP. Hasil penelitian Rahmawati et al.
(2004) pada planlet jahe emprit juga menunjukkan bahwa planlet yang dikulturkan pada media yang mengandung 30-50 g L¯1 sukrosa memiliki bobot yang lebih tinggi dibandingkan planlet yang dikulturkan pada media tanpa sukrosa.
Tabel 2 Pengaruh konsentrasi sukrosa terhadap jumlah tunas 2 MSP dan bobot basah planlet K. parviflora pada 10 MSP
Parameter Konsentrasi Sukrosa (g L¯
1)
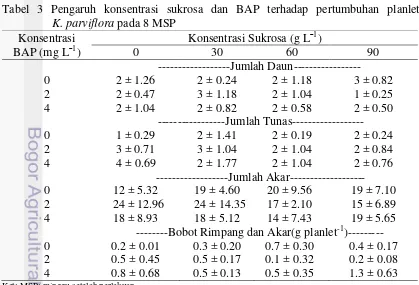
Jumlah daun berkisar antara 1 sampai 3 helai seperti yang tersaji pada tabel 3. Jumlah daun paling banyak dengan standar deviasi yang kecil terdapat pada kombinasi konsentrasi sukrosa 90 g L¯1 tanpa BAP. Pemberian konsentrasi sukrosa 90 g L¯1 tanpa BAP memiliki nilai tertinggi, namun tidak berbeda nyata dengan perlakuan lain. Jumlah tunas untuk semua perlakuan secara umum berkisar antara 1 sampai 2. Semua konsentrasi perlakuan tidak berpengaruh nyata terhadap jumlah tunas, meskipun perlakuan tanpa BAP dan sukrosa dengan BAP 4 mg L¯1 dan tanpa sukrosa berbeda sangat nyata. Jumlah akar menunjukkan nilai yang berkisar antara 11 sampai 38. Semua konsentrasi tidak menunjukkan pengaruh yang nyata terhadap jumlah akar. Bobot rimpang dan akar berkisar antara 0.1 sampai 1.3 g planlet-1. Semua konsentrasi perlakuan tidak berpengaruh nyata terhadap bobot rimpang dan akar per planlet.
Tabel 3 Pengaruh konsentrasi sukrosa dan BAP terhadap pertumbuhan planlet
---Bobot Rimpang dan Akar(g planlet-1)--- 0 0.2 ± 0.01 0.3 ± 0.20 0.7 ± 0.30 0.4 ± 0.17 2 0.5 ± 0.45 0.5 ± 0.17 0.1 ± 0.32 0.2 ± 0.08 4 0.8 ± 0.68 0.5 ± 0.13 0.5 ± 0.35 1.3 ± 0.63
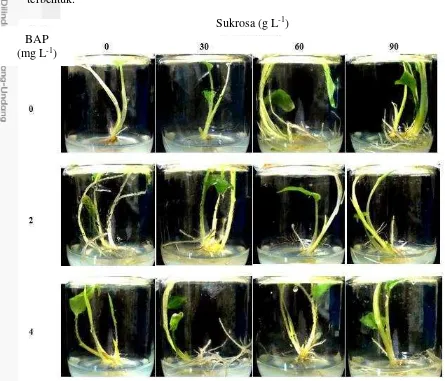
11 Gambar 2 menunjukkan keragaan planlet berbagai konsentrasi BAP dan sukrosa yang diaplikasikan. Secara umum planlet dengan konsentrasi sukrosa 90 g L¯1 tanpa BAP terlihat memiliki batang yang lebih tegar dan besar dibandingkan semua perlakuan. Daun secara keseluruhan memiliki kenampakkan warna yang hijau. Akar secara umum berwarna putih kecokelatan, warna akar yang putih menunjukkan akar yang baru terbentuk.
Gambar 2 Kondisi planlet K. parviflora pada berbagai media perlakuan pada 8 MSP Interaksi antara konsentrasi BAP dan sukrosa berpengaruh nyata terhadap jumlah rimpang mikro pada 8 MSP (Tabel 4). Planlet yang dikulturkan pada media tanpa BAP dan sukrosa memiliki jumlah rimpang mikro terendah dibandingkan planlet yang dikulturkan pada media yang mengandung BAP dan sukrosa. Hasil interaksi lainnya menunjukkan hasil yang tidak signifikan antar kombinasi media yang digunakan. Konsentrasi BAP 0, 2, dan 4 mg L¯1 tidakmemiliki pengaruh yang nyata terhadap jumlah rimpang mikro yang dihasilkan. Konsentrasi 90 g L¯1 sukrosa dan 0 mg L¯1 BAP dapat digunakan sebagai rekomendasi dalam penelitian sejenis mengenai inisiasi rimpang mikro. Penggunaan kombinasi tersebut lebih dipilih karena ditinjau dari segi ekonomi lebih menguntungkan dari sudut pandang bisnis, dalam hal penyediaan bahan tanam secara cepat, banyak dan bermutu.
BAP (mg L-1)
12
Tabel 4 Interaksi konsentrasi BAP dan sukrosa terhadap jumlah rimpang mikro planlet
K. parviflora pada 8 MSP
Ket: Angka yang diikuti oleh huruf kecil pada kolom yang sama dan angka yang diikuti oleh huruf besar pada baris yang sama menunjukkan tidak berbeda nyata berdasarkan DMRT pada taraf α =5 %.
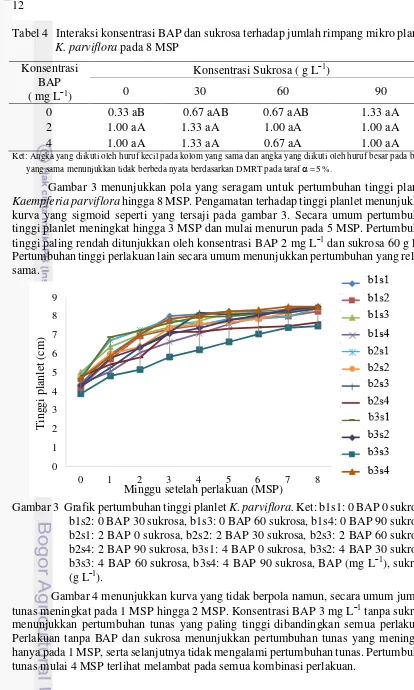
Gambar 3 menunjukkan pola yang seragam untuk pertumbuhan tinggi planlet
Kaempferia parviflora hingga 8 MSP. Pengamatan terhadap tinggi planlet menunjukkan kurva yang sigmoid seperti yang tersaji pada gambar 3. Secara umum pertumbuhan tinggi planlet meningkat hingga 3 MSP dan mulai menurun pada 5 MSP. Pertumbuhan tinggi paling rendah ditunjukkan oleh konsentrasi BAP 2 mg L¯1 dan sukrosa 60 g L¯1. Pertumbuhantinggi perlakuan lain secara umum menunjukkan pertumbuhan yang relatif sama.
Gambar 3 Grafik pertumbuhan tinggi planlet K. parviflora. Ket: b1s1: 0 BAP 0 sukrosa, b1s2: 0 BAP 30 sukrosa, b1s3: 0 BAP 60 sukrosa, b1s4: 0 BAP 90 sukrosa, b2s1: 2 BAP 0 sukrosa, b2s2: 2 BAP 30 sukrosa, b2s3: 2 BAP 60 sukrosa, b2s4: 2 BAP 90 sukrosa, b3s1: 4 BAP 0 sukrosa, b3s2: 4 BAP 30 sukrosa, b3s3: 4 BAP 60 sukrosa, b3s4: 4 BAP 90 sukrosa, BAP (mg L¯1), sukrosa (g L¯1).
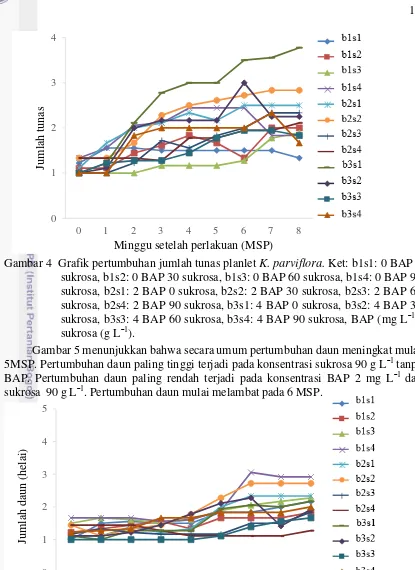
Gambar 4 menunjukkan kurva yang tidak berpola namun, secara umum jumlah tunas meningkat pada 1 MSP hingga 2 MSP. Konsentrasi BAP 3 mg L¯1 tanpa sukrosa menunjukkan pertumbuhan tunas yang paling tinggi dibandingkan semua perlakuan. Perlakuan tanpa BAP dan sukrosa menunjukkan pertumbuhan tunas yang meningkat hanya pada 1 MSP, serta selanjutnya tidak mengalami pertumbuhan tunas. Pertumbuhan tunas mulai 4 MSP terlihat melambat pada semua kombinasi perlakuan.
13
Gambar 4 Grafik pertumbuhan jumlah tunas planlet K. parviflora. Ket: b1s1: 0 BAP 0 sukrosa, b1s2: 0 BAP 30 sukrosa, b1s3: 0 BAP 60 sukrosa, b1s4: 0 BAP 90 sukrosa, b2s1: 2 BAP 0 sukrosa, b2s2: 2 BAP 30 sukrosa, b2s3: 2 BAP 60 sukrosa, b2s4: 2 BAP 90 sukrosa, b3s1: 4 BAP 0 sukrosa, b3s2: 4 BAP 30 sukrosa, b3s3: 4 BAP 60 sukrosa, b3s4: 4 BAP 90 sukrosa, BAP (mg L¯1), sukrosa (g L¯1).
Gambar 5 menunjukkan bahwa secara umum pertumbuhan daun meningkat mulai 5MSP. Pertumbuhan daun paling tinggi terjadi pada konsentrasi sukrosa 90 g L¯1 tanpa BAP. Pertumbuhan daun paling rendah terjadi pada konsentrasi BAP 2 mg L¯1 dan sukrosa 90 g L¯1. Pertumbuhan daun mulai melambat pada 6 MSP.
Gambar 5 Grafik pertumbuhan jumlah daun planlet K. parviflora. Ket: b1s1: 0 BAP 0 sukrosa, b1s2: 0 BAP 30 sukrosa, b1s3: 0 BAP 60 sukrosa, b1s4: 0 BAP 90 sukrosa, b2s1: 2 BAP 0 sukrosa, b2s2: 2 BAP 30 sukrosa, b2s3: 2 BAP 60 sukrosa, b2s4: 2 BAP 90 sukrosa, b3s1: 4 BAP 0 sukrosa, b3s2: 4 BAP 30 sukrosa, b3s3: 4 BAP 60 sukrosa, b3s4: 4 BAP 90 sukrosa, BAP (mg L¯1), sukrosa (g L¯1).
0 1 2 3 4
0 1 2 3 4 5 6 7 8
Jum
lah
tu
nas
Minggu setelah perlakuan (MSP)
0 1 2 3 4 5
0 1 2 3 4 5 6 7 8
Juml
ah
da
un (h
elai)
14
Pola pertumbuhan tinggi dan jumlah tunas planlet K. parviflora terlihat pada awal perlakuan cepat meningkat. Hal tersebut disebabkan oleh ketersediaan hara dan gula dalam media yang masih banyak. Pertambahan tinggi dan jumlah tunas mulai melambat pada 5 MSP. Hal tersebut diduga sebagian energi digunakan planlet untuk perkembangan dan pertambahan jumlah daun. Gambar 5 menunjukkan bahwa jumlah daun mulai meningkat pada 5 MSP. Pertambahan jumlah daun mulai melambat pada 6 MSP, hal tersebut dapat disebabkan oleh ketersediaan hara dan gula yang sudah mulai sedikit. Pertambahan jumlah daun yang melambat diduga juga planlet sedang menginisiasi pembentukan rimpang mikro. Berdasarkan hal tersebut perlu dilakukan penambahan sumber hara dan gula untuk meningkatkan energi yang tedapat dalam media. Marlin et al. (2013) melaporkan bahwa penambahan media cair dalam media padat (double layer) pada kultur jahe menghasilkan jumlah tunas yang lebih tinggi (5.5 tunas per eksplan) dan jumlah akar tertinggi (32.5 akar per eksplan).
Konsentrasi 30 g L¯1 sukrosa dan 2 mg L¯1 BAP terlihat jumlah tunas yang lebih banyak dibandingkan semua perlakuan, meskipun tidak berpengaruh nyata pada analisis data. Hasil penelitian tersebut sejalan dengan penelitian Lyla (2011) yang melaporkan bahwa dengan taraf sukrosa 5 % mampu menghasilkan tunas optimum untuk perbanyakan mata tunas kunyit putih. Hasil tersebut juga didukung oleh hasil penelitian Rahmawati et al. (2004) yang melaporkan bahwa jahe dapat diinduksi rimpang mikro dengan penambahan konsentrasi sukrosa 90 g L¯1 tanpa BAP. Konsentrasi perlakuan tersebut juga dapat digunakan sebagai rekomendasi dalam penelitian multlipikasi planlet.
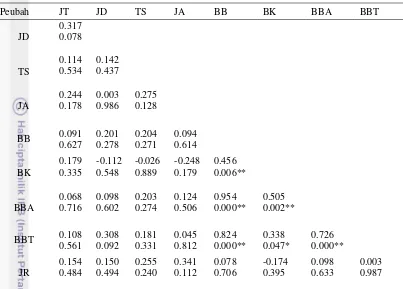
Korelasi adalah hubungan antar peubah dari faktor yang diamati. Korelasi antar peubah dari beberapa parameter yang diamati disajikan pada tabel 5. Hasil analisis menunjukkan bahwa bobot basah per planlet pada umur 8 MSP berkorelasi positif sangat nyata dengan bobot kering per planlet umur 8 MSP dan bobot basah tajuk per planlet. Hal tersebut menjelaskan bahwa bobot basah planlet mempengaruhi bobot kering dan bobot basah tajuk. Korelasi positif sangat nyata juga ditunjukkan oleh bobot kering per planlet dengan bobot basah akar per planlet, hal tersebut menunjukkan bahwa meningkatnya bobot basah akar dapat meningkatkan bobot kering planlet. Bobot basah akar berkorelasi positif sangat nyata terhadap bobot kering tajuk, meningkatnya bobot basah akar dapat meningkatkan bobot tajuk planlet. Bobot basah tajuk juga berkorelasi positif nyata terhadap bobot kering planlet, dengan demikian bobot basah tajuk mempengaruhi bobot basah planlet. Hasil analisis korelasi tersebut menunjukkan bahwa jumlah rimpang mikro tidak dipengaruhi oleh semua faktor seperti jumlah tunas, jumlah daun, jumlah akar, bobot basah, serta bobot kering.
15 Tabel 5 Korelasi beberapa parameter pengamatan K. parviflora pada 8 MSP
Peubah JT JD TS JA BB BK BBA BBT
**: sangat nyata pada taraf 1 %, *: nyata pada taraf 5 %. JD : Jumlah daun per planlet, JT: Jumlah tunas per planlet, JA: Jumlah akar per planlet, TS: Tinggi tunas, BB: Bobot basah per planlet, BK: Bobot kering per planlet, BBA: Bobot basah akar per planlet, BBT: Bobot basah tajuk per planlet, JR: Jumlah rimpang per planlet
Hasil pengamatan mikroskopis rimpang baik secara in vitro maupun in vivo, dilakukan untuk mendukung hasil penelitian. Rimpang in vivo yang digunakan sebagai pembanding berasal dari tanaman asal planlet in vitro (Alveno 2012) yang diaklimatisasi (Putri 2014b) dan ditanam dilapang selama 6 bulan. Struktur jaringan seperti yang tersaji pada gambar 6 menunjukkan bahwa terdapat kesamaan anatomi antara rimpang invitro
dan in vivo. Hasil pengamatan menunjukkan bahwa rimpang in vitro memiliki jaringan yang lengkap yaitu xilem, endodermis, korteks, epidermis, silinder pusat dan floem seperti halnya rimpang in vivo. Hal tersebut menunjukkan bahwa planlet yang diperbanyak secara in vitro dapat menghasilkan rimpang yang sama seperti tanaman yang di lapang.
Rimpang menjadi bagian yang penting untuk diamati, hal tersebut karena bagian utama yang dimanfaatkan dari kencur hitam tersebut yakni bagian rimpangnya, sebagai penyimpan senyawa-senyawa yang berguna untuk bidang kesehatan. Struktur bagian yang sama menjadi indikasi khusus bahwa rimpang yang dihasilkan baik secara in vitro
16
Gambar 6 Keragaan rimpang dan anatomi in vitro dan in vivo Kaempferia parviflora
Hasil pengamatan mikroskopis terhadap tangkai daun in vitro dan in vivo
(gambar 7) menunjukkan bahwa terdapat kesamaan antara anatomi hasil tangkai daun
in vitro dengan in vivo. Keragaan anatomi tangkai daun in vitro dan in vivo menunjukkan bahwa berkas vaskular lebih banyak ditunjukkan oleh anatomi in vivo dibandingkan anatomi in vitro, hal tersebut mengindikasikan bahwa tangkai daun in vivo lebih tua dibandingkan in vitro (Campbell dan Reece 2008).
Gambar 7 Keragaan tangkai daun dan anatomi in vitro pada 8 MSP dan in vivo pada 12 bulan setelah aklimatisasi K. parviflora
Iris
an melint
an
g
rimpa
ng
R
im
pa
ng
In Vitro In Vivo
Rimpang
Xilem
Endodermis
Korteks
Epidermis
Silinder pusat
Floem
In Vitro In Vivo
Ta
ng
k
ai daun
Iris
an m
eli
nt
an
g
tang
k
ai daun
Tangkai daun
Jaringan dasar
Berkas vaskular
17 Keragaan daun K. parviflora in vitro dan in vivo ditunjukkan pada gambar 8. Gambar anatomi dapat terlihat bahwa terdapat kesamaan struktur antara daun in vitro
dengan in vivo, meskipun pada daun in vitro masih terdapat sedikit urat daun. Hal tersebut karena jaringan pada daun in vitro tersebut lebih muda dibandingkan dengan daun in vivo. Anatomi daun in vitro terlihat sedikit terdapat stomata, hal tersebut diduga karena daun tidak mengalami fotosintesis, berbeda dengan tampilan anatomi daun
in vivo yang terdapat banyak stomata yang menyebar hampir diseluruh permukaan daun.
Gambar 8 Keragaan daun anatomi daun in vitro dan in vivo Kaempferia parviflora
Induksi rimpang mikro dapat dilakukan dengan beberapa syarat yang dapat memenuhi kriteria agar planlet dapat berimpang. Faktor-faktor yang mempengaruhi adalah kondisi tempat seperti cahaya, kelembaban, suhu, dalam hal ini diperlukannya tempat gelap, suhu yang cukup rendah berkisar 23 sampai 27 °C, kelembaban yang stabil (Tyagi et al. 2006). Ketersediaan cadangan makanan menjadi hal yang penting dalam induksi rimpang, apabila cadangan makanan melimpah, maka akan ditranslokasikan untuk terbentuknya rimpang mikro. Ketersediaan ZPT juga memiliki peranan penting dalam mempercepat proses inisiasi yaitu terbentuknya rimpang mikro, ZPT tersebut seperti sitokinin. Keadaan demikian dapat dimodifikasi secara teknis dalam rancangan penelitian, dengan tujuan untuk terbentuknya rimpang mikro pada planlet tersebut.
In Vitro In Vivo
Da
un
Iris
an m
eli
nt
an
g
da
un
Daun
Urat daun
Rongga daun
Stomata
18
SIMPULAN DAN SARAN
Simpulan
Perlakuan konsentrasi BAP dengan taraf 0 sampai 4 mg L¯1 tidak menunjukkan pengaruh nyata terhadap inisiasi rimpang mikro Kaempferia parviflora. Konsentrasi sukrosa yang diberikan berpengaruh nyata terhadap pembentukan jumlah tunas 2 MSP dan bobot basah planlet 10 MSP. K. parviflora dapat membentuk rimpang mikro secara
in vitro, hal tersebut karena struktur anatomi rimpang yang sama dengan struktur anatomi rimpang in vivo. K. parviflora yang dikulturkan pada media MS yang mengandung 90 g L¯1 sukrosa tanpa BAP memiliki jumlah rimpang mikro tertinggi pada 8 MSP, yaitu 5 rimpang.
Saran
Penelitian lanjutan perlu dilakukan dengan penambahan waktu inisiasi rimpang mikro 12-16 MSP, dengan perlakuan subkultur pada media yang sama. Planlet yang digunakan untuk inisiasi rimpang mikro sebaiknya dipastikan seragam agar hasilnya menjadi lebih baik. Penambahan media inisiasi juga perlu dilakukan apabila penambahan waktu inisiasi dilakukan agar, ketersediaan hara dan gula dapat terpenuhi. Rimpang mikro K. parviflora hasil inisiasi perlu ditunaskan untuk mengetahui, bahwa rimpang tersebut dapat bertunas dengan baik.
DAFTAR PUSTAKA
Alveno V. 2012. Multiple in vitro shoot induction of Kaempferia parviflora wall. Ex. Baker [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Archana CP, Deepu V, Geetha, SP, Indira B. 2013a. RAPD assessment for identification of clonal fidelity of microrhizome induced plants of Turmeric (Curcuma longa L.) cultivars. Intern Food Research J. 20 (6): 3325-3328.
Archana CP, Pillai GS, Balachandran I. 2013b. In vitro microrhizome induction in three high yielding cultivars of Zingiber officinale rosc. and their phytopathological analysis. J Advanced Biotechnology Research. 4(3): 296-300.
Artati N. 1989. Pengaruh manipulasi media terhadap efisiensi pengumbian mikro kentang (Solanum tuberosum L.) secara in vitro [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Campbell NA, Reece JB. 2008. Biologi. Wulandari DT, penerjemah; Hardani W, Adhika P, editor. Jakarta (ID): Erlangga. Terjemahan dari: Biology. Ed ke-8. Chaichanawongsaroj N, Amonyingcharoen S, Saifah E, Poovorawan Y. 2010. The
19 Chansakaow S.2005. Effect of light intensity and soil amendments on total phenolics and antioxidant activity of Kaempferia parviflora Wall. Ex. Bak. 31st Congress on Science and Technology of Thailand at Suranaree University of Technology. Cheethaparambil A, Pillai GS, Balachandran I. 2014. In vitro microrhizome and
minirhizome production in turmeric (Curcuma longa L.) cultivar Alleppey Supremeand its comparative anatomical and histochemical analysis. Int J Curr Microbiol App Sci. 3 (3): 535-542.
Chivapat S, Chavalittumrong P, Attawish A, Rungsipipat A. 2010. Chronic toxicity study of Kaempferia parviflora Wall ex. Baker extract. Thai J Vet Med. 40(4): 377-383.
De Padua. 1999. Plant Resources of South East Asia. P.268-286. In Kardono et al.
Selected Indonesian Medical Plants Monographs and Descriptions. Jakarta (ID): Gramedia Widiasarana Indonesia.
Ditjen Hortikultura. 2012. Volume Impor dan Ekspor Tanaman Obat 2012 [Internet]. [diunduh 2013 Des 21]. Tersedia pada:hortikultura.deptan.go.id/index.php?view =article&catid=57:ekspor-impor&i d=338:volume-nilai-impor-dan-eksporobatt h2012&format=pdf&option=co m_content&Itemid=474.
Dodds JH, Roberts LW. 1995. Experiments in Plant Tissue Culture. Cambridge (UK): Cambridge University Press.
Evi. 2012. Altitude and shading conditions affect vegetative growth of Kaempferia parviflora [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Ferry Y, Bambang ET, Randriani E. 2009. Pengaruh intensitas cahaya dan umur panen terhadap pertumbuhan, produksi, dan kualitas hasil temulawak diantara tanaman kelapa. Bul Littro. 20(2): 131-140.
Graham LE, Graham JM, Wilcox LW. 2006. Plant Biology. Second edition. USA: Pearson Education Inc. 670 p.
Gomez KA, Gomez AA. 1995. Prosedur Statistik untuk Penelitian Pertanian. Sjamsudin E, Baharsjah JS, penerjemah. Jakarta (ID): UI Press. Terjemahan dari: Statistical Prosedures for Agricultural Research.
Hartanto D, Aziz SA, Dinarti D. 2010. Induksi umbi tanaman daun dewa (Gynura pseudochina (Lour.) DC) secara in vitro dengan perlakuan sukrosa dan daminozide. J Agron Indonesia. 38(2): 144-149.
Hatta M, Hayati M, Irayani U. 2008. Pengaruh IAA dan BAP terhadap pertumbuhan tanaman nilam (Pogestemon cablin benth) in vitro. J Floratek.3: 50-56
Harjadi SS. 1989. Dasar-dasar Hortikultura. Bogor (ID): Jurusan Budidaya Pertanian Institut Pertanian Bogor.
. 1991. Pengantar Agronomi. Jakarta (ID): Gramedia.
[INATRIMS] Indonesia Technical Regulations Informations Management System. 2014. Tujuan Utama Ekspor Produk Tanaman Obat Indonesia. Kementerian Perdagangan Republik Indonesia [internet]. [diunduh 2014 Jan 27] Tersedia pada: inatrims.kemendag.go.id/id/product/detail/medicinal-herbs_16.
ICS-Unido. 2009. Kaempferia parviflora wall ex Baker. [diunduh 2013 Mar 14]. Tersedia pada: http://maps.ics.trieste.it/Home/TechnologyInfo/621
Karim MA. 2013. Pematahan dormansi rimpang Kaempferia parviflora Wall. Ex. Baker [skripsi]. Bogor (ID): Institut Pertanian Bogor.
20
Koatsaha J, Chulacupt S, Chonsakorn S, Teepoo S, Mongkholrattanasit R. 2012. Antibacterial activity by Kaempferia parviflora microencapsulation and applications for textile industry. Bangkok (TH): RMUTP International Conference: Textiles & Fashion.
Kummee S, Tewtrakul S, Subhadhirasakul S. 2008. Antimicrobial activity of the ethanol extract and compounds from the rhizomes of Kaempferia parviflora. Songklanakarin J Sci Technol. 30 (4): 463-466.
Lawrence J, Bacharach M. 1964. Analytical Toxicology. Philadelphia (US): CRC Press. Lyla NA. 2011. Pengaruh kadar sukrosa dalam medium MS (mushasige & skoog)
[tesis]. Semarang (ID): Universitas Dipenogoro.
Marlin, Romeida A, Hartal, Gonggo BM. 2013. Pengembangan teknologi mikropropagasi tanaman jahe gajah bebas penyakit layu bakteri Ralstonia solanacearum. Laporan tahun 1 penelitian hibah kompetisi bantuan operasional perguruan tinggi (BOPTN). Bengkulu (ID): Universitas Bengkulu.
Mulyono J. 2014. Pengantar laboratorium mikroteknik. Bogor (ID): Institut Pertanian Bogor.
Murashige T, Skoog F. 1962. A revised medium for rapid growth and bioassay with tobacco tissue culture. Physiol Plant. 15: 473-497.
Nayak S, Naik PK. 2006. Factors effecting in vitro microrhizome formation and growth in Curcuma longa l. and improved field performance of micropropagated plants.
Sci Asia. 32: 31-37
Ni’mah F, Ratnasari E, Budipramana LS. 2012. Pengaruh pemberian berbagai kombinasi konsentrasi sukrosa dan kinetin terhadap induksi umbi mikro kentang (Solanum tuberosum L.) kultivar granola kembang secara in-vitro. LenteraBio J. 1(1): 41-48.
Nugrahani P, Sukendah, Makziah. 2011. Teknik propagasi secara in vitro. Surabaya (ID): Universitas Pembangunan Nasional Veteran.
Nugroho NA. 1998. Manfaat dan Prospek Pengembangan Kunyit. Ed ke-1. Ungaran (ID): Trubus Agriwidya.
Phachonpai W, Maharun S, Tong-Un T, Muchimapura S, Wattanathorn J. 2012. The functional effect of Kaempferia parviflora on ischemic stroke in rats. American J Agricultural Biological Sci. 7 (2): 173-179.
Picheansoonthon C, Koonterm S. 2008. Notes on the genus Kaempferia L. (Zingiberaceae) in Thailand. J Thai Traditional Alternative Medicine. 6(1): 1-21. Puspitaningtyas DM, Wattimena GA. 1992. Pembentukan umbi kentang secara in vitro. Seminar Hasil Penelitian dan Pengembangan Bioteknologi. UPT Balai Pengembangan Kebun Raya. Jurusan Budidaya Pertanian. Fakultas Pertanian IPB Bogor.
Putiyanan S, Chansakaow S, Phrutivorapongkul A, Charoensup W. 2008. Standard pharmacognostic characteristic of some Thai Herrbal medicine. CMU J Nat Sci.7(2): 239-255.
Putri PA. 2014a. Laporan praktek kerja profesi apoteker. Depok (ID): Universitas Indonesia.
21 Rahma A. 2013. Analisis produksi dan kandungan bahan aktif Kaempferia parviflora
Wall. Ex. Baker pada ketinggian dan tingkat naungan yang berbeda [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Rahmawati M, Aziz SA, Dinarty D, Sastra DR. 2004. Pengaruh BAP dan sukrosa terhadap perbanyakan jahe empirit (Zingiber officinale Rose var. Amarun). Bul Agron. 32(3): 37-43.
Rajput MS, Sinha S, Mathur V, Agrawal P. 2011. Herbal antidepressants. International J Pharmaceutical Frontier Research. 1(1): 159-169.
Ratna D. 2010. Induksi umbi mikro kentang udara (Dioscorea bulbifera L.) dengan perlakuan beberapa konsentrasi sukrosa [skripsi]. Padang (ID): Universitas Andalas.
Singh TD, Chakpram L, Devi HS. 2014. Induction of in vitro microrhizomes using silver nitrate in Zingiber officinale Rosc. var. Baishey and Nadia. Indian J Biotechnology. 13: 256-262.
Skoog F, Miller EO. 1957. Chemical regulation of growth and organ formation in plant tissue cultured in vitro. J Exp Biol. 11: 118-131.
Sutthanut K. 2007. Simultaneous identification and quantation of 11 Flavonoid constituens in Kaempferia parviflora by gas chromatography. J Chromatogr A.
1143(1-2): 227-33.
Talanca AH, εas’ud S. 2009. Pengelolaan cendawan aspergillus flavus pada jagung.
Prosiding Seminar Nasional Serealia; 2009 Jul 28-30; Maros, Indonesia. Maros (ID): Balitsereal. Hlm 445-449.
Taji A, Kumar PP, Lakshmanan P. 2001. In Vitro Plant Breeeding. The Haworth Press. New York (US).
Tewtrakul S, Subhadirasakul S. 2008. Effects of compounds from Kaempferia parviflora on nitric oxide, prostaglandin E2 and tumor necrosis factor alpha productions in RAW 264.7 macrophage cells. J Etnopharmacol. 120 : 81-84. Trisomboon H. 2009. Kaempferia parviflora, a Thai herbal plant, neither promote
reproductive function nor increase libido via male hormone. Thai J Physiological Sci. 21(2): 83-86.
Tyagi RK, Agrawal A, Yusuf A. 2006. Conservation of zingiber germplasm through in vitro rhizome formation. Sci Horticulturae. 108: 210–219.
Vichitphan S, Vichitphan K, Sirikhansaeng P. 2007. Flavonoid content and antioxidant activity of krachai-dum (Kaempferia parviflora) wine. KMITL Sci Tech J. 7 : 97-105.
Wannanon P, Wattanathorn J, Tong-Un T, Pangphukiew P, Muchimapura S, Sripanidkulchai B, Phachonpai W. 2012. Efficacy assessment of Kaempferia parviflora for the management of erectile dysfunction. Online J Biological Sci. (4): 149-155
Wattanathorn J, Pangphukiew P, Sripanidkulchai K, Muchimapura S, Sripanidkuchai B. 2007. Evaluation of the anxiolytic and antidepressant effect of alcoholic extract of Kaempferia parviflora in aged rats. Am J Agri BiolSci. 2 : 94-98.
,Sripanidkuchai K. 2012. Aphrodisiac activity of Kaempferia parviflora. American J Agricultural and Biological Sci. 7 (2): 114-120.
22
. 2000. Pengembangan propagul kentang bermutu dan kultivar kentang unggul dalam mendukung peningkatan produksi kentang di Indonesia. Bogor (ID): Fakultas Pertanian Institut Pertanian Bogor. Orasi ilmiah guru besar tetap ilmu hortikultura
Weerateerangkul P, Surinkaew S, Chattipakorn SC, Chattipakorn N. 2013. Indian J Med Res. 137(1): 156–163.
Yenjai C, Prasanphen K, Daodee S, Wongpanich V, Kittakoop P. 2004. Bioactive flavonoids from Kaempferia parviflora. Fitoterapia. 75: 89-92.
Yusnita. 2003. Kultur Jaringan Cara Memperbanyak Tanaman Secara Efisien. Jakarta (ID) : Agromedia Pustaka.
23
LAMPIRAN
Lampiran 1 Komposisi Medium (MS) Murashige dan Skoog Stok Komponen Komposisi
(mg L-1)
Larutan stok (ml L-1 media)
A NH4NO3 1 650 20
B KNO3 1 900 20
C KH2PO4 170 5
H3BO3 6.2
KI 0.83
Na2MoO4. 2H2O 0.25 CoCl2. 6H2O 0.025
D CaCl2. 2H2O 332.2 5
E MgSO4. 7H2O 370 5
MnSO4.H2O 8.6
ZnSO4. 7H2O 16.9 CuSO4. 5H2O 0.025
F Na2EDTA 37.3 10
FeSO4. 7H2O 27.8
Myo Myo-inositol 100 10
Vitamin Thiamin HCl 0.1 10
Asam nikotinat 0.5 Pyridoxin HCl 0.5
Glycine 2.0
24
RIWAYAT HIDUP
Penulis dilahirkan di Pagelaran, Kabupaten Pringsewu pada tanggal 23 Agustus 1992 dari ayah Tarmudi dan ibu Rosnayati. Penulis adalah putra keempat dari empat bersaudara. Tahun 2010 penulis lulus dari SMA Negeri 2 Pringsewu dan pada tahun yang sama penulis lulus seleksi masuk Institut Pertanian Bogor (IPB) melalui jalur Tes Seleksi Nasional Masuk Perguruan Tinggi Negeri (SNMPTN) dan diterima di Departemen Agronomi dan Hortikultura, Fakultas Pertanian.
Selama mengikuti perkuliahan, penulis aktif menjadi asisten praktikum Ilmu Tanaman Perkebunan pada tahun akademik 2013/2014, asisten praktikum Dasar-Dasar Hortikultura tahun akademik 2013/2014. Penulis juga aktif sebagai pelatih pramuka di SMA Kornita IPB Bogor pada tahun 2014, pelatih pramuka di SD Negeri Babakan Dramaga 03 Bogor pada tahun 2014. Penulis juga pernah aktif sebagai staff Sahabat Kementerian Pendidikan BEM KM tahun akademik 2010/2011, staff PSDM di Himpunan Mahasiswa Agronomi (Himagron) tahun akademik 2011/2012, staff PSDM Organisasi Mahasiswa Daerah Asal (OMDA) Lampung tahun akademik 2011/2012, kepala divisi Aset dan Keuangan di UKM Pramuka IPB tahun akademik 2012/2013, Dewan Adat di UKM Pramuka IPB tahun akademik 2013/2014, admin website UKM Pramuka IPB pada tahun akademik 2013/2014, trainer outbond UKM Pramuka IPB untuk Ikatan Mahasiswa Kimia Indonesia pada tahun 2014, delegasi jambore on the air
(JOTA) dan jambore on the internet (JOTI) Nasional-International 2014, berprestasi sebagai pemenang cabang olahraga tenis meja pada Sanggar CUP 2014, berprestasi juga dalam ajang Lomba Gerak Jalan Tingkat Nasional 2014 sebagai Juara 1.
ABSTRAK
LEFIN KAFINDRA. Inisiasi Rimpang Mikro Kaempferia parviflora secara In Vitro
dengan Penambahan BAP dan Sukrosa. Dibimbing oleh NURUL KHUMAIDA dan SINTHO WAHYUNING ARDIE.
Kaempferia parviflora merupakan tanaman obat yang mengandung metabolit sekunder dan berkhasiat untuk mengobati berbagai macam penyakit. Perbanyakan
K. parviflora menggunakan rimpang terkendala oleh lamanya waktu untuk memproduksi rimpang di lapang, yaitu mencapai 8 bulan setelah tanam. Tujuan dari penelitian ini adalah untuk memperoleh konsentrasi sukrosa terbaik dan konsentrasi BAP terbaik dalam inisiasi rimpang mikro K. parviflora. Percobaan ini disusun berdasarkan rancangan kelompok lengkap teracak dengan dua faktor dan tiga ulangan. Faktor pertama adalah konsentrasi BAP dengan 3 taraf, yaitu 0, 2, dan 4 mg L¯1.Faktor kedua adalah konsentrasi sukrosa dengan 4 taraf, yaitu 0, 30, 60, dan 90 g L¯1. Data yang diperoleh dianalisis menggunakan uji F dan apabila berpengaruh nyata, maka dilanjutkan dengan uji lanjut DMRT (Duncan MultipleRange Test) pada taraf α= 5 %. Hasil penelitian menunjukkan bahwa K. parviflora dapat membentuk rimpang mikro in vitro. Hal tersebut ditunjukkan oleh struktur anatomi rimpang mikro yang serupa dengan rimpang in vivo. K. parviflora yang dikulturkan pada media MS yang mengandung 90 g L¯1 sukrosa tanpa BAP memiliki jumlah rimpang mikro tertinggi pada 8 MSP. Kata kunci: kesehatan, kencur hitam, obat tradisional
ABSTRACT
LEFIN KAFINDRA. Application of BAP and Sucrose In The In Vitro Micro Rhizome Initiation of Kaempferia parviflora.Supervised by NURUL KHUMAIDA and SINTHO WAHYUNING ARDIE.
Kaempferia parviflora is a medicinal plant that contains secondary metabolites and efficacious for treating various diseases. Rapid multiplication of K. parviflora
through its rhizome is hamprered by the long period needed to produce the rhizome. The objectives of this research were to obtain the best sucrose concentration and to determine the best BAP concentration in the in vitro micro rhizome initiation of K. parviflora. The experiment was arranged in a randomized complete block design with two factors and three replications. The first factor was BAP concentration, consisted of three levels i.e. 0, 2, and 4 mg L¯1. The second factor was sucrose concentration, consisted of four levels i.e. 0, 30, 60, and 90 g L¯1. Data obtained were analyzed by F-test, followed by DMRT (Duncan Multiple Range Test) at 5 % significant level. Sucrose concentration significantly affected the number of shoots and plantlets fresh weight. The results showed that K. parviflora could form micro rhizome in vitro, as indicated by the similar anatomical structure compared to the rhizome produced in vivo. K. parviflora cultured in MS medium cointaining 90 g L¯1 sucrose without BAP had the highest number of micro rhizome at 8 WAC.
PENDAHULUAN
Latar Belakang
Tanaman obat merupakan salah satu tanaman yang penting keberadaannya di Indonesia, hal tersebut karena masyarakat Indonesia banyak memanfaatkannya sebagai ramuan obat tradisional. Angka impor total tanaman obat 2012 mencapai 24 352.81 ton, sedangkan ekspor 3 466.22 ton dengan nilai sebesar US$18 040 581 dan US$7 469 935 (Ditjen Hortikultura 2012). Bentuk ekspor pada umumnya berupa bahan-bahan mentah,
seperti tanaman kering, bahan-bahan ekstrak, dan sebagian kecil produk jadi (INATRIMS 2014). Bentuk bahan baku obat tradisional yang diimpor berupa bahan
baku jamu, bahan baku ekstrak terstandar, bahan baku fitofarmaka (obat berbahan alam yang memenuhi syarat aman, berguna, dan berkhasiat yang dibuktikan dengan uji klinis), serta simplisia (bahan alam yang telah dikeringkan berupa tanaman utuh, daun, buah, batang, akar dan ekstrak tanaman) (Putri 2014a). Permintaan yang cukup tinggi terhadap tanaman obat menunjukkan bahwa pengembangan tanaman obat memiliki peluang pasar yang cukup besar di Indonesia.
Tanaman dari famili Zingiberaceae memiliki berbagai manfaat bagi masyarakat seperti, obat batuk, rematik, masuk angin, bumbu masak, dan sebagainya. Tanaman
Kaempferia parviflora termasuk dalam famili Zingiberaceae, yang berasal dari Thailand dan dikenal dengan sebutan “krachai dum”, banyak digunakan sebagai obat tradisional, viagra (Wannanon et al. 2012; Wattanathorn et al. 2012), juga banyak digunakan sebagai obat tradisional penambah energi (Putiyanan et al. 2008). Penelitian menunjukkan bahwa ekstrak rimpang tanaman tersebut memiliki banyak khasiat seperti antioksidan (Vichitphan et al. 2007), anti depresi (Wattanathorn et al. 2007; Rajput et al. 2011), anti halusinasi (Tewtrakul dan Subhadirasakul 2008) dan menghambat aktivitas Helicobacter pylori (Chaichanawongsaroj et al. 2010), serta sebagai obat stroke (Phachonpai et al. 2012). Tanaman tersebut banyak digunakan sebagai obat dan dalam kegiatan spiritual oleh masyarakat Thailand (Picheansoonthon dan Koonterm 2008). Tanaman ini juga banyak digunakan sebagai ramuan untuk menyeimbangkan tekanan darah serta mengurangi sakit perut di daerah asalnya yaitu Provinsi Loei (Trisomboon 2009). Menurut Lawrence dan Bacharach (1964) K. parviflora dapat dimanfaatkan sebagai tanaman hias dan rimpangnya dapat diolah untuk ekstrak rasa, bumbu, serta minyak wangi untuk parfum.
2
secara in vitro perlu dilakukan untuk memperoleh bahan tanam yang seragam, dengan mutu yang baik, serta waktu yang cepat. Teknik perbanyakan tanaman secara cepat diperlukan untuk memenuhi kebutuhan penyediaan bahan tanam dalam negeri. Inisiasi rimpang mikro penting dilakukan karena propagul rimpang mikro yang berasal dari eksplan bebas penyakit yang akan menghasilkan rimpang mikro yang bebas penyakit. Wattimena (2000) menyatakan bahwa penggunaan umbi mikro pada kentang dapat menghasilkan tanaman yang seragam dan umur panen sama dengan rimpang biasa, mudah dalam penyimpanan, transportasi dan pengiriman, mudah memenuhi persyaratan karantina untuk lalu lintas propagul baik dalam atau luar negeri. Oleh karena itu, pengembangan rimpang mikro pada K. parviflora juga dapat mempermudah penyimpanan dan transportasi rimpang untuk perbanyakan.
Beberapa senyawa dapat digunakan untuk menginduksi terbentuknya umbi atau rimpang mikro. Hartanto et al. (2010) melaporkan bahwa aplikasi sukrosa dengan konsentrasi 6 % dapat menginduksi terbentuknya rimpang tanaman daun dewa secara
in vitro. Aplikasi sukrosa untuk menginduksi rimpang mikro juga telah dilaporkan pada gembili, yaitu dengan konsentrasi 3-8 % (Ratna 2010). Selain sukrosa, 6-benzyl-adeno-purine (BAP) dilaporkan dapat menginduksi terbentuknya rimpang mikro pada jahe (Rahmawati et al. 2004). Hasil beberapa penelitian tersebut menunjukkan bahwa penambahan BAP dan sukrosa diperlukan untuk menginisiasi terbentuknya rimpang mikro.
Tujuan
Tujuan umum dari penelitian ini adalah untuk mempelajari inisiasi rimpang mikro
Kaempferia parviflora secara in vitro dan mendapatkan komposisi media yang optimum.
Tujuan khusus dari penelitian ini adalah:
1) Mengetahui pengaruh konsentrasi sukrosa terhadap pembentukan rimpang mikro
K. parviflora.
2) Mengetahui pengaruh konsentrasi BAP terhadap pembentukan rimpang mikro
K. parviflora.
3) Mengetahui pengaruh interaksi BAP dan sukrosa dalam pembentukan rimpang mikro
K. parviflora.
TINJAUAN PUSTAKA
Kaempferia parviflora
2
secara in vitro perlu dilakukan untuk memperoleh bahan tanam yang seragam, dengan mutu yang baik, serta waktu yang cepat. Teknik perbanyakan tanaman secara cepat diperlukan untuk memenuhi kebutuhan penyediaan bahan tanam dalam negeri. Inisiasi rimpang mikro penting dilakukan karena propagul rimpang mikro yang berasal dari eksplan bebas penyakit yang akan menghasilkan rimpang mikro yang bebas penyakit. Wattimena (2000) menyatakan bahwa penggunaan umbi mikro pada kentang dapat menghasilkan tanaman yang seragam dan umur panen sama dengan rimpang biasa, mudah dalam penyimpanan, transportasi dan pengiriman, mudah memenuhi persyaratan karantina untuk lalu lintas propagul baik dalam atau luar negeri. Oleh karena itu, pengembangan rimpang mikro pada K. parviflora juga dapat mempermudah penyimpanan dan transportasi rimpang untuk perbanyakan.
Beberapa senyawa dapat digunakan untuk menginduksi terbentuknya umbi atau rimpang mikro. Hartanto et al. (2010) melaporkan bahwa aplikasi sukrosa dengan konsentrasi 6 % dapat menginduksi terbentuknya rimpang tanaman daun dewa secara
in vitro. Aplikasi sukrosa untuk menginduksi rimpang mikro juga telah dilaporkan pada gembili, yaitu dengan konsentrasi 3-8 % (Ratna 2010). Selain sukrosa, 6-benzyl-adeno-purine (BAP) dilaporkan dapat menginduksi terbentuknya rimpang mikro pada jahe (Rahmawati et al. 2004). Hasil beberapa penelitian tersebut menunjukkan bahwa penambahan BAP dan sukrosa diperlukan untuk menginisiasi terbentuknya rimpang mikro.
Tujuan
Tujuan umum dari penelitian ini adalah untuk mempelajari inisiasi rimpang mikro
Kaempferia parviflora secara in vitro dan mendapatkan komposisi media yang optimum.
Tujuan khusus dari penelitian ini adalah:
1) Mengetahui pengaruh konsentrasi sukrosa terhadap pembentukan rimpang mikro
K. parviflora.
2) Mengetahui pengaruh konsentrasi BAP terhadap pembentukan rimpang mikro
K. parviflora.
3) Mengetahui pengaruh interaksi BAP dan sukrosa dalam pembentukan rimpang mikro
K. parviflora.
TINJAUAN PUSTAKA
Kaempferia parviflora
3 2008), dan Phitsanulok (Chivapat et al. 2010). Tanaman tersebut banyak ditemukan di hutan yang lembab, dan hutan bambu serta di bawah tegakkan pepohonan (Picheansoonthon dan Koonterm 2008).
Klasifikasi K. parviflora secara taksonomi adalah sebagai berikut (ICS Unido 2004):
Kingdom : Plantae
Sub-kingdom : Phanerogamae Divisi : Spermatophyta
Subdivisi : Angiospermae Kelas : Monocotyledonae Ordo : Scitaminales Family : Zingiberaceae Genus : Kaempferia
Species : Kaempferia parviflora
Tanaman K. parviflora memiliki keragaan morfologi yang khas seperti warna rimpang ungu kehitaman apabila dibelah (Graham et al. 2006; Putiyanan et al. 2008), rimpang luar berwarna kecokelatan (Putiyanan et al. 2008), penampang melintang rimpang K. parviflora berbentuk bundar atau elips dan memiliki garis lingkaran di tengah dan rimpang yang memiliki kuncup merupakan calon rimpang yang akan tumbuh menjadi individu tanaman (Graham et al. 2006). Penelitian Evi (2012) menunjukkan bahwa daun K. parviflora berbentuk elips dengan dasar bulat, panjang daun 8 sampai 21 cm, lebar daun 5 sampai 11 cm, serta batas daun bergelombang dan berwarna kemerahan, sementara penelitian Putiyanan et al. (2008) menunjukkan daun berwarna hijau, epidermis atas berwarna hijau tua, epidermis bawah berwarna hijau muda, tangkai daun berwarna hijau marun gelap. Bunga K. parviflora berwarna merah keunguan atau merah muda (Putiyanan et al. 2008), sedangkan Graham et al. (2006) menunjukkan bahwa terdapat spot ungu pada bagian bunga yang berwarna putih, bunga muncul di tengah antara 2 daun, tanaman memiliki 1 sampai 4 bunga dari satu perbungaan, dan bentuk bunga tidak teratur atau bilateral simetris.
Kaempferia parviflora dapat tumbuh dengan baik pada daerah dataran tinggi 500 sampai 700 m dpl (ICS Unido 2009). Pertumbuhan vegetatif dan produksi rimpang
K. parviflora paling baik pada ketinggian 1 200 m dpl (Rahma 2013). Tanaman tersebut dapat tumbuh dengan sangat baik dengan tanah beraerasi serta cahaya yang cukup. Rimpang siap panen kencur hitam tersebut berumur antara 11 sampai 12 bulan, rimpang yang telah dipanen baik disimpan pada tempat kering dan dingin sekitar 1 sampai 3 bulan sebelum masa penanaman. Berdasarkan penelitian Evi (2012), Kaempferia parviflora dapat tumbuh dengan baik pada deaerah dengan naungan alami. Zulfa (2012) melaporkan bahwa bio-fertilizer dapat meningkatkan hasil dan mencegah penyebaran penyakit nematoda pada akar. Tanaman kencur hitam juga dapat diperbanyak secara
in vitro dengan media MS0, dengan waktu multlipikasi selama 4 minggu setelah subkultur (Alveno 2012). Bibit hasil perbanyakan secara in vitro terbukti dapat diaklimatisasi dengan tingkat keberhasilan 100 % setelah 10 Minggu setelah aklimatisasi (Putri 2014b).