PENGARUH PEMBERIAN EKSTRAK ETANOL DAUN SIRSAK (Annona muricata Linn) TERHADAP GAMBARAN HISTOPATOLOGI SEL HEPAR TIKUS PUTIH (Rattus norvegicus) GALUR Sprague dawley YANG
DIINDUKSI 7,12–dimethylbenz(α)antrhacene (DMBA)
Oleh
FERI EKA SUPRATANDA
Skripsi
Sebagai Salah Satu Syarat untuk Mencapai Gelar SARJANA KEDOKTERAN
Pada
Fakultas Kedokteran Universitas Lampung
FAKULTAS KEDOKTERAN UNIVERSITAS LAMPUNG
ABSTRACT
THE INFLUENCE OF GIVING ETHANOL EXTRACT OF SOURSOP LEAVES (Annona muricata Linn) AGAINST
DYMETHYLBENZ(α)ANTHRACENE (DMBA) INDUCED APPEARANCE OF HEPAR HISTHOPATOLOGY
By
FERI EKA SUPRATANDA
Leaves of the soursop (Annona muricata Linn) is a plant that has many benefits and also used as hepatoprotective. Soursop leaves contain flavonoids, alkaloids and acetogenis that can neutralize free radicals or ROS (reactive oxygen species) and also as a cytotoxic. This study aimed to investigate the effect of the leaves extract of soursop (Annonna muricata Linn) against liver cell damage rats (Rattus norvegicus) Sprague Dawley strain by DMBA-induced.
In this study, 25 rats were divided into 5 groups and treated for 30 days. GI (given only distilled water), GII (DMBA only given 75 mg/kg), GIII (DMBA were given 75 mg/kg soursop leaves extract 100 mg/kg), GIV (DMBA were given 75 mg/kg and soursop leaves extract 200 mg/kgBW), and GV (DMBA were given 75 mg/kg and extracts of soursop leaves extract 400 mg/kg).
The result showed that the mean number of liver cell damage are GI: 1.20±0.837; GII 13.20±0.837; GIII 11.80±0.837; GIV 10.80±1.643; GV 10.40±1.140. ANOVA test found a significant difference p value = 0.001 for all groups. In the Post Hoc LSD test found significant differences in GI or p value = <0.05, the GII compared with GIII and GIV was not significant compared with GV also not significant. But if be compared GII with GIV and GV was significant. These results indicate that the ethanol extract of leaves of the soursop can reduce cell damage DMBA-induced rat liver due to its antioxidant content.
ABSTRAK
PENGARUH PEMBERIAN EKSTRAK ETANOL DAUN SIRSAK (Annona muricata Linn) TERHADAP GAMBARAN HISTOPATOLOGI SEL HEPAR TIKUS PUTIH (Rattus norvegicus) GALUR Sprague dawley YANG
DIINDUKSI DMBA
Oleh
FERI EKA SUPRATANDA
Daun sirsak (Annona muricata Linn) adalah tanaman yang memiliki banyak manfaat dan juga digunakan hepatoprotektor. Daun sirsak mengandung flavonoid dan alkaloid dan acetogenis yang dapat menetralkan radikal bebas atau ROS (reactive oxygen species). Penelitian ini bertujuan untuk mengetahui adanya pengaruh pemberian ekstrak daun sirsak (Annonna muricata Linn) terhadap kerusakan sel hepar tikus putih (Rattus norvegicus) galur Sprague dawley yang diinduksi DMBA.
Pada penelitian ini, 25 tikus dibagi dalam 5 kelompok dan diberi perlakuan selama 30 hari. KI (hanya diberi aquades), KII (hanya diberi DMBA 75 mg/kgBB), KIII (diberi DMBA 75 mg/kgBB ekstrak Daun sirsak 100 mg/KgBB), KIV (diberi DMBA 75 mg/KgBB dan ekstrak daun sirsak 200 mg/KgBB) dan KV (diberi DMBA 75 mg/KgBB dan ekstrak ekstrak daun sirsak 400 mg/KgBB).
Uji ANOVA didapatkan perbedaan yang bermakna (p=0,000) terhadap semua kelompok. Hasil penelitian menunjukkan bahwa jumlah rerata kerusakan sel hepar adalah KI: 1,20±0,837; KII: 13,20±0,837 ; KIII:11,80±0,837; KIV:10,80±1,643; K5:10,40±1,140. Pada uji Post Hoc LSD didapatkan perbedaan bermakna pada K I atau P<0,05, sedangkan pada K II dengan K III tidak bermakna dan K IV dengan K V juga tidak bermakna. Tetapi KII dibandingkan K IV dan K V bermakna. Hasil ini menunjukkan bahwa ekstrak etanol daun sirsak dapat menurunkan kerusakan sel hepar tikus yang diinduksi DMBA akibat kandungan antioksidannya.
DAFTAR ISI
Halaman
DAFTAR TABEL ... vii
DAFTAR GAMBAR ... vii
DAFTAR LAMPIRAN ... ix
I. PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Perumusan Masalah ... 5
1.3 Tujuan Penelitian ... 6
1.4 Manfaat Penelitian ... 6
1.5 Kerangka Teori... 7
1.6 Kerangka Konsep ... 11
1.7 Hipotesis ... 11
II. TINJAUAN PUSTAKA ... 12
2.1 Sirsak (Annona muricata Linn) ... 12
2.1.1 Deskripsi daun sirsak (Annona muricata Linn) ... 12
2.1.2 Kandungan kimia sirsak (Annona muricata Linn) ... 14
v
2.2 Hati ... 20
2.2.1 Anatomi Hati ... 20
2.2.2 Fisiologi Hati ... 22
2.2.3 Histologi Hati. ... 24
2.2.4 Histopatologi Hati. ... 27
2.3 Dimetilbenz[a]antrasen (DMBA)... 31
2.3.1 Deskripsi Dimetilbenz[a]antrasen (DMBA). ... 31
2.3.2 Mekanisme Aksi Dimetilbenz[a]antrasen (DMBA). ... 32
2.5 Tikus Putih (Rattus norvegicus) Galur Sprague dawley. ... 34
III. METODE PENELITIAN ... 37
3.1 Desain Penelitian ... 37
3.2 Tempat dan Waktu ... 37
3.3 Populasi dan Sampel ... 37
3.4 Bahan dan Alat Penelitian ... 39
3.4.1 Bahan Penelitian. ... 39
3.4.2 Bahan Kimia . ... 39
3.4.3 Alat Penelitian. ... 40
3.5 Prosedur Penelitian... 41
3.5.1 Prosedur Pemberian Ekstrak Daun Sirsak ... 41
3.5.1.1 Metode Pembuatan Ekstrak Daun Sirsak ... 41
3.5.1.2 Prosedur Pemberian Ekstrak Daun Sirsak ... 41
3.5.2 Prosedur Pemberian Dosis DMBA ... ...42
3.5.2.1 Prosedur Pemeliharaan Hewan Coba. ... 43
3.5.2.2 Prosedur Penelitian ... 44
3.6 Identifikasi Variabel dan Definisi Operasional ... 50
3.6.1 Identifikasi Variabel ... 50
3.6.2 Definisi Operasional Variabel ... 50
3.7 Analisis Data ... 52
IV. HASIL DAN PEMBAHASAN ... 54
4.1. Hasil Penelitian ... 54
4.1.1. Gambaran histopatologi hepar tikus ... 54
4.1.2. Analisis histopatologi kerusakan hepar tikus ... 57
4.2. Pembahasan ... 60
V. SIMPULAN DAN SARAN ... 70
5.1Simpulan ... 70
5.2Saran ... 70
DAFTAR PUSTAKA ... 72
viii
DAFTAR GAMBAR
Gambar Halaman
1. Kerangka Teori ... 10
2. Kerangka Konsep ... 11
3. Tanaman Sirsak ... 16
4. Annonaceus Acetogenin ... 18
5. Gambaran makroskopik hati manusia dari anterior ... 24
6. Lobulus hepatik ... 26
7. Gambaran mikroskopik dengan perbesaran 30x hati manusia ... 27
8. Pembengkakan sel disertai vakuolisasi ... 28
9. Struktur kimia DMBA ... 31
10. Mekanisme kerja DMBA ... 34
11. Diagram alur penelitian ... 49
12. Gambar histopatologi hepar tikus . ... 55
DAFTAR TABEL
Tabel Halaman
1. Klasifikasi Tikus Putih (Rattus norvegicus) galur Sprague dawley…...35
2. Definisi Operasional... 51
3. Rerata kerusakan sel hepar tikus yang diberikan ekstrak daun sirsak. ... 57
4. Analisis Saphiro-Wilk gambaran kerusakan sel hepar pada ekstrak daun
sirsak... 59 5. Hasil uji statistik jumlah kerusakan sel hepar perbandingan antar kelompok
ix
DAFTAR LAMPIRAN
Lampiran Halaman
A. Hasil Analisis Statistik Histopatologi Hepar Tikus. ... 78
B. Hasil Pengamatan ... 82
C. Gambaran Histopatologi Hepar Tikus. ... 83
D. Foto-Foto Penelitian. ... 85
BAB I PENDAHULUAN
1.1Latar Belakang
Hati merupakan organ yang paling penting dalam pengaturan homeostasis
tubuh yang meliputi metabolisme, biotransformasi, sintesis, penyimpanan dan
imunologi. Sel–sel hati atau hepatosit mempunyai regenarasi yang cepat. Oleh
karena itu hati akan dapat mempertahankan fungsinya apabila terjadi kerusakan
yang ringan, akan tetapi akan menjadi fatal jika kerusakan manjadi berat dan
serius. Penyebab tersering adalah akibat virus, efek toksik obat, racun, jamur
dan lain sebagainya. Di Indonesia prevalensi belum diketahui secara pasti,
tetapi menurut World Health Organization (WHO) penyakit hati ini menjadi
penyakit endemik di Indonesia dan menjadi penyebab kematianyang tergolong
tinggi (Depkes, 2007).
Berbagai macam mekanisme terlibat dalam kerusakan hepar, diantaranya
hilangnya antioksidan tubuh, mutasi gen, dan ketidakseimbangan proliferasi
dan apoptosis sel. Pada kanker, proliferasi terjadi lebih cepat dan tidak
terkontrol serta tidak berfungsinya agen proapoptotic. Sitokin yang paling
penting dalam menginduksi apoptosis hepatosit adalah golongan reseptor
2
necrosis factor-related apoptosis-inducing ligand (TRAIL) (Schattenberg et
al., 2011).
TNF‒α adalah sitokin proinflamasi yang berperan dalam proses proliferasi,
kematian sel dan perbaikan massa hati fungsional dengan cara proliferasi dan
regenerasi hepatosit. TNF‒α dapat mengaktifkan NF‒κB yang berperan
penting dalam perkembangan dan progresi kerusakan hati melalui hambatan
terhadap proses apoptosis. Meskipun TNF‒α awalnya diidentifikasi sebagai
faktor yang dapat menginduksi kematian sel pada sarkoma dan polimorfisme
gen TNF‒α berhubungan dengan keparahan kanker hati, peranan TNF‒α
dalam hepatokarsinogenesis masih belum jelas dan membutuhkan penelitian
lebih lanjut (Muriel, 2008).
Terapi karusakan hati didasarkan pada penyebab penyakit. Pengobatan yang
dilakukan bila telah mencapai tahap akhir atau end stage adalah pembedahan,
kemoterapi, radioterapi, dan transplantasi hati. Kemoterapi adalah pemberian
anti tumor pada penderita kanker untuk memperpanjang umur. Dilakukan
dengan memberikan obat anti kanker ke dalam arteri hepatika sehingga obat
secara langsung masuk sel‒sel kanker pada hati. Obat tersebut akan
mengecilkan tumor. Obat kemoterapi yang banyak digunakan adalah 5
Fluorourasil dan Adriamisin (Christian et al., 2009). Namun, terapi tersebut
masih banyak menimbulkan berbagai efek samping dan tidak menjamin akan
terjadinya kesembuhan total dan kemungkinan terjadinya reccurence (El–Serag
Radioterapi dan kemoterapi memiliki beberapa keterbatasan. Kemampuan sinar
yang digunakan untuk terapi mengalami peneurunan efektifitas karena ukuran
kanker yang semakin besar. Karena penanambahan dosis yang ditambahkan
juga melebihi dosis batas toksik pada organ normal manusia. Penggunaan obat
kimia seperti kemoterapi tidak hanya membunuh sel tumor namun juga
merusak sel darah yang menyebabkan penurunan fungsi imun atau bahkan
kematian yang disebabkan dari komplikasi akibat efek samping obat yang
serius (Li et al., 2008).
Akhir‒akhir ini masyarakat lebih memilih pengobatan tradisional dengan
menggunakan bahan baku tanaman herbal sebagai obat untuk mencegah
maupun menanggulangi berbagai keluhan dan penyakit. Salah satunya adalah
pemanfaatan daun sirsak (Annona muricata Linn) sebagai pengobatan kanker
(Zuhud, 2011).
Daun sirsak banyak mengandung zat aktif yang berkhasiat, di antaranya
annocatalin, annohexocin, annonacin, annomuricin, annomurine, anonol,
caclourine, gentisic acid, gigantetronin, linoleic acid, dan muricapentocin.
Selama ini daun sirsak diketahui khasiatnya secara tradisional yang berkhasiat
untuk mengobati berbagai penyakit (Ersi & Nila, 2011).
Kandungan kimia dari suku Annonaceae terdiri dari dua golongan yaitu non
alkaloid dan alkaloid. Golongan non alkaloid yang telah diketahui adalah
sukrosa, glukosa, fruktosa yang terdapat pada “pulp” serta gliserides yang
4
ditemukan pada tanaman ini meliputi beberapa senyawa dari golongan
benzil‒tetrahidro‒isoquinolin dan salah satunya adalah liriodin yang bersifat
antitumor, antibakteri dan antijamur. Kandungan kimia dari sirsak adalah
saponin, flavonoid, tanin, kalsium, fosfor, hidrat arang, vitamin (A, B, dan C),
fitosterol, Ca‒oksalat dan alkaloid murisine (Mangan, 2009).
Dari sekian banyak kandungan senyawa bioaktif fitokimia yang ditemukan
dalam tanaman sirsak (Annonna muricata Linn), annonaceous acetogenins
adalah salah satu komponen yang paling penting dan sangat bermanfaat.
Penelitian pertama mengenai sifat sitotoksik acetogenin dilakukan oleh
Universitas Purdue, di West Lafayette, Indiana, Amerika Serikat. Penelitian
lain yang membuktikan khasiat kandungan acetogenin di berbagai negara
dibiayai oleh Lembaga Institut Kanker Nasional, Amerika Serikat. Dari
penelitian tersebut didapatkan hasil bahwa sebanyak 20 tes laboratorium
menemukan bahwa daun dan batang Annona muricata memiliki sitotoksitas
terhadap sel kanker (Zuhud, 2011).
Pada penelitian kali ini digunakan 7,12–dimethylbenz(α)antrhacene (DMBA)
yang merupakan senyawa prokarsinogen dan bertindak sebagai karsinogen
potensial dengan menghasilkan berbagai zat metabolik reaktif yang
menyebabkan stres oksidatif dan kerusakan jaringan. Zat ini juga menyebabkan
terjadinya hepatoksisitas yang ditandai dengan kerusakan sel hepar, dilatasi
vakuol vena sentralis dan sinusoid, fokal nekrosis,TN‒α, kemokin dan sitokin
Berdasarkan hal tersebut penelitian ini dilakukan bertujuan untuk mengetahui
efek pemberian ekstrak etanol daun sirsak (Annona muricata Linn) terhadap
gambaran histopatologi sel hepar tikus putih (Rattus norvegicus) galur Sprague
dawley yang diinduksi DMBA.
1.2Perumusan Masalah
Berdasarkan uraian di atas, dapat dirumuskan permasalahan sebagai berikut:
A. Apakah pemberian ekstrak etanol daun sirsak (Annonna muricata Linn)
dapat menurunkan tingkat kerusakan sel hepar tikus putih (Rattus
norvegicus) galur Sprague dawley yang diinduksi DMBA?
B.Apakah peningkatan dosis ekstrak etanol daun sirsak (Annonna muricata
Linn) dapat menurunkan tingkat kerusakan sel hepar tikus putih (Rattus
6
1.3Tujuan Penelitian
Tujuan dari penelitian ini adalah:
A. Penelitian ini bertujuan untuk mengetahui adanya pengaruh pemberian
ekstrak daun sirsak (Annonna muricata Linn) dalam menghambat
kerusakan sel hepar tikus putih (Rattus norvegicus) galur Sprague dawley
yang diinduksi DMBA.
B. Mengetahui pengaruh peningkatan dosis ekstrak etanol daun sirsak
(Annonna muricata Linn) terhadap kerusakan sel hepar tikus putih
(Rattus norvegicus) galur Sprague dawley yang diinduksi DMBA.
1.4Manfaat Penelitian
Adapun manfaat dari penelitian ini adalah:
1. Manfaat bagi peneliti
Penelitian ini sebagai wujud pengaplikasian disiplin ilmu yang telah dipelajari
sehingga dapat mengembangkan wawasan keilmuan peneliti.
2. Bagi Ilmu Pengetahuan
Hasil penelitian ini diharapkan dapat memberikan informasi ilmiah mengenai
efek daun sirsak (Annona muricata Linn).
3. Manfaat bagi masyarakat
Hasil penelitian ini diharapkan dapat memberikan informasi mengenai efek
4. Bagi Fakultas Kedokteran Universitas Lampung (FK Unila)
Meningkatkan iklim penelitian dibidang agromedicine sehingga dapat
menunjang pencapaian visi FK Unila 2025 sebagai Fakultas Kedokteran
Sepuluh Terbaik di Indonesia pada tahun 2025 dengan kekhususan
agromedicine.
5. Bagi Peneliti Lain
Dapat dijadikan bahan acuan untuk dilakukannya penelitian yang serupa yang
berkaitan dengan efek daun sirsak (Annona muricata Linn).
1.5 Kerangka Teori
Daun sirsak banyak mengandung bahan–bahan yang bermanfaat bagi tubuh.
Daun sirsak (Annona muricata Linn) memiliki kandungan adalah sebagai
berikut seperti alkaloid, non–alkaloid, flavanoid, saponin, tanin, kalsium,
fosfor, hidrat arang, vitamin (A, B, dan C), fitosterol, Ca‒oksalat dan
alkaloid murisine atau senyawa acetogenin yang akan menimbulkan efek
hepatoprotektif terhadap tubuh (Mangan, 2009).
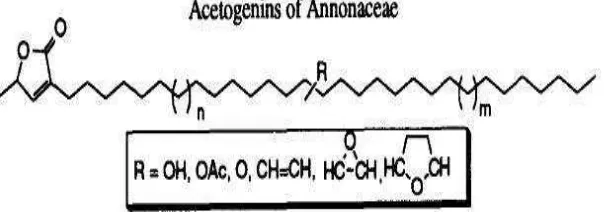
Daun sirsak mengandung sejumlah kandungan kimia yaitu acetogenin.
Acetogenin adalah senyawa poliketida dengan struktur C‒34 atau C‒37
rantai karbon tidak bercabang yang terikat pada gugus 2‒propanol pada C‒2
untuk membentuk suatu lakton. Senyawa ini memiliki 350 senyawa turunan
8
di dalam sirsak. Acetogenin telah terbukti sebagai senyawa sitotoksik terbesar
dalam membunuh sel kanker. Bahkan, annonaceous acetogenin sering
disebut sebagai inhibitor I atau penghambat pertumbuhan sel kanker paling
kuat dan selektif (Zuhud, 2011).
Akibatnya sel kehilangan energi dan pernafasan sel akan terhenti. Annonacin
acetogenin mampu memblokir mitokondria kompleks I
(NADH‒dehidrogenase), yang bertanggung jawab untuk konversi dari
nikotinamida adenosine dinukleotida hidrogen (NADH) ke NAD dan
membangun gradien proton melalui membran dalam mitokondria. Hal ini
secara efektif menonaktifkan kemampuan sel untuk menghasilkan
adenotrifosfat (ATP) melalui jalur oksidatif. Akhirnya memaksa sel ke
apoptosis atau nekrosis. Apoptosis adalah proses kematian sel terprogram dan
nekrosis adalah kematian sel prematur, inilah yang menyebabkan kematian
sel kanker (Amelia et al., 2012).
Flavonoid merupakan antioksidan yang kuat karena aktivitasnya sebagai
antioksidan dan antiinflamasi. Antioksidan akan menyebabkan terjadinya
penghambatan radikal bebas dengan cara menetralkan radikal bebas sehingga
mencegah kerusakan oksidatif pada sebagian besar biomolekul dan
menghasilkan proteksi terhadap kerusakan oksidatif secara signifikan
(Sreelatha & Padma, 2009). Antioksidan juga akan menstabilkan radikal
bebas dengan melengkapi kekurangan elektron yang dimiliki radikal bebas,
yang dapat menimbulkan stres oksidatif sehingga pembentukan radikal bebas
dapat ditekan atau dihambat (Waji & Sugrani, 2009).
DMBA adalah senyawa radikal bebas yang banyak terdapat pada asap rokok,
asap kendaraan bermotor, dan asap pabrik, pembakaran yang tidak sempurna
dan juga asap dapur rumah tangga yang sering dijumpai. DMBA merupakan
(prokarsinogen) sehingga harus mengalami biotransformasi untuk
menghasilkan karsinogen aktif. Proses metabolisme menghasilkan DMBA
menjadi senyawa yang lebih toksik. Akibat peningkatan DMBA akan
menstimulasi terjadinya inflamsi kronis akibat penimbunan makrofag
sehingga mengakibatkan NF‒kB teraktivasi (Gao et al., 2007).
Semakin tinggi paparan radikal bebas terhadap tubuh maka tubuh akan
merespon terhadap paparan radikal bebas akibat DMBA ini, salah satunya
akan terjadi di organ hati. Maka dari itu, DMBA akan dimetabolisme di hati
dan akan menjadi senyawa yang reaktif setelah mengalami metabolisme, hal
ini memungkinkan dapat menyebabkan kerusakan hati (Sari, 2008).
Stres oksidatif juga berperan dalam mekanisme umum terjadinya
perkembangan kerusakan hati dalam berbagai gangguan hati. Kadar Aspartate
Transaminase (AST), Alanine Transaminase (ALT), dan Alkaline
Phosphatase (ALP) yang terdapat dalam sel hati merupakan indikasi dari
kerusakan hepatoseluler yang ditemukan menurun pada tikus yang diinduksi
10
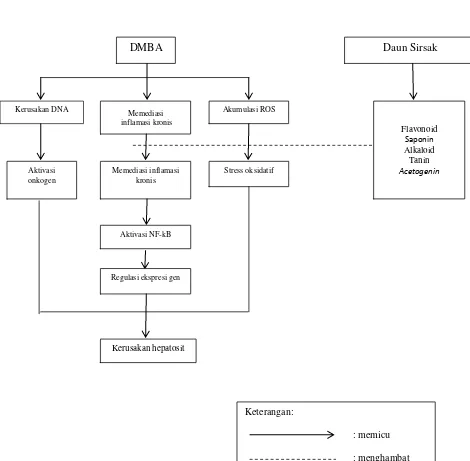
Gambar 1. Kerangka teori pengaruh ekstrak daun sirsak (Annona muricata Linn) terhadap induksi DMBA
Stress oksidatif Memediasi inflamasi
kronis
Daun Sirsak
Flavonoid
Saponin
Alkaloid Tanin
Acetogenin
DMBA
Aktivasi NF-kB
Regulasi ekspresi gen
Kerusakan hepatosit Kerusakan DNA Memediasi
inflamasi kronis
Akumulasi ROS
Aktivasi onkogen
Keterangan:
: memicu
1.6Kerangka Konsep
1.7Hipotesis
Hipotesis penelitian ini adalah:
A. Terdapat pengaruh pemberian ekstrak etanol daun sirsak (Annona
muricata Linn) terhadap gambaran histopatologi sel hepar tikus putih
(Rattus norvegicus) galur Sprague dawley yang diinduksi DMBA.
B. Pemberian perbedaan dosis ekstrak etanol daun sirsak (Annona muricata
Linn) dapat menurunkan tingkat kerusakan sel hepar tikus putih (Rattus
BAB II
TINJAUAN PUSTAKA
2.1Sirsak (Annona muricata Linn)
2.1.1 Deskripsi Sirsak (Annona muricata Linn)
Sirsak (Annona muricata Linn) merupakan tumbuhan yang
berasal dari Karibia, Amerika Tengah, dan Amerika Selatan.
Tumbuhan ini banyak tumbuh di Negara tropis seperti Angola,
Brazil, Columbia, Costa Rica, Cuba, Jamaica, India, Mexico,
Panama, Peru, Porto Rico, Venezuela, dan Indonesia. Paling baik
ditanam di daerah yang cukup berair dan ketinggian di atas 1000
meter dari permukaan laut. Kebanyakan masyarakat menanam
tanaman ini untuk diambil daging buahnya. Buah sirsak
mengandung banyak karbohidrat, terutama fruktosa. Kandungan
gizi lainnya adalah vitamin C, vitamin B1 dan vitamin B2 yang
cukup banyak. Bijinya dapat digunakan sebagai insektisida alami
Sistematika tanaman Sirsak (Annona muricata Linn):
Divisi : Spermatophyta
Subdivisi : Angiospermae
Kelas : Dicotyledoneae
Bangsa : Polycarpiceae
Suku : Annonaceae
Marga : Annona
Jenis : Annona muricata Linn (Sunarjono, 2006).
Sirsak (Annona Muricata Linn) berasal dari Karibia, Amerika
Tengah dan Amerika Selatan. Buah sirsak rasanya manis agak
asam sehingga sering dipakai sebagai bahan jus buah. Daging
buahnya kaya akan serat. Setiap 100 g buah yang dapat dimakan
mengandung 3,3 g serat sehingga dapat memenuhi 13%
kebutuhan serat per hari. Selain itu, daging buahnya mengandung
banyak karbohidrat (terutama fruktosa), vitamin C (20 mg/100 g),
B1 dan B2 (Sunarjono, 2006).
Annona muricata Linn (Sirsak) banyak ditemukan di sekitar
pekarangan rumah dan di ladang–ladang. Tumbuhan ini di
berbagai daerah Indonesia dikenal sebagai nangka sebrang,
nangka landa (Jawa), nangka walanda, sirsak (Sunda), nangka
14
durio ulondro (Nias), durian betawi (Minangkabau), serta jambu
landa (di Lampung) (Sunarjono, 2006).
Sirsak juga memiliki manfaat yang besar bagi kehidupan
manusia, yaitu sebagai buah yang syarat dengan gizi dan
merupakan bahan obat tradisional yang memiliki multi khasiat.
Dalam industri makanan, sirsak dapat diolah menjadi selai buah
dan sari buah, sirup dan dodol sirsak (Jannah, 2010).
2.1.2 Kandungan Kimia Sirsak
Dalam daun sirsak (Annona muricata Linn) terdapat senyawa
Acetogenin. Acetogenin adalah senyawa sitotoksik dimana
senyawa ini ialah senyawa polyketides dengan struktur 30–32
rantai karbon tidak bercabang yang terikat pada gugus
5‒methyl‒2‒furanone. Rantai furanone dalam gugus
hydrofuranone pada C23 memiliki aktivitas sitotoksik.
Acetogenin merupakan kumpulan senyawa aktif yang berada
hampir pada setiap bagian tanaman sirsak (Li et al., 2008).
Dari penelitian acetogenin yang terkandung didalam sirsak bisa
digunakan untuk menghantam kanker usus, pankreas, ovarium,
usus besar, payudara, liver, dan serviks. Annonaceous acetogenin
bekerja dengan menghambat produksi ATP dengan mengganggu
Sel kanker membutuhkan banyak energi sehingga membutuhkan
banyak ATP. Acetogenin masuk dan menempel di reseptor
dinding sel dan merusak ATP di dinding mitokondria.
Dampaknya produksi energi di dalam sel kanker pun berhenti dan
akhirnya sel kanker mati. Hebatnya, acetogenin sangat selektif
dan hanya menyerang sel kanker yang memiliki kelebihan ATP
saja sehingga tidak merusak sel normal (Muliyah, 2013).
Terdapat data mengenai nilai kekuatan sitotoksik beberapa
tanaman buah keluarga Annonaceae yang berada di Colombia.
Aktivitas sitotoksisitas diklasifikasikan menjadi empat, yaitu
aktivitas tinggi (LC50<10 µg/ml), aktif (10<LC50<50 µg/ml), aktif
sedang (50<LC50<100 µg/ml) dan tidak aktif (LC50>100 µg/ml).
Nilai LC50 yang rendah justru memiliki kemampuan sitotoksik
yang tinggi karena ekstrak yang digunakan untuk membunuh sel
kanker dan menjadi bersifat toksik bagi tubuh jumlahnya sedikit
(Osorio et al., 2007).
Nilai LC50 pada daun sirsak yang rendah menunjukkan kekuatan
sitotoksik acetogenin yang tinggi sudah tidak diragukan lagi
dalam menyerap radikal bebas di dalam tubuh dengan cepat.
Karena itu, acetogenin sangat berkhasiat sebagai racun yang
menghambat pertumbuhan sel abnormal penyebab berbagai
16
Gambar 3. (a) Buah sirsak, (b) Bunga sirsak, (c) Daun sirsak (Botanical garden, 2007)
2.1.3 Manfaat Daun Sirsak
Ada beberapa manfaat daun sirsak yang sering digunakan untuk
obat tradisional:
1) Sebagai Antikanker
Hasil penelitian menemukan beberapa senyawa aktif yang termasuk
ke dalam annonaceous acetogenin. Beberapa senyawa turunan
muricatocins B, annonacin A, trans‒isoannonacin,
annonacin‒10‒one, dan muricatocin. Senyawa‒senyawa aktif
tersebut ditemukan di dalam daun dan batang sirsak yang ternyata
mampu membunuh beragam sel kanker (Li et al., 2008).
Berikut fakta penghambatan senyawa acetogenin hasil di
Laboratorium Culture Cell, Pusat kanker Purdue, Amerika serikat,
menyatakan bahwa cis‒annonacin, salah satu senyawa acetogenin
dalam daun sirsak bersifat selektif mematikan sel‒sel kanker usus
besar dan memiliki kekuatan 10.000 kali lebih besar dibandingkan
dengan adriamycin sebagai obat kemotrapi (Zuhud, 2011).
Total sintesis murisolin menununjukkan aktivitas sitotoksik
terhadap sel‒sel tumor manusia sebesar 105–106 kali lebih kuat
dibandingkan dengan adriamycin. Sama halnya dengan sel kanker,
senyawa annonaceous acetogenin juga memiliki sifat sitotoksik
hanya pada sel tumor, sedangkan sel normal akan dibiarkan tetap
hidup. Murisolin adalah salah satu senyawa acetogenin untuk anti
18
Gambar 4 . Annonaceus Acetogenin
2) Sebagai Antiinflamasi
Inflamasi atau peradangan merupakan respon perlindungan yang
dilakukan oleh sel darah putih dan senyawa kimia lain di dalam
tubuh terhadap serangan virus dan bakteri akibat cedera atau
kerusakan jaringan. Annona muricata adalah salah satu tananam
yang dimanfaatkan oleh masyarakat di Brazil dan Amerika Selatan
sebagai obat anti inflamasi (Lima et al., 2011).
Flavonoid merupakan antioksidan yang kuat karena aktivitasnya
sebagai antioksidan dan antiinflamasi. Antioksidan ini mempunyai
aktivitas menetralkan radikal bebas sehingga mencegah kerusakan
oksidatif pada sebagian besar biomolekul dan menghasilkan
proteksi terhadap kerusakan oksidatif secara signifikan.
Antioksidan dapat menstabilkan radikal bebas dengan melengkapi
kekurangan elektron yang dimiliki radikal bebas, dan menghambat
terjadinya reaksi berantai dari pembentukan radikal bebas yang
3) Sebagai Antivirus
Para peneliti di Universitas Purdue, Amerika Serikat, pada tahun
1997 menyatakan bahwa NADH dehidrogenase di dalam ekstrak
daun sirsak sebagai penghambat inveksi virus Human
Imunodeficiency Virus (HIV). NADH dehidrogenase adalah enzim
di dalam protein yang terikat oleh membrane dari sistem transport
electron mitokondria. Selain itu, hasil penelitian yang tercantum
dalam review Laporan Ilmiah Skaggs tahun 1997 sampai 1998
menyatakan annonaceous acetogenin terutama yang berdekatan
dengan cincin bis‒tetrahidrofuran (THF) berperan sebagai
sitotoksik terhadap aktivitas virus malaria dan imunospresif
(Zuhud, 2011).
4) Sebagai Antibakteri
Senyawa acetogenin dan beberapa alkaloid murisolin, cauxine,
couclamine, stepharine, dan reticulin di dalam daun sirsak mampu
bertindak sebagai antibakteri. Kandungan fitokimia annonaceous
acetogenin pada ekstrak daun sirsak merupakan agen aktif
antibakteri. Khasiat daun sirsak mampu mengatasi infeksi yang
disebabkan oleh bakteri, seperti diare, bisul, infeksi saluran kemih
20
5) Sebagai Penyembuhan Luka
Luka adalah keadaan terganggunya jaringan yang disebabkan oleh
sifat fisik, kimia, mikroba atau reaksi imunologi yang
menyebabkan rusaknya jaringan. Aktivitas penyembuhan luka
ekstrak alkohol batang dan kulit Annona muricata menunjukkan
pengurangan area luka yang diuji pada tikus albino Rattus
norvegicus yang terbukti dapat menyembuhkan jaringan yang luka
(Gajalakshmi et al., 2012).
6) Sebagai Penurun Tekanan Darah
Beberapa studi yang dilakukan oleh para peneliti yang berbeda
terhadap tikus dengan tekanan darah tinggi pada tahun 1941 dan
1962 menunjukkan hasil bahwa daun dan kulit batang sirsak
bermanfaat sebagai penurun tekanan darah, vasodilator (pelebaran
pembuluh darah), relaksan otot polos dan kegiatan
cardiodepressant (menekan aktivitas jantung) (Zuhud, 2011).
2.2Hati
2.2.1 Anatomi Hati
Hepar merupakan kelenjar yang terbesar dalam tubuh manusia.
Hepar pada manusia terletak pada bagian atas cavum abdominis,
di bawah diafragma, di kedua sisi kuadran atas, yang sebagian
bersentuhan di bawah diafragma, permukaan bawah terletak
bersentuhan di atas organ‒organ abdomen. hepar difiksasi secara
erat oleh tekanan intraabdominal dan dibungkus oleh peritoneum
kecuali di daerah posterior‒superior yang berdekatan dengan
vena cava inferior dan mengadakan kontak langsung dengan
diafragma. Bagian yang tidak diliputi oleh peritoneum disebut
bare area. Terdapat refleksi peritoneum dari dinding abdomen
anterior, diafragma dan organ‒organ abdomen ke hepar berupa
ligamen (Snell, 2006).
Hati merupakan kelenjar terbesar dalam tubuh manusia dengan
berat kurang lebih 1,5 kg. Hati merupakan tempat pengolahan dan
penyimpanan nutrien yang diserap dari usus halus untuk dipakai
oleh bagian tubuh lainya. Posisi hati dalam dalam sistem sirkulasi
adalah untuk menampung, mengubah dan mengumpulkan
metabolit serta menetralisasi zat toksik. Hati juga memiliki fungsi
untuk menghasilkan protein plasma, seperti albumin, dan protein
(Junqueira et al., 2007).
Hati pada manusia terletak pada kuadran atas cavum abdominis.
Hati terbagi menjadi 2 lobus yaitu lobus hepatis dextra dan lobus
hepatis sinistra. Lobus hepatis dextra dibatasi oleh fossa vesice
biliaris dan sulcus cavae pada fascies visceralis hepatis. Pada
22
quadratus. Hati menerima darah dari dua sumber yakni 30%
berasal dari arteri hepatika propria dan 70% dari vena porta
(Moore & Agur, 2012).
2.2.2 Fisiologi Hati
Hati adalah kelenjar besar berwarna merah gelap terletak di bagian
atas abdomen sisi kanan. Unit fungsional dasar hati adalah lobulus
hati, yang berbentuk silindris. Hati manusia berisi 50.000 sampai
100.000 lobulus. Lobulus sendiri dibentuk terurama dari banyak
lempeng sel hepar. Masing‒masing lempeng hepar tebalnya satu
sampai dua sel, dan diantara sel yang berdekatan terdapat kanakuli
biliaris kecil yang mengalir ke duktus biliaris di dalam septum
fibrosa yang memisahkan lobulus hati yang berdekatan (Guyton &
Hall, 2008).
Fungsi dasar hati dapat dibagi menjadi (1) fungsi vaskular untuk
menyimpan dan menyaring darah, (2) fungsi metabolisme yang
berhubungan dengan sebagian besar sistem metabolisme tubuh, dan
(3) fungsi sekresi yang berperan membentuk empedu yang
mengalir melalui saluran empedu ke saluran pencernaan. Dalam
fungsi vaskularnya hati adalah sebuah tempat mengalir darah yang
besar. Hati juga dapat dijadikan tempat penimpanan sejumlah besar
darah. Aliran limfe dari hati juga sangat tinggi karena pori dalam
Kupffer (derivat sistem retikuloendotelial atau monosit–makrofag)
yang berfungsi untuk menyaring darah (Guyton & Hall, 2008).
Hati mempunyai beberapa fungsi yaitu:
a. Metabolisme karbohidrat
Fungsi hati dalam metabolisme karbohidrat adalah menyimpan
glikogen dalam jumlah besar, mengkonversi galaktosa dan
fruktosa menjadi glukosa, glukoneogenesis, dan membentuk
banyak senyawa kimia yang penting dari hasil perantara
metabolisme karbohidrat (Guyton & Hall, 2008).
b. Metabolisme lemak
Fungsi hati yang berkaitan dengan metabolisme lemak, antara
lain: mengoksidasi asam lemak untuk menyuplai energi bagi
fungsi tubuh yang lain, membentuk sebagian besar kolesterol,
fosfolipid dan lipoprotein, membentuk lemak dari protein dan
karbohidrat (Guyton & Hall, 2008).
c. Metabolisme protein
Fungsi hati dalam metabolisme protein adalah deaminasi asam
amino, pembentukan ureum untuk mengeluarkan amonia dari
cairan tubuh, pembentukan protein plasma, dan interkonversi
beragam asam amino dan membentuk senyawa lain dari asam
24
d. Lain‒lain
Fungsi hati yang lain diantaranya hati merupakan tempat
penyimpanan vitamin, hati sebagai tempat menyimpan besi, hati
membentuk zat–zat untuk koagulasi darah dalam jumlah banyak
dan hati mengeluarkan atau mengekskresikan obat–obatan, hormon
[image:34.595.167.510.318.553.2]dan zat lain (Guyton & Hall, 2008).
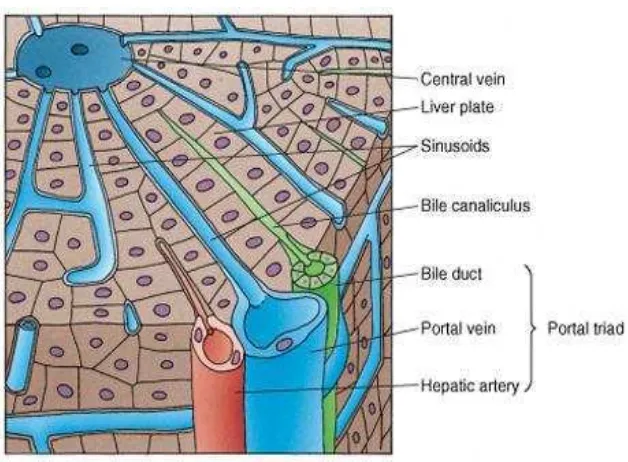
Gambar 5. Gambaran makroskopik hati manusia dari anterior (Putz & Pabst, 2007)
2.2.3 Histologi Hati
Sel–sel yang terdapat di hati antara lain: hepatosit, sel endotel,
penimbun lemak). Sel hepatosit berderet secara radier dalam
lobulus hati dan membentuk lapisan sebesar 1‒2 sel serupa
dengan susunan bata. Lempeng sel ini mengarah dari tepian
lobulus ke pusatnya dan beranastomosis secara bebas membentuk
struktur seperti labirin dan busa. Celah diantara lempeng_lempeng
ini mengandung kapiler yang disebut sinusoid hati (Junquiera et
al., 2007).
Sinusoid hati adalah saluran yang berliku–liku dan melebar,
diameternya tidak teratur, dilapisi sel endotel bertingkap yang
tidak utuh. Sinusoid dibatasi oleh 3 macam sel, yaitu sel endotel
(mayoritas) dengan inti pipih gelap, sel Kupffer yang fagositik
dengan inti ovoid, dan sel stelat atau sel Ito atau liposit hepatik
yang berfungsi untuk menyimpan vitamin A dan memproduksi
matriks ekstraseluler serta kolagen. Aliran darah di sinusoid
berasal dari cabang terminal vena portal dan arteri hepatik,
membawa darah kaya nutrisi dari saluran pencernaan dan juga
kaya oksigen dari jantung (Eroschenko, 2010; Junqueira et al.,
2007).
Traktus portal terletak di sudut‒sudut heksagonal. Pada traktus
portal, darah yang berasal dari vena portal dan arteri hepatik
dialirkan ke vena sentralis. Traktus portal terdiri dari 3 struktur
26
venula portal terminal yang dibatasi oleh sel endotel pipih.
Terdapat arteriola dengan dinding yang tebal yang merupakan
cabang terminal dari arteri hepatik. Ketiga adalah duktus biliaris
yang mengalirkan empedu. Selain ketiga struktur itu, ditemukan
juga limfatik (Junqueira et al., 2007). Hati adalah organ viseral
[image:36.595.194.508.315.546.2]terbesar dan terletak dibawah kerangka iga (Sloane, 2004).
Gambar 6. Lobulus hepatik (Junqueira et al., 2007)
Aliran darah di hati dibagi dalam unit struktural yang disebut
asinus hepatik.Asinus hepatik berbentuk seperti buah berry,
terletak di traktus portal. Asinus ini terletak di antara 2 atau lebih
venula hepatic terminal, dimana darah mengalir dari traktus
menjadi 3 zona, dengan zona 1 terletak paling dekat dengan
traktus portal sehingga paling banyak menerima darah kaya
oksigen, sedangkan zona 3 terletak paling jauh dan hanya
menerima sedikit oksigen. Zona 2 atau zona intermediet berada
diantara zona 1 dan 3. Zona 3 ini paling mudah terkena jejas
iskemik (Junqueira et al., 2007).
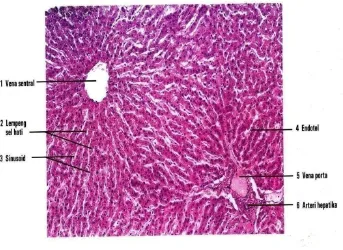
Gambar 7. Gambaran mikroskopik dengan perbesaran 30x hati manusia (Eroschenko, 2010)
2.2.4 Histopatologi Hati
Jejas sel dalam hati dapat bersifat reversibel atau ireversibel
[image:37.595.159.502.309.559.2]28
a. Jejas reversibel
1) Pembengkakan Sel
Pembengkakan merupakan manifestasi pertama yang ada hampir
pada semua bentuk jejas sel, sebagai akibat pergeseran air
ekstraseluler ke dalam sel, akibat gangguan pengaturan ion dan
[image:38.595.188.510.306.538.2]volume karena kehilangan ATP.
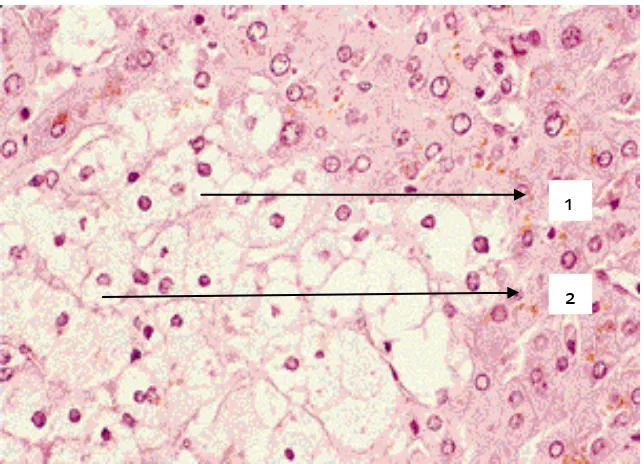
Gambar 8. Pembengkakan sel disertai vakuolisasi; Ket.: 1. Sel yang mengalami vakuolisasi, 2. Inti sel menggeser ke tepi (Robbins et al., 2007).
Bila air berlanjut tertimbun dalam sel, vakuol_vakuol kecil jernih
tampak dalam sitoplasma yang diduga merupakan retikulum
endoplasma yang melebar dan menonjol keluar atau segmen
pecahannya. Gambaran jejas nonletal ini kadang‒kadang disebut
degenerasi hidropik atau degenerasi vakuol. Selanjutnya hepatosit 1
yang membengkak juga akan tampak edematosa (degenerasi balon)
dengan sitoplasma ireguler bergumpal dan rongga‒rongga jernih
yang lebar (Robbins et al., 2007).
2) Perlemakan Hati
Perlemakan hati merupakan akumulasi trigliserida dalam sel‒sel
parenkim hati. Akumulasi timbul pada keadaan berikut:
a) Peningkatan mobilisasi lemak jaringan yang menyebabkan
peningkatan jumlah asam lemak yang sampai ke hati
b) Peningkatan kecepatan konversi dari asam lemak menjadi
trigliserida di dalam hati karena aktivitas enzim yang terlibat
meningkat
c) Penurunan oksidasi trigliserida menjadi asetil‒koA dan
penurunan bahan keton
d) Penurunan sintesis protein akseptor lipid
b. Jejas Ireversibel
1) Nekrosis
Nekrosis sel dapat terjadi langsung atau dapat mengikuti degenerasi
sel (jejas reversibel). Gambaran mikroskopik dari nekrosis dapat
berupa gambaran piknosis, karioreksis, dan kariolisis (Robbins et al.,
2007).
Berdasarkan lokasinya nekrosis terbagi menjadi tiga yaitu nekrosis
fokal, nekrosis zona, nekrosis submasif. Nekrosis sel hati fokal
30
sekelompok kecil sel pada seluruh daerah lobulus‒lobulus hati.
Nekrosis ini dikenali pada biopsi melalui badan asidofilik
(councilman) yang merupakan sel hati nekrotik dengan inti piknotik
atau lisis dan sitoplasma terkoagulasi berwarna merah muda. Selain
itu dapat dikenali juga pada daerah lisis sel hati yang dikelilingi oleh
kumpulan sel kupffer dan sel radang. Nekrosis zona sel hati adalah
nekrosis sel hati yang terjadi pada regio‒regio yang identik disemua
lobulus hati, sedangkan nekrosis submasif merupakan nekrosis sel
hati yang meluas hingga melewati batas lobulus, sering
menjembatani daerah portal dengan vena sentralis (bridging
necrosis) (Robbins et al., 2007).
2) Fibrosis
Fibrosis merupakan akumulasi matriks ekstraseluler yang merupakan
respon dari cedera akut atau kronik pada hati. Pada tahap awal,
fibrosis mungkin terbentuk di dalam atau di sekitar saluran porta
atau vena sentralis atau mungkin mengendap langsung didalam
sinusoid. Hal ini merupakan reaksi penyembuhan terhadap cedera.
Cedera pada hepatosit yang akan mengakibatkan pelepasan sitokin
dan faktor solubel lainnya oleh sel kupffer serta sel tipe lainnya pada
hati. Faktor‒faktor ini akan mengaktivasi sel stelat yang akan
mensintesis sejumlah besar komponen matriks ekstraseluler
2.3Dimetilbenz[a]antrasen (DMBA)
2.3.1 Deskripsi Dimetilbenz[a]antrasen (DMBA)
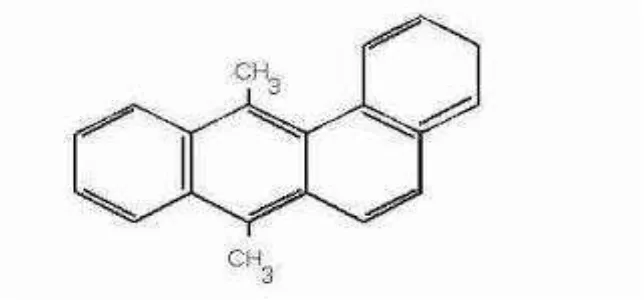
DMBA termasuk senyawa karsinogen golongan polisiklik
aromatik hidrokarbon (PAH), merupakan polutan lingkungan dan
produk pirolisis dari minyak dan material biologi, dihasilkan oleh
asap rokok, asap kendaraan, dan pembakaran tidak sempurna dari
bahan bakar batubara dan minyak bumi. Struktur kimia DMBA
memiliki 4 cincin aromatik yang berikatan, khas struktur PAH
dengan tiga atau lebih cincin aromatik dan 2 substituen metal
[image:41.595.186.508.436.586.2](Sharma et al., 2012).
Gambar 9. Struktur kimia DMBA (Sharma et al., 2012)
2.3.2 Mekanisme Aksi Dimetilbenz[a]antrasen (DMBA)
Stres oksidatif adalah mekanisme umum yang berkontribusi
32
berbagai gangguan hati. Kadar Aspartate Transaminase (AST),
Alanine Transaminase (ALT), dan Alkaline Phosphatase (ALP)
yang terdapat dalam sel hati merupakan indikasi dari kerusakan
hepatoseluler yang ditemukan menurun pada tikus yang diinduksi
DMBA (Sharma et al., 2012).
DMBA ini selanjutnya akan menyebabkan transformasi
neoplastik melalui kerusakan DNA, akumulasi reactive oxygen
species (ROS), dan memediasi inflamasi kronis. Kerusakan DNA
menyebabkan pengaktifan onkogen dan atau inaktivasi gen
supresi tumor dan berbagai epigenetik yang menyebabkan
progresi dari tumor (He & Karin, 2011). DMBA terbukti dapat
menginduksi produksi ROS yang mengakibatkan peroksidasi
lipid, kerusakan DNA, dan deplesi dari sel sistem pertahanan
antioksidan (Kasolo et al., 2010).
Mediator inflamasi kronis biasanya dihasilkan oleh makrofag
yang teraktivasi akibat induksi DMBA, kemudian akan dapat
mengakibatkan NF-kB teraktivasi yang akan menyebabkan
aktifitas kerusakan sel hepar menjadi semakin berat. NF-kB akan
meregulasi ekspresi gen yang termasuk dalam beberapa proses
yang mempunyai peranan penting di dalam perkembangan dan
progresi dari kanker, yaitu proliferasi, migrasi, dan apoptosis
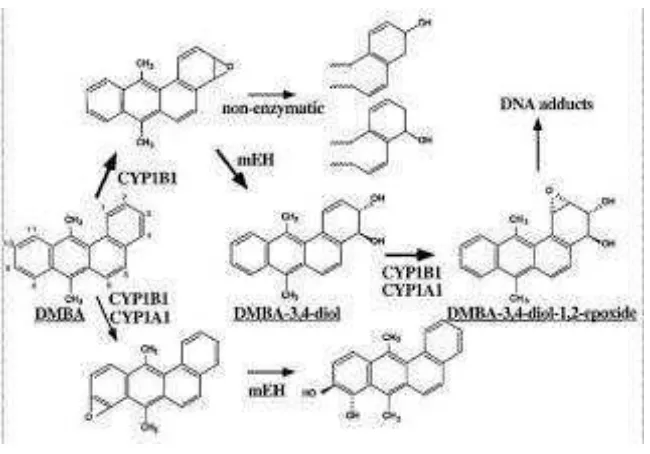
Proses metabolisme DMBA dilakukan oleh enzim-enzim
sitokrom P‒450 dan epoksidahidrolase, kemudian akan
menyebabkan terbentuknya proximate carcinogen (karsinogen
awal) dan selanjutnya berubah ultimate carcinogen (karsinogen
akhir) yang menyebabkan kerusakan DNA melalui pembentukan
epoksid dihidrodiol. Kemudian DNA adduct (kompleks yang
dibentuk oleh bagian DNA tertentu dengan senyawa mutagen
kimia dengan ikatan kovalen) akan terbentuk dan menyebabkan
mutasi sel yang membentuk sel–sel kanker. Dari metabolit aktif
inilah yang akan menjadi sel–sel kanker hepar dari induksi
DMBA (Fitricia et al., 2012).
Jalur metabolisme DMBA yang melalui aktivasi enzim sitokrom
P‒450 menjadi intermediate reaktif yang dapat merusak DNA,
yaitu terbentuknya epoksida dihidrodiol dan kation radikal.
Epoksida dihidrodiol akan mengikat gugus amino ekosiklik purin
DNA secara kovalen menjadi bentuk adduct stabil, sedangkan
kation radikal akan mengikat N7 atau C8 purin menjadi bentuk
adduct tak stabil yaitu depurinisasi menjadi tempat yang
34
Gambar 10. Mekanisme Kerja DMBA (Smith, 2006)
2.4Tikus Putih (Rattus norvegicus) Galur Sprague dawley
Tikus merupkan hewan mamalia yang biasa digunakan sebagai hewan
coba dalam berbagai penelitian di laboratorium karena tikus memiliki
daya adaptasi yang sangat tinggi sehingga dapat melakukan perkawinan
pada berbagai macam kondisi iklim dan lingkungan (Narendra, 2007).
Tikus putih (Rattus norvegicus) merupakan hewan pengerat dan sering
digunakan sebagai hewan percobaan atau digunakan untuk penelitian,
dikarenakan tikus merupakan hewan yang mewakili dari kelas mamalia,
sehingga kelengkapan organ, kebutuhan nutrisi, metabolisme
biokimianya, sistem reproduksi, pernafasan, peredaran darah dan
adalah galur Sprague dawley berjenis kelamin betina berumur kurang
lebih 3 bulan (Kesenja, 2005).
Tabel 1. Klasifikasi Tikus Putih (Rattus norvegicus) galur Sprague dawley.
Sumber: Narendra, 2007
Terdapat beberapa galur atau varietas tikus yang memiliki kekhususan
tertentu antara lain galur Sprague dawley, Wistar, dan galur Long Evans.
Tikus galur Sprague dawley memiliki ciri-ciri albino putih, berkepala
kecil dengan ekor yang lebih panjang daripada badannya. Tikus galur
Wistar memiliki ciri-ciri bentuk kepala lebih besar dengan ekor yang
lebih pendek, sedangkan galur Long Evans memiliki ciri badan
berukuran lebih kecil dari tikus putih, berwarna hitam pada bagian kepala
dan tubuh bagian depan (Putra, 2009).
Tikus putih (Rattus norvegicus) galur Sprague dawley merupakan tikus
yang paling sering digunakan untuk percobaan. Tikus ini memiliki
temperamen yang tenang sehingga mudah dalam penanganan. Rata-rata
KLASIFIKASI KETERANGAN
Kingdom Animalia
Filum Chordata
Kelas Mamalia
Ordo Rodentai
Subordo Sciurognathi
Familia Muridae
Genus Rattus
[image:45.595.164.479.216.406.2]36
ukuran berat badan tikus Sprague dawley adalah 10,5 gram. Berat badan
dewasa adalah 250‒300 gram untuk betina, dan 450‒520 gram untuk
BAB III
METODOLOGI PENELITIAN
3.1.Desain Penelitian
Penelitian ini merupakan penelitian eksperimental laboratorik yang
menggunakan metode rancangan acak terkontrol dengan pola post test‒only
control group design. Sebanyak 25 ekor tikus putih (Rattus norvegicus) galur
Sprague dawley berumur 10‒16 minggu yang dipilih secara acak dan dibagi
menjadi 5 kelompok, dengan pengulangan sebanyak 5 kali.
3.2.Tempat dan Waktu
Penelitian dilakukan di Laboratorium Patologi Anatomi Fakultas Kedokteran
Universitas Lampung untuk mengetahui gambaran mikroskopis hepar. Waktu
penelitian selama bulan Agustus‒September 2013.
3.3.Populasi dan Sampel
Populasi penelitian ini adalah tikus putih (Rattus norvegicus) jantan galur
Sprague dawley berumur 10-16 minggu yang diperoleh dari laboratorium
38
Sampel penelitian sebanyak 25 ekor yang dipilih secara acak yang dibagi
dalam 5 kelompok dengan pengulangan sebanyak 5 kali (n=5), sesuai dengan
rumus Frederer. Menurut Frederer, rumus penentuan sampel untuk uji
eksperimental adalah:
(n-1) (t-1) ≥ 15
Dimana t merupakan jumlah kelompok percobaan dan n merupakan jumlah
pengulangan atau jumlah sampel tiap kelompok. Penelitian ini menggunakan
5 kelompok perlakuan sehingga perhitungan sampel menjadi:
(n-1) (5-1)≥15
(n-1) 4≥15
(n-1)≥3,75
n≥4,75
Jadi sampel yang akan digunakan adalah berdasarkan perhitungan, yaitu
sejumlah 5 ekor tikus pada masing-masing kelompok percobaan dan jumlah
kelompok yang digunakan adalah 5 kelompok, sehingga untuk satu tanaman
herbal menggunakan 25 ekor tikus putih.
Kriteria inklusi:
1. Tidak tampak penampakan rambut kusam, rontok, atau botak, dan
bergerak aktif)
2. Memiliki berat badan sekitar 100‒200 gram
4. Drop out pada penelitian adalah 10% tiap kelompok
Kriteria eksklusi:
1. Tampak sakit (penampakan rambut kusam, rontok atau botak dan aktivitas
kurang atau tidak aktif, keluarnya eksudat yang tidak normal dari mata,
mulut, anus, genital)
2. Terdapat penurunan berat badan lebih dari 10% setelah masa adaptasi
dilaboratorium
3. Mati selama masa pemberian perlakuan
3.4.Bahan dan Alat Penelitian
3.4.1 Bahan Penelitian
Bahan penelitian yang digunakan ada dua yaitu DMBA dengan dosis
20 mg/kgBB, kemudian ekstrak etanol daun sirsak (Annona muricata
Linn) dengan dosis100 mg/KgBB, 200 mg/KgBB dan 400
mg/KgBB.
3.4.2 Bahan Kimia
Bahan yang digunakan untuk pembuatan preparat histopatologi
dengan metode paraffin meliputi: larutan formalin 10% untuk
fiksasi, alkohol 70%, alkohol 96%, alkohol absolut, etanol, xylol,
40
3.4.3 Alat Penelitian 1) Alat Penelitian
Alat penelitian yang digunakan dalam penelitian ini adalah:
1) Neraca analitik Metler Toledo dengan tingkat ketelitian 0,01 g, untuk
menimbang berat tikus
2) Spuit oral 1 cc, 3 cc dan 5 cc
3) Minor set, membedah tikus untuk mengidentifikasi hepar
4) Kapas dan alkohol.
2) Alat pembuat preparat histologi
Alat pembuat preparat histopatologi yang digunakan adalah object
glass, deck glass, tissue cassette, rotarymicrotome, oven, water bath,
platening table, autochnicom processor, staining jar, staining rak,
3.5.Prosedur Penelitian
3.5.1 Prosedur Pemberian Ekstrak Etanol Daun Sirsak (Annona muricata Linn)
3.5.1.1Metode Pembuatan Ekstrak Etanol Daun Sirsak
Daun sirsak yang telah dipetik, dicuci terlebih dahulu dengan
bilasan air dan dikeringkan selama 10 hari pada suhu ruangan
namun tidak terkena cahaya matahari langsung hingga daun
mengering. Daun sirsak yang telah kering kemudian diblender
sampai halus. Kemudian daun sirsak yang telah diblender
halus ditimbang sebanyak 20 gram. Daun yang telah
ditimbang, kemudian dimaserasi atau direndam dalam larutan
alkohol 95% sebanyak 450 mL selama 24 jam. Hasil
ekstraksi/maserasi kemudian disaring menggunakan kertas
saring Whattman hingga tidak tersisa residu atau padatan.
Setelah itu hasil filtrasi diuapkan pelarutnya hingga didapatkan
fraksi yang kental menggunakan rotary evaporator
(Hermawan & Laksono, 2012).
3.5.1.2Prosedur Pemberian Dosis Ekstrak Etanol Daun Sirsak
Dosis pertengahan yang akan digunakan dalam penelitian ini
berdasar pada penelitian yang dilakukan oleh Vianandra
(2011) adalah 200 mg/kg BB yang merupakan dosis efektif
42
sirsak (Annona muricata Linn) diambil dari setengah dosis
pertengahan tikus, sedangkan dosis kedua diambil dari hasil
pengalian 2x dosis pertama dan dosis ketiga diambil dari hasil
pengalian 4x dari dosis pertama atau 2x dari dosis kedua.
a. Dosis untuk tiap tikus pada kelompok 3
100 mg/kg BB X 0,2 kg (berat badan tikus)=20 mg
b. Dosis untuk tiap tikus pada kelompok 4
200 mg/kg BB X 0,2 kg (berat badan tikus)=40 mg
c. Dosis untuk tiap tikus pada kelompok 5
400 mg/kg BB X 0,2 kg (berat badan tikus)=80 mg
Volume ekstrak etanol daun sirsak (Annona muricata)
diberikan secara oral sebanyak 1 ml yang merupakan volume
yang boleh diberikan berdasarkan pada volume normal
lambung tikus yaitu 3‒5 ml. Jika volume ekstrak melebihi
volume lambung, dapat berakibat dilatasi lambung secara akut
yang kemudian akan dapat menyebabkan robeknya saluran
cerna pada tikus (Ngatidjan, 2006).
3.5.2 Prosedur Pemberian Dosis DMBA
Dosis DMBA yang diberikan adalah 75 mg/kgBB selama 2 kali
pemberian dengan jangka waktu 1 minggu secara intraperitoneal. Cara
tikus adalah 200 g, dosis DMBA yang akan diberikan adalah 75 mg/kg
BB dan volume maksimal DMBA yang dapat dipajankan pada tikus
adalah 1 ml, maka jumlah DMBA yang dibutuhkan adalah: Konsentrasi
DMBA=Dosis x Berat Badan / volume pajanan=0,075 mg/gr BB x 200
g/1 ml=15 mg/ml. Maka DMBA yang dibutuhkan untuk membuat 1 ml
larutan DMBA dengan dosis 75 mg/kgBB adalah 15 mg.
3.5.2.1Prosedur Pemeliharaan Hewan Coba
a. Pemeliharaan hewan coba sebelum intervensi
Pada pemeliharaan hewan sebelum intervensi dilakukan
adaptasi terlebih dahulu selam 3 hari dan diberikan diet standar
ad libitium dan akuades. Di dalam ruangan pemeliharaan
diatur sirkulasi udara dengan memberikan kipas angin,
pembersihan kandang dan juga cahaya yang cukup.
b. Pemeliharaan hewan selama intervensi
Tikus dibagi menjadi 5 kelompok dengan 5 ekor/kelompok.
Dalam 1 kandang terdapat 5 ekor tikus yang dibagi sebagai
berikut:
Kelompok I (kontrol negatif)=pemberian aquades + diet
standar ad libitium
Kelompok II (kontrol positif)=pemberian DMBA 20
44
Kelompok III (perlakuan coba)=pemberian ekstrak etanol daun
sirsak 20mg/200gBB + DMBA 20mg/200gBB
Kelompok IV (perlakuan coba)=pemberian ekstrak etanol daun
sirsak 40mg/200gBB + DMBA 20mg/200gBB.
Kelompok V (perlakuan coba)=pemberian ekstrak etanol daun
sirsak 80mg/200gBB + DMBA 20mg/200gBB.
c. Pemeliharaan hewan coba setelah intervensi
Hewan coba setelah perlakuan selama 4 minggu akan
dilakukan terminasi dengan cara dianastesi terlebih dahulu
menggunkan eter dan juga dilakukan servical dislocation.
3.5.2.2Prosedur Penelitian
Tikus yang akan dijadikan sampel, dibagi ke dalam 5 kelompok,
dimana setiap kelompok berisi 5 ekor tikus. Setiap kelompok
kemudian diberi perlakuan sebagai berikut:
a. Kelompok 1 merupakan kelompok kontrol negatif dengan
perlakuan pemberian aquadest dan makanan pelet, satu kali
sehari selama 8 minggu.
b. Kelompok 2 merupakan kelompok kontrol positif dengan
perlakuan DMBA, yang dibuat model kanker hepar dengan
pemberian DMBA dalam minyak zaitun dosis 75 mg/kgBB
c. Kelompok 3 merupakan kelompok perlakuan yang diberi
ekstrak etanol daun sirsak (Annona muricata Linn) dengan dosis
pemberian 100 mg/kg berat badan selama 4 minggu setelah
pemberian DMBA.
d. Kelompok 4 merupakan kelompok perlakuan yang diberi
ekstrak etanol daun sirsak (Annona muricata Linn) dengan dosis
pemberian 200 mg/kg berat badan selama 4 minggu setelah
pemberian DMBA.
e. Kelompok 5 merupakan kelompok perlakuan yang diberi
ekstrak dan sirsak (Annona muricata Linn) dengan dosis
pemberian 400 mg/kg berat badan selama 4 minggu setelah
pemberian DMBA.
Setelah pemberian DMBA yang terakhir, semua tikus diberi
pakan kontrol saja hingga akhir pengamatan atau selama 4
minggu. Setelah itu, tikus pada kelompok 3, 4 dan 5 diberi
ekstrak etanol daun sirsak (Annona muricata Linn) sesuai dosis
yang dilarutkan dengan aquadest setiap pagi selama 4 minggu.
Sementara kelompok kontrol negatif (kelompok 1) maupun
kontrol positif (kelompok 2) hanya diberi pakan kontrol dan
akuades.
Setelah minggu ke‒9, pengamatan dihentikan kemudian tikus
46
Selanjutnya dilakukan pembuatan preparat histopatologi hepar
dengan pewarnaan Hematoksilin-Eosin (HE).
Cara pembuatan sediaan histopatologi yang dilakukan di
Laboratorium Patologi Anatomi Universitas Lampung adalah
sebagai berikut :
1) Fixation
Spesimen berupa potongan organ hepar yang telah dipotong
secara representatif kemudian segera difiksasi dengan formalin
10% selama 24 jam, kemudian potongan dicuci dengan air
mengalir sebanyak 3‒5 kali.
2) Trimming
Potongan kelenjar yang telah terfiksasi dikecilkan hingga ukuran
±3 mm.
3) Dehidrasi
Dehidrasi bertujuan untuk mengeluarkan air yang terdapat di
dalam jaringan. Potongan organ hepar berturut‒turut direndam
dalam alkohol 70% selama 0,5 jam, alkohol 96% selama 0,5 jam
(2 kali), alkohol absolut selama 1 jam (3 kali).
4) Clearing
Clearing bertujuan untuk membersihkan sisa alkohol yang
terdapat dalam jaringan. Clearing dilakukan dengan memasukan
jaringan kedalam larutan xylol I dan II, masing‒masing selama
5) Impregnasi
Impregnasi dilakukan menggunakan paraffin selama 1 jam
dalam oven suhu 650 C.
6) Embedding
Sisa paraffin yang ada pada base mole dibersihkan dengan
memanaskan beberapa saat di atas api dan diusap dengan kapas.
Paraffin cair disiapkan dengan memasukkan paraffin ke dalam
cangkir logam dan dimasukkan dalam oven dengan suhu diatas
580C. Kemudian Paraffin cair dituangkan ke dalam base mole.
Jaringan yang telah diimpreg dipindahkan satu persatu dari
tissue cassette ke dasar base mole dengan mengatur jarak yang
satu dengan yang lainnya. Biarkan membeku kemudian lepaskan
tissue cassette dari base mole. Blok parafin telah siap dipotong
dengan mikrotom.
7) Cutting
Sebelum dipotong, blok didinginkan terlebih dahulu di lemari
es. Dilakukan pemotongan kasar, lalu dilanjutkan dengan
pemotongan halus dengan ketebalan 4‒5 mikron. Pemotongan
dilakukan menggunakan rotary microtome dengan disposable
knife. Kemudian dipilih lembaran potongan yang paling baik,
diapungkan pada air, dan dihilangkan kerutannya dengan cara
menekan salah satu sisi lembaran jaringan tersebut dengan ujung
48
Lembaran jaringan dipindahkan ke dalam water bath pada suhu
600C selama beberapa detik sampai mengembang sempurna.
Dengan gerakan menyendok, lembaran jaringan tersebut diambil
dengan slide bersih dan ditempatkan di tengah atau pada
sepertiga atas atau bawah. Slide yang berisi jaringan
ditempatkan pada inkubator (suhu 370C) selama 24 jam sampai
jaringan melekat sempurna.
8) Staining (pewarnaan)
9) Mounting dengan entelan dan tutup dengan deck glass
Pemeriksaan mikroskopis pada pewarnaan Hematoksilin‒Eosin
dilakukan dengan mengamati degenerasi bengkak keruh yang
merupakan hasil efek kemopreventif ekstrak pada slide pada
hepar. Degenarasi bengkak keruh pada organ hepar tikus dilihat
dengan melakukan pengamatan sediaan histopatologi
menggunakan mikroskop dengan perbesaran 400x.
10) Pembacaan Slide dengan mikroskop
Timbang berat badan tikus
K1 K2 K3 K4 K5
Tikus diadaptasi selama 3 hari
I.P I.P I.P I.P
DMBA 75mg/KgBB DMBA 75mg/KgBB DMBA 75mg/KgBB DMBA 75mg/KgBB
Cekok Cekok Cekok Cekok Cekok
Aquadest Aquadest DS 100 mg/KgBB DS 200 mg/KgBB DS 400 mg/KgBB
1x sehari 1x sehari 1x sehari 1x sehari 1x sehari
Tikus di narkosis dengan eter
Lakukan laparotomi lalu hepar tikus di ambil
Sampel hepar difiksasi dengan formalin 10%
Sample hepar dikirim ke Laboratorium Patologi Anatomi Fakultas Kedokteran Universitas Lampung untuk pembuatan sediaan histopatologi
Pengamatan sediaan histopatologi dengan mikroskop
[image:59.595.107.509.106.564.2]Interpretasi hasil pengamatan
Gambar 11. Diagram Alur Penelitian.
Pemberian Ekstrak Etanol Daun Sirsak (DS) hingga minggu ke– 8
DMBA 1x/minggu selama 2 minggu
50
3.6 Identifikasi Variabel dan Definisi Operasional Variabel
3.6.1 Identifikasi Variabel
Terdapat dua variabel dalam penelitian ini, yaitu:
a. Variabel Independen
Variabel independen adalah dosis ekstrak etanol daun
sirsak (Annona muricata Linn) 20 mg, 40 mg , dan 80 mg.
b. Variabel Dependen
Variabel dependen adalah gambaran histopatologi hepar
(degenerasi bengkak keruh).
3.6.2 Definisi Operasional Variabel
Untuk memudahkan penelitian dan agar penelitian tidak
menjadi terlalu luas, maka dibuat definisi operasional sebagai
Tabel 2. Definisi Operasional.
Variabel Definisi Skala
Dosis ekstrak etanol daun sirsak.
Dosis efektif daun sirsak adalah 200 mg/kg BB (Vianandra, 2011).
Kelompok I (kontrol negatif ) = pemberian aquades
Kelompok II (kontrol positif) = pemberian DMBA 20 mg/200gBB
Kelompok III (perlakuan coba) = pemberian ekstrak etanol daun sirsak 20mg/200gBB + DMBA 20mg/200gBB
Kelompok IV (perlakuan coba) = pemberian ekstrak etanol daun sirsak 40mg/200gBB + DMBA 20mg/200gBB.
Kelompok V (perlakuan coba) = pemberian ekstrak etanol daun sirsak 80mg/200gBB + DMBA 20mg/200gBB.
Numerik
Gambaran histopatologi sel hepar tikus
Gambaran kerusakan hepatosit tikus dilihat
dengan melakukan pengamatan sediaan
histopatologi menggunakan mikroskop dengan perbesaran 400x pada 5 lapangan pandang dimana setiap lapangan pandang diamati berupa degenerasi bengkak keruh yang terjadi pada hepatosit. Skala degenerasi bengkak keruh kemudian dihitung secara semikuantitatif dalam 5 lapang pandang berbeda. Skala penilaian Kawasaki (2009) dengan modifikasi:
Skor 0 = tidak ada hepatosit yang mengalami degenerasi bengkak keruh
Skor 1 = <10% hepatosit yang mengalami degenerasi bengkak keruh;
Skor 2 = 10–33% hepatosit yang mengalami degenerasi bengkak keruh;
Skor 3 = 34–66% hepatosit yang mengalami degenerasi bengkak keruh;
Skor 4 = >66–100% hepatosit yang mengalami degenerasi bengkak keruh
52
3.7 Analisis Data
Data yang diperoleh dari hasil pengamatan histopatologi di bawah
mikroskop diuji analisis statistik menggunakan software statistik. Hasil
penelitian dianalisis apakah memiliki distribusi normal atau tidak secara
statistik dengan uji normalitas Shapiro-Wilk karena jumlah sampel ≤50.
Kemudian, dilakukan uji Levene untuk menyetahui apakah dua atau
lebih kelompok data memiliki varians yang sama atau tidak. Jika
varians data berdistribusi normal dan homogen, dilanjutkan dengan
metode uji parametrik one way ANOVA. Bila tidak memenuhi syarat
uji parametrik, digunakan uji nonparametrik Kruskal-Wallis. Hipotesis
dianggap bermakna bila p<0,050. Jika pada uji ANOVA atau
Kruskal-Wallis menghasilkan nilai p<0,050, maka dilanjutkan dengan
melakukan analisis Post-Hoc LSD untuk melihat perbedaan antar
kelompok perlakuan.
3.8 Etika Penelitian
Implikasi etik pada hewan, pengelolaan binatang coba pada penelitian ini
mengikuti animal ethics. Hal yang perlu dilaksanakan sesuai dengan etik
antara lain megikuti prinsip 3R dalam protokol penelitian, yaitu:
replacement, reduction, dan refinement (Ridwan, 2013). Replacement
adalah keperluan memanfaatkan hewan percobaan sudah diperhitungkan
menjawab pertanyaan penelitian dan tidak dapat digantikan oleh mahluk
hidup lain seperti sel atau biakan jaringan. Dalam hal ini, peneliti tetap
menggunakan hewan coba tikus putih (Rattus norvegicus) galur Spargue
Dawley dan tidak digantikan dengan hewan coba lainnya. Reduction
diartikan sebagai pemanfaatan hewan dalam penelitian sesedikit
mungkin, tetapi tetap mendapatkan hasil yang optimal. Dalam penelitian
ini, peneliti menghitung jumlah minimum menggunakan rumus Frederer
yaitu (n-1) (t-1)>15, dengan n adalah jumlah hewan yang diperlukan dan
t adalah jumlah kelompok perlakuan. Refinement adalah memperlakukan
hewan percobaan secara manusiawi (humane), memelihara hewan
dengan baik, tidak menyakiti hewan, serta meminimalisasi perlakuan
yang menyakitkan sehingga menjamin kesejahteraan hewan coba sampai
akhir penelitian. Pada dasarnya prinsip refinement berarti membebaskan
hewan coba dari beberapa kondisi. Yang pertama adalah bebas dari rasa
lapar dan haus, dengan memberikan akses makanan dan air minum yang
sesuai dengan jumlah yang memadai baik jumlah dan komposisi nutrisi
V. SIMPULAN DAN SARAN
5.1 . Simpulan
1. Terdapat pengaruh pemberian ekstrak etanol daun sirsak (Annona
muricata Linn) terhadap gambaran histopatologi sel hepar tikus putih
(Rattus norvegicus) galur Sprague dawley yang diinduksi DMBA.
2. Pemberian perbedaan dosis ekstrak etanol daun sirsak (Annona muricata
Linn) 20 mg, 40 mg, dan 80 mg berpengaruh terhadap gambaran
histopatologi hepar tikus putih (Rattus norvegicus) galur Sprague dawley
yang diinduksi DMBA yaitu semakin meningkatnya dosis, rerata jumlah
hepatosit yang mengalami bengkak keruh mengalami penurunan walaupun
belum mencapai pada kondisi normal.
5.2 . Saran
Peneliti lain disaran untuk:
1. Menguji lebih lanjut toks